Method Article
プロモーター キャプチャこんにちは-c: 高解像度, ゲノム プロモーターの相互作用のプロファイリング
* これらの著者は同等に貢献しました
要約
DNA 規制要素、エンハンサーなどは、物理的にゲノム長距離にまたがる長距離染色体相互作用を介して多くの場合、ターゲット遺伝子のプロモーターに連絡して遺伝子発現を制御します。プロモーターが PCHi ハをやあ-C のキャプチャは、その標的遺伝子への潜在的な規制シーケンスの割り当てを有効にするプロモーターと遠位領域の重要な相互作用を識別します。
要約
ゲノムの 3次元組織は、その機能にリンクされます。たとえば、規制など転写エンハンサー制御時空 (場合によっては何百もの kilobases の) でかなりゲノム距離を多くの場合ブリッジとバイパスの物理的な接触を介してターゲット遺伝子発現近くの遺伝子。人間のゲノムの大半がある不明、推定 100 万のエンハンサーを隠し持って遺伝子ターゲット。遺伝子発現制御を理解することが重要、その標的遺伝子に遠位の規定する領域を割り当てます。単一の実験すべてのプロモーターのプロモーターが (PCHi C) 遠位相互作用のプロモーター領域 (ピアース) のゲノム規模の検出を有効にするをやあ-C のキャプチャを開発しました。PCHi - c、非常に複雑なやあ-C ライブラリはプロモータ配列をすべてプロモーターを含む断片の両端に相補的な RNA をビオチン化餌の何千ものハイブリッド ソリューションの選択の特に濃縮されています。目的は、プルダウン プロモータ配列し、エンハンサーやその他の潜在的な規制要素などの頻繁な相互作用パートナーです。高スループット ペアエンド シーケンス後統計テストは制限のフラグメント レベルで重要なピアースを識別するために各プロモーター結紮制限のフラグメントに適用されます。人間の数十とマウスの細胞型で長距離プロモーター作用のアトラスを生成する PCHi C を使いました。これらのプロモーター インタラクトーム マップは、ターゲット遺伝子に推定の規定する領域を割り当て、優遇空間プロモーター プロモーター間相互作用ネットワークを明らかに哺乳類の遺伝子発現制御のより深い理解に貢献しました。この情報も、疾患に関連する非コードをリンクすることによってヒトの遺伝性疾患と潜在的な疾患遺伝子の同定を理解する関連性の高いシーケンスまたは制御シーケンスのターゲット遺伝子の近くの亜種。
概要
ゲノムの 3次元組織が遺伝子活性化1,2,3,4 の抑圧を含む核プロセスの範囲の重要な役割を果たしていることを示唆している証拠の蓄積 ,5,6,7、8組換え9,10、DNA 修理11、DNA 複製12,13と細胞の老化が14。遠いエンハンサーは、彼らは適切な時空間的遺伝子発現制御のために不可欠である15,16,17を調節するプロモーターに近い空間で発見されます。エンハンサー削除表示ターゲット遺伝子転写18,19,20,21,22と 'の forced でクロマチンのループのため遠位エンハンサーが欠かせないエンハンサーとHbbの軌跡でそのターゲットのプロモーターとの間に設計されたテザリング転写活性化23を駆動するため十分であることを示します。さらに、異所性の増強物の制御の下で遺伝子をもたらすゲノム再編成は、不適切な遺伝子の活性化と疾患24,25,26で起因できます。一緒に、プロモーター エンハンサーの相互作用は遺伝子制御に不可欠な適切な遺伝子発現を確保するための厳格な規制を必要とする例を示します。人間とマウスのゲノムのそれぞれのハーバーの周り 100 万エンハンサーと推定されています。これらの増強物の大半は、標的遺伝子が知られている, とプロモーターやエンハンサーの間 'ルールの契約' は不完全に理解されます。こうして哺乳類遺伝子発現制御の解読において主要な課題に残る人のターゲット遺伝子転写のエンハンサーを割り当てます。
3 C27 (染色体構造キャプチャ) の導入とそのバリアント28,29,30,31三次元ゲノムの私達の理解をもたらしました.これらのテクニックは、やあ-C (高スループット染色体構造キャプチャ) の中で最も強力な細胞集団内で染色体の相互作用の全体のアンサンブルを識別するために設計されています。ハイ-C のライブラリ、通常細胞の数百万から生成されますは、ヒトゲノム32〜 4 kb フラグメント間推定 1011独立した結紮製品と非常に複雑です。(プロモーターやエンハンサーが含まれているなど)、個々 の制約間の相互作用の信頼性と再現性の同定結果のフラグメントとしてやあ-C のデータ可能な限りはやあ-C ライブラリ、超ディープのシーケンスに供されるこれは定期的にやあ-C ライブラリを準備する所の経済的に実行可能なソリューションではありません。この欠点を回避するためにプロモーターをキャプチャ具体的にはやあ-C ライブラリから結紮製品のプロモーターを含むを豊かにやあ-C を開発しました。我々 は 2 つの理由プロモーターに焦点を当てた。まず、プロモーター エンハンサー連絡先がたくさんの研究 (上記参照) で適切な遺伝子発現レベルの重要であると示されている、第二に、プロモーターは細胞のタイプ間主バリアント、同じキャプチャ ベイト システムを尋問する使用ことができます複数の細胞のタイプおよび条件調節回路。我々 のアプローチは、ビオチン標識 RNA 120mers プロモーターを含むやあ-C 結紮製品およびストレプトアビジン コートした磁気ビーズとそれに続くキャプチャに補足の数万人のやあ-C ライブラリのソリューションで交配に依存します。PCHi C 図書館でこの結果多くが大幅高周波数でプロモーターに組み合わされて断片の識別のみに焦点を当ててオリジナルのやあ-C ライブラリと比較しての複雑さの低減。
人間の数と推定される規制機能を暴く長距離遠位プロモーター相互作用する地域によって遺伝子発現制御のよりよい理解に貢献するマウス細胞型 PCHi C とで同様に非ランダムを使いました核の三次元空間でのプロモーター プロモーターの連絡先。多数のセル型33,34,35,36,37,38,マップいるプロモーター エンハンサー連絡先の何千もの何百も研究39、マウス胚性幹細胞7におけるポリコーム抑制複合媒介空間ゲノム構成を識別、細胞分化37,中にプロモーター interactomes の大規模な配線を実証38,39、およびリンク非コーディング疾患関連遺伝子プロモーター35の亜種を順序します。
PCHi C は、プロモーターとの相互作用の DNA シーケンスのゲノム広いアンサンブルをマップするに適して 方法です。関連するアプローチなどキャプチャやあ-C の連続ゲノム領域 (ディスカッションを参照してください) は、選択されたゲノム領域の高解像度の相互作用のプロファイルを取得する任意の方法です。PCHi C とやあ-C のキャプチャ、実験的観点から (唯一の違いは、キャプチャ システムの選択)、非常に似ている、アドバイスと提供のガイドラインが両方の方法に適用されます。ここでは、提案する PCHi C の詳細な説明根拠と PCHi C 実験の設計の概要を説明、ステップバイ ステップ PCHi C ライブラリの世代の議定書を提供する、高品質なデータを生成するプロトコルの様々 な段階での PCHi C ライブラリの品質の監視方法を示します。
プロトコル
1. ホルムアルデヒド固定
-
セルの準備: 2 x 10 の7セル実験あたりの最小値と開始。
- 文化で育つ細胞培養培地で細胞を再懸濁します。前のヴィヴォセル、1 x ダルベッコ変更イーグル培地 (DMEM)、10% (巻/巻) ウシ胎児血清 (FBS) で再懸濁します。
- 付着細胞培養培地を削除し、10% (巻/巻) FBS 室温 (RT; 20-25 ° C) で新鮮な媒体の 30.625 mL を追加します。
- 浮遊細胞の場合収集し、g と 20 ° C、3 分削除清 x 400 で細胞を遠心分離し、再 30.625 ml の 10% (巻/巻) 室温 FBS と媒体の細胞ペレットを中断
- 固体ティッシュ トリプシン (0.05% から 2.5%、最終濃度、細胞の種類に応じて) または単一細胞懸濁液を取得する均質化 dounce を使用します。この追加の手順後懸濁細胞のような細胞を扱います。
-
16% メタノール無料パラホルムアルデヒド (使用する直前のオープン アンプル) の 4.375 mL を最終濃度 2% (巻/巻) に追加します。ロッカーで穏やかな混合常温 10 分を修正しました。
注意: パラホルムアルデヒドは有害化学物質です。適切な保健及び安全性の規則に従ってください。 - 1 M の冷たいグリシンを出来立ての 5 mL を追加することによって反応を抑制します。常温では、穏やかな揺動に 5 分のミックスし、時折反転と 15 分のため氷の上、孵化させなさい。
-
洗うし、固定セルを収集します。
- 付着性のセル上清、板壁に PBS pH 7.4 x 氷冷 1 の 10 mL を追加し、それを取り外します。PBS pH 7.4 x 氷冷 1 の 1 mL を追加し、セルはセル スクレーパーや 50 mL のチューブに転送を収集します。可能な限り多くの細胞を収集を 2 回繰り返します。まで氷冷 PBS を 50 mL 最終巻に追加します。
- 浮遊細胞の場合、遠心分離機細胞は培養上清を削除 760 x g で 5 分 4 ° C と 50 ml の氷冷 PBS pH 7.4 の細胞ペレットを再中断します。
- 400 x gと 10 分のための 4 ° C で細胞を遠心し、上清を慎重に取り外します。細胞ペレットは、スナップを液体窒素で凍結し、その後数ヶ月間-80 ° C で保存をすることができます。
2. セル換散
- 出来立ての冷たい換散バッファーの 50 mL の細胞ペレットを再停止 (10 mM トリス塩酸 pH 8、0.2% (集集) Igepal CA-630、10 mM の NaCl、および 1 つのタブレット プロテアーゼ抑制剤のカクテル) と混ぜます。氷上で 30 分間インキュベート、反転によって時折ミックスします。760 x gと 4 ° C、5 分で核を遠心し、上清を除去します。
3 hindIII 消化。
- 1.25 x 制限バッファー 2 細胞核を洗います。再 1 mL の冷たい 1.25 x 制限バッファー 2 の細胞ペレットと 1.5 mL チューブに転送を中断します。760 g と 4 ° C、5 分 x の核スピンし、上清を除去します。
- 再 1790 1.25 x 制限バッファー 2 μ L で細胞ペレットを中断します。制限バッファー 2 倍 1.25 の 358 μ L で 500 万セルを含む各 5 因数を作る。
- Thermomixer で 37 ° C で 30 分間 1 分 (rpm) あたり 950 回転で 10% (重量/巻) SDS 因数と振る 11 μ L を追加します。細胞塊が表示する場合泡を回避、ピペッティングで切り離します。
- 10% の 75 μ L を追加因数と 950 rpm と、thermomixer で 15 分の 37 ° C に振るあたりトリトン X-100 (巻/巻)。細胞塊が表示する場合泡を回避、ピペッティングで切り離します。
-
12 μ L 100 U/μ L HindIII 100 の (合計で 1,200 台)/因数を追加し、37 ° C 一晩 (O/N) で、thermomixer で 950 rpm で揺れながらインキュベートします。
- 消化のコントロールの酵素 (未消化コントロール) を追加する前に新しいチューブのサンプル (各因数から 5 μ L) の 25 μ L を転送し、酵素 (消化コントロール) を追加した後、同じ手順を繰り返します。やあ-C のライブラリと同じ方法で両方のチューブを孵化させなさい。
- 次の朝 [因数あたり 100 U/μ L HindIII (500 台) の 5 μ L を追加し、thermomixer で 950 rpm で揺れながら 37 ° C 2 時間インキュベートします。
-
消化のコントロール: 消化と未消化のコントロール (3.5.1 を参照)、架橋反転 (手順 6)、フェノール: クロロホルム抽出と DNA の沈殿物 (ステップ 7) を実行します。
- HindIII サイトにまたがるプライマーのペアを設計します。同じ地域でHindIII サイトにまたがっていないプライマーの別のペアを設計します。(Q PCR) の量的な PCR 用プライマーを設計 Primer3 を使用して (http://bioinfo.ut.ee/primer3-0.4.0/) そして次のパラメーター。
プライマーのサイズ: 最適な 20 (分: 18、最大: 27);プライマーの Tm: 最適な 60 (分: 57、最大: 63);プライマー CG % コンテンツ: 分: 20、最大: 80;増幅サイズ: RT-PCR 〜 100 bp (従来の PCR 〜 300 のため bp);ライブラリを mispriming: 人間 (人間プライマー) または齧歯動物と簡単 (マウス プライマー)。 - 4 平均 Cts (しきい値サイクル) を取得する Q pcr: Ct [D;H]、スパンのHindIII サイト [H]; プライマーのペアで消化サンプル [D] から得られるCt [D;-]、 HindIII サイト [-] の対象としていないプライマーのペアで消化サンプル [D] から得られるものCt [U;H]、 HindIII サイトにまたがるプライマーのペアで未消化サンプル [U] から得られるCt [U;-]、 HindIII サイト [-] にまたがるいないプライマーのペアで未消化サンプル [U] から得られるもの。として消化のパーセンテージを計算: % 消化 = 100-100/2(Ct[D,H]-Ct[D,-]) - (Ct[U,H]-Ct[U,-])。
- HindIII サイトにまたがるプライマーのペアを設計します。同じ地域でHindIII サイトにまたがっていないプライマーの別のペアを設計します。(Q PCR) の量的な PCR 用プライマーを設計 Primer3 を使用して (http://bioinfo.ut.ee/primer3-0.4.0/) そして次のパラメーター。
4. 制限のフラグメントのビオチン化オーバー ハングします。
- ビオチン化マスター ミックスを調製: 30.6 μ 10 x バッファー制限 2、H2O の 10.2 μ L (分子生物学グレード)、10 mM dCTP 7.65 μ、10 mM dGTP の 7.65 μ L、dTTP の 10 mM の 7.65 μ L、ビオチン 14 dATP 0.4 mM の 191.25 μ L、5,000 U/mL DNA ポリメラーゼの 51 μ L 私大 (Klenow) フラグメント。
- 60 μ L 分注、ミックスあたりビオチン化マスター ミックスを追加し、37 ° C 1 時間 700 rpm (thermomixer) 5 の揺れで孵化させなさい s、あらゆる 30 s。1 時間後に、氷上因数を配置します。
5. 核結紮
- 結紮マスター ミックスを調製: T4 DNA リガーゼ バッファー、10 Mg/ml のウシ血清アルブミンの 51 μ L x 10 の 510 μ L (100 x BSA)、水 (分子生物学グレード) の 1754.4 μ L と 1 U/μ L T4 DNA リガーゼの 127.5 μ L (材料の表を参照してください)。
- 479 μ L 分注ミックスあたり結紮マスター ミックスを追加し、, 5 の 700 rpm で揺れ 4 h の 16 ° C で s、thermomixer で 2 分毎。
- 室温 30 分間加温します。
6. 架橋反転
- (高速遠心分離に適した) 50 mL 遠心管中のすべての因数を組み合わせます。
- 10 mg/ml の RNase A、ミックス、62.5 μ L を追加し、37 ° C で 30 分間インキュベート
- 10 mg/ml のプロティナーゼ K のミックス、300 μ L を追加し、37 ° C で 30 分間インキュベート
- 65 ° C で反応 O/N (または少なくとも 4 h) を孵化させなさい次の朝、10 mg/ml のプロティナーゼ K、ミックス、300 μ L を追加し、65 ° C で 1 時間インキュベート
7. DNA 精製
- 4337.5 μ TLE バッファー (10 mM トリス塩酸 pH 8.0; 0.1 mM EDTA pH 8.0) とミックスを追加します。
- 新しい 50 mL のチューブに RT と上部 (水性) 相の 3 分転送 9 ml 20,000 × gで 1 ボリューム (10 mL) フェノール pH 8.0、10 s、および遠心分離機の渦を追加します。
注意: フェノールは有害化学物質です。適切な保健及び安全性の規則に従ってください。 - 2 mL の残りの水相に TLE バッファーを追加、渦 10 s と RT で 20,000 x gで 3 分間遠心転送新しいチューブに水相の 2.5 mL からステップ最終巻を作る 7.2 11.5 mL。下の (有機) 相を有するチューブを破棄します。
- 新しい 50 mL のチューブに RT で 20,000 × g 3 分転送 11 ml 上部 (水相) のフェノール: クロロホルム: イソアミル アルコール (25:24:1)、10 s、および遠心分離機の渦の 1 ボリューム (11.5 mL) を追加します。7.3 手順を繰り返します。総サンプル ボリューム今 13.5 mL になります。
- 3 M ナトリウム酢酸 pH 5.2 と 33.75 mL の氷冷 100% エタノール、ミックス、1.35 mL を加えると,-80 ° C、45 分間でまたはまたは-20 ° C で一晩
- 4 ° C で 20,000 × g 10 分間遠心、上清を除去、出来立て 70% (巻/巻) エタノール 1 mL にペレットを再停止、新しい管に転送します。
- 4 ° C で、フルスピードでベンチトップ遠心分離機で 3 分間遠心し、上清を除去します。
- 氷冷 70% (巻/巻) エタノール 1 mL にペレットを再停止し、7.7 の手順を繰り返します。10 分の 37 ° C でペレットを乾燥し、TLE バッファーの 650 μ L で再度中断します。二本鎖 DNA を定量化する蛍光アッセイを用いた DNA 収量を決定します。
注: プロトコルは、凍結と数ヶ月間-80 ° c または-20 ° C、時間の短い期間でのサンプルを格納するスナップによってここで休止できます。
8. 品質コントロール
- DNA 電気泳動によるライブラリの整合性と結紮を監視します。0.8% アガロース/1 x TBE ゲル上のライブラリの実行 200 ng。DNA は、バンド 10 kb 以上として実行してください。
- 知られているセル型不変短い--長距離相互作用従来の pcr 法による検出します。テンプレート DNA PCR の反作用ごとの使用 100 ng。閉じると (3.7.1 を参照) 上記の説明に従って制限のサイトに向かって、PCR のプライマーを設計します。マウスと人間のやあ-C ライブラリの品質管理のためのプライマー シーケンスの表 1のとおりです。
-
フィルインと結紮制御: カットから産物を含むゲルのバンドを 8.2 を制御、ゲル抽出 DNA と同一のプライマーの組み合わせで 4 個別 PCR の反作用のテンプレートとして DNA を使用します。
- Amplicons PCR 精製キットを使用してを浄化し、DNA 濃度を定量化します。
- 15 μ L の最終巻の各私アンプリコンの 4 つ消化反応 (HindIII []、NheI [b]、 HindIII + NheI [c] となしの酵素 [d]) の準備: 500 私アンプリコンの ng、10 x バッファー制限 2.1、10 Mg/ml のウシ血清アルブミンの 0.15 μ L の 1.5 μ L (100 x BSA)、と酵素 (HindIII []、NheI [b]、 HindIII + 水は NheI [c] や [d]) の 0.1 μ L (10 単位)。
- 37 ° C で 1 時間のダイジェスト、1.5% (重量/巻) アガロース/1 x TBE ゲルの消化反応を実行します。
9. DNA の断片化
- 新しいチューブにサンプルの 50.5 μ g を転送し、ライブラリ (10 μ g) の 130 μ L を各バイアルに追加することによって 5 超音波バイアル (材料の表を参照) に 655 μ。 分割サンプルの最終巻に TLE バッファーを追加します。~ 400 のサイズにせん断超-超音波発生装置で bp (材料表参照) 次のパラメーターを使用して: デューティー比: 10%;最大入射電力 (w): 140;バーストあたりのサイクル数: 200;時間: 55 s。
- 新鮮な 2 mL チューブに熱量のサンプルを収集します。
10. 両面 SPRI ビーズのサイズ選択
- 反転、によってよくミックス SPRI (固体相リバーシブル固定) ビーズ ソリューション ビーズ ソリューションの 1.85 mL を新しいチューブに転送し、15 分間 RT させる。
- サンプルに水 (分子生物学グレード) の 350 μ L を追加 (最終巻 1 mL)。
- SPRI ビーズ ソリューションの 600 μ L をサンプルに追加 (合計量 1.6 mL; SPRI dna 溶液の比率: 1 に 0.6)、常温では、5 分間インキュベートし、回転のサンプルを収集するために 2-3 秒のベンチトップ遠心分離機のサンプル。
- ふたを開けて、磁気分離スタンド 5 分、転送上澄みを新しいチューブにサンプルを配置、ビーズを破棄します。
- 第 2 のサイズ選択手順 SPRI ビーズを集中: SPRI の転送 930 μ L を新しいチューブ ビーズ、上澄みを 5 分と廃棄のための磁気分離スタンドに配置。再 SPRI ビーズ ソリューションの 310 μ L でビーズを中断します。
- サンプルに集中 SPRI ビーズ (ステップ 10.5) の 300 μ L を追加 (合計量 1.9 mL; 比 SPRI dna ソリューションは現在、0.9 に 1)、RT で 5 分間インキュベート、スピン サンプル 2-3 s. 慎重に開いているため、ベンチトップ遠心分離機で蓋、磁気分離スタンド 5 min のためにチューブを置き、上澄みを廃棄します。
- 磁気分離スタンドのサンプル チューブに作りたての 70% エタノール (巻/巻) 1 mL を加え、30 s、および破棄清間インキュベートします。2 回繰り返します。
- 37 ° c 以上 5 分追加 300 μ L サンプル、ミックス、TLE バッファーの thermomixer (管蓋オープン) でビーズを乾燥し、室温で 10 分間インキュベートします。
- 2-3 s のベンチトップ遠心分離機のサンプルをスピン、蓋を開けると磁気分離のチューブ スタンド 5 分転送場所新しいチューブに上清をオフにしてビーズを破棄します。
11. ビオチン/ストレプトアビジン プルダウン結紮製品の
- バッファーを準備: TB バッファー x 1 (0.05%; 1 M 塩化ナトリウム 0.5 ミリメートルの EDTA 5 mM トリス塩酸 pH 8.0 トゥイーン 20);ntb 通信バッファー (10 mM トリス塩酸 pH 8.0; 1 mM EDTA; 2 M の NaCl) x 21 x NTB のバッファー (5 mM トリス塩酸 pH 8.0; 0.5 ミリメートルの EDTA が 1 M の NaCl)。
- 新しい管に (材料の表を参照) のストレプトアビジン結合磁性体ビーズ 200 μ L を追加、1 分の磁気分離スタンド上に配置し、上清を除去します。
-
500 μ L × 1 TB バッファーのビード二度洗浄しなさい。
- 各ビオチン プルダウンの中に洗浄ステップ、最後修理と DNA の端の非結紮、dATP のテーリングおよびアダプター結紮手順でビオチンの除去は、対応するバッファーのビードを再中断、RT と 3 分間 15 rpm で回転、ベンチトップ遠心管内をスピン2-3 秒、3 分間磁気分離スタンドにチューブを配置し、上清を削除します。
- 再 2 x NTB バッファーの 300 μ L でビーズを中断します。ミックス ビーズとサンプル (600 μ L 容量) と 3 rpm で回転ホイール上で 15 分間室温でインキュベートします。
- 3 分の磁気分離スタンドでビーズを再利用し、明確な上澄みを削除します。200 μ L 1 x 結紮バッファーの最初 500 μ L の 1 x NTB バッファーで 2 回ビーズを洗浄します。再 10 x 結紮バッファーの 50 μ L で、ビーズを中断します。
12. 非結紮 DNA の両端にビオチンの修理と除去を終了します。
- サンプル (合計で 50 μ L) を組み合わせて 2.5 mM dNTP ミックス (各 dNTP の 10 mM の 12.5 μ L)、18.1 μ l の 3,000 U/mL T4 DNA ポリメラーゼ、10,000 U/mL T4 PNK 18.1 μ 50 μ L 3.7 μ L 5,000 U/mL DNA ポリメラーゼの私の大きい (Klenow) フラグメント、、360.1 μ H2o.
- ミックスし、, 20 ° C 1 時間、5 の揺れで 700 rpm、thermomixer で 2 分毎で s。
- 磁気分離スタンドでビーズを再利用、明確な上清を除去、ビード TB バッファー x 1 の 500 μ L に二度洗浄しなさい。
- 1 x NTB バッファー、1 を 500 μ l 添加のワンウォッシュ後の 500 μ L でビーズを洗う x TLE。
- 磁気分離スタンドでビーズを再利用、明確な上清を除去および再 1 x TLE バッファーの 415 μ L でビーズを中断します。
13. dATP を尾行
- 制限バッファー 2、10 mM dATP の 5 μ L、5 U/μ L Klenow エキソ-マイナスの 30 μ L x 10 の 50 μ L とサンプル (415 μ L) を組み合わせます。
- 混合し、37 ° C、30 分、5 の揺れで孵化させなさい 700 rpm、thermomixer で 2 分毎で s。
- 磁気分離スタンドでビーズを再利用、明確な上清を除去、ビード TB バッファー x 1 の 500 μ L に二度洗浄しなさい。
- 1 x NTB バッファーを 500 μ l 添加でビーズを洗浄します。
14. アダプター結紮
- ライゲーション反応バッファー x 1 の 200 μ L でビーズを洗う (材料の表を参照してください)。
- 再 1 x ライゲーション反応バッファーを 200 μ l 添加でビーズを中断します。DNA のリガーゼの 4 μ L を追加 (材料の表を参照) と 15 μ M の 16 μ L 中古焼なまし PE アダプター (PE アダプター 1 と PE のアダプター 2 の平等なボリューム (30 μ M で両方) を混合し、常温、いくつかの分間インキュベートによって PE アダプターをアニール済み)。室温で 15 分間インキュベートします。
- 磁気分離スタンドでビーズを再利用、明確な上清を除去、ビード TB バッファー x 1 の 500 μ L に二度洗浄しなさい。
- 1 x NTB バッファーを 500 μ l 添加でビーズを洗浄します。バッファーの制限、2 x 1 の 100 μ L で、洗ってビーズは再バッファー制限、2 x 1 の 50 μ L でビーズを中断し、新しいチューブに移します。
15. ハイ-C のライブラリの増幅
- PCR マスター ミックスを調製: 5 x Phusion バッファーの 100 μ L6 μ L の 25 μ M PE PCR プライマー 1.0;6 μ L の 25 μ M PE PCR プライマー 2.0;14 μ dNTP ミックス (10 mM);Phusion ポリメラーゼ; 6 μ318 μ H2o.
- ミックス PCR マスター ミックス ビーズ (合計で 500 μ L)、50 μ L の 10 の因数で分割し、次の条件を使用して PCR によって増幅します。
98 ° C で 30 代
サイクルを 7: 10 98 ° c; s30 s 65 ° c;30 s 72 ° c
72 ° C で 7 分 - 新しい管に PCR の反作用を収集し、新しい管にビーズの磁気分離スタンドと転送上清 (500 μ L) を取り戻します。
-
SPRI ビーズを用いたライブラリ DNA を浄化します。
- スプリング ミックス ビーズ、新しいチューブにビーズの 460 μ L を転送し SPRI ビーズを PCR の反作用 (最終巻 950 μ L) の 15 分追加 450 μ L の RT にもたらす、常温では、5 分間インキュベート、回転のサンプルを収集するために 2-3 秒のベンチトップ遠心分離機のサンプル。
- ふたを開けて、磁気分離スタンド 5 min のためにサンプルを置き、上清を除去します。
- 磁気分離スタンドでビーズを維持、ビーズの明確な領域上のチューブのサンプル、30 s、および破棄の上清を残し 70% エタノール (巻/巻) 1 mL を追加します。
- 15.4.3 倍の手順を繰り返します。
- 5 分以上 thermomixer (管蓋オープン) で 37 ° C でビーズを乾燥させます。
- サンプルでは、ミックスに TLE バッファーの 51 μ l 添加し、thermomixer で 950 rpm で揺れ、37 ° C で 10 分間インキュベートします。
- 2-3 s のベンチトップ遠心分離機のサンプルをスピン、蓋を開けると磁気分離のチューブ スタンド 5 分転送場所新しいチューブに上清をオフにしてビーズを破棄します。
- こんにちは C ライブラリの濃度を定量化します。PCR の拡大の 7 ラウンド後定期的にこんにちは C ライブラリの 500-1,500 ng を取得します。
16. ハイブリッド ソリューションのキャプチャ
注: ブロックとバッファー (SHS1 4) 以下の解決策が、SureSelect キット (材料の表を参照してください)。
- 新しい管にこんにちは C ライブラリの 1 μ g に転送 500 ng 真空濃縮器のサンプルを蒸発させると (真空圧 45 ° C;材料表を参照してください: レベル 30.0、ランプ 5) 乾燥するまで。
- 再 3.6 μ H2O (分子生物学グレード)、ブロック 1、ブロック 2、2.5 μ L とカスタム ブロックの 0.6 μ L の 2.5 μ L を追加することにより蒸着こんにちは C ライブラリを中断します。
- 新しい PCR チューブ ストリップの井戸にサンプルを転送、PCR キャップ ストリップを閉じるし、氷の場所します。(ハイ-C の DNA) の「D」とラベル。
- 交配バッファーを準備: 12.5 μ SHS1 バッファー;SHS2 バッファーの 0.5 μ LSHS3 バッファーの 5 μ LSHS4 バッファーの 6.5 μ L。
- 65 ° c、thermomixer で 5 分間インキュベートします。新しい PCR チューブ ストリップの井戸の中へ転送、PCR キャップ ストリップと閉じて (交配バッファー) の"H"としたラベルで維持します。
- 新しい PCR チューブ ストリップの井戸の中へミックス 5 μ L ビオチン化 100 ng/μ L の RNA プローブ (-80 ° C で融解使用の直前に氷の上のストア);SRNase B (RNase 阻害剤) の 0.5 μ L と 1.5 μ H2O (分子生物学グレード)。
- PCR チューブ ストリップ PCR キャップ ストリップと氷の場所を閉じます。ラベルには"R"(RNA) のため。
- 次のパラメーターを使用して PCR マシンを設定します。
95 ° C で 5 分間65 ° c; 25 hふた加熱;29 μ L の PCR の反作用ボリューム。
できるだけ早くすべてのプロシージャの間にメモ: 進みます PCR マシンをサンプルの蒸発を避けるために実行しています。 - PCR マシンで"D"PCR チューブ ストリップを置き、PCR 機械の蓋を閉じるし、PCR 反応を開始します。PCR プログラム 65 ° C に達すると、PCR 機械の蓋を開き、PCR マシンで"H"PCR チューブ ストリップを配置します。PCR 機械の蓋を閉じるし、開く PCR 機械の蓋、場所"R"PCR チューブ PCR マシンのストリップ PCR マシンを終了 3 分間インキュベートします。
- 2 分後に PCR 機械の蓋と PCR チューブのすべてのストリップを開きます。よく"R"にも"R"、その後、すべてのボリュームにも"D"のも"H"の 13 μ L を転送します。反応をミックスに 3 回上下ピペット PCR チューブ ストリップを閉じる、削除"H"と"D"PCR チューブのストリップ、PCR 機械の蓋を閉じる。24 h 65 ° C で反応を孵化させなさい。
17. プロモーターのフラグメントを含む分離結紮製品
注: 次の手順は SureSelect アダプター キットおよびライブラリ (効能表を参照) を実行する推奨します。
- 事前事前に洗浄バッファー 2 65 ° C でサンプルごとの 1.5 mL を温めます。
- 新しい管にストレプトアビジン結合磁性体ビーズ (材料表参照) 60 μ L を追加、1 分の磁気分離スタンドに置き、上清を除去します。
- ビーズ x 結合バッファー 1 の 200 μ L で 3 回洗います。
注: 結紮製品のプロモーターを含むポスト キャプチャ分離中に洗浄ステップごとに再中断ビーズ対応するバッファーで、RT、回転ホイール上 15 rpm 3 分間回転、そっとスピンを収集する 2-3 秒のベンチトップ遠心管内サンプル、場所磁気分離のチューブ スタンド 3 min, と削除の上清。 - 再結合バッファー x 1 の 200 μ L でビーズを中断します。PCR マシンを開き、PCR チューブ (中に PCR プログラムがまだ実行されている) を除去し、磁気ビーズのチューブにハイブリダイゼーション反応を転送します。常温 3 rpm で回転ホイール上で 30 分間インキュベートします。
- 磁気分離スタンドでビーズを再利用し、明確な上澄みを削除します。再洗浄バッファー 1、ミックスの 500 μ L にビーズを中断し、thermomixer で 950 rpm で揺れながら 20 ° C で 15 分間インキュベートします。
- 3 分の磁気分離スタンドでビーズを再利用し、明確な上澄みを削除します。ミックスの再洗浄バッファー 2 の 500 μ L にビーズを中断、および、thermomixer で 950 rpm で揺れながら 65 ° C で 10 分を孵化させなさい。17.5 倍の手順を繰り返します。
- 磁気分離スタンドでビーズを再利用、明確な上澄みを除去し、再バッファー制限 2 x 1 の 200 μ L でビーズを中断します。磁気分離スタンドでビーズを再利用、上清を除去および再バッファー制限 2 x 1 の 30 μ L にビーズを中断します。
18. PCHi C ライブラリ増幅
- PCR マスター ミックスを調製: 5 x PCR のバッファー (バッファー Phusion) 60 μ、25 μ M PE PCR プライマー 1.0、25 μ M PE PCR プライマー 2.0、dNTP ミックス (10 mM)、Phusion ポリメラーゼの 3.6 μ L および H2o. 190.8 μ 8.4 μ L の 3.6 μ L の 3.6 μ L
- ミックス PCR マスター ミックス 50 μ L、および次の条件を使用して PCR 増幅の 6 の因数でビーズ (合計で 300 μ L)、除算:
30 98 ° c s
4 サイクルの: 10 98 ° c、30 秒 65 ° c、30 s 72 ° c s
72 ° C で 7 分 - 収集新しい管ですべての PCR の反作用、磁石のビーズを再利用、上澄みを転送 (300 μ L; PCHi C ライブラリが含まれています) で新しい管へ。
- 15.4 未満上記の手順に従って SPRI ナノビーズ PCHi C ライブラリを浄化します。
- PCHi C ライブラリの濃度を定量化します。
結果
プロモーターをキャプチャやあ-C は豊かなマウス7,34,36,39と人間33,35,37,38こんにちは C ライブラリのために使用されていますプロモーターの相互作用。(名前は HiCap) 同様のプロトコルは、サンドバーグ グループ40によって記述されています。図 1 aは、スケマティック ワークフローを示しますのプロモーターをキャプチャやあ-c.ここで説明したプロトコル、核で結紮41スプリアス結紮製品42の有意な減少の結果を使用してやあ-C ライブラリが生成されます。PCHi-C のため非常に複雑なマウスや人間のやあ-C ライブラリ ソリューションで交配を受けます、22,225 マウス プロモーターを含む HindIII 制限のフラグメントに、相補的な 39,021 のビオチン標識 Rna または 37,608 ビオチン標識 Rna を使用してキャプチャ22,076 人間プロモーターを含む HindIII 制限のフラグメントをそれぞれターゲット。制限のフラグメントを含むプロモーターは、どちらかまたは両方の端に個々 のビオチン標識 Rna (図 1 b) によって対象に指定できます。期待どおりに、両方のキャプチャが個々 のプロモーター (図 1; 塩基配列読み取り) 約 2 倍改善されたカバレッジを終了することが分かった。したがって、いつでも可能 (すなわち、非繰り返しの地域で)、ビオチン標識 Rna 制限のフラグメントの両端に相補的なを使用してキャプチャすることをお勧めします。
ライブラリの準備中に、早い段階で PCHi C ライブラリの品質を評価するには、DNA の ligation および前述31として、浄化の後 2 つのコントロールを実行します。最初は、3 C27のように結紮製品を増幅するプライマーのペアを使用することです。我々 は細胞型不変長距離結紮製品を増幅するプライマー (表 1) を使用して、 Myc遺伝子とその既知のエンハンサーの間などは約 2 Mb です (図 2 a) に位置するまたはHist1の軌跡 (遺伝子間1.5 Mb で区切られた)、および線形近接 ('短距離コントロール') に位置する 2 つの地域間。
2 つ目の品質管理は、ビオチン dATP を制限サイト オーバー ハングの Klenow を介したフィルイン中ビオチン設立の効率を判断する行われます。成功 Klenow フィルインと新しい NheI 認識部位 (図 2 bの形成の DNA 分子結紮製品と同一の場合の間元の制限サイトの消失の後の鈍終りの ligation 結果).NheI 消化結紮製品に同一の割合は、ビオチン結合効率の直接読み出しです。質の悪いやあ-C ライブラリは、高品質ライブラリが結紮製品 (図 2 b) の完全に近い NheI 消化 HindIII 消化の高レベルが表示されます。
バイオアナライザー (図によってこんにちは C ライブラリの準備 (すなわちストレプトアビジン-ビオチンのやあ-C 結紮製品のサイズ選択、アダプターの ligation およびキャプチャ前の PCR のプルダウン後) 後、こんにちは C ライブラリの整合性とサイズ分布を評価します。2 C). PCHi C ライブラリの準備 (すなわち、交配キャプチャのプロモーターを含む結紮製品と後のキャプチャ PCR 後) の終わりに同じ制御を実施します。やあ-C と PCHi C バイオアナライザー プロファイルの比較は、示しています予想通り、やあ-C ライブラリは、対応する PCHi C ライブラリよりもはるかに集中してライブラリのサイズ分布は類似性の高いキャプチャ手順を示すPCHi C (図 2、 D) サイズ バイアスを導入していません。
ペアエンド シーケンス後 PCHi C リードをマップ、品質制御、HiCUP パイプライン43を使用してフィルターされます。70-90% の有効なペア' の間に高品質 PCHi C ライブラリが含まれて (すなわち、ペアエンド シーケンス リード線形のゲノム地図; が近接しない 2 つの制限のフラグメントの間図 3 a、 B)。核で結紮プロトコル41,42を使用すると、トランスの割合を読む (すなわち、ペアエンド シーケンスを異なる染色体上にある 2 つの制限のフラグメント間読み取り) のペアは通常低く、5 と 25% の間の染色体領域と良いライブラリの品質を示す存在を反映しています。'有効なペア' こんにちは C ライブラリ、および彼らの対応する PCHi C ライブラリ35間の割合の直接比較は、示すすべてに有効なペアの割合の場合は (図 3 b) PCHi C ライブラリで高い。これは、PCHi C (図 3) の非有効な '同じフラグメント内部' の読み取りの比率の減少と一緒に伴われます。これは、キャプチャの手順だけでなく、結紮製品のプロモーターを含む豊か、また制限のフラグメントの端に制限キャプチャ oligos の位置のための断片 (図 1B参照)、予想されます。
HiCUP フィルタ リング後、は、捕集率を決定します。PCHi C ライブラリには、有効なシーケンス リード HiCUP フィルタ リング後の 3 種類が含まれています。
1) プロモーター: ゲノムを読み取ります (すなわち、キャプチャのプロモーター断片とゲノム内非プロモーター HindIII 制限のフラグメントの間ヒット)。
2) プロモーター: プロモーターを読み取ります (2 つのキャプチャのプロモーター断片間ヒット)。
3.) のゲノム: ゲノム (結紮製品パートナーのどちらもがキャプチャのプロモーターがマップされる、背景やあ-C 結紮製品) を読み取ります。これらは下流解析の前に破棄されます。
高品質 PCHi C ライブラリには、65-90% (図 3 D) キャプチャ効率 (カテゴリ 1 と 2 の合計) があります。やあ-C ライブラリへの直接比較を示します結果 PCHi C、~ 15-fold 濃縮用プロモーターを含む結紮 (図 3 D)、いくつかのケースでは 17-fold。これは架空の最大に近い (19.6-fold) PCHi-C のゲノム断片の割合に依存しているため濃縮キャプチャ システムによって覆われています。大きい濃縮は、ターゲット数制限断片44,45,46キャプチャ システムを設計することで実現できます。
セルの種類と系統特異性33,34,35, 細胞分化37,38,39 中に顕著な変化を示しますプロモーター interactomes の解析.図 4と5は、特定のプロモーターで系統の特異性と分化のダイナミクスの例を示します。たとえば、 ALADはすべての細胞で発現を示したが、その表現は赤芽球47で亢進。ALADプロモーターは、すべて造血細胞にいくつかの遠位断片と通信し、赤芽球 (図 4) では特に追加操作に従事します。イリノイ 8は、B 細胞、T 細胞、単球、好中球、巨核球 (細胞型特異的相互作用を含む、骨髄系の細胞の相互作用の多数で非常に少数の相互作用の統計的に有意な相互作用を示さない図 5)。これらの例は、PCHi C を使用して、セル型特定 interactomes を解明し、規制の可能性を持つプロモーターと相互作用する領域を識別する方法を示します。
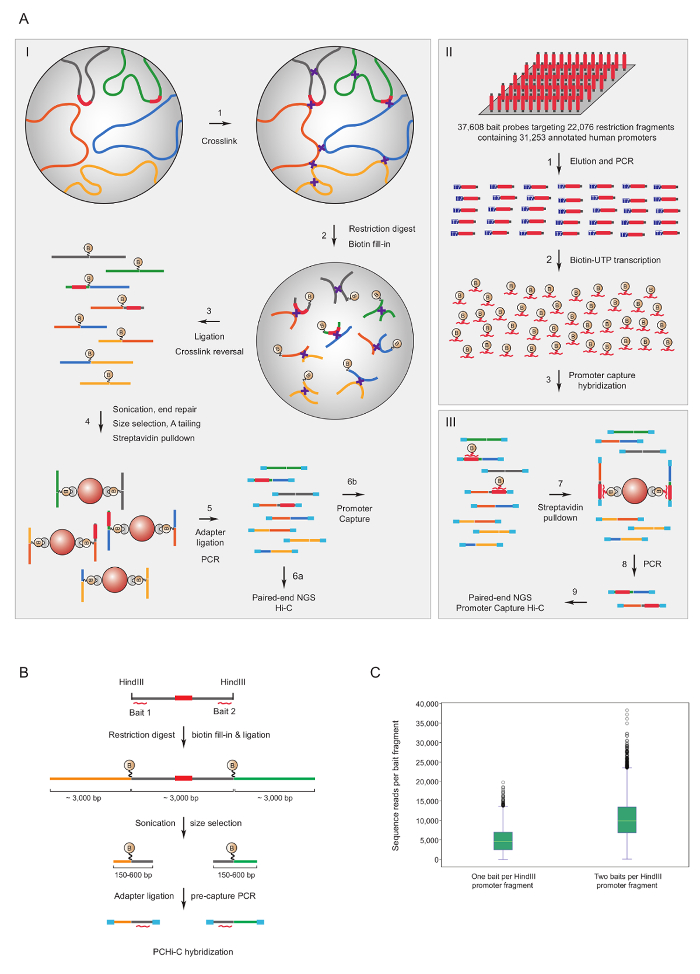
図 1: プロモーター キャプチャやあ-C の根拠とキャプチャ餌デザインします。PCHi C の(A)回路図ワークフロービオチン標識 RNA 餌 (II) ソリューションの交配に続いて核の結紮 (I) やあ-C41,42 (ここに示されて) すべての人間の断片をターゲットまたはマウスの遺伝子プロモーター (III)。(B) PCHi-C のための設計を餌します。ビオチン標識 RNA キャプチャ餌 (赤い曲線) がプロモーターを含む断片 (灰色; 注プロモーター配列自体は (赤) は、彼らが制限にある場合は RNA キャプチャ餌の対象のみの端に対して設計されていますフラグメント終了)。プロモーターを含む制限のフラグメント (グレー) および彼らの相互作用する制限のフラグメント (黄色と緑) から成る結紮製品は、RNA の餌と DNA ターゲットとシーケンス補完の交雑による分離とその後1 つの RNA 餌捕獲プローブ対狙わストレプトアビジン-ビオチン プルダウン、A. (C)比較 PCHi-C のキャプチャ効率プロモーターを含む制限のフラグメントで示すように、2 つの RNA 餌捕獲プローブ (回路図 B を参照)。この図の拡大版を表示するのにはここをクリックしてください。
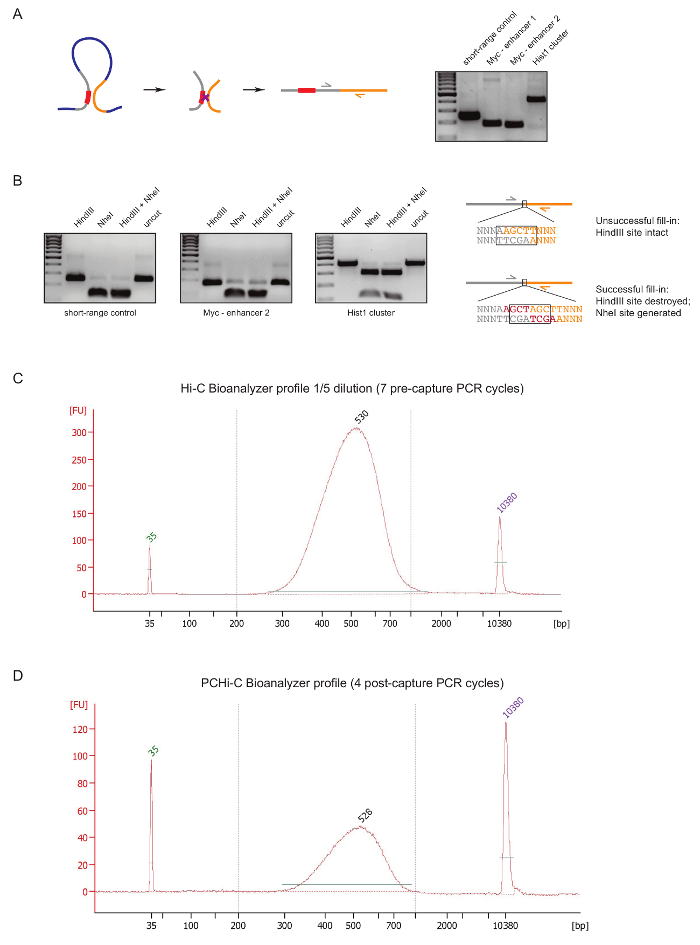
図 2: PCHi C 前シーケンス品質コントロール。(A)左、プロモーターと PIR、プロモーターを含む制限のフラグメント (灰色; 赤でプロモーター) と PIR 制限のフラグメント (黄色) から成るやあ-C 結紮製品の結果との間の空間の並置の概略図。右、DNA ゲルの電気泳動 (左の回路図に描かれている) 特定のプライマーを使用して増幅やあ-C 結紮製品の一例を示します。(B)は左、HindIII/NheI、NheI HindIII 制限の代表的な例は、やあ-C 結紮製品 (A に示すように PCR の製品) のダイジェストします。右、DNA の模式図は、やあ-C 結紮術後次の失敗 (top) にシーケンスまたは制限接合とその後結紮の成功 (下) dNTP Klenow フィルイン。(C)代表やあ-C ライブラリ バイオアナライザー プロファイル (1/5 希釈)。(D)代表 PCHi C ライブラリ バイオアナライザー プロファイル (無希釈)。この図の拡大版を表示するのにはここをクリックしてください。
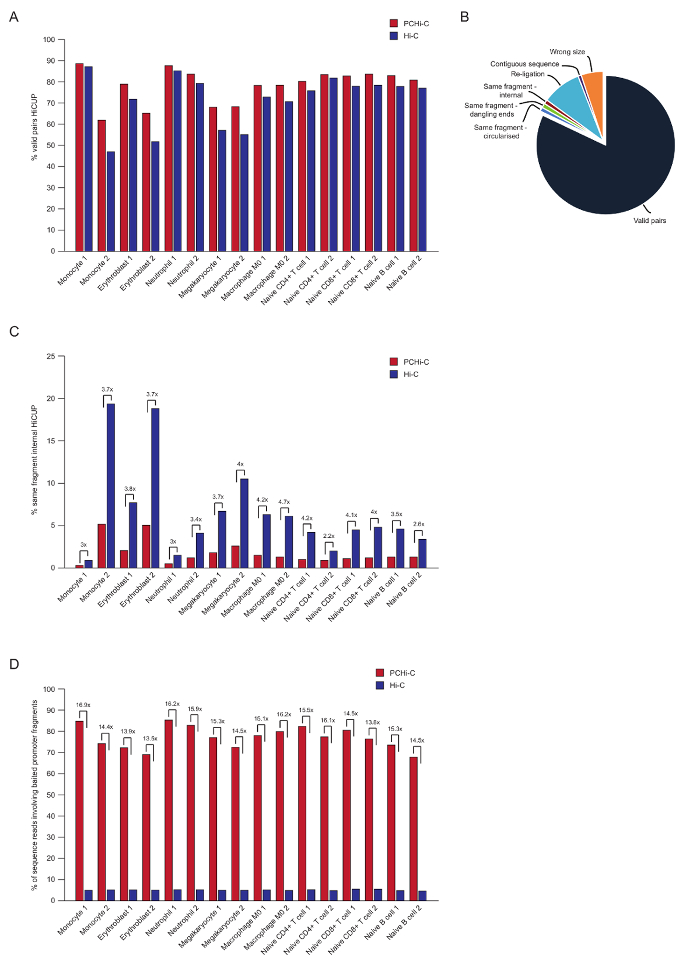
図 3: PCHi C ポスト シーケンス品質コントロール。(A)パーセント有効なシーケンスの比較 HiCUP43こんにちは C ライブラリ (Javierreらからデータ、2016年35) を対応する PCHi C 対で処理後のペアを読み取ります。(B)代表 HiCUP PCHi C 結果有効な表示は、ペア、および下流解析 (Javierreらからデータ、2016年35) 前に破棄されます他のシーケンスのカテゴリをお読みください。(C)内部同じフラグメントの割合の比較はやあ-C ライブラリ (Javierreらからデータ、2016年35) を対応する PCHi C 対処理 HiCUP 後読み取ります。(D)割合シーケンスの比較を含む餌のプロモーター断片 (捕) こんにちは C ライブラリ (Javierreら、2016年35からデータ) を対応する PCHi C 対で読み取ります。この図の拡大版を表示するのにはここをクリックしてください。
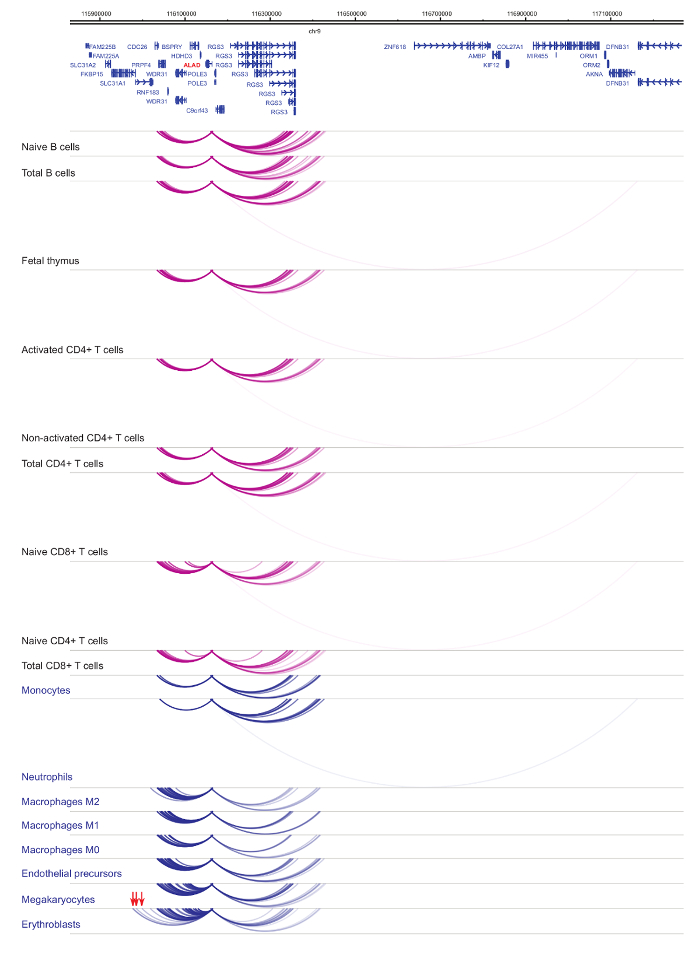
図 4: ALAD ひと造血細胞で PCHi C プロファイル。骨髄性細胞型プロモーター作用青いアーチとして表示され、リンパ系細胞の種類のプロモーター作用は紫色のアーチとして表示されます。赤芽球特定の相互作用は (Javierreらからデータ、2016年35) の赤い矢印で示されます。この図の拡大版を表示するのにはここをクリックしてください。
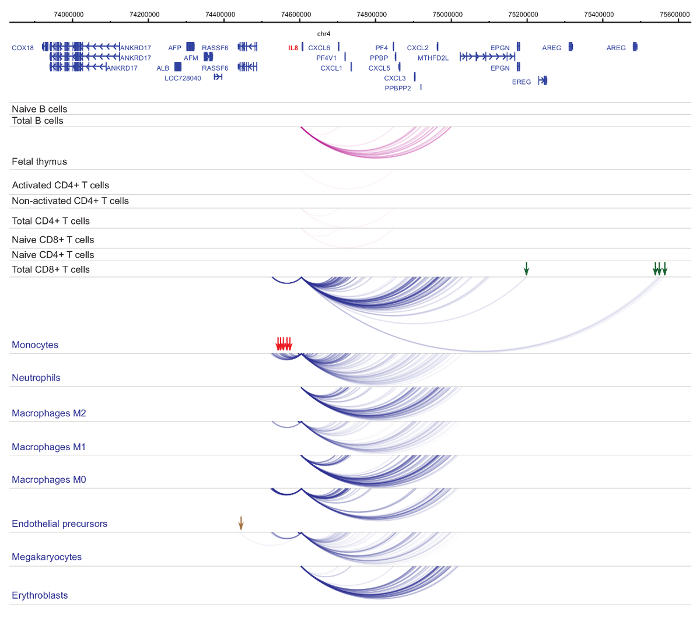
図 5:IL8ひと造血細胞で PCHi C プロファイル。骨髄性細胞型プロモーター作用青いアーチとして表示され、リンパ系細胞の種類のプロモーター作用は紫色のアーチとして表示されます。単球特定の相互作用は緑色の矢印で示されます、好中球特定の相互作用は、赤い矢印で示されます、核球・血小板の相互作用は (Javierreらからデータ、2016年35) 茶色矢印によって示されます。この図の拡大版を表示するのにはここをクリックしてください。
| 人間 | ||||||||
| 名 | シーケンス | 染色体 | ストランド | GRCh38/hg38 を開始します。 | 最後 GRCh38/hg38 | 3 C の相互作用およびビオチン結合テスト通りのプライマー組み合わせ | ||
| hs AHF64 デッカー | GCATGCATTAGCCTCTGCTGTTCTCTGAAATC | 11 | + | 116803960 | 116803991 | hs AHF66 デッカーとの組み合わせで使用します。 | ||
| hs AHF66 デッカー | CTGTCCAAGTACATTCCTGTTCACAAACCC | 11 | + | 116810219 | 116810248 | hs AHF64 デッカーとの組み合わせで使用します。 | ||
| hs MYC 遺伝子座 | GGAGAACCGGTAATGGCAAA | 8 | - | 127733814 | 127733833 | hs MYC-538 または hs MYC +1820 と組み合わせで使用します。 | ||
| hs MYC +1820 | AAAATGCCCATTTCCTTCTCC | 8 | + | 129554527 | 129554547 | hs MYC 遺伝子座と組み合わせてを使用します。 | ||
| hs MYC-538 | TGCCTGATGGATAGTGCTTTC | 8 | - | 127195696 | 127195716 | hs MYC 遺伝子座と組み合わせてを使用します。 | ||
| hs HIST1 F | AAGCAGGAAAAGGCATAGCA | 6 | + | 26207174 | 26207193 | hs HIST1 R との組み合わせで使用します。 | ||
| hs HIST1 R | TCTTGGGTTGTGGGACTTTC | 6 | + | 27771575 | 27771594 | hs HIST1 F と組み合わせてを使用します。 | ||
| マウス | ||||||||
| シーケンス | 染色体 | ストランド | GRCm38/mm10 を開始します。 | 最後 GRCm38/mm10 | 3 C の相互作用およびビオチン結合テスト通りのプライマー組み合わせ | |||
| TCATGAGTTCCCCACATCTTTG | 8 | + | 84841090 | 84841111 | mm Calr2 との組み合わせで使用します。 | |||
| CTGTGGGCACCAGATGTGTAAAT | 8 | + | 84848519 | 84848541 | mm Calr1 との組み合わせで使用します。 | |||
| TATCAAGGGTGCCCGTCACCTTCAGC | 6 | + | 125163098 | 125163123 | Gapdh4 デッカーとの組み合わせで使用します。 | |||
| GGGCTTTTATAGCACGGTTATAAAGT | 6 | + | 125163774 | 125163799 | Gapdh3 デッカーとの組み合わせで使用します。 | |||
| GGAGGAGGGAAAAGGAGTGATT | 6 | + | 52212829 | 52212850 | mm Hoxa13 との組み合わせで使用します。 | |||
| CAGGCATTATTTGCTGAGAACG | 6 | - | 52253490 | 52253511 | mm Hoxa7 との組み合わせで使用します。 | |||
| GGGTAATGGTGTCACTAACTGG | 13 | + | 23571284 | 23571305 | ミリメートル Hist1h3e または Hist1h4i と組み合わせてを使用します。 | |||
| GGGTTTGATGAGTTGGTGAAG | 13 | + | 23566541 | 23566561 | mm Hist1h2ae との組み合わせで使用します。 | |||
| TTGGGCCAAAGCCTATATGA | 13 | + | 22043085 | 22043104 | mm Hist1h2ae との組み合わせで使用します。 | |||
表 1: 人間の品質管理のためのプライマー シーケンスとマウスやあ-C のライブラリです。
ディスカッション
モジュラー設計のプロモーターをキャプチャやあ-C
プロモーターをキャプチャやあ-C は、具体的にはプロモーターを含む相互作用のためのやあ-C ライブラリを豊かにする設計されています。これらの相互作用は、結紮製品こんにちは C ライブラリに存在のサブセットのみを構成します。
やあ-C のキャプチャは、キャプチャ システムを変更することによって genomic 地域または関心領域のやあ-C ライブラリを豊かにする簡単に変更できます。キャプチャ領域は、連続的なゲノム セグメント44,45,46,48, されている増強物をすることができます私は過敏症のサイト49 PCHi C (' 逆キャプチャやあ-C'35) または DNase で識別.実験的スコープに応じて、キャプチャ ・ システムのサイズを調整できます。たとえば、ドライデンら。乳房癌44に関連する 3 つの遺伝子砂漠で 519 餌フラグメントをターゲットします。マーティンらによってキャプチャ システム。両方の連続的なゲノム セグメントを対象 (' 領域をキャプチャ ': 合計 211 ゲノム領域; 2,131 制限のフラグメント)、プロモーター (3,857 遺伝子プロモーター)45を選択。
SureSelect ライブラリは、異なるサイズの範囲で利用できる: 499 kb (5,190-4,806) 2.9 mb (5,190-4,816)、500 kb を 1 kb と 5.9 mb (5,190-4,831) 3 Mb。それぞれ個々 のキャプチャのビオチン RNA は 120 ヌクレオチド長いので、これらはシステムをキャプチャ 4,158 の最大宿泊人数は、24,166 と 49,166 個々 それぞれプローブをキャプチャします。これはそれぞれ 2,079、12,083, 24,583 の対象制限のフラグメントに対応して (制限のフラグメントの番号が 2 つの個々 のキャプチャ プローブがすべての制限のような仮定に基づく下限であることに注意してくださいフラグメント-反復配列により、現実にこれがすべての制限のケースではないフラグメント (図 1 b、 Cを参照してください)、使用可能なキャプチャ プローブの一定数の対象制限のフラグメントの数の増加の結果).
ここで説明されているプロトコルは 6 bp 認識部位を長距離相互作用を明らかにする制限酵素の使用に基づいています。4 bp 認識部位より近位の相互作用のより高い解像度の制限の酵素を使用しても可能な40,49です。
PCHi C の制限
1 つ固有の制限すべての染色体構造キャプチャ アッセイは、ライブラリの生成に使用される制限の酵素がその解像度を決定することです。同じ制限のフラグメントである DNA 要素間で発生する相互作用は、' 型 ' の試金に表示されません。さらに、PCHi C でいくつかのケースで 1 つ以上の転写開始部位は同じプロモーターを含む制限断片に配置でき、いくつかのケースでピアース港両方のアクティブおよび抑圧的なヒストン マークを難しくピンポイント規制要素は、の相互作用を仲介するプロモーターの相互作用の制御出力を予測します。この問題を軽減します 4 bp 認識部位による制限酵素が大幅に増加のやあ-C ライブラリの複雑さを犠牲にして来る (4 bp 認識サイト制限の酵素と生成されたこんにちは C ライブラリはやあ-C よりも少なくとも 100 倍以上複雑な6 bp 認識サイト制限の酵素と生成ライブラリ) と次世代シーケンシングのコスト。
別の制限は、現在 PCHi C プロトコルが開始材料は、まれなセルタイプのプロモーター作用の解析を排除として細胞の数百万を必要することです。10,000、100,000 細胞 (たとえば初期胚または造血幹細胞中に細胞) の細胞集団でプロモーター連絡先の尋問をする PCHi C の修正版にはキャプチャに貴重な追加となりますハイ-C のツールボックス。
最後に、ホルムアルデヒド固定に依存するすべてのメソッドと同様 PCHi C のみを記録 'フリーズ' されている固定の時点でします。したがって、動態とプロモーターの相互作用の動力学を調査する超解像度の生細胞の顕微鏡検査などの方法が PCHi C. と一緒に必要な
高解像度で空間染色体組織を分析する方法
染色体操作ライブラリの広大な複雑さには、統計的有意性の 2 の特定の制限の片の間の相互作用の製品の信頼性の高い識別が禁止されています。この問題を回避するためにシーケンスのキャプチャは、やあ-C33,34,40,44または特定の相互作用の 3 C50,51ライブラリを豊かに使用されています。濃縮のステップのやあ-C ライブラリ 3 C 以上のライブラリを使用する主な利点は、やあ-C、3 C とは異なり含まれている本物の結紮用濃縮ステップです。結果として、PCHi C ライブラリで有効な読み取りの割合は約キャプチャ c ライブラリ50、約 5-8% の有効なを含んだ HiCUP フィルタ リング後読み取りよりも 10 倍高い。Sahlenらは直接 HiCap PCHi C のような 3 C ライブラリを使用してキャプチャ-C と対照をなして、キャプチャ濃縮のやあ-C のライブラリを使用するをキャプチャ-C を比較しています。我々 の調査結果に一貫した、彼らは非結紮断片40のキャプチャ C ライブラリは、主に見つけた。加えて、HiCap ライブラリは、キャプチャ C ライブラリ40より高い複雑さを持っていた。
次世代キャプチャ C52 (NG キャプチャ-C) と呼ばれるキャプチャ-C のバリアントが PCHi C33,34, 元のプローブを重複するのではなく、以前に確立として制限のフラグメントの最後あたり 1 つのオリゴを使用します。キャプチャ C プロトコル50。控えめ、キャプチャ C と比較して有効な読み取りの割合が高くこれが NG キャプチャ-C はキャプチャ濃縮の 2 つの連続したラウンドを採用し、サイクルの PCR の比較的高い数 (合計で 20 に 24 のサイクルと比較して 11 サイクル通常 PCHi c)、シーケンス重複およびライブラリ複雑さの高い数値で必然的に結果は。PCHi C の最適化中に試用実験でユニークな (すなわち、重複していない) の割合がペアがのみ約 15% 出来る 19 PCR のサイクルを読むことがわかった (事前にキャプチャし 13 サイクル + 6 サイクル後キャプチャのデータは表示されません)、しかしPCR のサイクルの数を減らすための最適化は通常 75-90% 読み取りペアを生成します。PCR のサイクル数を大幅に削減、有益なシーケンス データの量を増やします。
最近メソッドは、やあ-C (HiChIP53) の興味の特定の蛋白質を介した染色体の相互作用に焦点を当てるとチップを組み合わせたものです。HiChIP データには嘉ペット54、類似原理に基づくと比較してより高い数53を呼び出すより高い信頼の相互作用を可能にする有益なシーケンス リードにはが含まれます。対応する HiChIP を直接比較する非常に興味深いものになるし、やあ-C のキャプチャ データを一度使用可能になった (たとえばコヒーシン ユニット Smc1a に対する抗体を用いた HiChIP53とキャプチャやあ-C のすべての Smc1a バインド制限フラグメント) 側。これらの 2 つのアプローチ間の 1 つの本質的な違いはやあ-C のキャプチャはクロマチン免疫沈降に依存しないし、したがって染色体相互作用タンパク質占有関係を問い合わせることが可能です。これにより、マウス esc キー空間ゲノム アーキテクチャ7の重要な調節因子としてよう PRC1 を識別するために使用されています、特定の要因バインドの有無で 3 D ゲノム構成の比較。
PCHi C および GWAS
ゲノムワイド関連研究 (GWAS) を明らかにしたことの 95% を超える疾患関連蛋白質のコーディングの遺伝子55に遠距離が多いで、ゲノムの非コーディング領域に塩基配列変異株があります。GWAS 亜種が多い私は発見 DNase 近くに過敏症のサイト規制電位とシーケンスの認刻極印であります。PCHi C とやあ-C のキャプチャは、GWAS リスク遺伝子座乳房癌44、大腸癌48、および自己免疫疾患35,45,46に関与するプロモーターをリンクに広く使用されています。PCHi C 型が自己免疫疾患に関連する Snp はリンパ球様細胞でピアースで濃縮した血小板と赤血球の特定の特性に関連付けられているシーケンスの亜種主に発見されたに対し 17 の異なるひと造血細胞に関する研究します。大食細胞と赤芽球、それぞれ35,56。したがって、組織型特異的プロモーター PCHi C が明らかに interactomes 可能性があります非コーディングの疾患関連の機能を理解するのに役立つの亜種をシーケンス、治療的介入の新しい潜在的な病気の遺伝子を識別します。
相互作用の促進者の地域の特徴
証拠の複数のラインは、遺伝子発現制御にプロモーター interactomes をリンクします。最初に、いくつかの PCHi C 研究は、ゲノム領域 (非常に) 表現された遺伝子のプロモーターとの相互作用が H3K27 アセチル化および p300 バインディング33,34などのエンハンサー アクティビティに関連付けられているマークで濃縮され、示されています。,37. 我々 は遺伝子発現レベルおよび相互作用のエンハンサーは、遺伝子発現の増強物の結果の添加効果レベル34,35のことを示唆している数には正の相関を発見しました。第二に、量的形質遺伝子座 (eQTLs) は、式は eQTLs35によって影響される同じ遺伝子に接続しているピアースで濃縮され表現が自然発生します。第三に、旅行57と PCHi C データの統合、ケアンズら発見旅行レポーター遺伝子マウス Esc でピアースへのマッピングを示す強い記者統合サイトでレポーター遺伝子よりも遺伝子発現プロモーター-相互作用する領域に58ピアースが転写調節活性を有していることを示します。一緒に、プロモーター interactomes PCHi C によって明らかに様々 なマウスとヒトの細胞型が遺伝子発現制御の主要な規制モジュールを含めることが示唆されました。
PCHi C33,34で検出されたすべてのピアースのエンハンサーがごく一部 (~ 20%) を表すことは注目に値するです。他のピアースは、構造や位相の役割ではなく、直接転写調節機能可能性があります。ただし、PCHi C 古典的なエンハンサー マークを抱くない調節機能を持つ DNA の要素が明らかにする証拠もあります。リンパ系細胞ラインでBRD7プロモーターはレポーター遺伝子アッセイ33エンハンサー活性を有することを示したエンハンサー マークに欠けている地域との対話を発見されました。同様の特性を持つ規制要素は現在高く評価よりも多い可能性があります。たとえば、規制 DNA 要素識別マークされていない規制要素 (UREs) が遺伝子発現を制御エンハンサーを欠いているため CRISPR ベースの画面は、59をマークします。
他のケースでピアースが転写抑制に関連するクロマチン マークを港に示されています。ピアースのマウス Esc のよう PRC1 によってバインドされている相互作用するプロモーターが従事して、抑圧的なマーク H3K27me37軸受抑圧された遺伝子の広範な空間ネットワーク。ヒトリンパ芽球細胞で遠い要素BCL6プロモーターとの相互作用は遺伝子レポーター遺伝子式33、ネイティブ コンテキストにBCL6転写を抑制する機能があることを示唆を鎮圧しました。
ピアースは、Esc での人間37クロマチン絶縁体蛋白 CTCF の占有率は、ピアースのもう一つのクラスを表すことができるためにの濃縮します。総称して、ピアース港遺伝子特徴付けられる機能的にまだ規制活動のコレクションであることが示唆されました。
開示事項
著者が明らかに何もありません。
謝辞
ヴァレリア ・ トランスに批判的な読み原稿および図 1 による専門家の助けをありがちましょう。この作品は、医学研究評議会、英国 (氏/L007150/1) 英国バイオ ・生物科学研究会議、英国 (BB/J004480/1) によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| 16% (vol/vol) paraformaldehyde solution | Agar Scientific | R1026 | |
| Dulbecco's Modified Eagle Medium (DMEM) 1x | Life Technologies | 41965-039 | |
| Fetal bovine serum (FBS) sterile filtered | Sigma | F9665 | |
| Low-retention filter tips | Starlab | S1180-3810, S1180-1810, S1180-8810 and S1182-1830 | |
| 10x PBS pH 7.4 | Life Technologies | 70011-036 | |
| Molecular biology grade water | Sigma-Aldrich | W4502 | |
| 1 M Tris-HCl pH 8.0 | Life Technologies | 15568-025 | |
| IGEPAL CA-630 | Sigma-Aldrich | I8896 | |
| 5 M NaCl | Life Technologies | 24740-011 | |
| Protease inhibitor cocktail (EDTA-free) | Roche Diagnostics | 11873580001 | |
| Restriction buffer 2 (10x NEBuffer 2) | New England Biolabs | B7002 | |
| DNA LoBind tube, 1.5 mL | Eppendorf | 0030 108.051 | |
| DNA LoBind tube, 2 mL | Eppendorf | 30108078 | |
| 20% (wt/vol) SDS | Bio-Rad Laboratories | 161-0418 | |
| 20% (vol/vol) Triton X-100 | Sigma-Aldrich | T8787 | |
| HindIII, 100 U/uL | New England Biolabs | R0104 | |
| 10 mM dCTP | Life Technologies | 18253-013 | |
| 10 mM dGTP | Life Technologies | 18254-011 | |
| 10 mM dTTP | Life Technologies | 18255-018 | |
| 0.4 mM Biotin-14-dATP | Life Technologies | 19524-016 | |
| DNA polymerase I large (Klenow) fragment 5000 units/mL | New England Biolabs | M0210 | |
| 10x T4 DNA ligase reaction buffer | New England Biolabs | B0202 | |
| 100x 10mg/ml Bovine Serum Albumin | New England Biolabs | B9001 | |
| T4 DNA ligase, 1 U/μL | Invitrogen | 15224-025 | |
| RNase A | Roche | 10109142001 | |
| Proteinase K, recombinant, PCR grade | Roche | 3115836001 | |
| 20 000×g 50 ml centrifuge tube | VWR | 525-0156 | |
| 0.5 M EDTA pH 8.0 | Life Technologies | 15575-020 | |
| Phenol pH 8.0 | Sigma | P4557 | |
| Phenol: Chloroform: Isoamyl Alcohol 25:24:1 | Sigma | P3803 | |
| Sodium acetate pH 5.2 | Sigma | S7899 | |
| Quant-iT PicoGreen | Invitrogen | P7589 | |
| QIAquick Gel Extraction Kit | Qiagen | 28704 | |
| QIAquick PCR Purification Kit | Qiagen | 28104 | |
| Restriction buffer 2.1 (10x NEBuffer 2.1) | New England Biolabs | B7202 | |
| NheI, 100U/uL | New England Biolabs | R0131 | |
| Micro TUBE AFA Fiber Pre-slit snap cap 6x16mm vials | Covaris | 520045 | For sonication |
| SPRI beads (Agencourt AMPure XP) | Beckman Coulter | A63881 | |
| Dynabeads MyOne Streptavidin C1 beads | Invitrogen | 65001 | |
| Tween 20 | Sigma | P9416 | |
| 10 mM dATP | Life Technologies | 18252-015 | |
| T4 DNA polymerase 3000 units/mL | New England Biolabs | M0203 | |
| T4 PNK 10000 units/mL | New England Biolabs | M0201 | |
| Klenow exo minus 5000 units/mL | New England Biolabs | M0212 | |
| Quick ligation reaction buffer | New England Biolabs | B6058 | |
| NEB DNA Quick ligase | New England Biolabs | M2200 | |
| PE adapter 1.0 (5'-P-GATCGGAAGAGCGGTTCAGC AGGAATGCCGAG-3') | Illumina | ||
| PE adapter 2.0 (5'-ACACTCTTTCCCTACACGACGCT CTTCCGATCT-3') | Illumina | ||
| NEB Phusion PCR kit | New England Biolabs | M0530 | |
| PE PCR primer 1.0 (5'-AATGATACGGCGACCACCGA GATCTACACTCTTTCCCTAC ACGACGCTCTTCCGATCT-3') | Illumina | ||
| PE PCR primer 2.0 (5'-CAAGCAGAAGACGGCATACGA GATCGGTCTCGGCATTCCT GCTGAACCGCTCTTCCGATCT-3') | Illumina | ||
| PCR strips | Agilent Technologies | 410022 and 401425 | |
| SureSelect SSEL TE Reagent ILM PE full adaptor kit | Agilent Technologies | 931108 | |
| SureSelect custom 3-5.9 Mb library | Agilent Technologies | 5190-4831 | custom design mouse or human PCHi-C system |
| Dynabeads MyOne Streptavidin T1 beads | Invitrogen | 65601 | |
| E220 high-performance focused ultra-sonicator | Corvaris | E220 |
参考文献
- Osborne, C. S., et al. Active genes dynamically colocalize to shared sites of ongoing transcription. Nature Genetics. 36, 1065-1071 (2004).
- Schoenfelder, S., et al. Preferential associations between co-regulated genes reveal a transcriptional interactome in erythroid cells. Nature Genetics. 42, 53-61 (2010).
- de Wit, E., et al. The pluripotent genome in three dimensions is shaped around pluripotency factors. Nature. 501, 227-231 (2013).
- Bantignies, F., et al. Polycomb-dependent regulatory contacts between distant Hox loci in Drosophila. Cell. 144, 214-226 (2011).
- Engreitz, J. M., et al. The Xist lncRNA exploits three-dimensional genome architecture to spread across the X chromosome. Science. 341, 1237973(2013).
- Denholtz, M., et al. Long-range chromatin contacts in embryonic stem cells reveal a role for pluripotency factors and polycomb proteins in genome organization. Cell Stem Cell. 13, 602-616 (2013).
- Schoenfelder, S., et al. Polycomb repressive complex PRC1 spatially constrains the mouse embryonic stem cell genome. Nature Genetics. 47, 1179-1186 (2015).
- Kundu, S., et al. Polycomb Repressive Complex 1 generates discrete compacted domains that change during differentiation. Molecular Cell. 65, 432-446 (2017).
- Skok, J. A., Gisler, R., Novatchkova, M., Farmer, D., de Laat, W., Busslinger, M. Reversible contraction by looping of the Tcra and Tcrb loci in rearranging thymocytes. Nature Immunology. 8, 378-387 (2007).
- Zhang, Y., et al. Spatial organization of the mouse genome and its role in recurrent chromosomal translocations. Cell. 148, 908-921 (2012).
- Aymard, F., et al. Genome-wide mapping of long-range contacts unveils clustering of DNA double-strand breaks at damaged active genes. Nature Structural & Molecular Biology. 24, 353-361 (2017).
- Ryba, T., et al. Evolutionarily conserved replication timing profiles predict long-range chromatin interactions and distinguish closely related cell types. Genome Research. 20, 761-770 (2010).
- Pope, B. D., et al. Topologically associating domains are stable units of replication-timing regulation. Nature. 515, 402-405 (2014).
- Chandra, T., et al. Global reorganization of the nuclear landscape in senescent cells. Cell Reports. 10, 471-483 (2015).
- Carter, D., Chakalova, L., Osborne, C. S., Dai, Y. F., Fraser, P. Long-range chromatin regulatory interactions in vivo. Nature Genetics. 32, 623-626 (2002).
- Tolhuis, B., Palstra, R. J., Splinter, E., Grosveld, F., de Laat, W. Looping and interaction between hypersensitive sites in the active beta-globin locus. Molecular Cell. 10, 1453-1465 (2002).
- Amano, T., Sagai, T., Tanabe, H., Mizushina, Y., Nakazawa, H., Shiroishi, T. Chromosomal dynamics at the Shh locus: limb bud-specific differential regulation of competence and active transcription. Developmental Cell. 16, 47-57 (2009).
- Zuniga, A., et al. Mouse limb deformity mutations disrupt a global control region within the large regulatory landscape required for Gremlin expression. Genes & Development. 18, 1553-1564 (2004).
- Sagai, T., Hosoya, M., Mizushina, Y., Tamura, M., Shiroishi, T. Elimination of a long-range cis-regulatory module causes complete loss of limb-specific Shh expression and truncation of the mouse limb. Development. 132, 797-803 (2005).
- D'Haene, B., et al. Disease-causing 7.4 kb cis-regulatory deletion disrupting conserved non-coding sequences and their interaction with the FOXL2 promotor: implications for mutation screening. PLoS Genet. 5, e1000522(2009).
- Sur, I. K., et al. Mice lacking a Myc enhancer that includes human SNP rs6983267 are resistant to intestinal tumors. Science. 338, 1360-1363 (2012).
- Herranz, D., et al. A NOTCH1-driven MYC enhancer promotes T cell development, transformation and acute lymphoblastic leukemia. Nature Medicine. 20, 1130-1137 (2014).
- Deng, W., et al. Controlling long-range genomic interactions at a native locus by targeted tethering of a looping factor. Cell. 149, 1233-1244 (2012).
- Groschel, S., et al. A single oncogenic enhancer rearrangement causes concomitant EVI1 and GATA2 deregulation in leukemia. Cell. 157, 369-381 (2014).
- Lupianez, D. G., et al. Disruptions of topological chromatin domains cause pathogenic rewiring of gene-enhancer interactions. Cell. 161, 1012-1025 (2015).
- Franke, M., et al. Formation of new chromatin domains determines pathogenicity of genomic duplications. Nature. 538, 265-269 (2016).
- Dekker, J., Rippe, K., Dekker, M., Kleckner, N. Capturing chromosome conformation. Science. 295, 1306-1311 (2002).
- Simonis, M., et al. Nuclear organization of active and inactive chromatin domains uncovered by chromosome conformation capture-on-chip (4C). Nature Genetics. 38, 1348-1354 (2006).
- Zhao, Z., et al. Circular chromosome conformation capture (4C) uncovers extensive networks of epigenetically regulated intra- and interchromosomal interactions. Nature Genetics. 38, 1341-1347 (2006).
- Dostie, J., et al. Chromosome Conformation Capture Carbon Copy (5C): A massively parallel solution for mapping interactions between genomic elements. Genome Research. 16, 1299-1309 (2006).
- Lieberman-Aiden, E., et al. Comprehensive mapping of long-range interactions reveals folding principles of the human genome. Science. 326, 289-293 (2009).
- Belton, J. M., McCord, R. P., Gibcus, J. H., Naumova, N., Zhan, Y., Dekker, J. Hi-C: a comprehensive technique to capture the conformation of genomes. Methods. 58, 268-276 (2012).
- Mifsud, B., et al. Mapping long-range promoter contacts in human cells with high-resolution capture Hi-C. Nature Genetics. 47, 598-606 (2015).
- Schoenfelder, S., et al. The pluripotent regulatory circuitry connecting promoters to their long-range interacting elements. Genome Res. 25, 582-597 (2015).
- Javierre, B. M., et al. Lineage-specific genome architecture links enhancers and non-coding disease variants to target gene promoters. Cell. 167, 1369-1384 (2016).
- Wilson, N. K., et al. Integrated genome-scale analysis of the transcriptional regulatory landscape in a blood stem/progenitor cell model. Blood. 127, e12-e23 (2016).
- Freire-Pritchett, P., et al. Global reorganisation of cis-regulatory units upon lineage commitment of human embryonic stem cells. Elife. 6, (2017).
- Rubin, A. J., et al. Lineage-specific dynamic and pre-established enhancer-promoter contacts cooperate in terminal differentiation. Nature Genetics. 49, 1522-1528 (2017).
- Siersbaek, R., et al. Dynamic rewiring of promoter-anchored chromatin loops during adipocyte differentiation. Molecular Cell. 66, 420-435 (2017).
- Sahlen, P., et al. Genome-wide mapping of promoter-anchored interactions with close to single-enhancer resolution. Genome Biology. 16, 156(2015).
- Nagano, T., et al. Single-cell Hi-C reveals cell-to-cell variability in chromosome structure. Nature. 502, 59-64 (2013).
- Nagano, T., Varnai, C., Schoenfelder, S., Javierre, B. M., Wingett, S. W., Fraser, P. Comparison of Hi-C results using in-solution versus in-nucleus ligation. Genome Biology. 16, 175(2015).
- Wingett, S., et al. HiCUP: pipeline for mapping and processing Hi-C data. F1000 Res. 4, 1310(2015).
- Dryden, N. H., et al. Unbiased analysis of potential targets of breast cancer susceptibility loci by Capture Hi-C. Genome Research. 24, 1854-1868 (2014).
- Martin, P., et al. Capture Hi-C reveals novel candidate genes and complex long-range interactions with related autoimmune risk loci. Nature Communications. 6, 10069(2015).
- McGovern, A., et al. Capture Hi-C identifies a novel causal gene, IL20RA, in the pan-autoimmune genetic susceptibility region 6q23. Genome Biol.ogy. 17, 212(2016).
- Hodge, D., et al. A global role for EKLF in definitive and primitive erythropoiesis. Blood. 107, 3359-3370 (2006).
- Jager, R., et al. Capture Hi-C identifies the chromatin interactome of colorectal cancer risk loci. Nature Communications. 6, 6178(2015).
- Joshi, O., et al. Dynamic reorganization of extremely long-range promoter-promoter Interactions between two states of pluripotency. Cell Stem Cell. 17, 748-757 (2015).
- Hughes, J. R., et al. Analysis of hundreds of cis-regulatory landscapes at high resolution in a single, high-throughput experiment. Nature Genetics. 46, 205-212 (2014).
- Kolovos, P., et al. Targeted Chromatin Capture (T2C): A novel high-resolution high-throughput method to detect genomic interactions and regulatory elements. Epigenetics Chromatin. 7, 10(2014).
- Davies, J. O., et al. Multiplexed analysis of chromosome conformation at vastly improved sensitivity. Nature Methods. 13, 74-80 (2016).
- Mumbach, M. R., et al. HiChIP: efficient and sensitive analysis of protein-directed genome architecture. Nature Methods. 13, 919-922 (2016).
- Fullwood, M. J., et al. An oestrogen-receptor-alpha-bound human chromatin interactome. Nature. 462, 58-64 (2009).
- Maurano, M. T., et al. Systematic localization of common disease-associated variation in regulatory DNA. Science. 337, 1190-1195 (2012).
- Petersen, R., et al. Platelet function is modified by common sequence variation in megakaryocyte super enhancers. Nat. Commun. 8, 16058(2017).
- Akhtar, W., et al. Chromatin position effects assayed by thousands of reporters integrated in parallel. Cell. 154, 914-927 (2013).
- Cairns, J., et al. CHiCAGO: Robust detection of DNA looping interactions in Capture Hi-C data. Genome Biology. 17, 127(2016).
- Rajagopal, N., et al. High-throughput mapping of regulatory DNA. Nature Biotechnology. 34, 167-174 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved