Method Article
C.エレガンスにおける大エキソファー小胞における生体内ニューロン集合体およびオルガネラ押出におけるスコアリングのための定量的アプローチ
要約
このプロトコルは、膜結合エキソファーの形態で C.エレガンス 細胞によって生成された大きな凝集および/または小器官押出(〜4μm)の検出および定量のアプローチを記述する。我々は、この破片の剥離メカニズムの解剖を容易にするために必要な株、成長条件、スコアリング基準、タイミングおよび顕微鏡観察の考慮事項について述べる。
要約
誤って折り畳まれたタンパク質およびミトコンドリア機能障害の毒性は、種を越えて、年齢に関連する機能的神経細胞の衰退および神経変性疾患を促進する極めて重要な因子である。これらの神経毒性の課題は、長い間細胞組み込みであると考えられてきましたが、1つのニューロンに由来する誤って折り畳まれたヒト疾患タンパク質が隣接する細胞に現れることができることを裏付けるかなりの証拠が、ヒト神経変性疾患における病理の広がりを促進するために提案された現象である。
凝集タンパク質を発現するC.エレガンス成体ニューロンは、凝集タンパク質、ミトコンドリア、リソソームを含むことができる大きな(約4μm)膜に取り囲まれた小胞を押し出すことができます。これらの大きな小胞は「エキソファー」と呼ばれ、エキソソーム(約100倍小さく、異なる生物形成を有する)とは異なる。エキソファーに細胞の破片を投げ出すは、ヒト神経変性疾患に凝集体が広がるプロセスに関連する、ニューロンプロテオースタシスとミトコンドリア品質管理の基本的な、しかし以前は認識されなかった枝を構成する保存されたメカニズムによって起こり得る。
エキソファーはタッチニューロン内で高コピートランスジェニックmCherryを発現する動物で主に研究されてきたが、これらのプロトコルは、蛍光タグ付きオルガネラまたは様々なクラスのニューロンに関心のある他のタンパク質を使用した発熱の研究にも同様に有用である。
ここに記載されている C.エレガンス の外因の物理的特徴、検出のための戦略、識別基準、定量のための最適なタイミング、およびエキソファーの生産レベルを調節できるストレスを制御する動物の成長プロトコルがあります。一緒に、ここで概説するプロトコルの詳細は、実験室全体のエキソファーの定量分析のための標準を確立するのに役立つはずです。この文書は、エキソファーが産生され、エキソファーが隣接する細胞および遠くの細胞によって反応される分子メカニズムを精巧にしようとする実験室の分野の資源として機能することを目指している。
概要
凝集体および機能不全ミトコンドリアの神経毒性の課題は、長い間細胞組み込みであると考えられてきましたが、最近では、1つのニューロンに由来する誤って折り畳まれたヒト疾患タンパク質が隣接する細胞にも広がり、病理を促進することが明らかになりました。同様に、哺乳動物のミトコンドリアは、細胞内分解2 のために、または挑戦した隣接細胞3におけるミトコンドリア集団の救助のために、元の産生の細胞から送り出すことができる。さまざまなサイズの小胞は、一般的に、細胞材料を隣接する細胞または流体周囲4に伝達することが観察されている。押し出された小胞の中には、平均的な神経細胞のソーマ(平均タッチニューロンソーマ〜6μm)の大きさに近づき、大きな凝集体やオルガネラに対応できるものもあります。
タンパク質凝集体および小器官を運ぶことができる大きな小胞押出の顕著な例は、有害な凝集を起こしやすい、分解耐性mCherry5をコードする高コピー数レポーター構築物を発現するC.エレガンスタッチ受容体ニューロンで起こる。エキソファーと呼ばれるタッチニューロンからの押出は、平均直径約4μmであり、選択的にmCherryまたは他の凝集体を含み、通常はタッチ受容体ニューロンを取り囲む隣接する皮下に直接送達される。この皮下皮はリソソームベースの分解を試みるが、mCherry凝集体のような一部の非消化性内容物は、動物の流体充填されたシュードコロームに皮下で再押し出され、そこからmCherryを長期間保存するために血球細胞と呼ばれる遠隔スカベンジャー細胞によって取り上げることができる(図1、図2)5。
大きな押出されたエキソファー小胞は、タッチ受容体原形質膜に囲まれた細胞を残し、凝集したヒト疾患タンパク質、ミトコンドリア、リソソームを含むことができる。エキソファー産生のプロセスは、潜在的に有毒な種の選別を伴うようだ(例えば、凝集しやすい発現mCherryは、主に神経細胞腫に残っているGFPのような可溶性の不快なタンパク質から分離される)。このようにして、脅迫的な実体の指示された追放はニューロン5によって達成される。オートファジー・ノックダウンによって誘発されるストレス、MG132媒介性プロテアソーム阻害、またはハンチントン病関連の拡大ポリグルタミンQ128またはアルツハイマー病関連フラグメントAβ1-42などのヒト疾患タンパク質のトランスジェニック発現などのプロテオスタシスの課題は、エキサを産生するニューロンの数を増加させることができる5。
エキソファーは最近文書化されたばかりで、生物学のメリットの説明で知られています。エキソファーは、C.エレガンスタッチ受容体ニューロンで発見され、最もよく研究されています。細胞体が体の周りに分布し、その超構造が特徴的な15の原始フィラメント微小管を特徴とするため、微小管細胞と呼ばれる6つのC.エレガンスメカノ感覚タッチニューロンがあります。タッチ受容体ニューロンは、前AVM(前腹側腸管ニューロン)、ALMR、ALML(左右の前側腸管ニューロン)、より中央のPVM(後側腹側腸管ニューロン)、後部PLMRおよびPLML(後側側微小管ニューロンおよび右および左)興味深いことに、6つのタッチ受容体ニューロンは、同じ攻撃的なトランスジーンを発現しているにもかかわらず、異なる速度でエキソファーを産生する(図3C)。6つのメカノ感覚タッチ受容体ニューロンのうち、ALMRニューロンは他のタッチニューロンよりも頻繁に発熱を受ける。タッチニューロンからのエキソファー数の定量は、ALMRに焦点を当てることによって通常確立される。
細胞形成は、典型的には神経細胞質の腫脹から始まる動的なプロセスである(図1A-B)。細胞内容物、オルガネラ、またはタンパク質凝集体は、神経細胞腫の片側に収集され、最も一般的にはALMRニューロンの後端(突出性神経突起から離れて)に向かって、プレエソファードメイン(PED)を形成する(図1B)。PEDが外側に突き出し始めると、初期の突起が観察され、認識可能な突出した芽を形成する。後期芽は、プレエキソファードメインの最も広い直径が、ソマエキソファー首の収縮の直径よりおよそ1/3大きいときに定義される(図1C)。エコファーはソーマからほぼ任意の方向に排出することができるが、ほとんどのエコファーは細胞体から後に出て、元の相馬とほぼ同じ焦点面にとどまる。
芽の首が薄いフィラメントに狭くなるにつれて、エキソファーは元のソーマから離れることができます。このフィラメント(図1D、矢印)を介して、外発性はソーマに付着したままで、後で剥離することができます。カルシウム、凝集体、ミトコンドリアなどの細胞内容物は、このフィラメントを介して付属のエキソファー5に移すことができるが、押し出された材料の大部分は、大規模な芽球によってエキソファーコンパートメントに入れ込まれる。エキソファーは、可視の接続チューブまたは薄いフィラメントがなく、そのエキソファーが送出側のソーマから完全に分離されている場合に成熟していると見なされます(図1E)。
C.エレガンスが産生するエキソファーは、すぐに皮下、タッチニューロンを取り囲む組織に遭遇する。最も一般的には、エキソファー小胞は尾部に向かって下皮内を後に移動するように見え、エソファーの内容物が劣化の対象と見える前に相腫からかなり遠く離れている可能性があります(例えば、距離は相馬から〜100μm離れている可能性があります)。蛍光エキソファー小胞は、皮下の多くの小胞に分裂し、「星空の夜」と呼ばれる外観を取る(図1Gおよび図2)。「星空の夜」段階では、穿刺蛍光物質は、元の孤独なエキソファーと比較して蛍光の多くの小さな点に皮下同期性を横切って散在するのを観察することができる。星空の夜は、低倍率の下で穿刺を見ることができ、より高い倍率で、下皮内で穿刺および/またはネットワークに見えることができます。星空夜の蛍光シグナルは、典型的には、蛍光のエキソファーおよびニューロンに比べて薄暗い(図2B-C)。多くの穿刺小胞へのmCherryの分散は、皮下細胞の内因性/リソソームネットワークとの貪食成熟および融合を伴うと考えられている。一部のエキソファー材料は皮下リソソームネットワークで分解される可能性が高いが、分解に強い残留種(mCherry凝集体など)は、細胞の破片を含むことができる流体室であるシュードコロームに皮下皮から投げ出される。蛍光物質は後に、血球細胞(図2C)と呼ばれる遠隔スカベンジャー細胞によって取り込まれ、濃縮、貯蔵、そして再びmCherryの分解を試みることができる。
凝集押出および移動の現象は,、C.エレガンス,55、6、7、D.6メラノガスター8、9などの遺伝モデルおよび複数の哺乳類モデルにおいて報告された、フィラ全体で保存されているように見える。7 9哺乳類細胞10に対して外発性状の押出が報告されており、保存されたメカニズムが凝集体および小器官の追放の根元にある可能性を示唆する観察である。したがって、エキソファー産生は、神経プロテオスタシスとミトコンドリア品質管理の基本的な、しかし以前は認識されなかった分担を構成する細胞破片管理の保存メカニズムであり、不均衡になると神経変性疾患に積極的に寄与する可能性がある。破片の識別および選別に関与する分子の同定、細胞外皮の異なる細胞外への輸送、押出、顎腺外射体と後期エキソファーを結ぶ筒状の結びつきの形成/sssion、および隣接する細胞による遠隔分解のための大押し出し小胞の認識は、将来の作業のために残っている。線虫モデルおよびフライモデルの研究は、これらのモデルが提供する公平な遺伝的アプローチと強力な細胞生物学的ツールを利用して生理学的文脈に参加する分子を同定するために、集合体およびオルガネラの収集および移動のメカニズムを定義する上で極めて重要である。
エキソファー生物学におけるメカニズムの解読における重要な第一歩は、生体内で再現可能な インビボ exopher定量のためのプロトコルを定義することを含む。 C.エレガンス モデルは、身体が透明であり、蛍光タグ付きタンパク質またはオルガネラを含むと容易に観察することができるので、そのような努力のための特定の利点を提供する。エキソファーは 、C.エレガンス ドーパミン作動性ニューロンPDEおよびCEP、ASEおよびASER感覚ニューロン、および色素充填アンフィドニューロン5によって生成されると報告されている。タッチ受容体ニューロンによって産生されるエキソファーが最も特徴付けられるので、ここで焦点は、エキソファー分析のためのタッチニューロンの使用である。しかし、基本的なアプローチは、任意のセルからのエキソファーの生産を測定するために適用することができます。 C.エレガンス が産生するエキソファーを検出して定量化するプロトコルは、mCherryタンパク質をトランスジェニックに発現する受容体ニューロンを検出し、定量化し、モニタリング可能な貨物とスコアリングにおける時間的制約に重点を置いて概説されている。この記事では 、インビボ エキソファー同定に向けたアプローチと、エキソファー産生を調節する環境および遺伝的条件の定量を定義する。プロトコルは、ベースラインエキソファーの生産の決定と遺伝子型間の比較のための一定の非ストレス条件に対する重要な注意を強調する。
プロトコル
1. エキソファー検出に有用な株
- エガンスのニューロン内で蛍光カルゴを発現する菌株を選択して、エキソファーを容易に可視化します。
注:表1は、タッチ受容体ニューロン,5、11、1211で産生されるエキソファー5を可視化するために使用された株をリストしています。12原則として、細胞または神経細胞の種類は、細胞または組織特異的プロモーターを使用して、押出しのために凝集または選択された蛍光タンパク質の発現を駆動することによって、エキソファー産生について試験することができる。 - あるいは、色素充填アッセイを使用して、アンフィドヘッドニューロンのエキソファーを可視化し、環境に開放され、5,13,13を埋め戻すことを可能にする。
2. 成長メディア
- 標準的な方法14、15,15に従って培養株に標準的な線虫増殖培地(NGM)を準備する。
注:食品の不足、またはフルオロデオキシウリジン(FuDR)は、子孫の生産をブロックするために一般的に使用され、劇的にエソファー産生に影響を与えることができます。継続的に供給された人口を維持し(細菌性食物の枯渇の短期間を避ける)、一定の温度で動物を維持します。
3. 動物の畜産は、一貫したエポファー生産に不可欠
- 一貫した媒体と一貫した細菌の食料源で動物を育てる。動物は、食品の制限が劇的にエキソファーの生産レベルを変えることができるので、短期間であっても細菌性食品を使い果た してはなりません 。
- 研究を通してメディアのレシピと準備の均一性を保ちます。
注: メディアの変更は、エキソファー生産の基礎レベルに影響を与える可能性があります。寒天バッチはベースラインのエコファー レベルに影響を与える可能性があるため、供給ロットが変更された場合は日付をメモします。健康な細菌性食品を確保し、乾燥寒天を防ぐために2週間後にストックプレートを投げ出し、排泄物レベルに影響を与える寒天変性の変化を引き起こす。 - 基礎条件の場合は、動物を一定の温度20°Cに保ちます。 可変温度(温度の一時的な変化)で動物を飼育すると、最大エキソファー産生のタイミングにばらつきが生じる可能性があります。
注: 温度変動は、カルチャ条件に限定されません。実験中または実験室のベンチでの温度変動は、影響を与える可能性があります。例えば、顕微鏡室内の温度は、培養インキュベーターやラボベンチと劇的に異なってはなりません。 - 受精卵は、エキソファーの早期成人生産に不可欠であるため、薬理学的な抗不妊治療の介入を使用しないでください。
注意:フルオロデオキシウリジン(FuDR)16またはC2217の使用は避ける必要があります。17寿命または老齢動物実験を行う場合、一般的な薬理学的抗不妊治療介入を使用するのではなく、細菌で広がる新鮮なプレートに大人を選ぶことによって、成人を小さな子孫から物理的に取り除くことによって、年齢同期集団を維持する必要があります。 - 汚染された培養物を使用しないでください。集団またはプレートの生物学的妥協の場合に実験を再開する。細菌または真菌の汚染は、動物のストレスや代謝の変化を誘発する可能性があり、実験集団から欠けている必要があります。
- 再現性のある結果を最大化するために、環境に起因するエピジェネティックな潜在的な変化を避けるために、実験前に少なくとも2つの健康で十分に供給された汚染のない世代の培養を20°Cで維持する。
4. 漂白、スクロース浮揚、またはL4幼虫摘み取りによるエキソファースコアリングの年齢同期
- エキソファー検出パターンは成人年齢によって変化し、混合年齢の動物の比較が結果を混乱させる可能性がありますので、実験集団を同じ生物学的年齢に保ちます。L4段階で「白い三日月」外陰部形態をチェックすることにより、常に実験動物集団の正常な同期を確保する。
注:一般的に、C.エレガンスメカノ感覚ALMRニューロンのピークエキソファー産生は、成人2-3日目(図3D)に起こり、L4段階後の日から測定される。成人1日目は、L4幼虫期の24時間後に、「白三日月」外陰部形態によって区別される(図5E)。 - グラビッド大人を漂白することによって同期卵集団を準備します。
- NGMプレート上で成長している動物を洗浄することによって卵で満たされたグラビッド大人を収集します。洗浄するには、プレートに1 mLのM9バッファーを入れ、上下にパイプして、浮遊動物で液体を収集し、1.5 mLマイクロ遠心チューブにピペットします。小心分離機で重力沈降または穏やかな遠心分離によるペレット動物と上清を除去します。
- H2Oで1mLの5M NaOHと150μLの6%次亜塩素酸ナトリウム(漂白剤)を加え、約5分間反転して混ぜます。
注:新鮮な漂白液は、動物のキューティクルが卵の収穫のために破壊されることを保証します。キューティクルの破壊の進行は、解剖顕微鏡の下で監視することができます。大人は、漂白を停止する必要がある時点で卵を壊し、解放する必要があります。 - 20 s用ミニ遠心チューブで静かに遠心分離機を使用し、上清を取り除きます。M9バッファーと遠心分離機を1 mL追加し、ペレットの上に約100 μLを残します。
- 手順 4.2.3 を 2 回繰り返して、漂白剤の痕跡を取り除きます。
- 残りの体積の卵を再中断し、新鮮な播種されたNGMプレートに移します。大人はlysedされますが、多くの実行可能な卵は準備中でなければなりません。
- 時間指定の卵レイによって同期された集団を準備します。
- 標準的な転送プロトコル14を使用して播種NGMプレートに20人のグラビッド大人を選んでください。
- 動物が自由にクロールし、1.5時間の卵を産むことを可能にする(低いブロードサイズの突然変異株は、より多くの成虫動物の導入を必要とするかもしれない)。
- 選ぶことで、すべての成虫動物を選んでプレートから取り除き、同期した卵の個体数を残します。数時間後にプレートをチェックして、成人の除去中に生存可能な成人がいないことを確認してください。
- 卵のショ糖浮揚選択によって同期卵集団を準備する。
- グラビッド動物が0.1%の洗剤(Tween 20またはTriton X-100など)でM9溶液でプレートをあふれさせ、15mLチューブに集めることによって、少なくとも24時間卵を産んでいた5つのNGMプレートから動物や卵を収集します。ペレット成人は室温で穏やかな遠心分離(30sの場合は2,000 x g) です。
- 上清を取り除き、新鮮なM9の15mLで動物を3回洗浄し、各洗浄後に上清を捨て、動物や卵に富んだペレットを保つようにしてください。
- 上清の2 mLを保持し、ペレットを再懸濁します。ボリュームスクロースで60%重量の2mLを加えます。
- 2000 x g で 5 分間の遠心分離機。この溶液は、卵に高度に濃縮された上相を表示します。
- 上相約2.5mLを新しい15mLチューブに移し、10mLのM9を加えます。
- 反転して1分間混ぜ、遠心分離機2000 x g で1分間混ぜます。
- 上清を取り除き、M9で卵を豊富に含めたペレットを洗います。卵ペレットの10〜15 μLは、新鮮なOP50シードのNGMプレートに分配することができる。
注:この方法は、卵の多くを準備します。収集された動物がOP50 大腸菌 食品を使い果たすことを許可しないでください。
- 開発のL4段階で動物を選ぶことによって同期された集団を準備する。
- 上記のように播種されたNGMプレート上で動物を成長させます。
注 :C.エレガンスは 4つの離散段階で発達します。20°Cでは、新たに産卵した卵は孵化するのに約9時間かかります(図5A)。ポストハッチは、動物が幼虫ステージ1(L1)を幼虫ステージ4(L4)に通過し、各段階が各溶融物間で8〜12時間持続する(図5A−F)。したがって、卵を接種して調製したプレートは、卵が導入されてから約40時間後に選ぶ多くのL4動物を有すべきである。 - 現像する外陰部の白い半月三日月形状を見つけることによってL4段組みの動物を特定する(図5E)。
注:L4段階の動物は、サイズと体の色素沈着で均一です。上演された動物の検査のための新鮮な成長プレートに白い三日月を持つ動物を選びます。翌日(〜24時間後)は成人1日としてカウントされるべきです。 - 大人の日に毎日動物の集団を得点 2.
注:エキソファーは、通常、基礎条件下でのピークエポファー生産である成人期の2日目に採点されます。しかし、興奮のピークとタイミングは、研究されている環境や遺伝的変化によって変化する可能性があるため、最も包括的な画像を生成するために、毎日4日間にわたって成動物の集団を採点することをお勧めします(図3D)。
- 上記のように播種されたNGMプレート上で動物を成長させます。
5. 蛍光顕微鏡によるエキソファーの検出
- 蛍光顕微鏡に合わせた高倍率擬似ステレオ解剖顕微鏡を用いて、エキソファーを観察します。
- NGMプレートに動物を固定化するには、10-100 mMレバミゾール/四トラミソール溶液をNGM寒天プレート表面にピペット処理します。2〜4分後、動物は麻痺し、寒天プレート上で直接観察することができる。
注:固定化治療は絶対に必要とされず、訓練された眼で、ニューロン同定およびエキソファーの存在は、エキソファーが産生されたかどうかを判断する際にプレート上の顕微鏡下で動物を這うことによって視覚的にスコアリングすることができる。 - 100xの総拡大を用いて蛍光ニューロンを観察し、エキソファーの顕微鏡の解剖を行います。
注:解剖顕微鏡を使用してエキソファーイベントを採点すると、飼育されている寒天プレート上で比較的容易に多数の動物を観察することができます。 - 共焦点顕微鏡を用いたエキソファー研究のためのライブイメージングおよび実装レポーター株
- 共焦点顕微鏡を使用して、細胞内ダイナミクスと細胞形成の特徴を生画像化します。
メモ:ライブイメージングは、エキソファーの生産は動的なプロセスであるため、エキソファーの生産の微妙な詳細を観察するための有利なアプローチです。 - 10-100 mMでのレバミゾールまたはテトラミゾールの利用、またはヒドロゲルポリスチレンマイクロビーズ(直径15μm、30μmまたは40μm)の適用を含む便利な方法を使用して、高解像度のライブイメージングのための動物の動きを制限する18。
- 共焦点顕微鏡を使用して、細胞内ダイナミクスと細胞形成の特徴を生画像化します。
- 化合物および共焦点顕微鏡のスライド調製
- 20~50匹の動物を顕微鏡スライド上の固定化剤に取り付けます。13 mmの直径の隆起リングで塗られた再使用可能な環状の細胞学のスライドは取付けのために有用である。
- 塗装された円の中または寒天パッドの上に10-100 mMレバミゾールや四トラミソールなどの麻痺の5-20 μLに生きている動物を選びます。
- 麻痺が4分間待ってから、カバースリップ(11/2-0.19 mm)またはNo.2(0.17-0.25mm)でスライドを覆います。
- 少数の動物を取り付ける
- マウントされた動物を粉砕しないでください。スライドあたり少数の(20未満の)動物だけを観察すると、カバースリップの圧力が等しくないために動物の一部を粉砕する危険性があります。このリスクは、低パーセントのアガロースパッドを取り付けることで最小限に抑えることができます。
- 2~4%のアガロースパッドスライドを作成し、2~15 μLの麻痺溶液をパッドに加えます。レバミゾールと四トラミゾールがパッドに拡散し、効果的な濃度を低下させることに注意してください。
- 動物を2~15μLの麻痺溶液またはマイクロビーズに取り付け、寒天パッドに置きます。カバースリップを上に置き、動物が無傷であることを確認してください 18.
- 寒天パッド調製
- 2%寒天パッドを調製するために、アガロースが均質で溶融状態になるまでM9溶液とマイクロ波に2%アガロースを加熱します。
- 十分な品質の寒天パッドを達成するために、交互混合とマイクロウェーブは、20秒未満の低電力で。熱いブロックに沸騰寒天を置き、泡が表面に上昇することを可能にすることによって、パッド内の気泡の包含を避ける。
- パスツールピペットを使用して、上昇した気泡の下の溶融溶液内の深いところから寒天を描きます。
- 2つのテーピングスライドを準備し、平らな表面にきれいなガラス顕微鏡スライドの両側に置きます。テーピングされたスライドを作るために、各スライドに5cmのラボテープを2本置きます(図6A)。
- パスツールピペットを使用して、テーピングされたスライドの間に挟まれたきれいな顕微鏡スライドに寒天を1滴置きます(図6B)。
- 慎重かつ迅速に、テーピングされたスライドを横切って配置することによって、4番目のきれいなスライドで溶融寒天の滴をカバーする(図6CC)。
メモ:スライドは、溶融した寒天を厚さ約0.4mm(テープの厚さ)の平らな円に静かに押し込む必要があります(図6D)。寒天はすぐに冷めるはずです。 - 上のスライドをスライドして取り外します (図 6E)。寒天パッドは素早く乾燥し、数分以内に使用するのが最善です。上部スライドを取り外したら、すぐにゲルパッドを使用して動物を取り付けます。気泡付きパッドは使用しないでください。
- 2枚のガラススライドの間に30分まで寒天パッドを保管してください。乾燥した寒天は動物を凝集させ、乾燥させる。麻痺溶液またはマイクロビーズの2〜15 μL以内に動物を取り付け、カバースリップで覆う。麻痺と取り付けから20分以内にスライドをスクリーンにします(図6)。
注意:ストレス状態はエキソファーの速度を変える可能性があるため、エキソファーのスクリーニング時に酸化ストレス(例: アジ化ナトリウム)を誘発する麻痺を避けてください。
- 回転円板共焦点顕微鏡によるエキソファーの検出
- 63xと100xで1.4の開口目標を持つオルガネラやその他の内容などの細胞生物学的特徴を観察する。
- 多次元取得を利用して、ステージ制御と画像取得が可能なソフトウェアを使用します。顕微鏡および画像処理ソフトウェアは、標準的なイメージングアプローチを伴うため、イメージングおよびデータ収集にも適している必要があります。
6. タッチニューロンの識別と、搭載された動物を用いたエキソファーのスコアリング
- 麻痺した成体動物(図6)
- 目的の Z 平面を特定します。低倍率明視野(10-40x)を使用して、動物の適切なZプレーンを特定し、動物の位置、頭尾方向、外陰部の位置(後の神経およびエキソファー識別のランドマーク)に注意してください(図3A& & 図5E)。
- 選択したレポーターの蛍光シグナルに焦点を当てます。同じZ面に滞在し、選択した細胞ゾリックレポーターのために10〜40倍の広視野蛍光観察に切り替えます。
注:この例では、蛍光発現は mec-4 メカノ感覚タッチニューロン特異的プロモーターによって駆動されます。高コピーアレイ、および異なる蛍光性は、発現にばらつきがあり、したがって蛍光強度が変化します。必要に応じて調整します。 - Z軸内をスクロールして、動物の深さと蛍光表現を焦点面で観察します。その際、ヘッド・テールの向きを確認します。頭部/咽頭は蛍光神経環を有し、この場合、尾部は1-2可視PLMソマを含むであろう(図3A)。
- タッチニューロンの識別
- 動物が左側に取り付けられているか、右側に取り付けられているかを特定します(図3A)。
注:動物の3次元性を考慮すると、光学系に最も近い側で最良のイメージング解像度が達成されます。 - 観察することによって相腫(ALM、ALMR、AVM)を識別する - 神経環および横神経プロセスを識別するために頭部から開始する。
- 10~40倍の拡大で、Z軸をゆっくりとスクロールして、接続されているプロセスを識別します。
- プロセスが特定されたら、下方方向に下方に従って外陰部に向かい、そこで相腫が明らかになり、プロセスの最後に丸い細胞体でマークされます。最も焦点が合った神経細胞ソーマが見つかると、他の神経細胞のランドマークを使用して次のように識別できます。
- 近くの腹側ニューロン であるAVM を使用して、動物の向きを割り当てるのに役立ちます。AVMニューロンがALMと同じ平面にある場合、動物はその側に置かれていて、その平面外のニューロンはALMRです。AVMニューロンが問題のALMと同じ平面にない場合、焦点面に最も近いタッチニューロンはALMLです。
- PVMニューロンを識別し、尾部付近に位置する別の腹側タッチニューロンを、前触れニューロンが同一平面内にあるかどうかを示す。もしそうなら、観察されたタッチニューロンはALMLである。
- 関心のある領域(ソーマの両側に位置する蛍光ニューロン)の近く、およびすべてのZプレーンで、最も深いニューロンを明確に焦点に設定することができない場合でも、他の相馬体の位置を感じることができます。
注:焦点が合っていない相馬はエキソファーと間違えられる可能性があるため、すべてのタッチニューロンソマの同定が重要です。
- 動物が左側に取り付けられているか、右側に取り付けられているかを特定します(図3A)。
7. エキソファーの識別とスコアリング
- タッチニューロンが見つかったら、芽のエキソファーとみなされるほど大きな突起(エキソファードメイン)(元の相馬の1/5分の1に達する)を検査する(図1C)。
注:平均エキソファーは直径2〜8μm前後を測定し、動物の平均相腫(ZB4065 bzIs166[Pmec-4::mCherry])は成人2日目に6〜10μmを測定します(図7B)。 - 芽やエキソファードメインが観察されない場合は、ニューロンソーマに、相馬から発せられる付着した薄いフィラメントがないか調べる。アタッチされたエキソファーは、元のソーマに近く、同様のZ面に位置する傾向があります。
注:エキソファーは、常に相馬に取り付けられたままではありません。付属フィラメントの検出は、物体がエキソファーであることを示す決定的な指標です。 - 接続されていないエソファーを識別するには、エソファーの内容を探します。エキソファーは、排出された蛍光タンパク質を濃縮することができ、したがって、しばしば相馬よりも明るいです。
メモ: エキソファーの内容は異種で可変です。リソソームやミトコンドリアなどの細胞小器官も、エソファー内で押し出すことができる(図4C-E)。 - 元の相馬が見つかった平面とは異なる焦点面で、接続されていないエソファーを探します。滲出はALMソーマからどの方向にも突き出ているが、神経細胞過程から後方向に、外発が相腫から遠ざかっているのが典型的である。
- 位置が大きく、ニューロンのソマとして識別されていない球状のオブジェクトがないか確認します。エキソファーは不規則な形状をすることができますが、典型的には球状の構造です。エキソファーは時間の経過とともに劣化するため、古いエキソファーはより不規則な形状を持つ傾向があります。
注:成熟したまたは古いエキソファーは、エキソファーの明るい蛍光強度とその球形を介して分散した「星空の夜」段階と区別されます。 - 以前の興奮の証拠として「星空の夜」表現型を調査してください。エキソファーは、エキソファーが小さな小胞に分裂し、周囲の皮下皮がエキソファーの内容物を劣化させようとすると、「星空の夜」段階に進みます(図1G、2B、3B、7A)。, 2B, 3B & 7A
注:星空の夜のステージは、構造的完全性を失った断片化され、散乱(時にはネットワーク化された)蛍光体によってマークされ、タッチニューロンおよびエキソファー構造と比較して薄暗い蛍光を表示します。 - 「複数のエポファー イベント」のインスタンスを探します。エキソファーは、通常、単一の発生(1個の相腫から発せられる1つのエキソファー)として生成されるが、ある状況下では、1つの相腫から複数のエキソファーを放出することができる(図7D)。
注: 成熟したエキソファーは、皮下で劣化するため、複数の小胞に分解することがあります。各エキソファーが独立したエキソファー生成イベントによって生成されたのか、または1つの元のエキソファー分割で追加の小胞を作成するのかを区別することは、タイムラプス観察によってのみ決定できる。 - すべての形態学的異常がエポファーに成熟するわけではないことを覚えておいてください。
- 外発性相馬をエポファーとして採点しないでください。拡張または尖った相腫は、時折(特に年齢やストレスの下で)観察することができますが、明確な狭窄部位のない延長は、エキソファーとして採点されません。
- エソファーイベント定量化で、相馬の1/5分 の1の大きさを達成しない小さな解決された芽を拒否します。
- エポファーとして、神経突起の伸びをカウントしないでください。成熟した神経突起は、年齢とともに劇的に伸びることができ(通常は神経プロセスの反対方向に)、蛍光タンパク質は、そのような構造の遠位末端に移行することができる19。
注: これらの神経突起の伸びは、数日から数週間にわたって明確な発達パターンを持ち、芽を形成せず、切り離さないため、エポファーではありません(図7E)。
- エソファー ではない 蛍光エンティティを特定します。
注:押し出された蛍光体と自己蛍光の正しい識別を確実にするために、バックグラウンド蛍光のアイデアを得ることが重要です。-
トランスジェニック蛍光発現対自己蛍光。 自己蛍光をトランスジェニック発現と間違えないでください。真のエキソファーシグナルは腸管や腸内になく(DIC確認を使用してこれらの組織を識別することができます)、エキソファーシグナルはバックグラウンド自己蛍光よりも有意に明るくなります。
注意:自己蛍光は腸顆粒腸蛍光色素沈着によって引き起こされ、年齢とともに蓄積する。異なる波長で見た場合は特に異種である。 - 胚からのシグナル。 胚シグナルを起産生と間違えないでください。蛍光から明視野照明に切り替え、子宮内の卵とのシグナルの関連を確認することにより、胚信号の疑いを確認する。
-
飛行機の外や近くの相馬体。 観察の開始時に焦点が合っていないソマでさえ、近くの相馬体をすべて特定して、平面外の相馬をエソファーと間違えないようにします。
注: ALMR からのエキソファーのスコアリングの場合は、AVM と ALMR ソマの場所を特定し、説明します。ソーマの身体識別の詳細は 図3Aに記載されています。
-
トランスジェニック蛍光発現対自己蛍光。 自己蛍光をトランスジェニック発現と間違えないでください。真のエキソファーシグナルは腸管や腸内になく(DIC確認を使用してこれらの組織を識別することができます)、エキソファーシグナルはバックグラウンド自己蛍光よりも有意に明るくなります。
8. スコアリングと統計
- バイナリとしてエコファーをスコア(はい、エキソファー/いいえ、エソファーはありません)。
- エキソファー検出は、特定のニューロンの「エキソファーイベント」と考えてください。エキソファーイベントは、相馬または複数のエポファーの近くで単一のエキソファーの観察を構成することができます。
注: 個々のエキソファー生成イベントの数を定量化するには、タイムラプス観察を使用します。 - 異なるセルが同じ速度でエキソファーを生成しないため、特定の特定セルごとにエポファー イベントをカウントします (例: 図 3Cを参照してください)。ALMRニューロンは、本明細書に記載された株の中で最もベースラインエキソファーを産生し、したがってしばしばこれはタッチ受容体ニューロンからのエキソファー定量のために選択される細胞である。
- 統計については、一般的に、少なくとも3つの生物学的試験を実施し、試験ごとに採点された 少なくとも30 匹の動物のうち、破壊の分析に必要な対応する数の観察を行う。
- コントロールと比較して1つまたは2つの突然変異体/治療を伴う複数の試験の場合、コクラン・マンテル・ハーンゼル検定は p 値を決定するのに適しています。
- 対照と比較して3つ以上の治療変異体を含む試験では、任意の数のカテゴリー予測変数の有意性を評価するために二項ロジスティック回帰分析を使用することも適切です。
結果
複数の蛍光レポーターを使用して、エキソファーを測定することができます。タッチニューロンエキソファーは、押出し用に選択される可能性のあるタンパク質の蛍光タグ付け、押し出し可能なオルガネラの標識、または細胞膜のタグ付けによって、生体内で容易に可視化されます。表1は、エキソファーの監視に使用された蛍光レポーターを発現したタッチニューロンを、図4に示す例で示した。エキソファーに押し出されることが知られているカルゴには、ヒトハンチンチンのN末端ドメインと拡大されたポリグルタミン(Q128)(図4B))、リソソーム関連膜タンパク質でGFPタグが付けられたリソソーム(LMP-1)およびミFigure 4Cトコンドリアが含まれる(図4D)。細胞質GFPは強く追放されず、ソーマ5に優先的に保持されているが、GFPは弱くエキソファーを視覚化することができる(図4A)。GFP が排出されるタンパク質に融合する場合、このタグを使用してエキソファーを視覚化できます。重要な点は、異なるタンパク質をタグ付けすることで、特定の貨物やオルガネラの追放、ならびにエキソファーを構成するタンパク質や膜に関する幅広い質問に対処できることです。
擬似実体顕微鏡のセットアップは、寒天プレート上の動物のエコファーを見るための効果的なツールです。このセットアップは、各倍率に高い数値開口光学、擬似ステレオ技術(立体的基盤上の個別の目的)、および中級から設置された目標の倍率で見るためのズーム操作スイッチを含む、化合物および立体技術のハイブリッドです。このような顕微鏡は、ニューロンの形態を観察するのに十分な強力な10倍の接眼レンズと目標を備え、ハイスループットスコアリングのためのエキソファーの生産(スキャン/ピッキングに使用される2倍の目的、識別とスコアリングに使用される10倍の目的)を備える必要があります。
標準的な実体顕微鏡の倍率は、通常、蛍光タンパク質を発現するタッチニューロンのネットワークを見るのに十分な解像度を持っていますが、標準的な解剖顕微鏡は、相馬と外射体の管状接続のような細胞内の詳細を観察するのに十分ではありません。このような観察には、共焦点顕微鏡が必要です(機器の詳細については 、材料表 を参照)。
励起量定量スタディでは、実験的応力を除去するために厳密な制御が必要です。 再現性のあるエオペファー生産には、一貫した成長条件の注意深い維持が必要です。具体的には、エソファー生産はストレス応答性があり、世代を超えた一貫した給餌、一定温度、および汚染のない成長が再現性にとって重要です。mCherryの高い神経発現を伴う基底成長条件下では、エキソファー産生は比較的低い(ALMの5-25%がエキソファーを産生する)が、浸透および酸化ストレスを含むいくつかのストレスは、エキソファー率を増加させることができる。mCherry発現はストレスと考えることができますが、エキソファーレベルのストレス感受性の結果として、適切に制御されれば、実験的ストレス導入は、より容易に産生を誘導し、観察する戦略となり得るということです。
タイミングと予想されるエキソファーの生産レベル。 手術は幼虫の発達の間事実上不在である。若い成人生活におけるピークエキソファー産生の期間は、成人の日1〜4日に非常に制限されているように見えます, 最も一般的には成人の日2または3で明らかである.ピークは前方または少し戻ることができるので、エキソファーの生産プロファイルの最も完全な評価は、成人の日1〜4日にわたって毎日複数の試験を採点することです。一般に、ALMRは1つの主要なエキソファーを産生し、小胞は少なくとも24時間持続する。エキソファーは、(最速で分単位で)かなり迅速に製造することができます。 最も一般的には、初期の成人期のニューロン当たりに1つの主要なエキソファーのみが産生されるが、複数のエキソファーの産生は可能である。
一般に、基礎条件下でmCherryを発現するALMRによるエキソファー生産は、成人2-3日目の最適な期間内に調べられたALMの5〜25%の範囲である(図3D)。プロテオスタシスは、他のストレスへの暴露と同様に、エキソファーレベルを調節することができる5を危機に発生させる。ストレスまたは遺伝的摂動は、エキソファーの押出を産生するALMRニューロンの90%もの検出率にエキソファー産生を増加させることができる。
外発性の特定の遺伝子の役割をテストするための摂食ベースのRNAi。線虫C.エレガンスは、一般に、目的の遺伝子20を標的とする二本鎖RNA(dsRNA)を発現する大腸菌株HT115を形質転換した動物に供給することによってRNAiノックダウンを行う。HT115細菌は、RNAi5を供給する際にエキソファーのスコアリング時に使用することができます。ほとんどの組織の転写物は、この技術を使用してRNAiによって標的にすることができるが、ニューロンはより難治性である。RNAiに対する感受性は、ニューロン特異的プロモーターの下でトランスジェニックdsRNAトランスポーターSID-1を発現する動物を用いて較正することができる。このようにして神経組織はRNAi21に感作することができる。
目的の遺伝子の組織特異的なノックダウンは、その成分に欠乏している変異体内の内因性RNAi代謝の成分を発現させることによって達成することができる。例えば、アルゴノーテタンパク質RDE-1は、動物がその遺伝子を標的とするRNAi介入にさらされたときにニューロンにのみ関心のある遺伝子のノックダウンを達成するために、rde-1変異動物のニューロンで特異的に発現することができる。
標準的な線虫RNAiプロトコル20、22を使用して、L422段階の両親をRNAiに曝露し、成人するまで変換されたHT115細菌を消費して子孫を開発することを可能にすることは、強い遺伝的ノックダウンを生成するが、実験動物が空のベクターコントロールとは異なる成長をする可能性があるため、RNAiによって誘発される潜在的な発達遅延に注意を払う。負のコントロール比較のためには、常に空のベクトル コントロールを含める必要があります。HT115細菌は、RNAiを供給する際にエキソファーのスコアリング時に使用することができます。しかしながら、RNAi曝露5の短期間であっても、いくつかの遺伝子は、起発性の変化に有効であることに注意してください。特定の遺伝子を標的にすることが発達障害につながる場合は、動物を生涯ノックダウンにさらすことを避け、動物は単にL4段階でRNAiプレートに選ばれ、L4から成人D2またはD3に曝露することができます。
| ひずみ名 | 遺伝子 | 説明 | エポファーの割合 | 参照 |
| SK4005 | zdIs5[Pmec-4GFP] | タッチニューロンにおけるGFPの細胞質発現 | 1-8% ALM | 図4A、メレンティエビッチ2017 |
| ZB4065 | bzIs166 [Pmec-4::mCherry] | タッチニューロンにおけるmCherry(bzIs166)の過剰発現は、細胞質シグナルとmCherry凝集体の両方を生成する。bzIs166はエキソファー誘導体である。mCherryの凝集体は、エキソファー生成の予測因子であり、エキソファーで優先的に押し出される。 | 3-20% ALM (通常の条件).20-80% ALM (断食条件). | 図 4B、 メレンティエビッチ 2017 |
| ZB4067 | bzIs167 [Pmec-4ミトグfp Pmec-4mCherry4];igIs1 [Pmec-7YFP Pmec-3htt57Q128::cfp lin-15+]; | YFP細胞は 、mec-7 タッチニューロンに対して、細胞内にラベルを付けます。共発現Q128::CFPは、エソファーを集約し、誘導する。CFPは優先的に沈黙する。 | ~25% | 図 4C, メレティイェビッチ 2017 |
| ZB4509 | bzIs166[Pメック-4mCherry];bzIs168 [Pmec-7LMP-1::GFP] | bzIs168 LMP-1::GFPは、形質膜およびリソソーム膜にラベルを付けます。bzIs168は、神経膜、エキソファー(膜結合)、およびリソソーム膜構造を同定するために使用することができる。 | 3-20% ALM | 図4D、メレンティエビッチ2017 |
| ZB4528 | bzIs166[Pメック-4mCherry];zhsEx17 [Pmec-4ミトLS::ROGFP] | アレーレzhsEx17は、局所酸化環境に従ってピーク励起波長を405nm(酸化)から476nm(還元)に変えるミトコンドリア局部レポーターです。それはタッチニューロンで発現され、タッチニューロンおよびミトエキサのミトコンドリアを識別するために単独で使用することができる。 | 3-20% ALMプロテオエキソファー.% ALM 水戸-エキソファー定量が進行中です。 | 図4E、メレンティエビッチ2017、キャノン2008、ゴース2013 |
表 1.タッチニューロン、タッチニューロン-エキソファー、およびエキソファー内容物の可視化に使用されてきた株。
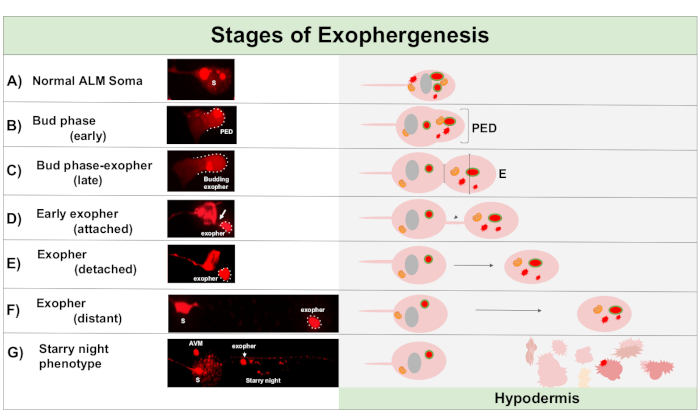
図1:起足の段階エキソファーを作り、排出するプロセスは「エキソファー創世記」と呼ばれています。エキソファー形成の動的プロセスは、数分から数時間かかることがあります。図示は、高エキソファー産生株における動的興奮形成過程における特定のステップにおける相腫およびエキソファー形態の例である、ZB4065 bzIs166[Pmec-4mCherry]。すべての画像は、100xの目的で撮影された2日目の成人ALMニューロンです。(A) 正常な相馬。Pmec-4mCherryをトランスジェニックに発現する成人メカノ感覚タッチニューロンALM。描かれている相腫形態は、この株の若年成人ニューロンの典型的な、細胞質中のmCherry濃度を有する。(B)初期の芽相。発熱の最初の観察可能なステップは、ソーマ膜の端に選択された細胞質材料の分極を含む。このステップは、しばしば、腫の膨張または腫脹を伴う。タッチニューロンの場合、プレエキソファードメイン(PED)は周囲の皮下に広がる(ここでは見えない)。初期の芽領域へのmCherry材料の濃度が高い点に注意してください。(C)遅い芽相。更なる細胞分極化とプレエキソファードメインの拡大に際して、相馬とエキソファー(矢印)の間の狭窄が明らかになる。このイベントは、遅い芽相への移行を通知します。後期芽期では細胞は明確な狭窄部位と分離された相腫およびエポファードメインを示すが、それはまだ相馬から完全につままれていない。出芽のエキソファーは、太い茎(矢印)によって取り付けられることがあります。問題のエキソファードメインの直径が建設現場/茎の直径よりおよそ1/3大きい場合、出芽ドメインは初期のエポファーと見なされます。(D) 初期エキソファー相。初期のエコファーは、出発する相馬からの茎によって取り付けることができます。細胞質物質は、このチューブを介してソーマからエキソファーに移すことができますが、ほとんどの材料は出芽の過程でロードされます。エキソファーは、(E)に描かれて、分離されたエキソファーが成熟したエキソファー(F)と見なされるように、相腫から切り離すことができる。成熟したエソファーは、周囲の皮下組織を通過し、出発する相腫から離れて移動する。(G) mCherry ラベル付きエキソファーが皮下内の小さい小胞に分解すると、皮下内陰性の内皮内に飛散した穿刺が現れる可能性が高い。分散したパンクト信号は「星空の夜」フェーズと呼ばれます。いくつかのエキソファー内容物の分解は、皮下リソソームによって達成される可能性が高いが、いくつかの物質は完全に分解されず、しばしば偽球に皮下皮によって再押し出される。ポストエキソファー生成mCherryトランジットについては、図2に詳細に説明します。この図の大きなバージョンを表示するには、ここをクリックしてください。
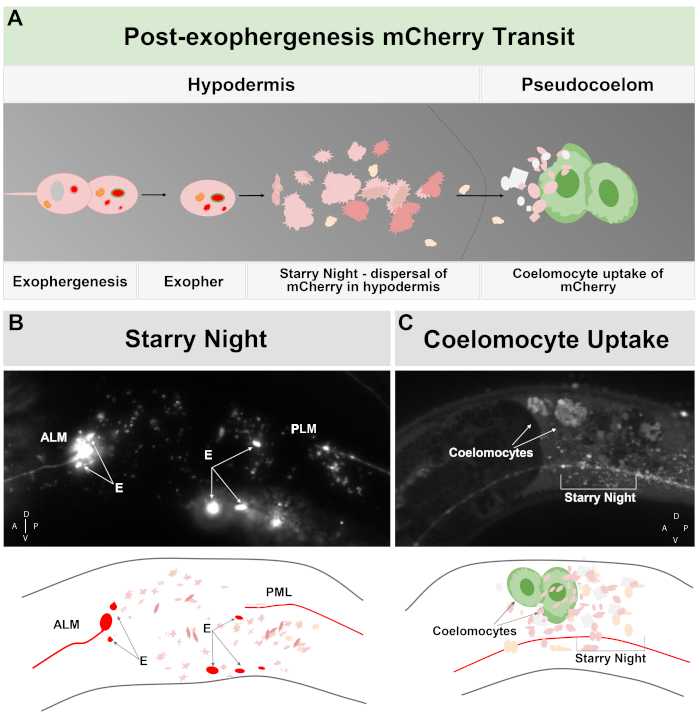
図2:エキソファー内のタッチニューロンから押し出されたmCherryは、周囲の皮下リソソームネットワークに従事するが、後に、コエロモサイトがmCherryを保存/分解できるシュードコロームに押し出すことができる。(a)エキソファーで押し出されたmCherryがニューロンによる追放後に体を通過する方法の漫画の要約。細胞形成中に選択された細胞内容物は、例えば、mCherryが局在化し、ニューロンおよび皮下血漿膜に囲まれた独立した小胞の送出ニューロンソーマから芽を出す。タッチニューロンは皮下組織に埋め込まれているため、エキソファードメインが外側に芽を出すにつれて、皮下にさらに移動する。エキソファーは、皮下を通過することができ、そして数時間後から数日後に、エキソファーの内容物は、皮下の内皮ネットワーク内で断片化することができる。mCherryは「星空の夜」と呼ばれる舞台である皮下全体に散らばったパンクタとして現れることができます。数日後、mCherryの一部は皮下から周囲のシュードコロームに通過し、そこで血球と呼ばれるスカベンジャー細胞が保存できるmCherryにアクセスし、取り上げることができる。(B)星空の夜のmCherry小胞の出現例。大きなエキソファーの破片と星空の夜の小胞を持つmCherryでタグ付けされたALM相馬の画像。ひずみはZB4065 bzIs166[Pmec-4mCherry]です。(C)遠方血球におけるmCherry濃度の例成体動物10日目の株ZB4065 bzIs166のサイドビューはmec-4、コエロサイト(矢印)に濃縮されたmCherryを示す。いくつかの星空の夜の小胞も明らかです。一般的に、コエロモサイト濃度は成人5日目の寿命の後に明らかになる。(Bボトム)漫画の複製 (B) タッチニューロンとプロセスが赤で輪郭を描いた, 明るいエキソファーの断片と同様に;異なるZ深度の散乱小胞は、明るいピンク色で示されています。(Cボトム)(C)の画像の漫画版は、緑色のピンクとコエロサイトで赤、星空の夜に神経細胞のプロセスを示す。この図の大きなバージョンを表示するには、ここをクリックしてください。
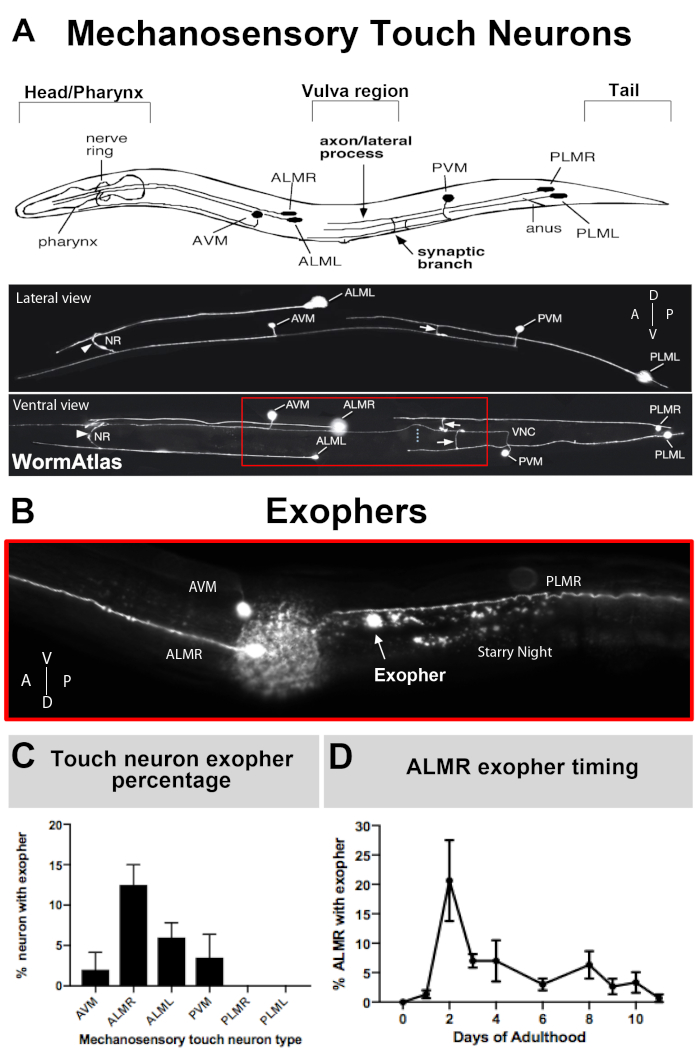
図3:メカノ感覚タッチニューロンは、正確な時間プロファイルを有する異なるレベルでエキソファーを産生する。(A)(上)動物の頭部のポンピング咽頭とニューロン密度の高い神経環、中型体の外陰部、テーパーテールを含む C.エレガンス の主要な解剖学的ランドマークとの空間的関係におけるメカノ感覚タッチニューロンの描写。(下)上面と左側から見たGFPを発現する蛍光標識されたタッチニューロン(WormAtlasから適応した画像)。赤いボックスは、ALM エキソファーが通常配置されている領域を示しています。(B)ALM由来エキソファーが発現する菌株で生成される中体領域の高倍率図[Pmec-4mCherry]。AVMおよびALMRニューロンが描かれて、示されているのはmCherry星空の夜と共にALMRエキソファーである。ALMRニューロンは、最も容易にエキソファーを産生する。(C) ALMRメカノ感覚タッチニューロンは、基底条件下での雌雄同体の他のタッチニューロンと比較して、より容易にエキソファーを産生する。成人2日目にメカノ感覚タッチニューロンのエキソファー産生が、個々のタッチ受容体ニューロンに対してスコア付けされるようにすることが示される。株:ZB4065 bzIs166[Pmec-4mCherry]、N>150、エラーバーはSEMです(D)ALMRタッチニューロンは、思春期のL4ステージまたは高齢の動物と比較して成人期の2日目および3日目に多くのエキソファーを産生する。ひずみ: ZB4065 bzIs166[Pmec-4mCherry]、N>150、エラーバーはSEMです 。
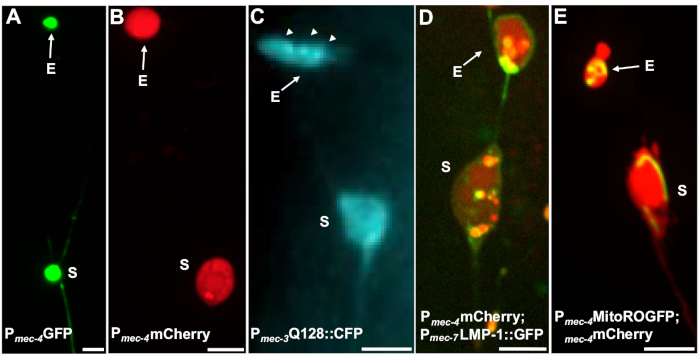
図4:エキソファーの内容物をタグ付けする蛍光レポーターの例エキソファーを観察する簡単な方法は、神経細胞プロモーターから蛍光植物を発現するトランスジェニック動物を作ることだ。蛍光体は、発熱体の可視化を可能にし、トランスジェニック発現は、発熱を増加させる凝集および/またはプロテオーストレスを誘導する。アンフィドニューロンによって産生されるエキソファーは、視覚化のために染料充填を使用して、ネイティブの条件下でも観察することができる。図示は、エキソファー、(E)エキソファー、(S)相腫を観察するために使用することができる一般的な株の例である。(A)SK4005 zdIs5の大人のALMからの相馬とエソファーは、写真撮影にmec-4使用される100xの目的、スケールバー3μm。Aこの株では、可溶GFPを含むエキソファーが測定されるが、エキソファー産生はまれに起こる。他の研究でエキソファーで優先的に押し出すことができるタンパク質にGFPを融合させることは、成熟したエキソファーでGFP融合が検出できることを確認する。(B)MCherryを発現し、タッチニューロンのエキソファー産生を誘導する株ZB4065 bzIs166[Pmec-4mCherry]の成人のALM相腫およびエキソファー。写真撮影、スケールバー5 μmに使用される100xの目的。(C)ALM相腫と株ZB4067 bzIs167の成人の排泄物 [Pmec-4ミトグFP PCmec-4 mCherry4];igIs1[Pmec-7YFP Pmec-3htt57Q128::cfp lin-15+]。htt57Q128::CFP のイメージに使用される選択的な青色チャネル。エキソファーは、相馬よりもエキソファーに集中して表示されるhtt57Q128::CFP凝集体(矢印)を含んでいます。写真、スケールバー5μmに使用される40xの目的。(D-E)エキソファーは、オルガネラおよび蛍光タンパク質によるオルガネラ特異的なタグ付けを含むことができるので、オルガネラ押出のモニタリングが可能です。(D)リソソーム膜タグLMP-1:::GFPは、ソーマとエキソファー膜を概説し、膜の膜を弱くタグ(細胞膜の局在化はリソソームターゲティングに向かう途中の人身売買ステップである)、リソソーム小器官に強くラベルを付ける。示されているのは、Pmec-4mCherryとPmec-7LMP-1:::膜およびリソソームに局地化するGFPを共同発現する成人ALM相馬である。相馬には、他の小さな押出しがエソファー断片(矢印)である可能性が高い付着したエキソファーがある。GFP陽性構造は、ソーマに含まれており、大きなエキソファーに存在している、株:ZB4509 bzIs166[Pmec-4mCherry];bzIs168[Pmec-7LMP-1::GFP]。; bzIs168写真撮影、スケールバー5 μmに使用される100xの目的。E)ミトコンドリアGFPマーカーを使用して、相腫およびエポファーのミトコンドリアを同定することができる。図示は、Pmec-4mCherryおよびmito::ROGFPを発現する成人ALM相腫であり、ミトコンドリアマトリックスに局地化する。ミト::ROGFPは、mCherryなしで単独で発現し、ミトコンドリアを含むエキソファーのニューロンおよびスコアを容易に同定するために使用することができる。株: ZB4528 bzIs166[Pmec-4mCherry];zhsEx17 [Pmec-4ミトLS::ROGFP]。写真に使用される100xの目的。スケールバー5μm。この図の大きなバージョンを表示するには、ここをクリックしてください。
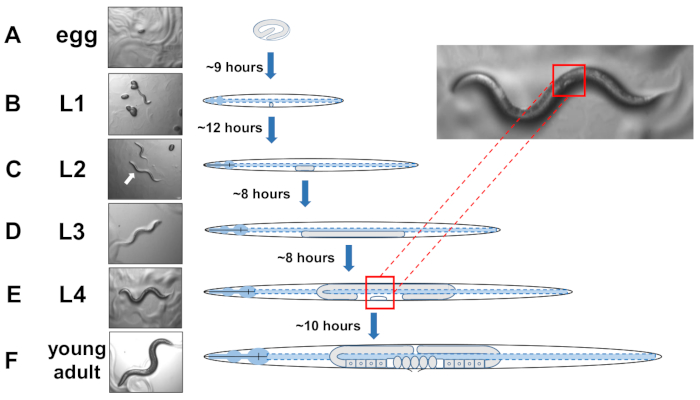
図5:C.エレガンスとL4同定の発生周期。(A)20°Cで卵は、母親によって産まれた後に孵化するのに約9時間かかります。(B) 新たに孵化した動物が幼虫期1(L1)にあり、12時間後にL2幼虫に溶け込む。(C)動物は、それぞれ約8時間、L2および(D)L3幼虫段階に残る。(E)思春期の動物は第4の幼虫期(L4)と考えられ、中身の近くで白い三日月として現れる顕著な発達外陰部によってマークされる。三日月の存在は、後でエキソファーのスコアリングを容易にする同期培養を確立するために、L4ステージング動物の容易な識別とピッキングを可能にする。動物は、卵子、目に見える精子、および産卵の開始によって同定されたグラビッド成人への最終的なモルトの前に約10時間L4段階にとどまります。この図の大きなバージョンを表示するには、ここをクリックしてください。

図6:顕微鏡スライド寒天パッドの調製。 (A) 1本の実験室用テープを一本のスライドで準備します。写真のように間に非テーピング顕微鏡スライドを置きます。 B)滑り台の上に溶けたアガロースを一滴置きます。(C)落としの上に静かに滑らかなスライドを置き、アガロースを膨らませた円パッドに押し込みます。(D) テーピングされたスライドを削除し、偶数パッドを作成するために必要な寒天の平坦化を達成します。(E)アガロースパッドが乾いたら、上のスライドを取り外します。(F)ピペット麻痺溶液(レバミゾールまたは四量化液)寒天パッドの上に。(G)適切にステージングされた動物を麻痺に摘み取る。(H)動物をカバースリップでそっと覆い、動物が生きていることを確認する。 この図の大きなバージョンを表示するには、ここをクリックしてください。
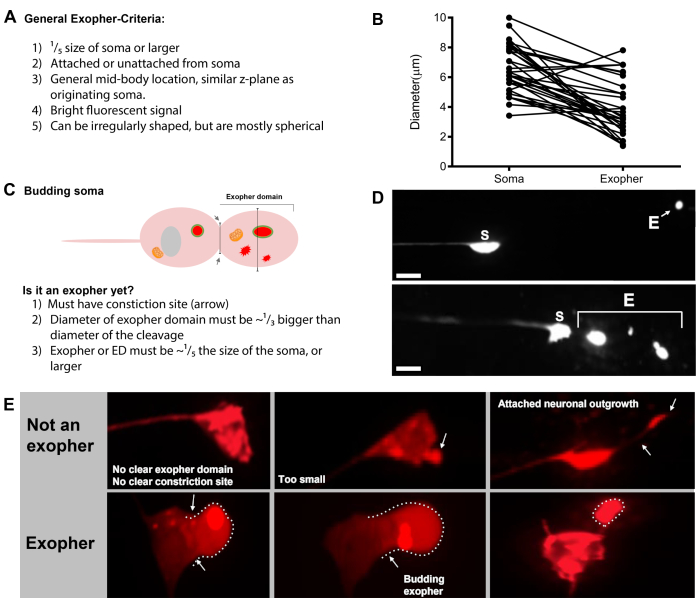
図 7: エキソファーおよびエキソファー識別基準の文字。(A) エキソファーを識別する一般的な基準。(B)送信側のソーマと押し出されたエキソファーの直径比較をμm単位で測定した。成体ALMソマ、N=35、株:ZB4065 bzIs166[Pmec-4mCherry] - 6.53 μmの相馬の平均サイズと3.83 μmのエソファーの平均サイズ。(C) エポファー ドメインと出芽エポファーを区別するための基準を定義する。(D) 最も一般的には、個々のニューロンは、その内容物を低下させようとする皮下が後で分裂または断片する1つの大きなエキソファーを作る。それでも、1つのニューロンから複数のエキソファーイベントから派生する可能性のある1つのタッチニューロンの隣に複数のエキソファーが観察されるか、あるいは別の方法で、エキソファーが芽やフラグメント化を行うこともできます。複数のエキソファー状エンティティの原点は、タイムラプス顕微鏡を使用してのみ決定できます。Top は、単一の遠くのエキソファーを持つ ALMR タッチ ニューロンの相馬を示しています。下は、複数のエキソファーのような押出を有するALMRタッチニューロンソーマを示す。(E) エキソファー事象と間違えられる成人ALMタッチニューロンソマにおける一般的な形態学的特徴。左上- 明確なエソファードメインまたは狭窄部位を持たない膨張したALM相馬。トップミドル- ニューロンは、エキソファーに類似している可能性のある小さな細胞外突起を持つことができますが、エキソファーとみなされるサイズ要件基準を満たしていません。右上– 年齢とともに、タッチニューロンは、彼らのマイナーな神経突起に沿って成長を開発することができます。多くの場合、mCherry材料は、神経突起の成長の先端に収集することができます。収集されたmCherryがエキソファーからソーマへのサイズ要件を満たしていない場合、これはエキソファーとして採点されません。下は、エキソファードメインまたはエキソファーの定義基準を持つ成体ALMニューロンを示しています。ボトム左- 選択的にmCherryサイトソルとmCherryタグ付き凝集体を含む顕著なエキソファードメインを有するALM相馬。エソファードメイン狭窄部位は矢印でマークされ、サイズ基準(少なくともソーマの1/5分の1)を満たしています。エソファー領域の最大直径は狭窄部位の直径よりほぼ1/3大きく、エソファーイベントの基準を満たしています。下中央- ALMソーマは、サイズ基準を満たす顕著な出芽エポファーを有する。明確な狭窄部位があります。右下 -外発サイズ要件を満たすmCherry充填エキソファーが付いているALM相馬。このエキソファーは、薄い接続フィラメントによって取り付けられる。すべての画像は株ZB4065 bzIs166からである[Pmec-4mCherry]。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
大きなエキソファーの形での骨体およびオルガネラ排除の インビボ 分子機構の特徴は、その初期段階にある。追放のための貨物の指定に関する質問、細胞内のこれらの貨物の偏光コレクション、エキソファーを生成する決定の規制、押出を媒介する機械、および隣接する細胞内の劣化機械とのエキソファーの相互作用はすべて取り上げられる。さらに、カルシウム、凝集体、ミトコンドリアを含む生物学的材料を通過できる管状の接続の 生体内 での可視化は興味深く、それ自体が研究された生物学です。なぜ特定の細胞が他の細胞よりも排泄する傾向があるのかという疑問も未解決であるが、このプロトコルで概説されているアプローチで遺伝的に解剖され始めることができる。
このプロトコルで詳細に説明されているのは、エキソファー生産の再現可能なスコアリングを達成するためのアプローチであり、エソファーと近くの細胞ソマを区別すること、排泄物産生のピークを捉える分析のタイミング、および成長条件の厳密な制御を行い、エキソファーレベルを調節できる意図しないストレスを排除する。大きな初期のエキソファーの区別、または周囲の皮下皮における「星空の夜」の分散の両方を、エソファー産生の証拠として定量することができる。そうは言うまでも、基底条件下でmCherryを発現するニューロンは、エキソファーを産生する特定のタイプのニューロンの5〜25%に最も頻繁に関連している。ストレス条件の導入を制御して、押出を生み出すニューロンの90%もの検出にエキソファー産生を増加させることができ、特に調節剤の遺伝的または薬理学的スクリーンに有用である。
ヒト神経変性疾患では、大きな凝集体が病気のニューロンから隣接する細胞に移り、病理の広がりを促進することができる。エキソファー機構は、フィラ全体の凝集押しに使用される保存されたメカニズムを介して起こる可能性があります。このプロセスの効率を高めるin vivo 分子を定義するか(より効果的なプロテオスタシス制御と考えられる)、またはブロックして、複数の神経変性疾患に対抗するための新しい戦略の設計に影響を与える可能性があります。したがって、ここで説明するプロトコルは、古典的な遺伝子変異生成スクリーン、エンハンサーおよびサプレッサーを同定するために遺伝子を体系的にノックダウンするゲノムワイドRNAiスクリーン、またはこのプロセスの候補薬理学的調節因子を同定する薬物介入研究に使用することができる。このアプローチは簡単ですが、やや面倒です。エキソファーは非常に大きく、拡大解剖顕微鏡で見ることができます。それでも 、C.エレガンス ニューロンは比較的小さく、オルガネラまたはその膜を見ると、より高い電力共焦点画像を必要とし、遅いプロセスです。スループットを高めるオプションには、マルチウェルプレート形式の高いコンテンツイメージングアプローチが含まれる可能性があります。
エキソファースコアリングへの標準化されたアプローチの適用は、ニューロンが細胞の破片を組織し、排除することができるプロセスの協調的な遺伝的解剖の根源であるべきである。
開示事項
なし
謝辞
我々は、次のNIH助成金を認める: R01AG047101 および R37AG56510.Driscollとグラントの研究室のメンバーは、厳格な実験と強力なコミュニケーションで、記述されたプロトコルの開発と微調整に広く貢献してきました。
資料
| Name | Company | Catalog Number | Comments |
| 95B Scientific CMOS camera | Photometrics Prime | ||
| 1,000 μL low retention tips | Sarstedt | ||
| 10 mL serological pipette | Appleton Woods | CC214 | |
| 10 μL low retention tips | Sarstedt | 70.1130.105 | |
| 13% sodium hypochlorite | Acros Organics | AC219255000 | |
| 15 mL centrifuge tubes | Fisher Scientific | 05-539-12 | |
| 2 L erlenmeyer flasks | Scientific Laboratory Supplies | FLA4036 | |
| 25 mL serological pipette | Appleton Woods | CC216 | |
| 300 μL low retention tips | Sarstedt | 70.765.105 | |
| 50 mL serological pipette | Appleton Woods | CC117 | |
| 5-Fluoro-2'-deoxyuridine 98% | Alfa Aesar | L16497.ME | |
| 9 cm sterile Petri dishes | Fisher Scientific | 11309283 | |
| absolute ethanol | Vwr | 20821.33 | |
| Agar | Sigma Aldrich | A1296 | |
| C. elegans strain wild type | Supplied by CGC | N2 | C. elegans strain |
| calcium chloride dihydrate | Sigma Aldrich | C3881 | |
| cholesterol | Acros | 110190250 | |
| dibasic sodium phosphate | Sigma Aldrich | S3264 | |
| E. coli strain OP50 | Supplied by CGC | Op50 | E coli strain |
| FBS10 Standard microscope | Meyer Instruments | KSC 410-1-100-1 | FBS10 Standard with Plate Base, 100/100 Trinocular Head and Flip zoom |
| glass pipette 270 mm | Fisherbrand | FB50255 | |
| Heraeus Multifuge X3R | Thermofisher scientific | 75004515 | |
| Inoculating Spreaders | Fisher Scientific | 11821741 | |
| LB medium capsules | MP biomedicals | 3002-031 | |
| LDI – Laser Diode Illuminator | 89 North | ||
| levamisole | Sigma Aldrich | 16595-80-5 | |
| M4 multipette | Eppendorf | 4982000012 | |
| magnesium sulphate | Sigma Aldrich | M7506 | |
| monobasic potassium phosphate | Sigma Aldrich | P0662 | |
| Multitron Standard shaking incubator | Infors HT | INFO28573 | |
| Nalgene 1 L Centrifuge pots | Fisher Scientific | 3120-1000 | |
| P10 pipette | Eppendorf Research Plus | 3123000020 | |
| P1000 pipette | Eppendorf Research Plus | ||
| P200 pipette | Eppendorf Research Plus | 3123000055 | |
| pipeteboy 2 | VWR | 612-0927 | |
| Polystyrene microbeads | Sigma Aldrich | MFCD00131491 | |
| RC5C plus floor mounted centrifuge | Sorvall | 9900884 | |
| Reusable ringed cytology slides | ThermoFisher Scientific | 22037242 | |
| SK4005 zdIs5[Pmec-4GFP] | contract Driscoll lab | GFP expressed in touch neurons | |
| sodium chloride | Sigma Aldrich | 13422 | |
| Sodium hydroxide | Fisher Chemical | S/4880/53 | |
| Tactrol 2 Autoclave | Priorclave | ||
| Triton-X | Thermofisher scientific | 28313 | |
| Tween 20 | Sigma Aldrich | 9005-64-5 | |
| X-Light V2 Spinning Disk Confocal Unit | CrestOptics | ||
| ZB4065 bzIs166[Pmec-4mCherry] | contract Driscoll lab | mCherry expressed in touch neurons | |
| ZB4067 bzIs167[Pmec-4mitogfp Pmec-4mCherry4]; igIs1[Pmec-7YFP Pmec-3htt57Q128::cfp lin-15+] | contract Driscoll lab | Q128 expressed in touch neurons | |
| ZB4509 bzIs166[Pmec-4mCherry]; bzIs168[Pmec-7LMP-1::GFP] | contract Driscoll lab | mitoROGFP expressed in touch neurons | |
| ZB4528 bzIs166[Pmec-4mCherry]; zhsEx17 [Pmec-4mitoLS::ROGFP] | contract Driscoll lab | autophagy marker expressed in touch neurons | |
| ZEISS Axio Vert.A1 | Zeiss |
参考文献
- Davis, A. A., Leyns, C. E. G., Holtzman, D. M. Intercellular Spread of Protein Aggregates in Neurodegenerative Disease. Annual Review of Cell and Developmental Biology. 34, 545-568 (2018).
- Davis, C. H., et al. Transcellular degradation of axonal mitochondria. Proceedings of the National Academy of Sciences of the United States of America. 111 (26), 9633-9638 (2014).
- Torralba, D., Baixauli, F., Sanchez-Madrid, F. Mitochondria Know No Boundaries: Mechanisms and Functions of Intercellular Mitochondrial Transfer. Frontiers in Cell and Developmental Biology. 4, 107 (2016).
- Stahl, P. D., Raposo, G. Extracellular Vesicles: Exosomes and Microvesicles Integrators of Homeostasis. Physiology (Bethesda, Md.). 34 (3), 169-177 (2019).
- Melentijevic, I., et al. C-elegans neurons jettison protein aggregates and mitochondria under neurotoxic stress. Nature. 542 (7641), 367 (2017).
- Nussbaum-Krammer, C. I., Park, K. W., Li, L., Melki, R., Morimoto, R. I. Spreading of a prion domain from cell-to-cell by vesicular transport in Caenorhabditis elegans. PLoS Genetics. 9 (3), 1003351 (2013).
- Tyson, T., et al. Novel animal model defines genetic contributions for neuron-to-neuron transfer of alpha-synuclein. Scientific Reports. 7, (2017).
- Babcock, D. T., Ganetzky, B. Transcellular spreading of huntingtin aggregates in the Drosophila brain. Proceedings of the National Academy of Sciences of the United States of America. 112 (39), 5427-5433 (2015).
- Pearce, M. M. P., Spartz, E. J., Hong, W., Luo, L., Kopito, R. R. Prion-like transmission of neuronal huntingtin aggregates to phagocytic glia in the Drosophila brain. Nature Communications. 6, 6768 (2015).
- Fu, H., Li, J., Du, P., Jin, W., Cui, D. Metabolic wastes are extracellularly disposed by excretosomes, nanotubes and exophers in mouse HT22 cells through an autophagic vesicle clustering mechanism. bioRxiv. 10 (1), (2019).
- Ghose, P., Park, E. C., Tabakin, A., Salazar-Vasquez, N., Rongo, C. Anoxia-reoxygenation regulates mitochondrial dynamics through the hypoxia response pathway, SKN-1/Nrf, and stomatin-like protein STL-1/SLP-2. PLoS Genetics. 9 (12), 1004063 (2013).
- Cannon, M. B., Remington, S. J. Redox-sensitive green fluorescent protein: probes for dynamic intracellular redox responses. A review. Methods in Molecular Biology. 476, 51-65 (2008).
- Perkins, L. A., Hedgecock, E. M., Thomson, J. N., Culotti, J. G. Mutant sensory cilia in the nematode Caenorhabditis elegans. Developmental Biology. 117 (2), 456-487 (1986).
- Stiernagle, T. Maintenance of C. elegans. WormBook: The Online Review of C. Elegans Biology. , 1-11 (2006).
- Sutphin, G. L., Kaeberlein, M. Measuring Caenorhabditis elegans life span on solid media. Journal of Visualized Experiments. (27), (2009).
- Mitchell, D. H., Stiles, J. W., Santelli, J., Sanadi, D. R. Synchronous growth and aging of Caenorhabditis elegans in the presence of fluorodeoxyuridine. Journal of Gerontology. 34 (1), 28-36 (1979).
- Weicksel, S. E., et al. A novel small molecule that disrupts a key event during the oocyte-to-embryo transition in C. elegans. Development. 143 (19), 3540-3548 (2016).
- Dong, L., et al. Reversible and long-term immobilization in a hydrogel-microbead matrix for high-resolution imaging of Caenorhabditis elegans and other small organisms. PloS One. 13 (3), 0193989 (2018).
- Toth, M. L., et al. Neurite sprouting and synapse deterioration in the aging Caenorhabditis elegans nervous system. Journal of Neuroscience. 32 (26), 8778-8790 (2012).
- Conte, D., MacNeil, L. T., Walhout, A. J. M., Mello, C. C. RNA Interference in Caenorhabditis elegans. Current Protocols in Molecular Biology. 109, (2015).
- Calixto, A., Chelur, D., Topalidou, I., Chen, X., Chalfie, M. Enhanced neuronal RNAi in C. elegans using SID-1. Nature Methods. 7 (7), 554-559 (2010).
- Maher, K. N., Catanese, M., Chase, D. L. Large-scale gene knockdown in C. elegans using dsRNA feeding libraries to generate robust loss-of-function phenotypes. Journal of Visualized Experiments. (79), e50693 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved