Method Article
Quantitative Ansätze für scoring in vivo Neuronal Aggregate und Organelle Extrusion in Large Exopher Vesicles in C. elegans
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt Ansätze zur Detektion und Quantifizierung großer Aggregat- und/oder Organellenextrusionen (ca. 4 m), die von C. elegans-Zellen in Form von membrangebundenen Exophern erzeugt werden. Wir beschreiben Stämme, Wachstumsbedingungen, Bewertungskriterien, Timing und Mikroskopieüberlegungen, die erforderlich sind, um die Zerlegung dieses Abfallvertreibungsmechanismus zu erleichtern.
Zusammenfassung
Toxizität von falsch gefalteten Proteinen und mitochondriale Dysfunktion sind entscheidende Faktoren, die altersassoziierten funktionellen neuronalen Rückgang und neurodegenerative Erkrankungen über Arten fördern. Obwohl diese neurotoxischen Herausforderungen seit langem als zellintrinininininininsisch angesehen werden, stützen sich nun beträchtliche Beweise darauf, dass falsch gefaltete Proteine menschlicher Krankheiten, die aus einem Neuron stammen, in benachbarten Zellen auftreten können, ein Phänomen, das vorgeschlagen wird, um die Ausbreitung der Pathologie bei menschlichen neurodegenerativen Erkrankungen zu fördern.
C. elegans adulte Neuronen, die aggregierende Proteine exprimieren, können große (ca. 4 m) membranumgabte Vesikel extrudieren, die das aggregierte Protein, Mitochondrien und Lysosomen umfassen können. Diese großen Vesikel werden "Exopher" genannt und unterscheiden sich von Exosomen (die etwa 100x kleiner sind und unterschiedliche Biogenese haben). Das Auswerfen von zellulären Ablagerungen in Exophern kann durch einen konservierten Mechanismus auftreten, der einen grundlegenden, aber bisher unbekannten Zweig der neuronalen Proteostase und mitochondrialen Qualitätskontrolle darstellt, die für Prozesse relevant sind, durch die sich Aggregate in menschlichen neurodegenerativen Erkrankungen ausbreiten.
Während Exopher meist bei Tieren untersucht wurden, die hochkopierte transgene mCherry in Berührungsneuronen ausdrücken, sind diese Protokolle gleichermaßen nützlich bei der Untersuchung der Exophergenese mit fluoreszierend markierten Organellen oder anderen Proteinen, die in verschiedenen Klassen von Neuronen von Interesse sind.
Hier sind die physikalischen Merkmale von C. elegans exophers beschrieben, Strategien für deren Erkennung, Identifikationskriterien, optimale sifktierende Zeit für quantitation und Tierwachstumsprotokolle, die auf Spannungen steuern, die exopher Produktionsniveaus modulieren können. Zusammen sollten die hier skizzierten Protokolle dazu dienen, einen Standard für die quantitative Analyse von Exophern in Laboratorien festzulegen. Dieses Dokument soll als Ressource für Laboratorien dienen, die molekulare Mechanismen erarbeiten wollen, durch die Exopher hergestellt werden und durch die Exopher von benachbarten und entfernten Zellen reagiert werden.
Einleitung
Die neurotoxischen Herausforderungen von Aggregaten und dysfunktionalen Mitochondrien gelten seit langem als zellintrinininint, aber in jüngerer Zeit ist es klar geworden, dass falsch gefaltete menschliche Krankheitsproteine, die aus einem Neuron stammen, sich auch auf benachbarte Zellen ausbreiten können, wodurch die Pathologie1gefördert wird. Ebenso können Säugetiermitochondrien aus der Zelle ihrer ursprünglichen Produktion für den transzellulären Abbau2 oder zur Rettung von mitochondrialen Populationen in herausgeforderten benachbarten Zellen geschickt werden3. Vesikel unterschiedlicher Größe wurden in der Regel beobachtet, um zelluläre Materialien zu benachbarten Zellen oder in die fluide Umgebung zu übertragen4. Einige extrudierte Vesikel nähern sich der Größe des durchschnittlichen neuronalen Soma (durchschnittliche Berührung Neuronsoma soma 6 m) und können große Aggregate und Organellen aufnehmen.
Ein eindrucksvolles Beispiel für große Vesikelextrusion, die Proteinaggregate und Organellen tragen kann, tritt in C. elegans Touch-Rezeptor-Neuronen auf, die eine hohe Kopierzahl ausdrücken, die ein schädliches Aggregations-anfälliges, abbauresistentes mCherry5kodiert. Extrusionen aus den Touch-Neuronen, sogenannte Exopher, haben einen durchschnittlichen Durchmesser von 4 m, umfassen selektiv mCherry oder andere Aggregate und werden direkt in die benachbarte Hypodermis abgegeben, die normalerweise die Touch-Rezeptor-Neuronen umgibt. Die Hypodermis versucht eine Lysosome-basierte Degradation, aber einige nicht verdauliche Inhalte wie mCherry-Aggregate können durch die Hypodermis in das flüssigkeitsgefüllte Pseudocoelom des Tieres retrudiert werden, von dem aus der mCherry von entfernten Schnitzelzellen, den sogenannten Coelomozyten, zur Langzeitlagerung aufgenommen werden kann (Abbildung 1, Abbildung 2)5.
Die großen extrudierten Exopher-Vesikel verlassen die Zelle umgeben von Touch-Rezeptor-Plasmamembran und können aggregierte Proteine menschlicher Krankheiten, Mitochondrien und Lysosomen enthalten. Der Prozess der Exopher-Produktion scheint die Sortierung potenziell toxischer Arten zu beinhalten (z. B. wird ein aggregationsanfällig exprimierter mCherry von löslichen, inoffensiven Proteinen wie GFP getrennt, die hauptsächlich im neuronalen Soma verbleiben). Auf diese Weise wird die gezielte Vertreibung der bedrohlichen Wesen durch das Neuron5erreicht. Eine Proteostase-Herausforderung, wie Stress, der durch Autophagie-Knockdown, MG132-vermittelte Proteasome-Hemmung oder transgene Expression von proteiniumgenauen menschlichen Krankheiten wie dem Huntington-assoziierten erweiterten Polyglutamin Q128 oder dem Alzheimer-Krankheitsfragment A-1-42induziert wird, kann die Anzahl der Neuronen erhöhen, die Exophers produzieren5.
Da exophers erst vor kurzem dokumentiert wurden, verdient das, was über ihre Biologie bekannt ist, eine Beschreibung. Exopher wurden in entdeckt, und sind die am besten untersucht, C. elegans Touch-Rezeptor-Neuronen. Es gibt sechs C. elegans mechanosensorische Berührungneuronen, die Zellkörper um den Körper verteilt haben (Abbildung 3A) und werden Mikrotubuli-Zellen genannt, weil ihre Ultrastruktur unverwechselbare 15 Protofilament-Mikrotubuli aufweist. Die Touch-Rezeptor-Neuronen sind die vorderen AVM (anterior ventralmicrotubule neuron), ALMR, und ALML (vordere laterale Mikrotubuli-Neuronen rechts und links), die zentralere PVM (posterior ventral microtubule neuron), und die hinteren PLMR und PLML (posterior lateral microtubule neurons rechts und links) im Schwanz. Interessanterweise produzieren die sechs Touch-Rezeptor-Neuronen Exopher mit unterschiedlichen Raten, obwohl sie das gleiche offensive Transgen ausdrücken (Abbildung 3C). Von den sechs mechanosensorischen Touch-Rezeptor-Neuronen erfährt das ALMR-Neuron häufiger eine Exophergenese als die anderen Touch-Neuronen. Die Quantifizierung von Exopher-Zahlen aus Berührungsneuronen wird daher in der Regel durch Fokussierung auf die ALMR festgestellt.
Exophergenese ist ein dynamischer Prozess, der typischerweise mit der Schwellung des neuronalen Zytoplasmas beginnt (Abbildung 1A-B). Zelluläre Inhalte, Organellen oder Proteinaggregate werden auf einer Seite des neuronalen Soma gesammelt, am häufigsten in Richtung des hinteren Endes des ALMR-Neurons (weg vom projizierten Neurit), und bilden eine vorexopher Domain (PED) (Abbildung 1B). Der frühe Vorsprung wird beobachtet, wenn die PED beginnt, nach außen zu projizieren und eine erkennbar hervorstehende Knospe zu bilden. Die späte Knospe wird definiert, wenn der breiteste Durchmesser der vorexopher Domäne etwa 1/3 größer ist als der Durchmesser der Verengung des soma-exopher Halses (Abbildung 1C). Exopher können in fast jeder Richtung aus dem Soma ausgeworfen werden, aber die meisten Exopher verlassen nach hinten aus dem Zellkörper und bleiben in ungefähr der gleichen Fokalebene wie das Ursprungssoma.
Der Exopher kann sich vom Ursprungssoma entfernen, da sich der Hals der Knospe zu einem dünnen Filament verengt. Exopher können über dieses Filament (Abbildung 1D, Pfeil) am Soma befestigt bleiben und sich später lösen. Zellinhalte wie Kalzium, Aggregate und Mitochondrien können über dieses Filament in den beigefügten Exopher5übertragen werden, obwohl der Großteil des extrudierten Materials durch das massive aufkeimende Ereignis in das Exopherfach gelegt wird. Exopher gelten als ausgereift, wenn es kein sichtbares Verbindungsrohr oder dünnes Filament gibt und der Exopher vollständig vom sendenden Soma getrennt ist (Abbildung 1E).
Exopher, die von C. elegans produziert werden, berühren Neuronen sofort auf die Hypodermis, das Gewebe, das das Berührungsneuron umgibt. Am häufigsten scheint das Exopher-Vesikel innerhalb der Hypodermis nach hinten zum Schwanz zu reisen, und kann ziemlich weit vom Soma entfernt sein, bevor Exopher-Inhalte gezielt auf Abbau ausgerichtet erscheinen (z. B. kann der Abstand 100 m vom Soma entfernt sein (Abbildung 1F)). Das fluoreszierende Exopher-Vesikel zerfällt in viele kleinere Vesikel innerhalb der Hypodermis und nimmt ein Aussehen an, das als "Sternennacht" bezeichnet wird (Abbildung 1G und Abbildung 2). In der "Sternennacht"-Phase kann punktiertes fluoreszierendes Material beobachtet werden, das über das hypodermale Syncytium in viele kleinere Fluoreszenzpunkte im Vergleich zum ursprünglichen Einzelexopher verstreut ist. Sternennacht kann unter geringer Vergrößerung und mit höherer Vergrößerung punktuell aussehen, kann punktgenau aussehen und/oder innerhalb der Hypodermis vernetzt sein. Das fluoreszierende Signal der Sternennacht ist in der Regel dimmer als der Exopher und die neuronal exprimierte Fluoreszenz (Abbildung 2B-C). Die Zerstreuung von mCherry in viele punktierte Vesikel wird gedacht, um Phagomreifung und Fusion mit dem endosomalen/lysosomalen Netzwerk der hypodermalen Zelle beinhalten. Einige Exopher-Materialien werden wahrscheinlich im hypodermalen lysosomalen Netzwerk abgebaut, aber Restarten, die resistent gegen Abbau sind (wie mCherry-Aggregate), werden aus der Hypodermis in das Pseudocoelom geworfen, ein Flüssigkeitsfach, das zellulären Schmutz enthalten kann. Das fluoreszierende Material wird später von entfernten Schnitzelzellen, den sogenannten Coelomozyten (Abbildung 2C), aufgenommen, die sich konzentrieren, speichern und erneut versuchen können, mCherry zu abbauen.
Das Phänomen der Aggregatextrusion und -übertragung scheint über Phyla hinweg konserviert zu sein, nachdem es in genetischen Modellen wie C. elegans5,6,7 und D. melanogaster8,9 sowie in mehreren Säugetiermodellen berichtet wurde. Exopherartige Extrusionen wurden für Säugetierzellen10berichtet, eine Beobachtung, die darauf hindeutet, dass konservierte Mechanismen der Aggregat- und Organellenausscheidung zugrunde liegen könnten. Die Exopher-Produktion kann somit ein konservierter Mechanismus des zellulären Abfallmanagements sein, der einen grundlegenden, aber bisher unbekannten Zweig der neuronalen Proteostase und mitochondrialen Qualitätskontrolle darstellt, die, wenn sie unausgewogen sind, aktiv zu neurodegenerativen Erkrankungen beitragen könnten. Identifizierung der Moleküle, die an der Diskriminierung und Sortierung von Abfällen beteiligt sind, Transport zu einem bestimmten subzellulären Gebietsschema, Extrusion, Bildung/Sission der röhrenförmigen Verbindung, die das Soma mit dem späten Exopher verbindet, und Erkennung des großen extrudierten Vesikels für den fernen Abbau durch eine benachbarte Zelle bleiben für zukünftige Arbeiten erhalten. Studien an Nematoden- und Fliegenmodellen werden von entscheidender Bedeutung für die Definition von Mechanismen der Sammlung und Übertragung von Organellen sein, wobei unvoreingenommene genetische Ansätze und leistungsstarke zellbiologische Werkzeuge verwendet werden, die von diesen Modellen angeboten werden, um teilnehmende Moleküle im physiologischen Kontext zu identifizieren.
Zu den kritischen ersten Schritten bei der Entschlüsselung von Mechanismen, die in der Exopher-Biologie wirksam sind, gehört die Definition von Protokollen für reproduzierbare in vivo exopher Quantifizierung. Das C. elegans Modell bietet einen besonderen Vorteil für solche Bemühungen, da der Körper transparent ist und Exopher leicht beobachtet werden können, wenn sie fluoreszierend markierte Proteine oder Organellen enthalten. Exophers wurden berichtet, dass von C. elegans dopaminergen Neuronen PDE und CEP, ASE und ASER sensorische Neuronen, und Farbstoff füllenden Amphid Neuronen generiert werden5. Da Exopher, die von Touch-Rezeptor-Neuronen produziert werden, am besten charakterisiert sind, liegt der Fokus hier auf der Verwendung von Touch-Neuronen für die Exopher-Analyse. Der grundlegende Ansatz kann jedoch angewendet werden, um die Exopherproduktion aus jeder Zelle zu messen. Protokolle zum Nachweis und quantitieren von C. elegans Touch-Rezeptor-Neuronen, die transgenerweise mCherry-Protein ausdrücken, werden skizziert, mit einem Schwerpunkt auf Ladungen, die überwacht werden können, und zeitlichen Einschränkungen bei der Bewertung. Dieser Artikel definiert Ansätze zur in vivo exopher Identifizierung und die Quantifizierung von Umwelt- und genetischen Bedingungen, die die Exopher-Produktion modulieren. Protokolle betonen die kritische Aufmerksamkeit für konstante Nicht-Stress-Bedingungen für die Bestimmung der Ausgangsproduktion und für Vergleiche zwischen Genotypen.
Protokoll
1. Stämme nützlich für exopher Erkennung
- Wählen Sie eine Sorte, die fluoreszierende Ladungen innerhalb der Neuronen von C. elegans ausdrückt, um Exopher sevisitor leicht zu visualisieren.
HINWEIS: Tabelle 1 listet Stämme auf, die verwendet wurden, um Exopher zu visualisieren, die in Denkrezeptorneuronen5,11,12produziert wurden. Grundsätzlich kann jede Zelle oder jeder neuronale Typ auf die Exopher-Produktion getestet werden, indem ein zell- oder gewebespezifischer Promotor verwendet wird, um die Expression eines fluoreszierenden Proteins anzutreiben, das sich aggregiert oder anderweitig für die Extrusion ausgewählt ist. - Alternativ können Sie einen Farbstoff-Füll-Assay verwenden, um Exopher in den amphiden Kopfneuronen zu visualisieren, die für die Umwelt offen sind und für die Verfüllung5,13zugänglich sind.
2. Wachstumsmedien
- Bereiten Sie Standardnematoden-Wachstumsmedien (NGM) auf Kulturstämme nach den Standardmethoden14,15vor.
HINWEIS: Mangel an Lebensmitteln, oder Fluor-Deoxyuridin (FuDR), häufig verwendet, um die Produktion von Nachkommen zu blockieren, und kann dramatisch beeinflussen exopher Produktion. Halten Sie die Population kontinuierlich gefüttert (vermeiden Sie auch kurze Perioden der bakteriellen Nahrungserschöpfung) und halten Sie Tiere auf einer konstanten Temperatur.
3. Tierhaltung entscheidend für konsequente Exopher-Produktion
- Heben Sie Tiere auf konsistenten Medien und mit konsistenten bakteriellen Nahrungsquellen. Den Tieren darf die bakterielle Nahrung nicht ausgehen, auch nicht für kurze Zeit, da die Begrenzung der Nahrung die Produktionsniveaus drastisch verändern kann.
- Halten Sie Medienrezepte und Zubereitungen während einer Studie einheitlich.
HINWEIS: Wechselnde Medien können sich auf die Basalproduktionsniveaus auswirken. Agar-Chargen können die Basisexopher-Ebenen beeinflussen, wenn sich die Lieferlose ändern, notieren Sie sich also das Datum. Werfen Sie Lagerplatten nach zwei Wochen, um eine gesunde bakterielle Nahrung zu gewährleisten und getrocknete Agar zu verhindern, die Veränderungen in der Agar-Osmolarität verursacht, die exopher Ebenen beeinflussen. - Halten Sie die Tiere bei einer konstanten Temperatur von 20 °C. Die Aufzucht von Tieren bei variablen Temperaturen (auch vorübergehende Temperaturänderungen) kann zu Schwankungen im Timing der maximalen Produktion führen.
HINWEIS: Die Temperaturvariabilität ist nicht auf Kulturbedingungen beschränkt. Temperaturschwankungen während der Experimente oder auf der Laborbank können wirkungsvoll sein. Beispielsweise sollten sich die Temperaturen innerhalb eines Mikroskopraums nicht dramatisch von der Kulturinkubator- oder Laborbank unterscheiden. - Verwenden Sie keine pharmakologischen Anti-Fruchtbarkeits-Interventionen, da befruchtete Eier für die frühe Erwachsenenproduktion von Exophern entscheidend sind.
HINWEIS: Die Anwendung von Fluor-Deoxyuridin (FuDR)16 oder C2217muss vermieden werden. Bei der Durchführung von Tierversuchen im Lebensalter oder im alter alter Alter sollten alterssynchrone Populationen aufrechterhalten werden, indem Erwachsene physisch aus ihrer kleineren Nachkommenschaft entfernt werden, indem sie auf frische Platten gepflückt werden, die mit Bakterien verteilt sind, anstatt häufige pharmakologische Anti-Fruchtbarkeits-Interventionen zu verwenden. - Verwenden Sie keine kontaminierten Kulturen; Wiederbeginn von Experimenten im Falle eines biologischen Kompromisses der Population oder der Platte. Bakterielle oder Pilzkontamination kann Belastungen und metabolische Veränderungen bei Tieren auslösen und muss in experimentellen Populationen fehlen.
- Um reproduzierbare Ergebnisse zu maximieren, pflegen Sie Kulturen für mindestens zwei gesunde, gut ernährte, kontaminationsfreie Generationen bei 20 °C vor dem Experimentieren, um potenzielle umweltbedingte epigenetische Veränderungen zu vermeiden.
4. Alterssynchronisation für Exopher-Scoring durch Bleichen, Saccharose-Flotation oder L4-Larven-Picking
- Halten Sie experimentelle Populationen im gleichen biologischen Alter, da exopher Nachweismuster mit dem Erwachsenenalter variieren und der Vergleich von Tieren gemischten Alters die Ergebnisse verwirren kann. Sorgen Sie immer für eine erfolgreiche Synchronisation von experimentellen Tierpopulationen, indem Sie die "weiße Halbmond"-Vulva-Morphologie im L4-Stadium überprüfen.
ANMERKUNG: Im Allgemeinen tritt die Spitzenexopherproduktion für C. elegans mechanosensorische ALMR-Neuronen am Erwachsenentag 2-3 (Abbildung 3D)auf, gemessen an Tagen nach der L4-Stufe. Erwachsener Tag 1 ist 24 Stunden nach dem L4 Larvenstadium, das durch "weiße Halbmond" Vulva Morphologie unterschieden wird (Abbildung 5E). - Bereiten Sie synchronisierte Eipopulationen durch Bleichen gravid Erwachsene.
- Sammeln Sie mit Eiern gefüllte Erwachsene, indem Sie Tiere waschen, die auf einem NGM-Teller wachsen. Zum Waschen die Platte mit 1 ml M9-Puffer überfluten, nach oben und unten pfeifen, um Flüssigkeit mit hängenden Tieren und Pipetten in ein 1,5 ml Mikrozentrifugenrohr zu sammeln. Pellettiere durch Gravitationsversiedlung oder sanfte Zentrifugation mit einer Minizentrifuge und entfernen Sie den Überstand.
- Fügen Sie 150 l 5M NaOH und 150 l 6% Natriumhypochlorit (Bleichmittel) in 1 ml inH2O hinzu und mischen Sie durch Inversion ca. 5 Minuten.
HINWEIS: Frische Bleichlösung sorgt dafür, dass die tierische Nagelhaut bei der Eiernte gestört werden kann. Fortschritte bei der Unterbrechung der Nagelhaut können unter einem Sezierendes Mikroskop überwacht werden; Erwachsene sollten die Eier brechen und an der Stelle abgeben, an der das Bleichen gestoppt werden sollte. - Zentrifugieren Sie vorsichtig mit einem Minizentrifugenrohr für 20 s und entfernen Sie den Überstand. Fügen Sie 1 ml M9-Puffer und Zentrifuge wieder hinzu, so dass etwa 100 l auf dem Pellet bleiben.
- Wiederholen Sie die Schritte 4.2.3 zweimal, um Spuren von Bleichlösung zu entfernen.
- Die Eier im verbleibenden Volumen wieder aussetzen und auf eine frisch gesäte NGM-Platte übertragen. Erwachsene werden lysiert, aber viele lebensfähige Eier sollten in der Vorbereitung sein.
- Bereiten Sie synchronisierte Populationen nach zeitgegzeiträumem Ei-Lay vor.
- Wählen Sie 20 gravid Erwachsene auf eine gesäte NGM-Platte mit Standard-Transferprotokolle14.
- Lassen Sie Tiere frei kriechen und Legen Voneier für 1,5 h (mutierte Stämme mit niedrigen Brutgrößen können die Einführung von mehr erwachsenen Tieren erfordern).
- Entfernen Sie alle erwachsenen Tiere vom Teller, indem Sie pflücken und die synchronisierte Eierpopulation zurücklassen. Überprüfen Sie die Platten ein paar Stunden später, um sicherzustellen, dass keine lebensfähigen Erwachsenen während der Entfernung von Erwachsenen vermisst wurden.
- Bereiten Sie synchronisierte Eipopulationen durch Saccharose-Flotation Auswahl von Eiern.
- Sammeln Sie Tiere und Eier von fünf NGM-Platten, auf denen Gravid-Tiere seit mindestens 24 Stunden Eier legen, indem Sie Platten mit M9-Lösung mit 0,1% Reinigungsmittel (wie Tween 20 oder Triton X-100) überfluten und in einem 15 ml-Rohr sammeln. Pellet Erwachsene durch sanfte Zentrifugation bei Raumtemperatur (2.000 x g für 30 s).
- Überstand entfernen und Tiere dreimal in 15 ml frischem M9 waschen, den Überstand nach jeder Wäsche entsorgen, wobei sichergestellt ist, dass das Pellet in Tieren und Eiern angereichert bleibt.
- Halten Sie 2 ml Überstand und setzen Sie das Pellet wieder auf. Fügen Sie 2 ml von 60% Volumen-Saccharose hinzu.
- Zentrifuge bei 2000 x g für 5 min. Die Lösung zeigt nun eine obere Phase, die in Eiern hoch angereichert ist.
- Ca. 2,5 ml der oberen Phase auf ein neues 15 ml Rohr übertragen und 10 ml M9 hinzufügen.
- Durch Inversion für 1 min mischen und dann Zentrifuge 2000 x g für 1 min.
- Entfernen Sie den Überstand und waschen Sie das eiangereicherte Pellet in M9. 10-15 l des Eipellets können auf eine frische OP50-Saat-NGM-Platte verteilt werden.
ANMERKUNG: Diese Methode bereitet eine große Anzahl von Eiern; nicht zulassen, dass gesammelten Tieren die OP50 E. coli-Nahrung ausgeht.
- Bereiten Sie synchronisierte Populationen vor, indem Sie Tiere im L4-Entwicklungsstadium pflücken.
- Wachsen Sie Tiere auf gesäten NGM-Platten, wie oben beschrieben.
HINWEIS: C. elegans entwickeln sich in vier diskreten Stadien. Bei 20 °C benötigt ein neu gelegtes Ei etwa 9 Stunden zum Schlüpfen (Abbildung 5A). Nach der Luke durchläuft ein Tier das Larvenstadium 1 (L1) bis zur Larvenstufe 4 (L4), wobei jede Stufe zwischen jedem Molt 8-12 Stunden dauert (Abbildung 5A-F). Daher sollte ein Teller, der durch Impfen mit Eiern zubereitet wird, viele L4-Tiere etwa 40 Stunden nach der Einführung der Eier pflücken müssen. - Identifizieren Sie L4-inszenierte Tiere, indem Sie die weiße Halbmond-Halbmondform der sich entwickelnden Vulva lokalisieren (Abbildung 5E).
HINWEIS: Tiere im L4-Stadium sind einheitlich in größe und in Körperpigmentierung. Wählen Sie Tiere mit dem weißen Halbmond auf eine frische Wachstumsplatte für die Untersuchung von inszenierten Tieren. Der folgende Tag (ca. 24 Stunden später) sollte als Erwachsener Tag 1 gezählt werden. - Bewerten Sie eine Population von Tieren täglich am 2. Erwachsenentag.
HINWEIS: Exopher werden in der Regel an Tag 2 des Erwachsenenalters bewertet, das ist die höchste Exopher-Produktion unter basalen Bedingungen. Da jedoch der Höhepunkt der Exophergenese und der Zeitpunkt durch Umwelt- oder genetische Veränderungen verschoben werden können, die untersucht werden, wird empfohlen, eine Population erwachsener Tiere täglich über vier Tage zu bewerten, um das umfassendste Bild zu erzeugen (Abbildung 3D).
- Wachsen Sie Tiere auf gesäten NGM-Platten, wie oben beschrieben.
5. Detektion von Exophern mit einem Fluoreszenzmikroskop
- Beobachten Sie Exopher mit einem pseudo-stereo-Sezierenmikroskop mit hoher Vergrößerung, das für die Fluoreszenzmikroskopie ausgestattet ist.
- Immobilisieren Sie Tiere auf NGM-Platten, indem Sie 100-200 l 10-100 mM Levamisol/Tetramisole-Lösung auf die NGM-Agarplattenoberfläche pfeifen. Nach 2-4 Minuten werden die Tiere gelähmt und können direkt auf der Agarplatte beobachtet werden.
HINWEIS: Immobilisierungsbehandlungen sind nicht unbedingt erforderlich, so dass bei einem geschulten Auge neuronale Identifikation und Exopherpräsenz durch visuelles Nachführen von kriechenden Tieren unter dem Mikroskop auf dem Teller bewertet werden kann, wenn festgestellt wird, ob ein Exopher hergestellt wurde oder nicht. - Beobachten Sie fluoreszierende Neuronen mit einer Gesamtvergrößerung von 100x, um die Zersezieren von Exophern zu sezieren.
HINWEIS: Das Scoring von Exopher-Ereignissen mittels Seziermikroskopie ermöglicht die Beobachtung einer großen Anzahl von Tieren mit relativer Leichtigkeit direkt auf den Agarplatten, auf denen sie aufgezogen werden. - Live-Bildgebung und Montage von Reporterstämmen für Exopher-Studien mit konfokaler Mikroskopie
- Verwenden Sie ein konfokales Mikroskop, um intrazelluläre Dynamik und Eigenschaften der Exophergenese zu leben.
HINWEIS: Live-Bildgebung ist ein vorteilhafter Ansatz, um subtile Details der Exopher-Produktion zu beobachten, da die Exopher-Produktion ein dynamischer Prozess ist. - Beschränken Sie die Bewegung von Tieren für hochauflösende Live-Bildgebung mit praktischen Methoden, einschließlich der Verwendung von Levamisol oder Tetramiso bei 10-100 mM oder die Anwendung von Hydrogel-Polystyrol-Mikroperlen (mit Durchmessern von 15 m, 30 m oder 40 m)18.
- Verwenden Sie ein konfokales Mikroskop, um intrazelluläre Dynamik und Eigenschaften der Exophergenese zu leben.
- Gleitvorbereitung für die Compound- und Konfokalmikroskopie
- Montieren Sie 20-50 Tiere in ein Immobilisierungsmittel auf einem Mikroskopschlitten. Wiederverwendbare ringförmige Zytologie-Dias mit erhobenen Ringen mit 13 mm Durchmesser eignen sich zur Montage.
- Wählen Sie lebende Tiere in 5-20 L eines Gelähmten wie 10-100 mM Levamisol oder Tetramiso im bemalten Kreis oder auf dem Agarpad.
- Warten Sie 4 Minuten auf Lähmung, und decken Sie dann die Rutsche mit einem Deckel (empfohlen Nr. 11/2 (0,16 – 0,19 mm) oder Nr. 2 (0,17 - 0,25 mm).
- Montage einer kleinen Anzahl von Tieren
- Montierte Tiere nicht zerquetschen; bei der Beobachtung nur einiger (weniger als 20) Tiere pro Rutsche besteht die Gefahr, dass einige tiere durch einen ungleichen Druck des Deckelrutsches zerquetscht werden. Dieses Risiko kann durch die Verwendung eines niedrigen Prozentsatzes Agarose Pad für die Montage minimiert werden.
- Machen Sie eine 2-4% Agarose Pad-Folie, und fügen Sie dann 2-15 L der paralytischen Lösung auf das Pad. Denken Sie daran, Levamisol und Tetramisole diffundieren in das Pad, verringerung ihre effektive Konzentration.
- Montieren Sie, indem Sie Tiere in einen 2-15 L Tropfen der paralytischen Lösung oder Mikroperlen, die auf dem Agarpad ruhen. Legen Sie den Deckelzettel oben und überprüfen Sie, ob die Tiere intakt sind18.
- Agar Pad Vorbereitung
- Um 2% Agar-Pads zuzubereiten, 2% Agarose in M9-Lösung und Mikrowelle erhitzen, bis sich die Agarose in einem homogenen und geschmolzenen Zustand befindet.
- Um ein Agar-Pad von ausreichender Qualität zu erreichen, abwechselnd Mischen und Microwaving bei geringer Leistung für weniger als 20 Sekunden. Vermeiden Sie die Aufnahme von Luftblasen in das Pad, indem Sie kochenden Agar auf einen Heizblock legen und die Blasen an die Oberfläche steigen lassen.
- Verwenden Sie eine Pasteur Pipette, um Agar aus der Tiefe innerhalb der geschmolzenen Lösung unter den aufgestiegenen Blasen zu ziehen.
- Bereiten Sie zwei verklebte Dias vor und platzieren Sie auf beiden Seiten eines sauberen Glasmikroskops auf einer ebenen Oberfläche. Um die geklebten Dias zu machen, legen Sie zwei 5 cm Streifen Laborband auf jedem Dia(Abbildung 6A).
- Legen Sie mit einer Pasteur-Pipte einen einzigen Tropfen Agar auf das saubere Mikroskop-Dia zwischen den verklebten Dias(Abbildung 6B).
- Sorgfältig und schnell, decken Sie den Tropfen des geschmolzenen Agarmit mit einem vierten sauberen Dia, indem Sie in über die geklebten Dias(Abbildung 6Cc).
HINWEIS: Die Folie sollte den geschmolzenen Agar vorsichtig in einen abgeflachten Kreis von etwa 0,4 mm Dicke (dicke Dicke des Bandes) drücken (Abbildung 6D). Der Agar sollte schnell abkühlen. - Entfernen Sie den oberen Schlitten, indem Sie ihn abschieben (Abbildung 6E). Agar-Pads trocknen schnell und sind am besten innerhalb von Minuten verwendet. Sobald der obere Schlitten entfernt ist, verwenden Sie das Gelpad sofort für die Montage von Tieren. Vermeiden Sie die Verwendung von Pads mit Luftblasen.
- Agar-Pads bis zu 30 Minuten zwischen den beiden Glasrutschen aufbewahren. Getrockneter Agar bewirkt, dass Tiere zusammenklumpen und verkrüppeln. Mount Tiere innerhalb von 2-15 L von paralytischer Lösung oder Mikroperlen und Abdeckung mit Deckelschlupf; bildschirm die Folie innerhalb von 20 Minuten nach Lähmung und Montage (Abbildung 6).
HINWEIS: Da Stressbedingungen die Exopher-Raten verändern können, vermeiden Sie Gelähmte, die oxidativen Stress (z. B. Natriumazid) beim Screening auf Exopher auslösen können.
- Detektion von Exophern mit einem Konfokalmikroskop der Spinnscheibe
- Beobachten Sie zellbiologische Merkmale wie Organellen und andere Inhalte mit 1,4 numerischen Blendenobjektiven bei 63x und 100x.
- Verwenden Sie Software, die in der Lage ist, die Bühnensteuerung und Bildaufnahme unter Verwendung der multidimensionalen Erfassung zu steuern. Mikroskope und Bildverarbeitungssoftware sollten auch für die Bildgebung und Datenerfassung geeignet sein, da diese Schritte Standard-Bildgebungsansätze beinhalten.
6. Identifizieren von Touch-Neuronen und Scoring für Exopher mit montierten Tieren
- Mount gelähmtes erwachsenes Tier (Abbildung 6).
- Identifizieren Sie die gewünschte Z-Ebene. Verwenden Sie die geringe Vergrößerung Hellfeld (10-40x), um die geeignete Z-Ebene des Tieres zu identifizieren, unter Berücksichtigung der Positionierung des Tieres, Kopf-Schwanz-Ausrichtung, und Lage der Vulva - die Meilensteine für spätere neuronale und exopher Identifizierung sind (Abbildung 3A & Abbildung 5E).
- Konzentrieren Sie sich auf das Fluoreszenzsignal des gewählten Reporters. Bleiben Sie in der gleichen Z-Ebene, wechseln Sie zu Weitfeld-Fluoreszenz-Anzeige bei 10-40x für den gewählten zytosolischen Reporter.
HINWEIS: In diesem Beispiel wird die fluoreszierende Expression durch den mec-4 mechanosensorischen Touch-Neuron-spezifischen Promotor angetrieben. Hohe Kopierarrays und verschiedene Fluorophore weisen eine Variabilität der Expression und damit eine variable Fluoreszenzintensität auf. Passen Sie bei Bedarf an. - Scrollen Sie innerhalb der Z-Achse, um die Tiefe des Tieres und die fluoreszierende Expression in der Brennebene zu beobachten. Bestätigen Sie dabei die Kopf-Schwanz-Orientierung; der Kopf/Pharynx wird den fluoreszierenden Nervenring haben und in diesem Fall enthält der Schwanz 1-2 sichtbare PLM-Somas (Abbildung 3A).
- Identifizieren von Berührungsneuronen
- Identifizieren Sie, ob das Tier auf der linken oder rechten Seite montiert ist (Abbildung 3A).
HINWEIS: Unter Berücksichtigung der 3-Dimensionalität des Tieres wird die beste bildgebende Auflösung auf der Seite erreicht, die der Optik am nächsten ist. - Identifizieren Sie das Soma (ALM, ALMR, AVM) durch Beobachtung - beginnen Sie am Kopf, um den Nervenring und die lateralen neuronalen Prozesse zu identifizieren.
- Bei 10-40-facher Vergrößerung scrollen Sie langsam durch die Z-Achse, um den angehängten Prozess zu identifizieren.
- Sobald der Prozess identifiziert ist, folgen Sie ihm seitlich in der hinteren Richtung in Richtung der Vulva, wo das Soma sichtbar sein wird, gekennzeichnet durch einen runden Zellkörper am Ende des Prozesses. Sobald das in-Fokus-Neuronaum gefunden wird, Kann es identifiziert werden, indem andere neuronale Landmarken wie folgt verwendet werden:
- Verwenden Sie die AVM, ein nahe gelegenes ventrales Neuron, um die Tierorientierung zuzuweisen. Wenn sich das AVM-Neuron in der gleichen Ebene wie die ALM befindet, ruht das Tier auf seiner Seite und das Neuron außerhalb dieser Ebene ist die ALMR . Befindet sich das AVM-Neuron nicht in derselben Ebene wie die betreffende ALM, ist das nächste Berührungsneuron zur Brennebene ALML.
- Identifizieren Sie das PVM-Neuron, ein weiteres ventrales Touch-Neuron in der Nähe des Schwanzes, um anzuzeigen, ob sich das vordere Touch-Neuron in derselben Ebene befindet. Wenn ja, ist das beobachtete Touch-Neuron ALML.
- Holen Sie sich ein Gefühl für die Position anderer Soma-Körper, in der Nähe des Interessenbereichs (fluoreszierende Neuronen auf beiden Seiten des Soma), und in allen Z-Ebenen, auch wenn es nicht möglich ist, das tiefste Neuron in einen klaren Fokus zu setzen.
HINWEIS: Die Identifizierung aller Berührungs-Neuron-Somas ist wichtig, da das nicht fokussierte Soma mit Exophern verwechselt werden kann.
- Identifizieren Sie, ob das Tier auf der linken oder rechten Seite montiert ist (Abbildung 3A).
7. Identifizieren und Scoring für Exophers
- Sobald ein Berührungsneuron gefunden wurde, inspizieren Sie es auf große Vorsprünge (Exopher-Domänen), die groß genug sind, um als Knospenexopher betrachtet zu werden (und erreichen Mindestens 1/5th der Größe des Ursprungssoma) ( Abbildung1C).
ANMERKUNG: Der durchschnittliche Exopher misst einen Durchmesser von etwa 2-8 m, während der durchschnittliche Soma eines (ZB4065 bzIs166[Pmec-4::mCherry]) Tiere 6-10 m bei Tag 2 Erwachsenen misst(Abbildung 7B). - Wenn keine Knospe oder Exopher-Domäne beobachtet wird, überprüfen Sie das neuronale Soma auf ein angehängtes dünnes Filament, das vom Soma ausgeht. Angefügte Exopher befinden sich in der Regel näher am Ursprungssoma und in einer ähnlichen Z-Ebene.
HINWEIS: Exopher bleiben nicht immer am Soma hängen. Der Nachweis eines angeschlossenen Filaments ist ein endgültiger Hinweis darauf, dass es sich bei dem Objekt um einen Exopher handelt. - Suchen Sie nach dem Inhalt eines Exophers, um einen nicht angefügten Exopher zu identifizieren. Exopher können ausgestoßene fluoreszierende Proteine konzentrieren und sind daher oft heller als das Soma.
HINWEIS: Der Inhalt von Exophern ist heterogen und variabel. Zellorganellen wie Lysosomen und Mitochondrien können auch innerhalb von Exophern extrudiert werden (Abbildung 4C-E). - Suchen Sie nach nicht angeschlossenen Exophern in verschiedenen Brennebenen als der Ebene, in der das Ursprungssoma gefunden wurde. Obwohl Exophers aus dem ALM-Soma in jede Richtung hervorragen, ist es typisch, dass Exopher sausen vom Soma weg, in hinterer Richtung vom neuronalen Prozess.
- Suchen Sie nach großen, sphärischen Objekten, die nicht positioniert und als neuronale Somas identifiziert werden. Exopher können unregelmäßig geformt sein, sind aber typischerweise kugelförmige Strukturen. Exopher werden im Laufe der Zeit abgebaut, so dass ältere Exopher tendenziell eine unregelmäßigere Form haben.
HINWEIS: Reife oder ältere Exopher unterscheiden sich von der dispergierten "Sternennacht"-Stufe durch die hellere Fluoreszenzintensität von Exophern und ihre sphärische Form. - Untersuchen Sie den "Sternennacht"-Phänotyp als Beweis für eine frühere Exophergenese. Exophers schreiten “in eine "Sternennacht"-Phase vor, während der Exopher in kleinere Vesikel zerfällt und die umgebende Hypodermis versucht, den Exopher-Inhalt zu degradieren (Abbildung 1G, 2B, 3B & 7A).
HINWEIS: Die Sternennachtphase ist durch fragmentierte und verstreute (manchmal vernetzte) fluoreszierende Einheiten gekennzeichnet, die ihre strukturelle Integrität verloren haben und eine schwache Fluoreszenz im Vergleich zu den Berührungsneuronen und Exopherstrukturen aufweisen. - Suchen Sie nach Instanzen von "multiple exopher-Ereignissen". Exopher werden in der Regel als ein einmaliges Vorkommen erzeugt (1 Exopher, der von 1 soma ausgeht), aber unter bestimmten Umständen können mehr als ein Exopher aus einem einzigen Soma freigesetzt werden (Abbildung 7D).
HINWEIS: Reife Exopher können in mehrere Vesikel zerfallen, da sie in der Hypodermis abgebaut werden. Es kann unterschieden werden, ob jeder Exopher durch ein unabhängiges Exophergenese-Ereignis erzeugt wurde oder ob ein ursprünglicher Exopher split, um ein zusätzliches Vesikel zu erzeugen, nur durch Zeitrafferbeobachtung bestimmt werden kann. - Denken Sie daran, dass nicht alle morphologischen Anomalien zu Exophern reifen.
- Erzielen Sie kein distended soma als Exopher. Ein verlängertes oder spitzes Soma kann gelegentlich beobachtet werden (besonders mit dem Alter oder unter Stress), aber eine Verlängerung ohne eine klare Verengungsstelle wird nicht als Exopher bewertet.
- Ablehnen Sie kleine aufgelöste Knospen, die bei der Quantifizierung des Exopher-Ereignisses nicht das 1/5der Größe des Soma erreichen.
- Zählen Sie nicht Neuritenauswüchse als Exopher. Reife Neurrite können sich mit dem Alter dramatisch ausdehnen (in der Regel in die entgegengesetzte Richtung des neuronalen Prozesses) und fluoreszierendes Protein kann in das distale Ende solcher Strukturen wandern19.
ANMERKUNG: Diese Neuritenauswüchse sind keine Exopher, da sie über Tage und Wochen ein ausgeprägtes Entwicklungsmuster haben, keine Knospen bilden und sich nicht lösen (Abbildung 7E).
- Identifizieren Sie fluoreszierende Entitäten, die keine Exopher sind.
HINWEIS: Es ist wichtig, sich ein Bild von der Hintergrundfluoreszenz zu machen, um eine korrekte Identifizierung des extrudierten fluoreszierenden Wesens im Vergleich zur Autofluoreszenz zu gewährleisten.-
Transgene fluoreszierende Expression vs. Autofluoreszenz. Verwechseln Sie die Autofluoreszenz nicht mit der transgenen Expression. Das wahre Exopher-Signal wird nicht im Darm oder Darm sein (DIC-Bestätigung kann verwendet werden, um diese Gewebe zu identifizieren) und Exopher-Signal wird deutlich heller als Hintergrund-Autofluoreszenz sein.
HINWEIS: Die Autofluoreszenz wird durch Darmgranulat-Darm-Darm-Fluoreszenzpigmentierung verursacht und akkumuliert sich mit dem Alter. Es ist heterogen, vor allem mit unterschiedlichen Wellenlängen betrachtet. - Signal von Embryonen. Verwechseln Sie das Embryosignal nicht mit Exophergenese. Bestätigen Sie den Verdacht auf Embryosignal, indem Sie von Fluoreszenz zu Hellfeldbeleuchtung wechseln und auf Assoziationen von Signalen mit Eiern in der Gebärmutter überprüfen.
-
Aus dem Flugzeug oder in der Nähe Soma Körper. Vermeiden Sie es, ein aus dem Flugzeug-Soma für einen Exopher zu betrachten, indem Sie alle nahegelegenen Soma-Körper identifizieren, sogar somas a-fokus zu Beginn der Beobachtung.
HINWEIS: Wenn Sie für Exopher von ALMR punkten, identifizieren und berücksichtigen Sie den Standort von AVM- und ALMR-Somas. Weitere Einzelheiten zur Identifizierung des Soma-Körpers sind in Abbildung 3Abeschrieben.
-
Transgene fluoreszierende Expression vs. Autofluoreszenz. Verwechseln Sie die Autofluoreszenz nicht mit der transgenen Expression. Das wahre Exopher-Signal wird nicht im Darm oder Darm sein (DIC-Bestätigung kann verwendet werden, um diese Gewebe zu identifizieren) und Exopher-Signal wird deutlich heller als Hintergrund-Autofluoreszenz sein.
8. Scoring und Statistik
- Score exophers als binär (ja, es gibt einen exopher/no, es gibt keinen Exopher).
- Betrachten Sie Exopher-Erkennung als ein "Exopher-Ereignis" für ein bestimmtes Neuron. Ein Exopher-Ereignis kann die Beobachtung eines einzelnen Exophers in der Nähe eines Soma oder mehrerer Exopher darstellen.
HINWEIS: Um die Anzahl der einzelnen Exophergeneseereignisse zu quantifizieren, verwenden Sie die Zeitrafferbeobachtung. - Zählen Sie Exopher-Ereignisse pro einer bestimmten identifizierten Zelle, da verschiedene Zellen keine Exopher mit der gleichen Rate erzeugen (siehe z. B. Abbildung 3C). ALMR-Neuronen produzieren die meisten Ausgangsexopher in den hier beschriebenen Stämmen und daher oft ist dies die Zelle, die für die Exopher-Quantifizierung aus Touch-Rezeptor-Neuronen ausgewählt wurde.
- Für die Statistik führen im Allgemeinen mindestens 3 biologische Versuche von mindestens 30 Pro Versuch bewerteten Tieren mit der entsprechenden Anzahl von Beobachtungen durch, die für die Analyse der Störung erforderlich sind.
- Für mehrere Versuche mit einem oder zwei Mutanten/Behandlungen im Vergleich zur Kontrolle ist der Cochran-Mantel-Haenszel-Test geeignet, p-Werte zu bestimmen.
- Für Versuche mit mehr als zwei Mutanten von Behandlungen im Vergleich zur Kontrolle, ist es auch angemessen, eine binäre logistische Regressionsanalyse zu verwenden, um die Signifikanz für eine beliebige Anzahl von kategorialen Prädiktoren zu bewerten.
Ergebnisse
Mehrere fluoreszierende Reporter können verwendet werden, um Exopher zu messen. Touch-Neuronenexopher werden in vivo leicht durch fluoreszierende Markierung von Proteinen visualisiert, die für die Extrusion ausgewählt werden können, durch Kennzeichnung von Organellen, die extrudiert werden können, oder durch Tagging von Zellmembranen. Tabelle 1 identifiziert Berührungsneuronen-dfluoreszierende Fluoreszenzreporter, die zur Überwachung von Exophern verwendet wurden, mit repräsentativen Beispielen in Abbildung 4. Ladungen, von denen bekannt ist, dass sie extrudiert werden, umfassen eine Fusion der N-Terminal-Domäne von menschlichem Huntingtin mit expandiertem Polyglutamin (Q128) (Abbildung 4B), Lysosomen, die GFP-markiert sind mit lysosomalassoziiertem Membranprotein (LMP-1) (Abbildung 4C), und Mitochondrien, die mit matrixlokalisiertem GFP markiert sind (Abbildung 4D). Zytoplasmatisches GFP wird nicht stark ausgestoßen und bevorzugt im Soma5beibehalten, obwohl GFP Exopher schwach visualisieren kann (Abbildung 4A). Wenn GFP mit Proteinen verschmolzen wird, die ausgestoßen werden, kann dieses Tag verwendet werden, um Exopher zu visualisieren. Ein wichtiger Punkt ist, dass durch die Kennzeichnung verschiedener Proteine eine Vielzahl von Fragen zur Ausweisung bestimmter Ladungen und Organellen sowie zu den Proteinen und Membranen, aus denen Exopher bestehen, angegangen werden können.
Ein Pseudo-Stereomikroskop-Setup ist ein effektives Werkzeug, um Exopher bei Tieren auf Agarplatten zu betrachten. Dieses Setup ist eine Mischung aus compoundierter und stereoskopischer Technologie, die eine hohe numerische Blendenoptik auf jeder Vergrößerung, Pseudo-Stereo-Technologie (diskrete Objektive über eine stereoskopische Basis) und einen Zoom-Betriebsschalter für die Anzeige bei Vergrößerungen zwischenden bis zu installierten Objektiven umfasst. Ein solches Mikroskop sollte mit 10-fachen Okularen und Objektiven ausgestattet sein, die leistungsfähig genug sind, um neuronale Morphologie und Exopher-Produktion für High-Throughput-Scoring zu beobachten (2x Objektiv zum Scannen/Pflücken, 10-faches Objektiv zur Identifizierung und Bewertung).
Während die Vergrößerungsfunktionen von Standard-Stereomikroskopen in der Regel eine hohe Auflösung aufweisen, um das Netzwerk von Berührungsneuronen zu sehen, die fluoreszierende Proteine exzieren, reichen Standard-Sezierenvonmikroskope nicht aus, um subzelluläre Details von Exophernwies wie die röhrenförmigen Verbindungen von Soma zu exopher zu beobachten. Solche Beobachtungen erfordern eine konfokale Mikroskopie (siehe Materialtabelle für Gerätedetails).
Exopher-Quantitationsstudien erfordern strenge Kontrollen, um experimentelle Spannungen zu beseitigen. Für die reproduzierbare Exopher-Produktion ist die sorgfältige Aufrechterhaltung gleichbleibender Wachstumsbedingungen erforderlich. Genauer gesagt ist die Exopher-Produktion stressempfindlich, so dass eine konstante Fütterung, konstante Temperatur und kontaminationsfreies Wachstum über Generationen hinweg entscheidend für die Reproduzierbarkeit sind. Unter basalen Wachstumsbedingungen mit hoher neuronaler Expression von mCherry ist die Exopher-Produktion relativ gering (5-25% der ALM produzieren Exopher), aber einige Belastungen, einschließlich osmotischem und oxidativem Stress, können die Exopher-Raten erhöhen. Während mCherry Ausdruck kann als Stress gedacht werden, eine logische Folge der Stress-Empfindlichkeit der Exopher-Ebenen ist, dass, wenn richtig kontrolliert, experimentelle Stress-Einführung kann eine Strategie, um leichter zu induzieren und beobachten Exophergenese.
Timing und erwartete Exopher-Produktionsniveaus. Exopher sind praktisch abwesend während der Larvenentwicklung. Die Phase der Spitzenproduktion im jungen Erwachsenenleben scheint stark auf die Erwachsenentage 1-4 beschränkt zu sein, am häufigsten am 2. oder 3. Erwachsenentag. Da sich der Peak ein wenig vorwärts oder zurück bewegen kann, besteht die vollständigste Bewertung eines Exopher-Produktionsprofils darin, mehrere Versuche täglich über Erwachsene 1-4 zu bewerten. Im Allgemeinen produziert ein ALMR einen Hauptexopher, wobei das Vesikel mindestens 24 Stunden lang anhält. Der Exopher kann relativ schnell produziert werden (in der Reihenfolge der Minuten am schnellsten). Am häufigsten wird im frühen Erwachsenenleben pro Neuron nur ein großer Exopher produziert, aber die Produktion mehrerer Exopher ist möglich.
Im Allgemeinen reicht die Exopher-Produktion durch ALM, die mCherry unter basalen Bedingungen ausdrücken, zwischen 5-25% der ALMRs, die innerhalb des optimalen Zeitrahmens des Erwachsenentages 2-3 untersucht werden (Abbildung 3D). Proteostase-Krisen5, sowie Exposition gegenüber anderen Belastungen können Exopher-Niveau modulieren. Stress oder genetische Störungen können die Exopher-Produktion auf Nachweisraten von bis zu 90 % der ALMR-Neuronen erhöhen, die Exopher-Extrusionen produzieren.
Fütterungsbasierte SENnai zum Testen von Rollen bestimmter Gene in der Exophergenese. Die Nematode C. elegans wird häufig RNAi-Knock down durch Fütterung von Tieren transformiert E. coli-Stamm HT115, die eine doppelsträngige RNA (dsRNA) auf ein Gen von Interesse20auszudrücken ausgesetzt. HT115 Bakterien können verwendet werden, wenn sie für Exopher bei der Fütterung RNAi5punkten. Während Transkripte in den meisten Geweben von RNAi mit dieser Technik gezielt werden können, Neuronen sind refraktärer. Die Empfindlichkeit gegenüber RNAi kann mit Tieren kalibriert werden, die den transgenen dsRNA-Transporter SID-1 unter einem neuronspezifischen Promotor ausdrücken. Auf diese Weise kann neuronales Gewebe für RNAi21sensibilisiert werden.
Gewebespezifische Sendearbeiten eines Gens von Interesse können erreicht werden, indem eine Komponente des endogenen RNAi-Stoffwechsels innerhalb einer Mutante exzessither exzessiert wird, die in dieser Komponente mangelhaft ist. Zum Beispiel: Das Argonaute-Protein RDE-1 kann speziell in den Neuronen von rde-1-mutierten Tieren exprimiert werden, um ein Gen von Interesse nur in Neuronen zu erreichen, wenn Tiere einer RNAi-Intervention ausgesetzt sind, die auf dieses Gen abzielt.
Mit Standard-Nematoden RNAi Protokolle20,22, Exposition der Eltern in der L4-Stufe bei der RNAi und ermöglicht ihre Nachkommen konsumierende transformierte HT115 Bakterien bis zum Erwachsenenalter erzeugt die starke genetische Knock-down, aber aufmerksam auf mögliche Entwicklungsverzögerungen durch RNAi induziert, da experimentelle Tiere anders als eine leere Vektorkontrolle wachsen können. Es ist wichtig, immer das leere Vektorsteuerelement für den Negativsteuerungsvergleich einzuschließen. HT115 Bakterien können bei der Bewertung für Exopher bei der Fütterung VON RNAi verwendet werden. Beachten Sie jedoch, dass einige Gene auch während kürzerer Perioden der RNAi-Exposition wirksam sind, um die Exophergenese-Raten zu ändern5. Wenn die Ausrichtung auf bestimmte Gene zu Entwicklungsversagen führt, vermeiden Sie es, Tiere einem lebenslangen Knockdown auszusetzen, tiere können einfach im L4-Stadium auf RNAi-Platten für die Exposition von L4 gegenüber Erwachsenen D2 oder D3 gepflückt werden.
| Dehnungsname | Genotyp | Beschreibung | Exopher-Prozentsatz | Verweis |
| SK4005 | zdIs5[Pmec-4GFP] | Zytosolic Expression von GFP in Berührungneuronen. | 1-8% ALM | Abbildung 4A, Melentijevic 2017 |
| ZB4065 | bzIs166[Pmec-4::mCherry] | Overexpression von mCherry (bzIs166) in Berührungsneuronen, produziert sowohl zytosolische Signal und mCherry Aggregate. bzIs166 ist ein Exopher-Induktor. mCherry Aggregate sind Prädiktoren der Exophergenese und werden bevorzugt in Exopherexetoren extrudiert. | 3-20% ALM (normale Bedingungen). 20-80% ALM (Fastenbedingungen). | Abbildung 4B, Melentijevic 2017 |
| ZB4067 | bzIs167[Pmec-4mitogfp Pmec-4mCherry4]; igIs1[Pmec-7YFP Pmec-3htt57Q128::cfp lin-15+]; | YFP cytosolisch bezeichnet mec-7 Touch Neuronen. Koausgedrückt Q128::CFP-Aggregate und induziert Exopher. DIE GFP schweigt bevorzugt. | 25 % | Abbildung 4C, Meletijevic 2017 |
| ZB4509 | bzIs166[Pmec-4mCherry]; bzIs168[Pmec-7LMP-1::GFP] | bzIs168 LMP-1::GFP kennzeichnet Plasmamembranen und lysosomale Membranen. bzIs168 kann verwendet werden, um neuronale Membranen, Exopher (wie sie membrangebunden sind) und lysosomal-Membranstrukturen zu identifizieren. | 3-20% ALM | Abbildung 4D, Melentijevic 2017 |
| ZB4528 | bzIs166[Pmec-4mCherry]; zhsEx17 [Pmec-4mitoLS::ROGFP] | Allele zhsEx17 ist ein mitochondrially lokalisierter Reporter, der seine Maximale Erregungswellenlänge von 405nm (oxidiert) auf 476nm (reduziert) entsprechend der lokalen oxidativen Umgebung ändert. Es wird in den Berührungsneuronen ausgedrückt und kann auf eigene Faust verwendet werden, um Mitochondrien in Berührungneuronen und in Mito-Exophern zu identifizieren. | 3-20% ALM proteo-exopher. % ALM mito-exopher Quantifizierung in Arbeit. | Abbildung 4E, Melentijevic 2017, Kanone 2008, Ghose 2013 |
Tabelle 1. Stämme, die für die Visualisierung von Berührungsneuronen, Berührungneuronen und Exopher-Inhalten verwendet wurden.
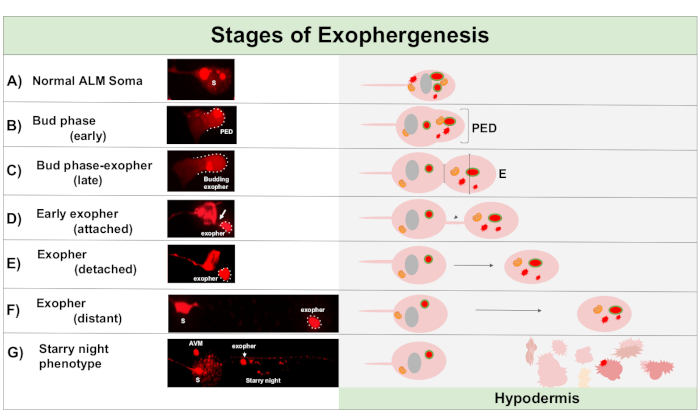
Abbildung 1: Stadien der Exophergenese. Der Prozess der Herstellung und des Auswerfens eines Exophers wird als "Exopher-Genese" bezeichnet. Der dynamische Prozess der Exopher-Bildung kann mehrere Minuten bis mehrere Stunden dauern. Dargestellt sind Beispiele für Soma und Exopher Morphologie in bestimmten Schritten während des dynamischen Exophergenese-Prozesses in einem hochexopher produzierenden Stamm, ZB4065 bzIs166[Pmec-4mCherry]. Alle Bilder sind von Tag 2 erwachsenen ALM Neuronen mit einem 100x Objektiv genommen. (A) Normales Soma. Erwachsene mechanosensorische Berührung Neuron ALM transgenexös ausdrückenDe Pmec-4mCherry. Die dargestellte Somamorphologie ist typisch für junge erwachsene Neuronen in diesem Stamm, mit mCherry-Konzentrationen im Zytoplasma. (B) Frühe Knospenphase. Der erste beobachtbare Schritt der Exophergenese beinhaltet die Polarisation des ausgewählten zytoplasmatischen Materials bis zum Rand der Soma-Membran. Dieser Schritt wird oft von einer Ausdehnung oder Schwellung des Soma begleitet. Bei den Touch-Neuronen erstreckt sich die Pre-Exopher-Domäne (PED) bis in die umgebende Hypodermis (hier nicht sichtbar). Beachten Sie die größere Konzentration von mCherry Material in die frühe Knospendomäne. (C) Späte Knospenphase. Bei einer weiteren zellulären Polarisation und einer Ausdehnung der vorexopher-Domäne wird eine Verengung zwischen Soma und Exopher (Pfeil) deutlich. Dieses Ereignis signalisiert den Übergang zur späten Knospenphase. Obwohl die Zelle im späten Knospenstadium eine klare Verengungsstelle und separate Soma- und Exopher-Domänen aufweist, ist sie noch nicht vollständig vom Soma abgeklemmt; der angehende Exopher kann durch einen dicken Stiel (Pfeil) befestigt werden. Die aufkeimende Domäne gilt als frühes Exopher, wenn der Durchmesser der betreffenden Exopher-Domäne etwa 1/3 größer ist als der Durchmesser der Baustelle/Stiel. (D) Frühphase. Frühe Exopher können durch einen Stiel aus dem abscheidenden Soma befestigt werden – der Durchmesser dieser Verbindung kann dünn werden, wenn sich der Exopher vom Soma entfernt. Zytoplasmatisches Material kann über dieses Rohr vom Soma zum Exopher übertragen werden, obwohl das meiste Material während des Budding-Outs geladen wird. Exopher können sich vom Soma lösen, wie in (E) dargestellt, getrennte Exopher gelten als reife Exopher (F). Der reife Exopher kann durch das umgebende hypodermale Gewebe durchqueren und sich vom abgehenden Soma entfernen. (G) Der Abbau des mCherry-markierten Exophers in kleinere Vesikel innerhalb der Hypodermis führt zu einem verstreuten Punktion des mCherry-Materials, höchstwahrscheinlich, wenn es in das hypodermale endolysosomale Netzwerk eintritt. Das dispergierte Punktiatsignal wird als "Sternennacht"-Phase bezeichnet. Die Degradation einiger Exopher-Inhalte wird wahrscheinlich durch hypodermale Lysosomen erreicht, aber einiges Material ist nicht vollständig degradiert und wird oft durch die Hypodermis in den Pseudocoelom re-extrudiert. Der Post-Exophergenese mCherry Transit wird in Abbildung 2ausführlicher beschrieben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
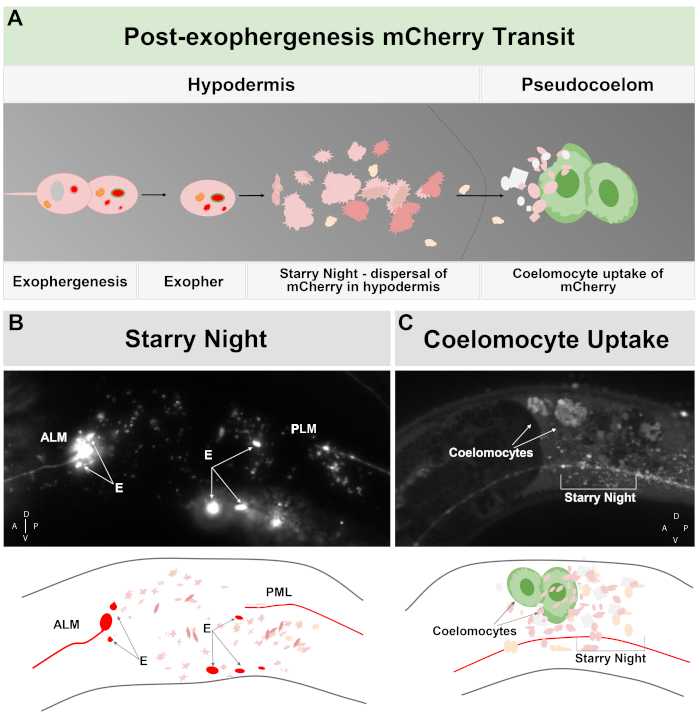
Abbildung 2: mCherry extrudiert aus Berührungneuronen in Exophern greift das umgebende hypodermale lysosomale Netzwerk ein, kann aber später in das Pseudocoelom extrudiert werden, wo Coelomozyten die mCherry speichern/abbauen können. (A) Cartoon-Zusammenfassung, wie mCherry extrudiert in Exophers den Körper nach der Vertreibung durch Neuronen durchquert. Während der Exophergenese werden ausgewählte zelluläre Inhalte wie mCherry lokalisiert und keimen vom sendenden neuronalen Soma in einem unabhängigen Vesikel ab, das von den neuronalen und hypodermalen Plasmamembranen umgeben ist. Da die Touch-Neuronen in das hypodermale Gewebe eingebettet sind, bewegt sich die Exopher-Domäne nach außen in die Hypodermis. Der Exopher kann die Hypodermis durchqueren, und nach Stunden bis Tagen können exopher Inhalte innerhalb des endolysosomalen Netzwerks der Hypodermis fragmentieren. Die mCherry kann als verstreute Puncta in der Hypodermis erscheinen, eine Bühne namens "Sternennacht". Nach ein paar Tagen kann ein Teil der mCherry aus der Hypodermis in das umgebende Pseudocoelom gelangen, wo Schnitzelzellen, die Coelomozyten genannt werden, Zugang zu mCherry erhalten und aufnehmen können, das gespeichert werden kann. (B) Beispiel für das Aussehen der sternenelen Nacht mCherry Vesikel. Bild eines ALM-Soma mit mCherry mit großen Exopher-Fragmenten und sternenhohen Nachtbläschen getaggt. Dehnung ist ZB4065 bzIs166[Pmec-4mCherry]. (C) Beispiel für die mCherry-Konzentration in entfernten Coelomozyten. Sideview eines erwachsenen Tiertages 10 des Stammes ZB4065 bzIs166[Pmec-4mCherry] zeigt mCherry konzentriert in Coelomocytes (Pfeile). Einige sterneneare Nachtbläschen sind ebenfalls offensichtlich. Im Allgemeinen wird die Coelomozytenkonzentration nach etwa 5. Tag des Erwachsenen lebensnotwendig. (B unten) Cartoon-Reproduktion von (B), mit Berührung Neuronen und Prozesse in rot umrissen, wie hellste exopher Fragmente; verstreute kleine Vesikel verschiedener Z-Tiefen werden in hellerem Rosa dargestellt. (C unten) Cartoon-Version des Bildes von (C), zeigt neuronalen Prozess in rot, sternenelige Nacht in rosa und Coelomocytes in grün. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
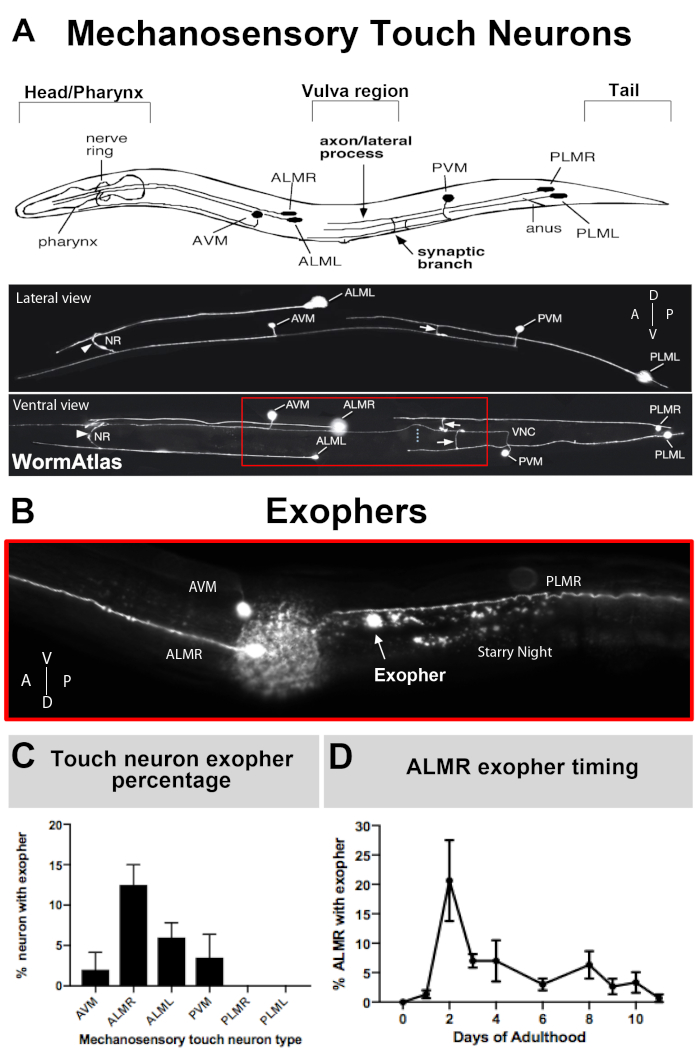
Abbildung 3: Mechanosensorische Berührungsneuronen erzeugen Exopher auf verschiedenen Ebenen mit einem präzisen zeitlichen Profil. (A) (Oben) Cartoon-Darstellung von mechanosensorischen Berührungsneuronen in räumlicher Beziehung zu wichtigen anatomischen Landmarken von C. elegans einschließlich des pumpenden Rachens und des neurondichten Nervenrings am Kopf des Tieres, der Vulva am Mittelkörper und des verjüngten Schwanzes. (Unten) Fluoreszierend beschriftete Touch-Neuronen, die GFP von oben und links ausdrücken (Bilder von WormAtlas angepasst). Das rote Feld zeigt den Bereich, in dem sich ALM-Exopher normalerweise befinden. (B) Hohe Vergrößerungsansicht des mittleren Körperbereichs, in dem ALM-abgeleitete Exopher in einer Sorte hergestellt werden, die [Pmec-4mCherry] ausdrückt. AVM und ALMR Neuron sind dargestellt, und gezeigt ist ein ALMR Exopher zusammen mit mCherry Sternennacht. ALMR Neuronen produzieren am ehesten Exopher. (C) ALMR mechanosensorische Berührungneuronen produzieren leichter Exopher im Vergleich zu anderen Berührungsneuronen in Hermaphroditen unter basalen Bedingungen. Mechanosensorische Touch Neuron Exopher Produktion am Erwachsenen Tag 2, wie für individuelle Touch-Rezeptor-Neuronen bewertet ist angezeigt. Dehnung: ZB4065 bzIs166[Pmec-4mCherry], N>150, Fehlerbalken sind SEM. (D) ALMR Touch Neuronen produzieren mehr Exopher an den Tagen 2 und 3 des Erwachsenenalters im Vergleich zum jugendlichen L4-Stadium oder mit Tieren im fortgeschrittenen Alter. Dehnung: ZB4065 bzIs166[Pmec-4mCherry], N>150, Fehlerbalken sind SEM. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
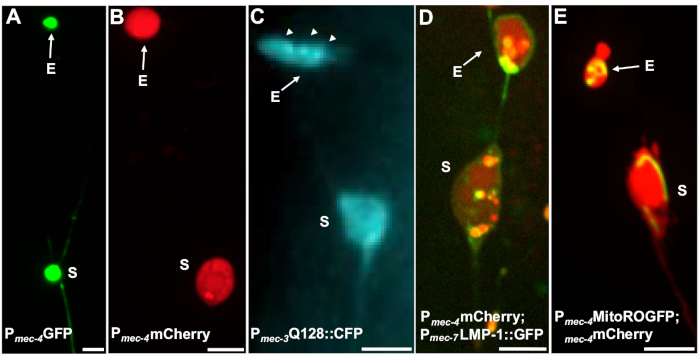
Abbildung 4: Beispiele für einige fluoreszierende Reporter, die Exopher-Inhalte markieren. Eine einfache Möglichkeit, Exopher zu beobachten, besteht darin, transgene Tiere zu schaffen, die Fluorophore von neuronalen Promotoren ausdrücken. Die Fluorophore ermöglichen die Visualisierung des Exophers und der transgenen Expression induziert Aggregation und/oder Proteostress, die die Exophergenese erhöht. Exopher, die von Amphid-Neuronen produziert werden, können auch unter nativen Bedingungen beobachtet werden, indem Farbstofffüllung zur Visualisierung verwendet wird. Gezeigt werden Beispiele für häufige Stämme, die verwendet werden können, um Exopher, (E) exopher, (S) soma zu beobachten. (A) Soma und exopher von einem ALM eines Erwachsenen der Sorte SK4005 zdIs5[Pmec-4GFP],100x Objektiv für die Fotografie verwendet, Skala bar 3m. Bei diesem Stamm werden Exopher, die lösliches GFP enthalten, gemessen, aber die Exopher-Produktion kommt selten vor. Die Verschmelzung von GFP mit Proteinen, die in anderen Studien bevorzugt extrudiert werden können, bestätigt, dass GFP-Fusionen in reifen Exophern nachgewiesen werdenkönnen. (B) ALM-Soma und Exopher eines Erwachsenen des Stammes ZB4065 bzIs166[Pmec-4mCherry], das mCherry ausdrückt und eine Berührungder Neuronenexopher-Produktion induziert. 100x Objektiv für die Fotografie verwendet, Skala bar 5 m. (C) ALM-Soma und Exopher eines Erwachsenen des Stammes ZB4067 bzIs167[Pmec-4mitogfp Pmec-4mCherry4]; igIs1[Pmec-7YFP Pmec-3htt57Q128::cfp lin-15+]; selektiver blauer Kanal, der für das Abbild von htt57Q128::CFP verwendet wird. Der Exopher enthält htt57Q128::CFP-Aggregate (Pfeile), die im Exopher konzentrierter erscheinen als im Soma. 40x Objektiv für die Fotografie verwendet, Skala bar 5 m. (D-E) Exopher können Organellen und organellespezifische Markierungen mit fluoreszierenden Proteinen enthalten, die die Überwachung der Organellenextrusion ermöglichen. (D) Das Lysosomale Membran-Tag LMP-1::GFP umreißt das Soma und die Exopher-Membran und markiert Plasmamembranen schwach (Plasmamembranlokalisierung ist ein Handelsschritt auf dem Weg zu lysosomalem Targeting) und bezeichnet lysosomale Organellen stark. Gezeigt wird ein erwachsener ALM soma Co-Expressing Pmec-4mCherry und das Pmec-7LMP-1::GFP, das zu Membranen und Lysosomen lokalisiert. Das Soma hat einen angehängten Exopher mit anderen kleineren Extrusionen, die wahrscheinlich Exopher-Fragmente (Pfeile) sind. GFP-positive Strukturen sind im Soma enthalten und sind im großen Exophervorhanden, Stamm: ZB4509 bzIs166[Pmec-4mCherry]; bzIs168[Pmec-7LMP-1::GFP]. 100x Objektiv für die Fotografie verwendet, Skala bar 5 m. E) Ein mitochondrialer GFP-Marker kann verwendet werden, um Mitochondrien in Soma und Exophern zu identifizieren. Gezeigt wird ein erwachsener ALM-Soma, der Pmec-4mCherry und Mito::ROGFP ausdrückt, das in die mitochondriale Matrix lokalisiert. mito::ROGFP ausgedrückt allein, ohne die mCherry, kann auch leicht verwendet werden, um Neuronen zu identifizieren und Für Exopher zu punkten, die Mitochondrien enthalten. Dehnung: ZB4528 bzIs166[Pmec-4mCherry]; zhsEx17 [Pmec-4mitoLS::ROGFP]. 100x Objektiv für die Fotografie verwendet; Skala bar 5'm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
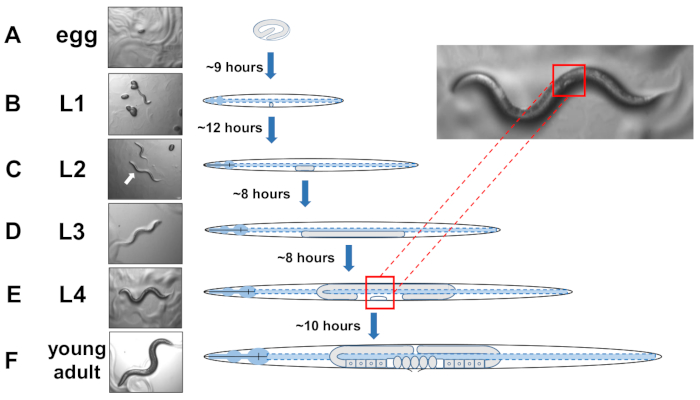
Abbildung 5: Entwicklungszyklus von C. elegans und L4-Identifikation. (A) Bei 20 °C dauert es etwa 9 Stunden, bis ein Ei einmal von der Mutter geschlüpft ist. (B) Ein neu geschlüpftes Tier befindet sich im Larvenstadium 1 (L1) und wird nach 12 Stunden in eine L2-Larve eingeschlämmt. (C) Die Tiere verbleiben jeweils etwa 8 Stunden in den L2- und (D)L3-Larvenstadien. (E) Jugendliche Tiere gelten als die vierte Larvenstufe (L4) und sind durch eine auffällig emittierende Vulva gekennzeichnet, die als weißer Halbmond in der Nähe des Mittleren Körpers erscheint. Das Vorhandensein dieser während Halbmond ermöglicht eine einfache Identifizierung und Kommissionierung von L4 inszenierten Tieren, um synchronisierte Kulturen zu etablieren, die später das Scoring für Exopher erleichtern. Die Tiere bleiben im L4-Stadium für etwa 10 Stunden vor ihrem letzten Molt in gravid Erwachsenen, F) identifiziert durch die Entwicklung von Eiern, sichtbare Spermatheca, und die Einleitung der Ei-Laying. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Vorbereitung des Mikroskop-Dia-Agar-Pads. (A) Bereiten Sie zwei Dias mit einem einzigen Streifen Laborband in der Längsrichtung über der Oberseite vor. Platzieren Sie ein nicht verklebtes Mikroskop-Dia dazwischen, wie abgebildet. B) Legen Sie einen Tropfen geschmolzene Agarose auf die Rutsche. (C) Legen Sie eine saubere Rutsche sanft auf den Tropfen und drücken Sie die Agarose in ein deflationiertes Kreispolster. (D) Entfernen Sie die geklebten Dias, die wirken, um eine gleichmäßige Abflachung des Agars zu erreichen, die benötigt wird, um ein gleichmäßiges Pad zu erstellen. (E) Entfernen Sie die obere Rutsche, sobald das Agarose-Pad getrocknet ist. (F) Pipette eine paralytische Lösung (Levamisol oder Tetramisole) auf dem Agarpad. (G) Wählen Sie entsprechend inszenierte Tiere in den Gelähmten. (H) Bedecken Sie die Tiere vorsichtig mit einem Deckelund und stellen Sie sicher, dass die Tiere am Leben sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
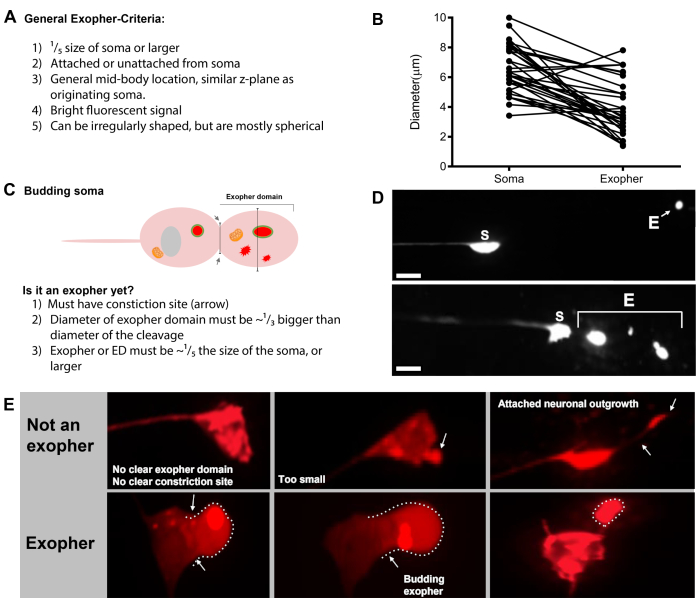
Abbildung 7: Zeichen von Exophern und Exopher-Identifikationskriterien. (A) Allgemeine Kriterien, die einen Exopher identifizieren. (B) Durchmesservergleiche zwischen dem sendenden Soma und dem extrudierten Exopher, gemessen in m. Erwachsene ALM-Somas, N=35, Stamm: ZB4065 bzIs166[Pmec-4mCherry] - 6,53 m durchschnittliche Größe des Soma und 3,83 m durchschnittliche Größe des Exophers. (C) Definition von Kriterien für die Unterscheidung zwischen einer Exopher-Domäne und einem angehenden Exopher. (D) Am häufigsten machen einzelne Neuronen einen großen Exopher, der sich später spaltet oder fragmentiert, während die Hypodermis versucht, ihren Inhalt zu verschlechtern. Dennoch können mehrere Exopher neben einem Touch-Neuron beobachtet werden, die entweder von mehreren Exopher-Ereignissen aus einem Neuron oder alternativ stammen könnten, Exopher können sich auch knospen oder fragmentieren. Der Ursprung mehrerer exopher-ähnlicher Entitäten kann nur mit Hilfe der Zeitraffermikroskopie bestimmt werden. Top zeigt ein ALMR-Touch-Neuron-Soma mit einem einzigen entfernten Exopher. Unten zeigt ein ALMR-Touch-Neuron-Soma mit mehreren exopherartigen Extrusionen. (E) Häufige morphologische Merkmale in erwachsenen ALM berühren Neuronensomas, die mit Exopher-Ereignissen verwechselt werden können. Oben links - Ein distended ALM soma, ohne klare Exopher-Domain oder Verengungsseite. Obere Mitte - Neuronen können kleine extrazelluläre Vorsprünge haben, die analog zu Exophern sein können, aber nicht größenanforderungen erfüllen, um als Exopher betrachtet zu werden. Oben rechts – Mit dem Alter können Touch-Neuronen Auswüchse entlang ihres kleinen Neurites entwickeln. Oft kann mCherry Material an der Spitze des Neuritenauswüchses gesammelt werden. Dies wird nicht als Exopher gewertet, wenn die gesammelte mCherry die Größenanforderungen von Exopher-to-Soma nicht erfüllt. Unten zeigt erwachsene ALM-Neuronen, die definierte Kriterien für eine Exopher-Domäne oder einen Exopher haben. Botom links - ALM soma, das eine prominente exopher Domain hat, die selektiv mCherry Cytosol und mCherry getaggte Aggregate enthält. Die Exopher-Domänenverengungsstelle ist durch Pfeile gekennzeichnet und erfüllt die Größenkriterien (mindestens 1/5der Größe des Soma). Der größte Durchmesser der Exopher-Domäne ist fast 1/3 größer als der Durchmesser des Verengungsplatzes und erfüllt die Kriterien für ein Exopher-Ereignis. Untere Mitte - ALM-Soma, das einen prominenten angehenden Exopher hat, der die Größenkriterien erfüllt. Es gibt eine klare Verengungsstelle. Unten rechts - ALM-Soma mit einem angehängten mCherry-gefüllten Exopher, der die Anforderungen an die Größe von Exopher erfüllt. Der Exopher wird durch ein dünnes Verbindungsfilament befestigt. Alle Bilder stammen von Stamm ZB4065 bzIs166[Pmec-4mCherry]. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Charakterisierung der in vivo molekularen Mechanismen der Aggregat- und Organellenelimination in Form von großen Exophern steckt noch in den Kinderschuhen. Fragen nach der Ausweisungsbezeichnung, der polarisierten Sammlung dieser Ladungen innerhalb der Zelle, der Regelung der Entscheidung, Exopher zu erzeugen, der Maschinerie, die Extrusionen vermittelt, und dem Zusammenspiel von Exophern mit den abbauenden Maschinen in einer benachbarten Zelle müssen noch geklärt werden. Darüber hinaus ist die in vivo Visualisierung von röhrenförmigen Verbindungen, die biologische Materialien passieren können, die Kalzium, Aggregate und Mitochondrien enthalten, interessant und unterstudierte Biologie für sich. Fragen, warum bestimmte Zellen anfälliger für exopher Produktion als andere sind auch ungelöst, können aber beginnen, genetisch mit den Indimierten Ansätzen in diesem Protokoll skizziert werden.
In diesem Protokoll werden die Ansätze zur Erzielung einer reproduzierbaren Bewertung der Exopher-Produktion ausführlich beschrieben, wobei die Unterscheidung von Exophern von nahegelegenen Zellsomas, das Timing von Analysen zur Erfassung des Spitzenwerts der Exopher-Produktion und die strenge Kontrolle der Wachstumsbedingungen zur Vermeidung unbeabsichtigter Spannungen, die exopher-Niveaus modulieren können, im Einzelnen beschrieben werden. Sowohl die Unterscheidung des großen frühstächtigen Exophers als auch die Streuung der "Sternennacht" in der umgebenden Hypodermis können als Beweis für die Exopher-Produktion quantifiziert werden. Davon abgesehen, Neuronen, die mCherry unter basalen Bedingungen exzieren, sind am häufigsten mit 5-25% der Neuronen einer bestimmten Art, die einen Exopher produziert verbunden. Die kontrollierte Einführung von Stressbedingungen könnte angewendet werden, um die Exopherproduktion auf den Nachweis von bis zu 90 % der Neuronen zu erhöhen, die Extrusionen produzieren, besonders nützlich für genetische oder pharmakologische Siebe für Modifikatoren.
Bei menschlichen neurodegenerativen Erkrankungen können große Aggregate von erkrankten Neuronen in benachbarte Zellen übertragen werden, um die Ausbreitung der Pathologie zu fördern. Der Exopher-Mechanismus kann über einen konservierten Mechanismus zur Aggregatextrusion über Phyla hinweg auftreten. Die Definition der In-vivo-Moleküle, die entweder die Effizienz dieses Prozesses erhöhen (als effektivere Proteostase-Kontrolle betrachtet) oder sie blockieren könnte genutzt werden, um die Entwicklung neuer Strategien zur Bekämpfung mehrerer neurodegenerativer Erkrankungen zu beeinflussen. Als solches könnte das hier beschriebene Protokoll für klassische genetische Mutagenese-Screens, genomweite RNAi-Screens, die Gene systematisch niederschlagen, um Enhancer und Unterdrücker zu identifizieren, oder für Arzneimittelinterventionsstudien verwendet werden, die kandidatenpharmakologische Modifikatoren dieses Prozesses identifizieren. Der Ansatz ist einfach, wenn auch etwas mühsam. Exopher sind so groß, dass sie mit einem Hochvergrößerungsmikroskop betrachtet werden können. Dennoch sind C. elegans Neuronen relativ klein und wenn man sich ihre Organellen oder ihre Membranen ansieht, benötigen sie konfokale Bilder mit höherer Leistung und ist ein langsamer Prozess. Optionen für einen höheren Durchsatz könnten Bildverarbeitungsansätze mit hohem Inhalt im Multi-Well-Plattenformat umfassen.
Die Anwendung eines standardisierten Ansatzes zur Exopher-Scoring sollte einer abgestimmten genetischen Zerlegung des Prozesses zugrunde liegen, durch den Neuronen zelluläre Ablagerungen organisieren und beseitigen können.
Offenlegungen
nichts
Danksagungen
Wir bestätigen die folgenden NIH-Stipendien: R01AG047101 und R37AG56510. Die Mitglieder der Driscoll- und Grant-Labore haben mit strengen Experimenten und starker Kommunikation einen umfangreichen Beitrag zur Entwicklung und Feinabstimmung der beschriebenen Protokolle geleistet.
Materialien
| Name | Company | Catalog Number | Comments |
| 95B Scientific CMOS camera | Photometrics Prime | ||
| 1,000 μL low retention tips | Sarstedt | ||
| 10 mL serological pipette | Appleton Woods | CC214 | |
| 10 μL low retention tips | Sarstedt | 70.1130.105 | |
| 13% sodium hypochlorite | Acros Organics | AC219255000 | |
| 15 mL centrifuge tubes | Fisher Scientific | 05-539-12 | |
| 2 L erlenmeyer flasks | Scientific Laboratory Supplies | FLA4036 | |
| 25 mL serological pipette | Appleton Woods | CC216 | |
| 300 μL low retention tips | Sarstedt | 70.765.105 | |
| 50 mL serological pipette | Appleton Woods | CC117 | |
| 5-Fluoro-2'-deoxyuridine 98% | Alfa Aesar | L16497.ME | |
| 9 cm sterile Petri dishes | Fisher Scientific | 11309283 | |
| absolute ethanol | Vwr | 20821.33 | |
| Agar | Sigma Aldrich | A1296 | |
| C. elegans strain wild type | Supplied by CGC | N2 | C. elegans strain |
| calcium chloride dihydrate | Sigma Aldrich | C3881 | |
| cholesterol | Acros | 110190250 | |
| dibasic sodium phosphate | Sigma Aldrich | S3264 | |
| E. coli strain OP50 | Supplied by CGC | Op50 | E coli strain |
| FBS10 Standard microscope | Meyer Instruments | KSC 410-1-100-1 | FBS10 Standard with Plate Base, 100/100 Trinocular Head and Flip zoom |
| glass pipette 270 mm | Fisherbrand | FB50255 | |
| Heraeus Multifuge X3R | Thermofisher scientific | 75004515 | |
| Inoculating Spreaders | Fisher Scientific | 11821741 | |
| LB medium capsules | MP biomedicals | 3002-031 | |
| LDI – Laser Diode Illuminator | 89 North | ||
| levamisole | Sigma Aldrich | 16595-80-5 | |
| M4 multipette | Eppendorf | 4982000012 | |
| magnesium sulphate | Sigma Aldrich | M7506 | |
| monobasic potassium phosphate | Sigma Aldrich | P0662 | |
| Multitron Standard shaking incubator | Infors HT | INFO28573 | |
| Nalgene 1 L Centrifuge pots | Fisher Scientific | 3120-1000 | |
| P10 pipette | Eppendorf Research Plus | 3123000020 | |
| P1000 pipette | Eppendorf Research Plus | ||
| P200 pipette | Eppendorf Research Plus | 3123000055 | |
| pipeteboy 2 | VWR | 612-0927 | |
| Polystyrene microbeads | Sigma Aldrich | MFCD00131491 | |
| RC5C plus floor mounted centrifuge | Sorvall | 9900884 | |
| Reusable ringed cytology slides | ThermoFisher Scientific | 22037242 | |
| SK4005 zdIs5[Pmec-4GFP] | contract Driscoll lab | GFP expressed in touch neurons | |
| sodium chloride | Sigma Aldrich | 13422 | |
| Sodium hydroxide | Fisher Chemical | S/4880/53 | |
| Tactrol 2 Autoclave | Priorclave | ||
| Triton-X | Thermofisher scientific | 28313 | |
| Tween 20 | Sigma Aldrich | 9005-64-5 | |
| X-Light V2 Spinning Disk Confocal Unit | CrestOptics | ||
| ZB4065 bzIs166[Pmec-4mCherry] | contract Driscoll lab | mCherry expressed in touch neurons | |
| ZB4067 bzIs167[Pmec-4mitogfp Pmec-4mCherry4]; igIs1[Pmec-7YFP Pmec-3htt57Q128::cfp lin-15+] | contract Driscoll lab | Q128 expressed in touch neurons | |
| ZB4509 bzIs166[Pmec-4mCherry]; bzIs168[Pmec-7LMP-1::GFP] | contract Driscoll lab | mitoROGFP expressed in touch neurons | |
| ZB4528 bzIs166[Pmec-4mCherry]; zhsEx17 [Pmec-4mitoLS::ROGFP] | contract Driscoll lab | autophagy marker expressed in touch neurons | |
| ZEISS Axio Vert.A1 | Zeiss |
Referenzen
- Davis, A. A., Leyns, C. E. G., Holtzman, D. M. Intercellular Spread of Protein Aggregates in Neurodegenerative Disease. Annual Review of Cell and Developmental Biology. 34, 545-568 (2018).
- Davis, C. H., et al. Transcellular degradation of axonal mitochondria. Proceedings of the National Academy of Sciences of the United States of America. 111 (26), 9633-9638 (2014).
- Torralba, D., Baixauli, F., Sanchez-Madrid, F. Mitochondria Know No Boundaries: Mechanisms and Functions of Intercellular Mitochondrial Transfer. Frontiers in Cell and Developmental Biology. 4, 107 (2016).
- Stahl, P. D., Raposo, G. Extracellular Vesicles: Exosomes and Microvesicles Integrators of Homeostasis. Physiology (Bethesda, Md.). 34 (3), 169-177 (2019).
- Melentijevic, I., et al. C-elegans neurons jettison protein aggregates and mitochondria under neurotoxic stress. Nature. 542 (7641), 367 (2017).
- Nussbaum-Krammer, C. I., Park, K. W., Li, L., Melki, R., Morimoto, R. I. Spreading of a prion domain from cell-to-cell by vesicular transport in Caenorhabditis elegans. PLoS Genetics. 9 (3), 1003351 (2013).
- Tyson, T., et al. Novel animal model defines genetic contributions for neuron-to-neuron transfer of alpha-synuclein. Scientific Reports. 7, (2017).
- Babcock, D. T., Ganetzky, B. Transcellular spreading of huntingtin aggregates in the Drosophila brain. Proceedings of the National Academy of Sciences of the United States of America. 112 (39), 5427-5433 (2015).
- Pearce, M. M. P., Spartz, E. J., Hong, W., Luo, L., Kopito, R. R. Prion-like transmission of neuronal huntingtin aggregates to phagocytic glia in the Drosophila brain. Nature Communications. 6, 6768 (2015).
- Fu, H., Li, J., Du, P., Jin, W., Cui, D. Metabolic wastes are extracellularly disposed by excretosomes, nanotubes and exophers in mouse HT22 cells through an autophagic vesicle clustering mechanism. bioRxiv. 10 (1), (2019).
- Ghose, P., Park, E. C., Tabakin, A., Salazar-Vasquez, N., Rongo, C. Anoxia-reoxygenation regulates mitochondrial dynamics through the hypoxia response pathway, SKN-1/Nrf, and stomatin-like protein STL-1/SLP-2. PLoS Genetics. 9 (12), 1004063 (2013).
- Cannon, M. B., Remington, S. J. Redox-sensitive green fluorescent protein: probes for dynamic intracellular redox responses. A review. Methods in Molecular Biology. 476, 51-65 (2008).
- Perkins, L. A., Hedgecock, E. M., Thomson, J. N., Culotti, J. G. Mutant sensory cilia in the nematode Caenorhabditis elegans. Developmental Biology. 117 (2), 456-487 (1986).
- Stiernagle, T. Maintenance of C. elegans. WormBook: The Online Review of C. Elegans Biology. , 1-11 (2006).
- Sutphin, G. L., Kaeberlein, M. Measuring Caenorhabditis elegans life span on solid media. Journal of Visualized Experiments. (27), (2009).
- Mitchell, D. H., Stiles, J. W., Santelli, J., Sanadi, D. R. Synchronous growth and aging of Caenorhabditis elegans in the presence of fluorodeoxyuridine. Journal of Gerontology. 34 (1), 28-36 (1979).
- Weicksel, S. E., et al. A novel small molecule that disrupts a key event during the oocyte-to-embryo transition in C. elegans. Development. 143 (19), 3540-3548 (2016).
- Dong, L., et al. Reversible and long-term immobilization in a hydrogel-microbead matrix for high-resolution imaging of Caenorhabditis elegans and other small organisms. PloS One. 13 (3), 0193989 (2018).
- Toth, M. L., et al. Neurite sprouting and synapse deterioration in the aging Caenorhabditis elegans nervous system. Journal of Neuroscience. 32 (26), 8778-8790 (2012).
- Conte, D., MacNeil, L. T., Walhout, A. J. M., Mello, C. C. RNA Interference in Caenorhabditis elegans. Current Protocols in Molecular Biology. 109, (2015).
- Calixto, A., Chelur, D., Topalidou, I., Chen, X., Chalfie, M. Enhanced neuronal RNAi in C. elegans using SID-1. Nature Methods. 7 (7), 554-559 (2010).
- Maher, K. N., Catanese, M., Chase, D. L. Large-scale gene knockdown in C. elegans using dsRNA feeding libraries to generate robust loss-of-function phenotypes. Journal of Visualized Experiments. (79), e50693 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten