Method Article
ワンポット純粋な無細胞システム
要約
標準的な実験装置を用いて組換え純粋な無細胞TX-TLシステムを製造するための迅速かつ費用対効果の高い方法を提示します。
要約
定義されたPURE(組換え元素を用いたタンパク質合成)転写翻訳システムは、無細胞合成生物学の魅力的なシャシーを提供します。残念ながら、市販のシステムはコストがかかり、そのタントは限られています。それに比べて、ユーザーのニーズに基づいて、自家製のアプローチをカスタマイズできます。しかし、自家製システムの調製は、リボソームと36の中規模タンパク質精製の必要性のために時間がかかり、困難です。タンパク質の精製をコキュレーションと共精製によって合理化することで、時間と労力の要件を最小限に抑えることができます。ここでは、標準の実験装置を使用して、1週間以内にすべてのPUREシステムコンポーネントを製造するための、簡単で調整可能で時間的でコスト効率の良い方法を紹介します。さらに、OnePot PUREの性能は、市販のシステムに匹敵する。OnePot PURE調製方法は、そのシンプルさと費用対効果のために、PUREシステムのアクセシビリティをより多くのラボに拡大します。
概要
無細胞転写翻訳(TX-TL)システムは、生物学的システムの調査およびエンジニアリングのための有望なプラットフォームです。彼らはもはや成長、ホメオスタシス、または規制メカニズムを含む生命維持プロセスに依存しなくなるため、単純化された調整可能な反応条件を提供します1.このように、無細胞システムは生体分子システムの調査に貢献し、合理的なバイオデザイン戦略2をテストするフレームワークを提供し、将来の合成細胞3、4のシャシーを提供することが期待される。完全組換えPUREシステムは、その定義された最小限の構成、ならびにその調整性および調整可能性5のために特に魅力的なシャーシを提供する。
2001年5年に最初の機能的、完全組換えPUREシステムが確立されて以来、システム限界を拡大し、システムの組成を最適化して、転写調節9、膜10、11および分泌タンパク質合成12を可能にするシステムの組成を最適化し、タンパク質の折りたたみを容易にする。.現在では、PUREfrex(ジーンフロンティア)、PURExpress(NEB)、マジックピュア(クリエイティブバイオラボ)の3つの市販システムがあります。しかし、これらのシステムはコストがかかり、その正確な組成は独自であり、したがって未知であり、適応性は限られている。
社内で調製されたPUREシステムは、最も費用対効果が高く、チューニング可能なオプション15、16であることが判明しました。しかし、タンパク質およびリボソーム分画に必要な37の精製ステップは、時間と退屈です。PUREシステム調製17、18、19の効率を改善するためにいくつかの試みがなされている。我々は、最近、PUREシステムに存在するすべての必要な非リボソームタンパク質を共培養し、共精製することが可能であることを実証した。このOnePot法は、費用対効果が高く、時間効率が良く、準備時間を数週間から3営業日に短縮することが実証されています。このアプローチは、市販のPURExpressシステム20に匹敵するタンパク質産生能力を有するPUREシステムを生成する。PURE調製17、18、19を簡素化するための以前のアプローチとは対照的に、OnePotアプローチでは、すべてのタンパク質が依然として別々の株で発現している。これにより、ユーザーは単に特定の株を省略または追加したり、接種量を調整したりするだけでOnePot PUREシステムの組成を調整することができ、それぞれ中退PUREシステムを生成したり、最終的なタンパク質比を変更することができます。
ここに示すプロトコルは、前述の20のOnePot PUREシステムを作成するための詳細な方法を提供しますが、β-メルカプトエタノールはトリス(2-カルボクセチル)ホスフィン(TCEP)に置き換えられました。また、リボソーム精製の2つの方法は、疎水性相互作用とスクロースクッションを用いた伝統的なタグフリーリボソーム精製、清水ら15から適応し、および王らら18 およびエーデルスら21 に基づくNi-NTAリボソーム精製を著しく修飾する。後者の方法は、PUREシステムの調製をさらに容易にし、標準的な実験室用機器のみが必要であるため、より多くの実験室にアクセスできるようにします。
実験プロトコルは、1週間以内に標準的な実験装置を使用して調製することができるシンプルで、調整可能な、費用対効果の高い無細胞プラットフォームを提供するために、多目的なPURE無細胞TX-TLシステムの調製をまとめたものです。標準の PURE 構図を導入するほか、システムの機能性を確保するためにプロトコルの重要なステップに主に焦点を当てて、調整する方法と場所を示します。
プロトコル
注: このプロトコルは、組換えコンポーネントからの無細胞TX-TLシステムの準備について説明します。便宜上、作品は5つの部分に分かれています。最初の部分では、プロトコルを開始する前に行う必要がある準備手順について説明します。第2部は、OnePotタンパク質溶液の調製について説明します。第3部はリボソーム精製について説明し、第4部はエネルギー溶液の調製を詳述し、最後の部分はPURE反応を設定するためのマニュアルを提供する。便宜上、プロトコルは日に分けられ、 表1の日次スケジュールにまとめられています。スケジュールに従って、システム全体を1週間で1人で準備することができます。
1. 予備作業
- 補足表 1に記載されている細菌培養培地および培地サプリメントを準備する。ピペットチップ、96深層プレートを含む必要な材料を準備し、滅菌します。
- ひずみ準備
- ヒートショック法を用いて、対応する発現ベクトルで 表2 に示した発現歪を変換します。
- 化学に有能な細菌に精製プラスミドを加え、氷の上で20〜30分間インキュベートします。
- 42°Cで30s(ヒートショック)に入れ、氷の上に2分間置きます。
- 細菌のピペット20 μLをアンピシリン(AMP)を含む寒天プレートに直接上にし、一晩で37°Cでインキュベートする。プレートは4°Cで1週間保存します。
- 寒天プレートから細菌の単一コロニーとAMPを含むLB培地の3 mLを接種する。一晩260rpmで振りながら37°Cでインキュベートする。
- 250 μL の培養物を 50% (v/v) のグリセロールの 250 μL と混合し、-80 °Cで保存します。
注:将来的に迅速な準備のために、グリセロールストックとして96ウェルプレートに株を保存してください。
- コロニー PCR およびシーケンシングにより、すべてのベクター変換を確認します。遺伝子、プロモーター領域、およびリボソーム結合部位を配列する。
- ヒートショック法を用いて、対応する発現ベクトルで 表2 に示した発現歪を変換します。
- 式テスト
- 調製したグリセロールストックの約1 μLを1.3 mLの深層プレートに入れたAMPを含むLB培地を300μLに接種します。通気性のある膜でプレートを密封し、260rpmで一晩振りながら37°Cでインキュベートします。
注: すべての式は、この時点で個別に行われます。 - 1 μLの一晩培養した AMP を含む新鮮な LB 培地を 300 μL に接種します。一晩260rpmで振りながら37°Cでインキュベートする。2時間後、イソプロピルβ-D-1-チオガラクトピラノシド(IPTG)の100μMで細胞を誘導し、さらに3時間増殖させる。
- 培養液10μLを10μLの2xレムリバッファーで混合し、95°Cに加熱して10分間加熱します。テーブル遠心分離機を使用してサンプルを1分間回転させ、PAGEゲルに上澄み液を10 μLロードします。200 V で 30 分間、トリス/グリシン/SDS バッファーでゲルを実行します。脱イオン水でよくそれをすすい。クーマシータンパク質染色でゲルを覆い、1時間インキュベートします。必要に応じてゲルを水中にデステインする( 図1の発現試験の代表的な結果)。
注意: グラデーション(4%-15%または4%-20%)PAGEゲルを使用して、良好な分離を実現します。
- 調製したグリセロールストックの約1 μLを1.3 mLの深層プレートに入れたAMPを含むLB培地を300μLに接種します。通気性のある膜でプレートを密封し、260rpmで一晩振りながら37°Cでインキュベートします。
- IMACセファローズ樹脂の修復とクリーニング
- 列の準備。
- ボルテックスでセファローズ樹脂をよく混ぜます。
- 必要量の樹脂を空の重力流カラムにピペットします。
注:必要な樹脂の量は、His-リボソーム精製とタンパク質精製の間で異なり、それぞれのセクションで指定されています。 - 30mLの脱イオン水で樹脂を洗います。
- セクション 1.4.4 で指定された列再充電を続行します。
注: 次の手順に進む前に、必ずすべての液体を列を通過させてください。ただし、列が乾かないようにしてください。カラムを通して液体を動かしたときは、液体が樹脂に到達したら、流れを止めるか、次のステップに進んでください。
- 復旧。
- 30mLの脱イオン水でカラムを洗います。
- 0.2 M EDTA および 0.5 M NaCl 溶液の 10 mL を塗布します。
- 0.5 M NaCl溶液の30 mLを加えます。
- 50mLの脱イオン水でカラムを洗います。
- エタノールを4°Cで20%(v/v)で保存するか、次のステップに進みます。
- 清掃。
注意:保護具を着用してください。- 0.5 M NaOHの30 mLでカラムを洗います。
- 30mLの脱イオン水でカラムを洗います。
- 0.1 Mの酢酸を30 mLで洗浄します。
- 30mLの脱イオン水でカラムを洗います。
- 70%(v/v)エタノールの30 mLでカラムを洗います。
- 50mLの脱イオン水でカラムを洗います。
- エタノールを4°Cで20%(v/v)で保存するか、次のステップに進みます。
- 充電を再開する。
- 0.1Mの硫酸ニッケル溶液を10mL加えてカラムに加えます。
注意:硫酸ニッケルは有毒です。硫酸ニッケルの廃棄物は、サプライヤーが示す予防措置で廃棄する必要があります。 - 50mLの脱イオン水でカラムを洗います。
- エタノールを4°Cで20%(v/v)で保存するか、カラムの平衡化を続けます。
注:列がステップ間のエタノールで保存されている場合は、カラムを水で洗って、エタノールの痕跡をすべて取り除くようにしてください。
- 0.1Mの硫酸ニッケル溶液を10mL加えてカラムに加えます。
- 列の準備。
2. OnePotタンパク質溶液の発現と精製
注: このプロトコルは、3 つの部分から日に分かれています (図 2)。理想的な調製手順は、13.5 mg/mL OnePotタンパク質溶液の1.5 mLを生成し、これは1000以上の10 μL PURE反応に対応します。ただし、溶液の量と理想的な濃度はバッチによって異なります。経験豊富なユーザーは、一度に複数の OnePot PURE の準備を実行できます。
1日目:
- 補足表 1に記載されている細菌培養培地および培地サプリメントを準備する。
- ピペットチップ、96個の深いプレート、1つの1 Lバッフルアーレンマイヤーフラスコなど、必要な材料を準備して滅菌します。
- 補足表 2に記載されているとおりにバッファーと補足を準備します。ボトルトップフィルター(0.45 μm)を使用してすべてのバッファーを殺菌し、4 °Cで保管します。 特に指示がない限り、使用する直前に1 mM TCEPですべてのバッファを補足します。
- OnePotタンパク質精製には2mLのセファロース樹脂を使用してください。セクション 1.4 で説明されているように列を準備します。
- スターター培養を準備するには、20 mLのLBメディアと20 μLのAMPを組み合わせます。滅菌96、1.3 mLの深いウェルプレートで、35のウェルに300 μLの培地を加えます。伸び率の熱不安定(EF-Tu)を除き、それぞれの株でそれぞれの菌を接種し、通気性のある膜でプレートを密封します。
メモ:96ウェルレプリケータを使用してプレートを接種します(「 材料表」を参照)。深い井戸プレートの井戸量とスターター文化のボリュームが不可欠です。メディアボリュームが大きくなったり、ウェルボリュームが小さくなったりすると、通潤不整合のために異なる細菌密度が生まれます。 - EF-Tu培養の場合、スナップキャップ付き14 mL培養チューブに3mLのLB培地を接種します。EF-Tu の 1 つの 3 mL のカルチャは、OnePot 式の 1 つのカルチャで十分です。
- 一晩260rpmで振りながら37°Cでインキュベートする。
2日目:
注:特に明記されていない限り、室温ですべての手順を実行します。
- 500 mLのLBメディアと500 μLの AMP を無菌バッフルフラスコに移します。
- 1675 μL の EF-Tu 培養物と深層プレートから各培養物の 55 μL を使用して OnePot PURE 培養を接種する (表 2)。
注: このステップでは、全体のタンパク質組成は、接種比を調整することによって調整することができます。全体の接種容積が3.6 mLで一定であることを確認してください。
オプション:すべての株が一晩成長していることを確認するには、プレートリーダーを使用して96ウェルプレートの600 nM(OD600)で一晩培養物の光学密度を測定します。光学密度測定には10倍の希釈を使用してください。 - 260rpmの揺れで37°Cで2時間培養し、または培養のOD600 が0.2-0.3になるまで培養を行う。
- 0.1 mM IPTGの500 μLで培養を誘導し、さらに3時間成長させます。
- 4°Cで遠心分離して細胞を収穫し、3220 x g で10分間回収し、さらに使用するまで細胞ペレットを-80 °Cで保存します。
注:タイミングを最適化するには、2日目のインキュベーション時間の間にセクション4で説明するエネルギーソリューションを準備します(表1)。
3日目:
- 以下の手順で説明する精製に必要なバッファ量を測定し、 補足表2に示すように、それらすべてにTCEPを追加します。TCEPなしで残りのバッファーを 4 °C で保管し、将来の精製を行います。
- 充電カラム(セクション2.4)を30 mLのバッファAと平衡化します。バッファAが通過した25mLが通過した後、下からカラムを閉じます。並行して、ステップ 2.15 から 2.17 に進みます。
- 細胞を解凍し、血清ピペットを使用して、細胞ペレットを7.5mLの緩衝液Aの中で再懸濁させる。
- 130ワットのプローブ超音波処理器(材料表、プローブチップ径:6mmを参照)を使用して細胞をライセします:4 x 20 sパルスオン、20 sパルスオフ、70%振幅。超音波処理が成功すると、ソリューションが暗くなります(図2)。
注:超音波処理中に氷の上に細胞を維持することを確認してください。プローブをチューブに触れずに溶液の奥深くに入れ。大量の泡が発生すると、エネルギー移動が減衰します。その場合は、フォームを落ち着かせ、プローブを溶液の奥深くに下げ、超音波処理時間を延長します。 - 超音波処理の直後に4°Cで20分間、21130 x g で遠心分離によって細胞の破片を取り除きます。氷の上にライセートを保ちます。
- 平衡化された列に上澄み剤を追加します。上から列を閉じ、漏れがないことを確認します。チューブ回転器を使用して回転下で4°Cで3時間カラムをインキュベートします。
- カラムから非結合成分をエルトし、25mLの緩衝液Aで洗浄する。
- 25 mM イミダゾールバッファー (バッファー A の 23.95 mL およびバッファー B の 1.25 mL) の 25 mL でカラムを洗浄します。
- 450 mM イミダゾールバッファーの 5 mL (バッファー A の 0.5 mL およびバッファー B の 4.5 mL) のタンパク質をエル化します。溶出したタンパク質を常に氷の上に置いてください。
- 25 mLのHTバッファーで溶出液を希釈し、氷の上に混合物を保持します。15 mL 遠心フィルターに 15 mL を加え、1.5 mL の体積に濃縮します。残りの15mLを濃縮液でフィルターに加え、もう一度1.5mLに濃縮します。
- 濃縮サンプルに10mLのHTバッファーを加え、1mLに濃縮します。同量のストックバッファーBを加え、さらに使用するまで-80 °Cで保管します。
注:交換/濃度の1ラウンドは、4°Cで3220 x g で約60分回転します。 - バッファー交換中に、セクション 1.4 で指定されている列を復元します。
4日目:
- 供給者が述べたようにブラッドフォードアッセイを使用してタンパク質濃度を測定します。サンプルを3 kDaカットオフ遠心フィルターの0.5 mLで20mg/mLに濃縮します。
注:タンパク質溶液を濃度測定の前に25倍または50倍希釈して、ブラッドフォードアッセイを過飽和にしないようにします。 - 理想的なタンパク質濃度を確立するために、タンパク質溶液の異なる濃度でこの段階(セクション5.2)で発現試験を行う。滴定を行うために、溶液の総容積を一定に保ち、ストックバッファーBを含むOnePotタンパク質溶液を5つの異なる比率でピペットする(補足表7)。
- SDS-PAGEを使用してOnePot PUREタンパク質組成を確認します(図3A)。サンプル2.5 μLを7.5 μLの水で希釈し、10 μLの2xレムリバッファーと混合し、サンプルの5 μLと2.5 μLをゲルにロードします。セクション 1.3.3 で指定された SDS-PAGE を実行します。
- アリコートは、発現を検証し、濃度を調整した後、50 μLアリコートにタンパク質溶液をアリコートする。OnePot PUREタンパク質溶液は、さらに使用されるまで-80 °Cで保管してください。
注: タンパク質成分が存在しないと疑われる場合、または OnePot PURE で予想より低い濃度で存在する場合は、次の手順を実行します。 - それぞれの菌株の一晩培養物が、全ての培養物の光学濃度測定(OD600)を行うことにより、他の培養物と同等の割合で成長したかどうかを確認する。
- 特定株の追加の発現試験を実施し、疑わしいタンパク質の発現を検証する。
3. リボソーム溶液
注:2つの異なるリボソーム精製戦略が導入され、1つはヘキジスチジンタグ付け用、もう1つは非タグ付きリボソーム用です。標準親和性のNi-NTA重力フローカラムにHis-purificationを使用した精製法の主な利点は、精製が容易で、速く、かつFPLCシステムや超遠心分離機などの追加の実験室機器を必要としないことです。しかし、OnePot PURE反応におけるタンパク質生産能力は、タグフリーリボソームと比較して約3分の1です。したがって、所定のアプリケーションに高収率が重要であるかどうかに基づいてリボソーム製造方法を選択する。
-
彼のタグ付きリボソーム精製
注:このプロトコルは、 大腸菌 RB1株、教授王(コロンビア大学、米国)からの贈り物を利用しています18.この株は50Sリボソームタンパク質(L7/L12)のC末流にヘキサチジンタグをゲノム挿入し、Ni-NTA重力流カラムを用いた精製を可能にする。通常の収率は3.45 μMリボソームの約0.5 mLで、500以上の10 μL PURE反応に十分です。
1日目:
- 補足表 1に記載されている細菌培養培地および培地サプリメントを準備する。
- ピペットチップ、5 Lエルレンマイヤーフラスコ、1つの100 mLエルレンマイヤーフラスコを含む必要な材料を準備し、滅菌します。
- 補足表 2に記載されているとおりにバッファーと補足を準備します。フィルターは、ボトルトップフィルター(0.45 μm)を使用してすべてのバッファーを殺菌し、4 °Cで保管します。
2日目:
- ピペット5mLの樹脂をカラムにし、セクション1.4で規定したカラムを用意する。
注: 樹脂の容積が大きいため、修復と精製にかかる時間が大幅に長くなります。クロスコンタミネーションを避け、精製前に十分に清掃するために、リボソーム精製用に別のカラムを使用してください。 - 100 mL のエルレンマイヤーフラスコに 35 mL の LB 培地を接種することにより 、大腸菌 RB1株の一晩培養を準備します。260rpmで振りながら37°Cでインキュベートする。
3日目:
注:特に明記されていない限り、室温ですべての手順を実行します。
- LB培地2Lを5L滅菌フラスコに加え、12mLの一晩培養で接種し、260rpmで振盪しながら37°Cで3〜4時間インキュベートする。
注:または、1 Lバッフルフラスコで4 x 500 mLの培養物で細菌培養を行います。 - ペレット細胞は、3220 x g および4°Cで10分間遠心分離して細胞をペレット化した。 さらに使用するまで-80°Cで保管してください。
4日目:
- ステップ 3.1.4 で準備した列を平衡化します。30 mL のライシス バッファーを使用します。
- 血清ピペットを使用して、20 mLのリシスバッファーにペレットを再懸濁します。
- 氷上の130ワットのプローブ超音波処理器( 材料表、プローブ先端径:6mmを参照)で細胞をライセします。20 sパルスオフ、70%振幅(手順の詳細についてはステップ2.16を参照)。
- 超音波処理の直後に、4°Cで21130 x g で20分間遠心分離して細胞の破片を取り除きます。 氷の上にライセートを保ちます。
- 上清を列にロードし、通します。
- 溶解および溶出バッファーの次の混合物でカラムを洗浄します。
- 洗浄0:30mLのリシスバッファーを使用してください。
- 洗浄1:5mMイミダゾール(溶解バッファー29mL、溶出バッファー1mL)の30mLを使用してください。
- ウォッシュ2:25 mMイミダゾール(50mLの溶解バッファー、溶出バッファー10 mL)60 mLを使用してください。
- 洗浄3:40 mMイミダゾール(溶解バッファーの22 mL、溶出バッファーの8 mL)の30 mLを使用してください。
- 洗浄4:60 mMイミダゾール(18mLの溶解バッファー、溶出バッファー12 mL)の30 mLを使用してください。
- 溶出バッファーの 7.5 mL でリボソームを溶出します。溶出したタンパク質を常に氷の上に置いてください。
- リボソームバッファーの 45 mL に純粋なβメルカプトエタノールの 22 μL を追加します。
注意:βメルカプトエタノールは有毒です。安全対策を講じ、ヒュームフードで作業してください。 - 15 mL 遠心フィルターに溶出液を加え、1 mL に濃縮します。
- 濃縮サンプルにリボソームバッファーの 15 mL を加え、再び 1 mL に濃縮します。
注: 前の手順を 2 回繰り返します。 - さらに使用するまで-80°Cで保管してください。
注:交換/濃度の1ラウンドは、4°Cで3220 x g で遠心分離の約60分かかります。 - バッファー交換中に、セクション 1.4 で指定されている列を復元します。
5日目:
- リボソーム緩衝液中の1:100希釈した試料の吸光度を260nMで測定して、リボソーム濃度を測定する。希釈液の吸光度値が10の場合、前述の16のように希釈されていない溶液の23μMに相当する。
- 3.45 μMの最終在庫濃度を実装します。濃度を調整するには、リボソームバッファーでリボソームを希釈するか、4°Cの3 kDa 0.5 mL 遠心フィルターで14000 x g で遠心分離してさらに濃縮します。
注:最適なシステム発現を実現するには、リボソーム濃度滴定を行います(セクション5.2、補足表7)。 - セクション 1.3.3 で指定されているように、SDS-PAGE (図 3A)を使用してリボソーム構成を検証します。サンプル2.5 μLを7.5 μLの水で希釈し、10 μLの2xレムリバッファーと混合し、5 μL と 2.5 μL のサンプルをゲルにロードします。
-
タグフリーリボソーム精製
注:タグフリーリボソーム精製は、FPLCシステム(材料表)を使用して行われ、2 x 5 mLのブチルカラム(材料表)を使用した疎水性相互作用クロマトグラフィーに基づいています。リボソームは任意の株から精製することができるが、 大腸菌A19( エールCGSCで大腸菌 遺伝資源)株を使用すると、そのRNase I欠失22に起因する有利である。冷蔵室または冷却キャビネットで4°Cで精製を行います。通常の収率は、500以上の10 μL PURE反応に相当する10 μMリボソームの約0.5 mLです。
1日目:
- 補足表 1に記載されている細菌培養培地および培地サプリメントを準備する。
- ピペットチップ、5 Lエルレンマイヤーフラスコ、100 mLのエルレンマイヤーフラスコなど、必要な材料を準備し、滅菌します。
- 補足表 2に記載されているとおりにバッファーと補足を準備します。フィルターは、ボトルトップフィルター(0.45 μm)を使用してすべてのバッファーを殺菌し、4 °Cで保管します。
2日目:
- 大腸菌A19株の一晩培養を調製するために、100mLのエルレンマイヤーフラスコ中に35mLのLB培地を接種する。260rpmで振りながら37°Cでインキュベートする。
3日目:
- LB培地2Lを5L滅菌バッフルフラスコに移し、一晩培養した30mLで接種し、200rpmで振りながら37°Cで3〜4時間インキュベートする。
- 4°Cで15分間4000xgで遠心分離して細胞をペレット化する。 25 mLの懸濁液バッファーにペレットを再懸濁し、さらに使用するまで-80 °Cで保管します。
4日目:
- ステップ 3.2.13-3.2.19 と並行してステップ 3.2.8-3.2.12 を実行します。
- 氷上の130ワットのプローブ超音波処理器( 材料表 とプローブ先端径を参照:6 mm)を使用して細胞を解凍し、解凍します。20 sパルスオフ、70%振幅(ステップ2.16手順の詳細を参照)。
- 4°Cで20000xgで遠心分離により細胞の破片を直ちに除去します。
- 上清を吸引し、容積を測定する。等量の懸濁液バッファー(高塩)を加えて、硫酸アンモニウムの最終濃度を1.5Mに調整し、よく混ぜます。
- 4°Cで20000xgで遠心分離により沈殿を20°Cで20分間除去する。
- FPLC精製前に0.45 μmのポリエーテルサルホン膜シリンジフィルターを使用して上清をフィルターし、100 mL ガラス瓶にろ液を集めます。上清は常に4°Cに保ちます。
- 二重ブチルカラム(2 x 5 mL)を用いて疎水性クロマトグラフィー精製用FPLCシステムを次のように設定します。この設定では、1 つの列ボリューム (CV) は 10 mL のボリュームを表します。
- 3 つの入口が必要になります: バッファーラインとして 2 つと、サンプルラインとして 1 つ。浄化器のデフォルト設定により、バッファーCとバッファDにそれぞれラインA1とB1、およびサンプルラインとしてラインA2を選択するのが便利です。ポンプの流量(10 mL/min)を除く、または特に指示がない限り、デフォルトの流量は4 mL/minを適用してください。
注:TCEPは高価な試薬であるため、対応する量を平衡化ステップの後にのみバッファCとDに追加してください。 - システムポンプ洗浄を20%((v/v)エタノールで洗浄し、システムを洗浄し、以前の精製から汚染の可能性を除去します。0.2 mL/min の流量を手動で設定し、カラムをマウントします。フローを停止します。
- 水でシステムポンプ洗浄を実行します。3 CVの水で柱を洗います。
- 平衡化: TCEP を使用しないバッファー C に入口 A1 と A2 を入口 B1 を入口 D に入ります。ポンプ洗浄を実行し、4 CVのバッファーCでカラムを平衡化します。
- TCEP をバッファー C および D に追加します。
- 15 mLチューブまたはクリアラウンドフラクションコレクターチューブを分画コレクターに準備し、4〜5 mL溶出分画を収集します。
- 荷重:入口A2をフィルター処理されたサンプルでボトルに入れます。サンプルボリュームの約90%をカラムにロードします。TCEP含有バッファーCの20 mLでサンプルを希釈し、サンプルの10mLをカラムに積み込みます。希釈ステップを少なくとも2回繰り返し、できるだけ多くのサンプルをカラムにロードします。機械に空気が吸い込まれるのを防ぐためには重要です。
- 洗浄工程1:非結合成分を除去するために3CVの緩衝液Cで洗浄する。
- 洗浄工程2:80%緩衝液C及び20%緩衝Dの5CVで洗浄する。
- 溶出:バッファーCの50%、バッファDの50%を、総溶出量5CVで塗布して製品を溶出させ、この分数を集電管に集めます。
- 洗浄工程3:全量5CVの100%緩衝Dを用いて全ての強く相互作用する汚染物質を溶出させる。
- 260または280 nMでのサンプル画分の吸収スペクトルを解析する(図4)。最初のピークは、ロード中に溶出した非吸収タンパク質と最初の洗浄ステップを示しています。第2のピークは、第2の洗浄工程で溶出した汚染物質を示す。3番目のピークは最終製品を監視し、最後のピークは強く相互作用する汚染物質を示しています。さらに処理するために、3番目のピークに対応するすべてのサンプル分数をプールします。溶出したタンパク質を常に氷の上に置いてください。
- 回収した分率をクッションバッファーの15 mLに4つのポリカーボネート超遠心分離チューブにそっと重ね合わせる。最大15mLのサンプルをクッションバッファーの15mLに加えます。チューブの重量をうまくバランスを取るようにしてください。4°Cで100000 x g の超遠心分離によりリボソームを16時間ペレット化する。
注:超遠心チューブに亀裂がないことを確認してください。 - 次のように列をクリーニングし、リセットします。5 mL/min の流量がうまく機能します。すべての入口を水に入れ、ポンプ洗浄を行います。2 CVの水で柱を洗います。
- 入口を0.5 M NaOH溶液に入れ、ポンプ洗浄を行い、その後3CVのNaOHでカラムを洗浄します。
- 入口を水に入れ、ポンプ洗浄を行い、2CVの水でカラムを洗います。
- 入口を0.1Mの酢酸溶液に入れ、ポンプ洗浄を行い、続いて3CVの酢酸溶液でカラムを洗浄します。
- ポンプ洗浄し、水の2 CVでカラムを洗浄します。
- すべての入口を20%((v/v)エタノールに入れ、ポンプ洗浄工程を実行し、20%((v/v)エタノール溶液の3 CVで洗浄して20%((v/v)エタノールでカラムを保存します。
メモ:システムが乾いたり、空気を吸い込んだりしないようにしてください。バッファーを直接エタノールに適用したり、エタノールをバッファーに適用したりしないでください。必ず間に水洗ステップを追加し、そうでなければ柱が詰まらせる危険性があります。十分なサンプルコレクションチューブを追加してください。
5日目:
- 上清を捨て、慎重に、半透明のペレットを邪魔することなく、各ペレットを0.5mLの氷冷リボソームバッファーで洗浄します。この手順を 2 回繰り返します。
- 可能な限り低い速度を使用して磁気攪拌棒(直径3mM、長さ10mM)を使用して、氷上のリボソームバッファーの100 μLの透明ペレットを再懸濁します。リボソームを回収し、さらに50 μLのリボソームバッファーでチューブを洗浄します。
注:半透明のペレットは見えにくいです。そのため、チューブの側面からペレットを丁寧に洗浄する。 - リボソーム緩衝液中の1:100の割合で希釈した試料の260nMでの吸光度を測定することにより、リボソーム濃度を測定する。希釈液の吸光度10は、前述の16のように希釈されていない溶液の23μMに相当する。
- 最終ストック濃度10μMを実装します。濃度を調整するには、リボソームバッファーでリボソームを希釈するか、4°Cの3 kDa遠心フィルターで14000 x g で遠心分離してさらに濃縮します。
注:最適なシステム表現を実現するには、リボソーム滴定を行います(セクション5.2、補足表7)。 - セクション 1.3.3 で指定されているように、SDS-PAGE (図 3A)でリボソーム構成を確認します。サンプル2.5 μLを7.5 μLの水で希釈し、10 μLの2xレムリバッファーと混合し、サンプルを5 μLと2.5 μLのサンプルをゲルにロードします。
4. エネルギーソリューション
注: ここで紹介した 2.5x エネルギー ソリューションの組成は、標準的な TX-TL 反応に適したソリューションの例です。タイミングを最適化するには、2日目にエネルギー溶液を準備します。アミノ酸溶液の調製について詳細に説明し、その後に最終調製手順を説明する。
- アミノ酸溶液
注:アミノ酸溶液を一括で準備してください。2000 μL 以上の最終容積に必要なアミノ酸ストック溶液の量を準備することで、それ以外の場合は非常に少量の計量誤差を低減します。アミノ酸溶液の全体的な濃度は、アミノ酸の溶解度およびそれぞれのストック溶液濃度によって制限される。標準のPUREシステムでは、最終濃度3.25mMの溶液を調製します。アミノ酸溶液計算表(補足表3)をテンプレートとして使用します。十分な溶解性を確保するために、塩の形態でシステインを使用する。KOHベースのアミノ酸調製方法の使用は避けてください。すべてのアミノ酸のストック溶液を調製することなく、最終的なアミノ酸溶液にアミノ酸の正確な量を直接計量することが可能です。.しかし、これはより困難で正確ではありません。- チロシンを除く 補助表3に記載されているように、各アミノ酸のストック溶液を調製する。
注:水中のアミノ酸の溶解度が異なるために、ストック溶液のそれぞれの推奨濃度が異なります。 - 最小質量[mg]は、ターゲット全体の体積に対して十分な量のストック溶液を得るために必要なおおよその最小質量を基準として提供する。
注: 最小質量は 10% の余剰で計算されます。 - 溶液の調製を容易にするために、正確な量のアミノ酸を計量するのではなく、代わりに、手元の質量のために、所望の濃度を達成するために水の量を調整する。必要な脱イオン水の量(水を加える[μL])を、補足 表3のスプレッドシートを用いて、実際の質量(淡黄色の細胞)と所望の濃度に基づいて計算する。
- 全ての沈殿物が溶解するまでボルテックスによりアミノ酸ストック溶液を可溶化する。個々のアミノ酸ストック溶液は、数週間にわたって-20°Cで保存することができます。
注:いくつかのアミノ酸は、水に溶解することが困難です。プロセスには時間がかかる場合があります。 - アミノ酸溶液のチューブに直接3.25 mMの最終濃度を得るために必要なチロシンの正確な量を量る。
注:チロシンは、水に溶解することは非常に困難です。ストックソリューションを準備する代わりに、直接追加します。 - 最終ボリュームに示されているように、対応する量のアミノ酸ストック溶液と水を加えて[μL]カラム(水色の細胞)を追加し、溶液をボルテックスします。完成したアミノ酸溶液を-80°Cで保存し、さらに使用します。
- チロシンを除く 補助表3に記載されているように、各アミノ酸のストック溶液を調製する。
- エネルギーソリューションの調製
注:合計で、2.5xエネルギー溶液は、各アミノ酸の0.75 mMを含みます。 酢酸マグネシウム29.5mM、グルタミン酸カリウム250mM、ATPおよびGTPの5mM、CTP、UTP、TCEPのそれぞれ2.5mM、大腸菌MRE 600、50mMのクレアチンリン酸、0.05mM 5 mMのスペルミジン、および 125 mM の HEPES.初めてのユーザーは、200 μLの小さなバッチでエネルギーソリューションを調製します。- 氷上の 補足表5 に記載されているすべての水溶液を解凍します。
- 一方、 補足表 4に記載されている残りのコンポーネントに対して、ストック ソリューションを準備します。準備後にすべてのソリューションを氷の上に保管してください。
注:500 μLのRNaseおよびDNaseフリーの水をバイアルに直接加え、凍結乾燥したtRNAを溶解します。穏やかな渦によってよく混ぜます。RNasesの導入を避けるためにピペットを制限してください。 - ストックソリューションと水の計算されたボリューム(補足表5)を追加し、渦を使用してよく混ぜます。常に氷の上にソリューションを保ちます。
- 1 μLをpHストリップにピペットして溶液のpHを測定し、溶液のpHが中性であることを確認します。
- アリコートは、氷上のチューブあたり50〜100 μLのエネルギー溶液を、さらに使用するまで-80°Cで保存します。アリクォートしながら、部品が沈殿するのを防ぐために、頻繁にメインストックを渦出させる。
注:必要に応じて、PURExpressのソリューションAなど、商用エネルギーソリューションに対して新しく作られたエネルギーソリューションの活性アッセイを実施します。エネルギー溶液を用いてシステムの性能が著しく低下することが観察される場合、イオン濃度、特にマグネシウムイオンを、滴定(5〜20mM)によって最適化することが有利であり得る。
5. ワンポットピュア反応
- DNAテンプレート
注:T7プロモーターの下流にコードされたタンパク質は、線形または円形DNAのいずれかからPUREで発現することができる。拡張 PCR を使用して線形 DNA テンプレートを生成することで、面倒なクローニング手順を省略できます。この研究のための線形テンプレートは、以下に述べるようにPCRによって生成された、高忠実度DNAポリメラーゼ(材料表)を用いた。本研究で使用されるプライマー配列、融解温度、およびサーモサイクラーの設定は 、補足表6に記載されています。DNAテンプレートの調製は、毎日のスケジュールには含まれていません。- ポリメラーゼサプライヤーの推奨に従ってPCR反応を設定します。
注: 高忠実度 DNA ポリメラーゼ (表) の最適化されたパラメータは 、補足表 6に示されています。 - 遺伝子特異的プライマー(500nM)を用いてプラスミドまたはゲノムから標的遺伝子(例えばeGFP)を線形鋳型として増幅する(パラメータについては、 補足表6参照)。
- 増幅は、以下の拡張PCRステップのアニーリング配列を提供するために短い拡張を生成します。
- アガロースゲルのアンプリコンで正しいサイズと純度を確認します。
- 増幅されたDNAを、その後の拡張ステップのテンプレートとして使用します。50 μL 以上の反応を設定します。
- 拡張プライマー(2.5 nM)で10 PCR増幅サイクルを実行します。増幅サイクルが完了したら、すぐに最終プライマー(500 nM)を同じ反応に加え、30サイクルを実行して拡張PCR産物を増幅します。融解温度とプライマーシーケンスは 、補足表 6 を参照してください。
- DNA精製キットを使用してDNA断片を精製し、溶出バッファーを含むEDTAの代わりにヌクレアーゼを含まない水でDNAを溶出させます。
- アガロースゲルのリニアテンプレートで、正しいサイズと純度を確認します。
- UV-Vis分光光度計を使用して、NG/μLでDNA濃度を測定します。
- ポリメラーゼサプライヤーの推奨に従ってPCR反応を設定します。
- PURE リアクションの設定
注:最終的な反応組成は、1xエネルギー溶液、タグフリーリボソームまたはHisタグリボソーム、OnePot PUREタンパク質、およびDNAテンプレートです。反応量比は、40%のエネルギー溶液、30%タンパク質およびリボソーム溶液、および30%のDNAおよび水を含む。典型的な反応量は5μL~25μLの間で変化し、プレートリーダー上で蛍光タンパク質の発現を連続的に定量化します。グリーンライスを使用する in vitro 蛍光標識リジン残基を新たに合成したタンパク質に組み込んだ翻訳標識システムは、SDS-PAGEゲル上の非蛍光タンパク質の発現を検証する。反応テンプレートの例は、 補足表 7 PURE無細胞発現反応の確立に役立つ。黄色の細胞はユーザ入力値を示し、オレンジ色の細胞は、必要に応じて反応に添加される追加の試薬を示す。正しいイオンバランスを確保するために、コンポーネントの体積比を正確に保ちます。例えば、より高いタンパク質濃度を達成するために、OnePotタンパク質溶液濃度を増加させる。しかし、反応に添加されるタンパク質溶液の量を増やさない。- スプレッドシート内の対応する黄色の細胞のDNAの濃度[ng/μL]と長さ[塩基対]を記入します。反応に2~10nMのDNAを使用する。
- μLで希望の総反応量を記入します。
- 必要な試薬を冷凍庫から取り出し、氷の上で解凍します。
注: コンポーネントの再凍結は、機能を低下させることなく可能です。ただし、フリーズ融解サイクルの数を最小限に抑え、タイムサンプルは氷上にできるだけ保存されます。 - PCRチューブの片側または384ウェルプレート上のウェルの片隅に、計算された量の水、DNA、エネルギー溶液をピペットします。同じ側に任意の追加試薬の必要量を追加します。サンプルの蒸発と実験開始時間のバイアスを避けるために、実験ごとのサンプル数を最小限に抑えます。
注:エネルギー源の早期消費や収率の低下を避けるために、エネルギー成分をタンパク質成分から物理的に分離しておくことが重要です。 - PCRチューブの反対側または384ウェルプレートの反対側の隅に、計算された量のタンパク質およびリボソーム溶液をピペットします。
注:ピペットエラーの影響を軽減するために、可能な限りマスターミックスを使用してください。初期テストの後、リボソームとタンパク質溶液を混合し、1つの溶液として保存することができます。 - 短時間(30s)回転して反応成分を合合させます。プレートリーダー実験中の蒸発を防ぐには、35 μLの液体ワックスを加え、透明なシーラントでプレートを密封します( 材料表を参照)。
- 37°Cで3時間以上インキュベートする。
- プレートリーダーでの読み出しについては、必要な波長で2分毎に蛍光強度を測定します(代表結果は 図3Bに示されています)。
- Green Lys ラベル付きサンプルに対して、次の手順を実行します。
- 無細胞発現後、37°Cで30分間RNase Aの0.16 μg/μLでサンプルをインキュベートし、グリーンライスラベルキットの蛍光背景を除去します。
注: 他のタイプの RNas はバックグラウンドを十分に削除できないので、RNase A を使用してください。 - セクション1.3.3で規定されているようにSDS-PAGEを実行して、タンパク質発現を可視化します。脱イオン水で染色されていないゲルを軽く洗い、励起波長488nmを使用して蛍光イメージャーで画像化します。
- 続いて、従来のクマシー染色法を用いてゲルを染色する。適切なパラメータについては、セクション1.3.3を参照してください。
注:推奨リボソーム濃度でタンパク質溶液の滴定を行い、必要に応じて、その後に最適なOnePotタンパク質濃度でリボソームを滴定します。市販のPURExpress ΔRibosomeキットをポジティブコントロールとして使用します。溶液A、ファクターミックス、およびリボソーム溶液は、それぞれ調製されたエネルギー、OnePotタンパク質溶液、および精製リボソームに対応する。
結果
上記のプロトコルは、任意の実験室でPURE無細胞TX-TLシステムの確立を容易にするように設計されています。このプロトコルには、Pureシステムの3つの異なる部分の調製の詳細な説明が含まれています:OnePotタンパク質、リボソーム、およびエネルギー溶液。ワークフローを最適化する詳細な日次スケジュールを 表 1に示します。ワークフローは、Hisタグ付きリボソームの精製のために最適化されており、タグなしリボソーム精製が行われると、時間枠が若干異なる場合があります。1つの調製物は、500の10 μL反応の最小値のためのPUREの十分な量を提供する。さらに、調製された溶液は-80°Cで1年以上安定しており、複数の凍結融解サイクルに耐えることができます。
すべての株に対する十分な過剰発現レベルは、最終的なタンパク質溶液の機能性にとって非常に重要です。 図1 は、OnePotタンパク質調製のために続いて使用される36個の個々の株すべてにおいて成功した過剰発現を示す。過剰発現タンパク質のバンド強度の変動は、おそらくSDS-PAGEゲルにボリュームをロードする偏りのために起こった。予想されるタンパク質サイズを 表2にまとめた。GlyRS と PheRS は、さまざまな分子量の 2 つのサブユニットで構成されます。残りの34個のタンパク質は、単一のサブユニットで構成されています。このプロトコルのシンプルさと時間効果の鍵は、コキュレーションと共精製のステップです(図2)。OnePotタンパク質溶液は、他のすべての発現株に対するEF-Tu株の比率を増加させることによって調製した。最終的なタンパク質の全体組成をSDS-PAGE(図3A)で分析した。ゲル(レーン2、3)からは、EF-Tu(43.3 kDa)が他のタンパク質に比べて高濃度で存在することが顕著である。ゲルはタンパク質発現比の第一の指標を良好に提供するが、個々のタンパク質が発現したかどうか、どのレベルで発現したか否かを判断することは困難である。したがって、上記のように、コキュレーションの前に各株の過剰発現を確認することを強くお勧めします。
大腸菌リボソームは、50個以上の個々のタンパク質サブユニット23から構成される複雑な分子機械である。タグフリーリボソーム精製用260 nmにおける代表的な吸収スペクトルを図4に示す。第3のピークは、リボソーム溶出の成功の特徴である。両方のリボソーム精製法について、SDS-PAGEゲル上の期待される走行パターン(図3A)18が観察された。我々は、少量(<10%)ではあるが、両方の精製のための汚染を観察した。特に、異なる汚染物質は、方法の変動に起因するタグなし(レーン5、6)およびHisタグ付き(レーン11、12)リボソームに存在していた。ユーザーの参照のために、結合されたシステムのためのSDS-PAGEのゲルはまた含まれている(車線8、9、および14、15)。
最後に、異なるリボソームバリアントを用いた準備システム(図3)の性能を比較する。 in vitro eGFP発現の時間コースは、両方のPUREシステムが機能し、蛍光eGFPを生成することを示しています。しかし、OnePotタンパク質溶液をHisタグ付きリボソームと組み合わせて、滴定によって最適化されたリボソーム濃度を用いて、非タグリボソームバージョンの発現量の3分の1しか得られなかった(図3B)。同様の結果は、異なるサイズの3つのタンパク質を発現させ、緑色のLys tRNA in vitro 標識システムを用いて標識した場合に観察された(図3C)。蛍光ゲルに見られるように、完全長の製品は両方のシステムで正常に発現されました。しかし、表現レベルの約半分だけがHisタグリボソームシステムで達成されました。蛍光標識に加えて、3つのタンパク質すべてについて期待されるバンドは、クーマッシー染色ゲルで区別可能である(図3D)。この結果は、標準装置を用いた実験室で1週間以内に調製できる発現系が、線形テンプレートからT7プロモーターの下流にコードされるタンパク質の インビトロ 発現に使用できることを示している。

図1: PUREシステムのすべての発現株に対する過剰発現試験の代表的な結果 PUREタンパク質の数とサイズを 表2にまとめた。タンパク質番号21、24、27は、より良い視覚化のために星でマークされています。 この図の大きなバージョンを表示するには、ここをクリックしてください。
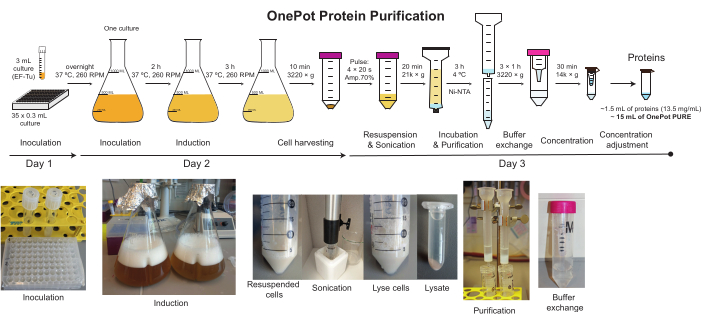
図2:OnePotタンパク質精製 OnePotタンパク質溶液の製造に関与するすべてのステップの模式的描写および対応する写真。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:異なるリボソーム変異体を用いた調製システムの性能(A)OnePotタンパク質溶液のクーマシーブルー染色SDS-PAGEゲル(レーン2、3)、タンパク質溶液なしのタグフリーリボソーム(レーン5、6)、タンパク質溶液(レーン8、9)、タンパク質溶液なしのリボソーム(レーン8、9)、タンパク質溶液なしのリボソーム(レーン11、12)と14のタンパク質溶液を用いた。1サンプルにつき2つの異なる濃度がロードされた。(B) ヒズタグリボソームとタグフリーリボソームのeGFP発現の比較in vitro eGFP発現の蛍光強度は、タグフリーリボソーム(1.8 μM、青)およびHisタグ付きリボソーム(0.62 μM、赤色)を使用してPURE反応を経て監視します。線形鋳型およびOnePotタンパク質溶液の濃度はそれぞれ4 nMおよび2mg/mLであった。パネル(C)および(D)は、タグフリー(1.8 μM、青、レーン3、4、5)とHisタグリボソーム(0.62 μM、赤、レーン6、7、8)で示されたOnePotで合成されたタンパク質のSDS-PAGEゲルを示し、それぞれ緑色のインビトロラベリングキット(C)で標識し、クーマスDと染色する)黒矢印は、合成タンパク質の予想バンドを示します: eGFP (26.9 kDa), ArgRS (64.7 kDa), T7 RNAP (98.9 kDa).線形鋳型およびOnePotタンパク質溶液濃度はそれぞれ4nMおよび1.6mg/mLであった。この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:260nmの吸光スペクトル タグフリーリボソームの疎水性相互作用精製中の260nmにおける吸光スペクトルの代表的な結果。 この図の大きなバージョンを表示するには、ここをクリックしてください。
表1: すべてのOnePot PUREソリューションの準備のための毎日の時間最適化スケジュール。 このテーブルをダウンロードするにはここをクリックしてください。
表2:PUREタンパク質リストこのテーブルをダウンロードするには、ここをクリックしてください。
補足表1:試薬 この表には、この研究で使用された試薬と成分の濃度、体積、およびその他の特定の詳細がリストされています。 このテーブルをダウンロードするには、ここをクリックしてください。
補足表 2: バッファー。 このスプレッドシートには、タンパク質、タグフリーリボソーム、Hisタグリボソーム精製のための正確なバッファー組成、および調製に使用されるストックソリューションの濃度がリストされています。さらに、バッファボリュームに基づいて必要なコンポーネントの量を計算します。 このテーブルをダウンロードするには、ここをクリックしてください。
補足表3:アミノ酸計算 このスプレッドシートには、エネルギー溶液に必要なアミノ酸と推奨ストック溶液濃度が記載されています。実際の重み付けされた質量に基づいて各アミノ酸に添加される水の量を算出し、また、最終的なアミノ酸の混合物に添加されるアミノ酸溶液の体積を計算する。 このテーブルをダウンロードするには、ここをクリックしてください。
補足表4:エネルギーソリューションのストックソリューション この表は、エネルギーソリューションに必要なストックソリューションの濃度と量を一覧表示し、貯蔵条件を含むさらなる詳細を示しています。 このテーブルをダウンロードするには、ここをクリックしてください。
補足表 5: エネルギーソリューション 次の表に、エネルギー溶液成分とその推奨濃度を示します。さらに、ストック溶液濃度とエネルギー溶液の体積に基づいて、最終解に追加される必要量を計算します。 このテーブルをダウンロードするには、ここをクリックしてください。
補足表 6: PCR. この表は、拡張PCRに使用されるプライマーの配列と濃度をリストし、高忠実度DNAポリメラーゼに最適化された融解温度とサーモサイクラーステップを示しています。 このテーブルをダウンロードするには、ここをクリックしてください。
補足表7:PURE反応。 スプレッドシートは PURE リアクションの設定例を示しています。タグフリーリボソームまたはHisタグリボソームを使用して、PURE反応に使用される濃度と成分の体積をリストします。また、タンパク質とリボソーム滴定の体積比を計算します。 このテーブルをダウンロードするには、ここをクリックしてください。
ディスカッション
ここで提示するプロトコルは、標準組成物15に基づいて多目的なPURE発現システム20を調製する、シンプルで時間的かつ費用対効果の高い方法を説明する。プロトコルを提供された毎日のスケジュール(表1)と一緒に利用することで、すべての成分を1週間で調製し、最大50010 μL PURE反応に十分な量の収量を得ることができます。このプロトコルで使用されるタンパク質は、高コピープラスミドから過剰発現しており、大腸菌に対する毒性が低いため、必要なすべてのタンパク質に対して良好な発現レベルが観察される(図1)。これにより、株の容易な調整が可能になり、したがって、コカルチャーにおけるタンパク質組成も、接種株20の比率を単に改変するだけである。リボソームタンパク質以外にも、EF-Tuの濃度は発現収率6において基本的に重要であることが示された。これに対し、他のタンパク質成分の濃度の変化は、PUREシステム7,24の堅牢性に対して比較的低い影響を及ぼしていた。従って、他のすべての成分に関してEF−Tuの接種比を調整することにより、標準PURE組成物と同等の組成物が達成でき、かつ同様の収率20を有するPURE系を達成することができる。タンパク質溶液を調製する際には、すべての株がうまく成長し、誘導後にコードされたタンパク質を過剰発現することが重要である(図1)。
リボソーム機能は、PUREシステム24の全体的な性能の鍵です。このプロトコルでは、リボソーム溶液を調製するための2つの異なる方法、すなわちタグフリーおよびHisタグ付きリボソーム精製が実証される。タグフリーリボソーム精製は、疎水性相互作用クロマトグラフィーに続いて、FPLC精製システムおよび超遠心分離機15へのアクセスを必要とするスクロースクッションによる遠心分離に基づいている。これに対し、Hisタグ付きリボソーム18 および重力流親和性クロマトグラフィー精製を利用した方法は、特殊な機器を必要とせず、ほとんどの研究室で行うことができる。したがって、後者の方法は、シンプルさとアクセシビリティなどの利点をもたらします。しかし、OnePot PUREでHisタグ付きリボソームを使用した場合、タグなしバリアントと比較して、合成収率が有意に低いことがわかった(図3)。アプリケーションの種類に基づいて、この低収率は許容できる場合があります。
エネルギー溶液は 、インビトロ TX-TL反応に燃料を供給するために必要な低分子量成分およびtRNAを提供する。このプロトコルは、ユーザーのニーズに基づいて簡単に調整できる典型的なエネルギーソリューションのレシピを提供します。tRNA、NTP、およびクレアチンリン酸と共に、Mg2+ イオンの豊富さと濃度は、トランスクリプションと翻訳の重要な要因であるため、PUREシステム8の全体的な性能にとって重要な存在でした。場合によっては、イオンの滴定が、したがって、全体的なPURE性能を大幅に向上させることができます。DNAの完全性は、PUREのパフォーマンスにとって非常に重要です。したがって、プロモーター領域、リボソーム結合部位、標的遺伝子を検証し、適切なDNA濃度(<2nM)を確保する配列は、PURE反応の設定中に生じる可能性のある問題のトラブルシューティングに役立ちます。
PUREシステムは最小限のTX-TLシステムであり、特定のアプリケーションは、このように追加の調整を必要とするかもしれません25.これらは、異なるRNAポリメラーゼ9、26、シャペロン13、およびEF-PまたはArfA8などのタンパク質因子を組み込むこともできる。これらのタンパク質に対する発現株は、コ培養物に含めることができるが、それらを調製されたシステムに別々に加えることは、必要なタンパク質レベルのより良い制御を提供するかもしれない。さらに、小胞の含みは、膜タンパク質10,11の産生に不可欠である。環境を還元するのではなく酸化し、ジスルフィド結合イソメラーゼは、適切なジスルフィド結合形成を促進し、例えば分泌タンパク質12に必要とされる。
追加の成分が反応を妨げないようにすることが不可欠です。反応を設定したり、他のコンポーネントを追加するときに注意を払う最も重要な要因を以下に示します。互換性のないバッファーが使用されず、イオン濃度が乱されていないことを確認します。グリセロール、カリウム、マグネシウム、カルシウムイオン、浸透糖、ピロリン酸塩、抗生物質、EDTAを含む溶液はできるだけ避けてください。例えば、DNA精製中に溶出バッファーを水に置き換えることは、この緩衝液中の一般的な添加剤であるEDTAとして有益であり得る。NTPやdNTPなどの追加の負電荷分子を溶液に供給するには、負に荷電した分子がキレート剤として動作し、正に荷電した分子に結合するため、マグネシウム濃度8を調整する必要があります。中性pHは反応に理想的である。したがって、すべてのコンポーネントは、対応するpHにバッファリングする必要があります。これは、特に、高酸性または塩基性分子(例えば、NTPなど)にとって重要です。良好な収率を達成するためには、34°C未満の温度が収率27を大幅に低下させるので、37°C付近の温度を実装する必要があります。
OnePot PURE を準備する前に、ターゲット アプリケーションと、ボリューム、純度、変更の容易さ、コンポーネントの含みやすさ、または省略などの関連する要件を考慮する必要があることに注意してください。多くのアプリケーションでは、システムは優れた選択肢になりますが、他のシステムには、収率、調整可能性、およびOnePotシステムでは提供できないその他の要因が必要な場合があります。これらのプロトコルは、このような準備のための重要なステップがすべてここに要約されるため、導入されたプロトコルは、任意の自家製システムの準備に有益です。
OnePotシステムの主な利点の1つは、市販のPURExpressシステムとの互換性であり、各PURExpressコンポーネントをOnePotと同等のコンポーネントに順次交換することで、すべてのコンポーネントの機能性と完全性を個別にテストする可能性があります。タンジーや簡単、高速、コスト効果の高い準備などのOnePot PUREシステムの利点は、無細胞TX-TLを世界中のより多くの研究所にアクセス可能にし、無細胞合成生物学におけるこの強力なプラットフォームの実装を拡大することに貢献します。
開示事項
著者らは、競合する財政的利益はないと宣言している。
謝辞
この研究は、欧州連合(EU)のHorizon 2020研究イノベーションプログラムグラント723106、スイス国立科学財団グラント(182019)、EPFLの下で欧州研究評議会によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 10x Tris/Glycine/SDS buffer | Bio-Rad Laboratories | 1610732 | |
| 15 mL centrifuge tubes | VWR International | 525-0309 | |
| 384-well Black Assay Plates | Corning | 3544 | |
| 4-20% Mini-PROTEANRTM TGXTM Precast Protein Gels | Bio-Rad Laboratories | 4561096 | |
| 50 mL centrifuge tubes | VWR International | 525-0304 | |
| 96-Well Polypropylene DeepWell plate | Nunc | 260252 | |
| Acetic acid, 99.8 % | Acros | 222140010 | |
| Äkta purifier | GE Healthcare | purification of tag free ribosomes | |
| AMICON ULTRA 0.5 mL - 3 KDa | Merck Millipore | UFC500324 | |
| AMICON ULTRA 15 mL - 3 KDa | Merck Millipore | UFC900324 | |
| Amino acids | Sigma-Aldrich | LAA21-1KT | |
| Ammonium chloride | Sigma-Aldrich | 09718-250G | |
| Ammonium sulfate | Sigma-Aldrich | A4418 | |
| Ampicillin | Condalab | 6801 | |
| BenchMark Fluorescent Protein Standard | ThermoFisher | LC5928 | |
| Breathe-Easy sealing membrane | Diversified Biotech | Z380059-1PAK | |
| Centrifuge tubes polycarbonate | Beckman | 355631 | purification of tag free ribosomes |
| Chill-out Liquid Wax | Bio-Rad Laboratories | CHO1411 | |
| Creatine phosphate | Sigma-Aldrich | 27920 | |
| DNA Clean & Concentrator-25 (Capped) | Zymo | ZYM-D4034-200TS | |
| DTT | SantaCruz Biotech | sc-29089B | |
| Econo-Pac Chromatography Columns | Bio-Rad Laboratories | 7321010 | |
| EDTA (Ethylenediaminetetraacetic acid) | Sigma-Aldrich | 03609-250G | |
| Eppendorf Protein LoBind microcentrifuge tubes | VWR International / Eppendorf | 525-0133 | |
| Falcon 14 mL Round Bottom Polystyrene Test Tube, with Snap Cap | Falcon | 352051 | |
| Flasks, baffled 1000 mL 4 baffles, borosilicate glass | Scilabware | 9141173 | |
| FluoroTect Green Lys in vitro Translation Labeling System | Promega | L5001 | optional |
| Folinic acid | Sigma-Aldrich | PHR1541 | |
| Glycerol | Sigma-Aldrich | G7757-1L | |
| HEPES | Gibco | 15630-056 | |
| HiTrap Butyl HP Column | GE Healthcare | 28411005 | purification of tag free ribosomes |
| IMAC Sepharose 6 Fast Flow | GE Healthcare | 17-0921-07 | |
| Imidazole | Sigma-Aldrich | I2399 | |
| InstantBlue | Expedeon | ISB1L-1L | |
| IPTG (Isopropyl-beta-D-thiogalactoside) | Alfa Aesar | B21149.03 | |
| Laemmli buffer (2x), sample buffer | Sigma-Aldrich | S3401-1VL | |
| Lysogeny broth (LB) media | AppliChem | A0954 | |
| Magnesium acetate | Sigma-Aldrich | M0631 | |
| Magnesium chloride | Honeywell Fluka | 63020-1L | |
| Nickel Sulfate | Alfa Aesar | 15414469 | |
| NTP | ThermoFisher | R0481 | |
| Phusion High-Fidelity DNA Polymerase (2 U/µL) | ThermoFisher | F530S | |
| Potassium chloride | Sigma-Aldrich | P5405-1KG | |
| Potassium glutamate | Sigma-Aldrich | 49601 | |
| PURExpress In Vitro Protein Synthesis Kit | NEB | E6800S | |
| PURExpress Δ Ribosome Kit | NEB | E3313S | |
| Quick Start Bradford 1x Dye Reagent | Bio-Rad Laboratories | 5000205 | |
| Rapid-Flow Sterile Single Use Vacuum Filter Units | ThermoFisher | 564-0020 | |
| RNaseA solution | Promega | A7973 | |
| SealPlate film | Excel Scientific | Z369659-100EA | |
| Sodium hydroxide | Sigma-Aldrich | 6203 | |
| Spermidine | Sigma-Aldrich | S2626 | |
| Sucrose | Sigma-Aldrich | 84097 | |
| TCEP (Tris(2-carboxyethyl)phosphin -hydrochlorid) | Sigma-Aldrich | 646547-10X1mL | |
| Thickwall Polycarbonate Tube | Beckman | 355631 | |
| Trichloroacetic acid | Sigma-Aldrich | T0699 | |
| Tris base | ThermoFisher | BP152-500 | |
| tRNA | Roche | 10109541001 | |
| Ultracentrifuge Optima L-80 | Beckman | purification of tag free ribosomes | |
| Whatman GD/X syringe filters | GE Whatman | WHA68722504 | |
| β-mercaptoethanol | Sigma-Aldrich | M6250-100mL |
参考文献
- Laohakunakorn, N., et al. Bottom-up construction of complex biomolecular systems with cell-free synthetic biology. Frontiers in Bioengineering and Biotechnology. 8, 213(2020).
- Laohakunakorn, N. Cell-free systems: a proving ground for rational biodesign. Frontiers in Bioengineering and Biotechnology. 8, 788(2020).
- Cho, E., Lu, Y. Compartmentalizing cell-free systems: toward creating life-like artificial cells and beyond. ACS Synthetic Biology. 9 (11), 2881-2901 (2020).
- Gaut, N. J., Adamala, K. P. Reconstituting natural cell elements in synthetic cells. Advanced Biology (Weinh). 5 (3), 2000188(2021).
- Shimizu, Y., et al. Cell-free translation reconstituted with purified components. Nature Biotechnology. 19 (8), 751-755 (2001).
- Li, J., Gu, L., Aach, J., Church, G. M. Improved cell-free RNA and protein synthesis system. PLoS One. 9 (9), 106232(2014).
- Kazuta, Y., Matsuura, T., Ichihashi, N., Yomo, T. Synthesis of milligram quantities of proteins using a reconstituted in vitro protein synthesis system. Journal of Bioscience and Bioengineering. 118 (5), 554-557 (2014).
- Li, J., et al. Dissecting limiting factors of the protein synthesis using recombinant elements (PURE) system. Translation. 5 (1), Austin, Tex. 1327006(2017).
- de Maddalena, L. L., et al. GreA and GreB enhance expression of Escherichia coli RNA polymerase promoters in a reconstituted transcription-translation system. ACS Synthethic Biology. 5 (9), 929-935 (2016).
- Kuruma, Y., Ueda, T. The PURE system for the cell-free synthesis of membrane proteins. Nature Protocols. 10 (9), 1328-1344 (2015).
- Jacobs, M. L., Boyd, M. A., Kamat, N. P. Diblock copolymers enhance folding of a mechanosensitive membrane protein during cell-free expression. Proceedings of the National Academy of Sciences of the Unites States of America. 116 (10), 4031-4036 (2019).
- Shimizu, Y., Kanamori, T., Ueda, T. Protein synthesis by pure translation systems. Methods. 36 (3), San Diego, Calif. 299-304 (2005).
- Niwa, T., Kanamori, T., Ueda, T., Taguchi, H. Global analysis of chaperone effects using a reconstituted cell-free translation system. Proceedings of the National Academy of Sciences of the Unites States of America. 109 (23), 8937-8942 (2012).
- Niwa, T., et al. Large-scale analysis of macromolecular crowding effects on protein aggregation using a reconstituted cell-free translation system. Frontiers in Microbiology. 6, 1113(2015).
- Shimizu, Y., Ueda, T. PURE technology. Methods in molecular biology. 607, Clifton, N.J. 11-21 (2010).
- Horiya, S., Bailey, J. K., Krauss, I. J. Directed evolution of glycopeptides using mRNA display. Methods in Enzymology. 597, 83-141 (2017).
- Villarreal, F., et al. Synthetic microbial consortia enable rapid assembly of pure translation machinery. Nature Chemical Biology. 14 (1), 29-35 (2018).
- Wang, H. H., et al. Multiplexed in vivo His-tagging of enzyme pathways for in vitro single-pot multienzyme catalysis. ACS Synthetic Biology. 1 (2), 43-52 (2012).
- Shepherd, T., et al. De Novo Design and synthesis of a 30-cistron translation-factor module. Nucleic Acids Research. 45 (18), 10895-10905 (2017).
- Lavickova, B., Maerkl, S. J. A Simple, robust, and low-cost method to produce the PURE cell-free system. ACS Synthetic Biology. 8 (2), 455-462 (2019).
- Ederth, J., Mandava, C. S., Dasgupta, S., Sanyal, S. A single-step method for purification of active his-tagged ribosomes from a genetically engineered Escherichia coli. Nucleic Acids Research. 37 (2), 15(2009).
- Gesteland, R. F. Isolation and characterization of ribonuclease I mutants of Escherichia coli. Journal of Molecular Biology. 16 (1), 67-84 (1996).
- Li, J., et al. Cogenerating synthetic parts toward a self-replicating system. ACS Synthetic Biology. 6 (7), 1327-1336 (2017).
- Matsuura, T., Kazuta, Y., Aita, T., Adachi, J., Yomo, T. Quantifying epistatic interactions among the components constituting the protein translation system. Molecular Systems Biology. 5, 297(2009).
- Libicher, K., Hornberger, R., Heymann, M., Mutschler, H. In vitro self-replication and multicistronic expression of large synthetic genomes. Nature Communications. 11 (1), 904(2020).
- Niederholtmeyer, H., Stepanova, V., Maerkl, S. J. Implementation of cell-free biological networks at steady state. Proceedings of the National Academy of Sciences of the United States of America. 110 (40), 15985-15990 (2013).
- Lavickova, B., Laohakunakorn, N., Maerkl, S. J. A partially self-regenerating synthetic cell. Nature Communications. 11 (1), 6340(2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved