Method Article
Бесклеточная система OnePot PURE
В этой статье
Резюме
Мы представляем быстрый и экономичный метод получения рекомбинантной бесклеточной системы PURE TX-TL с использованием стандартного лабораторного оборудования.
Аннотация
Определенная система транскрипции-трансляции PURE (синтез белка с использованием рекомбинантных элементов) обеспечивает привлекательное шасси для бесклеточной синтетической биологии. К сожалению, коммерчески доступные системы являются дорогостоящими, а их настраиваемость ограничена. Для сравнения, самодельный подход может быть настроен на основе потребностей пользователя. Однако приготовление самодельных систем является трудоемким и трудным из-за необходимости рибосом, а также 36 белковых чисток среднего масштаба. Оптимизация очистки белка путем кокультурирования и совместной очистки позволяет свести к минимуму временные и трудовые требования. Здесь мы представляем простой, настраиваемый, экономичный и экономичный метод производства всех компонентов системы PURE в течение 1 недели с использованием стандартного лабораторного оборудования. Кроме того, производительность OnePot PURE сопоставима с коммерчески доступными системами. Метод подготовки OnePot PURE расширяет доступность системы PURE для большего количества лабораторий благодаря своей простоте и экономической эффективности.
Введение
Бесклеточные транскрипционно-трансляционные системы (TX-TL) представляют собой перспективную платформу для исследования и проектирования биологических систем. Они обеспечивают упрощенные и настраиваемые условия реакции, поскольку они больше не зависят от жизнеобеспеспеивающих процессов, включая рост, гомеостаз или регуляторные механизмы1. Таким образом, ожидается, что бесклеточные системы будут способствовать исследованию биомолекулярных систем, предложат основу для тестирования рациональных стратегий биодизайна2и обеспечат шасси для будущей синтетической клетки3,4. Полностью рекомбинантная система PURE предлагает особенно привлекательное шасси благодаря своему определенному и минимальному составу, а также его регулируемости и настраиваемости5.
С тех пор, как в 2001 году была создана первая функциональная, полностью рекомбинантная система PURE5,были предприняты усилия по расширению границ системы и оптимизации состава системы для улучшения системы, дающей6,7,8,позволяющей транскрипционную регуляцию9,мембрану10,11 и секреторной синтез белка12,а также облегчить сворачивание белка13,14 . В настоящее время существует три коммерчески доступные системы: PUREfrex (GeneFrontier), PURExpress (NEB) и Magic PURE (Creative Biolabs). Однако эти системы являются дорогостоящими, их точный состав является запатентованным и, следовательно, неизвестным, а адаптивность ограничена.
Системы PURE, подготовленные на месте, оказались наиболее экономичным и настраиваемым вариантом15,16. Однако требуемые 37 этапов очистки белковых и рибосомных фракций являются трудоемкими и утомительными. Было предпринято несколько попыток повысить эффективность подготовки системы PURE17,18,19. Недавно мы продемонстрировали, что можно кокультурировать и совместно очищать все необходимые небибосомные белки, присутствующие в системе PURE. Этот метод OnePot оказался экономически эффективным и эффективным по времени, сократив время подготовки с нескольких недель до 3 рабочих дней. Подход генерирует систему PURE с производительностью белка, сопоставимой с коммерчески доступной системой PURExpress20. В отличие от предыдущих подходов к упрощению препарата PURE17,18,19,в подходе OnePot все белки по-прежнему экспрессируются в отдельных штаммах. Это позволяет пользователю настраивать состав системы OnePot PURE, просто пропуская или добавляя определенные штаммы или регулируя объемы прививки, тем самым генерируя системы ВЫпадения PURE или изменяя конечные соотношения белков, соответственно.
Протокол, представленный здесь, предоставляет подробный метод создания системы OnePot PURE, как описаноранее 20,хотя β-меркаптоэтанол был заменен трис(2-карбоксиэтил)фосфином (TCEP). Кроме того, описаны два способа очистки рибосом: традиционная очистка рибосом без меток с использованием гидрофобного взаимодействия и сахарозной подушки, адаптированная из Shimizu et al.15,и очистка рибосом Ni-NTA на основе Wang et al.18 и Ederth et al.21, но значительно модифицированная. Последний метод дополнительно облегчает подготовку системы PURE и делает ее доступной для большего количества лабораторий, поскольку требуется только стандартное лабораторное оборудование.
Экспериментальный протокол суммирует подготовку универсальной бесклеточной системы PURE TX-TL для обеспечения простой, перестраиваемой, экономически эффективной бесклеточной платформы, которая может быть подготовлена с использованием стандартного лабораторного оборудования в течение недели. Помимо введения стандартной композиции PURE, мы указываем, как и где она может быть скорректирована, уделяя основное внимание критическим шагам в протоколе для обеспечения функциональности системы.
протокол
ПРИМЕЧАНИЕ: Этот протокол описывает получение бесклеточной системы TX-TL из рекомбинантных компонентов. Для удобства работа разделена на пять частей. В первой части описываются этапы подготовки, которые должны быть выполнены перед началом протокола. Во второй части описывается приготовление белкового раствора OnePot. Третья часть описывает очистку рибосом, четвертая часть подробно описывает приготовление энергетического раствора, а последняя часть содержит руководство по настройке реакции PURE. Для удобства протоколы разделены на дни и сведены в ежедневные расписания в таблице 1. Следуя графику, вся система может быть подготовлена за 1 неделю одним человеком.
1. Предварительная работа
- Подготовьте бактериальные питательные среды и добавки к средам, как описано в дополнительной таблице 1. Подготовьте и стерилизуйте необходимые материалы, включая наконечники пипеток, 96 пластин для глубоких скважин.
- Подготовка штамма
- Преобразуйте выражения деформации, указанные в таблице 2, с соответствующими векторами выражений с помощью метода теплового удара.
- Добавьте очищенную плазмиду к химически компетентным бактериям и инкубировать на льду в течение 20-30 мин.
- Поместите смесь при 42 °C в течение 30 с (тепловой удар), а затем поместите ее обратно на лед на 2 мин.
- Пипетка 20 мкл бактерий непосредственно на агаровые пластины, содержащие ампициллин (АМФО), и инкубируют при 37 °C в течение ночи. Хранить пластины при 4 °C до 1 недели.
- Инокулируют 3 мл LB-среды, содержащей AMP, одной колонией бактерий из агаровых пластин. Насиживать при 37 °C при встряхивании при 260 об/мин в течение ночи.
- Смешайте 250 мкл культуры с 250 мкл 50% (v/v) глицерина и храните при -80 °C.
ПРИМЕЧАНИЕ: Для более быстрой подготовки в будущем храните штаммы в 96-колодезной пластине в виде запасов глицерина.
- Подтвердить все векторные превращения с помощью колониальных ПЦР и секвенирования. Секвенировать ген, промоторную область и сайт связывания рибосом.
- Преобразуйте выражения деформации, указанные в таблице 2, с соответствующими векторами выражений с помощью метода теплового удара.
- Экспресс-тест
- Инокулируют 300 мкл среды LB, содержащей AMP, примерно 1 мкл подготовленных запасов глицерина в пластине глубиной 1,3 мл. Запечатайте пластину дышащей мембраной, а затем инкубируют при 37 °C, встряхивая при 260 оборотах в минуту в течение ночи.
ПРИМЕЧАНИЕ: На этом этапе все выражения выполняются отдельно. - Инокулируют 300 мкл свежей ЛБ среды, содержащей АМП, 1 мкл ночных культур. Насиживать при 37 °C при встряхивании при 260 об/мин в течение ночи. Через 2 ч индуцируют клетки 100 мкМ изопропила β-D-1-тиогалакопиранозида (IPTG) и растут еще 3 ч.
- Смешайте 10 мкл культуры с 10 мкл 2x буфера Laemmli и нагревайте до 95 °C в течение 10 мин. Раскрутите образцы в течение 1 мин с помощью настольной центрифуги и загрузите 10 мкл супернатанта на гель PAGE. Запустите гель в буфере Tris/Glycine/SDS при 200 В в течение 30 мин. Хорошо промойте его деионизированной водой. Покрыть гель протеиновым пятном Кумасси и инкубировать в течение 1 ч. При необходимости размяните гель в воде (репрезентативные результаты для экспрессивного теста на рисунке 1).
ПРИМЕЧАНИЕ: Используйте градиентные (4%-15% или 4%-20%) гели PAGE для достижения хорошего разделения.
- Инокулируют 300 мкл среды LB, содержащей AMP, примерно 1 мкл подготовленных запасов глицерина в пластине глубиной 1,3 мл. Запечатайте пластину дышащей мембраной, а затем инкубируют при 37 °C, встряхивая при 260 оборотах в минуту в течение ночи.
- Восстановление и очистка смолы Сефарозы IMAC
- Подготовка колонны.
- Хорошо перемешайте смолу Сефарозы путем вихря.
- Пипетка необходимого количества смолы в пустую колонку гравитационного потока.
ПРИМЕЧАНИЕ: Количество необходимой смолы варьируется между очисткой Гис-рибосом и очисткой белка и указано в соответствующих разделах. - Промыть смолу 30 мл деионизированной воды.
- Перезачисляем плату за колонку, как указано в разделе 1.4.4.
ПРИМЕЧАНИЕ: Всегда позволяйте всей жидкости проходить через колонну, прежде чем переходить к следующему шагу. Однако убедитесь, что колонна никогда не пересыхает. Всякий раз, когда жидкость проходит через колонну, убедитесь, что вы остановили поток или переходите к следующему шагу, как только жидкость достигнет смолы.
- Восстановление.
- Промыть колонну 30 мл деионизированной воды.
- Применяют 10 мл раствора 0,2 М ЭДТА и 0,5 М Раствор NaCl.
- Добавьте 30 мл раствора NaCl 0,5 М.
- Промыть колонну 50 мл деионизированной воды.
- Хранить в 20% (v/v) этаноле при 4 °C или продолжить следующий этап.
- Чистка.
ВНИМАНИЕ: Носите защитное снаряжение.- Промыть колонну 30 мл 0,5 М NaOH.
- Промыть колонну 30 мл деионизированной воды.
- Промыть колонну 30 мл 0,1 М уксусной кислоты.
- Промыть колонну 30 мл деионизированной воды.
- Промыть колонну 30 мл 70% (v/v) этанола.
- Промыть колонну 50 мл деионизированной воды.
- Хранить в 20% (v/v) этаноле при 4 °C или продолжить следующий этап.
- Подзарядка.
- Добавить в колонку 10 мл раствора 0,1 М раствора сульфата никеля.
ВНИМАНИЕ: Сульфат никеля токсичен. Отходы сульфата никеля должны быть выброшены с соблюдением мер предосторожности, указанных поставщиком. - Промыть колонну 50 мл деионизированной воды.
- Хранить в 20% ((v/v)) этаноле при 4 °C или продолжать с уравновешивать колонку.
ПРИМЕЧАНИЕ: Если колонка хранится в этаноле между этапами, обязательно удалите все следы этанола, промыв столб водой.
- Добавить в колонку 10 мл раствора 0,1 М раствора сульфата никеля.
- Подготовка колонны.
2. Экспрессия и очистка белкового раствора OnePot
ПРИМЕЧАНИЕ: Протокол состоит из трех частей, разделенных на дни(рисунок 2). Идеальная процедура приготовления производит 1,5 мл 13,5 мг/мл белкового раствора OnePot, что соответствует более чем одной тысяче 10 мкл PURE реакций. Однако количество и идеальная концентрация раствора будут варьироваться от партии к партии. Опытные пользователи могут выполнять несколько препаратов OnePot PURE одновременно.
День 1:
- Приготовьте бактериальные питательные среды и добавки к средам, как описано в дополнительной таблице 1.
- Подготовьте и стерилизуйте необходимые материалы, включая наконечники пипеток, две пластины из глубоких скважин на 96 и одну 1-литую колбу Эрленмейера.
- Подготовьте буферы и добавки, как описано в дополнительной таблице 2. Фильтр стерилизует все буферы с помощью бутылочных верхних фильтров (0,45 мкм) и хранит их при 4 °C. Дополняйте все буферы 1 мМ TCEP непосредственно перед использованием, если не указано иное.
- Используйте 2 мл сефарозной смолы для очистки белка OnePot. Подготовьте столбец, как описано в разделе 1.4.
- Для приготовления заквасок соедините 20 мл среды LB с 20 мкл AMP. В стерильной пластине глубиной 96, 1,3 мл добавьте 300 мкл среды в 35 скважин. Инокулируйте каждый из них соответствующей деформацией, за исключением термостабильного коэффициента удлинения (EF-Tu), и запечатайте пластину дышащей мембраной.
ПРИМЕЧАНИЕ: Привить пластину с помощью репликатора с 96 скважинами (см. Таблицу материалов). Объем скважины глубокой плиты скважины и объем закваски имеют важное значение. Большие объемы среды или меньшие объемы скважин приведут к различной бактериальной плотности из-за несоответствий аэрации. - Для культуры EF-Tu привить 3 мл среды LB в культурную трубку 14 мл с защелкиванием колпачка. Одного 3 мл культуры для EF-Tu достаточно для одной культуры выражения OnePot.
- Насиживать при 37 °C при встряхивании при 260 об/мин в течение ночи.
День 2:
ПРИМЕЧАНИЕ: Выполните все шаги при комнатной температуре, если не указано иное.
- Перенесите 500 мл LB-среды и 500 мкл AMP в стерильную перемешанный колбу.
- Инокулируют культуру OnePot PURE 1675 мкл культуры EF-Tu и 55 мкл каждой из культур из пластины глубокой скважины(таблица 2).
ПРИМЕЧАНИЕ: На этом этапе общий состав белка может быть скорректирован путем настройки коэффициентов прививки. Убедитесь, что общий объем прививки остается постоянным на уровне 3,6 мл.
ДОПОЛНИТЕЛЬНО: Чтобы подтвердить, что все штаммы выросли за ночь, измерьте оптическую плотность ночных культур на уровне 600 нМ (OD600)в 96-скважинной пластине с помощью пластинчатого считывателя. Используйте разбавление 10x для измерения оптической плотности. - Инкубировать культуру в течение 2 ч при 37 °С с встряхиванием 260 об/мин или до тех пор, пока OD600 культуры не достигнет 0,2-0,3.
- Индуцируют культуру с 500 мкл 0,1 мМ IPTG и растут еще 3 ч.
- Собирают клетки центрифугированием при 4 °C и 3220 х г в течение 10 мин и хранят гранулу ячейки при -80 °C до дальнейшего использования.
ПРИМЕЧАНИЕ: Для оптимизации сроков подготовьте энергетический раствор, описанный в разделе 4, во время инкубации на 2-й день(таблица 1).
День 3:
- Измерьте количества буферов, необходимых для очистки, описанных на этапах ниже, и добавьте TCEP ко всем из них, как указано в дополнительной таблице 2. Храните оставшиеся буферы без TCEP при 4 °C для будущих очистк.
- Уравновешивают заряженную колонну (секция 2.4) 30 мл буфера А. После того, как 25 мл буфера А пройдут, закройте колонну снизу. Параллельно переходите к шагам 2.15-2.17.
- Разморозить клетки и использовать серологическую пипетку для повторного суспендирования клеточной гранулы в 7,5 мл буфера А.
- Различите ячейки с помощью 130-ваттного зондового ультразвукового аппарата (см. Таблицу материалов,диаметр наконечника зонда: 6 мм) со следующими параметрами: 4 x 20 с импульс включен, импульс 20 с выключен, амплитуда 70%. Если ультразвуковая ю прошла успешно, решение станет темнее(рисунок 2).
ПРИМЕЧАНИЕ: Убедитесь, что клетки хранятся на льду во время ультразвуковой работы. Поместите зонд достаточно глубоко в раствор, не касаясь трубки. Если образуется большое количество пены, передача энергии будет демпфирована. В этом случае дайте пене осесть, опустите зонд глубже в раствор и продлите время ультразвуковой работы. - Удаляют остатки клеток центрифугированием при 21130 х г в течение 20 мин при 4 °C сразу после ультразвуковой обшивки. Держите лисат на льду.
- Добавьте супернатант в уравновешивающий столбец. Закройте колонну сверху и убедитесь, что нет утечки. Инкубируют колонну в течение 3 ч при 4 °C при вращении с помощью трубчатого ротатора.
- Элюйте несвязанные компоненты из колонны и промывайте 25 мл буфера А.
- Промыть колонну 25 мл имидазолового буфера 25 мМ (23,95 мл буфера А и 1,25 мл буфера В).
- Элюдирует белки с помощью 5 мл имидазолового буфера 450 мМ (0,5 мл буфера А и 4,5 мл буфера В). Всегда держите элюированные белки на льду.
- Разбавить элюат 25 мл HT буфера, держите смесь на льду. Добавьте 15 мл в центробежный фильтр объемом 15 мл и концентрат в объеме 1,5 мл. Оставшиеся 15 мл добавляют в фильтр с концентрированным раствором и еще раз концентрируют до 1,5 мл.
- Добавьте 10 мл HT-буфера к концентрированной пробе и сконцентрируйте до 1 мл. Добавьте равное количество запасного буфера B и храните при -80 °C до дальнейшего использования.
ПРИМЕЧАНИЕ: Один раунд обмена/концентрации занимает около 60 мин вращения при 3220 х г при 4 °C. - Во время буферного обмена восстановите столбец, как указано в разделе 1.4.
День 4:
- Измерьте концентрацию белка с помощью анализа Брэдфорда, как описано поставщиком. Сконцентрировать образец с помощью отсечкового центробежного фильтра 0,5 мл 3 кДа до 20 мг/мл.
ПРИМЕЧАНИЕ: Разбавьте белковый раствор в 25 или 50 раз перед измерениями концентрации, чтобы избежать перенасыщения анализа Брэдфорда. - Чтобы установить идеальную концентрацию белка, выполните экспресс-тест на этом этапе (раздел 5.2) с различными концентрациями белкового раствора. Для выполнения титрования держите общий объем раствора постоянным и пипетку белкового раствора OnePot, включая запасной буфер B, в пяти различных соотношениях(Дополнительная таблица 7).
- Проверьте белковую композицию OnePot PURE с помощью SDS-PAGE(рисунок 3A). Разбавить 2,5 мкл образца 7,5 мкл воды, смешать с 10 мкл 2x буфера Laemmli, а затем загрузить 5 мкл и 2,5 мкл образцов в гель. Запустите SDS-PAGE, как указано в разделе 1.3.3.
- Аликвотирование белкового раствора в 50 мкл аликвот после проверки экспрессии и корректировки концентрации. Храните белковый раствор OnePot PURE при -80 °C до дальнейшего использования.
ПРИМЕЧАНИЕ: Если предполагается, что белковый компонент отсутствует или присутствует в более низкой, чем ожидалось, концентрации в OnePot PURE, выполните следующие действия. - Проверьте, росла ли ночная культура соответствующего штамма со скоростью, сопоставимой с другими культурами, выполняя измерения оптической плотности (OD600)всех культур.
- Выполните дополнительный экспресс-тест конкретного штамма, чтобы проверить экспрессию подозрительного белка.
3. Рибосомный раствор
ПРИМЕЧАНИЕ: Введены две различные стратегии очистки рибосом, одна для гексаистидин-метки и одна для неметированных рибосом. Основным преимуществом метода очистки с использованием His-очистки на стандартной сродной ni-NTA гравитационной проточной колонне является то, что очистка проста, быстра и не требует дополнительного лабораторного оборудования, такого как система FPLC и ультрацентрифуга. Тем не менее, способность производства белка в реакциях OnePot PURE составляет около одной трети по сравнению с рибосомами без меток. Поэтому выбирайте способ получения рибосом исходя из того, важен ли высокий выход для данного применения.
-
Его метка рибосомная очистка
ПРИМЕЧАНИЕ: Этот протокол использует штамм E. coli RB1, подарок от профессора Ванга (Колумбийский университет, США)18. Этот штамм имеет геномную вставку гексаистидиновой метки на конце C рибосомального белка 50S (L7 / L12), что позволяет очищать с использованием колонки гравитационного потока Ni-NTA. Обычный выход составляет около 0,5 мл рибосом 3,45 мкМ, что достаточно для более чем пятисот 10 мкл реакций PURE.
День 1:
- Приготовьте бактериальные питательные среды и добавки к средам, как описано в дополнительной таблице 1.
- Подготовьте и стерилизуйте необходимые материалы, включая наконечники пипеток, одну колбу Эрленмейера объемом 5 л и одну колбу Эрленмейера объемом 100 мл.
- Подготовьте буферы и добавки, как описано в дополнительной таблице 2. Фильтр стерилизует все буферы с помощью бутылочных верхних фильтров (0,45 мкм) и хранит их при 4 °C.
День 2:
- Пипетку 5 мл смолы на столбец и подготовьте столбец, как указано в разделе 1.4.
ПРИМЕЧАНИЕ: Из-за большего объема смолы восстановление и очистка занимают значительно больше времени. Используйте другую колонку для очистки рибосом, чтобы избежать перекрестного загрязнения и тщательно очистите ее перед очисткой. - Приготовьте ночную культуру штамма E. coli RB1 путем инокуляции 35 мл среды LB в колбу Эрленмейера 100 мл. Инкубировать при 37 °C при встряхивании при 260 об/мин.
День 3:
ПРИМЕЧАНИЕ: Выполните все шаги при комнатной температуре, если не указано иное.
- Добавьте 2 л lb-среды в 5-литую колбу, привите 12 мл ночной культуры, а затем инкубируйте в течение 3-4 ч при 37 °C при встряхивании при 260 об/мин.
ПРИМЕЧАНИЕ: В качестве альтернативы, выполнить бактериальное культивирование в 4 х 500 мл культур в 1 л сбитых колбах. - Гранулируют ячейки центрифугированием в течение 10 мин при 3220 х г и 4 °C. Хранить при -80 °C до дальнейшего использования.
День 4:
- Уравновешивают колонку, подготовленную на этапе 3.1.4. с 30 мл лизисного буфера.
- Повторно суспендируют гранулу в 20 мл лизисного буфера с помощью серологической пипетки.
- Разжижайте ячейки с помощью 130-ваттного зондового ультразвукового устройства (см. Таблицу материалов,диаметр наконечника зонда: 6 мм) на льду со следующими параметрами: импульс 11 х 20 с; 20 с импульса выключено, амплитуда 70% (подробности процедуры см. на шаге 2.16).
- Сразу после ультразвуковой мушки удаляют остатки клеток центрифугированием в течение 20 мин при 21130 х г при 4 °C. Держите лисат на льду.
- Загрузите супернатант в колонны и пропустите его.
- Промыть колонну следующими смесями буферов лизиса и элюирования.
- Промывка 0: используйте 30 мл лизисного буфера.
- Промывка 1: используйте 30 мл имидазола 5 мМ (29 мл лизисного буфера, 1 мл буфера элюирования).
- Промывка 2: использовать 60 мл имидазола 25 мМ (50 мл лизисного буфера, 10 мл буфера элюирования).
- Промывка 3: использовать 30 мл имидазола 40 мМ (22 мл лизисного буфера, 8 мл буфера элюирования).
- Промывка 4: использовать 30 мл имидазола 60 мМ (18 мл лизисного буфера, 12 мл буфера элюирования).
- Элюируют рибосомы 7,5 мл буфера элюдения. Всегда держите элюированные белки на льду.
- Добавьте 22 мкл чистого β-меркаптоэтанола к 45 мл рибосомного буфера.
ВНИМАНИЕ: β-меркаптоэтанол токсичен. Примите меры предосторожности и работайте в вытяжном вытяжке. - Добавьте элюат в центробежный фильтр 15 мл и сконцентрируйте до 1 мл.
- Добавьте 15 мл рибосомного буфера к концентрированной пробе и снова сконцентрируйте до 1 мл.
ПРИМЕЧАНИЕ: Повторите предыдущий шаг дважды. - Хранить при -80 °C до дальнейшего использования.
ПРИМЕЧАНИЕ: Один раунд обмена/концентрации занимает около 60 мин центрифугирования при 3220 х г при 4 °C. - Во время буферного обмена восстановите столбец, как указано в разделе 1.4.
День 5:
- Определение концентрации рибосом путем измерения абсорбирующей силы при 260 нМ образца, разбавленного 1:100 в буфере рибосом. Величина абсорбции 10 разбавленного раствора соответствует 23 мкМ неразбавленному раствору, как описаноранее 16.
- Ввести конечную концентрацию запаса 3,45 мкМ. Для регулировки концентрации рибосомы разбавляют рибосомным буфером или концентрируют их дополнительно центрифугированием при 14000 х г в центробежном фильтре 3 кДа 0,5 мл при 4 °C.
ПРИМЕЧАНИЕ: Для достижения оптимальной экспрессии системы проводят титрование концентрации рибосом (раздел 5.2, дополнительная таблица 7). - Проверьте состав рибосом с помощью SDS-PAGE(рисунок 3A),как указано в разделе 1.3.3. Разбавьте 2,5 мкл образца 7,5 мкл воды, смешайте с 10 мкл 2x буфера Laemmli, а затем загрузите 5 мкл и 2,5 мкл образцов на гель.
-
Очистка рибосом без меток
ПРИМЕЧАНИЕ: Очистка рибосом без меток выполняется с использованием системы FPLC(Таблица материалов)и основана на гидрофобной хроматографии взаимодействия с использованием 2 х 5 мл бутильных столбцов(Таблица материалов). Хотя рибосомы могут быть очищены от любого штамма, использование штамма E. coli A19 (генетические ресурсыE. coli в Йельском университете CGSC) является выгодным из-за его удаления RNase I22. Выполните очистку при 4 °C в холодильной камере или в охлаждающем шкафу. Обычный выход составляет около 0,5 мл рибосом 10 мкМ, что соответствует более чем пятистам 10 мкл реакций PURE.
День 1:
- Приготовьте бактериальные питательные среды и добавки к средам, как описано в дополнительной таблице 1.
- Подготовьте и стерилизуйте необходимые материалы, включая наконечники пипеток, колбу Эрленмейера объемом 5 л и колбу Эрленмейера объемом 100 мл.
- Подготовьте буферы и добавки, как описано в дополнительной таблице 2. Фильтр стерилизует все буферы с помощью бутылочных верхних фильтров (0,45 мкм) и хранит их при 4 °C.
День 2:
- Чтобы приготовить ночную культуру штамма E. coli A19, привите 35 мл среды LB в колбу Эрленмейера 100 мл. Инкубировать при 37 °C при встряхивании при 260 об/мин.
День 3:
- Переложите 2 л ЛБ среды в 5 л стерильную перемешанный колбу, привите 30 мл ночной культуры, а затем инкубируйте в течение 3-4 ч при 37 °C при встряхивании при 200 об/мин.
- Гранулируют ячейки центрифугированием при 4000 х г в течение 15 мин при 4 °С. Повторно суспендируют гранулы в 25 мл суспензионного буфера и хранят при -80 °C до дальнейшего использования.
День 4:
- Выполните шаги 3.2.8-3.2.12 параллельно с шагами 3.2.13-3.2.19.
- Оттаивайте и лизируйте ячейки с помощью 130-ваттного зондового ультразвукового аппарата (см. Таблицу материалов и диаметр наконечника зонда: 6 мм) на льду со следующими параметрами: импульс 12 x 20 с; Импульс выключен 20 с, амплитуда 70% (см. шаг 2.16 подробностей процедуры).
- Немедленно удаляют остатки клеток центрифугированием при 20000 х г в течение 20 мин при 4 °C.
- Аспирировать супернатант и измерить объем. Добавьте равный объем буфера суспензии (с высоким содержанием соли) для регулировки конечной концентрации сульфата аммония до 1,5 М и хорошо перемешайте.
- Удаляют осадок центрифугированием при 20000 х г в течение 20 мин при 4 °C.
- Отфильтруйте супернатант с помощью мембранного шприцевого фильтра полиэфирсульфона 0,45 мкм перед очисткой FPLC и соберите фильтрат в стеклянную бутылку объемом 100 мл. Держите супернатант при 4 °C в любое время.
- Настройте систему FPLC для очистки хроматографии гидрофобного взаимодействия с использованием двойной бутиловой колонки (2 х 5 мл) следующим образом. Для этой установки объем одного столбца (CV) относится к объему 10 мл.
- Потребуется три входа: два в качестве буферных линий и один в качестве линии образца. Благодаря настройкам очистителя по умолчанию удобно выбирать линии A1 и B1 для буфера C и buffer D соответственно, а также строку A2 в качестве выборочной линии. Применяйте расход по умолчанию 4 мл/мин, за исключением промывок насоса (10 мл/мин) или если не указано иное.
ПРИМЕЧАНИЕ: Поскольку TCEP является дорогостоящим реагентом, добавляйте соответствующее количество к буферам C и D только после этапа уравновешивания. - Выполните промывку системного насоса в 20% ((v/v)) этаноле, чтобы очистить систему и удалить потенциальное загрязнение от предыдущих очистк. Вручную установите расход 0,2 мл/мин и установите колонну. Остановите поток.
- Выполните промывку системного насоса водой. Вымойте колонну 3 CV воды.
- Уравновешивание: поместите входы A1 и A2 в буфер C и вход B1 в буфер D без TCEP. Выполните промывку насоса и уравновесьте колонну 4 CV буфера C.
- Добавьте TCEP в буферы C и D.
- Подготовьте трубки по 15 мл или очистите круглые фракционные коллекторные трубки к коллектору фракций для сбора фракций элюирования 4-5 мл.
- Загрузка: Поместите вход A2 в бутылку с отфильтрованным образцом. Загрузите примерно 90% объема образца на колонку. Разбавьте образец 20 мл TCEP-содержащего буфера C и загрузите 10 мл образца на колонку. Повторите этап разбавления по крайней мере дважды и загрузите в колонну как можно больше пробы. Очень важно убедиться, что воздух не всасывается в машину.
- Этап стирки 1: промыть 3 CV буфера C для удаления несвязаных компонентов.
- Этап стирки 2: промывка с 5 CV 80% буфера C и 20% буфера D.
- Элюирование: элюируют продукт, применяя 50% буфера C и 50% буфера D, с общим объемом элюирования 5 CV. Соберите эту фракцию в коллекторные трубки.
- Этап промывки 3: Элюйте все сильно взаимодействующие загрязняющие вещества с использованием 100% буфера D общим объемом 5 CV.
- Анализ спектра поглощения фракции образца при 260 или 280 нМ(рисунок 4). Первый пик показывает неусвоенные белки, элюированные во время загрузки и первой ступени промывки; второй пик показывает загрязняющие вещества, которые были элюированы во время второй ступени промывки. Третий пик контролирует конечный продукт, а последний пик показывает сильно взаимодействующие загрязняющие вещества. Объедините все фракции образца, соответствующие третьему пику, для дальнейшей обработки. Всегда держите элюированные белки на льду.
- Аккуратно наложите восстановленную фракцию на 15 мл буфера подушки в четырех ультрацентрифугированных трубках из поликарбоната. Добавьте максимум 15 мл образца к 15 мл буфера подушки. Убедитесь, что вес трубки хорошо сбалансирован. Гранулирование рибосом ультрацентрифугированием при 100000 х г при 4 °С в течение 16 ч.
ПРИМЕЧАНИЕ: Убедитесь, что в ультрацентрифугационных трубках нет трещин. - Очистите и сбросьте столбец следующим образом. Скорость потока 5 мл/мин работает хорошо. Поместите все впускные вводы и выполните промывку насоса. Вымойте колонну 2 CV воды.
- Поместите вход в раствор NaOH 0,5 М, выполните промывку насоса, а затем промыть колонну с 3 CV NaOH.
- Поместите впускное отверстие в воду, выполните промывку насосом, а затем промыть колонну в 2 CV воды.
- Поместите на входное отверстие в 0,1 М раствор уксусной кислоты, выполните промывку насоса, а затем промыть колонну 3 CV раствора уксусной кислоты.
- Насос мойте и мойте колонну 2 CV воды.
- Поместите все входы в 20% ((v/v)) этанол, выполните этап промывки насоса и храните колонку в 20% ((v/v)) этаноле, промыв ее 3 CV 20% ((v/v)) раствора этанола.
ПРИМЕЧАНИЕ: Убедитесь, что система никогда не высыхает и не всасывает воздух. Никогда не применяйте буфер непосредственно к этанолу или этанол к буферу. Всегда добавляйте шаг промывки водой между ними, так как в противном случае существует риск засорения колонны осадками. Обязательно добавьте достаточное количество пробирок для сбора проб.
День 5:
- Выбросьте супернатант и осторожно, не нарушая полупрозрачную гранулу, промыть каждую гранулу 0,5 мл ледяного рибосомного буфера. Повторите этот шаг дважды.
- Повторно суспендируют каждую из прозрачных гранул в 100 мкл буфера рибосом на льду с помощью магнитного перемешивания (диаметр 3 мМ, длина 10 мМ) на магнитной мешалке с минимально возможной скоростью. Соберите повторно суспендированные рибосомы и промыть трубки дополнительными 50 мкл рибосомного буфера.
ПРИМЕЧАНИЕ: Полупрозрачную гранулу трудно увидеть. Поэтому тщательно промывайте гранулу с боков трубки. - Определение концентрации рибосом путем измерения абсорбции при 260 нМ образца, разбавленного в соотношении 1:100 в рибосомном буфере. Абсорбцию 10 разбавленного раствора соответствует 23 мкМ неразбавленному раствору, как описаноранее 16.
- Внедрить конечную концентрацию запаса 10 мкМ. Для регулировки концентрации разбавляют рибосомы рибосомным буфером или концентрируют их дополнительно центрифугированием при 14000 х г в центробежном фильтре 3 кДа при 4 °C.
ПРИМЕЧАНИЕ: Для достижения оптимальной экспрессии системы проводят титрование рибосом (раздел 5.2, дополнительная таблица 7). - Проверьте состав рибосом с помощью SDS-PAGE(рисунок 3A),как указано в разделе 1.3.3. Разбавить 2,5 мкл образца 7,5 мкл воды, смешать с 10 мкл 2x буфера Laemmli, а затем загрузить 5 мкл и 2,5 мкл образцов в гель.
4. Энергетическое решение
ПРИМЕЧАНИЕ: Представленная здесь композиция для 2,5-кратного энергетического раствора является примером раствора, который хорошо работал для стандартной реакции TX-TL. Чтобы оптимизировать сроки, подготовьте энергетический раствор в течение 2 дня. Приготовление раствора аминокислот подробно объясняется с последующей заключительной процедурой приготовления.
- Раствор аминокислот
ПРИМЕЧАНИЕ: Приготовьте раствор аминокислоты навалом. Приготовление количества растворов аминокислотного запаса, необходимого для конечного объема не менее 2000 мкл, уменьшит погрешность взвешивания для очень небольших количеств. Общая концентрация раствора аминокислот ограничена растворимостью аминокислот и соответствующими концентрациями в растворе. Для стандартной системы PURE готовят раствор с конечной концентрацией 3,25 мМ. Используйте таблицу расчета аминокислотного раствора (Дополнительная таблица 3) в качестве шаблона. Используют цистеин в виде соли для обеспечения достаточной растворимости. Избегайте использования методов приготовления аминокислот на основе KOH. Можно непосредственно взвесить точное количество аминокислот в конечный раствор аминокислот без приготовления запасного раствора для всех аминокислот. Однако это более сложно и менее точно.- Готовят стоковые растворы для каждой аминокислоты, как описано в дополнительной таблице 3,за исключением тирозина.
ПРИМЕЧАНИЕ: Из-за различной растворимости аминокислот в воде соответствующие рекомендуемые концентрации запасного раствора различаются. - Минимальная масса [мг] обеспечивает приблизительную минимальную массу, необходимую для получения достаточного количества запасного раствора для целевого общего объема, в качестве эталона.
ПРИМЕЧАНИЕ: Минимальная масса рассчитывается с избытком 10%. - Для более легкого приготовления растворов не взвешивайте точное количество аминокислоты, а вместо этого, для массы под рукой, отрегулируйте количество воды для достижения желаемой концентрации. Рассчитайте необходимое количество деионизированной воды (воды для добавления [мкл]) на основе фактической заполненной массы (светло-желтые ячейки) и желаемой концентрации с помощью электронной таблицы в дополнительной таблице 3.
- Солюбилизируйте растворы аминокислот путем вихря до тех пор, пока весь осадок не растворится. Отдельные растворы аминокислот могут храниться при -20 °C в течение нескольких недель.
ПРИМЕЧАНИЕ: Некоторые аминокислоты трудно растворяются в воде; процесс может занять некоторое время. - Взвесьте точное количество тирозина, необходимое для получения конечной концентрации 3,25 мМ непосредственно в пробирке для раствора аминокислоты.
ПРИМЕЧАНИЕ: Тирозин очень трудно растворить в воде. Добавьте его напрямую, а не готовь складской раствор. - Добавьте соответствующие количества растворов аминокислотного запаса и воды, как указано в окончательном объеме, чтобы добавить колонку [мкл] (светло-голубые клетки) и хорошо вихрь раствора. Хранить готовый раствор аминокислоты при -80 °C до дальнейшего использования.
- Готовят стоковые растворы для каждой аминокислоты, как описано в дополнительной таблице 3,за исключением тирозина.
- Приготовление энергетического раствора
ПРИМЕЧАНИЕ: В общей сложности 2,5-кратный энергетический раствор содержит 0,75 мМ каждой аминокислоты, 29,5 мМ ацетата магния, 250 мМ глутамата калия, 5 мМ АТФ и ГТФ каждый, 2,5 мМ CTP, UTP и TCEP, соответственно, 8,75 мг/мл тРНК из E. coli MRE 600, 50 мМ креатинфосфата, 0,05 мМ фолиновой кислоты, 5 мМ спермидина и 125 мМ HEPES. Первые пользователи готовят энергетический раствор небольшими партиями по 200 мкл. Храните отдельные растворы, приготовленные в соответствии с дополнительной таблицей 4, при -20 °C или -80 °C для последующего использования.- Разморозить на льду все водные растворы, упомянутые в Дополнительной таблице 5.
- Тем временем подготовьте складовые решения для остальных компонентов, перечисленных в Дополнительной таблице 4. Все растворы после приготовления держите на льду.
ПРИМЕЧАНИЕ: Добавьте 500 мкл воды без РНКазы и ДНКазы непосредственно во флакон для растворения лиофилизированных тРНК. Хорошо перемешать мягким вихрем; ограничить пипетирование, чтобы избежать введения РНКаз. - Сложите рассчитанные объемы(Дополнительная таблица 5)запасов растворов и воды и хорошо перемешайте с помощью вихря. Всегда держите раствор на льду.
- Измерьте рН раствора, пипетируя 1 мкл на полосу рН, чтобы убедиться, что рН раствора нейтрален.
- Аликвот энергетический раствор по 50-100 мкл на пробирку на льду и хранят при -80 °С до дальнейшего использования. Во время аликвотирования часто вихряйте основной запас, чтобы предотвратить осаждение компонентов.
ПРИМЕЧАНИЕ: При желании провести анализ активности вновь созданного энергетического решения по коммерческим энергетическим решениям, например, раствору А в PURExpress. Если наблюдается значительно более низкая производительность системы с энергетическим раствором, оптимизация концентраций ионов, особенно ионов магния, путем титрования (5-20 мМ) может быть выгодной.
5. Реакция OnePot PURE
- Шаблон ДНК
ПРИМЕЧАНИЕ: Белки, кодируемые ниже по течению промотора Т7, могут быть экспрессированы в PURE из линейной или круговой ДНК. Генерируя линейный шаблон ДНК с использованием расширения ПЦР, утомительные шаги клонирования могут быть опущены. Линейные шаблоны для этого исследования были сгенерированы с помощью ПЦР, как описано ниже, с использованием высокоточной ДНК-полимеразы(Таблица материалов). Последовательности грунтовок, температуры плавления и настройки термоциклера, используемые в этом исследовании, указаны в дополнительной таблице 6. Подготовка шаблона ДНК не входит в ежедневный график.- Настройте реакцию ПЦР в соответствии с рекомендацией поставщика полимеразы.
ПРИМЕЧАНИЕ: Оптимизированные параметры для высокоточной ДНК-полимеразы(Таблица материалов)приведены в Дополнительной таблице 6. - Амплифицировать ген-мишень (например, eGFP) в виде линейного шаблона из плазмиды или генома с помощью ген-специфических праймеров (500 нМ) (параметры см. в дополнительной таблице 6).
- Амплификация генерирует короткие расширения для обеспечения последовательностей отжига для следующих этапов ПЦР расширения.
- Проверьте ампликон на агарозном геле на правильный размер и чистоту.
- Используйте амплифицированную ДНК в качестве шаблона для последующих этапов расширения. Устанавливают реакцию не менее 50 мкл.
- Запустите 10 циклов амплификации ПЦР с помощью удлинительных праймеров (2,5 нМ). После завершения циклов амплификации немедленно добавьте конечные праймеры (500 нМ) к той же реакции и выполните 30 циклов для усиления расширенного продукта ПЦР. Температуры плавления и последовательности грунтовок приведены в дополнительной таблице 6.
- Очистите фрагменты ДНК с помощью набора для очистки ДНК и элюируйте ДНК в воде без нуклеаз вместо ЭДТА, содержащего буфер элюации.
- Проверьте линейный шаблон на агарозном геле на правильный размер и чистоту.
- Измерьте концентрацию ДНК в нг/мкл с помощью спектрофотометра UV-Vis.
- Настройте реакцию ПЦР в соответствии с рекомендацией поставщика полимеразы.
- Настройка реакции PURE
ПРИМЕЧАНИЕ: Конечная реакционная композиция состоит из 1x энергетического раствора, рибосом без меток или рибосом His-tag, белков OnePot PURE и шаблона ДНК. Объемное отношение реакции содержит 40% энергетического раствора, 30% раствора белка и рибосомы и 30% ДНК и воды. Типичные реакционные объемы варьируются от 5 мкл до 25 мкл. Количественное измерение экспрессии флуоресцентного белка непрерывно на пластинчатом считывателе. Используйте зеленый Lys in vitro Система трансляции маркировки, которая включает флуоресцентно меченый остаток лизина во вновь синтезированные белки для проверки экспрессии нефлуоресцентных белков на гегеле SDS-PAGE. Пример шаблона реакции приведен в Дополнительная таблица 7 чтобы помочь установить реакцию экспрессии PURE без клеток. Ячейки желтого цвета указывают на введенные пользователем значения, а ячейки оранжевого цвета указывают на дополнительные реагенты, которые необходимо дополнительно добавить в реакцию. Поддерживайте точность объемных соотношений компонентов, чтобы обеспечить правильный ионный баланс. Например, для достижения более высокой концентрации белка увеличьте концентрацию белкового раствора OnePot; однако не следует увеличивать объем белкового раствора, добавленного в реакцию.- Заполните концентрацию [нг/мкл] и длину [пары оснований] ДНК в соответствующих желтых клетках в электронной таблице. Используйте 2-10 нМ ДНК для реакции.
- Заполните желаемый общий объем реакции в мкл.
- Извлеките необходимые реагенты из морозильной камеры и разморозьте их на льду.
ПРИМЕЧАНИЕ: Повторное замораживание компонентов возможно без снижения функциональности. Тем не менее, сведите к минимуму количество циклов замораживания-оттаивания и время, в течение которого образцы хранятся на льду, насколько это возможно. - Пипетка рассчитанного количества воды, ДНК и энергетического раствора на одну сторону ПЦР-трубки или один угол скважины на 384-скважинной пластине. Добавьте необходимое количество любого дополнительного реагента на ту же сторону. Минимизируйте количество образцов в эксперименте, чтобы избежать испарения образца и смещения времени начала эксперимента.
ПРИМЕЧАНИЕ: Крайне важно, чтобы энергетический компонент физически отделялся от белковых компонентов, чтобы избежать преждевременного потребления источников энергии и снижения урожайности. - Пипетка рассчитанных количеств белка и рибосомного раствора на другую сторону ПЦР-трубки или противоположный угол 384-й колодезной пластины.
ПРИМЕЧАНИЕ: По возможности используйте мастер-миксы, чтобы уменьшить влияние ошибок пипетки. После первоначального тестирования рибосомные и белковые растворы можно смешивать и хранить в виде одного раствора. - Открутите в течение короткого времени (30 с) для слияния реакционных компонентов. Чтобы предотвратить испарение во время экспериментов со считывателем пластин, добавьте 35 мкл жидкого воска и запечатайте пластину прозрачным герметином (см. Таблицу материалов).
- Инкубировать в течение минимум 3 ч при 37 °C.
- Для считывания показаний на пластинчатом считывателе измеряйте интенсивность флуоресценции на требуемой длине волны каждые 2 мин (репрезентативные результаты показаны на рисунке 3В).
- Выполните следующие действия для образцов с метками Green Lys.
- После бесклеточной экспрессии инкубируют образец с 0,16 мкг/мкл РНКазы А в течение 30 мин при 37 °C, чтобы удалить флуоресцентный фон набора маркировки Green Lys.
ПРИМЕЧАНИЕ: Используйте РНКазу А, так как другие типы РНКаз недостаточно хорошо удаляют фон. - Визуализируйте экспрессию белка, запустив SDS-PAGE, как указано в разделе 1.3.3. Осторожно вымойте неокрашивающийся гель в деионизированной воде и визуализируйте его на флуоресцентном томоире с длиной волны возбуждения 488 нм.
- Впоследствии окрашивают гель с помощью обычных методов окрашивания Кумасси. Подходящие параметры см. в разделе 1.3.3.
ПРИМЕЧАНИЕ: Выполните титрование белкового раствора с рекомендуемой концентрацией рибосом и, при необходимости, титруйте рибосомы с оптимальной концентрацией белка OnePot после этого. Используйте коммерческий комплект PURExpress ΔRibosome в качестве положительного элемента управления. Раствор А, Фактор Микс и раствор рибосомы соответствуют приготовленной энергии, белковому раствору OnePot и очищенным рибосомам соответственно.
Результаты
Вышеуказанный протокол предназначен для облегчения создания бесклеточной системы PURE TX-TL в любой лаборатории. Протокол включает подробное описание приготовления трех отдельных частей системы PURE: белка OnePot, рибосомы и энергетического раствора. Подробное ежедневное расписание, оптимизирует рабочий процесс, приведено в таблице 1. Рабочий процесс оптимизирован для очистки рибосом, помеченных His, и временные рамки могут немного отличаться, если выполняется очистка рибосом без меток. Один препарат обеспечивает достаточное количество PURE для реакций не менее пятисот 10 мкл. Кроме того, приготовленные растворы стабильны более года при -80 °C и могут выдерживать множественные циклы замораживания-оттаивания.
Адекватные уровни сверхэкспрессии для всех штаммов имеют решающее значение для функциональности конечного белкового раствора. На рисунке 1 показана успешная сверхэкспрессия во всех 36 отдельных штаммах, используемых впоследствии для приготовления белка OnePot. Изменение интенсивности полосы перегражённым белкам произошло, скорее всего, из-за смещения объемов загрузки на гель SDS-PAGE. Ожидаемые размеры белков обобщены в таблице 2. GlyRS и PheRS состоят из двух субъединиц различной молекулярной массы; остальные 34 белка состоят из одной субъедицы. Ключом к простоте и эффективности этого протокола по времени является этап кокультурирования и совместной очистки(рисунок 2). Белковый раствор OnePot готовили путем увеличения соотношения штамма EF-Tu по отношению ко всем остальным штаммам экспрессии. Общий состав конечных белков анализировали с помощью SDS-PAGE(рисунок 3А). Из гелей (полосы 2, 3) заметно, что EF-Tu (43,3 кДа) присутствует в более высокой концентрации по сравнению с другими белками, как и ожидалось. В то время как гель обеспечивает хорошее первое указание на соотношение экспрессии белка, трудно определить, был ли экспрессирован каждый отдельный белок и на каком уровне. Поэтому настоятельно рекомендуется подтвердить сверхэкспрессию у каждого штамма перед кокультурированием, как показано выше.
Рибосома E. coli представляет собой сложную молекулярную машину, состоящую из более чем 50 отдельных белковых субъединиц23. Репрезентативный спектр поглощения при 260 нм для очистки рибосом без меток показан на фиг.4; третий пик характерен для успешного элюции рибосом. Для обоих методов очистки рибосом наблюдалась ожидаемая картина выполнения на гелене SDS-PAGE(рисунок 3A)18. Мы наблюдали загрязнения для обеих очистк, хотя и в небольших количествах (<10%). Примечательно, что различные загрязняющие вещества присутствовали в рибосомах без меток (полосы 5, 6) и His-tagged (полосы 11, 12) из-за различий в методе. Для справки для пользователей также включены гели SDS-PAGE для комбинированных систем (полосы 8, 9 и 14, 15).
Наконец, сравниваются характеристики подготовленных систем(рисунок 3)с использованием различных вариантов рибосом. Временные курсы экспрессии eGFP in vitro показывают, что обе системы PURE функциональны и производят флуоресцентный eGFP. Однако белковый раствор OnePot в сочетании с рибосомами, помеченными His, с использованием концентрации рибосом, оптимизированной титрованием, дал только одну треть уровня экспрессии версии без помеченных рибосом(рисунок 3B). Аналогичные результаты наблюдались, когда три белка разных размеров были экспрессированы и помечены с использованием системы маркировки Green Lys tRNA in vitro (рисунок 3C). Как видно на флуоресцентном геле, полноразмерные продукты были успешно выражены в обеих системах; однако только около половины уровня экспрессии было достигнуто с помощью рибосомной системы His-tag. В дополнение к флуоресцентной маркировке, ожидаемые полосы для всех трех белков различимы на геле, окрашенном Кумасси(рисунок 3D). Результаты показывают, что введенная система экспрессии, которая может быть подготовлена в течение недели в лаборатории со стандартным оборудованием, может быть использована для экспрессии in vitro белков, кодируемых после промотора Т7 из линейных шаблонов.

Рисунок 1:Репрезентативные результаты теста на сверхэкспрессию для всех штаммов экспрессии системы PURE. Количество и размеры белка PURE обобщены в таблице 2. Белковые числа 21, 24 и 27 отмечены звездочкой для лучшей визуализации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
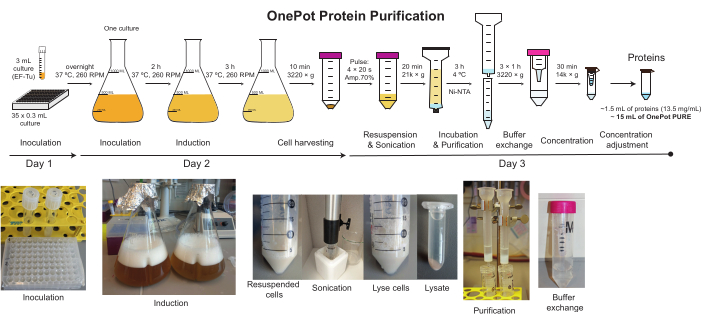
Рисунок 2:Очистка белка OnePot. Схематическое изображение и соответствующие фотографии всех этапов, участвующих в производстве белкового раствора OnePot. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3:Производительность подготовленных систем с использованием различных рибосомных вариантов. (A) Coomassie окрашенные синим цветом SDS-PAGE гели из белкового раствора OnePot (полосы 2, 3), рибосомы без меток без белкового раствора (полосы 5, 6) и с белковым раствором (полосы 8, 9), His-метки рибосом без белкового раствора (полосы 11, 12) и с белковым раствором (полосы 14, 15). На образец были загружены две различные концентрации. (B) Сравнение экспрессии eGFP помеченных His-меток рибосом и рибосом без меток. Интенсивность флуоресценции экспрессии eGFP in vitro контролируется с течением времени для реакции PURE с использованием рибосом без меток (1,8 мкМ, синий) и рибосом с гисс-метками (0,62 мкМ, красный). Концентрации линейного шаблона и белкового раствора OnePot составляли 4 нМ и 2 мг/мл соответственно. Панели(C)и(D)показывают гель SDS-PAGE белков, синтезированных в OnePot с безметочными (1,8 мкМ, синие, полосы 3, 4, 5) и Рибосомами His-tag (0,62 мкМ, красный, полосы 6, 7, 8), помеченными набором маркировки GreenLys in vitro (C)и окрашенными синим цветом Coomassie(D),соответственно. Черными стрелками обозначены ожидаемые полосы синтезированных белков: eGFP (26,9 кДа), ArgRS (64,7 кДа), T7 RNAP (98,9 кДа). Линейный шаблон и концентрации белкового раствора OnePot составляли 4 нМ и 1,6 мг/мл соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4:Спектры поглощения при 260 нм. Репрезентативные результаты спектров поглощения при 260 нм при гидрофобной очистке взаимодействия рибосом без меток. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Ежедневный оптимизированный по времени график подготовки всех решений OnePot PURE. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 2: Список чистых белков Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Дополнительная таблица 1: Реагенты. В таблице перечислены концентрации, объемы и другие конкретные детали реагентов и компонентов, используемых во время этого исследования. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Дополнительная таблица 2: Буферы. В электронной таблице перечислены точные буферные композиции для очистки белка, рибосомы без меток и рибосомы His-tag, а также концентрации стоковых растворов, используемых для их приготовления. Кроме того, он вычисляет необходимое количество компонентов на основе объема буфера. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Дополнительная таблица 3: Расчет аминокислот. В электронной таблице перечислены аминокислоты и рекомендуемые концентрации их в растворе, необходимые для энергетического раствора. Он рассчитывает количество воды, добавляемой к каждой аминокислоте, на основе фактической взвешенной массы, а также рассчитывает объем раствора аминокислоты, который будет добавлен в конечную смесь аминокислот. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Дополнительная таблица 4: Складовые решения для энергетического решения. В таблице перечислены концентрации и объемы запасов растворов, необходимых для энергетического раствора, и указаны дополнительные сведения, включая условия хранения. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Дополнительная таблица 5: Энергетическое решение. В таблице перечислены компоненты энергетического раствора и их рекомендуемые концентрации. Кроме того, он рассчитывает их необходимые объемы для добавления в конечный раствор на основе их концентраций в запасе раствора и объема энергетического раствора. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Дополнительная таблица 6: ПЦР. В таблице перечислены последовательности и концентрации праймеров, используемых для удлинительной ПЦР, и указаны температуры плавления и этапы термоциклера, оптимизированные для высокоточной ДНК-полимеразы. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Дополнительная таблица 7: Реакция PURE. В электронной таблице приведен пример настройки реакции PURE. В нем перечислены используемые концентрации и объемы компонентов для реакции PURE с использованием рибосом без меток или рибосом His-tag. Кроме того, он рассчитывает объемные соотношения для титрования белка и рибосомы. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
Протокол, представленный здесь, описывает простой, экономически эффективный способ получения универсальной системы экспрессии20 PURE на основе стандартной композиции15. Используя протокол вместе с прилагаемыми суточными графиками(таблица 1),все компоненты могут быть приготовлены за 1 неделю и дают количества, достаточные для реакций PURE до пятисот 10 мкл. Поскольку белки, используемые в этом протоколе, чрезмерно экспрессируются из плазмид с высокой копией и имеют низкую токсичность для E. coli,хорошие уровни экспрессии наблюдаются для всех необходимых белков(рисунок 1). Это позволяет легко регулировать штаммы, а следовательно, и белковый состав в кокультурах, просто изменяя соотношения прививочных штаммов20. Помимо рибосомных белков, концентрация EF-Tu показала, что она имеет фундаментальное значение для экспрессии6. Напротив, изменения концентрации других белковых компонентов оказали относительно низкое влияние на надежность системы PURE7,24. Таким образом, регулируя коэффициент инокуляции EF-Tu по отношению ко всем другим компонентам, можно достичь сопоставимой композиции со стандартной композицией PURE, и можно достичь системы PURE с аналогичным выходом20. При приготовлении белкового раствора крайне важно убедиться, что все штаммы хорошо растут и сверхэкспрессируют кодируемый белок после индукции(рисунок 1).
Функция рибосом является ключевой для общей производительности системы PURE24. В этом протоколе демонстрируются два различных способа приготовления раствора рибосомы, т.е. очистка рибосом без меток и с метками His. Очистка рибосом без меток основана на гидрофобной хроматографии взаимодействия с последующим центрифугированием с сахарозной подушкой, что требует доступа к системе очистки FPLC и ультрацентрифуге15. Напротив, метод, использующий помеченные His-метки рибосомы18 и очистку гравитационной аффинной хроматографии, не требует специализированного оборудования и может быть выполнен в большинстве лабораторий. Последний метод, таким образом, приносит такие преимущества, как простота и доступность. Тем не менее, мы наблюдали значительно более низкий выход синтеза при использовании рибосом His-меток в OnePot PURE по сравнению с вариантом без тегов(рисунок 3). В зависимости от типа применения, этот более низкий выход может быть приемлемым.
Энергетическое решение обеспечивает низкомолекулярные компоненты и тРНК, необходимые для подпитки реакций TX-TL in vitro. Этот протокол предоставляет рецепт типичного энергетического решения, которое может быть легко скорректировано в зависимости от потребностей пользователя. Вместе с тРНК, NTP и креатинфосфатом обилие и концентрация ионов Mg2+ имеют решающее значение для общей производительности системы PURE8,поскольку они являются критическими кофакторами для транскрипции и трансляции. В некоторых случаях титрование ионов может, таким образом, значительно повысить общую производительность PURE. Целостность ДНК имеет решающее значение для производительности PURE. Таким образом, последовательность, верифицирующая промоторную область, сайт связывания рибосом и ген-мишень и гарантирующая, что адекватная концентрация ДНК (<2 нМ) поможет устранить проблемы, которые могут возникнуть при настройке реакции PURE.
Система PURE представляет собой минимальную систему TX-TL, и поэтому для конкретных применений могут потребоваться дополнительные корректировки25. Они могут включать включение различных РНК-полимераз9,26,шаперонов13и белковых факторов, таких как EF-P или ArfA8. Хотя экспрессионные штаммы для этих белков могут быть включены в кокультуры, добавление их отдельно в подготовленную систему может обеспечить лучший контроль требуемых уровней белка. Кроме того, включение везикул имеет важное значение для производства мембранных белков10,11. Окисление, а не восстанавливающие среды и дисульфидная связующая изомераза способствуют надлежащему образованию дисульфидных связей, которые, например, необходимы для секреторных белков12.
Важно убедиться, что любые дополнительные компоненты не мешают реакции. Наиболее важные факторы, на которые следует обратить внимание при настройке реакции или добавлении других компонентов, перечислены ниже. Убедитесь, что не используются несовместимые буферы и не нарушаются концентрации ионов. Избегайте растворов, содержащих глицерин, высокие концентрации калия, магния, ионов кальция, осмолитов, пирофосфатов, антибиотиков или ЭДТА, насколько это возможно. Например, замена буфера элюации водой во время очистки ДНК может быть полезной, поскольку ЭДТА является общей добавкой в этом буфере. Снабжение растворов дополнительными отрицательно заряженными молекулами, такими как NTP или dNTP, требует регулировки концентрации магния8,поскольку отрицательно заряженные молекулы ведут себя как хелатирующие агенты и связывают положительно заряженные молекулы. Нейтральный рН идеально подходит для реакции. Соответственно, все компоненты должны быть буферизованы до соответствующего рН; это особенно важно для высококислых или основных молекул, таких как NFP. Наконец, температура и объем являются ключевыми параметрами для реакции. Для достижения хорошего урожая следует ввести температуру около 37 °C, так как температура ниже 34 °C значительно снизит урожайность27° C.
Уместно отметить, что перед приготовлением OnePot PURE следует рассмотреть целевое применение и связанные с ним требования, такие как объем, чистота, простота модификации, а также включение или пропуск компонентов. Для многих приложений система будет отличным выбором, но другие могут потребовать урожайности, регулируемости и других факторов, которые система OnePot не может обеспечить. Независимо от этого, введенный протокол будет полезен для подготовки любой самодельной системы, поскольку здесь кратко изложены все критические шаги для такой подготовки.
Одним из главных преимуществ системы OnePot является ее совместимость с коммерчески доступной системой PURExpress, которая обеспечивает возможность тестирования функциональности и целостности всех компонентов в отдельности путем последовательной замены каждого компонента PURExpress на его эквивалент OnePot. Преимущества системы OnePot PURE, такие как настраиваемость и простая, быстрая и экономичная подготовка, сделают бесклеточный TX-TL доступным для большего количества лабораторий по всему миру и будут способствовать расширению внедрения этой мощной платформы в бесклеточной синтетической биологии.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Эта работа была поддержана Европейским исследовательским советом в рамках гранта Программы исследований и инноваций Европейского союза Horizon 2020 723106, гранта Швейцарского национального научного фонда (182019) и EPFL.
Материалы
| Name | Company | Catalog Number | Comments |
| 10x Tris/Glycine/SDS buffer | Bio-Rad Laboratories | 1610732 | |
| 15 mL centrifuge tubes | VWR International | 525-0309 | |
| 384-well Black Assay Plates | Corning | 3544 | |
| 4-20% Mini-PROTEANRTM TGXTM Precast Protein Gels | Bio-Rad Laboratories | 4561096 | |
| 50 mL centrifuge tubes | VWR International | 525-0304 | |
| 96-Well Polypropylene DeepWell plate | Nunc | 260252 | |
| Acetic acid, 99.8 % | Acros | 222140010 | |
| Äkta purifier | GE Healthcare | purification of tag free ribosomes | |
| AMICON ULTRA 0.5 mL - 3 KDa | Merck Millipore | UFC500324 | |
| AMICON ULTRA 15 mL - 3 KDa | Merck Millipore | UFC900324 | |
| Amino acids | Sigma-Aldrich | LAA21-1KT | |
| Ammonium chloride | Sigma-Aldrich | 09718-250G | |
| Ammonium sulfate | Sigma-Aldrich | A4418 | |
| Ampicillin | Condalab | 6801 | |
| BenchMark Fluorescent Protein Standard | ThermoFisher | LC5928 | |
| Breathe-Easy sealing membrane | Diversified Biotech | Z380059-1PAK | |
| Centrifuge tubes polycarbonate | Beckman | 355631 | purification of tag free ribosomes |
| Chill-out Liquid Wax | Bio-Rad Laboratories | CHO1411 | |
| Creatine phosphate | Sigma-Aldrich | 27920 | |
| DNA Clean & Concentrator-25 (Capped) | Zymo | ZYM-D4034-200TS | |
| DTT | SantaCruz Biotech | sc-29089B | |
| Econo-Pac Chromatography Columns | Bio-Rad Laboratories | 7321010 | |
| EDTA (Ethylenediaminetetraacetic acid) | Sigma-Aldrich | 03609-250G | |
| Eppendorf Protein LoBind microcentrifuge tubes | VWR International / Eppendorf | 525-0133 | |
| Falcon 14 mL Round Bottom Polystyrene Test Tube, with Snap Cap | Falcon | 352051 | |
| Flasks, baffled 1000 mL 4 baffles, borosilicate glass | Scilabware | 9141173 | |
| FluoroTect Green Lys in vitro Translation Labeling System | Promega | L5001 | optional |
| Folinic acid | Sigma-Aldrich | PHR1541 | |
| Glycerol | Sigma-Aldrich | G7757-1L | |
| HEPES | Gibco | 15630-056 | |
| HiTrap Butyl HP Column | GE Healthcare | 28411005 | purification of tag free ribosomes |
| IMAC Sepharose 6 Fast Flow | GE Healthcare | 17-0921-07 | |
| Imidazole | Sigma-Aldrich | I2399 | |
| InstantBlue | Expedeon | ISB1L-1L | |
| IPTG (Isopropyl-beta-D-thiogalactoside) | Alfa Aesar | B21149.03 | |
| Laemmli buffer (2x), sample buffer | Sigma-Aldrich | S3401-1VL | |
| Lysogeny broth (LB) media | AppliChem | A0954 | |
| Magnesium acetate | Sigma-Aldrich | M0631 | |
| Magnesium chloride | Honeywell Fluka | 63020-1L | |
| Nickel Sulfate | Alfa Aesar | 15414469 | |
| NTP | ThermoFisher | R0481 | |
| Phusion High-Fidelity DNA Polymerase (2 U/µL) | ThermoFisher | F530S | |
| Potassium chloride | Sigma-Aldrich | P5405-1KG | |
| Potassium glutamate | Sigma-Aldrich | 49601 | |
| PURExpress In Vitro Protein Synthesis Kit | NEB | E6800S | |
| PURExpress Δ Ribosome Kit | NEB | E3313S | |
| Quick Start Bradford 1x Dye Reagent | Bio-Rad Laboratories | 5000205 | |
| Rapid-Flow Sterile Single Use Vacuum Filter Units | ThermoFisher | 564-0020 | |
| RNaseA solution | Promega | A7973 | |
| SealPlate film | Excel Scientific | Z369659-100EA | |
| Sodium hydroxide | Sigma-Aldrich | 6203 | |
| Spermidine | Sigma-Aldrich | S2626 | |
| Sucrose | Sigma-Aldrich | 84097 | |
| TCEP (Tris(2-carboxyethyl)phosphin -hydrochlorid) | Sigma-Aldrich | 646547-10X1mL | |
| Thickwall Polycarbonate Tube | Beckman | 355631 | |
| Trichloroacetic acid | Sigma-Aldrich | T0699 | |
| Tris base | ThermoFisher | BP152-500 | |
| tRNA | Roche | 10109541001 | |
| Ultracentrifuge Optima L-80 | Beckman | purification of tag free ribosomes | |
| Whatman GD/X syringe filters | GE Whatman | WHA68722504 | |
| β-mercaptoethanol | Sigma-Aldrich | M6250-100mL |
Ссылки
- Laohakunakorn, N., et al. Bottom-up construction of complex biomolecular systems with cell-free synthetic biology. Frontiers in Bioengineering and Biotechnology. 8, 213 (2020).
- Laohakunakorn, N. Cell-free systems: a proving ground for rational biodesign. Frontiers in Bioengineering and Biotechnology. 8, 788 (2020).
- Cho, E., Lu, Y. Compartmentalizing cell-free systems: toward creating life-like artificial cells and beyond. ACS Synthetic Biology. 9 (11), 2881-2901 (2020).
- Gaut, N. J., Adamala, K. P. Reconstituting natural cell elements in synthetic cells. Advanced Biology (Weinh). 5 (3), 2000188 (2021).
- Shimizu, Y., et al. Cell-free translation reconstituted with purified components. Nature Biotechnology. 19 (8), 751-755 (2001).
- Li, J., Gu, L., Aach, J., Church, G. M. Improved cell-free RNA and protein synthesis system. PLoS One. 9 (9), 106232 (2014).
- Kazuta, Y., Matsuura, T., Ichihashi, N., Yomo, T. Synthesis of milligram quantities of proteins using a reconstituted in vitro protein synthesis system. Journal of Bioscience and Bioengineering. 118 (5), 554-557 (2014).
- Li, J., et al. Dissecting limiting factors of the protein synthesis using recombinant elements (PURE) system. Translation. 5 (1), 1327006 (2017).
- de Maddalena, L. L., et al. GreA and GreB enhance expression of Escherichia coli RNA polymerase promoters in a reconstituted transcription-translation system. ACS Synthethic Biology. 5 (9), 929-935 (2016).
- Kuruma, Y., Ueda, T. The PURE system for the cell-free synthesis of membrane proteins. Nature Protocols. 10 (9), 1328-1344 (2015).
- Jacobs, M. L., Boyd, M. A., Kamat, N. P. Diblock copolymers enhance folding of a mechanosensitive membrane protein during cell-free expression. Proceedings of the National Academy of Sciences of the Unites States of America. 116 (10), 4031-4036 (2019).
- Shimizu, Y., Kanamori, T., Ueda, T. Protein synthesis by pure translation systems. Methods. 36 (3), 299-304 (2005).
- Niwa, T., Kanamori, T., Ueda, T., Taguchi, H. Global analysis of chaperone effects using a reconstituted cell-free translation system. Proceedings of the National Academy of Sciences of the Unites States of America. 109 (23), 8937-8942 (2012).
- Niwa, T., et al. Large-scale analysis of macromolecular crowding effects on protein aggregation using a reconstituted cell-free translation system. Frontiers in Microbiology. 6, 1113 (2015).
- Shimizu, Y., Ueda, T. PURE technology. Methods in molecular biology. 607, 11-21 (2010).
- Horiya, S., Bailey, J. K., Krauss, I. J. Directed evolution of glycopeptides using mRNA display. Methods in Enzymology. 597, 83-141 (2017).
- Villarreal, F., et al. Synthetic microbial consortia enable rapid assembly of pure translation machinery. Nature Chemical Biology. 14 (1), 29-35 (2018).
- Wang, H. H., et al. Multiplexed in vivo His-tagging of enzyme pathways for in vitro single-pot multienzyme catalysis. ACS Synthetic Biology. 1 (2), 43-52 (2012).
- Shepherd, T., et al. De Novo Design and synthesis of a 30-cistron translation-factor module. Nucleic Acids Research. 45 (18), 10895-10905 (2017).
- Lavickova, B., Maerkl, S. J. A Simple, robust, and low-cost method to produce the PURE cell-free system. ACS Synthetic Biology. 8 (2), 455-462 (2019).
- Ederth, J., Mandava, C. S., Dasgupta, S., Sanyal, S. A single-step method for purification of active his-tagged ribosomes from a genetically engineered Escherichia coli. Nucleic Acids Research. 37 (2), 15 (2009).
- Gesteland, R. F. Isolation and characterization of ribonuclease I mutants of Escherichia coli. Journal of Molecular Biology. 16 (1), 67-84 (1996).
- Li, J., et al. Cogenerating synthetic parts toward a self-replicating system. ACS Synthetic Biology. 6 (7), 1327-1336 (2017).
- Matsuura, T., Kazuta, Y., Aita, T., Adachi, J., Yomo, T. Quantifying epistatic interactions among the components constituting the protein translation system. Molecular Systems Biology. 5, 297 (2009).
- Libicher, K., Hornberger, R., Heymann, M., Mutschler, H. In vitro self-replication and multicistronic expression of large synthetic genomes. Nature Communications. 11 (1), 904 (2020).
- Niederholtmeyer, H., Stepanova, V., Maerkl, S. J. Implementation of cell-free biological networks at steady state. Proceedings of the National Academy of Sciences of the United States of America. 110 (40), 15985-15990 (2013).
- Lavickova, B., Laohakunakorn, N., Maerkl, S. J. A partially self-regenerating synthetic cell. Nature Communications. 11 (1), 6340 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены