Method Article
نظام خلية ونبوت PURE الخالي من الخلايا
In This Article
Summary
نقدم طريقة سريعة وفعالة من حيث التكلفة لإنتاج نظام PURE الخالي من الخلايا النقي باستخدام معدات المختبر القياسية.
Abstract
يوفر نظام PURE المحدد (تخليق البروتين باستخدام العناصر المؤتلفة) نظام النسخ والترجمة هيكلا جذابا لعلم الأحياء الاصطناعي الخالي من الخلايا. ولسوء الحظ، فإن النظم المتاحة تجاريا مكلفة، وسمك التونة فيها محدود. وبالمقارنة، يمكن تخصيص نهج منزلي الصنع بناء على احتياجات المستخدم. ومع ذلك ، فإن إعداد الأنظمة المحلية الصنع يستغرق وقتا طويلا وشاقا نظرا للحاجة إلى الريبوسومات بالإضافة إلى 36 تنقية بروتين متوسطة النطاق. تبسيط تنقية البروتين عن طريق coculturing والتنقية المشتركة يسمح لتقليل متطلبات الوقت والعمل. هنا، نقدم طريقة سهلة وقابلة للتعديل والوقت وفعالة من حيث التكلفة لإنتاج جميع مكونات نظام PURE في غضون أسبوع واحد، وذلك باستخدام معدات المختبر القياسية. وعلاوة على ذلك، فإن أداء OnePot PURE مماثل للأنظمة المتاحة تجاريا. تعمل طريقة إعداد OnePot PURE على توسيع إمكانية الوصول إلى نظام PURE إلى المزيد من المختبرات نظرا لبساطته وفعاليته من حيث التكلفة.
Introduction
تشكل أنظمة النسخ والترجمة الخالية من الخلايا (TX-TL) منصة واعدة للتحقيق في الأنظمة البيولوجية والهندسية. فهي توفر ظروف رد فعل مبسطة وغير قادرة، حيث أنها لم تعد تعتمد على العمليات التي تحافظ على الحياة، بما في ذلك النمو، أو التوازن، أو الآليات التنظيمية1. وبالتالي، فمن المتوقع أن النظم الخالية من الخلايا سوف تسهم في التحقيق في النظم الجزيئية الحيوية، وتقديم إطار لاختبار استراتيجيات التصميم الحيوي العقلاني2،وتوفير هيكل لخلية اصطناعية في المستقبل3،4. يوفر نظام PURE المؤتلف بالكامل هيكلا جذابا بشكل خاص نظرا لتكوينه المحدد والحد الأدنى ، بالإضافة إلى قابليته للتعديل وقابليته للضبط5.
منذ أول وظيفية، تم تأسيس نظام PURE المؤتلف بالكامل في عام 20015،وقد بذلت جهود لتوسيع حدود النظام وتحسين تكوين النظام لتحسين إنتاج النظام6،7،8، والسماح لتنظيم النسخ9، غشاء10،11 والتوليف البروتينإفرازي 12، وتسهيل طي البروتين13،14 . في الوقت الحاضر ، هناك ثلاثة أنظمة متاحة تجاريا: PUREfrex (GeneFrontier) ، PURExpress (NEB) ، وماجيك PURE (Biolabs الإبداعية). غير أن هذه النظم مكلفة، وتكوينها الدقيق ملكية خاصة، وبالتالي فهي غير معروفة، والقدرة على التكيف محدودة.
PURE نظم أعدت في المنزل ثبت أن الخيار الأكثر فعالية من حيث التكلفة و tunable15،16. ومع ذلك ، فإن خطوات تنقية 37 المطلوبة للبروتين والكسور الريبوسومية تستغرق وقتا طويلا ومملة. وقد بذلت عدة محاولات لتحسين كفاءة إعداد نظام PURE17،18،19. لقد أثبتنا مؤخرا أنه من الممكن زراعة جميع البروتينات غير الريبوسومية المطلوبة الموجودة في نظام PURE والمشاركة في تنقيتها. وقد أثبتت طريقة OnePot هذه أنها فعالة من حيث التكلفة وفعالة من حيث الوقت ، مما يقلل من وقت التحضير من عدة أسابيع إلى 3 أيام عمل. هذا النهج يولد نظام PURE مع قدرة إنتاج البروتين مماثلة لنظام PURExpress المتاحة تجاريا20. خلافا للنهج السابقة لتبسيط إعداد PURE17،18،19، في نهج OnePot لا تزال جميع البروتينات يتم التعبير عنها في سلالات منفصلة. وهذا يمكن المستخدم من ضبط تكوين نظام OnePot PURE بمجرد حذف أو إضافة سلالات محددة أو ضبط أحجام التطعيم ، وبالتالي توليد أنظمة PURE التسرب أو تغيير نسب البروتين النهائية ، على التوالي.
يوفر البروتوكول المعروض هنا طريقة مفصلة لإنشاء نظام OnePot PURE كما هو موضح سابقا20، على الرغم من استبدال β ميركابتوثانول بفوسفين tris(2-carboxyethyl)phosphine (TCEP). وعلاوة على ذلك، توصف طريقتان لتنقية الريبوسوم: تنقية الريبوسوم التقليدية الخالية من العلامات باستخدام التفاعل الكاره للماء ووسادة السكروز، المقتبسة من شيميزو وآخرون15،وتنقية الريبوسوم Ni-NTA استنادا إلى وانغ وآخرون18 وإديرث وآخرون21 ولكن تم تعديلها بشكل كبير. كما أن هذه الطريقة الأخيرة تيسر إعداد نظام PURE وتجعله في متناول المزيد من المختبرات، حيث لا يلزم سوى معدات مختبرية قياسية.
يلخص البروتوكول التجريبي إعداد نظام PURE الخالي من الخلايا متعدد الاستخدامات TX-TL لتوفير منصة بسيطة وغير قادرة وفعالة من حيث التكلفة خالية من الخلايا ، والتي يمكن إعدادها باستخدام معدات المختبر القياسية في غضون أسبوع. بالإضافة إلى إدخال التكوين النقي القياسي ، فإننا نبين كيف وأين يمكن تعديله ، مع التركيز بشكل أساسي على الخطوات الحاسمة في البروتوكول لضمان وظائف النظام.
Protocol
ملاحظة: يصف هذا البروتوكول إعداد نظام TX-TL الخالي من الخلايا من المكونات المؤتلفة. للراحة، يتم فصل العمل إلى خمسة أجزاء. يصف الجزء الأول خطوات التحضير، التي يجب القيام بها قبل بدء البروتوكول. يصف الجزء الثاني إعداد محلول بروتين OnePot. يصف الجزء الثالث تنقيات الريبوسوم ، الجزء الرابع يفصل إعداد محلول الطاقة ، ويوفر الجزء الأخير دليلا لإعداد تفاعل PURE. للراحة، تنقسم البروتوكولات إلى أيام وتلخص في الجداول اليومية في الجدول 1. بعد الجدول الزمني، يمكن إعداد النظام بأكمله في أسبوع واحد من قبل شخص واحد.
1. الأعمال الأولية
- إعداد وسائل الإعلام الثقافة البكتيرية والمكملات الإعلامية على النحو المبين في الجدول التكميلي 1. إعداد وتعقيم المواد المطلوبة، بما في ذلك نصائح ماصة، 96 لوحات عميقة البئر.
- إعداد سلالة
- تحويل سلالات التعبير المشار إليها في الجدول 2 مع ناقلات التعبير المقابلة باستخدام طريقة الصدمة الحرارية.
- إضافة البلازميد المنقى إلى البكتيريا المختصة كيميائيا واحتضان على الجليد لمدة 20-30 دقيقة.
- ضع الخليط على حرارة 42 درجة مئوية لمدة 30 s (صدمة حرارية) ثم ضعه مرة أخرى على الجليد لمدة دقيقتين.
- ماصة 20 ميكرولتر من البكتيريا مباشرة على لوحات أجار تحتوي على أمبيسلين (AMP) واحتضان في 37 درجة مئوية بين عشية وضحاها. تخزين لوحات في 4 °C لمدة تصل إلى 1 أسبوع.
- تلقيح 3 مل من وسائط LB التي تحتوي على AMP مع مستعمرة واحدة من البكتيريا من لوحات أجار. احتضان عند 37 درجة مئوية في حين تهتز في 260 دورة في الدقيقة بين عشية وضحاها.
- مزيج 250 ميكرولتر من الثقافة مع 250 ميكرولتر من 50٪ (v/v) الجلسرين وتخزينها في -80 درجة مئوية.
ملاحظة: لإعداد أسرع في المستقبل، تخزين سلالات في لوحة 96 جيدا كما أسهم الجلسرين.
- تأكيد جميع التحولات ناقلات بواسطة PCR مستعمرة والتسلسل. تسلسل الجين، منطقة المروج، وموقع الربط ريبوسوم.
- تحويل سلالات التعبير المشار إليها في الجدول 2 مع ناقلات التعبير المقابلة باستخدام طريقة الصدمة الحرارية.
- اختبار التعبير
- تلقيح 300 ميكرولتر من وسائط LB التي تحتوي على AMP مع حوالي 1 ميكرولتر من مخزون الجلسرين المعد في لوحة بئر عميقة سعة 1.3 مل. ختم لوحة مع غشاء تنفس ومن ثم احتضان في 37 درجة مئوية في حين تهتز في 260 دورة في الدقيقة بين عشية وضحاها.
ملاحظة: يتم إجراء كافة التعبيرات بشكل منفصل عند هذه النقطة. - تلقيح 300 ميكرولتر من وسائط LB الطازجة التي تحتوي على AMP مع 1 ميكرولتر من الثقافات بين عشية وضحاها. احتضان عند 37 درجة مئوية في حين تهتز في 260 دورة في الدقيقة بين عشية وضحاها. بعد 2 ح, حث الخلايا مع 100 ميكرومتر من ايزوبروبيل β-D-1-thiogalactopyranoside (IPTG) وتنمو لمدة 3 ساعات إضافية.
- مزيج 10 ميكرولتر من الثقافة مع 10 ميكرولتر من 2x Laemmli العازلة والحرارة إلى 95 درجة مئوية لمدة 10 دقيقة. تدور العينات لمدة دقيقة واحدة باستخدام جهاز الطرد المركزي الجدول وتحميل 10 ميكرولتر من supernatant على هلام الصفحة. تشغيل هلام في تريس / الجليسين / SDS العازلة في 200 V لمدة 30 دقيقة. شطف جيدا مع الماء deionized. تغطية هلام مع وصمة عار بروتين كوماسي واحتضان لمدة 1 ساعة. Destain الجل في الماء إذا لزم الأمر (نتائج تمثيلية لاختبار التعبير في الشكل 1).
ملاحظة: استخدم المواد الهلامية PAGE المتدرجة (4٪-15٪ أو 4٪-20٪)
- تلقيح 300 ميكرولتر من وسائط LB التي تحتوي على AMP مع حوالي 1 ميكرولتر من مخزون الجلسرين المعد في لوحة بئر عميقة سعة 1.3 مل. ختم لوحة مع غشاء تنفس ومن ثم احتضان في 37 درجة مئوية في حين تهتز في 260 دورة في الدقيقة بين عشية وضحاها.
- IMAC سيبهاروز الراتنج استعادة والتنظيف
- إعداد العمود.
- مزيج راتنج سيفاروز جيدا عن طريق الدوامة.
- ماصة الكمية المطلوبة من الراتنج في عمود تدفق الجاذبية فارغة.
ملاحظة: تختلف كمية الراتنج المطلوبة بين تنقية الريبوسوم وتنقية البروتين ويتم تحديدها في الأقسام المعنية. - غسل الراتنج مع 30 مل من الماء deionized.
- تابع إعادة شحن العمود كما هو محدد في القسم 1.4.4.
ملاحظة: دع كافة السائل يمر عبر العمود قبل المتابعة مع الخطوة التالية. ومع ذلك، تأكد من أن العمود لا يعمل الجافة. كلما تشغيل أي سائل من خلال العمود، وضمان لوقف تدفق أو الاستمرار في الخطوة التالية بمجرد وصول السائل الراتنج.
- ترميم.
- غسل العمود مع 30 مل من الماء deionized.
- تطبيق 10 مل من 0.2 M EDTA و 0.5 M NaCl الحل.
- إضافة 30 مل من حل NaCl 0.5 M.
- غسل العمود مع 50 مل من الماء deionized.
- تخزين في 20٪ (v/v) الإيثانول في 4 درجة مئوية أو الاستمرار في الخطوة التالية.
- تنظيف.
تنبيه: ارتداء معدات الحماية.- اغسل العمود ب 30 مل من 0.5 M NaOH.
- غسل العمود مع 30 مل من الماء deionized.
- غسل العمود مع 30 مل من حمض الخليك 0.1 M.
- غسل العمود مع 30 مل من الماء deionized.
- غسل العمود مع 30 مل من 70٪ (v/v) الإيثانول.
- غسل العمود مع 50 مل من الماء deionized.
- تخزين في 20٪ (v/v) الإيثانول في 4 درجة مئوية أو الاستمرار في الخطوة التالية.
- إعادة الشحن.
- إضافة 10 مل من محلول كبريتات النيكل 0.1 M للعمود.
تنبيه: كبريتات النيكل سامة. وينبغي التخلص من نفايات كبريتات النيكل بالاحتياطات التي أشار إليها المورد. - غسل العمود مع 50 مل من الماء deionized.
- تخزين في 20٪ ((v/v)) الإيثانول في 4 درجة مئوية أو الاستمرار في التوازن العمود.
ملاحظة: إذا كان العمود مخزنا في الإيثانول بين الخطوات، فتأكد من إزالة جميع آثار الإيثانول عن طريق غسل العمود بالماء.
- إضافة 10 مل من محلول كبريتات النيكل 0.1 M للعمود.
- إعداد العمود.
2. ونبوت البروتين الحل التعبير والتنقية
ملاحظة: يتكون البروتوكول من ثلاثة أجزاء مقسمة إلى أيام(الشكل 2). ينتج إجراء التحضير المثالي 1.5 مل من محلول بروتين OnePot 13.5 ملغم / مل ، والذي يتوافق مع أكثر من ألف 10 ميكرولتر من ردود الفعل PURE. ومع ذلك ، فإن كمية وتركيز مثالي للحل تختلف من دفعة إلى دفعة. يمكن للمستخدمين ذوي الخبرة إجراء العديد من الاستعدادات OnePot PURE في وقت واحد.
اليوم الأول:
- إعداد وسائل الإعلام الثقافة البكتيرية والمكملات الإعلامية على النحو المبين في الجدول التكميلي 1.
- إعداد وتعقيم المواد المطلوبة، بما في ذلك نصائح ماصة، واثنين من لوحات 96 بئر عميق، وقارورة واحدة 1 L حيرة Erlenmeyer.
- إعداد المخازن المؤقتة والمكملات الغذائية كما هو موضح في الجدول التكميلي 2. تصفية تعقيم جميع المخازن المؤقتة باستخدام مرشحات زجاجة أعلى (0.45 ميكرومتر) وتخزينها في 4 درجة مئوية. تكملة جميع المخازن المؤقتة مع 1 MM TCEP الحق قبل الاستخدام، ما لم ينص على خلاف ذلك.
- استخدام 2 مل من راتنج سيفاروز لتنقية البروتين OnePot. قم بإعداد العمود كما هو موضح في القسم 1.4.
- لإعداد الثقافات بداية، والجمع بين 20 مل من وسائل الإعلام LB مع 20 ميكرولتر من AMP. في العقيمة 96، 1.3 مل عميق جيدا لوحة، إضافة 300 ميكرولتر من وسائل الإعلام في 35 بئرا. تلقيح كل واحد منهم مع سلالة كل منها، باستثناء عامل الاستطالة الحرارية غير مستقرة (EF-Tu)، وختم لوحة مع غشاء تنفس.
ملاحظة: تلقيح اللوحة باستخدام جهاز نسخ متماثل 96 جيدا (انظر جدول المواد). حجم البئر من لوحة عميقة البئر وحجم ثقافة المبتدئين ضرورية. سوف وحدات التخزين أكبر وسائل الإعلام أو أحجام الآبار أصغر يؤدي إلى كثافة بكتيرية مختلفة بسبب عدم اتساق التفرين. - لثقافة EF-Tu، قم بتطعيم 3 مل من وسائط LB في أنبوب ثقافة سعة 14 مل مع غطاء سريع. واحد 3 مل من الثقافة لEF-Tu كافية لثقافة تعبير OnePot واحد.
- احتضان عند 37 درجة مئوية في حين تهتز في 260 دورة في الدقيقة بين عشية وضحاها.
اليوم الثاني:
ملاحظة: تنفيذ كافة الخطوات في درجة حرارة الغرفة ما لم يشر إلى خلاف ذلك.
- نقل 500 مل من وسائط LB و 500 ميكرولتر من AMP إلى القارورة العقيمة المحيرة.
- تلقيح ثقافة OnePot PURE مع 1675 ميكرولتر من ثقافة EF-Tu و 55 ميكرولتر لكل ثقافة من الثقافات من لوحة البئر العميقة(الجدول 2).
ملاحظة: خلال هذه الخطوة، يمكن تعديل التركيب الكلي للبروتين عن طريق ضبط نسب التطعيم. تأكد من أن حجم التطعيم الكلي يبقى ثابتا عند 3.6 مل.
اختياري: للتأكد من أن جميع السلالات قد نمت بين عشية وضحاها، وقياس الكثافة البصرية للثقافات بين عشية وضحاها في 600 nM (OD600) في لوحة 96 جيدا باستخدام لوحة القارئ. استخدام تخفيف 10x لقياس الكثافة البصرية. - احتضان الثقافة لمدة 2 ساعة في 37 درجة مئوية مع اهتزاز 260 دورة في الدقيقة، أو حتى OD600 من الثقافة تصل إلى 0.2-0.3.
- حث الثقافة مع 500 ميكرولتر من 0.1 M M IPTG وتنمو لمدة 3 ساعات إضافية.
- حصاد الخلايا عن طريق الطرد المركزي في 4 درجة مئوية و 3220 × ز لمدة 10 دقيقة وتخزين بيليه الخلية في -80 درجة مئوية حتى مزيد من الاستخدام.
ملاحظة: لتحسين التوقيت، قم بإعداد محلول الطاقة الموضح في القسم 4 خلال أوقات الحضانة في اليوم الثاني(الجدول 1).
اليوم الثالث:
- قياس كميات المخازن المؤقتة اللازمة للتنقية الموضحة في الخطوات أدناه وإضافة TCEP إلى كل منهم على النحو المبين في الجدول التكميلي 2. تخزين المخازن المؤقتة المتبقية دون TCEP في 4 درجة مئوية لتنقية المستقبل.
- يتوازن العمود المشحون (القسم 2.4) مع 30 مل من المخزن المؤقت A. بعد مرور 25 مل من المخزن المؤقت A، أغلق العمود من الأسفل. بالتوازي مع ذلك، تابع الخطوات 2.15-2.17.
- إذابة الخلايا واستخدام ماصة المصلية لإعادة إنفاق بيليه الخلية في 7.5 مل من العازلة A.
- Lyse الخلايا باستخدام سونيكاتور مسبار 130 واط (انظر جدول المواد، قطر طرف التحقيق: 6 مم) مع المعلمات التالية: 4 × 20 نبضة على ، 20 نبضة s قبالة ، 70 ٪ السعة. إذا سونيكيشن ناجحة، والحل سوف تتحول أغمق(الشكل 2).
ملاحظة: تأكد من إبقاء الخلايا على الجليد أثناء sonication. ضع المسبار عميقا بما يكفي في المحلول دون لمس الأنبوب. إذا تم توليد كمية كبيرة من الرغوة، سيتم تخميد نقل الطاقة. في هذه الحالة، والسماح للرغوة تسوية، وانخفاض التحقيق أعمق في الحل، وتمديد الوقت سونيكيشن. - إزالة حطام الخلية عن طريق الطرد المركزي في 21130 x g لمدة 20 دقيقة في 4 درجة مئوية مباشرة بعد sonication. أبقي ال(ليسات) على الجليد
- أضف الناسخ الفائق إلى العمود المتساوي. أغلق العمود من الأعلى وتأكد من عدم وجود تسرب. احتضان العمود لمدة 3 ساعة في 4 درجة مئوية تحت دوران باستخدام أنبوب الدوار.
- Elute مكونات غير منضمة من العمود ويغسل مع 25 مل من العازلة A.
- اغسل العمود ب 25 مل من 25 mM imidazole المخزن المؤقت (23.95 مل من المخزن المؤقت A و 1.25 مل من المخزن المؤقت B).
- Elute البروتينات مع 5 مل من 450 mM imidazole العازلة (0.5 مل من العازلة A و 4.5 مل من العازلة B). الحفاظ على البروتينات الملوتة على الجليد في جميع الأوقات.
- تمييع eluate مع 25 مل من العازلة HT، والحفاظ على الخليط على الجليد. أضف 15 مل إلى فلتر طرد مركزي سعة 15 مل وركز على حجم 1.5 مل. أضف المتبقية 15 مل إلى مرشح مع حل مركزة والتركيز على 1.5 مل مرة أخرى.
- إضافة 10 مل من المخزن المؤقت HT إلى العينة المركزة والتركيز إلى 1 مل. إضافة كمية متساوية من المخزن المؤقت للمخزون B وتخزينها عند -80 درجة مئوية حتى مزيد من الاستخدام.
ملاحظة: جولة واحدة من تبادل / تركيز يستغرق حوالي 60 دقيقة الغزل في 3220 × ز في 4 درجة مئوية. - أثناء تبادل المخزن المؤقت استعادة العمود كما هو محدد في المقطع 1.4.
اليوم الرابع:
- قياس تركيز البروتين باستخدام مقايسة برادفورد كما وصفها المورد. ركز العينة باستخدام فلتر طرد مركزي مقطوف سعة 0.5 مل من 3 كيلودا إلى 20 ملغم/مل.
ملاحظة: تمييع محلول البروتين 25-أضعاف أو 50 أضعاف قبل قياسات التركيز لتجنب الإفراط في تشبع المقايسة برادفورد. - لإنشاء تركيز البروتين المثالي، قم بإجراء اختبار التعبير في هذه المرحلة (القسم 5.2) بتركيزات مختلفة من محلول البروتين. لتنفيذ المعايرة، والحفاظ على الحجم الإجمالي للحل ثابت وماصة محلول البروتين OnePot، بما في ذلك المخزن المؤقت ب، في خمس نسب مختلفة (الجدول التكميلي 7).
- تحقق من تكوين البروتين النقي OnePot باستخدام SDS-PAGE (الشكل 3A). تمييع 2.5 ميكرولتر من العينة مع 7.5 ميكرولتر من الماء، وخلط مع 10 ميكرولتر من العازلة Laemmli 2x ومن ثم تحميل 5 ميكرولتر و 2.5 ميكرولتر من العينات إلى هلام. تشغيل SDS-PAGE كما هو محدد في المقطع 1.3.3.
- Aliquot محلول البروتين إلى 50 ميكرولتر aliquots بعد التحقق من التعبير وضبط التركيز. تخزين محلول البروتين ونبوت PURE في -80 درجة مئوية حتى مزيد من الاستخدام.
ملاحظة: إذا كان يشتبه في وجود مكون بروتين، أو كان موجودا بتركيز أقل من المتوقع في OnePot PURE، قم بتنفيذ الخطوات التالية. - تحقق مما إذا كانت الثقافة بين عشية وضحاها من سلالة كل منها نمت بمعدل مماثل للثقافات الأخرى من خلال إجراء قياسات الكثافة البصرية (OD600)من جميع الثقافات.
- إجراء اختبار تعبير إضافي للسلالة محددة للتحقق من التعبير عن البروتين المشتبه به.
3. حل ريبوسوم
ملاحظة: يتم تقديم استراتيجيتين مختلفتين لتنقية الريبوسوم، واحدة للهيكساهيستيدين الموسومة وواحدة للريبوسومات غير الموسومة. الميزة الرئيسية لطريقة تنقية باستخدام تنقيته على تقارب قياسي ني-NTA عمود تدفق الجاذبية هو أن تنقية سهلة وسريعة، ولا يتطلب معدات مختبرية إضافية، مثل نظام FPLC والطرد الفائق. ومع ذلك ، فإن القدرة على إنتاج البروتين في ردود فعل OnePot PURE حوالي الثلث مقارنة بالريبوسومات الخالية من العلامات. لذلك، اختر طريقة لإنتاج الريبوسوم على أساس ما إذا كان العائد المرتفع مهما للتطبيق المحدد.
-
له الموسومة تنقية الريبوسوم
ملاحظة: يستخدم هذا البروتوكول سلالة E. coli RB1، وهي هدية من البروفيسور وانغ (جامعة كولومبيا، الولايات المتحدة الأمريكية)18. هذه السلالة لديها إدراج الجينوم من علامة hexahistidine على نهاية C من البروتين ريبوسوم 50S (L7/L12)، مما يسمح لتنقية باستخدام عمود ني-NTA الجاذبية تدفق. العائد المعتاد هو حوالي 0.5 مل من 3.45 ميكرومتر ريبوسومات، وهو ما يكفي لأكثر من خمسمائة 10 ميكرولتر من ردود الفعل النقية.
اليوم الأول:
- إعداد وسائل الإعلام الثقافة البكتيرية والمكملات الإعلامية على النحو المبين في الجدول التكميلي 1.
- إعداد وتعقيم المواد المطلوبة، بما في ذلك نصائح ماصة، قارورة واحدة 5 L Erlenmeyer، وقارورة Erlenmeyer 100 مل.
- إعداد المخازن المؤقتة والمكملات الغذائية كما هو موضح في الجدول التكميلي 2. تصفية تعقيم جميع المخازن المؤقتة باستخدام مرشحات زجاجة أعلى (0.45 ميكرومتر) وتخزينها في 4 درجة مئوية.
اليوم الثاني:
- ماصة 5 مل من الراتنج إلى عمود وإعداد العمود على النحو المحدد في القسم 1.4.
ملاحظة: نظرا لارتفاع حجم الراتنج، واستعادة وتنقية يستغرق وقتا أطول بكثير. استخدام عمود مختلف لتنقية الريبوسوم لتجنب التلوث المتبادل وتنظيفه جيدا قبل تنقية. - إعداد ثقافة بين عشية وضحاها من سلالة E. coli RB1 عن طريق تلقيح 35 مل من وسائل الإعلام LB في قارورة Erlenmeyer 100 مل. حضانة عند 37 درجة مئوية في حين تهتز في 260 دورة في الدقيقة.
اليوم الثالث:
ملاحظة: تنفيذ كافة الخطوات في درجة حرارة الغرفة ما لم يشر إلى خلاف ذلك.
- أضف 2 لتر من وسائط LB إلى قارورة معقمة سعة 5 لترات، والقح مع 12 مل من الثقافة بين عشية وضحاها، ثم احتضن لمدة 3-4 ساعات عند 37 درجة مئوية أثناء الاهتزاز عند 260 دورة في الدقيقة.
ملاحظة: بدلا من ذلك، إجراء زراعة البكتيريا في 4 × 500 مل من الثقافات في 1 لتر قوارير حائرة. - بيليه الخلايا عن طريق الطرد المركزي لمدة 10 دقيقة في 3220 × ز و 4 درجة مئوية. يخزن عند -80 درجة مئوية حتى يتم استخدامه مرة أخرى.
اليوم الرابع:
- إعادة توازن العمود المعد في الخطوة 3.1.4. مع 30 مل من تحلل العازلة.
- Resuspend بيليه في 20 مل من العازلة تحلل باستخدام ماصة المصلية.
- Lyse الخلايا مع سونيكاتور مسبار 130 واط (انظر جدول المواد، قطر طرف التحقيق: 6 مم) على الجليد مع المعلمات التالية: 11 × 20 نبضة على ؛ 20 نبضة، 70٪ سعة (انظر الخطوة 2.16 للحصول على تفاصيل الإجراء).
- بعد صوتنة مباشرة، قم بإزالة حطام الخلية عن طريق الطرد المركزي لمدة 20 دقيقة عند 21130 × ز عند 4 درجات مئوية. أبقي ال(ليسات) على الجليد
- تحميل supernatant إلى الأعمدة والسماح لها بالمرور.
- اغسل العمود بالخليط التالي من التحلل ومخازن التحلل المؤقتة.
- غسل 0: استخدام 30 مل من العازلة تحلل.
- غسل 1: استخدام 30 مل من 5 mM imidazole (29 مل من العازلة تحلل, 1 مل من العازلة elution).
- غسل 2: استخدام 60 مل من 25 mM imidazole (50 مل من العازلة تحلل, 10 مل من العازلة elution).
- غسل 3: استخدام 30 مل من 40 mM imidazole (22 مل من العازلة تحلل, 8 مل من العازلة elution).
- غسل 4: استخدام 30 مل من 60 mM imidazole (18 مل من العازلة تحلل, 12 مل من العازلة elution).
- Elute الريبوسومات مع 7.5 مل من العازلة elution. الحفاظ على البروتينات الملوتة على الجليد في جميع الأوقات.
- إضافة 22 ميكرولتر من β-ميركابتوثانول النقي إلى 45 مل من العازلة ريبوسوم.
تنبيه: β ميركابتوثانول سام. اتخاذ احتياطات السلامة والعمل في غطاء الدخان. - أضف اليواتي إلى فلتر طرد مركزي سعة 15 مل وركز على 1 مل.
- إضافة 15 مل من العازلة ريبوسوم إلى العينة المركزة والتركيز مرة أخرى إلى 1 مل.
ملاحظة: كرر الخطوة السابقة مرتين. - يخزن عند -80 درجة مئوية حتى يتم استخدامه مرة أخرى.
ملاحظة: تستغرق جولة واحدة من التبادل/التركيز حوالي 60 دقيقة من الطرد المركزي عند 3220 × ز عند 4 درجات مئوية. - أثناء تبادل المخزن المؤقت استعادة العمود كما هو محدد في المقطع 1.4.
اليوم الخامس:
- تحديد تركيز الريبوسوم عن طريق قياس الامتصاص في 260 nM من عينة مخففة 1:100 في العازلة ريبوسوم. قيمة امتصاص 10 من محلول مخفف يتوافق مع 23 ميكرومتر من محلول غير مخفف كما هو موضح سابقا16.
- تنفيذ تركيز المخزون النهائي من 3.45 ميكرومتر. لضبط التركيز، تمييع الريبوسومات مع العازلة ريبوسوم أو تركيزها أكثر عن طريق الطرد المركزي في 14000 س ز في 3 كيلودا 0.5 مل فلتر الطرد المركزي في 4 درجة مئوية.
ملاحظة: لتحقيق التعبير الأمثل للنظام، قم بإجراء المعايرة تركيز الريبوسوم (القسم 5.2، الجدول التكميلي 7). - تحقق من تكوين الريبوسوم باستخدام SDS-PAGE (الشكل 3A) كما هو محدد في القسم 1.3.3. تمييع 2.5 ميكرولتر من العينة مع 7.5 ميكرولتر من الماء، ومزيج مع 10 ميكرولتر من العازلة Laemmli 2x، ومن ثم تحميل 5 ميكرولتر و 2.5 ميكرولتر من العينات على هلام.
-
تنقية الريبوسوم الخالية من العلامات
ملاحظة: يتم تنفيذ تنقية الريبوسوم خالية من العلامات باستخدام نظام FPLC (جدول المواد) ويستند إلى اللونيات التفاعل الكاره للماء باستخدام أعمدة بوتيل 2 × 5 مل (جدول المواد). على الرغم من أن الريبوسومات قد يتم تنقيتها من أي سلالة، وذلك باستخدام E. coli A19 (E. كولاي الموارد الوراثية في جامعة ييل CGSC) سلالة مفيدة بسبب حذف RNase I22. قم بإجراء عملية تنقية عند درجة حرارة 4 درجات مئوية إما في غرفة باردة أو خزانة تبريد. العائد المعتاد هو حوالي 0.5 مل من 10 ميكرومتر ريبوسومات، وهو ما يتوافق مع أكثر من خمسمائة 10 ميكرولتر من ردود الفعل PURE.
اليوم الأول:
- إعداد وسائل الإعلام الثقافة البكتيرية والمكملات الإعلامية على النحو المبين في الجدول التكميلي 1.
- إعداد وتعقيم المواد المطلوبة، بما في ذلك نصائح ماصة، 5 L قارورة إرلينماير، وقارورة إرلينماير 100 مل.
- إعداد المخازن المؤقتة والمكملات الغذائية كما هو موضح في الجدول التكميلي 2. تصفية تعقيم جميع المخازن المؤقتة باستخدام مرشحات زجاجة أعلى (0.45 ميكرومتر) وتخزينها في 4 درجة مئوية.
اليوم الثاني:
- لإعداد ثقافة بين عشية وضحاها من سلالة E. coli A19، تلقيح 35 مل من وسائل الإعلام LB في قارورة Erlenmeyer 100 مل. حضانة عند 37 درجة مئوية في حين تهتز في 260 دورة في الدقيقة.
اليوم الثالث:
- نقل 2 L من وسائل الإعلام LB في قارورة 5 L حائرة معقمة, تلقيح مع 30 مل من الثقافة بين عشية وضحاها, ومن ثم احتضان لمدة 3-4 ساعة في 37 درجة مئوية في حين تهتز في 200 دورة في الدقيقة.
- بيليه الخلايا عن طريق الطرد المركزي في 4000 × ز لمدة 15 دقيقة في 4 درجة مئوية. Resuspend بيليه في 25 مل من العازلة تعليق وتخزينها في -80 درجة مئوية حتى مزيد من الاستخدام.
اليوم الرابع:
- تنفيذ الخطوات 3.2.8-3.2.12 بالتوازي مع الخطوات 3.2.13-3.2.19.
- إذابة الخلايا ويزي باستخدام سونيكاتور مسبار 130 واط (انظر جدول المواد وقطر طرف المسبار: 6 مم) على الجليد مع المعلمات التالية: 12 × 20 نبضة على؛ 20 نبضة إيقاف، 70٪ السعة (انظر الخطوة 2.16 تفاصيل الإجراء).
- إزالة حطام الخلية فورا عن طريق الطرد المركزي في 20000 س ز لمدة 20 دقيقة في 4 درجة مئوية.
- يستنشق supernatant وقياس حجم. إضافة حجم متساو من العازلة تعليق (الملح العالي) لضبط التركيز النهائي لكبريتات الأمونيوم إلى 1.5 M وتخلط جيدا.
- إزالة الترسب عن طريق الطرد المركزي في 20000 س ز لمدة 20 دقيقة في 4 درجة مئوية.
- تصفية supernatant باستخدام 0.45 ميكرومتر البولي إيثرسولفون غشاء حقنة مرشح قبل تنقية FPLC وجمع filtrate في زجاجة 100 مل. حافظ على الناسخة الفائقة عند 4 درجات مئوية في جميع الأوقات.
- إعداد نظام FPLC لتنقية الكروماتوغرافيا التفاعل المائي باستخدام عمود بوتيل مزدوج (2 × 5 مل) على النحو التالي. بالنسبة لهذا الإعداد، تشير وحدة تخزين عمود واحد (CV) إلى وحدة تخزين 10 مل.
- ستكون هناك حاجة إلى ثلاثة مداخل: اثنان كخطوط عازلة وواحد كخط عينة. نظرا للإعدادات الافتراضية جهاز تنقية، من الملائم اختيار الخطين A1 وB1 للحاجز C وD المخزن المؤقت، على التوالي، والخط A2 كخط العينة. تطبيق معدل تدفق افتراضي 4 مل/ دقيقة، باستثناء غسل المضخة (10 مل/دقيقة) أو ما لم يذكر خلاف ذلك.
ملاحظة: كما TCEP هو كاشف مكلفة إضافة المبلغ المطابق إلى المخازن المؤقتة C و D فقط بعد خطوة التوازن. - إجراء نظام مضخة غسل في 20٪ ((v/v)) الإيثانول لتنظيف النظام وإزالة التلوث المحتمل من عمليات التنقية السابقة. تعيين معدل تدفق يدويا من 0.2 مل / دقيقة وتركيب العمود. أوقف التدفق.
- تنفيذ نظام مضخة يغسل بالماء. غسل العمود مع 3 السيرة الذاتية من الماء.
- التوازن: ضع المداخل A1 و A2 في المخزن المؤقت C والمدخل B1 في المخزن المؤقت D بدون TCEP. تنفيذ غسل مضخة وتتوازن العمود مع 4 السيرة الذاتية من C العازلة.
- إضافة TCEP إلى المخازن المؤقتة C و D.
- إعداد أنابيب 15 مل أو أنابيب جمع الكسور المستديرة واضحة إلى جامع الكسور لجمع 4-5 مل كسور elution.
- التحميل: ضع مدخل A2 في الزجاجة مع العينة المصفاة. تحميل حوالي 90٪ من حجم العينة على العمود. تمييع العينة مع 20 مل من المخزن المؤقت C المحتوي على TCEP، وتحميل 10 مل من العينة على العمود. كرر خطوة التخفيف مرتين على الأقل وحمل أكبر قدر ممكن من العينة على العمود. من المهم جدا التأكد من عدم امتصاص أي هواء في الجهاز.
- غسل الخطوة 1: غسل مع 3 السيرة الذاتية من C العازلة لإزالة المكونات غير منضم.
- غسل الخطوة 2: غسل مع 5 السيرة الذاتية من 80٪ العازلة C و 20٪ العازلة D.
- Elution: elute المنتج عن طريق تطبيق 50٪ من العازلة C و 50٪ من D العازلة، مع حجم elution مجموع 5 CV. جمع هذا الكسر في أنابيب جامع.
- غسل الخطوة 3: Elute جميع الملوثات التفاعل بقوة باستخدام 100٪ العازلة D مع حجم إجمالي قدره 5 السيرة الذاتية.
- تحليل طيف امتصاص جزء العينة عند 260 أو 280 nM (الشكل 4). تظهر القمة الأولى البروتينات غير الممتصة التي يتم ذرها أثناء التحميل وخطوة الغسيل الأولى. تظهر القمة الثانية الملوثات التي تم إلتهابها خلال خطوة الغسيل الثانية. تراقب القمة الثالثة المنتج النهائي، وتظهر القمة الأخيرة الملوثات المتفاعلة بقوة. تجميع كافة الكسور عينة المقابلة إلى الذروة الثالثة لمزيد من المعالجة. الحفاظ على البروتينات الملوتة على الجليد في جميع الأوقات.
- تراكب بلطف كسر تعافى على 15 مل من العازلة وسادة في أربعة أنابيب الطرد الفائق البولي. أضف 15 مل كحد أقصى من العينة إلى 15 مل من المخزن المؤقت للوسادة. تأكد من تحقيق التوازن بين وزن الأنبوب جيدا. بيليه الريبوسومات عن طريق الطرد المركزي الفائق في 100000 س ز في 4 درجة مئوية لمدة 16 ساعة.
ملاحظة: تأكد من عدم وجود أي شقوق في أنابيب الطرد المركزي الفائق. - تنظيف وإعادة تعيين العمود كما يلي. معدل تدفق 5 مل / دقيقة يعمل بشكل جيد. وضع جميع مداخل في الماء وتنفيذ غسل مضخة. غسل العمود مع 2 السيرة الذاتية من الماء.
- ضع المدخل في محلول NaOH 0.5 M ، قم بإجراء غسل المضخة ، ثم اغسل العمود ب 3 سيرة ذاتية من NaOH.
- ضع المدخل في الماء، قم بغسل المضخة، ثم اغسل العمود في 2 CV من الماء.
- ضع المدخل إلى محلول حمض الخليك 0.1 M ، قم بإجراء غسل المضخة ، ثم اغسل العمود ب 3 سيرة ذاتية من محلول حمض الخليك.
- ضخ غسل وغسل العمود مع 2 السيرة الذاتية من الماء.
- ضع جميع المداخل في الإيثانول بنسبة 20٪ (v/v)) ، ونفذ خطوة غسل المضخة ، وخزن العمود في 20٪ ((v /v)) الإيثانول عن طريق غسله ب 3 سيرة ذاتية من محلول الإيثانول بنسبة 20٪ ((v/v).)
ملاحظة: تأكد من أن النظام لا يعمل أبدا الجافة أو تمتص في الهواء. لا تقم أبدا بتطبيق العازلة مباشرة على الإيثانول، أو الإيثانول إلى المخزن المؤقت. دائما إضافة خطوة غسل المياه في ما بين، وإلا هناك خطر من الرواسب انسداد العمود. تأكد من إضافة أنابيب جمع عينات كافية.
اليوم الخامس:
- تجاهل supernatant وبعناية، دون إزعاج بيليه شفافة، وغسل كل بيليه مع 0.5 مل من الجليد الباردة الريبوسوم العازلة. كرر هذه الخطوة مرتين.
- Resuspend كل من الكريات واضحة في 100 ميكرولتر من العازلة ريبوسوم على الجليد باستخدام شريط اثارة المغناطيسي (قطر 3 MM، 10 طول MM) على stirrer المغناطيسي باستخدام أقل سرعة ممكنة. جمع ريبوسومات resuspended وغسل الأنابيب مع إضافية 50 ميكرولتر من العازلة ريبوسوم.
ملاحظة: من الصعب رؤية الكريات الشفافة. لذلك، اغسل البيليه بعناية من جانبي الأنبوب. - تحديد تركيز الريبوسوم عن طريق قياس الامتصاص في 260 nM من العينة المخفف بنسبة 1:100 في العازلة ريبوسوم. امتصاص 10 من محلول مخفف يتوافق مع 23 ميكرومتر من محلول غير مخفف كما هو موضح سابقا16.
- تنفيذ تركيز المخزون النهائي من 10 ميكرومتر. لضبط التركيز، تمييع الريبوسومات مع العازلة ريبوسوم أو تركيزها أكثر عن طريق الطرد المركزي في 14000 س ز في مرشح الطرد المركزي 3 كدا في 4 درجة مئوية.
ملاحظة: لتحقيق التعبير الأمثل للنظام، قم بإجراء المعايرة الريبوسومية (القسم 5.2، الجدول التكميلي 7). - تحقق من تكوين ريبوسوم مع SDS-PAGE (الشكل 3A) كما هو محدد في القسم 1.3.3. تمييع 2.5 ميكرولتر من العينة مع 7.5 ميكرولتر من الماء، ومزيج مع 10 ميكرولتر من العازلة Laemmli 2x، ومن ثم تحميل 5 ميكرولتر و 2.5 ميكرولتر من العينات إلى هلام.
4. حل الطاقة
ملاحظة: تكوين حل الطاقة 2.5x المقدمة هنا هو مثال على الحل الذي يعمل بشكل جيد لرد فعل TX-TL القياسية. لتحسين التوقيت، قم بإعداد حل الطاقة خلال اليوم الثاني. يتم شرح إعداد محلول الأحماض الأمينية بالتفصيل ، يليه إجراء التحضير النهائي.
- محلول الأحماض الأمينية
ملاحظة: إعداد محلول الأحماض الأمينية بكميات كبيرة. إعداد كمية من الأحماض الأمينية حلول المخزون المطلوبة لحجم النهائي من 2000 ميكرولتر على الأقل سوف يقلل من خطأ في الوزن لكميات صغيرة جدا خلاف ذلك. التركيز الكلي للمحلول الأحماض الأمينية محدودة من قبل الذوبان من الأحماض الأمينية وتركيزات الأسهم حل كل منها. لنظام PURE القياسي، قم بإعداد حل بتركيز نهائي قدره 3.25 mM. استخدم جدول حساب محلول الأحماض الأمينية(الجدول التكميلي 3)كقالب. استخدام السيستين في شكل ملح لضمان الذوبان كافية. تجنب استخدام أساليب إعداد الأحماض الأمينية المستندة إلى KOH. فمن الممكن أن تزن مباشرة الكميات الدقيقة من الأحماض الأمينية في الحل النهائي للأحماض الأمينية دون إعداد حل الأسهم لجميع الأحماض الأمينية. ومع ذلك ، فإن هذا هو أكثر تحديا وأقل دقة.- إعداد حلول المخزون لكل الأحماض الأمينية كما هو موضح في الجدول التكميلي 3, باستثناء التيروزين.
ملاحظة: نظرا للزلوبيلات المختلفة للأحماض الأمينية في الماء ، تختلف التركيزات المقترحة لحل المخزون. - الحد الأدنى من الكتلة [ملغ] يوفر الحد الأدنى التقريبي للكتلة المطلوبة للحصول على كمية كافية من محلول المخزون للحجم الإجمالي المستهدف، كمرجع.
ملاحظة: يتم حساب الحد الأدنى من الكتلة مع فائض 10٪. - لإعداد أسهل من الحلول، لا تزن الكمية الدقيقة من الأحماض الأمينية، ولكن بدلا من ذلك، للكتلة في متناول اليد، وضبط كمية المياه لتحقيق التركيز المطلوب. حساب كمية المياه deionized (المياه لإضافة [μL]) اللازمة، استنادا إلى الكتلة الفعلية شغلها في (الخلايا الصفراء الخفيفة) والتركيز المطلوب باستخدام جدول البيانات في الجدول التكميلي 3.
- Solubilize حلول المخزون الأحماض الأمينية عن طريق الدوامة حتى يذوب كل عجل. يمكن تخزين المحاليل الفردية مخزون الأحماض الأمينية في -20 درجة مئوية لعدة أسابيع.
ملاحظة: بعض الأحماض الأمينية من الصعب أن تذوب في الماء; قد تستغرق العملية بعض الوقت. - تزن الكمية الدقيقة من التيروزين المطلوبة للحصول على تركيز النهائي من 3.25 mM مباشرة في أنبوب لمحلول الأحماض الأمينية.
ملاحظة: التيروزين من الصعب جدا أن تذوب في الماء. إضافته مباشرة بدلا من إعداد حل المخزون. - إضافة كميات المقابلة من الأحماض الأمينية حلول الأوراق المالية والمياه على النحو المبين في المجلد النهائي لإضافة [μL] العمود (الخلايا الزرقاء الخفيفة) ودوامة الحل بشكل جيد. تخزين محلول الأحماض الأمينية المكتملة في -80 درجة مئوية حتى مزيد من الاستخدام.
- إعداد حلول المخزون لكل الأحماض الأمينية كما هو موضح في الجدول التكميلي 3, باستثناء التيروزين.
- إعداد حل الطاقة
ملاحظة: في المجموع، يحتوي محلول الطاقة 2.5x على 0.75 مللي متر من كل حمض أميني، 29.5 مللي متر من خلات المغنيسيوم، 250 مللي متر من الغلوتامات البوتاسيوم، 5 مللي متر من ATP و GTP لكل منهما، 2.5 مللي متر من CTP، UTP، و TCEP، على التوالي، 8.75 ملغم / مل من الحمض النووي الريبي من E. coli MRE 600، 50 مللي متر من فوسفات الكرياتين، 0.05 mM من حمض الفولينيك، 5 مليون متر من الحيوانات المنوية، و 125 مليون متر من HEPES. المستخدمين لأول مرة إعداد حل الطاقة في دفعات صغيرة من 200 ميكرولتر. تخزين الحلول الفردية المعدة وفقا للجدول التكميلي 4 في -20 درجة مئوية أو -80 درجة مئوية للاستخدام في وقت لاحق.- إذابة جميع الحلول المائية المذكورة في الجدول التكميلي 5 على الجليد.
- وفي الوقت نفسه، قم بإعداد حلول المخزون للمكونات المتبقية المدرجة في الجدول التكميلي 4. الحفاظ على جميع الحلول على الجليد بعد التحضير.
ملاحظة: أضف 500 ميكرولتر من المياه الخالية من RNase و DNase مباشرة إلى القارورة لإذابة الحمض النووي الريبي الليوفيلي. تخلط جيدا عن طريق دوامة لطيف. الحد من الأنابيب لتجنب إدخال RNases. - إضافة كميات محسوبة (الجدول التكميلي 5) من حلول المخزون والمياه وخلط جيدا باستخدام دوامة. الحفاظ على الحل على الجليد في جميع الأوقات.
- قياس درجة الحموضة للمحلول عن طريق pipetting 1 ميكرولتر على شريط درجة الحموضة، لضمان أن درجة الحموضة للحل محايدة.
- Aliquot حل الطاقة في 50-100 ميكرولتر لكل أنبوب على الجليد وتخزينها في -80 درجة مئوية حتى مزيد من الاستخدام. بينما aliquoting، دوامة المخزون الرئيسي في كثير من الأحيان لمنع المكونات من التعجيل.
ملاحظة: اختياريا، إجراء اختبار نشاط لحل الطاقة المصنوع حديثا ضد حلول الطاقة التجارية، مثل الحل A في PURExpress. إذا لوحظ أداء أقل بكثير للنظام مع محلول الطاقة، وتحسين تركيزات الأيونات، وخاصة أيونات المغنيسيوم، عن طريق المعايرة (5-20 mM) قد تكون مفيدة.
5. رد فعل OnePot PURE
- قالب الحمض النووي
ملاحظة: يمكن التعبير عن البروتينات المشفرة في المصب من المروج T7 في PURE من الحمض النووي الخطي أو الدائري. من خلال إنشاء قالب الحمض النووي الخطي باستخدام PCR التمديد، يمكن حذف خطوات الاستنساخ مملة. تم إنشاء القوالب الخطية لهذه الدراسة بواسطة PCR كما هو موضح أدناه ، باستخدام بوليمرات الحمض النووي عالي الدقة(جدول المواد). يتم تحديد تسلسلات التمهيدي ودرجات الحرارة الذائبة وإعدادات الترموسيكلر المستخدمة في هذه الدراسة في الجدول التكميلي 6. لا يتم تضمين إعداد قالب الحمض النووي في الجدول الزمني اليومي.- إعداد تفاعل PCR كما أوصى به مورد البوليميراز.
ملاحظة: المعلمات الأمثل لبوليميراز الحمض النووي عالية الدقة(جدول المواد)تعطى في الجدول التكميلي 6. - تضخيم الجين المستهدف (مثل eGFP) كقالب خطي من البلازميد أو الجينوم باستخدام التمهيديات الخاصة بالجينات (500 nM) (للاطلاع على المعلمات، انظر الجدول التكميلي 6).
- التضخيم بإنشاء ملحقات قصيرة لتوفير تسلسلات التلين للخطوات PCR الملحق التالي.
- تحقق من أمبليكون على هلام الآغاروز للحجم الصحيح والنقاء.
- استخدم الحمض النووي مكبرة كقالب للخطوات التمديد اللاحقة. إعداد رد فعل لا يقل عن 50 ميكرولتر.
- تشغيل 10 دورات تضخيم PCR مع التمهيديات التمديد (2.5 nM). بعد الانتهاء من دورات التضخيم، إضافة على الفور التمهيديات النهائية (500 nM) إلى نفس رد الفعل وتشغيل 30 دورات لتضخيم المنتج PCR الموسعة. العثور على درجات الحرارة ذوبان وتسلسل التمهيدي في الجدول التكميلي 6.
- تنقية شظايا الحمض النووي باستخدام مجموعة تنقية الحمض النووي وe elute الحمض النووي في المياه الخالية من النيوكليز بدلا من EDTA التي تحتوي على العازلة elution.
- تحقق من القالب الخطي على هلام الآغاروز للحجم الصحيح والنقاء.
- قياس تركيز الحمض النووي في نانوغرام / ميكرولتر باستخدام مطياف الأشعة فوق البنفسجية فيس.
- إعداد تفاعل PCR كما أوصى به مورد البوليميراز.
- إعداد رد فعل PURE
ملاحظة: تكوين رد الفعل النهائي هو حل الطاقة 1x، الريبوسومات خالية من العلامات أو ريبوسومات له العلامة، بروتينات OnePot PURE، وقالب الحمض النووي. نسبة حجم التفاعل تضم 40٪ حل الطاقة, 30٪ البروتين والحل ريبوسوم, و 30٪ الحمض النووي والماء. تتراوح أحجام التفاعل النموذجية بين 5 ميكرولتر و25 ميكرولتر. استخدام الهاء الأخضر in vitro نظام وضع العلامات الترجمة، الذي يتضمن بقايا ليسين المسمى الفلورسنت في البروتينات توليفها حديثا، للتحقق من التعبير عن البروتينات غير الفلورية على هلام SDS-PAGE. ويرد نموذج رد فعل على سبيل المثال في الجدول التكميلي 7 للمساعدة في تأسيس رد فعل التعبير الخالي من الخلايا PURE. تشير الخلايا باللون الأصفر إلى قيم إدخال المستخدم، وتشير الخلايا باللون البرتقالي إلى وجود كاشفات إضافية لإضافتها اختياريا إلى التفاعل. حافظ على دقة نسب حجم المكونات لضمان توازن الأيونات الصحيح. على سبيل المثال، لتحقيق تركيز البروتين أعلى، وزيادة تركيز محلول البروتين OnePot. ومع ذلك، لا تزيد من حجم محلول البروتين المضافة إلى رد الفعل.- املأ التركيز [نانوغرام/ميكرولتر] وطول [أزواج الأساس] للحمض النووي في الخلايا الصفراء المقابلة في جدول البيانات. استخدام 2-10 نم من الحمض النووي لرد الفعل.
- ملء في حجم رد الفعل الإجمالي المطلوب في μL.
- إزالة الكواشف المطلوبة من الثلاجة وتذوب لهم على الجليد.
ملاحظة: إعادة تجميد المكونات ممكن دون انخفاض في الأداء الوظيفي. ومع ذلك، تقليل عدد دورات التجميد والذوبان والعينات الزمنية المخزنة على الجليد قدر الإمكان. - ماصة كميات محسوبة من الماء والحمض النووي، ومحلول الطاقة إلى جانب واحد من أنبوب PCR أو زاوية واحدة من بئر على لوحة 384 جيدا. أضف المبلغ المطلوب لأي كاشف إضافي على نفس الجانب. تقليل عدد العينات لكل تجربة لتجنب تبخر العينة والتحيز التجريبي لوقت البدء.
ملاحظة: من المهم الحفاظ على عنصر الطاقة منفصلا ماديا عن مكونات البروتين لتجنب الاستهلاك المبكر لمصادر الطاقة وانخفاض الغلة. - ماصة كميات محسوبة من البروتين والحل ريبوسوم إلى الجانب الآخر من أنبوب PCR أو الزاوية المقابلة من لوحة 384 جيدا.
ملاحظة: استخدام خلطات رئيسية كلما أمكن لتقليل تأثير أخطاء ماسورة. بعد الاختبار الأولي، يمكن خلط الريبوسوم وحلول البروتين وتخزينها كحل واحد. - تدور لفترة قصيرة (30 ق) لدمج مكونات رد الفعل. لمنع التبخر أثناء تجارب قارئ اللوحة، أضف 35 ميكرولتر من الشمع السائل وختم اللوحة بسائل مانع للتسرب شفاف (انظر جدول المواد).
- حضانة لمدة لا تقل عن 3 ساعة في 37 درجة مئوية.
- للقراءة على قارئ لوحة، وقياس كثافة مضان في الطول الموجي المطلوب كل 2 دقيقة (تظهر النتائج التمثيلية في الشكل 3B).
- تنفيذ الخطوات التالية للحصول على عينات Lys الخضراء المسمى.
- بعد التعبير الخالي من الخلايا، احتضن العينة ب 0.16 ميكروغرام/ميكرولتر من RNase A لمدة 30 دقيقة عند 37 درجة مئوية لإزالة الخلفية الفلورية لمجموعة وضع العلامات على الليس الخضراء.
ملاحظة: استخدام RNase A، كما لا تقم بإزالة أنواع أخرى من RNases الخلفية بشكل جيد بما فيه الكفاية. - تصور التعبير البروتيني عن طريق تشغيل SDS-PAGE كما هو محدد في القسم 1.3.3. اغسل الجل غير الملطخ برفق في الماء المتأين، وصوره على صور فلورية باستخدام طول موجي مثير 488 نانومتر.
- في وقت لاحق، وصمة عار الجل باستخدام أساليب تلطيخ Coomassie التقليدية. للاطلاع على المعلمات المناسبة انظر القسم 1-3-3.
ملاحظة: إجراء المعايرة من محلول البروتين مع تركيز الريبوسوم الموصى بها، وإذا لزم الأمر، ريبوسومات titrate مع تركيز البروتين OnePot الأمثل بعد ذلك. استخدام مجموعة PURExpress ΔRibosome التجارية كعنصر تحكم إيجابي. الحل A، عامل ميكس، والحل ريبوسوم تتوافق مع الطاقة المعدة، والحل البروتين OnePot، والريبوسومات المنقى، على التوالي.
النتائج
تم تصميم البروتوكول أعلاه لتسهيل إنشاء نظام PURE TX-TL الخالي من الخلايا في أي مختبر. يتضمن البروتوكول وصفا مفصلا لإعداد الأجزاء الثلاثة المتميزة من نظام PURE: بروتين OnePot ، الريبوسوم ، وحل الطاقة. يظهر جدول يومي مفصل، يعمل على تحسين سير العمل، في الجدول 1. تم تحسين سير العمل لتنقية الريبوسومات الموسومة به ، وقد تختلف الأطر الزمنية قليلا إذا تم تنفيذ تنقية الريبوسوم الخالية من العلامات. إعداد واحد يوفر كمية كافية من PURE لتفاعلات 10 10 50 على الأقل. وعلاوة على ذلك، فإن الحلول المعدة مستقرة لأكثر من عام عند -80 درجة مئوية ويمكن أن تصمد أمام دورات التجمد والذوبان المتعددة.
مستويات التعبير المفرط الكافية لجميع السلالات حاسمة بالنسبة لوظائف محلول البروتين النهائي. يظهر الشكل 1 فرط التعبير الناجح في جميع السلالات الفردية ال 36 المستخدمة لاحقا لإعداد بروتين OnePot. حدث الاختلاف في كثافة نطاق البروتينات المفرطة في التعبير على الأرجح بسبب التحيز في أحجام التحميل على هلام SDS-PAGE. يتم تلخيص أحجام البروتين المتوقعة في الجدول 2. GlyRS و PheRS تتكون من اثنين من وحدات فرعية من مختلف الأوزان الجزيئية; البروتينات المتبقية 34 تتكون من وحدة فرعية واحدة. مفتاح بساطة هذا البروتوكول وفعاليته الزمنية هو خطوة coculturing والتنقية المشتركة(الشكل 2). تم إعداد محلول بروتين OnePot عن طريق زيادة نسبة سلالة EF-Tu فيما يتعلق بجميع سلالات التعبير الأخرى. تم تحليل التركيب العام للبروتينات النهائية من قبل SDS-PAGE (الشكل 3A). من المواد الهلامية (lanes 2، 3)، فمن الملاحظ أن EF-Tu (43.3 كيلودا) موجود في تركيز أعلى مقارنة بالبروتينات الأخرى، كما هو متوقع. في حين أن الجل يوفر مؤشرا أول جيدا لنسب التعبير عن البروتين، فإنه من الصعب تحديد ما إذا كان ومستوى كل بروتين فردي أعرب. لذلك ، يوصى بشدة بتأكيد التعبير المفرط في كل سلالة قبل coculturing ، كما هو موضح أعلاه.
وE. القولونية ريبوسوم هو آلة الجزيئية المعقدة تتألف من أكثر من 50 وحدة فرعية البروتين الفردية23. يظهر طيف امتصاص تمثيلي عند 260 نانومتر لتنقية الريبوسوم الخالي من العلامات في الشكل 4؛ الذروة الثالثة هي سمة من سمات elution ريبوسوم ناجحة. لكلا أساليب تنقية الريبوسوم، لوحظ نمط التشغيل المتوقع على هلام SDS-PAGE (الشكل 3A)18. لقد لاحظنا تلوثات لكلا التطهيرين ، وإن كان ذلك بكميات صغيرة (<10٪). وتجدر الإشارة إلى أن ملوثات مختلفة كانت موجودة في الريبوسومات الخالية من العلامات (الممرات 5 و6) والريبوسومات الموسومة به (الممرات 11 و12) بسبب الاختلاف في الطريقة. كمرجع للمستخدم، يتم تضمين المواد الهلامية SDS-PAGE للأنظمة المدمجة أيضا (الممرات 8 و9 و14 و15).
وأخيرا ، يتم مقارنة أداء النظم المعدة(الشكل 3)باستخدام المتغيرات الريبوسوم المختلفة. تظهر الدورات الزمنية للتعبير في المختبر eGFP أن كلا النظامين PURE يعملان وينتجان eGFP فلوريا. ومع ذلك ، فإن محلول بروتين OnePot جنبا إلى جنب مع الريبوسومات الموسومة به ، باستخدام تركيز الريبوسوم الأمثل عن طريق المعايرة ، لم يسفر إلا عن ثلث مستوى التعبير عن الإصدار الريبوسوم غير الموسوم(الشكل 3B). ولوحظت نتائج مماثلة عندما أعرب عن ثلاثة بروتينات من أحجام مختلفة ووصفت باستخدام الأخضر Lys tRNA في نظام وضع العلامات في المختبر (الشكل 3C). وكما رأينا في الجل الفلوري، تم التعبير عن المنتجات كاملة الطول بنجاح في كلا النظامين؛ ومع ذلك، فقط حوالي نصف مستوى التعبير تم تحقيقه مع نظام الريبوسوم له العلامة. بالإضافة إلى وضع العلامات الفلورية ، يمكن تمييز النطاقات المتوقعة لجميع البروتينات الثلاثة على هلام ملطخ بالكوماسي(الشكل 3D). وتبين النتائج أن نظام التعبير المقدم، الذي يمكن إعداده في غضون أسبوع في مختبر مزود بمعدات قياسية، يمكن استخدامه للتعبير المختبري عن البروتينات المشفرة في المصب لمروج T7 من القوالب الخطية.

الشكل 1:النتائج التمثيلية لاختبار التعبير المفرط لجميع سلالات التعبير في نظام PURE. يتم تلخيص أرقام وأحجام البروتين النقي في الجدول 2. يتم وضع علامة على أرقام البروتين 21 و 24 و 27 مع نجمة لتصور أفضل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
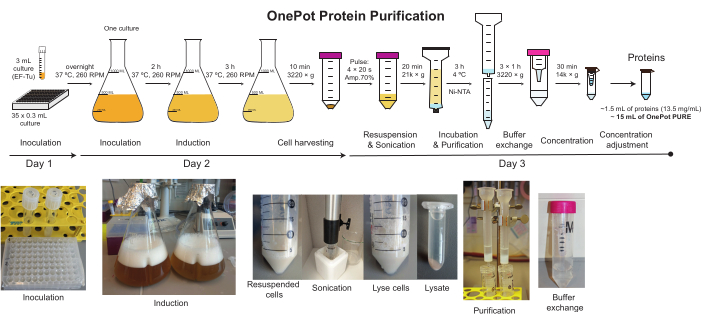
الشكل 2: تنقية البروتين OnePot. تصوير التخطيطي والصور المقابلة لجميع الخطوات المشاركة في إنتاج محلول البروتين OnePot. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: أداء النظم المعدة باستخدام المتغيرات الريبوسوم المختلفة. (أ)Coomassie الأزرق الملون SDS-PAGE المواد الهلامية من محلول البروتين OnePot (الممرات 2، 3)، الريبوسومات خالية من العلامات دون محلول البروتين (الممرات 5، 6) ومع محلول البروتين (الممرات 8، 9)، له الموسومة ريبوسومات دون محلول البروتين (الممرات 11، 12) ومع محلول البروتين (الممرات 14، 15). تم تحميل تركيزين مختلفين لكل عينة. (ب)مقارنة التعبير eGFP له الموسومة ريبوسومات والريبوسومات خالية من العلامات. يتم رصد كثافة الفلورية في المختبر eGFP التعبير مع مرور الوقت لرد فعل PURE باستخدام الريبوسومات خالية من العلامات (1.8 ميكرومتر، الأزرق) والريبوسومات له الموسومة (0.62 ميكرومتر، أحمر). وكانت تركيزات القالب الخطي ومحلول بروتين OnePot 4 nM و 2 ملغم / مل ، على التوالي. لوحات (C) و (D) تظهر هلام SDS-PAGE من البروتينات توليفها في OnePot مع العلامة خالية (1.8 ميكرومتر, الأزرق، والممرات 3، 4، 5) والريبوسومات له العلامة (0.62 ميكرومتر، الأحمر، الممرات 6، 7، 8) وصفت مع GreenLys في طقم وضع العلامات في المختبر (C)وملطخة الأزرق Coomassie(D)،على التوالي. تشير الأسهم السوداء إلى النطاقات المتوقعة من البروتينات المركبة: eGFP (26.9 كيلودا) وArgRS (64.7 كيلودا) و T7 RNAP (98.9 كيلودا). كان القالب الخطي وتركيزات محلول بروتين OnePot 4 nM و 1.6 ملغم / مل ، على التوالي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: أطياف الامتصاص في 260 نانومتر. النتائج التمثيلية لأطياف الامتصاص عند 260 نانومتر أثناء تنقية التفاعل الكاره للماء للريبوسومات الخالية من العلامات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: جدول زمني يومي محسن زمنيا لإعداد جميع حلول OnePot PURE. يرجى النقر هنا لتنزيل هذا الجدول.
الجدول 2: قائمة البروتين PURE يرجى النقر هنا لتحميل هذا الجدول.
الجدول التكميلي 1: الكواشف. يسرد الجدول التركيزات والأحجام والتفاصيل المحددة الأخرى للكواشف والمكونات المستخدمة أثناء هذه الدراسة. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي 2: المخازن المؤقتة. يسرد جدول البيانات التراكيب العازلة الدقيقة للبروتين ، والريبوسوم الخالي من العلامات ، وتنقية الريبوسوم ، بالإضافة إلى تركيزات حلول المخزون المستخدمة لإعدادها. بالإضافة إلى ذلك، فإنه يحسب كميات المطلوبة من المكونات استنادا إلى وحدة التخزين المؤقت. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي 3: حسابات الأحماض الأمينية. يسرد جدول البيانات الأحماض الأمينية وتركيزات محلول المخزون الموصى بها المطلوبة لحل الطاقة. يحسب كمية الماء التي يمكن إضافتها إلى كل حمض أميني استنادا إلى الكتلة الفعلية وزنها، ويحسب أيضا حجم محلول الأحماض الأمينية لإضافته إلى خليط الأحماض الأمينية النهائي. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي 4: حلول المخزون لحل الطاقة. يسرد الجدول تركيزات وحجم حلول المخزون اللازمة لحل الطاقة ويشير إلى مزيد من التفاصيل، بما في ذلك ظروف التخزين. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي 5: حل الطاقة. يسرد الجدول مكونات محلول الطاقة وتركيزاتها الموصى بها. بالإضافة إلى ذلك، فإنه يحسب أحجامها المطلوبة لإضافتها إلى الحل النهائي على أساس تركيزاتها حل المخزون وحجم محلول الطاقة. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي 6: PCR. يسرد الجدول تسلسل وتركيزات المبرمجين المستخدمين في تمديد PCR ويشير إلى درجات حرارة ذوبان وخطوات دورة حرارية محسنة لبوليميراز الحمض النووي عالي الدقة. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي 7: رد فعل نقي. يعرض جدول البيانات إعداد مثال لرد فعل PURE. يسرد التركيزات المستخدمة وأحجام المكونات لرد فعل PURE باستخدام الريبوسومات الخالية من العلامات أو الريبوسومات الوسمية الخاصة به. وعلاوة على ذلك، فإنه يحسب نسب حجم للبروتين والثقيل ريبوسوم. الرجاء الضغط هنا لتحميل هذا الجدول.
Discussion
يصف البروتوكول المعروض هنا طريقة بسيطة وفعالة من حيث الوقت والتكلفة لإعداد نظام تعبير PURE متعدد الاستخدامات20 استنادا إلى التركيب القياسي15. باستخدام البروتوكول جنبا إلى جنب مع الجداول اليومية المقدمة (الجدول 1)، يمكن إعداد جميع المكونات في أسبوع واحد وكميات كافية لكمية تصل إلى خمسمائة 10 ميكرولتر من ردود الفعل PURE. منذ البروتينات المستخدمة في هذا البروتوكول هي overexpressed من plasmids نسخة عالية ولها سمية منخفضة لE. القولونية, ويلاحظ مستويات التعبير الجيد لجميع البروتينات المطلوبة (الشكل 1). وهذا يسمح للتكيف السهل للسلالات، وبالتالي أيضا تكوين البروتين في الثقافات المشتركة، وذلك ببساطة عن طريق تعديل نسب سلالات التطعيم20. وإلى جانب البروتينات الريبوسومية، أظهر تركيز EF-Tu أن تكون ذات أهمية أساسية للتعبير الغلة6. في المقابل، كان للتغيرات في تركيز مكونات البروتين الأخرى تأثير منخفض نسبيا على قوة نظام PURE7،24. ولذلك، من خلال تعديل نسبة التطعيم من EF-Tu فيما يتعلق بجميع المكونات الأخرى، يمكن تحقيق تكوين مماثل لتكوين PURE القياسي، ويمكن تحقيق نظام PURE مع عائد مماثل20. في إعداد محلول البروتين، من المهم جدا ضمان نمو جميع السلالات بشكل جيد وفرط التعبير عن البروتين المشفر بعد الحث(الشكل 1).
وظيفة ريبوسوم هو المفتاح للأداء العام للنظام PURE24. في هذا البروتوكول، يتم عرض طريقتين مختلفتين لإعداد محلول الريبوسوم، أي تنقية الريبوسوم الخالية من العلامات والموسومات. ويستند تنقية الريبوسوم خالية من الوسم على الكروماتوغرافيا التفاعل الكاره للماء تليها الطرد المركزي مع وسادة السكروز، الأمر الذي يتطلب الوصول إلى نظام تنقية FPLC ومطاردة مركزية فائقة15. في المقابل، فإن الطريقة التي تستخدم له الموسومة ريبوسومات18 وتدفق الجاذبية تقارب تنقية الكروماتوغرافيا لا يتطلب معدات متخصصة ويمكن القيام بها في معظم المختبرات. ولذلك، فإن الطريقة الأخيرة تجلب مزايا مثل البساطة وسهولة الوصول. ومع ذلك، لاحظنا انخفاض كبير في غلة التوليف عند استخدام الريبوسومات الموسومة به في OnePot PURE مقارنة بالمتغير الخالي من العلامات(الشكل 3). واستنادا إلى نوع التطبيق، قد يكون هذا العائد المنخفض مقبولا.
يوفر محلول الطاقة مكونات الوزن الجزيئي المنخفضة وRNAs المطلوبة لتغذية تفاعلات TX-TL المختبرية. يوفر هذا البروتوكول وصفة لحل الطاقة النموذجية، والتي يمكن تعديلها بسهولة على أساس احتياجات المستخدم. جنبا إلى جنب مع الحمض النووي الريبي، NTP، والفوسفات الكرياتين، وفرة وتركيز أيونات Mg2+ كانت حاسمة للأداء العام للنظام PURE8،كما أنها عوامل المساعدة الحرجة للنسخ والترجمة. في بعض الحالات، يمكن أن المعايرة الأيونات، وبالتالي، إلى حد كبير تعزيز الأداء العام PURE. سلامة الحمض النووي أمر بالغ الأهمية لأداء PURE. وهكذا، تسلسل التحقق من المنطقة المروج، موقع الربط ريبوسوم، والجين الهدف وضمان أن تركيز الحمض النووي كافية (<2 nM) سوف تساعد على استكشاف المشكلات التي قد تنشأ أثناء إعداد رد فعل PURE.
نظام PURE هو نظام TX-TL الحد الأدنى، وتطبيقات محددة قد تتطلب بالتالي تعديلات إضافية25. قد تشمل هذه دمج البوليمرات RNAمختلفة 9،26، مرافقين13، وعوامل البروتين مثل EF-P أو ArfA8. على الرغم من أن سلالات التعبير عن هذه البروتينات يمكن تضمينها في الثقافات المشتركة، إضافة كل على حدة إلى النظام المعد قد توفر تحكما أفضل في مستويات البروتين المطلوبة. وعلاوة على ذلك، إدراج الحويصلات أمر ضروري لإنتاج بروتينات الأغشية10،11. أكسدة بدلا من الحد من البيئات والايزوميراز السندات ثنائي الكبريتيد تسهيل تكوين السندات ثنائي الكبريتيد السليم، والتي هي، على سبيل المثال، مطلوبة للبروتينات إفرازي12.
من الضروري التأكد من أن أي مكونات إضافية لا تتداخل مع رد الفعل. يتم سرد أهم العوامل التي يجب الانتباه إليها عند إعداد رد فعل أو إضافة مكونات أخرى أدناه. تأكد من عدم استخدام المخازن المؤقتة غير المتوافقة أو إزعاج تركيزات الأيونات. تجنب المحاليل التي تحتوي على الجلسرين، تركيزات عالية من البوتاسيوم، المغنيسيوم، أيونات الكالسيوم، الأوسموليت، البيرفوسفات، المضادات الحيوية، أو EDTA، قدر الإمكان. على سبيل المثال، يمكن أن يكون استبدال العازلة elution بالماء أثناء تنقية الحمض النووي مفيدة كما EDTA هو المضافة الشائعة في هذا المخزن المؤقت. تزويد الحلول مع جزيئات إضافية مشحونة سلبا مثل NTP أو dNTP يتطلب ضبط تركيز المغنيسيوم8، كما تتصرف الجزيئات المشحونة سلبا كعوامل chelating وربط جزيئات مشحونة إيجابيا. درجة الحموضة المحايدة مثالية لرد الفعل. وبناء على ذلك، ينبغي أن تكون جميع المكونات مخزنة مؤقتا إلى الرقم PH المطابق؛ هذا مهم بشكل خاص للجزيئات الحمضية للغاية أو الأساسية مثل NTPs. وأخيرا ، درجة الحرارة والحجم هي المعلمات الرئيسية لرد الفعل. لتحقيق عائد جيد، ينبغي للمرء أن تنفيذ درجة حرارة حوالي 37 درجة مئوية، ودرجات الحرارة أقل من 34 درجة مئوية سوف يقلل بشكل كبير من العائد27.
من المهم ملاحظة أنه قبل إعداد OnePot PURE ، يجب على المرء أن ينظر في التطبيق المستهدف والمتطلبات المرتبطة به ، مثل الحجم والنقاء وسهولة التعديل وإدراج المكونات أو إغفالها. بالنسبة للعديد من التطبيقات ، سيكون النظام خيارا ممتازا ، ولكن قد يتطلب البعض الآخر غلة وقابلية تعديل وعوامل أخرى ، والتي لا يمكن لنظام OnePot توفيرها. وبغض النظر عن ذلك، فإن البروتوكول الذي تم إدخاله سيكون مفيدا لإعداد أي نظام منزلي الصنع، حيث يتم تلخيص جميع الخطوات الحاسمة لمثل هذا الإعداد هنا.
واحدة من المزايا الرئيسية لنظام OnePot هي توافقه مع نظام PURExpress المتاح تجاريا ، والذي يوفر إمكانية اختبار وظائف وسلامة جميع المكونات بشكل منفصل عن طريق استبدال كل مكون PURExpress بشكل متسلسل بمكافئ OnePot الخاص به. إن مزايا نظام OnePot PURE ، مثل التونة والإعداد السهل والسريع والفعال من حيث التكلفة ، ستجعل TX-TL الخالية من الخلايا في متناول المزيد من المختبرات في جميع أنحاء العالم وستساهم في توسيع تنفيذ هذه المنصة القوية في البيولوجيا الاصطناعية الخالية من الخلايا.
Disclosures
ويعلن أصحاب البلاغ أنه ليس لديهم مصالح مالية متنافسة.
Acknowledgements
وقد دعم هذا العمل مجلس البحوث الأوروبي في إطار منحة برنامج أفق 2020 للبحوث والابتكار التابعة للاتحاد الأوروبي 723106، ومنحة المؤسسة الوطنية السويسرية للعلوم (182019)، وEPFL.
Materials
| Name | Company | Catalog Number | Comments |
| 10x Tris/Glycine/SDS buffer | Bio-Rad Laboratories | 1610732 | |
| 15 mL centrifuge tubes | VWR International | 525-0309 | |
| 384-well Black Assay Plates | Corning | 3544 | |
| 4-20% Mini-PROTEANRTM TGXTM Precast Protein Gels | Bio-Rad Laboratories | 4561096 | |
| 50 mL centrifuge tubes | VWR International | 525-0304 | |
| 96-Well Polypropylene DeepWell plate | Nunc | 260252 | |
| Acetic acid, 99.8 % | Acros | 222140010 | |
| Äkta purifier | GE Healthcare | purification of tag free ribosomes | |
| AMICON ULTRA 0.5 mL - 3 KDa | Merck Millipore | UFC500324 | |
| AMICON ULTRA 15 mL - 3 KDa | Merck Millipore | UFC900324 | |
| Amino acids | Sigma-Aldrich | LAA21-1KT | |
| Ammonium chloride | Sigma-Aldrich | 09718-250G | |
| Ammonium sulfate | Sigma-Aldrich | A4418 | |
| Ampicillin | Condalab | 6801 | |
| BenchMark Fluorescent Protein Standard | ThermoFisher | LC5928 | |
| Breathe-Easy sealing membrane | Diversified Biotech | Z380059-1PAK | |
| Centrifuge tubes polycarbonate | Beckman | 355631 | purification of tag free ribosomes |
| Chill-out Liquid Wax | Bio-Rad Laboratories | CHO1411 | |
| Creatine phosphate | Sigma-Aldrich | 27920 | |
| DNA Clean & Concentrator-25 (Capped) | Zymo | ZYM-D4034-200TS | |
| DTT | SantaCruz Biotech | sc-29089B | |
| Econo-Pac Chromatography Columns | Bio-Rad Laboratories | 7321010 | |
| EDTA (Ethylenediaminetetraacetic acid) | Sigma-Aldrich | 03609-250G | |
| Eppendorf Protein LoBind microcentrifuge tubes | VWR International / Eppendorf | 525-0133 | |
| Falcon 14 mL Round Bottom Polystyrene Test Tube, with Snap Cap | Falcon | 352051 | |
| Flasks, baffled 1000 mL 4 baffles, borosilicate glass | Scilabware | 9141173 | |
| FluoroTect Green Lys in vitro Translation Labeling System | Promega | L5001 | optional |
| Folinic acid | Sigma-Aldrich | PHR1541 | |
| Glycerol | Sigma-Aldrich | G7757-1L | |
| HEPES | Gibco | 15630-056 | |
| HiTrap Butyl HP Column | GE Healthcare | 28411005 | purification of tag free ribosomes |
| IMAC Sepharose 6 Fast Flow | GE Healthcare | 17-0921-07 | |
| Imidazole | Sigma-Aldrich | I2399 | |
| InstantBlue | Expedeon | ISB1L-1L | |
| IPTG (Isopropyl-beta-D-thiogalactoside) | Alfa Aesar | B21149.03 | |
| Laemmli buffer (2x), sample buffer | Sigma-Aldrich | S3401-1VL | |
| Lysogeny broth (LB) media | AppliChem | A0954 | |
| Magnesium acetate | Sigma-Aldrich | M0631 | |
| Magnesium chloride | Honeywell Fluka | 63020-1L | |
| Nickel Sulfate | Alfa Aesar | 15414469 | |
| NTP | ThermoFisher | R0481 | |
| Phusion High-Fidelity DNA Polymerase (2 U/µL) | ThermoFisher | F530S | |
| Potassium chloride | Sigma-Aldrich | P5405-1KG | |
| Potassium glutamate | Sigma-Aldrich | 49601 | |
| PURExpress In Vitro Protein Synthesis Kit | NEB | E6800S | |
| PURExpress Δ Ribosome Kit | NEB | E3313S | |
| Quick Start Bradford 1x Dye Reagent | Bio-Rad Laboratories | 5000205 | |
| Rapid-Flow Sterile Single Use Vacuum Filter Units | ThermoFisher | 564-0020 | |
| RNaseA solution | Promega | A7973 | |
| SealPlate film | Excel Scientific | Z369659-100EA | |
| Sodium hydroxide | Sigma-Aldrich | 6203 | |
| Spermidine | Sigma-Aldrich | S2626 | |
| Sucrose | Sigma-Aldrich | 84097 | |
| TCEP (Tris(2-carboxyethyl)phosphin -hydrochlorid) | Sigma-Aldrich | 646547-10X1mL | |
| Thickwall Polycarbonate Tube | Beckman | 355631 | |
| Trichloroacetic acid | Sigma-Aldrich | T0699 | |
| Tris base | ThermoFisher | BP152-500 | |
| tRNA | Roche | 10109541001 | |
| Ultracentrifuge Optima L-80 | Beckman | purification of tag free ribosomes | |
| Whatman GD/X syringe filters | GE Whatman | WHA68722504 | |
| β-mercaptoethanol | Sigma-Aldrich | M6250-100mL |
References
- Laohakunakorn, N., et al. Bottom-up construction of complex biomolecular systems with cell-free synthetic biology. Frontiers in Bioengineering and Biotechnology. 8, 213 (2020).
- Laohakunakorn, N. Cell-free systems: a proving ground for rational biodesign. Frontiers in Bioengineering and Biotechnology. 8, 788 (2020).
- Cho, E., Lu, Y. Compartmentalizing cell-free systems: toward creating life-like artificial cells and beyond. ACS Synthetic Biology. 9 (11), 2881-2901 (2020).
- Gaut, N. J., Adamala, K. P. Reconstituting natural cell elements in synthetic cells. Advanced Biology (Weinh). 5 (3), 2000188 (2021).
- Shimizu, Y., et al. Cell-free translation reconstituted with purified components. Nature Biotechnology. 19 (8), 751-755 (2001).
- Li, J., Gu, L., Aach, J., Church, G. M. Improved cell-free RNA and protein synthesis system. PLoS One. 9 (9), 106232 (2014).
- Kazuta, Y., Matsuura, T., Ichihashi, N., Yomo, T. Synthesis of milligram quantities of proteins using a reconstituted in vitro protein synthesis system. Journal of Bioscience and Bioengineering. 118 (5), 554-557 (2014).
- Li, J., et al. Dissecting limiting factors of the protein synthesis using recombinant elements (PURE) system. Translation. 5 (1), 1327006 (2017).
- de Maddalena, L. L., et al. GreA and GreB enhance expression of Escherichia coli RNA polymerase promoters in a reconstituted transcription-translation system. ACS Synthethic Biology. 5 (9), 929-935 (2016).
- Kuruma, Y., Ueda, T. The PURE system for the cell-free synthesis of membrane proteins. Nature Protocols. 10 (9), 1328-1344 (2015).
- Jacobs, M. L., Boyd, M. A., Kamat, N. P. Diblock copolymers enhance folding of a mechanosensitive membrane protein during cell-free expression. Proceedings of the National Academy of Sciences of the Unites States of America. 116 (10), 4031-4036 (2019).
- Shimizu, Y., Kanamori, T., Ueda, T. Protein synthesis by pure translation systems. Methods. 36 (3), 299-304 (2005).
- Niwa, T., Kanamori, T., Ueda, T., Taguchi, H. Global analysis of chaperone effects using a reconstituted cell-free translation system. Proceedings of the National Academy of Sciences of the Unites States of America. 109 (23), 8937-8942 (2012).
- Niwa, T., et al. Large-scale analysis of macromolecular crowding effects on protein aggregation using a reconstituted cell-free translation system. Frontiers in Microbiology. 6, 1113 (2015).
- Shimizu, Y., Ueda, T. PURE technology. Methods in molecular biology. 607, 11-21 (2010).
- Horiya, S., Bailey, J. K., Krauss, I. J. Directed evolution of glycopeptides using mRNA display. Methods in Enzymology. 597, 83-141 (2017).
- Villarreal, F., et al. Synthetic microbial consortia enable rapid assembly of pure translation machinery. Nature Chemical Biology. 14 (1), 29-35 (2018).
- Wang, H. H., et al. Multiplexed in vivo His-tagging of enzyme pathways for in vitro single-pot multienzyme catalysis. ACS Synthetic Biology. 1 (2), 43-52 (2012).
- Shepherd, T., et al. De Novo Design and synthesis of a 30-cistron translation-factor module. Nucleic Acids Research. 45 (18), 10895-10905 (2017).
- Lavickova, B., Maerkl, S. J. A Simple, robust, and low-cost method to produce the PURE cell-free system. ACS Synthetic Biology. 8 (2), 455-462 (2019).
- Ederth, J., Mandava, C. S., Dasgupta, S., Sanyal, S. A single-step method for purification of active his-tagged ribosomes from a genetically engineered Escherichia coli. Nucleic Acids Research. 37 (2), 15 (2009).
- Gesteland, R. F. Isolation and characterization of ribonuclease I mutants of Escherichia coli. Journal of Molecular Biology. 16 (1), 67-84 (1996).
- Li, J., et al. Cogenerating synthetic parts toward a self-replicating system. ACS Synthetic Biology. 6 (7), 1327-1336 (2017).
- Matsuura, T., Kazuta, Y., Aita, T., Adachi, J., Yomo, T. Quantifying epistatic interactions among the components constituting the protein translation system. Molecular Systems Biology. 5, 297 (2009).
- Libicher, K., Hornberger, R., Heymann, M., Mutschler, H. In vitro self-replication and multicistronic expression of large synthetic genomes. Nature Communications. 11 (1), 904 (2020).
- Niederholtmeyer, H., Stepanova, V., Maerkl, S. J. Implementation of cell-free biological networks at steady state. Proceedings of the National Academy of Sciences of the United States of America. 110 (40), 15985-15990 (2013).
- Lavickova, B., Laohakunakorn, N., Maerkl, S. J. A partially self-regenerating synthetic cell. Nature Communications. 11 (1), 6340 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved