このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
mRNAを含んだポリ(ベータアミノエステル)ナノ粒子のワクチン接種目的での合成と特性評価
要約
ここでは、ポリ(βアミノエステル)ポリマーに基づいてmRNAナノ粒子を製造するための簡単なプロトコルが提示され、カプセル化されたmRNAを変更することによって容易に調整できる。また、ポリマー、ナノ粒子、およびそれらの インビトロ 必須の特徴を合成するためのワークフローも記載されている。予防接種に関する概念実証も追加されます。
要約
予防接種は現代社会の大きな成功の一つであり、病気の予防と予防に欠かせないものです。従来のワクチンは、感染因子の全体または一部で構成されていた。しかし、課題は残っており、新しいワクチン技術が不可欠です。この文脈において、免疫目的のためのmRNAの使用は、SARS-CoV-2感染を予防する2つのmRNAワクチンの迅速な承認によって示されるように、強化された性能を示している。ウイルス感染の予防に成功するだけでなく、mRNAワクチンを治療用のがん用途にも使用できます。
それにもかかわらず、ヌクレアーゼの存在によるmRNAの不安定性および身体からの速いクリアランスは、その裸の送達を不可能にする。この文脈において、ナノ医薬品、特に高分子ナノ粒子は、重要なmRNA送達系である。したがって、本稿の目的は、独自の高分子ナノ粒子に基づくmRNAワクチン候補の処方および試験のためのプロトコルを記述することである。使用されるポリ(βアミノエステル)ポリマーの合成と化学的特徴づけ、ナノ粒子を形成するためのmRNAによる錯体化、およびそれらの凍結乾燥方法論について、ここで議論する。これは、ストレージと流通のコストを削減するための重要なステップです。最後に、 インビトロ トランスフェクトおよび成熟モデル樹状細胞に対する能力を実証するために必要な試験が示される。このプロトコルは、これらのワクチンが多種多様な疾患を予防または治癒することを可能にする高い汎用性のために、ワクチン接種に取り組んでいる科学界に利益をもたらすでしょう。
概要
感染症は、世界中の何百万人もの人間に深刻な脅威を表しており、依然として一部の発展途上国における主要な死因の1つです。予防ワクチン接種は、感染症1,2を予防・管理するための現代社会の最も効果的な介入の一つであった。20世紀の関連性における科学のこれらの重要なマイルストーンは、SARS-CoV-2ウイルス3によって引き起こされる最近の世界的なCovid-19パンデミックによって述べられています。病気の普及を抑制するために効率的なワクチンを持つことの重要性を認識し、すべての生物医学界からの協力的な努力は、1年未満で市場で多くの予防ワクチンを成功に導いた4年未満。
伝統的に、ワクチンは減衰(生きている、減少した病原性)または不活性化(死粒子)ウイルスで構成されていた。しかし、安全ミスのマージンのない病気の場合、ウイルス粒子は不可能であり、代わりにタンパク質サブユニットが使用されます。それにもかかわらず、サブユニットは通常、複数のエピトープ/抗原の組み合わせを可能にせず、ワクチン接種効力を高めるためにアジュバントが必要である5,6。したがって、新しいワクチンタイプの必要性は明らかです。
現在のパンデミックの間に示されているように、核酸に基づく新しいワクチン候補は、長い開発プロセスを回避し、同時に重要な患者の免疫を産生しながら高い汎用性を提供するという点で有利であり得る。これは、最初に実験的ながんワクチンとして設計されたmRNAワクチンの場合です。抗原特異的T細胞応答3、5、6、7を生成するその自然な能力のおかげで。mRNAは抗原性タンパク質をコードする分子であり、同じ変化を変えるだけで、ワクチンは同じ微生物の他の変異体を免疫するように迅速に調整することができ、異なる株、他の感染性微生物、あるいは癌免疫療法治療にもなる。また、大規模な生産コストの面でも有利です。しかし、mRNAは裸の投与を妨げる重大なハードルを持っています:その安定性と完全性は、ヌクレアーゼでいっぱいの生理学的媒体で損なわれます。このため、抗原提示細胞にmRNAをベクター化してそれを保護するナノメトリックキャリアの使用が2,8に必要である。
この文脈では、ポリ(βアミノエステル)(pBAE)は、カチオン電荷9、10、11のおかげで、ナノメトリック粒子中の複雑なmRNAに顕著な能力を示した生体適合性および生分解性ポリマーのクラスである。これらのポリマーは、エステル結合で構成されており、生理学的条件下でのエステラーゼによる分解が容易になります。pBAEライブラリー候補のうち、末端のカチオンオリゴペプチドで機能化したものは、エンドサイトーシスを通じて細胞を効率的に透過し、カプセル化された遺伝子材料をトランスフェクトする小さなナノ粒子を形成する高い能力を示した。さらに、その緩衝能力のおかげで、エンドソームコンパートメントの酸性化により、内経エスケープ12,13が可能となる。すなわち、特定の種類のpBAE、 骨格の疎水性部分(いわゆるC6 pBAE)を含む彼らの安定性とエンドオリゴペプチドの組み合わせを高める(トリリジンで修飾されたポリマーの60%とトリヒスチジンを有するポリマーの40%)は、非経口投与後に選択的に抗原提示細胞をトランスフェクトし、mRNAコード化された抗原提示を行う.さらに、これらの製剤は、ナノメディシン製剤の主なボトルネックステップの1つを回避できることも実証されている:それらの機能性を失うことなく凍結乾燥する可能性は、ソフトドライ環境15での長期安定性を可能にする。
この文脈において、現在のプロトコルの目的は、プロトコルの重要なステップの説明を与え、感染症予防および腫瘍治療アプリケーションのための効率的なワクチンの生産を可能にすることによって、科学界にmRNAナノ粒子の形成のための手順を提供することである。
以下のプロトコルは、オリゴペプチドの最終修飾ポリ(βアミノエステル)-ナノ粒子合成に更に使用されるOM-pBAEポリマーを合成するための完全なトレーニングを記述する。プロトコルには、ナノ粒子製剤も含まれる。さらに、結果として得られる製剤が正または否定的な結果を定義するために必要な品質管理特性評価機能を確実に達成するために、手順および代表的な結果の成功のための重要なステップも提供される。このプロトコルの概要を 図 1に示します。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. 末端オリゴペプチドを用いたpBAEポリマーの合成(OM-pBAE)
- C6-pBAEの重合
- 5-アミノ-1-ペンタノールを追加します (38 ミリモル;MW = 103.16 Da) 1-ヘキシルアミン (38 ミリモル;MW = 101.19 Da) 丸底ガラスフラスコ(100 mL)に。その後、1,4-ブタンジオールジアクリレート(82ミリモル;2 mmol)を加える。MW = 198.22 Da)。
- シリコーンオイルバスを90°Cで予熱し、丸底フラスコをオイルバスに入れ、一晩(約18時間)磁気攪拌棒の助けを借りて混合物をかき混ぜます。その後、丸底フラスコから製品を取り出し、-20°Cの冷凍庫に入れる。
注:製品は、粘着性の粉末の形で、へらの助けを借りてフラスコから取り出されます。1H-NMRを介して得られたポリマーの構造を検証することが不可欠である。NMRスペクトルは、クロロホルムdとD2Oを溶媒として使用して、400MHzの機器(材料表を参照)に記録されました。各ポリ(βアミノエステル)の約10mgを1mLの重水素化溶媒に取り込み、溶解させた。
- OM-pBAEを得るためにペプチドとの反応
- 選択したペプチドに0.1M HClの25 mLを加え、例えば、トリフルオロ酢酸(TFA、200mg)を有するペプチドCys-His-Hisを、凍結乾燥に耐え、一晩手動で攪拌できる50mL遠心管に入れて、透明な溶液を得る。
- 溶液を-80°Cで1時間凍結し、得られた塩酸ペプチドを凍結乾燥させる。
注: 最終重みが理論値に対応しているかどうかを確認します。 - ジメチルスルホキシドでC6-pBAE(0.031ミリモル)の溶液を作ります。また、ジメチルスルホキシド中の塩酸ペプチド(0.078 mmol)の溶液を作ります。
- 2つのソリューションをスクリューキャップチューブに混ぜ、キャップにネジを入れします。25°Cの温度を20時間、磁気攪拌棒で水浴中に混合液を撹拌します。
- 混合物を7:3(v/v)ジエチルエーテル/アセトンに加えます。得られた懸濁液を4°Cで25,000xgで遠心分離し、溶媒を除去する。 次に、7:3(v/v)ジエチルエーテル/アセトンで固体を2回洗います。その後、真空(<0.2気圧)で製品を乾燥させます。
- ジメチルスルホキシドで100mg/mLの製品の溶液を作ります。得られた生成物はC6-ペプチド-pBAEと名付けられます。得られたポリマーの構造を1H-NMRを通して検証し、末端アクリレートに関連するオレフィン信号の消失を確認することが不可欠である。使用しない場合、ポリマーは-20°Cで凍結することができる。
2. ポリプレックス形成
注: すべての手順は、一定の温度を維持するために、条件付きの部屋内で実行する必要があります。
- ポリマーC6-ペプチドpBAEおよびボルテックス溶液を解凍する。
- ポリマーを上下に混合し、酢酸ナトリウム(NaAc)で12.5mM(V1)の溶液を調製します。その後、混合物をボルテックスし、10分待ちます。
- 0.5 mg/mLでmRNAを調製し、ピペット(V2)で混合する。
注: mRNA のボルテックスを避けることは非常に重要です。 - ポリマー混合物を最終濃度でボルテックスし、DMSO中のポリマーストックとアセテート緩衝液との間に均一な溶液を得た。
注: 最終的なポリマー濃度は、選択したN/P(窒素対リン酸基)比によって異なります。N/P比は、使用する各特定のmRNAに依存します。eGFP カプセル化の場合、たとえば、前に報告された14のように 25:1 の比率が使用されました。 - 遺伝子材料溶液とC6-ペプチドpBAE溶液(mRNA濃度の25倍)を1:1(V i=V1+V2)の比率で混合する。
注:C6-ペプチドpBAEは、mRNAが混合のために上下にピペットすることによって追加されるマイクロ遠心チューブにロードされます。調製後、ポリプレックス、核酸、およびC6-ペプチド-pBAE濃度が半分希釈される。 - 25°Cで30分間、サーモブロックでインキュベートします。1:2 RNaseフリー水で沈殿し、あらかじめロードされたマイクロ遠心分離チューブに水を入れます。
- 賦形剤を含める。mRNAとpBAE(Vi)の混合物と同じボリュームをHEPES 20 mMに加え、スクロースは上下にピペット処理を行い4%を加えます。この時点で、試料は3倍希釈されている。
3. ポリプレックス凍結乾燥
- 瞬間的に、前のポリプレックス溶液の-80°Cフリーザーで1時間凍結する。
- 次の手順で一次乾燥を行います: (1) -60 °C で 1 h および 0.001 hPa;(2) -40 °Cおよび0.0001 hPaで1時間。(3) -20 °C および 0.0001 hPa で 4 h;(4)5°Cで12時間、0.0001 hPa.
- 使用するまで水分補給を避けるために、すぐに-20 °Cで保管してください。
4. ポリプレックス再懸濁液
注:このプロトコルは、凍結乾燥したC6ペプチド-pBAEナノ粒子を再構築するために使用されるプロセスを説明し、特性評価、 インビトロ、 または インビボ 分析のためにさらに使用します。
- 使用の瞬間に-20°Cから凍結乾燥したナノ粒子を取り、迅速に所望の濃度を達成するために固体を再分散するために、対応する量のデミロゲン化(DEPC)水を追加します。
注:同じ濃度が想定される場合、体積はナノ粒子の初期体積と同じになりますが、各実験で示されます。 - ピペットを全再懸濁するまで穏やかにピペット、ピペットと一緒に液体を伴う。
注: バイアルの壁に材料が残らないようにしてください。 - 一度溶解すると、ピペットは激しく上下し、泡を避けます。
注:サンプルは、より高い濃度でより明らかである半透明の側面を持っている必要があります - サンプルを氷の上または4°Cで、再構成後24時間の最大期間保管してください。凍結を避けてください。
5. ポリプレックス特性
- 動的光散乱
注:流体力学直径(nm)、多分散度指数(PDI)、およびナノ粒子の表面電荷を25°C、633 nmレーザー波長、および173°信号検出器で測定し、ゼータ電位分析装置を用いた( 材料表参照)。- 流体力学径(nm)
- 上記のように0.25mg/mLのmRNAの最終濃度に遺伝子材料をピペット化することにより、mRNAとpBAEを混合したナノ粒子を十分に調製します(ステップ2)。
- 濾過された希釈培地でマイクロキュベットを洗い込み、不純物から完全に洗浄します。次に、キュベットに少なくとも50 μLのサンプル溶液を充填し、キャップします。次に、DLS計測器内のサンプルを紹介し、セルが正しく挿入されていることを確認します。
メモ:希釈メディアは0.22 μmのシリンジフィルタを使用してフィルタリングされます。 - 作成された 標準操作手順 (SOP) ファイルを開き、目的の サンプル名を紹介します。[ サイズの計測]を選択します。
注: サイズ測定用の SOP を作成するためのすべてのパラメータを 表 1に示します。 - [再生] をクリックして、DLS を使用してパーティクル サイズの測定を実行します。
メモ:トリプルビープ音が鳴った後、解析は完了です。 - 測定シート上のサンプルに対応する結果を選択して、平均粒子径、平均PDI、標準偏差、およびグラフィックスを取得します。完了したら、DLS機器からセルを取り外します。
- サンプルを取り出し、ゼータ電位分析のために保管し、脱イオン水で細胞をきれいに洗い流します。最後に、洗浄されたキュベットを圧縮空気ガス流で乾燥させます。
- 表面電荷(mV)
- 上記のように0.25mg/mLのmRNAの最終濃度に遺伝子材料をピペット化することにより、mRNAとpBAEを混合したナノ粒子を完全に調製します(ステップ2、ポリプレックス形成)。次に、溶液を凍結して乾燥させます。
注:この場合、表面電荷の測定のために、サンプルの凍結乾燥は、適切なバッファーにサンプルを再分散する措置を実行する前に強くお勧めし、pHおよび電解質濃度の体の状態をシミュレートします。 - 水を使用して凍結乾燥サンプルを再中断します。サンプルを水で1/10(最終濃度0.025mg/mL)で希釈します。
- 濾過された希釈培地で使い捨てに折りたたまれた毛細管細胞(ゼータ電位キュベット)を前洗いして、不純物から完全に洗浄します。次いで、キュベットを希釈したナノ粒子で満たし、1mLシリンジを使用し、フィラーの両側をキャップします。
注:ナノ粒子分散液は、キュベット(〜1mL)で利用可能なボリュームを満たさなければならなくて、気泡の形成に特別な注意を払い、測定を妨げることができました。 - サンプルを DLS 内で紹介します。セルが正しく挿入されていることを確認してください。
- ゼータ電位解析用に作成された SOP ファイルを開き、目的の サンプル名を紹介します。 ゼータ電位測定を選択します。
注: ゼータ電位測定の SOP を作成するためのパラメータは 、表 2に示されています。 - 再生をクリックして、DLSを使用してゼータ電位測定を実行します。
メモ:トリプルビープ音が鳴った後、解析が完了しました。 - 測定シート上のサンプルに対応する結果を選択して、ゼータ電位、標準偏差、およびグラフィックスの平均を取得します。完了したら、DLS装置からセルを取り外します。
- サンプルを取り出し、必要に応じて保存します。次に、キュベットセルを脱イオン水で洗浄し、続いてエタノールと水を再び洗い流します。最後に、洗浄されたキュベットを圧縮空気ガス流で乾燥させます。
メモ:データを分析するには、推奨ソフトウェアを使用してください。
- 上記のように0.25mg/mLのmRNAの最終濃度に遺伝子材料をピペット化することにより、mRNAとpBAEを混合したナノ粒子を完全に調製します(ステップ2、ポリプレックス形成)。次に、溶液を凍結して乾燥させます。
- 流体力学径(nm)
- ナノ粒子追跡解析(NTA)
注:流体力学的直径(nm)およびナノ粒子の濃度は、ナノ粒子追跡アナライザを使用して25°C、488nmレーザー波長で測定されました(参照してください。 資料一覧).- NTA およびサンプル準備
- コンピュータと機器の電源を入れ替えます。まず、すべてのコンポーネントが正しく接続されているかどうかを確認します。次に、推奨ソフトウェアを開きます。ソフトウェアは、すべてのアクセサリが正しく接続されているかどうかを確認します。
- トッププレート(ここではOリングセル)をレーザーモジュールに接続します。
メモ:このパーツをねじ込まないでください。 - まず、1 mL シリンジで、バッファーおよび/または脱イオン水でチャンバーをロードします。この手順を少なくとも 2 回繰り返します。チャンバーに泡を入れないようにしてください。
- DLSサイズ測定に使用した濃度から1/1000を脱イオン水で希釈してサンプルを調製します。少なくとも1 mLを準備し、1 mLのシリンジにロードして、気泡を導入しないようにします。
- サンプルをシリンジを使用してチャンバーにロードします。次に、レーザーモジュールをNTA大チャンバーに差し込みます。
メモ:大きい部屋は部屋が測定のために置かれるスペースを意味する。
- 画像の最適化
- まず、 ハードウェアで カメラ と適切なレーザーが選択されているかどうかを確認します。
注:ここでは、1台のカメラとブルーレーザー488 nmしかありません。 - カメラレベルを0から開始し、キャプチャウィンドウで カメラの開始 を押します。
注: この時点で、次のパラメータを調整します。 ビーム位置 (画面上で上下に移動可能)。 カメラレベル: 過飽和ピクセルを避けます。 フォーカス(横車輪):できるだけより良い焦点を合わせるようにしてください。未焦点のパーティクルの代わりに、ハローを持つパーティクルを使用することをおしただしい。濃度:濃度を調整して、フィールドあたり10~100個のパーティクルを持つようになります。
- まず、 ハードウェアで カメラ と適切なレーザーが選択されているかどうかを確認します。
- ビデオ録画
- ソフトウェアで、[ 計測選択- SOP]ウィンドウ(左下)に移動し、[ 標準測定]を選択します。
注:(ソフトウェアが平均および標準偏差の計算を実行できるように)30 sの3つの尺度を実行するプログラム。サンプルのレコードを保存するために、名前とフォルダー パス (ベース ファイル名) を指定します。SOP パラメータが正しく設定されたら、[ スクリプトの作成 と 実行] を押します。最初の反復が測定されると、プログラムは新しいサンプルを追加するように要求します。次に、サンプルの別の部分は、シリンジのプランジャーを押すことによってチャンバーに導入されなければなりません。最後に、3 回目の反復を分析するために 3 回目を繰り返します。
- ソフトウェアで、[ 計測選択- SOP]ウィンドウ(左下)に移動し、[ 標準測定]を選択します。
- ビデオ処理
- 3つの測定が完了したら、測定された粒子を分析するために 画面ゲイン と 検出しきい値 を再取り付けします。この時点で、解析を実行するために各フレームに約 100 個のパーティクルが表示されます (高い赤の十字と低い青の十字が予想されます)。
- 解析が完了した後で、結果を pdf ファイルにエクスポートします。また、動画やエクセルファイルとしてエクスポートすることも可能です。
- NTA のクリーニング
注: 次のサンプルを調じる前に、開いているすべての測定値を閉じます。生成されたファイルは膨大であり、コンピュータによっては、複数のオープンを維持することは容易ではありません。- 粒子が観察されないまで、その後の測定を行う前に水を繰り返し洗い流すことによってNTAチャンバーを洗浄します。その後、使用されるバッファー (PBS) をフラッシュして、メジャーを続行します。
- チャンバー内の空気を洗い流し、その日の最後の測定が完了したら、顕微鏡グレードの紙でそれを乾燥させます。
- トランスミッション電子顕微鏡(TEM)でサイズと形状を特徴付けます。サンプルを準備します。最終ボリュームの30 μLは、TEM特性評価に十分です。
注:新鮮で凍結乾燥した - 再懸濁後 - ナノ粒子を測定することができます。 - 炭素被覆銅グリッドに10μLのサンプルをドロップします。10分間乾燥させます。必要に応じて、濾紙を柔らかくタップして、余分な液体を取り除きます。
- 酢酸ウラニル溶液を10 μL(2%w/v)に落とし、負の染色を行います。1分間乾燥させます。必要に応じて、濾紙を柔らかくタップして、液体過剰を除去します。
- サンプルを顕微鏡に導入し、スキャンします(電圧動作80kV)。
注: 画像のさらなる分析には、適切なソフトウェアを使用できます。
- NTA およびサンプル準備
- カプセル化効率
- サンプル準備
- 所望の濃度でナノ粒子を準備し、それらを凍結し、乾燥させます。その後、ナノ粒子を再懸濁し、6μg/mLの最終濃度で希釈します。
- 20x ストック ソリューションから 1x TE バッファーを準備します。
メモ:Vt(総体積)=(サンプル数x 100 μL x 4)(サンプル数x 290 μL)+ 2 mL。 - 100 μg/μL のストックから 3 μg/μL のヘパリンで TE バッファーを準備します。
メモ: Vt = サンプル数 x 50 μL x 2. - 標準を準備する
- 1x Tris-EDTA(TE)バッファで0.2 μg/mLから0.025 μg/mLまでの範囲のRNA規格を準備します(表S1A)。
注:リボソームRNAと異なる場合には、RNA標準でmRNAを使用してください。 - ヘパリン(表S1B)を使用してRNA:pBAE標準を調製する。ヘパリン標準を準備する (表 S1C).
- 96ウェルプレートを次のように準備します。
- 96 ウェルプレートの最初のレーンに 295 μL の TE バッファーをロードします(分析するサンプルと同じ数ウェル)。次に、1x TE バッファの 50 μL をレーン B および C (各サンプルの重複) にロードします。
- ヘパリンの3 μg/μLを持つ1x TBEバッファの50 μLをレーンDとE(各サンプルに対して重複)にロードします。次に、各標準の100 μLをレーンF、G、H(各規格に対して重複)でロードします。
- レーンAに各サンプルの5μLをロードします(各ウェルの濃度は0.1 μg/mL)。下の4つのウェルに各サンプルの50 μLをピペットで混合し、負荷を入れます(そのうちの2つは50 μLのバッファ1x TEを含み、さらに2つはヘパリンの3 μg/μLの1x TEバッファを含みます)。
- 37°Cで30分間サンプルをインキュベートします。 1x TE バッファーで、製造者のプロトコル ( 材料表を参照) に従って RiboGreen 試薬を準備します。
注:1:200と渦を希釈します。光から守る。Vt = フルウェル数 x 100 μL - 各ウェルにリボグリーン溶液の100 μLをロードします。500 nmの励起波長および525 nmの発光波長のマイクロプレートリーダーを使用して蛍光を検出する。
- 結果分析
- 3 つのキャリブレーションカーブを準備する
注:まず、リボソームRNA標準。この較正曲線でヘパリンを含まないサンプルを補間します。第二に、mRNA:pBAEヘパリンを使用する。この検量線でヘパリンを有する試料を補間する。第三に、ヘパリン。働く集中が線形範囲であることを保証するために使用される。 - カプセル化効率 (EE%)
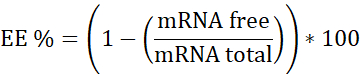
- 3 つのキャリブレーションカーブを準備する
- サンプル準備
6. インビトロ 特性評価
- 定性評価のための蛍光顕微鏡
- トランスフェクションの24時間後に顕微鏡に96ウェルプレートを置きます。10x の目的でセルの視覚化を開始します。
注: この場合、HeLa セルが使用されます。セルは、伝送モード(明るいフィールド)を使用してローカライズされ、この時点でフォーカスを調整する必要があります。- まず、サンプルの背景に関するソフトウェアを参照するためにホワイトバランスを適用します。次いで、画像を取得し、分析中に蛍光画像とオーバーレイする。
- 顕微鏡モードを反射モード(蛍光)に変更し、フィルターホイールを青色レーザー(488nm)に移動してeGFPを可視化します。
注: この時点で、露出時間とゲインを調整する必要があります。ゲインは、バックグラウンド信号のアーティファクトと過剰を避けるために、3と5の間の値で調整する必要があります。露光時間の調整は、トランスフェクション効率(msから1 s)に依存します。 - すべてのサンプルを比較するために、同じ露出時間を使用して、すべての条件またはウェルの画像を取得します。
- トランスフェクションの24時間後に顕微鏡に96ウェルプレートを置きます。10x の目的でセルの視覚化を開始します。
- 定量的評価のためのフローサイトメトリー(FC)
- マルチチャンネルピペットを使用して、フローサイトメトリー実験用の96ウェルプレートを準備します。
注: JAWSII セルラインなどの半接着セルを操作する場合は、すべてのメディアボリュームを回復し、別の 96 ウェル プレートに保存します。大量のトランスフェクトされた細胞が含まれている可能性があるため、このメディアを熱望しないでください。 - 1x PBSの100 μL/wellで細胞(HeLa細胞が使用されています)をきれいにし、それを熱望します。次に、25 μL/ウェルのトリプシンを加え、37°Cで5分間インキュベートします。
- 細胞が切り離されたら、以前に回収された培地を添加してトリプシン作用を停止し、細胞を固定し、ホルマリン10%の31.25 μL/ウェルを20分間(最終濃度2.5%)加えます。
注:この時点で、細胞の剥離を確実にするために顕微鏡で細胞の状態を可視化することが重要です。細胞が取り外し、その凝集を避けるのを助けるために、数回上下にピペットすることを強くお勧めします。これにより、信頼性の高い結果が得られます。 - フローサイトメーターとソフトウェアをオンにします。ソフトウェアでは、実験の適切な条件(プレートの種類、サンプルの体積、および、サンプル間の揺れ、リンスなどの他のパラメータ)を設定します。
注: ステップ 6.2.5 の場合、流量は 120 μL/min である必要があります。1分ごとに1サイクルを混ぜ、1サイクルずつよくすすいでください。混合は、培地中に分散した細胞を維持し、個々の細胞のより良い分析を可能にするために不可欠です。また、リンスは、サンプル間のサイトメーターのマイクロ流体を洗浄する必要があります。最後に、十分なバッファがあるかどうか、およびすべてのコンポーネントが正しく接続されているかどうかを確認します。 - 正にトランスフェクトされた細胞の割合を定量化するために、適切なパラメータを設定します。
- まず、フローデータを(前方散乱光)FSC対SCC(側面散乱光)散乱プロットで表示し、細胞を破片と区別します。次に、振幅(FSC-A)と高さ(FSC-H)を比較する別の散布図が、個々の細胞をゲートにプロットし、判別する。
注:未治療の集団は、陽性トランスフェクト細胞に対応する集団をゲートすることができます。次に、陽性トランスフェクトされた細胞の定量がヒストグラムプロット上の適切なチャネル上で行われる。したがって、陽性にトランスフェクトされた細胞は、ヒストグラム上のイベントの連続体として表現されなければならない。
- まず、フローデータを(前方散乱光)FSC対SCC(側面散乱光)散乱プロットで表示し、細胞を破片と区別します。次に、振幅(FSC-A)と高さ(FSC-H)を比較する別の散布図が、個々の細胞をゲートにプロットし、判別する。
- マルチチャンネルピペットを使用して、フローサイトメトリー実験用の96ウェルプレートを準備します。
7. インビトロ 機能試験:オボアルブミン(OVA)を抗原モデルmRNAとして用いることで免疫細胞を活性化する能力
- トランスフェクションの前日に96ウェルプレートに10,000個の細胞/ウェル(JAWSII細胞が使用されています)。
注:各条件の三重を持っている必要がある限り多くのウェルをプレート。細胞を少なくとも12時間プレートに取り付けます(一晩のインキュベーションをお勧めします)。 - 以下のノートに記載されているようにpBAE NPを準備し、ウェルあたり0.6 μg mRNAをトランスフェクトします。
注:陽性のコントロールとして、トランスフェクション試薬を使用して細胞をトランスフェクトします。ここでは、ウェルあたり0.1 μg mRNA、1ウェル当たり0.25μLのトランスフェクション試薬を使用しました。OVA 用の mRNA のコーディゼーションを購入しました ( 材料表を参照)。ポリアデニル化され、5-メトキシウリジンで修飾され、哺乳類のシステムに最適化され、サプライヤーの独自の方法であるCap1構造のエンドキャッピングによって保護されています。 - 乾燥空気インキュベーターで24時間96ウェルプレートを37°Cおよび5%CO2でインキュベートします。
注: この時間の後、メディアには特定の数のセルが含まれている可能性があるため、メディアを熱望しないでください。細胞を回復し、別のウェルやプレートに保存します。 - ウェルに残った細胞を25 μLの1x PBSで洗浄します。次に、それを熱望し、トリプシンの25 μLを加え、37°Cで5分間プレートをインキュベートして細胞を取り外します。以前に回収したメディアを対応する井戸に追加して、トリプシン反応を停止します。
- プレートを4°Cで5分間400xgで遠心します。 メディアを熱望する。1x PBSの50 μL/ウェルとホルマリンの2.5%を加えます。細胞を固定するために4°Cで20分間インキュベートします。
- 手順 7.5 と 7.5.1 を繰り返します。その後、1x PBSと3%BSA(ブロッキングバッファ)の50 μL/ウェルを加え、4°Cで30分間インキュベートします。 再度、ステップ7.5と7.5.1を繰り返し、1x PBSで一次抗体(マウスα-OVA)の50μL/wellを加え、BSAを3%で30分間インキュベートします。
- ステップ7.5と7.5.1を繰り返し、1x PBSの50 μL/ウェルで細胞を洗います。アスパイアメディア、および2次抗体溶液(α-マウス-AlexaFluor488/PerCPおよびCy5.5-CD11b/APC-CD86)を1x PBSおよび3%BSAに添加します。4°Cで1時間インキュベートします。
- プレートを400xgで5分間遠心します。その後、50 μL/ウェルの1x PBSで細胞を洗浄します。次に、遠心分離機(400 x g 5分間)を目指し、1x PBSおよび2.5%ホルマリンの100 μL/ウェルで細胞を再懸濁します。
- 上述したようにフローサイトメトリーで分析する(ステップ6.2)。
Access restricted. Please log in or start a trial to view this content.
結果
ポリマー合成と特性評価
OM-pBAE合成手順は 図2に示されています。 図2A が示すように、OM-pBAEを得る第一の工程は、アミン(1-ヘキシルアミンおよび5-アミノ-1-ペンタノール、比1:1)をジアクリレート(1,4-ブタンジオールジアクリレート)に添加してC6-pBAEを合成することです。この反応は、90°Cで20時間、一定の攪拌を行う。その後、オリゴ...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
昨年Covid-19大流行が発生した後、感染症対策の観点からワクチンの重要性が重要な成分8として明らかになってきた。世界中の科学者からの努力は、多くのワクチンの市場へのリリースを可能にしました。歴史上初めて、mRNAワクチンは、数ヶ月以内に新しい抗原に適応する能力のために彼らの迅速な設計のおかげで、以前の仮説の成功を実証しました5,
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は何も開示したり、利益相反を持っていません。
謝辞
MINECO/FEDER(補助金SAF2015-64927-C2-2-R、RTI2018-094734-B-C22、COV20/01100)からの財政支援を認めている。CGFは彼女のIQS博士フェローシップを認めました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 1,4-butanediol diacrylate | Sigma Aldrich | 123048 | |
| 1-hexylamine | Sigma Aldrich | 219703 | |
| 5-amino-1-pentanol | Sigma Aldrich | 411744 | |
| Acetone | Panreac | 141007 | |
| CD11b antibody | BD | 550993 | |
| CD86 antibody | Bioligend | 105007 | |
| Chlor hydroxhyde | Panreac | 181023 | |
| Chloroform-d | Sigma Aldrich | 151823 | |
| Cys-His-His-His peptide | Ontores | Custom | |
| Cys-Lys-Lys-Lys peptide | Ontores | Custom | |
| D2O | Sigma Aldrich | 151882 | |
| DEPC reagent for Rnase free water | Sigma Aldrich | D5758 | This reagent is important to treat MilliQ water to remove any RNases of the buffers |
| Diethyl eter | Panreac | 212770 | |
| dimethyl sulfoxide | Sigma Aldrich | 276855 | |
| HEPES | Sigma Aldrich | H3375 | |
| mRNA EGFP | TriLink Technologies | L-7601 | |
| mRNA OVA | TriLink Technologies | L-7610 | |
| RiboGreen kit | ThermoFisher | R11490 | |
| sodium acetate | Sigma Aldrich | 71196 | |
| sucrose | Sigma Aldrich | S0389 | |
| Trifluoroacetic acid | Sigma Aldrich | 302031 | |
| Trypsin-EDTA | Fisher Scientific | 11570626 | |
| α-mouse AlexaFluor488 antibody | Abcam | Ab450105 | |
| Equipment | |||
| Nanoparticle Tracking Analyzer | Malvern Panalytical | NanoSight NS300 | |
| Nuclear Magnetic Ressonance Spectrometer | Varian | 400 MHz | |
| ZetaSizer | Malvern Panalytical | Nano ZS | For zeta potential and hydrodynamic size determination |
| Software | |||
| NanoSight NTA software | Malvern Panalytical | MAN0515-02-EN-00 | |
| NovoExpress Software | Agilent | Not specified | |
| ZetaSizer software | Malvern Panalytical | DTS Application | To analyze surface charge and hydrodynamic sizes |
参考文献
- Chumakov, K., Benn, C. S., Aaby, P., Kottilil, S., Gallo, R. Can existing live vaccines prevent COVID-19. Science. 368 (6496), 1187-1188 (2020).
- Zhang, C., Maruggi, G., Shan, H., Li, J. Advances in mRNA vaccines for infectious diseases. Frontiers in Immunology. 10, 1-13 (2019).
- Wherry, E. J., Jaffee, E. M., Warren, N., D'Souza, G., Ribas, A. How did we get a COVID-19 vaccine in less than 1 year. Clinical Cancer Research. 27 (8), 2136-2138 (2021).
- Folegatti, P. M., et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. The Lancet. 396 (10249), 467-478 (2020).
- Geall, A. J., Mandl, C. W., Ulmer, J. B. RNA: The new revolution in nucleic acid vaccines. Seminars in Immunology. 25 (2), 152-159 (2013).
- Ulmer, J. B., Geall, A. J. Recent innovations in mRNA vaccines. Current Opinion in Immunology. 41, 18-22 (2016).
- Kranz, L. M., et al. Systemic RNA delivery to dendritic cells exploits antiviral defence for cancer immunotherapy. Nature. 534 (7607), 396-401 (2016).
- Milane, L., Amiji, M. Clinical approval of nanotechnology-based SARS-CoV-2 mRNA vaccines: impact on translational nanomedicine. Drug Delivery and Translational Research. 1 (4), 3(2020).
- Green, J. J., Langer, R., Anderson, D. G. A combinatorial polymer library approach yields insight into nonviral gene delivery. Accounts of Chemical Research. 41 (6), 749-759 (2008).
- Guerrero-Cázares, H., et al. Biodegradable polymeric nanoparticles show high efficacy and specificity at DNA delivery to human glioblastoma in vitro and in vivo. ACS Nano. 8 (5), 5141-5153 (2014).
- Kozielski, K. L., Tzeng, S. Y., Hurtado De Mendoza, B. A., Green, J. J. Bioreducible cationic polymer-based nanoparticles for efficient and environmentally triggered cytoplasmic siRNA delivery to primary human brain cancer cells. ACS Nano. 8 (4), 3232-3241 (2014).
- Segovia, N., Dosta, P., Cascante, A., Ramos, V., Borrós, S. Oligopeptide-terminated poly(β-amino ester)s for highly efficient gene delivery and intracellular localization. Acta Biomaterialia. 10 (5), 2147-2158 (2014).
- Dosta, P., Segovia, N., Cascante, A., Ramos, V., Borrós, S. Surface charge tunability as a powerful strategy to control electrostatic interaction for high efficiency silencing, using tailored oligopeptide- modified poly (beta-amino ester)s (PBAEs). Acta Biomaterialia. 20, 82-93 (2015).
- Fornaguera, C., et al. mRNA delivery system for targeting antigen-presenting cells in vivo. Advanced Healthcare Materials. 7 (17), 180033(2018).
- Fornaguera, C., Castells-Sala, C., Lázaro, M. Á, Cascante, A., Borrós, S. Development of an optimized freeze-drying protocol for OM-PBAE nucleic acid polyplexes. International Journal Pharmaceutics. 569, (2019).
- Fornaguera, C., Solans, C. Analytical methods to characterize and purify polymeric nanoparticles. International Journal of Polymer Science. , (2018).
- Fornaguera, C., Solans, C. Characterization of polymeric nanoparticle dispersions for biomedical applications: size, surface charge and stability. Pharmaceutical Nanotechnology. 6 (3), 147-164 (2018).
- Sahin, U., Karikó, K., Türeci, Ö MRNA-based therapeutics-developing a new class of drugs. Nature Reviews Drug Discovery. 13 (10), 759-780 (2014).
- Fan, Y. N., et al. Cationic lipid-assisted nanoparticles for delivery of mRNA cancer vaccine. Biomaterials Science. 6 (11), 3009-3018 (2018).
- Le Moignic, A., et al. Preclinical evaluation of mRNA trimannosylated lipopolyplexes as therapeutic cancer vaccines targeting dendritic cells. Journal of Controlled Release. 278, 110-121 (2018).
- Banerji, A., et al. mRNA vaccines to prevent COVID-19 disease and reported allergic reactions: Current evidence and approach. Journal of Allergy and Clinical Immunology: In Practice. 9 (4), 1423-1437 (2021).
- Kaczmarek, J. C., Kowalski, P. S., Anderson, D. G. Advances in the delivery of RNA therapeutics: from concept to clinical reality. Genome Medicine. 9 (1), 1-16 (2017).
- Dosta, P., et al. Delivery of anti-microRNA-712 to inflamed endothelial cells using poly(β-amino ester) nanoparticles conjugated with VCAM-1 targeting peptide. Advanced Healthcare Materials. , 1-11 (2021).
- Segovia, N., et al. Hydrogel doped with nanoparticles for local sustained release of siRNA in breast cancer. Advanced Healthcare Materials. 4 (2), 271-280 (2015).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved