A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
סינתזה ואפיון של חלקיקי פולי (בטא אמינואסטרים) טעונים mRNA למטרות חיסון
In This Article
Summary
כאן, פרוטוקול פשוט מוצג לייצור חלקיקי mRNA המבוססים על פולי (בטא אמינואסטר) פולימרים, קל להתאמה על ידי שינוי mRNA אנקפסולציה. זרימת העבודה לסינתזה של הפולימרים, הננו-חלקיקים והאפיון החיוני שלהם מתוארים גם הם. כמו כן מתווספת הוכחת תפיסה בנוגע לחיסון.
Abstract
חיסון היה אחת ההצלחות הגדולות של החברה המודרנית והוא הכרחי בשליטה ומניעת מחלות. חיסונים מסורתיים היו מורכבים מכל או שברים של חומר זיהומיות. עם זאת, האתגרים נותרו, וטכנולוגיות חיסונים חדשות הן חובה. בהקשר זה, השימוש ב- mRNA למטרות חיסון הראה ביצועים משופרים, כפי שהוכח באישור מהיר של שני חיסוני mRNA המונעים זיהום SARS-CoV-2. מעבר להצלחה במניעת זיהומים ויראליים, חיסוני mRNA יכולים לשמש גם ליישומי סרטן טיפוליים.
עם זאת, חוסר היציבות של mRNA ואת הסיווג המהיר שלה מהגוף בשל נוכחות של גרעינים עושה את המסירה העירומה שלה לא אפשרי. בהקשר זה, ננו-רפואה, ובמיוחד חלקיקים פולימריים, הן מערכות מסירה קריטיות של mRNA. לכן, מטרת מאמר זה היא לתאר את הפרוטוקול לגיבוש ובדיקה של מועמד לחיסון mRNA המבוסס על חלקיקים פולימריים קנייניים. הסינתזה והאפיון הכימי של פולי (בטא אמינואסטרים) פולימרים המשמשים, המורכבות שלהם עם mRNA כדי ליצור חלקיקים, ומתודולוגיית lyophilization שלהם יידונו כאן. זהו צעד מכריע להפחתת עלויות האחסון וההפצה. לבסוף, הבדיקות הנדרשות כדי להפגין את יכולתם במבחנה transfect ומודל בוגר תאים דנדריטיים יצוינו. פרוטוקול זה יועיל לקהילה המדעית העובדת על חיסון בשל הרבגוניות הגבוהה שלו המאפשרת לחיסונים אלה למנוע או לרפא מגוון רחב של מחלות.
Introduction
מחלות זיהומיות מהוות איום חמור על מיליוני בני אדם ברחבי העולם, והן עדיין אחד הגורמים המובילים למוות בכמה מדינות מתפתחות. חיסון מניעתי היה אחת ההתערבויות היעילות ביותר של החברה המודרנית כדי למנוע ולשלוט במחלות זיהומיות1,2. אבני דרך קריטיות אלה של המדע ברלוונטיות של המאהה-20 נאמרו על ידי מגיפת Covid-19 העולמית האחרונה שנגרמה על ידי נגיף SARS-CoV-23. מתוך הכרה בחשיבות של חיסונים יעילים לצמצום הפצת המחלה, מאמצי שיתוף פעולה מכל הקהילות הביו-רפואיות הביאו בהצלחה לחיסונים מניעתיים רבים בשוק תוך פחות משנה4.
באופן מסורתי, חיסונים היו מורכבים מווירוסים מוחלשים (חיים, הפחתת ארס) או מומתים (חלקיקי מוות). עם זאת, עבור מחלות מסוימות ללא מרווח לשגיאות בטיחות, חלקיקים ויראליים אינם אפשריים, ו- subunits חלבון משמשים במקום. עם זאת, subunits בדרך כלל לא מאפשר שילוב של יותר אפיטופ אחד / אנטיגן, ואדג'ובנטים נדרשים כדי לשפר את עוצמת החיסון5,6. לכן, הצורך בסוגי חיסונים חדשניים ברור.
כפי שהוכח במהלך המגפה הנוכחית, מועמדים חדשים לחיסון המבוססים על חומצות גרעין יכולים להיות יתרון מבחינת הימנעות מתהליכי פיתוח ארוכים ומתן רב-תכליתיות גבוהה תוך ייצור, במקביל, חיסון חיוני למטופל. זהו המקרה של חיסוני mRNA, שתוכננו בתחילה כחיסונים ניסיוניים לסרטן. הודות ליכולת הטבעית שלהם לייצר תגובות תאי T ספציפיות אנטיגן3,5,6,7. בהיותה mRNA המולקולה המקודדת את החלבון האנטיגני, רק משתנה זהה, ניתן להתאים את החיסון במהירות כדי לחסן וריאנטים אחרים של אותו מיקרואורגניזם, זנים שונים, מיקרואורגניזמים זיהומיים אחרים, או אפילו להפוך לטיפול אימונותרפי לסרטן. בנוסף, הם יתרון במונחים של עלויות ייצור בקנה מידה גדול. עם זאת, ל-mRNA יש משוכה משמעותית המעכבת את הממשל העירום שלהם: יציבותו ויושרו נפגעות בתקשורת הפיזיולוגית, מלאות גרעין. מסיבה זו, השימוש במנשא ננומטרי שמגן עליו וקטורינג mRNA לתאים המציגים אנטיגן נדרש2,8.
בהקשר זה, פולי (אמינו בטא) (pBAE) הם סוג של פולימרים ביו-תואמים ומתכלים שהפגינו יכולת יוצאת דופן ל-mRNA מורכב בחלקיקים ננומטריים, הודות למטענים הקטיים שלהם9,10,11. פולימרים אלה מורכבים קשרים אסתר, מה שהופך את השפלתם קלה על ידי אסטראזות בתנאים פיזיולוגיים. בין המועמדים לספריית pBAE, אלה שתפקדו עם אוליגופפטידים קטיקטיים בסופו הראו יכולת גבוהה יותר ליצור חלקיקים קטנים לחדור ביעילות לתאים באמצעות אנדוציטוזיס ולהדביק את חומר הגן encapsulated. יתר על כן, הודות ליכולת האגירה שלהם, החמצת התא אנדוזום מאפשרת בריחה אנדוזומית12,13. כלומר, סוג מסוים של pBAE, כולל עגבת הידרופובית על עמוד השדרה שלהם (מה שנקרא C6 pBAE) כדי לשפר את היציבות שלהם ואת השילוב הסופי-אוליגופפטידים (60% של פולימר שונה עם תלת ליצין ו 40% של הפולימר עם tri-histidine) כי באופן סלקטיבי טרנסקלציה אנטיגן מציג תאים לאחר ניהול parenteral לייצר את מצגת אנטיגן מקודד mRNA ואחריו חיסון עכברים פורסם לאחרונה14 . בנוסף, הוכח גם כי ניסוחים אלה יכולים לעקוף את אחד השלבים צוואר הבקבוק העיקרי של ניסוחים nanomedicine: האפשרות להקפיא לייבש אותם מבלי לאבד את הפונקציונליות שלהם, המאפשר יציבות לטווח ארוך בסביבות יבשותרכות 15.
בהקשר זה, מטרת הפרוטוקול הנוכחי היא להפוך את ההליך להיווצרות חלקיקי mRNA לזמינים לקהילה המדעית על ידי מתן תיאור הצעדים הקריטיים בפרוטוקול ומאפשר ייצור חיסונים יעילים ליישומים למניעת מחלות זיהומיות וטיפול בגידולים.
הפרוטוקול הבא מתאר את האימון המלא לסנתז אוליגופפטיד שינוי קצה פולי (אמינו בטא) - פולימרים OM-pBAE שישמשו עוד יותר עבור סינתזה ננו-חלקיקים. בפרוטוקול, ניסוח ננו-חלקיקים כלול גם. בנוסף, ניתנים גם צעדים קריטיים להצלחת ההליך והתוצאות הייצוגיות כדי להבטיח שהניסוחים המתקבלים ישיגו את תכונות אפיון בקרת האיכות הנדרשות כדי להגדיר תוצאה חיובית או שלילית. פרוטוקול זה מסוכם באיור 1.
Protocol
1. סינתזה של פולימר pBAE עם אוליגופפטידים סוף (OM-pBAE)
- פילמור של C6-pBAE
- הוסף 5-אמינו-1-פנטנול (38 mmol; MW = 103.16 Da) 1-הקסילמין (38 mmol; MW = 101.19 Da) לתוך בקבוק זכוכית עגולה (100 מ"ל). לאחר מכן, להוסיף 1,4-בוטנדיול דיאקרילט (82 mmol; MW = 198.22 Da).
- מחממים מראש את אמבט שמן הסיליקון ב-90 מעלות צלזיוס, מניחים את הבקבוקון העגול באמבט השמן ומערבבים את התערובת בעזרת מוט ערבוב מגנטי למשך הלילה (כ-18 שעות). לאחר מכן, לקחת את המוצר מן הבקבוקון התחתון העגול ומניחים אותו במקפיא ב -20 °C (70 °F).
הערה: המוצר הוא בצורה של אבקה דביקה והוא נלקח מן הבקבוק בעזרת מרית. זה חיוני כדי לאמת את המבנה של הפולימר המתקבל באמצעות 1H-NMR. ספקטרום NMR נרשם במכשיר 400 MHz (ראה טבלה של חומרים) באמצעות כלורופורם-d ו- D2O כממסים. סביב 10 מ"ג של כל אסטר פולי (β אמינו) נלקחו ומומסים 1 מ"ל של ממס deuterated.
- תגובה עם פפטידים כדי להשיג OM-pBAE
- הוסף 25 מ"ל של 0.1 M HCl לפפטידים נבחרים, למשל, פפטיד Cys-His-His-His עם חומצה טריפלואורואצטית (TFA, 200 מ"ג), לתוך צינור צנטריפוגה 50 מ"ל ששקל בעבר שיכול לעמוד ייבוש בהקפאה ולערבב באופן ידני לילה כדי להשיג פתרון ברור.
- להקפיא את הפתרון ב -80 °C למשך 1 שעות וייבש להקפיא את פפטיד הידרוכלוריד וכתוצאה מכך.
הערה: בדוק אם המשקל הסופי תואם לערך התיאורטי. - הפוך פתרון של C6-pBAE (0.031 mmol) בדימתיל סולפוקסיד. כמו כן, להפוך פתרון של פפטיד הידרוכלוריד (0.078 mmol) דימתיל סולפוקסיד.
- מערבבים את שני הפתרונות בצינור כובע בורג ובורג על הכובע. מערבבים את תמיסה תערובת באמבט מים עם טמפרטורה מבוקרת של 25 °C (20 °F) במשך 20 שעות עם מוט ערבוב מגנטי.
- מוסיפים את התערובת ל-7:3 (v/v) דיאתיל אתר/אצטון. צנטריפוגה ההשעיה וכתוצאה מכך ב 25,000 x g ב 4 °C (70 °F) כדי להסיר את הממס. לאחר מכן, לשטוף את מוצק עם 7:3 (v/v) דיאתיל אתר / אצטון פעמיים. לאחר מכן, לייבש את המוצר תחת ואקום (<0.2 atm).
- הפוך פתרון של 100 מ"ג/מ"ל של המוצר דימתיל גופרתי. המוצר המתקבל נקרא C6-פפטיד-pBAE. זה חיוני כדי לאמת את המבנה של הפולימר המתקבל באמצעות 1H-NMR כדי לאשר את היעלמותם של אותות olefin הקשורים אקרילטים מסוף. אם לא נעשה שימוש, הפולימר יכול להיות קפוא ב -20 °C (50 °F).
2. היווצרות פוליפלקסים
הערה: כל ההליכים צריכים להתבצע בתוך חדר מותנה כדי לשמור על טמפרטורה קבועה.
- להפשיר את הפולימרים C6-פפטיד-pBAE ומערבולת הפתרון.
- פיפטה הפולימר מערבבים מעלה ומטה ומכינים פתרון של 12.5 מ"מ (V1)בנתרן אצטט (NaAc). לאחר מכן, מערבולת את התערובת ולחכות 10 דקות.
- הכן את mRNA ב 0.5 מ"ג / מ"ל ומערבבים על ידי pipetting (V2).
הערה: זה חיוני כדי למנוע מערבולת mRNA. - מערבולת תערובת הפולימר בריכוז הסופי כדי להשיג פתרון הומוגני בין מלאי הפולימר ב- DMSO לבין מאגר אצטט.
הערה: ריכוז הפולימר הסופי תלוי ביחס N/P (חנקן לקבוצות פוספט) שנבחר. יחס ה- N/P תלוי בכל mRNA ספציפי לשימוש. עבור אנקפסולציה eGFP, למשל, נעשה שימוש ביחס של 25:1, כפי שדווח בעבר14. - מערבבים את פתרון החומר הגנטי ואת פתרון C6-פפטידPBAE (פי 25 מריכוז ה-mRNA) ביחס של 1:1 (Vi = V1 + V2).
הערה: C6-פפטיד-pBAE טעון בצינור microcentrifuge שבו mRNA מתווסף על ידי צנרת למעלה ולמטה לערבוב. לאחר הכנת, הפוליפלקס, חומצת הגרעין וריכוז C6-פפטיד-pBAE מדוללים למחצה. - דגירה ב 25 °C (30 °F) במשך 30 דקות בלוק תרמוב. לזרז עם 1:2 RNase מים חינם על ידי הוספת המדגם לצינור microcentrifuge טעון מראש עם מים.
- כלול את ההפרשות. הוסף את אותו נפח כמו התערובת של mRNA ו pBAE (Vi) ב HEPES 20 mM וסוכרוז 4% על ידי צנרת למעלה ולמטה. בשלב זה, המדגם כבר מדולל 3x.
3. ליופיליזציה פוליפלקסים
- באופן מיידי, להקפיא ב -80 °C מקפיא של פתרון polyplex הקודם עבור 1 שעה.
- בצע את הייבוש הראשי על ידי ביצוע השלבים: (1) 1 שעות ב -60 °C (60 °F) ו 0.001 hPa; (2) 1 שעות ב -40 °C ו 0.0001 hPa; (3) 4 שעות ב -20 °C (70 °F) ו 0.0001 hPa; (4) 12 שעות ב 5 °C (5 °F) ו 0.0001 hPa.
- יש לאחסן במהירות של -20 מעלות צלזיוס באופן מיידי כדי למנוע התייבשות עד לשימוש.
4. התחדשות פוליפלקס
הערה: פרוטוקול זה מתאר את התהליך המשמש לשחזור חלקיקי C6-פפטיד-pBAE lyophilized לשימוש נוסף שלהם או עבור אפיון, במבחנה, או ניתוח vivo.
- קח את חלקיקי ליופילים מ -20 °C רק ברגע השימוש ולהוסיף במהירות את הכמות המתאימה של depyrogenated (DEPC) מים כדי להפיץ מחדש את מוצק כדי להשיג את הריכוז הרצוי.
הערה: הנפח יהיה זהה לנפח הראשוני של הננו-חלקיקים אם אותו ריכוז צפוי, אך הוא יצוין עבור כל ניסוי. - פיפטה בעדינות עד resuspension הכולל, מלווה את הנוזל עם pipette.
הערה: ודא כי לא נשאר חומר על קיר של המשחקון. - לאחר מומס, pipette למעלה ולמטה במרץ, הימנעות בועות.
הערה: המדגם צריך להיות שקוף עד שקוף היבט, אשר ניכר יותר בריכוזים גבוהים יותר - יש לאחסן את הדגימות על קרח או ב-4 °C (75 °F) לתקופה מקסימלית של 24 שעות לאחר ההקמה מחדש. הימנע הקפאה.
5. אפיון פוליפלקס
- פיזור אור דינמי
הערה: קוטר הידרודינמי (nm), אינדקס polydispersity (PDI), ומטען פני השטח של חלקיקיםנמדדו ב 25 °C (633 ננומטר אורך גל לייזר, וגלאי אותות 173°, באמצעות מנתח פוטנציאלי זטה (ראה טבלה של חומרים ).- קוטר הידרודינמי (nm)
- הכן את הננו-חלקיקים המערבבים mRNA ו- pBAE ביסודיות על ידי הקטרת חומר הגן לשבר הפולימר לריכוז סופי של mRNA של 0.25 מ"ג / מ"ל כפי שתואר לעיל (שלב 2).
- יש לשטוף מראש מיקרו-קובט עם מדיית דילול מסוננת כדי לנקות אותה לחלוטין מ זיהומים. לאחר מכן, למלא את cuvette עם לפחות 50 μL של הפתרון לדוגמה וכיפה זה. לאחר מכן, הצג את הדוגמה בתוך מכשיר DLS, ודא שהתא נוסף כראוי.
הערה: מדיית הדילול מסוננת באמצעות מסנן מזרק של 0.22 מיקרומטר. - פתח את קובץ שגרת הפעולה הרגילה (SOP) שנוצר והכנס את השם לדוגמההרצוי . בחר מדידת גודל.
הערה: כל הפרמטרים ליצירת SOP למדידות גודל מסופקים בטבלה 1. - הפעל את מדידת גודל החלקיקים באמצעות DLS על-ידי לחיצה על הפעל.
הערה: לאחר צלילי הצפצוף המשולש, הניתוח הושלם. - בחר את התוצאות המתאימות לדגימה בגליון המדידה כדי להשיג את גודל החלקיקים הממוצע, PDI הממוצע, סטיית התקן והגרפיקה. לאחר סיום, הסר את התא מציוד DLS.
- הסר את המדגם, שמור אותו לניתוח פוטנציאל זטה, ולנקות ולשטוף את התא עם מים deionized. לבסוף, יבש את cuvette ניקה תחת זרם גז אוויר דחוס.
- מטען פני השטח (mV)
- הכן את הננו-חלקיקים המערבבים mRNA ו- pBAE ביסודיות על ידי הקטרת חומר הגן לשבר הפולימר לריכוז סופי של mRNA של 0.25 מ"ג / מ"ל כפי שתואר לעיל (שלב 2, היווצרות פוליפלקס). לאחר מכן, להקפיא ולייבש את הפתרון.
הערה: במקרה זה, למדידת מטען פני השטח, מומלץ מאוד לייבש את המדגם לפני ביצוע האמצעים כדי לשפץ את המדגם במאגר המתאים, המדמה את תנאי הגוף של ריכוז pH ואלקטרוליט. - resuspend מדגם ליופילי באמצעות מים. לדלל את המדגם 1/10 במים (ריכוז סופי 0.025 מ"ג / מ"ל).
- יש לשטוף מראש תא נימי מקופל חד פעמי (זטה פוטנציאלי cuvette) עם מדיית דילול מסוננת כדי לנקות אותו לחלוטין מזיהומים. לאחר מכן, מלא את cuvette עם חלקיקים מדוללים, באמצעות מזרק 1 מ"ל, וכובע שני הצדדים של חומרי המילוי.
הערה: פיזור הננו-חלקיקים צריך למלא את הנפח הזמין בקובט (~ 1 מ"ל), תוך תשומת לב מיוחדת להיווצרות הבועה, אשר יכול להכשיל אמצעים. - הצג את המדגם בתוך DLS; ודא שהתא נוסף כראוי.
- פתח את קובץ SOP שנוצר עבור ניתוח פוטנציאלי zeta והכנס את השם לדוגמההרצוי . בחר מדידה בעלת פוטנציאל זטה.
הערה: פרמטרים ליצירת SOP עבור מדידות פוטנציאליות של זטה ניתנים בטבלה 2. - הפעל מדידה פוטנציאלית של זטה באמצעות DLS על-ידי לחיצה על הפעל.
הערה: לאחר צליל הצפצוף המשולש, הניתוח הושלם. - בחר את התוצאות המתאימות לדגימה בגליון המדידה כדי להשיג את פוטנציאל הזטה הממוצע, סטיית התקן והגרפיקה. לאחר סיום, הסר את התא מציוד DLS.
- הסר את המדגם ולשמור אותו אם יש צורך. לאחר מכן, לנקות ולשטוף את תא cuvette עם מים deionized, ואחריו אתנול ומים שוב. לבסוף, יבש את cuvette ניקה תחת זרם גז אוויר דחוס.
הערה: כדי לנתח את הנתונים, השתמש בתוכנה המומלצת.
- הכן את הננו-חלקיקים המערבבים mRNA ו- pBAE ביסודיות על ידי הקטרת חומר הגן לשבר הפולימר לריכוז סופי של mRNA של 0.25 מ"ג / מ"ל כפי שתואר לעיל (שלב 2, היווצרות פוליפלקס). לאחר מכן, להקפיא ולייבש את הפתרון.
- קוטר הידרודינמי (nm)
- ניתוח מעקב חלקיקים (NTA)
הערה: קוטר הידרודינמי (nm) וריכוז של חלקיקים נמדדו ב 25 °C (75 °F), אורך גל לייזר 488 ננומטר באמצעות מנתח מעקב חלקיקים (ראה רשימת חומרים).- נת"ע והכנת מדגם
- תדליק את המחשב ואת הציוד. תחילה, בדוק אם כל הרכיבים מחוברים כראוי. לאחר מכן, פתח את התוכנה המומלצת. התוכנה תבדוק אם כל האביזרים מחוברים כראוי.
- חבר את הלוח העליון, כאן, תא O-טבעת, לתוך מודול הלייזר.
הערה: אל תגזים בחלק זה. - ראשית לטעון את התא עם חוצץ ו / או deionized מים עם מזרק 1 מ"ל. חזור על ההליך לפחות פעמיים. הימנע החדרת בועות בחדר.
- הכן את המדגם על ידי דילול 1/1000 במים דה-יונים מהריכוז המשמש במדידת גודל DLS. הכן לפחות 1 מ"ל לטעון אותו לתוך מזרק 1 מ"ל, הימנעות החדרת בועות.
- טען את הדגימות לתוך התא באמצעות מזרק. לאחר מכן, חבר את מודול הלייזר לתא הגדול של NTA.
הערה: תא גדול מציין את הרווח שבו ממוקם התא למדידה.
- מיטוב תמונה
- ראשית, בחומרה, בדוק אם המצלמה והלייזר המתאים נבחרו.
הערה: כאן, יש רק מצלמה אחת ואת לייזר כחול 488 ננומטר. - התחל ברמת המצלמה ב- 0 והקש על התחל מצלמה בחלון לכידה.
הערה: בשלב זה, התאם את הפרמטרים הבאים. מיקום קרן (ניתן להזיז אותו למעלה ולמטה על המסך). רמת המצלמה: הימנע פיקסלים רוויים יתר על המידה. פוקוס (גלגל לרוחב):נסה להתמקד טוב ככל האפשר. עדיף שיהיו חלקיקים עם הילה במקום חלקיקים לא ממוקדים. ריכוז: התאם את הריכוז כך שיהיו בין 10 ל-100 חלקיקים בכל שדה.
- ראשית, בחומרה, בדוק אם המצלמה והלייזר המתאים נבחרו.
- הקלטת וידאו
- בתוכנה, עבור אל חלון בחירת מדידה- SOP (משמאל למטה) ובחר מדידה רגילה.
הערה: תוכנית לבצע שלושה מדדים של 30 s כל אחד (כדי לאפשר לתוכנה לבצע חישובי ממוצע וסטיית תקן). ספק שם ונתיב תיקיה (בשם קובץ בסיס) כדי לשמור את הרשומות של הדוגמה. כאשר פרמטרי SOP מוגדרים כראוי, הקש יצירה והפעלה של קובץ Script. לאחר השכפול הראשון נמדד, התוכנית תבקש להוסיף מדגם חדש. לאחר מכן, חלק נוסף של המדגם חייב להיות הציג בחדר על ידי דחיפת הבוכנה של המזרק. לבסוף, חזור על פעם שלישית כדי לנתח את השכפול השלישי.
- בתוכנה, עבור אל חלון בחירת מדידה- SOP (משמאל למטה) ובחר מדידה רגילה.
- עיבוד וידאו
- הסתגל מחדש את סף השגת המסך והזיהוי לאחר סיום שלושת האמצעים כדי לנתח את החלקיקים הנמדדים. ברגע זה, כ -100 חלקיקים צריכים להופיע בכל מסגרת כדי לבצע את הניתוח (צלבים אדומים גבוהים וצלבים כחולים נמוכים צפויים).
- ייצאו את התוצאות בקובץ PDF לאחר השלמת הניתוח. בנוסף, ניתן לייצא כמו קטעי וידאו וקבצי Excel.
- ניקוי נת"ע
הערה: סגור את כל המדידות שנפתחו לפני לימוד המדגם הבא; מאז הקבצים שנוצרו הם עצומים בהתאם למחשב, זה לא קל לשמור על יותר מאחד פתוח.- נקה את תא NTA על ידי שטיפה חוזרת ונשנית של מים לפני ביצוע המדידה הבאה עד שלא נצפו חלקיקים; לאחר מכן, רוקן את המאגר המשמש (PBS) כדי להמשיך עם האמצעים.
- לשטוף אוויר בתוך התא ולייבש אותו עם נייר כיתה מיקרוסקופי לאחר המדידה האחרונה של היום הושלמה.
- לאפיין את הגודל והצורה על ידי מיקרוסקופיה אלקטרונית שידור (TEM). הכינו את הדגימות. 30 μL של אמצעי האחסון הסופי מספיק לאפיון TEM.
הערה: הן טרי וליופילי - לאחר resuspension - חלקיקים ניתן למדוד. - זרוק 10 μL של מדגם על רשת נחושת מצופה פחמן. תן לו להתייבש במשך 10 דקות. הסר את הנוזל העודף, במידת הצורך, על ידי הקשה רכה על נייר מסנן.
- זרוק 10 μL של uranyl אצטט (2% w / v) פתרון עבור כתמים שליליים. תן לו להתייבש במשך 1 דקות. הסר את עודף הנוזל, במידת הצורך, על ידי הקשה רכה על נייר מסנן.
- הצג את המדגם במיקרוסקופ וסריקה (פעולת מתח 80 kV).
הערה: ניתן להשתמש בתוכנה מתאימה לניתוח נוסף של התמונות.
- נת"ע והכנת מדגם
- יעילות אנקפסולציה
- הכנת דוגמה
- הכן את הננו-חלקיקים בריכוז הרצוי והקפיא וייבש אותם. לאחר מכן, resuspend הננו-חלקיקים לדלל אותם בריכוז הסופי של 6 מיקרוגרם / מ"ל.
- הכן מאגר TE אחד מפתרון המלאי של 20x.
הערה: Vt (נפח כולל) = (מספר הדגימות x 100 μL x 4) (מספר הדגימות x 290 μL) + 2 מ"ל. - הכן מאגר TE עם 3 מיקרוגרם / μL של הפרין מהמלאי של 100 מיקרוגרם / μL.
הערה: Vt = מספר הדגימות x 50 μL x 2. - הכנת התקנים
- הכן תקן RNA הנע בין 0.2 מיקרוגרם ל-0.025 מיקרוגרם/מ"ל במאגר טריס-EDTA (TE)(טבלה S1A).
הערה: השתמש ב- mRNA בתקן ה- RNA במקרה שונה מה- RNA ריבוזומלי. - הכן RNA:pBAE סטנדרטי עם הפרין (טבלה S1B). הכן תקן הפרין(טבלה S1C).
- הכן צלחת 96-גם כדלקמן.
- טען 295 μL של מאגר TE בנתיב הראשון של צלחת 96 באר (כמו בארות רבות כמו דוגמאות לנתח). לאחר מכן, טען 50 μL של מאגר TE 1x לנתיבים B ו- C (כפילויות עבור כל מדגם).
- טען 50 μL של 1x TBE חוצץ עם 3 מיקרוגרם / μL של הפרין לנתיבים D ו- E (כפילויות עבור כל מדגם). לאחר מכן, טען 100 μL של כל תקן בנתיבים F, G ו- H (כפילויות עבור כל תקן).
- עומס 5 μL של כל מדגם בנתיב A (ריכוז בכל באר הוא 0.1 מיקרוגרם / מ"ל). ערבבו כראוי על ידי צנרת וטעינה של 50 מיקרו-אל של כל דגימה בארבע הבארות שלהלן (שתיים מהן מכילות 50 μL של מאגר 1x TE ועוד שניים המכילים חיץ TE 1x עם 3 מיקרוגרם/מיקרו-ל של הפרין).
- לדגור על המדגם במשך 30 דקות ב 37 °C (50 °F). הכן ריאגנט RiboGreen לפי פרוטוקול היצרן (ראה טבלת חומרים) במאגר TE אחד.
הערה: לדלל 1: 200 ומערבולת. הגן מפני אור. Vt = מספר בארות מלאות x 100 μL. - לטעון 100 μL של פתרון ריבוגרין לתוך כל באר. לזהות פלואורסצנטיות באמצעות קורא המיקרו-לוח עם אורך גל עירור של 500 ננומטר ואורך גל פליטה של 525 ננומטר.
- ניתוח תוצאות
- הכן את שלוש עקומות הכיול
הערה: ראשית, תקן RNA ריבוזומלי. אינטרפולציה בעקומת כיול זו הדגימות שאינן מכילות הפרין. שנית, mRNA: pBAE עם הפרין. אינטרפולציה בעקומת הכיול הזו המדגם שיש לו הפרין. שלישית, הפרין. משמש כדי להבטיח את ריכוז העבודה הוא בטווח הליניארי. - חשב יעילות אנקפסולציה (EE%) כדלקמן:
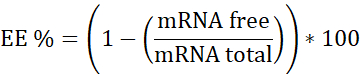
- הכן את שלוש עקומות הכיול
- הכנת דוגמה
6. אפיון במבחנה
- מיקרוסקופיית פלואורסצנטיות להערכה איכותית
- מניחים את הלוח 96-well על המיקרוסקופ לאחר 24 שעות של transfection. התחל לדמיין תאים עם המטרה 10x.
הערה: תאי HeLa משמשים במקרה זה. התאים מותאמים לשפות שימוש במצב השידור (שדה בהיר), ויש להתאים את המוקד כעת.- ראשית, החל איזון לבן כדי להפנות לתוכנה על הרקע של הדגימות. לאחר מכן, לרכוש תמונה כדי לכסות אותו עם תמונת פלואורסצנטיות במהלך הניתוח.
- שנה את מצב המיקרוסקופ למצב השתקפות (פלואורסצנטיות) והזז את גלגל המסנן ללייזר הכחול (488 ננומטר) כדי לדמיין eGFP.
הערה: בשלב זה, יש להתאים את זמן החשיפה ואת הרווח. יש להתאים את הרווח בערכים שבין 3 ל- 5 כדי להימנע מממצאים ועודף על אות הרקע. התאמת זמן החשיפה תלויה ביעילות ההדבקה (מ- ms ל- 1 s). - לרכוש תמונות עבור כל התנאים או בארות המעסיקים את אותו זמן חשיפה כדי להשוות את כל הדגימות.
- מניחים את הלוח 96-well על המיקרוסקופ לאחר 24 שעות של transfection. התחל לדמיין תאים עם המטרה 10x.
- ציטומטריית זרימה (FC) להערכה כמותית
- השתמש פיפטה רב ערוצית כדי להכין את צלחת 96 באר לניסוי cytometry זרימה.
הערה: בעת עבודה עם תאים דבקים למחצה, כגון בשורת התא JAWSII, לשחזר את כל עוצמת המדיה ולאחסן אותו לתוך צלחת אחרת 96 באר. אל תשאפו למדיה זו מכיוון שהיא עשויה להכיל מספר משמעותי של תאים שהודבקו. - נקה את התאים (תאי HeLa משמשים כאן) עם 100 μL / באר של 1x PBS ולשאף אותו. לאחר מכן, להוסיף 25 μL / באר של טריפסין ודגרה אותו ב 37 °C (5 דקות).
- לאחר שהתאים מנותקים, הוסף מדיה שהתאוששה בעבר כדי לעצור את פעולת טריפסין ולתקן את התאים, הוספת 31.25 μL / well של פורמלין 10% במשך 20 דקות (ריכוז סופי 2.5%).
הערה: בשלב זה, חשוב לדמיין את מצב התאים על ידי מיקרוסקופיה כדי להבטיח את ניתוק התאים. מומלץ מאוד pipette למעלה ולמטה מספר פעמים כדי לעזור לתאים לנתק ולהימנע agglomeration שלהם. זה יניב תוצאה אמינה. - הפעל את ציטומטר הזרימה ואת התוכנה. בתוכנה, להגדיר את התנאים המתאימים עבור הניסוי (סוג של צלחת, נפח מדגם, ופרמטרים אחרים כגון רועד, שטיפה בין דגימות.
הערה: עבור שלב 6.2.5, קצב הזרימה צריך להיות 120 μL / min. מערבבים מחזור אחד כל דקה אחת ושוטפים מחזור אחד כל אחד היטב. ערבוב חיוני כדי לשמור על התאים מפוזרים בתקשורת ולאפשר ניתוח טוב יותר של תאים בודדים. בנוסף, שטיפה יש צורך לנקות את microfluidics של cytometer בין דגימות. לבסוף, בדוק אם קיימים מספיק מאגרים ואם כל הרכיבים מחוברים כראוי. - הגדר את הפרמטרים המתאימים כדי לכמת את אחוז התאים שהודבקו באופן חיובי.
- תחילה, הצג את נתוני הזרימה על (אור מפוזר קדימה) FSC לעומת SCC (אור מפוזר בצד) לחלק כדי להבחין בין התאים לבין הפסולת. לאחר מכן, חלקת פיזור נוספת המשווה את המשרעת (FSC-A) לעומת גובה (FSC-H) משורטטת לשער ולהפלות תאים בודדים.
הערה: האוכלוסייה שלא טופלה מאפשרת לשער את האוכלוסיות המתאימות לתאים שהודבקו באופן חיובי. לאחר מכן, כימות התאים שהודבקו באופן חיובי מתבצע בערוץ הנכון בעלילת היסטוגרמה. לכן, התאים שהודבקו באופן חיובי חייבים להיות מיוצגים כרצף של אירועים בהיסטוגרמה.
- תחילה, הצג את נתוני הזרימה על (אור מפוזר קדימה) FSC לעומת SCC (אור מפוזר בצד) לחלק כדי להבחין בין התאים לבין הפסולת. לאחר מכן, חלקת פיזור נוספת המשווה את המשרעת (FSC-A) לעומת גובה (FSC-H) משורטטת לשער ולהפלות תאים בודדים.
- השתמש פיפטה רב ערוצית כדי להכין את צלחת 96 באר לניסוי cytometry זרימה.
7. בדיקות פונקציונליות במבחנה: קיבולת להפעיל תאי מערכת החיסון מודל באמצעות אליבאמין (OVA) כמו mRNA מודל אנטיגני
- צלחת 10,000 תאים /טוב (תאי JAWSII משמשים כאן) בצלחת 96-באר יום לפני transfection.
הערה: צלחת כמו בארות רבות כנדרש יש משולשים עבור כל תנאי. תן לתאים להתחבר לצלחת לפחות במשך 12 שעות (מומלץ דגירה לילית). - הכן את ה-NPs של pBAEs כמתואר בפתק שלהלן כדי להעביר 0.6 מיקרוגרם mRNA לבאר.
הערה: כבקרה חיובית, הדבק את התאים באמצעות ריאגנט transfection. כאן, השתמשנו 0.1 מיקרוגרם mRNA לבאר ו 0.25 μL של ריאגנט transfection לבאר. mRNA קידוד עבור OVA נרכש (ראה טבלת חומרים). הוא רבידנילט, שונה עם 5-methoxyuridine, ומותאם למערכות יונקים, והוא מוגן באמצעות כיסוי קצה עם מבנה Cap1, שיטה קניינית מהספק. - לדגור על צלחת 96-באר עבור 24 שעות באינקובטור אוויר יבש ב 37 °C (5% CO2).
הערה: לאחר זמן זה, אל תאשר את המדיה מכיוון שהיא עשויה להכיל מספר מסוים של תאים. לשחזר את התאים ולשמור אותם באר אחרת או צלחת. - לשטוף את התאים שנותרו על הבאר עם 25 μL של 1x PBS. לאחר מכן, לשאוף אותו ולהוסיף 25 μL של טריפסין ודגרה את הצלחת במשך 5 דקות ב 37 °C (77 °F) כדי לנתק את התאים. הפסק את תגובת טריפסין על-ידי הוספת המדיה שנמצאה בעבר לבאר הכתב.
- צנטריפוגות את הצלחת ב 400 x גרם במשך 5 דקות ב 4 °C (5 °F). לשאוף לתקשורת. הוסף 50 μL / באר של PBS 1x ו 2.5% של פורמלין. לדגור אותו ב 4 °C (55 °F) במשך 20 דקות כדי לתקן תאים.
- חזור על שלבים 7.5 ו- 7.5.1. לאחר מכן, להוסיף 50 μL / באר של 1x PBS ו 3% BSA (חוצץ חסימה) ודגרה במשך 30 דקות ב 4 °C (70 °F). שוב, חזור על שלבים 7.5 ו- 7.5.1 ולאחר מכן הוסף 50 μL / well של הנוגדן העיקרי (עכבר α-OVA) ב 1x PBS ו 3% BSA ודגרה במשך 30 דקות ב 4 °C (7 °F).
- חזור על שלבים 7.5 ו- 7.5.1 ולאחר מכן לשטוף את התאים עם 50 μL / באר של 1x PBS. שאף מדיה ולאחר מכן הוסף פתרון נוגדנים משני (α-עכבר-AlexaFluor488/PerCP ו- Cy5.5-CD11b/APC-CD86) ב- 1x PBS ו- 3% BSA. לדגור אותו במשך 1 שעות ב 4 °C (5 °F).
- צנטריפוגות את הצלחת ב 400 x g במשך 5 דקות. לאחר מכן, לשטוף את התאים עם 50 μL / באר של 1x PBS. לאחר מכן, צנטריפוגה (400 x g במשך 5 דקות), לשאוף, ולאחר מכן resuspend התאים ב 100 μL / well של 1x PBS ו 2.5% פורמלין.
- לנתח אותו על ידי ציטומטריית זרימה, כמתואר לעיל (שלב 6.2).
תוצאות
סינתזה ואפיון פולימרים
הליך הסינתזה של OM-pBAE ניתן באיור 2. כפי שמראה איור 2A, הצעד הראשון להשגת ה-OM-pBAE הוא לסנתז את ה-C6-pBAE על ידי הוספת האמינים (1-הקסילאמין ו-5-אמינו-1-פנטנול, יחס 1:1) ל-diacrylate (1,4-בוטנדיול ניאקרילט). תגובה זו מתבצעת ב 90 °C (50 °F) במשך 20 שעות עם ?...
Discussion
לאחר פרוץ מגפת Covid-19 בשנה שעברה, החשיבות של חיסונים במונחים של בקרת מחלות זיהומיות באה לידי ביטוי כמרכיב קריטי8. מאמצי מדענים ברחבי העולם אפשרו את שחרורם לשוק של חיסונים רבים. בפעם הראשונה בהיסטוריה, חיסוני mRNA הוכיחו את הצלחתם המשוערת בעבר, הודות לעיצוב המהיר שלהם בגלל יכולתם ל...
Disclosures
למחברים אין מה לחשוף או כל ניגודי אינטרסים.
Acknowledgements
תמיכה כספית מ- MINECO /FEDER (מענקים SAF2015-64927-C2-2-R, RTI2018-094734-B-C22 ו- COV20/01100) מוכרת. CGF הודתה מלגת IQS הדוקטורט שלה.
Materials
| Name | Company | Catalog Number | Comments |
| 1,4-butanediol diacrylate | Sigma Aldrich | 123048 | |
| 1-hexylamine | Sigma Aldrich | 219703 | |
| 5-amino-1-pentanol | Sigma Aldrich | 411744 | |
| Acetone | Panreac | 141007 | |
| CD11b antibody | BD | 550993 | |
| CD86 antibody | Bioligend | 105007 | |
| Chlor hydroxhyde | Panreac | 181023 | |
| Chloroform-d | Sigma Aldrich | 151823 | |
| Cys-His-His-His peptide | Ontores | Custom | |
| Cys-Lys-Lys-Lys peptide | Ontores | Custom | |
| D2O | Sigma Aldrich | 151882 | |
| DEPC reagent for Rnase free water | Sigma Aldrich | D5758 | This reagent is important to treat MilliQ water to remove any RNases of the buffers |
| Diethyl eter | Panreac | 212770 | |
| dimethyl sulfoxide | Sigma Aldrich | 276855 | |
| HEPES | Sigma Aldrich | H3375 | |
| mRNA EGFP | TriLink Technologies | L-7601 | |
| mRNA OVA | TriLink Technologies | L-7610 | |
| RiboGreen kit | ThermoFisher | R11490 | |
| sodium acetate | Sigma Aldrich | 71196 | |
| sucrose | Sigma Aldrich | S0389 | |
| Trifluoroacetic acid | Sigma Aldrich | 302031 | |
| Trypsin-EDTA | Fisher Scientific | 11570626 | |
| α-mouse AlexaFluor488 antibody | Abcam | Ab450105 | |
| Equipment | |||
| Nanoparticle Tracking Analyzer | Malvern Panalytical | NanoSight NS300 | |
| Nuclear Magnetic Ressonance Spectrometer | Varian | 400 MHz | |
| ZetaSizer | Malvern Panalytical | Nano ZS | For zeta potential and hydrodynamic size determination |
| Software | |||
| NanoSight NTA software | Malvern Panalytical | MAN0515-02-EN-00 | |
| NovoExpress Software | Agilent | Not specified | |
| ZetaSizer software | Malvern Panalytical | DTS Application | To analyze surface charge and hydrodynamic sizes |
References
- Chumakov, K., Benn, C. S., Aaby, P., Kottilil, S., Gallo, R. Can existing live vaccines prevent COVID-19. Science. 368 (6496), 1187-1188 (2020).
- Zhang, C., Maruggi, G., Shan, H., Li, J. Advances in mRNA vaccines for infectious diseases. Frontiers in Immunology. 10, 1-13 (2019).
- Wherry, E. J., Jaffee, E. M., Warren, N., D'Souza, G., Ribas, A. How did we get a COVID-19 vaccine in less than 1 year. Clinical Cancer Research. 27 (8), 2136-2138 (2021).
- Folegatti, P. M., et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. The Lancet. 396 (10249), 467-478 (2020).
- Geall, A. J., Mandl, C. W., Ulmer, J. B. RNA: The new revolution in nucleic acid vaccines. Seminars in Immunology. 25 (2), 152-159 (2013).
- Ulmer, J. B., Geall, A. J. Recent innovations in mRNA vaccines. Current Opinion in Immunology. 41, 18-22 (2016).
- Kranz, L. M., et al. Systemic RNA delivery to dendritic cells exploits antiviral defence for cancer immunotherapy. Nature. 534 (7607), 396-401 (2016).
- Milane, L., Amiji, M. Clinical approval of nanotechnology-based SARS-CoV-2 mRNA vaccines: impact on translational nanomedicine. Drug Delivery and Translational Research. 1 (4), 3 (2020).
- Green, J. J., Langer, R., Anderson, D. G. A combinatorial polymer library approach yields insight into nonviral gene delivery. Accounts of Chemical Research. 41 (6), 749-759 (2008).
- Guerrero-Cázares, H., et al. Biodegradable polymeric nanoparticles show high efficacy and specificity at DNA delivery to human glioblastoma in vitro and in vivo. ACS Nano. 8 (5), 5141-5153 (2014).
- Kozielski, K. L., Tzeng, S. Y., Hurtado De Mendoza, B. A., Green, J. J. Bioreducible cationic polymer-based nanoparticles for efficient and environmentally triggered cytoplasmic siRNA delivery to primary human brain cancer cells. ACS Nano. 8 (4), 3232-3241 (2014).
- Segovia, N., Dosta, P., Cascante, A., Ramos, V., Borrós, S. Oligopeptide-terminated poly(β-amino ester)s for highly efficient gene delivery and intracellular localization. Acta Biomaterialia. 10 (5), 2147-2158 (2014).
- Dosta, P., Segovia, N., Cascante, A., Ramos, V., Borrós, S. Surface charge tunability as a powerful strategy to control electrostatic interaction for high efficiency silencing, using tailored oligopeptide- modified poly (beta-amino ester)s (PBAEs). Acta Biomaterialia. 20, 82-93 (2015).
- Fornaguera, C., et al. mRNA delivery system for targeting antigen-presenting cells in vivo. Advanced Healthcare Materials. 7 (17), 180033 (2018).
- Fornaguera, C., Castells-Sala, C., Lázaro, M. &. #. 1. 9. 3. ;., Cascante, A., Borrós, S. Development of an optimized freeze-drying protocol for OM-PBAE nucleic acid polyplexes. International Journal Pharmaceutics. 569, (2019).
- Fornaguera, C., Solans, C. Analytical methods to characterize and purify polymeric nanoparticles. International Journal of Polymer Science. , (2018).
- Fornaguera, C., Solans, C. Characterization of polymeric nanoparticle dispersions for biomedical applications: size, surface charge and stability. Pharmaceutical Nanotechnology. 6 (3), 147-164 (2018).
- Sahin, U., Karikó, K., Türeci, &. #. 2. 1. 4. ;. MRNA-based therapeutics-developing a new class of drugs. Nature Reviews Drug Discovery. 13 (10), 759-780 (2014).
- Fan, Y. N., et al. Cationic lipid-assisted nanoparticles for delivery of mRNA cancer vaccine. Biomaterials Science. 6 (11), 3009-3018 (2018).
- Le Moignic, A., et al. Preclinical evaluation of mRNA trimannosylated lipopolyplexes as therapeutic cancer vaccines targeting dendritic cells. Journal of Controlled Release. 278, 110-121 (2018).
- Banerji, A., et al. mRNA vaccines to prevent COVID-19 disease and reported allergic reactions: Current evidence and approach. Journal of Allergy and Clinical Immunology: In Practice. 9 (4), 1423-1437 (2021).
- Kaczmarek, J. C., Kowalski, P. S., Anderson, D. G. Advances in the delivery of RNA therapeutics: from concept to clinical reality. Genome Medicine. 9 (1), 1-16 (2017).
- Dosta, P., et al. Delivery of anti-microRNA-712 to inflamed endothelial cells using poly(β-amino ester) nanoparticles conjugated with VCAM-1 targeting peptide. Advanced Healthcare Materials. , 1-11 (2021).
- Segovia, N., et al. Hydrogel doped with nanoparticles for local sustained release of siRNA in breast cancer. Advanced Healthcare Materials. 4 (2), 271-280 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved