Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Aşı Amacıyla mRNA Yüklü Poli (Beta Aminoesterler) Nanopartiküllerinin Sentezi ve Karakterizasyonu
Bu Makalede
Özet
Burada, poli (beta aminoester) polimerlere dayalı mRNA nanopartikülleri üretmek için basit bir protokol sunulmaktadır, kapsüllenmiş mRNA değiştirilerek uyarlanabilir. Polimerleri, nanopartikülleri ve in vitro temel karakterizasyonlarını sentezlemek için iş akışı da açıklanmıştır. Bağışıklama ile ilgili bir kavram kanıtı da ekleniyor.
Özet
Aşılama modern toplumun en büyük başarılarından biri olmuştur ve hastalığın kontrol altına alma ve önlemede vazgeçilmezdir. Geleneksel aşılar enfeksiyöz ajanın tamamından veya kesirlerinden oluşuyordu. Bununla birlikte, zorluklar devam ediyor ve yeni aşı teknolojileri zorunlu. Bu bağlamda, sars-CoV-2 enfeksiyonunu önleyen iki mRNA aşısının hızlı bir şekilde onaylanmasıyla gösterildiği gibi, mRNA'nın bağışıklama amacıyla kullanılması gelişmiş bir performans göstermiştir. Viral enfeksiyonları önlemede başarının ötesinde, mRNA aşıları terapötik kanser uygulamaları için de kullanılabilir.
Bununla birlikte, mRNA'nın kararsızlığı ve çekirdeklerin varlığı nedeniyle vücuttan hızlı bir şekilde temizlenmesi çıplak teslimatını mümkün kılmaz hale getirir. Bu bağlamda, nanotıplar ve özellikle polimerik nanopartiküller kritik mRNA dağıtım sistemleridir. Bu nedenle, bu makalenin amacı, tescilli polimerik nanopartiküllere dayanarak bir mRNA aşı adayının formülasyonu ve testi için protokolü açıklamaktır. Kullanılan polimerlerin sentezi ve kimyasal karakterizasyonu, nanopartiküller oluşturmak için mRNA ile kompleksleşmesi ve lizofilizasyon metodolojileri burada tartışılacaktır. Bu, depolama ve dağıtım maliyetlerini azaltmak için çok önemli bir adımdır. Son olarak, in vitro transfect ve olgun model dendritik hücrelere kapasitelerini göstermek için gerekli testler belirtilecektir. Bu protokol, bu aşıların çok çeşitli hastalıkları önlemesini veya iyileştirmesini sağlayan yüksek çok yönlülüğü nedeniyle aşılama üzerinde çalışan bilim camiasına fayda sağlayacaktır.
Giriş
Bulaşıcı hastalıklar dünya çapında milyonlarca insan için ciddi bir tehdit oluşturmuş ve hala bazı gelişmekte olan ülkelerde önde gelen ölüm nedenlerinden biridir. Profilaktik aşılama, modern toplumun bulaşıcı hastalıkları önlemek ve kontrol etmek için en etkili müdahalelerinden biri olmuştur1,2. 20. yüzyıl ilgisindebilimin bu kritik kilometre taşları SARS-CoV-2 virüsünün neden olduğu son dünya çapındaki Covid-19 salgını tarafından dile getirildi3. Hastalığın yayılmasını engellemek için verimli aşılara sahip olmanın öneminin farkına vararak, tüm biyomedikal topluluklardan gelen işbirliği çabaları, bir yıldan kısa bir sürede piyasada birçok profilaktik aşı ile başarılı bir şekilde sonuçlanmıştır4.
Geleneksel olarak, aşılar zayıflatma (canlı, azaltılmış virülans) veya inaktive (ölüm parçacıkları) virüslerinden oluşuyordu. Bununla birlikte, güvenlik hataları için marjı olmayan bazı hastalıklar için viral parçacıklar mümkün değildir ve bunun yerine protein alt birimleri kullanılır. Bununla birlikte, alt ünvanlar genellikle birden fazla epitop / antijen kombinasyonunu etkinleştirmez ve aşılama gücünü artırmak için yardımcılar gerekir5,6. Bu nedenle, yeni aşı türlerine olan ihtiyaç açıktır.
Mevcut pandemi sırasında da gösterildiği gibi, nükleik asitlere dayalı yeni aşı adayları, uzun gelişim süreçlerinden kaçınmak ve aynı zamanda hayati bir hasta bağışıklama üretirken yüksek çok yönlülük sağlamak açısından avantajlı olabilir. Bu, başlangıçta deneysel kanser aşısı olarak tasarlanan mRNA aşıları için de böyledir. Antijene özgü T hücre yanıtları üretme doğal kapasiteleri sayesinde3,5,6,7. MRNA antijenik proteini kodlayan molekül olarak, sadece aynı şekilde değişen aşı, aynı mikroorganizmanın diğer varyantlarını, farklı suşları, diğer enfeksiyöz mikroorganizmaları bağışıklık kazanmak ve hatta bir kanser immünoterapik tedavisi haline gelmek için hızla uyarlanabilir. Ayrıca büyük ölçekli üretim maliyetleri açısından avantajlıdırlar. Bununla birlikte, mRNA çıplak yönetimlerini engelleyen önemli bir engele sahiptir: çekirdeğin dolu fizyolojik medyada istikrarı ve bütünlüğü tehlikeye girer. Bu nedenle, onu koruyan ve mRNA'yı antijen sunan hücrelere vektörleştiren bir nanometrik taşıyıcının kullanılmasıgerekir 2,8.
Bu bağlamda, poli (beta aminoesterler) (pBAE), katyonik yükleri9,10,11sayesinde nanometrik parçacıklarda karmaşık mRNA'ya olağanüstü bir yetenek gösteren biyouyumlu ve biyobozunur polimerler sınıfıdır. Bu polimerler, fizyolojik koşullarda esterazlar tarafından bozulmalarını kolaylaştıran ester bağlarından oluşur. pBAE kütüphane adayları arasında, son katyonik oligopeptidlerle işlevsel hale getirilenler, endositoz yoluyla hücrelere verimli bir şekilde nüfuz etmek ve kapsüllenmiş gen materyalini transfect etmek için küçük nanopartiküller oluşturmak için daha yüksek bir kapasite gösterdi. Ayrıca, tamponlama kapasiteleri sayesinde, endozom bölmesinin asitlenmesi endosomal kaçış sağlar12,13. Yani, belirli bir tür pBAE, stabilitelerini ve uç-oligopeptid kombinasyonlarını geliştirmek için omurgalarındaki hidrofobik moieties (C6 pBAE olarak adlandırılır) dahil olmak üzere (polimerin% 60'ı üç lizin ve 40 ile modifiye edilmiştir Parenteral uygulamadan sonra antijen sunan hücreleri seçici olarak transfects ve fare bağışıklama tarafından izlenen mRNA kodlu antijen sunumunu üreten tri-histidinli polimerin% yakın zamanda yayınlanmıştır14 . Ek olarak, bu formülasyonların nanotıp formülasyonlarının ana darboğaz adımlarından birini atlatabileceği de gösterilmiştir: yumuşak kuru ortamlarda uzun süreli stabilite sağlayan işlevlerini kaybetmeden dondurma-kurutma imkanı15.
Bu kapsamda mevcut protokolün amacı, protokoldeki kritik adımların açıklamasını yaparak, bulaşıcı hastalıkların önlenmesi ve tümör tedavisi uygulamaları için verimli aşıların üretilmesini sağlayarak mRNA nanopartiküllerinin oluşumuna ilişkin prosedürü bilim camiasının kullanımına açmaktır.
Aşağıdaki protokol, nanopartikül sentezi için daha fazla kullanılacak oligopeptid son modifiye poli (beta aminoesterler) - OM-pBAE polimerlerini sentezlemek için tam egzersizi açıklar. Protokolde nanopartikül formülasyonu da yer almaktadır. Buna ek olarak, prosedürün başarısı için kritik adımlar ve elde edilen formülasyonların olumlu veya olumsuz bir sonuç tanımlamak için gerekli kalite kontrol karakterizasyon özelliklerini gerçekleştirmesini sağlamak için de sağlanır. Bu protokol Şekil 1'de özetlenmiştir.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Uç oligopeptidler (OM-pBAE) ile pBAE polimer sentezi
- C6-pBAE'nin Polimerizasyonu
- 5-amino-1-pentanol (38 mmol) ekleyin; MW = 103.16 Da) 1-altıgen (38 mmol; MW = 101.19 Da) yuvarlak tabanlı cam şişeye (100 mL). Ardından, 1,4 butanediol diakrilit (82 mmol) ekleyin; MW = 198,22 Da).
- Silikon yağ banyounu 90 °C'de önceden ısıtın, yuvarlak tabanlı şişeyi yağ banyosuna yerleştirin ve karışımı bir gecede manyetik bir karıştırma çubuğu (~18 saat) yardımıyla karıştırın. Ardından, ürünü yuvarlak alt şişeden alın ve -20 °C'de dondurucuya yerleştirin.
NOT: Ürün yapışkan bir toz şeklindedir ve bir spatula yardımıyla şişeden çıkar. Elde edilen polimerin yapısını 1H-NMR ile doğrulamak önemlidir. NMR spektrumu, çözücü olarak kloroform-d ve D2O kullanılarak 400 MHz'lik bir enstrümanda (bkz. Malzeme Tablosu)kaydedildi. Her poliden yaklaşık 10 mg (β-amino ester) alındı ve döterlenmiş çözücünün 1 mL'sinde çözüldü.
- OM-pBAE elde etmek için peptitlerle reaksiyon
- Seçilen peptitlere 25 mL 0,1 M HCl ekleyin, örneğin, Trifluoroasetik asitli peptit Cys-His-His-His -His (TFA, 200 mg), daha önce dondurularak kurumaya dayanabilen ve net bir çözelti elde etmek için bir gecede manuel olarak karıştırabilen 50 mL santrifüj tüpüne ekleyin.
- Çözeltiyi -80 °C'de 1 saat dondurun ve elde eden peptit hidroklorürü dondurarak kurutun.
NOT: Son ağırlığın teorik değere karşılık gelip gelmediğini kontrol edin. - Dimetil sülfit içinde C6-pBAE (0.031 mmol) çözeltisi yapın. Ayrıca, dimetil sülfitte peptit hidroklorürün (0.078 mmol) bir çözeltisini yapın.
- İki çözeltiyi bir vidalı kapak tüpünde karıştırın ve kapağın üzerine vidalayın. Karışım çözeltisini, 20 saat boyunca kontrollü sıcaklığı 25 °C olan bir su banyosunda manyetik bir karıştırma çubuğu ile karıştırın.
- Karışımı 7:3 (v/v) dietil eter/asetona ekleyin. Çözücüyü çıkarmak için elde ettiği süspansiyonu 4 °C'de 25.000 x g'da santrifüj edin. Ardından, katıyı 7:3 (v/v) dietil eter/aseton ile iki kez yıkayın. Ardından, ürünü bir vakumun altında kurulayın (<0,2 atm).
- Dimetil sülfit içinde ürünün 100 mg/ mL'lik bir çözeltisini yapın. Elde eden ürün C6-peptid-pBAE olarak adlandırılır. Terminal akrilatlarla ilişkili olefin sinyallerinin kayboluşunu doğrulamak için elde edilen polimerin yapısını 1H-NMR üzerinden doğrulamak önemlidir. Kullanılmadığı takdirde polimer -20 °C'de dondurulabilir.
2. Poliplexes oluşumu
NOT: Tüm prosedürler sabit bir sıcaklığı korumak için şartlandırılmış bir odanın içinde yapılmalıdır.
- C6-peptid-pBAE polimerlerini çözün ve çözeltiyi girdap haline sokun.
- Pipet polimer yukarı ve aşağı karıştırın ve sodyum asetat (NaAc) içinde12,5mM (V 1) çözelti hazırlayın. Daha sonra karışımı girdaplayın ve 10 dakika bekleyin.
- mRNA'yı 0,5 mg/mL'de hazırlayın ve pipetleme (V2)ile karıştırın.
NOT: mRNA'nın girdaplamasını önlemek çok önemlidir. - DMSO'daki polimer stoğu ile asetat tamponu arasında homojen bir çözelti elde etmek için polimer karışımını son konsantrasyonda girdaplayın.
NOT: Son polimer konsantrasyonu seçilen N/P (azot ila fosfat grupları) oranına bağlıdır. Yok oranı kullanılacak her bir spesifik mRNA'ya bağlıdır. Örneğin, eGFP kapsülleme için, daha önce bildirildiği gibi 25:1 oranı kullanılmıştır14. - Genetik materyal çözeltisini ve C6-peptidepBAE çözeltisini (mRNA konsantrasyonunun 25x'i) 1:1 (Vi = V1 + V2)oranında karıştırın.
NOT: C6-peptid-pBAE, karıştırma için yukarı ve aşağı pipetleme ile mRNA'nın eklendiği bir mikrosantrifüj tüpüne yüklenir. Hazırlandıktan sonra, polikleks, nükleik asit ve C6-peptit-pBAE konsantrasyonları yarı seyreltilir. - 25 °C'de bir termokta 30 dakika kuluçkaya yatır. Numuneyi önceden yüklenmiş bir mikrosantrifüj tüpüne su ile ekleyerek 1:2 RNase içermeyen su ile çökelti.
- Excipients dahil. HEPES 20 mM'de mRNA ve pBAE (Vi)karışımı ile aynı hacmi ekleyin ve yukarı ve aşağı pipetleme ile sakkaroz% 4. Bu noktada, örnek 3 kat seyreltilmiştir.
3. Polyplexes lyophilization
- Anında, önceki poliplex çözeltisinin -80 °C dondurucusunda 1 saat dondurun.
- Adımları izleyerek birincil kurutmayı gerçekleştirin: (1) -60 °C'de 1 saat ve 0,001 hPa; (2) -40 °C'de 1 saat ve 0.0001 hPa; (3) -20 °C'de 4 saat ve 0.0001 hPa; (4) 5 °C'de 12 saat ve 0.0001 hPa.
- Kullanıma kadar yeniden sulanmasını önlemek için hemen -20 °C'de saklayın.
4. Polyplex resüspensyon
NOT: Bu protokol, liyofilize C6-peptid-pBAE nanopartiküllerini karakterizasyon, in vitro veya in vivo analiz için daha fazla kullanım için yeniden oluşturmak için kullanılan süreci açıklar.
- Kullanım anında -20 °C'den liyofilize nanopartikülleri alın ve istenen konsantrasyonu elde etmek için katıyı yeniden keşfetmek için karşılık gelen miktarda depirojen (DEPC) suyu hızla ekleyin.
NOT: Aynı konsantrasyon öngörülüyorsa, hacim nanopartiküllerin başlangıç hacmiyle aynı olacaktır, ancak her deney için belirtilecektir. - Pipet, sıvıya pipetle eşlik ederek, toplam resüspensyona kadar hafifçe.
NOT: Şişenin duvarında malzeme kalmadıklarından emin olun. - Çözüldükten sonra, pipet güçlü bir şekilde yukarı ve aşağı, kabarcıklardan kaçınarak.
NOT: Numune, daha yüksek konsantrasyonlarda daha belirgin olan şeffaf ve yarı saydam bir görünüme sahip olmalıdır - Numuneleri buzda veya 4 °C'de, yeniden inşa ettikten sonra maksimum 24 saat boyunca saklayın. Donmaktan kaçının.
5. Çok yönlü karakterizasyon
- Dinamik ışık saçılım
NOT: Hidrodinamik çap (nm), polidisperlik indeksi (PDI) ve nanopartiküllerin yüzey yükü Zeta potansiyel analizörü kullanılarak 25 °C, 633 nm lazer dalga boyu ve 173° sinyal dedektörü olarak ölçüldü (bkz. Malzeme Tablosu).- Hidrodinamik çap (nm)
- Gen malzemesini polimer fraksiyonuna daha önce açıklandığı gibi 0,25 mg/mL'lik son bir mRNA konsantrasyonuna pipetleterek mRNA ve pBAE'yi karıştıran nanopartikülleri iyice hazırlayın (adım 2).
- Bir mikroküveyi, safsızlıklardan tamamen temizlemek için filtrelenmiş seyreltme ortamıyla önceden durulayın. Ardından, cuvette'i numune çözeltisinin en az 50 μL'si ile doldurun ve kapayın. Ardından, örneği DLS cihazına tanıyın, hücrenin doğru yerleştirildiğinden emin olun.
NOT: Seyreltme ortamı 0,22 μm şırındıcı filtre kullanılarak filtrelenmiştir. - Oluşturulan Standart İşlem Yordamı (SÇP) dosyasını açın ve istediğiniz Örnek Adıtanıtın. Boyut Ölçümü 'nseçin.
NOT: Boyut ölçümleri için SÇP oluşturmak için tüm parametreler Tablo 1'de verilmiştir. - Oynat 'a tıklayarak DLS kullanarak parçacık boyutu ölçümünü çalıştırın.
NOT: Üçlü bip sesinden sonra analiz tamamlanır. - Ortalama parçacık boyutunu, ortalama PDI'yı, standart sapmayı ve grafikleri elde etmek için ölçüm sayfasındaki örneğe karşılık gelen sonuçları seçin. Tamamlandığında, hücreyi DLS ekipmanından çıkarın.
- Numuneyi çıkarın, zeta potansiyeli analizi için saklayın ve hücreyi deiyonize suyla temizleyin ve durulayın. Son olarak, temizlenen cuvette'i basınçlı bir hava gazı akımının altında kurutun.
- Yüzey yükü (mV)
- Gen malzemesini polimer fraksiyonuna daha önce açıklandığı gibi 0,25 mg/mL'lik son bir mRNA konsantrasyonuna pipetleterek mRNA ve pBAE'yi karıştıran nanopartikülleri iyice hazırlayın (adım 2, Polyplex oluşumu). Ardından, çözeltiyi dondurun ve kurutun.
NOT: Bu durumda, yüzey yükünün ölçümü için, numuneyi uygun tamponda yeniden analiz etmek için önlemleri almadan önce, pH ve elektrolit konsantrasyonunun vücut koşullarını simüle ederek numunenin dondurularak kurutılması şiddetle tavsiye edilir. - Su kullanarak liyofilize numuneyi yeniden sürtün. Numuneyi suda 1/10 seyreltin (son konsantrasyon 0.025 mg/mL).
- Tek kullanımlık katlanmış kılcal hücreyi (zeta potansiyel cuvette) safsızlıklardan tamamen temizlemek için filtrelenmiş seyreltme ortamı ile önceden durulayın. Daha sonra, cuvette'i 1 mL şırıngam kullanarak seyreltilmiş nanopartiküllerle doldurun ve dolgu maddelerinin her iki tarafını da kaplayın.
NOT: Nanopartikül dağılımı, cuvette (~1 mL) bulunan hacmi doldurmalı ve kabarcık oluşumuna özel dikkat gösterir, bu da önlemleri bozabilir. - Örneği DLS içinde tanıtın; hücrenin doğru yerleştirildiğinden emin olun.
- Zeta potansiyel analizi için oluşturulan SÇP dosyasını açın ve istediğiniz Örnek Adıtanıtın. Zeta-Potansiyel Ölçümü 'nseçin.
NOT: Zeta potansiyel ölçümleri için SÇP oluşturma parametreleri Tablo 2'de verilmiştir. - Oynat 'a tıklayarak DLS kullanarak zeta potansiyeline sahip ölçümü çalıştırın.
NOT: Üçlü bip sesinden sonra analiz tamamlanır. - Ortalama zeta potansiyeli, standart sapma ve grafikleri elde etmek için ölçüm sayfasındaki örneğe karşılık gelen sonuçları seçin. Tamamlandığında, hücreyi DLS ekipmanından çıkarın.
- Örneği çıkarın ve gerekirse saklayın. Daha sonra, cuvette hücresini deiyonize suyla temizleyin ve durulayın, ardından tekrar etanol ve su. Son olarak, temizlenen cuvette'i basınçlı bir hava gazı akımının altında kurutun.
NOT: Verileri analiz etmek için önerilen yazılımı kullanın.
- Gen malzemesini polimer fraksiyonuna daha önce açıklandığı gibi 0,25 mg/mL'lik son bir mRNA konsantrasyonuna pipetleterek mRNA ve pBAE'yi karıştıran nanopartikülleri iyice hazırlayın (adım 2, Polyplex oluşumu). Ardından, çözeltiyi dondurun ve kurutun.
- Hidrodinamik çap (nm)
- Nanopartikül Takip Analizi (NTA)
NOT: Hidrodinamik çap (nm) ve nanopartikül konsantrasyonu Nanopartikül Takip Analizörü kullanılarak 25 °C, 488 nm lazer dalga boyunda ölçüldü (bkz. Malzeme Masası).- NTA ve numune hazırlama
- Bilgisayarı ve ekipmanı aç. İlk olarak, tüm bileşenlerin doğru takılı olup olmadığını kontrol edin. Ardından, önerilen yazılımı açın. Yazılım, tüm aksesuarların doğru bağlanıp bağlanmadığını kontrol edecektir.
- Üst plakayı, burada, O-ring hücresini lazer modülüne bağlayın.
NOT: Bu bölümü fazla ab fazla sökmeyin. - İlk önce odayı tampon ve/veya deiyonize su ile 1 mL şırıngara ile yükleyin. İşlemi en az iki kez tekrarlayın. Hazneye kabarcıklar sokmaktan kaçının.
- DLS boyut ölçümünde kullanılan konsantrasyondan deiyonize suda 1/1000 seyrelterek numuneyi hazırlayın. En az 1 mL hazırlayın ve kabarcıkların tanıtılmasını önleyerek 1 mL şırındıya yükleyin.
- Örnekleri bir şırınna kullanarak hazneye yükleyin. Ardından, lazer modülini NTA büyük odasına takın.
NOT: Büyük oda, ölçüm için odanın yerleştiği alanı gösterir.
- Görüntü optimizasyonu
- İlk olarak, Donanım'da Kameranın ve uygun lazerin seçili olup olmadığını kontrol edin.
NOT: Burada sadece bir kamera ve Blue Laser 488 nm vardır. - Kamera düzeyi 0 ile başlayın ve Yakalama penceresinde Kamerayı Başlat'a basın.
NOT: Bu noktada, aşağıdaki parametreleri ayarlayın. Işın konumu (ekranda yukarı ve aşağı hareket ettirilebilir). Kamera Seviyesi: aşırı doymamış piksellerden kaçının. Odak (yanal tekerlek): mümkün olduğunca iyi odaklanmaya çalışın. Odaklanmamış parçacıklar yerine haleli parçacıklara sahip olmak daha iyidir. Konsantrasyon: Konsantrasyonu alan başına 10 ila 100 parçacık olacak şekilde ayarlayın.
- İlk olarak, Donanım'da Kameranın ve uygun lazerin seçili olup olmadığını kontrol edin.
- Video kaydı
- Yazılımda, Ölçüm Seçimi- SÇP penceresine gidin (soldan aşağı) ve Standart Ölçüm'ü seçin.
NOT: Her biri 30 sn'lik üç ölçüm gerçekleştirme programı (yazılımın ortalama ve standart sapma hesaplamaları yapmasını sağlamak için). Örneğin kayıtlarını kaydetmek için bir ad ve klasör yolu (Temel dosya adında) sağlayın. SÇP parametreleri doğru ayarlandığında, Komut DosyasıOluştur ve Çalıştır 'a basın. İlk yineleme ölçüldükten sonra, program yeni bir örnek eklemesini ister. Daha sonra, şırınd pistonu itilerek numunenin başka bir kısmı hazneye sokulmalıdır. Son olarak, üçüncü yinelemeyi çözümlemek için üçüncü kez yineleyin.
- Yazılımda, Ölçüm Seçimi- SÇP penceresine gidin (soldan aşağı) ve Standart Ölçüm'ü seçin.
- Video işleme
- Ölçülen parçacıkları analiz etmek için üç ölçü tamamlandıktan sonra Ekran Kazanç ve Algılama Eşiğini yeniden doğrulayın. Şu anda, analizi yapmak için her karede yaklaşık 100 parçacık görünmelidir (yüksek kırmızı haçlar ve düşük mavi haçlar beklenmektedir).
- Analiz tamamlandıktan sonra sonuçları pdf dosyasına dışa aktar. Buna ek olarak, video ve excel dosyaları olarak dışa aktarma mümkündür.
- NTA'nın temizlenmesi
NOT: Aşağıdaki örneği incelemeden önce açılan tüm ölçümleri kapatın; oluşturulan dosyalar muazzam olduğundan ve bilgisayara bağlı olarak, birden fazla açık tutmak kolay değildir.- Hiçbir parçacık gözlenene kadar sonraki ölçümü yapmadan önce suyu tekrar tekrar yıkayarak NTA haznesini temizleyin; daha sonra, ölçülere devam etmek için kullanılan arabelleği (PBS) yıkayın.
- Odanın içindeki havayı yıkayın ve günün son ölçümü tamamlandıktan sonra mikroskobik sınıf kağıtla kurulayın.
- İletim Elektronik Mikroskopisi (TEM) ile boyut ve şekli karakterize eder. Örnekleri hazırlayın. TEM karakterizasyonu için son hacmin 30 μL'si yeterlidir.
NOT: Hem taze hem de liyofilize - resüspensyondan sonra- nanopartiküller ölçülebilir. - Karbon kaplı bakır ızgaraya 10 μL numune bırakın. 10 dakika kurumasına izin verin. Gerekirse filtre kağıdına yumuşakça dokunarak fazla sıvıyı çıkarın.
- Negatif boyama için 10 μL uranil asetat (%2 w/v) çözeltisini bırakın. 1 dakika kurumasına izin verin. Gerekirse filtre kağıdına yumuşakça dokunarak sıvı fazlalığını çıkarın.
- Numuneyi mikroskop ve taramaya sokun (voltaj işlemi 80 kV).
NOT: Görüntülerin daha fazla analizi için uygun yazılım kullanılabilir.
- NTA ve numune hazırlama
- Kapsülleme verimliliği
- Numune hazırlama
- Nanopartikülleri istediğiniz konsantrasyonda hazırlayın ve dondurup kurulayın. Daha sonra, nanopartikülleri yeniden haline getirin ve 6 μg / mL'lik son konsantrasyonda seyreltin.
- 20x stok çözümünden 1x TE tampon hazırlayın.
NOT: Vt (Toplam hacim) = (numune sayısı x 100 μL x 4) (numune sayısı x 290 μL) + 2 mL. - 100 μg/μL stoktan 3 μg/μL Heparin ile TE tamponu hazırlayın.
NOT: Vt = Numune sayısı x 50 μL x 2. - Standartları hazırlayın
- 1x Tris-EDTA (TE) tamponunda(Tablo S1A)0,2 μg/mL ile 0,025 μg/mL arasında değişen bir RNA standardı hazırlayın.
NOT: Ribozomal RNA'dan farklı olması durumunda RNA standardında mRNA kullanın. - Heparin (Tablo S1B) ile RNA:pBAE standardı hazırlayın. Heparin standardını hazırlayın (Tablo S1C).
- Aşağıdaki gibi 96 kuyulu bir tabak hazırlayın.
- 96 kuyu plakasının ilk şeridinde 295 μL TE tamponu yükleyin (analiz etmek için numuneler kadar). Ardından, 50 μL 1x TE arabelleği B ve C şeritlerine yükleyin (her örnek için yinelenenler).
- 3 μg/μL Heparin ile 50 μL 1x TBE tamponu D ve E şeritlerine yükleyin (her numune için kopyalar). Ardından, her standardın 100 μL'lerini F, G ve H şeritlerine yükleyin (her standart için yinelenenler).
- A şeridindeki her numunenin 5 μL'liğini yükleyin (her kuyudaki konsantrasyon 0,1 μg/mL'dir). Pipetleme ile düzgün bir şekilde karıştırın ve aşağıdaki dört kuyuya her numuneden 50 μL yükleyin (ikisi 50 μL tampon 1x TE ve ikisi 3 μg / μL Heparin ile 1x TE tampon içeren).
- Numuneyi 37 °C'de 30 dakika kuluçkaya yatırın. RiboGreen reaktifini üretici protokolüne göre hazırlayın(bkz. Malzeme Tablosu) 1x TE arabelleği içinde.
NOT: 1:200 ve girdabı seyreltin. Işıktan kork. Vt = Tam kuyu sayısı x 100 μL. - Her kuyuya 100 μL RiboGreen çözeltisi yükleyin. 500 nm'lik bir ekscitasyon dalga boyu ve 525 nm emisyon dalga boyu ile mikro plaka okuyucuyu kullanarak floresan tespit edin.
- Sonuç analizi
- Üç kalibrasyon eğrisini hazırlayın
NOT: İlk olarak Ribozomal RNA standardı. Heparin içermeyen numuneleri bu kalibrasyon eğrisinde enterpolasyon yapın. İkincisi, Heparin ile mRNA:pBAE. Heparin'e sahip örneği bu kalibrasyon eğrisinde enterpolasyona haline. Üçüncüsü, Heparin. Çalışma konsantrasyonu doğrusal aralıkta olduğundan emin olmak için kullanılır. - Kapsülleme verimliliğini (EE%) aşağıdaki gibi hesaplayın:
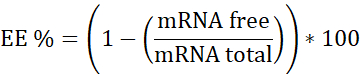
- Üç kalibrasyon eğrisini hazırlayın
- Numune hazırlama
6. In vitro karakterizasyon
- Nitel değerlendirme için floresan mikroskopi
- 96 kuyu plakasını 24 saat transfeksiyondan sonra mikroskopa yerleştirin. Hücreleri 10x hedefiyle görselleştirmeye başlayın.
NOT: Bu durumda HeLa hücreleri kullanılır. Hücreler iletim modu (parlak alan) kullanılarak yerelleştirilir ve odak şu anda ayarlanmalıdır.- İlk olarak, örneklerin arka planı hakkında yazılıma başvurmak için beyaz bir denge uygulayın. Ardından, analiz sırasında floresan görüntü ile kaplamak için bir görüntü elde edin.
- Mikroskop modunu yansıma moduna (floresan) değiştirin ve eGFP'yi görselleştirmek için filtre tekerleğini mavi lazere (488 nm) taşıyın.
NOT: Bu noktada Pozlama süresi ve Kazanç ayarlanmalıdır. Arka plan sinyalinde yapıtları ve fazlalığı önlemek için kazanç 3 ile 5 arasındaki değerlerde ayarlanmalıdır. Pozlama süresinin ayarlanması transeksiyon verimliliğine bağlıdır (ms'den 1 s'ye kadar). - Tüm örnekleri karşılaştırmak için aynı pozlama süresini kullanan tüm koşullar veya kuyular için görüntüler elde edin.
- 96 kuyu plakasını 24 saat transfeksiyondan sonra mikroskopa yerleştirin. Hücreleri 10x hedefiyle görselleştirmeye başlayın.
- Nicel değerlendirme için akış sitometrisi (FC)
- Akış sitometrisi deneyi için 96 kuyu plakasını hazırlamak için çok kanallı bir pipet kullanın.
NOT: JAWSII hücre hattında olduğu gibi yarı yapışan hücrelerle çalışırken, tüm ortam hacmini kurtarın ve başka bir 96 kuyu plakasında saklayın. Önemli sayıda transfected hücre içerebileceğinden, bu medyaya özenmeyin. - Hücreleri (HeLa hücreleri burada kullanılır) 100 μL / kuyu 1x PBS ile temizleyin ve arzu edin. Ardından, 25 μL / iyi trypsin ekleyin ve 5 dakika boyunca 37 ° C'de kuluçkaya yatırın.
- Hücreler ayrıldıktan sonra, trypsin eylemini durdurmak ve hücreleri düzeltmek için daha önce kurtarılmış ortam ekleyin ve hücreleri sabitleyin, 20 dakika boyunca% 10 formalin 31.25 μL / kuyu ekleyin (son konsantrasyon% 2.5).
NOT: Bu noktada, hücrelerin dekarakmasını sağlamak için hücrelerin durumunu mikroskopi ile görselleştirmek çok önemlidir. Hücrelerin kopmasına ve aglomerasyonlarından kaçınmasına yardımcı olmak için birkaç kez pipet yukarı ve aşağı borulanması şiddetle tavsiye edilir. Bu güvenilir bir sonuç üretecektir. - Akış sayometresini ve yazılımı açın. Yazılımda, deneme için uygun koşulları ayarlayın (plaka türü, numune hacmi ve numuneler arasında titreme, durulama gibi diğer parametreler).
NOT: 6.2.5 adımı için akış hızı 120 μL/dk olmalıdır. Her 1 dakikada bir döngüyü karıştırın ve her birini iyice durulayın. Karıştırma, ortamda dağılmış hücreleri korumak ve bireysel hücrelerin daha iyi analizini sağlamak için gereklidir. Ek olarak, numuneler arasında sitometrenin mikroakışkanlarını temizlemek için durulama gereklidir. Son olarak, yeterli arabellek olup olmadığını ve tüm bileşenlerin doğru bağlanıp bağlanmadığını denetleyin. - Pozitif transfected hücrelerin yüzdesini ölçmek için uygun parametreleri ayarlayın.
- İlk olarak, hücreleri enkazdan ayırmak için akış verilerini (İleri dağınık ışık) FSC ile SCC (Yan dağınık ışık) saçılma grafiğinde görüntüleyin. Daha sonra, genliği (FSC-A) yüksekliğe (FSC-H) karşılaştıran başka bir dağılım grafiği, tek tek hücrelerin kaplayıp ayırt etmesi için çizilir.
NOT: Tedavi edilmeyen popülasyon, pozitif transfected hücrelere karşılık gelen popülasyonları geçitlemeyi sağlar. Daha sonra, pozitif transkuna olmuş hücrelerin nicelemesi bir histogram grafiğinde uygun kanalda gerçekleştirilir. Bu nedenle, pozitif transfected hücreler histogramdaki olayların sürekliliği olarak temsil edilmelidir.
- İlk olarak, hücreleri enkazdan ayırmak için akış verilerini (İleri dağınık ışık) FSC ile SCC (Yan dağınık ışık) saçılma grafiğinde görüntüleyin. Daha sonra, genliği (FSC-A) yüksekliğe (FSC-H) karşılaştıran başka bir dağılım grafiği, tek tek hücrelerin kaplayıp ayırt etmesi için çizilir.
- Akış sitometrisi deneyi için 96 kuyu plakasını hazırlamak için çok kanallı bir pipet kullanın.
7. In vitro işlevsellik testleri: ovalbumin (OVA) antijenik model mRNA olarak kullanarak model bağışıklık hücrelerini aktive etme kapasitesi
- Plaka 10.000 hücre/kuyu (JAWSII hücreleri burada kullanılır) transfection'dan bir gün önce 96 kuyulu bir plakada.
NOT: Her durum için üç taraflı olması için gerektiği kadar kuyu plakalayın. Hücrelerin plakaya en az 12 saat boyunca bağlanmasına izin verin (bir gecelik inkübasyon önerilir). - Kuyu başına 0,6 μg mRNA'yı transfect etmek için aşağıdaki NOT'ta açıklandığı gibi pBAEs NP'leri hazırlayın.
NOT: Pozitif bir kontrol olarak, transfeksiyon reaktifi kullanarak hücreleri transfectect. Burada kuyu başına 0,1 μg mRNA ve kuyu başına 0,25 μL transfeksiyon reaktifi kullandık. OVA için mRNA kodlayıcı satın alındı (bkz. Malzeme Tablosu). Poliadenillenmiş, 5-metoksiyuridin ile modifiye edilmiş ve memeli sistemleri için optimize edilmiştir ve tedarikçiden tescilli bir yöntem olan Cap1 yapısı ile bir uç kapaklama ile korunmaktadır. - 96 kuyu plakasını 37 °C ve %5 CO 2'de kuru hava inkübatöründe24saat boyunca kuluçkaya yatırın.
NOT: Bu süreden sonra, belirli sayıda hücre içerebileceğinden medyayı arzu etmeyin. Hücreleri kurtarın ve başka bir kuyuya veya tabağa kaydedin. - Kuyuda kalan hücreleri 25 μL 1x PBS ile yıkayın. Daha sonra, onu arzu edin ve 25 μL tripsin ekleyin ve hücreleri ayırmak için plakayı 37 ° C'de 5 dakika kuluçkaya yatırın. Daha önce kurtarılan medyayı muhabire iyi ekleyerek trypsin reaksiyonunu durdurun.
- Plakayı 4 °C'de 5 dakika boyunca 400 x g'da santrifüj edin. Medyaya talip olmak. 1x PBS'nin 50 μL/kuyu ve formalin%2,5'ini ekleyin. Hücreleri sabitlemek için 20 dakika boyunca 4 °C'de kuluçkaya yatır.
- 7.5 ve 7.5.1 adımlarını yineleyin. Ardından, 1x PBS ve% 3 BSA (Engelleme tamponu) için 50 μL / kuyu ekleyin ve 4 ° C'de 30 dakika kuluçkaya yatırın. Yine, 7.5 ve 7.5.1 adımlarını tekrarlayın ve ardından 1x PBS ve% 3 BSA'da birincil antikorun (fare α-OVA) 50 μL / kuyu ekleyin ve 4 ° C'de 30 dakika kuluçkaya yatırın.
- 7.5 ve 7.5.1 adımlarını tekrarlayın ve ardından hücreleri 50 μL/ kuyu 1x PBS ile yıkayın. Medyayı arzu edin ve ardından 1x PBS ve% 3 BSA'da ikincil antikor çözeltisi (α-mouse-AlexaFluor488/PerCP ve Cy5.5-CD11b/APC-CD86) ekleyin. 4 °C'de 1 saat kuluçkaya yatırın.
- Plakayı 5 dakika boyunca 400 x g'da santrifüj edin. Ardından, hücreleri 1x PBS'nin 50 μL / kuyusu ile yıkayın. Daha sonra, santrifüj (5 dakika için 400 x g), aspire ve daha sonra hücreleri 1x PBS ve% 2.5 Formalin'in 100 μL / kuyusunda yeniden biriktirin.
- Yukarıda açıklandığı gibi akış sitometrisine göre analiz edin (adım 6.2).
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Polimer sentezi ve karakterizasyonu
OM-pBAE sentez prosedürü Şekil 2'de verilmiştir. Şekil 2A'nın gösterdiği gibi, OM-pBAE'yi elde olmanın ilk adımı, aminleri (1-heksillamin ve 5-amino-1-pentanol, oran 1:1) aksanlara (1,4-butanediol diakrilit) ekleyerek C6-pBAE'yi sentezlemektir. Bu reaksiyon 90 ° C'de 20 saat boyunca ve sürekli karıştırma ile gerçekleştirilir. Daha sonra, önceki reaksiyondan elde edilen bir C6 polimer çö...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Geçen yıl Covid-19 salgınının patlak verinin ardından aşıların bulaşıcı hastalık kontrolü açısından önemi kritik bir bileşen olarak kendini göstermiştir8. Dünya çapındaki bilim adamlarının çabaları, birçok aşının piyasaya sürülmesini sağladı. Tarihte ilk kez, mRNA aşıları, bazı aylar içinde herhangi bir yeni antijene uyum sağlama kapasiteleri nedeniyle hızlı tasarımları sayesinde daha önce hipotezlenmiş başarılarını göstermiştir
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi veya çıkar çatışması yoktur.
Teşekkürler
MINECO/FEDER'in (SAF2015-64927-C2-2-R, RTI2018-094734-B-C22 ve COV20/01100 hibeleri) finansal desteği kabul edilmektedir. CGF, IQS Doktora Bursunu kabul etti.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1,4-butanediol diacrylate | Sigma Aldrich | 123048 | |
| 1-hexylamine | Sigma Aldrich | 219703 | |
| 5-amino-1-pentanol | Sigma Aldrich | 411744 | |
| Acetone | Panreac | 141007 | |
| CD11b antibody | BD | 550993 | |
| CD86 antibody | Bioligend | 105007 | |
| Chlor hydroxhyde | Panreac | 181023 | |
| Chloroform-d | Sigma Aldrich | 151823 | |
| Cys-His-His-His peptide | Ontores | Custom | |
| Cys-Lys-Lys-Lys peptide | Ontores | Custom | |
| D2O | Sigma Aldrich | 151882 | |
| DEPC reagent for Rnase free water | Sigma Aldrich | D5758 | This reagent is important to treat MilliQ water to remove any RNases of the buffers |
| Diethyl eter | Panreac | 212770 | |
| dimethyl sulfoxide | Sigma Aldrich | 276855 | |
| HEPES | Sigma Aldrich | H3375 | |
| mRNA EGFP | TriLink Technologies | L-7601 | |
| mRNA OVA | TriLink Technologies | L-7610 | |
| RiboGreen kit | ThermoFisher | R11490 | |
| sodium acetate | Sigma Aldrich | 71196 | |
| sucrose | Sigma Aldrich | S0389 | |
| Trifluoroacetic acid | Sigma Aldrich | 302031 | |
| Trypsin-EDTA | Fisher Scientific | 11570626 | |
| α-mouse AlexaFluor488 antibody | Abcam | Ab450105 | |
| Equipment | |||
| Nanoparticle Tracking Analyzer | Malvern Panalytical | NanoSight NS300 | |
| Nuclear Magnetic Ressonance Spectrometer | Varian | 400 MHz | |
| ZetaSizer | Malvern Panalytical | Nano ZS | For zeta potential and hydrodynamic size determination |
| Software | |||
| NanoSight NTA software | Malvern Panalytical | MAN0515-02-EN-00 | |
| NovoExpress Software | Agilent | Not specified | |
| ZetaSizer software | Malvern Panalytical | DTS Application | To analyze surface charge and hydrodynamic sizes |
Referanslar
- Chumakov, K., Benn, C. S., Aaby, P., Kottilil, S., Gallo, R. Can existing live vaccines prevent COVID-19. Science. 368 (6496), 1187-1188 (2020).
- Zhang, C., Maruggi, G., Shan, H., Li, J. Advances in mRNA vaccines for infectious diseases. Frontiers in Immunology. 10, 1-13 (2019).
- Wherry, E. J., Jaffee, E. M., Warren, N., D'Souza, G., Ribas, A. How did we get a COVID-19 vaccine in less than 1 year. Clinical Cancer Research. 27 (8), 2136-2138 (2021).
- Folegatti, P. M., et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. The Lancet. 396 (10249), 467-478 (2020).
- Geall, A. J., Mandl, C. W., Ulmer, J. B. RNA: The new revolution in nucleic acid vaccines. Seminars in Immunology. 25 (2), 152-159 (2013).
- Ulmer, J. B., Geall, A. J. Recent innovations in mRNA vaccines. Current Opinion in Immunology. 41, 18-22 (2016).
- Kranz, L. M., et al. Systemic RNA delivery to dendritic cells exploits antiviral defence for cancer immunotherapy. Nature. 534 (7607), 396-401 (2016).
- Milane, L., Amiji, M. Clinical approval of nanotechnology-based SARS-CoV-2 mRNA vaccines: impact on translational nanomedicine. Drug Delivery and Translational Research. 1 (4), 3(2020).
- Green, J. J., Langer, R., Anderson, D. G. A combinatorial polymer library approach yields insight into nonviral gene delivery. Accounts of Chemical Research. 41 (6), 749-759 (2008).
- Guerrero-Cázares, H., et al. Biodegradable polymeric nanoparticles show high efficacy and specificity at DNA delivery to human glioblastoma in vitro and in vivo. ACS Nano. 8 (5), 5141-5153 (2014).
- Kozielski, K. L., Tzeng, S. Y., Hurtado De Mendoza, B. A., Green, J. J. Bioreducible cationic polymer-based nanoparticles for efficient and environmentally triggered cytoplasmic siRNA delivery to primary human brain cancer cells. ACS Nano. 8 (4), 3232-3241 (2014).
- Segovia, N., Dosta, P., Cascante, A., Ramos, V., Borrós, S. Oligopeptide-terminated poly(β-amino ester)s for highly efficient gene delivery and intracellular localization. Acta Biomaterialia. 10 (5), 2147-2158 (2014).
- Dosta, P., Segovia, N., Cascante, A., Ramos, V., Borrós, S. Surface charge tunability as a powerful strategy to control electrostatic interaction for high efficiency silencing, using tailored oligopeptide- modified poly (beta-amino ester)s (PBAEs). Acta Biomaterialia. 20, 82-93 (2015).
- Fornaguera, C., et al. mRNA delivery system for targeting antigen-presenting cells in vivo. Advanced Healthcare Materials. 7 (17), 180033(2018).
- Fornaguera, C., Castells-Sala, C., Lázaro, M. Á, Cascante, A., Borrós, S. Development of an optimized freeze-drying protocol for OM-PBAE nucleic acid polyplexes. International Journal Pharmaceutics. 569, (2019).
- Fornaguera, C., Solans, C. Analytical methods to characterize and purify polymeric nanoparticles. International Journal of Polymer Science. , (2018).
- Fornaguera, C., Solans, C. Characterization of polymeric nanoparticle dispersions for biomedical applications: size, surface charge and stability. Pharmaceutical Nanotechnology. 6 (3), 147-164 (2018).
- Sahin, U., Karikó, K., Türeci, Ö MRNA-based therapeutics-developing a new class of drugs. Nature Reviews Drug Discovery. 13 (10), 759-780 (2014).
- Fan, Y. N., et al. Cationic lipid-assisted nanoparticles for delivery of mRNA cancer vaccine. Biomaterials Science. 6 (11), 3009-3018 (2018).
- Le Moignic, A., et al. Preclinical evaluation of mRNA trimannosylated lipopolyplexes as therapeutic cancer vaccines targeting dendritic cells. Journal of Controlled Release. 278, 110-121 (2018).
- Banerji, A., et al. mRNA vaccines to prevent COVID-19 disease and reported allergic reactions: Current evidence and approach. Journal of Allergy and Clinical Immunology: In Practice. 9 (4), 1423-1437 (2021).
- Kaczmarek, J. C., Kowalski, P. S., Anderson, D. G. Advances in the delivery of RNA therapeutics: from concept to clinical reality. Genome Medicine. 9 (1), 1-16 (2017).
- Dosta, P., et al. Delivery of anti-microRNA-712 to inflamed endothelial cells using poly(β-amino ester) nanoparticles conjugated with VCAM-1 targeting peptide. Advanced Healthcare Materials. , 1-11 (2021).
- Segovia, N., et al. Hydrogel doped with nanoparticles for local sustained release of siRNA in breast cancer. Advanced Healthcare Materials. 4 (2), 271-280 (2015).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır