Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Синтез и характеристика наночастиц поли(бета-аминоэфиров), нагруженных мРНК, для целей вакцинации
В этой статье
Резюме
Здесь представлен простой протокол получения наночастиц мРНК на основе поли(бета-аминоэфирных) полимеров, который легко адаптировать путем изменения инкапсулированной мРНК. Также описан рабочий процесс синтеза полимеров, наночастиц и их сущностной характеристики in vitro. Также добавляется доказательство концепции иммунизации.
Аннотация
Вакцинация является одним из главных успехов современного общества и необходима для борьбы с болезнями и их профилактики. Традиционные вакцины состояли из целых или фракций инфекционного агента. Тем не менее, проблемы остаются, и новые вакцинные технологии являются обязательными. В этом контексте использование мРНК для целей иммунизации показало повышенную эффективность, о чем свидетельствует быстрое одобрение двух мРНК-вакцин, предотвращающих инфекцию SARS-CoV-2. Помимо успеха в предотвращении вирусных инфекций, мРНК-вакцины также могут использоваться для терапевтического применения рака.
Тем не менее, нестабильность мРНК и ее быстрое выведение из организма из-за наличия нуклеаз делает ее голую доставку невозможной. В этом контексте нанолекарства и, в частности, полимерные наночастицы являются критическими системами доставки мРНК. Таким образом, целью данной статьи является описание протокола составления и испытания мРНК-вакцины-кандидата на основе запатентованных полимерных наночастиц. Синтез и химическая характеристика используемых поли(бета-аминоэфиров) полимеров, их комплексообразование с мРНК с образованием наночастиц и методология их лиофилизации будут обсуждаться здесь. Это важный шаг для снижения затрат на хранение и дистрибуцию. Наконец, будут указаны необходимые тесты для демонстрации их способности к трансфекции in vitro и зрелой модели дендритных клеток. Этот протокол принесет пользу научному сообществу, работающему над вакцинацией, из-за его высокой универсальности, которая позволяет этим вакцинам предотвращать или лечить широкий спектр заболеваний.
Введение
Инфекционные заболевания представляют собой серьезную угрозу для миллионов людей во всем мире и по-прежнему являются одной из ведущих причин смерти в некоторых развивающихся странах. Профилактическая вакцинация является одним из наиболее эффективных вмешательств современного общества по профилактике и борьбе с инфекционными заболеваниями1,2. Эти критические вехи науки в актуальности20-говека были отмечены недавней всемирной пандемией Covid-19, вызванной вирусом SARS-CoV-23. Признавая важность наличия эффективных вакцин для сдерживания распространения болезни, совместные усилия всех биомедицинских сообществ успешно привели к появлению на рынке многих профилактических вакцин менее чем за4года.
Традиционно вакцины состояли из ослабленных (живых, пониженной вирулентности) или инактивированных (частиц смерти) вирусов. Однако для некоторых заболеваний, не имеющих запаса для ошибок безопасности, вирусные частицы невозможны, и вместо них используются белковые субъединицы. Тем не менее, субъединицы обычно не позволяют комбинировать более одного эпитопа/антигена, а адъюванты необходимы для повышения эффективности вакцинации5,6. Поэтому потребность в новых типах вакцин очевидна.
Как было продемонстрировано во время нынешней пандемии, новые вакцины-кандидаты на основе нуклеиновых кислот могут быть выгодными с точки зрения избежания длительных процессов разработки и обеспечения высокой универсальности при одновременном проведении жизненно важной иммунизации пациента. Это относится к мРНК-вакцинам, которые изначально были разработаны как экспериментальные противораковые вакцины. Благодаря их естественной способности вырабатывать антиген-специфические Т-клеточные ответы3,5,6,7. Будучи мРНК молекулой, которая кодирует антигенный белок, только изменяя один и тот же, вакцина может быть быстро адаптирована для иммунизации других вариантов того же микроорганизма, различных штаммов, других инфекционных микроорганизмов или даже стать иммунотерапевтическим средством лечения рака. Кроме того, они выгодны с точки зрения масштабных производственных затрат. Однако мРНК имеет значительное препятствие, которое препятствует их голому введению: ее стабильность и целостность скомпрометированы в физиологических средах, полных нуклеаз. По этой причине требуется использование нанометрического носителя, который защищает его и векторизует мРНК к антигенпрезентирующим клеткам2,8.
В этом контексте поли(бета-аминоэфиры) (pBAE) представляют собой класс биосовместимых и биоразлагаемых полимеров, которые продемонстрировали замечательную способность к комплексу мРНК в нанометрических частицах, благодаря их катионным зарядам9,10,11. Эти полимеры состоят из эфирных связей, что облегчает их деградацию эстеразами в физиологических условиях. Среди кандидатов в библиотеку pBAE те, кто функционализирован конечными катионными олигопептидами, показали более высокую способность образовывать небольшие наночастицы для эффективного проникновения в клетки через эндоцитоз и трансфекции инкапсулированного генного материала. Кроме того, благодаря их буферной способности, подкисление эндосомного отсека позволяет эндосомному выходу12,13. А именно, недавно был опубликован специфический вид pBAE, включая гидрофобные фрагменты на их позвоночнике (так называемый C6 pBAE) для повышения их стабильности и концево-олигопептидную комбинацию (60% полимера, модифицированного три-лизином и 40% полимера с три-гистидином), которая избирательно трансфектирует антигенпрезентирующие клетки после парентерального введения и производит презентацию антигена, кодированную мРНК, с последующей иммунизацией мышей14 . Кроме того, также было продемонстрировано, что эти составы могут обойти одно из основных узких мест наномедицинских составов: возможность сублимационной сушки их без потери их функциональности, что обеспечивает долгосрочную стабильность в мягких сухих средах15.
В этом контексте целью текущего протокола является предоставление процедуры формирования наночастиц мРНК научному сообществу путем описания критических шагов в протоколе и создания возможностей для производства эффективных вакцин для профилактики инфекционных заболеваний и лечения опухолей.
Следующий протокол описывает полную тренировку по синтезу олигопептидных концевых модифицированных поли(бета-аминоэфиров) - полимеров OM-pBAE, которые в дальнейшем будут использоваться для синтеза наночастиц. В протокол также включена формулировка наночастиц. Кроме того, предусмотрены критические шаги для успеха процедуры и репрезентативные результаты для обеспечения того, чтобы полученные составы выполняли требуемые характеристики контроля качества для определения положительного или отрицательного результата. Этот протокол обобщен на рисунке 1.
протокол
1. Синтез полимера pBAE с концевыми олигопептидами (OM-pBAE)
- Полимеризация C6-pBAE
- Добавьте 5-амино-1-пентанол (38 ммоль; MW = 103,16 Да) 1-гексиламин (38 ммоль; MW = 101,19 Да) в стеклянную колбу с круглым дном (100 мл). Затем добавляют 1,4-бутандиола диакрилат (82 ммоль; MW = 198,22 Да).
- Предварительно нагрейте силиконовую масляную ванну при 90 °C, поместите колбу с круглым дном в масляную ванну и перемешайте смесь с помощью магнитного перемешивателя в течение ночи (~18 ч). Затем возьмите продукт из колбы с круглым дном и поместите его в морозильную камеру при -20 °C.
ПРИМЕЧАНИЕ: Продукт имеет форму липкого порошка и вынимается из колбы с помощью шпателя. Важно проверить структуру полученного полимера с помощью 1Н-ЯМР. Спектры ЯМР регистрировались в приборе с частотой 400 МГц (см. Таблицу материалов)с использованием хлороформа-d иD2O в качестве растворителей. Около 10 мг каждого поли(β-аминоэфира) брали и растворяли в 1 мл дейтерированного растворителя.
- Реакция с пептидами с получением OM-pBAE
- Добавьте 25 мл 0,1 M HCl к выбранным пептидам, например, пептиду Cys-His-His-His с трифторуксусной кислотой (TFA, 200 мг), в ранее взвешенную 50 мл центрифужную трубку, которая может выдерживать сублимационную сушку и вручную перемешиваться в течение ночи для получения прозрачного раствора.
- Заморозить раствор при -80 °С в течение 1 ч и сублимировать полученный пептид гидрохлорид.
ПРИМЕЧАНИЕ: Проверьте, соответствует ли конечный вес теоретическому значению. - Делают раствор C6-pBAE (0,031 ммоль) в диметилсульфоксиде. Также делают раствор пептида гидрохлорида (0,078 ммоль) в диметилсульфоксиде.
- Смешайте два раствора в трубке с винтовой крышкой и прикрутите к колпачку. Перемешайте раствор смеси на водяной бане с контролируемой температурой 25 °C в течение 20 ч с помощью магнитного перемешивания.
- Добавьте смесь к 7:3 (v/v) диэтиловому эфиру/ацетону. Центрифугируют полученную суспензию при 25 000 х г при 4 °C для удаления растворителя. Затем дважды промыть твердое вещество диэтиловым эфиром/ацетоном 7:3 (v/v). Затем высушите продукт под вакуумом (<0,2 атм).
- Делают раствор из 100 мг/мл продукта в диметилсульфоксиде. Полученный продукт называется C6-пептид-pBAE. Необходимо проверить структуру полученного полимера через 1H-ЯМР для подтверждения исчезновения олефиновых сигналов, связанных с концевыми акрилатами. Если полимер не используется, его можно заморозить при -20 °C.
2. Образование полиплексов
ПРИМЕЧАНИЕ: Все процедуры должны выполняться внутри кондиционированного помещения для поддержания постоянной температуры.
- Разморозьте полимеры C6-пептид-pBAE и вращайте раствор.
- Пипетку полимера смешивают вверх и вниз и готовят раствором 12,5 мМ(V1)в ацетате натрия (NaAc). Затем вихрьте смесь и подождите 10 минут.
- Готовят мРНК в дозе 0,5 мг/мл и перемешивают путем пипетирования(V2).
ПРИМЕЧАНИЕ: Крайне важно избегать вихря мРНК. - Вихрь полимерной смеси в конечной концентрации для получения однородного раствора между полимерным материалом в ДМСО и ацетатным буфером.
ПРИМЕЧАНИЕ: Конечная концентрация полимера зависит от выбранного соотношения N/P (азот-фосфатные группы). Соотношение N/P зависит от каждой конкретной используемой мРНК. Например, для инкапсуляции eGFP использовалось соотношение 25:1, как сообщалосьранее 14. - Смешайте раствор генетического материала и раствор C6-peptidepBAE (25x от концентрации мРНК) в соотношении 1:1 (Vi = V1 + V2).
ПРИМЕЧАНИЕ: C6-пептид-pBAE загружается в микроцентрифужную трубку, где мРНК добавляется путем пипетирования вверх и вниз для смешивания. После приготовления полиплекс, нуклеиновая кислота и C6-пептид-pBAE концентрации наполовину разбавляются. - Инкубировать при 25 °C в течение 30 мин в термоблоке. Осаждайте водой без 1:2 РНКазы, добавляя образец в предварительно загруженную микроцентрифужную трубку с водой.
- Включите вспомогательные вещества. Добавьте тот же объем, что и смесь мРНК и pBAE (Vi)в HEPES 20 мМ и сахарозу 4% путем пипетирования вверх и вниз. На данный момент образец был разбавлен в 3 раза.
3. Полиплексная лиофилизация
- Мгновенно заморозьте при -80 °C морозильную камеру предыдущего полиплексного раствора в течение 1 ч.
- Выполняют первичную сушку, выполнив следующие этапы: (1) 1 ч при -60 °C и 0,001 гПа; (2) 1 ч при -40°C и 0,0001 гПа; (3) 4 ч при -20°C и 0,0001 гПа; (4) 12 ч при 5 °C и 0,0001 гПа.
- Хранить при температуре -20 °C немедленно, чтобы избежать регидратации до использования.
4. Полиплексная ресуспензия
ПРИМЕЧАНИЕ: Этот протокол описывает процесс, используемый для реконструкции лиофилизированных наночастиц C6-пептид-pBAE для их дальнейшего использования либо для характеристики, in vitro, либо in vivo анализа.
- Возьмите лиофилизированные наночастицы от -20 °C только в момент использования и быстро добавьте соответствующее количество депирогенированной (DEPC) воды для повторного окрашивания твердого вещества для достижения желаемой концентрации.
ПРИМЕЧАНИЕ: Объем будет таким же, как и исходный объем наночастиц, если предусмотрена такая же концентрация, но он будет указан для каждого эксперимента. - Пипетку осторожно до полного повторного суспендирования, сопровождая жидкость пипеткой.
ПРИМЕЧАНИЕ: Убедитесь, что на стенке флакона не осталось никакого материала. - После растворения пипетка энергично поднимается и опускается, избегая пузырьков.
ПРИМЕЧАНИЕ: Образец должен иметь прозрачный и полупрозрачный вид, который более очевиден при более высоких концентрациях. - Храните образцы на льду или при температуре 4 °C в течение максимум 24 ч после восстановления. Избегайте замерзания.
5. Полиплексная характеристика
- Динамическое рассеяние света
ПРИМЕЧАНИЕ: Гидродинамический диаметр (нм), индекс полидисперсности (PDI) и поверхностный заряд наночастиц измерялись при 25 °C, длине волны лазера 633 нм и детекторе сигнала 173° с использованием анализатора потенциала Zeta (см. Таблицу материалов).- Гидродинамический диаметр (нм)
- Тщательно подготовьте наночастицы, смешивающие мРНК и пБАЭ, путем пипетирования генного материала полимерной фракции до конечной концентрации мРНК 0,25 мг/мл, как описано выше (этап 2).
- Предварительно промыть микрокювету фильтрованной разбавляющей средой, чтобы полностью очистить ее от примесей. Затем заполните кювету по меньшей мере 50 мкл раствора образца и закройте его крышкой. Затем введите образец внутрь инструмента DLS, убедитесь, что ячейка вставлена правильно.
ПРИМЕЧАНИЕ: Разрежающая среда фильтруется с помощью шприцевого фильтра 0,22 мкм. - Откройте созданный файл стандартной процедуры работы (SOP) и введите требуемый образец имени. Выберите Измерение размера.
ПРИМЕЧАНИЕ: Все параметры для создания СОП для измерения размеров приведены в таблице 1. - Запустите измерение размера частиц с помощью DLS, нажав кнопку Play.
ПРИМЕЧАНИЕ: После тройного звукового сигнала анализ завершен. - Выберите результаты, соответствующие образцу на листе измерений, чтобы получить средний размер частиц, средний PDI, стандартное отклонение и графики. После этого извлеките ячейку из оборудования DLS.
- Извлеките образец, сохраните его для анализа дзета-потенциала, очистите и промойте клетку деионизированной водой. Наконец, высушите очищенную кювету под потоком газа сжатого воздуха.
- Поверхностный заряд (мВ)
- Подготовьте наночастицы, тщательно смешивающие мРНК и pBAE, путем пипетирования генного материала полимерной фракции до конечной концентрации мРНК 0,25 мг/мл, как описано выше (этап 2, Полиплексное образование). Далее заморозьте и высушите раствор.
ПРИМЕЧАНИЕ: В этом случае для измерения поверхностного заряда настоятельно рекомендуется сублимационная сушка образца перед выполнением мероприятий по повторному погружению образца в соответствующий буфер, имитирующий условия pH и концентрации электролита в организме. - Повторное суспендирование лиофилизированного образца с использованием воды. Разбавить образец на 1/10 в воде (конечная концентрация 0,025 мг/мл).
- Предварительно промыть одноразовую сложенную капиллярную клетку (дзета-потенциальную кювету) фильтрованной разбавляющей средой, чтобы полностью очистить ее от примесей. Затем заполните кювету разбавленными наночастицами, используя шприц объемом 1 мл, и закройте крышкой обе стороны наполнителей.
ПРИМЕЧАНИЕ: Дисперсия наночастиц должна заполнять объем, доступный в кювете (~ 1 мл), уделяя особое внимание образованию пузыря, что может возмущать измерения. - Представьте образец внутри DLS; убедитесь, что ячейка вставлена правильно.
- Откройте файл SOP, созданный для анализа дзета-потенциала, и введите нужное имя образца. Выберите Измерение зета-потенциала.
ПРИМЕЧАНИЕ: Параметры создания СОП для измерений дзета-потенциала приведены в таблице 2. - Запустите измерение дзета-потенциала с помощью DLS, нажав кнопку Play.
ПРИМЕЧАНИЕ: После тройного звукового сигнала анализ завершен. - Выберите результаты, соответствующие образцу на листе измерений, чтобы получить средний дзета-потенциал, стандартное отклонение и графики. После этого извлеките ячейку из оборудования DLS.
- Извлеките образец и сохраните его, если это необходимо. Затем очистите и промойте клетку кюветы деионизированной водой, а затем снова этанолом и водой. Наконец, высушите очищенную кювету под потоком газа сжатого воздуха.
ПРИМЕЧАНИЕ: Для анализа данных используйте рекомендуемое программное обеспечение.
- Подготовьте наночастицы, тщательно смешивающие мРНК и pBAE, путем пипетирования генного материала полимерной фракции до конечной концентрации мРНК 0,25 мг/мл, как описано выше (этап 2, Полиплексное образование). Далее заморозьте и высушите раствор.
- Гидродинамический диаметр (нм)
- Анализ отслеживания наночастиц (NTA)
ПРИМЕЧАНИЕ: Гидродинамический диаметр (нм) и концентрацию наночастиц измеряли при 25 °C, длине волны лазера 488 нм с помощью анализатора отслеживания наночастиц (см. Таблица материалов).- НТА и пробоподготовка
- Включите компьютер и оборудование. Во-первых, проверьте, правильно ли подключены все компоненты. Затем откройте рекомендуемое программное обеспечение. Программа проверит, правильно ли подключены все аксессуары.
- Подключите верхнюю пластину, здесь, ячейку уплотнительного кольца, к лазерному модулю.
ПРИМЕЧАНИЕ: Не переворачивайте эту часть. - Сначала загрузите камеру буферной и/или деионизированной водой шприцем объемом 1 мл. Повторите процедуру не менее двух раз. Избегайте введения пузырьков в камеру.
- Подготовьте образец, разбавив 1/1000 в деионизированной воде от концентрации, используемой при измерении размера DLS. Подготовьте не менее 1 мл и загрузите его в шприц объемом 1 мл, избегая введения пузырьков.
- Загрузите образцы в камеру с помощью шприца. Затем подключите лазерный модуль к большой камере NTA.
ПРИМЕЧАНИЕ: Большая камера обозначает пространство, в котором камера размещена для измерения.
- Оптимизация изображений
- Во-первых, в окне Оборудованиепроверьте, выбрана ли камера и соответствующий лазер.
ПРИМЕЧАНИЕ: Здесь есть только одна камера и Blue Laser 488 нм. - Начните с уровня камеры на 0 и нажмите Запустить камеру в окне Захват.
ПРИМЕЧАНИЕ: На этом этапе настройте следующие параметры. Положение луча (его можно перемещать вверх и вниз по экрану). Уровень камеры:избегайте перенасыщенных пикселей. Фокусировка (боковое колесо):постарайтесь сфокусироваться как можно лучше. Лучше иметь частицы с гало вместо несфокусированных частиц. Концентрация: Отрегулируйте концентрацию, чтобы иметь от 10 до 100 частиц на поле.
- Во-первых, в окне Оборудованиепроверьте, выбрана ли камера и соответствующий лазер.
- Видеозаписи
- В программном обеспечении перейдите в окно Выбор измерения- SOP (внизу слева) и выберите Стандартное измерение.
ПРИМЕЧАНИЕ: Программа для выполнения трех измерений по 30 с каждая (для того, чтобы программное обеспечение могло выполнять расчеты среднего и стандартного отклонения). Укажите имя и путь к папке (в base filename) для сохранения записей примера. Когда параметры SOP настроены правильно, нажмите кнопку Создать и запустить сценарий. После измерения первой реплики программа попросит добавить новый образец. Затем еще одна часть образца должна быть введена в камеру, толкая плунжер шприца. Наконец, повторите третий раз, чтобы проанализировать третью реплику.
- В программном обеспечении перейдите в окно Выбор измерения- SOP (внизу слева) и выберите Стандартное измерение.
- Обработка видео
- Перенастройте порог усиления и обнаружения экрана после завершения трех измерений для анализа измеренных частиц. В этот момент в каждом кадре должно появиться около 100 частиц для выполнения анализа (ожидаются высокие красные крестики и низкие синие кресты).
- Экспортируйте результаты в PDF-файл после завершения анализа. Кроме того, можно экспортировать как видео, так и файлы Excel.
- Очистка NTA
ПРИМЕЧАНИЕ: Закройте все вскрытые измерения перед изучением следующего образца; поскольку генерируемые файлы огромны и зависят от компьютера, нелегко поддерживать более одного открытого.- Очистите камеру NTA путем многократного промывки водой перед выполнением последующего измерения до тех пор, пока частицы не будут замечены; впоследствии очистите используемый буфер (PBS) для продолжения выполнения мер.
- Промывайте воздух внутри камеры и высушите его микроскопической бумагой после завершения последнего измерения дня.
- Охарактеризовать размер и форму с помощью трансмиссионной электронной микроскопии (ТЭМ). Подготовьте образцы. 30 мкл конечного объема достаточно для определения характеристик ТЕА.
ПРИМЕЧАНИЕ: Как свежие, так и лиофилизированные - после ресуспензии - наночастицы могут быть измерены. - Опустите 10 мкл образца на медную сетку с углеродным покрытием. Дайте высохнуть в течение 10 минут. Удалите лишнюю жидкость, если это необходимо, мягко постукивая по фильтровальной бумаге.
- Капля 10 мкл раствора уранилацетата (2% мас./об.) для отрицательного окрашивания. Дайте высохнуть в течение 1 мин. Удалите избыток жидкости, если это необходимо, мягко постукивая по фильтровальной бумаге.
- Вводят образец в микроскоп и сканируют (напряжение работы 80 кВ).
ПРИМЕЧАНИЕ: Для дальнейшего анализа изображений может быть использовано соответствующее программное обеспечение.
- НТА и пробоподготовка
- Эффективность инкапсуляции
- Пробоподготовка
- Подготовьте наночастицы в нужной концентрации, заморозьте и высушите их. Затем повторно суспендируют наночастицы и разбавляют их в конечной концентрации 6 мкг/мл.
- Подготовьте 1 буфер TE из 20-кратного складского раствора.
ПРИМЕЧАНИЕ: Vt (Общий объем) = (количество образцов x 100 мкл x 4) (количество образцов x 290 мкл) + 2 мл. - Готовят TE-буфер с 3 мкг/мкл гепарина из запаса 100 мкг/мкл.
ПРИМЕЧАНИЕ: Vt = Количество образцов x 50 мкл x 2. - Подготовка стандартов
- Подготовьте стандарт РНК в диапазоне от 0,2 мкг/мл до 0,025 мкг/мл в 1x буфере Tris-EDTA (TE)(таблица S1A).
ПРИМЕЧАНИЕ: Используйте мРНК в стандарте РНК в случае, если он отличается от рибосомальной РНК. - Приготовьте РНК:пБАЭ стандарт с гепарином(таблица S1B). Готовят гепарин стандартный(таблица S1C).
- Подготовьте 96-луночную плиту следующим образом.
- Загрузка 295 мкл буфера TE в первой полосе 96-луночной плиты (столько же скважин, сколько образцов для анализа). Затем загрузите 50 мкл 1x БУФЕРа TE в полосы B и C (дубликаты для каждого образца).
- Загрузка 50 мкл 1x буфера TBE с 3 мкг/мкл гепарина в полосы D и E (дубликаты для каждого образца). Затем загрузите 100 мкл каждого стандарта в полосы F, G и H (дубликаты для каждого стандарта).
- Нагрузка 5 мкл каждого образца в полосе А (концентрация в каждой скважине составляет 0,1 мкг/мл). Правильно перемешайте путем пипетирования и загрузите 50 мкл каждого образца на четыре скважины ниже (две из них содержат 50 мкл буфера 1x TE и еще два содержат 1x TE буфера с 3 мкг/мкл гепарина).
- Инкубируйте образец в течение 30 мин при 37 °C. Приготовьте реагент RiboGreen в соответствии с протоколом производителя (см. Таблицу материалов)в буфере 1x TE.
ПРИМЕЧАНИЕ: Разбавить 1:200 и вихрь. Защита от света. Vt = Количество полных скважин x 100 мкл. - Загрузите 100 мкл раствора RiboGreen в каждую скважину. Обнаружение флуоресценции с помощью микропластичного считывателя с длиной волны возбуждения 500 нм и длиной волны излучения 525 нм.
- Анализ результатов
- Подготовка трех калибровочных кривых
ПРИМЕЧАНИЕ: Во-первых, стандарт рибосомальной РНК. Интерполируйте в этой калибровочной кривой образцы, не содержащие гепарина. Во-вторых, мРНК:pBAE с гепарином. Интерполируйте в этой калибровочной кривой образец, содержащий гепарин. В-третьих, гепарин. Используется для обеспечения рабочей концентрации в линейном диапазоне. - Рассчитайте эффективность инкапсуляции (EE%) следующим образом:
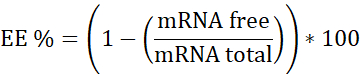
- Подготовка трех калибровочных кривых
- Пробоподготовка
6. Характеристика in vitro
- Флуоресцентная микроскопия для качественной оценки
- Поместите 96-луночную пластину на микроскоп после 24 ч трансфекции. Начните визуализировать ячейки с 10-кратным объективом.
ПРИМЕЧАНИЕ: В этом случае используются ячейки HeLa. Ячейки локализуются с помощью режима передачи (яркого поля), и фокус должен быть отрегулирован в это время.- Во-первых, примените баланс белого, чтобы ссылаться на программное обеспечение о фоне образцов. Затем получите изображение, чтобы наложить его на флуоресцентное изображение во время анализа.
- Измените режим микроскопа на режим отражения (флуоресценции) и переместите колесо фильтра на синий лазер (488 нм) для визуализации eGFP.
ПРИМЕЧАНИЕ: На этом этапе время экспозиции и усиление должны быть скорректированы. Коэффициент усиления должен быть отрегулирован в значениях от 3 до 5, чтобы избежать артефактов и превышения фонового сигнала. Регулировка времени экспозиции зависит от эффективности трансфекции (от мс до 1 с). - Получайте изображения для всех условий или скважин, используя одинаковое время экспозиции, чтобы сравнить все образцы.
- Поместите 96-луночную пластину на микроскоп после 24 ч трансфекции. Начните визуализировать ячейки с 10-кратным объективом.
- Проточная цитометрия (FC) для количественной оценки
- Используйте многоканальную пипетку для подготовки 96-луночной пластины для эксперимента по проточной цитометрии.
ПРИМЕЧАНИЕ: При работе с полуадгезивными ячейками, например, в клеточной линии JAWSII, восстановите весь объем среды и сохраните его в другой 96-луночной пластине. Не стремитесь к этой среде, так как она может содержать значительное количество трансфектированных клеток. - Очистите клетки (здесь используются клетки HeLa) 100 мкл / лунка 1x PBS и стремитесь к этому. Затем добавляют 25 мкл/лунку трипсина и инкубируют его при 37 °C в течение 5 мин.
- Как только клетки отсоединяются, добавляют ранее восстановленную среду, чтобы остановить действие трипсина и зафиксировать клетки, добавляя 31,25 мкл / лунку формалина 10% в течение 20 мин (конечная концентрация 2,5%).
ПРИМЕЧАНИЕ: На этом этапе крайне важно визуализировать состояние клеток с помощью микроскопии, чтобы обеспечить отслоение клеток. Настоятельно рекомендуется несколько раз подниматься и опускаться вверх и вниз, чтобы помочь клеткам отсоединиться и избежать их агломерации. Это даст надежный результат. - Включите проточный цитометр и программное обеспечение. В программном обеспечении настройте правильные условия для эксперимента (тип пластины, объем образца и другие параметры, такие как встряхивание, промывка между образцами.
ПРИМЕЧАНИЕ: Для этапа 6.2.5 расход должен составлять 120 мкл/мин. Смешивайте один цикл каждые 1 минуту и промывайте один цикл каждый раз. Смешивание имеет важное значение для поддержания клеток, диспергированных в среде, и позволяет лучше анализировать отдельные клетки. Кроме того, полоскание необходимо для очистки микрофлюидики цитометра между образцами. Наконец, проверьте, достаточно ли буферов и правильно ли подключены все компоненты. - Настройте соответствующие параметры для количественной оценки процента положительно трансфектированных клеток.
- Во-первых, просмотрите данные о потоке на графике рассеяния (прямой рассеянный свет) FSC и SCC (боковой рассеянный свет), чтобы отличить ячейки от обломков. Затем другой точечный график, сравнивающий амплитуду (FSC-A) и высоту (FSC-H), строится для затвора и различения отдельных ячеек.
ПРИМЕЧАНИЕ: Необработанная популяция позволяет охватить популяции, соответствующие положительно трансфектированным клеткам. Затем количественное определение положительно трансфектированных клеток выполняется по соответствующему каналу на графике гистограммы. Поэтому положительно трансфектированные клетки должны быть представлены в виде континуума событий на гистограмме.
- Во-первых, просмотрите данные о потоке на графике рассеяния (прямой рассеянный свет) FSC и SCC (боковой рассеянный свет), чтобы отличить ячейки от обломков. Затем другой точечный график, сравнивающий амплитуду (FSC-A) и высоту (FSC-H), строится для затвора и различения отдельных ячеек.
- Используйте многоканальную пипетку для подготовки 96-луночной пластины для эксперимента по проточной цитометрии.
7. Функциональные тесты in vitro: способность активировать модельные иммунные клетки с помощью овальбумина (OVA) в качестве антигенной модельной мРНК
- Пластина 10 000 клеток / лунка (здесь используются клетки JAWSII) в 96-луночной пластине за день до трансфекции.
ПРИМЕЧАНИЕ: Накройте столько колодцев, сколько требуется, чтобы иметь трипликаты для каждого условия. Дайте клеткам прикрепиться к пластине не менее чем в течение 12 ч (рекомендуется ночная инкубация). - Подготовьте pBAE NP, как описано в ПРИМЕЧАНИИ ниже, для трансфекции 0,6 мкг мРНК на лунку.
ПРИМЕЧАНИЕ: В качестве положительного контроля трансфектируйте клетки с помощью трансфекционного реагента. Здесь мы использовали 0,1 мкг мРНК на лунку и 0,25 мкл трансфекционного реагента на лунку. Приобретена кодификация мРНК для OVA (см. Таблицу материалов). Он полиаденилирован, модифицирован 5-метоксиуридином и оптимизирован для систем млекопитающих и защищен с помощью концевой крышки структурой Cap1, запатентованным методом от поставщика. - Инкубируйте 96-луночную плиту в течение 24 ч в сухом воздушном инкубаторе при 37 °C и 5% CO2.
ПРИМЕЧАНИЕ: По истечении этого времени не стремитесь к носителю, так как он может содержать определенное количество ячеек. Восстановите клетки и сохраните их в другом колодце или пластине. - Промыть оставшиеся на лунке клетки 25 мкл 1x PBS. Затем добавьте 25 мкл трипсина и инкубируйте пластину в течение 5 мин при 37 °C, чтобы отсоединить клетки. Остановите реакцию трипсина, добавив на корреспондент ранее восстановленные носители.
- Центрифугировать пластину при 400 х г в течение 5 мин при 4 °C. Стремитесь к средствам массовой информации. Добавьте 50 мкл/лунку 1x PBS и 2,5% формалина. Инкубируйте его при 4 °C в течение 20 минут, чтобы зафиксировать клетки.
- Повторите шаги 7.5 и 7.5.1. Затем добавьте 50 мкл/лунку 1x PBS и 3% BSA (блокирующий буфер) и инкубируйте в течение 30 мин при 4 °C. Снова повторите шаги 7.5 и 7.5.1, а затем добавьте 50 мкл/лунку первичного антитела (мышиный α-OVA) в 1x PBS и 3% BSA и инкубируйте в течение 30 мин при 4 °C.
- Повторите шаги 7.5 и 7.5.1, а затем промойте ячейки с 50 мкл/лунка 1x PBS. Используйте носитель, а затем добавьте раствор вторичных антител (α-mouse-AlexaFluor488/PerCP и Cy5.5-CD11b/APC-CD86) в 1x PBS и 3% BSA. Инкубировать его в течение 1 ч при 4 °C.
- Центрифугировать пластину при 400 х г в течение 5 мин. Затем промыть клетки 50 мкл/лунка 1x PBS. Далее центрифугу (400 х г в течение 5 мин) стремятся, а затем повторно суспендируют клетки в 100 мкл/лунку 1x PBS и 2,5% формалина.
- Проанализируйте его методом проточной цитометрии, как описано выше (шаг 6.2).
Результаты
Синтез и определение характеристик полимеров
Процедура синтеза OM-pBAE приведена на рисунке 2. Как показано на рисунке 2А, первым шагом к получению OM-pBAE является синтез C6-pBAE путем добавления аминов (1-гексиламина и 5-амино-1-пентанола, соотношение 1:1)...
Обсуждение
После вспышки пандемии Covid-19 в прошлом году важность вакцин с точки зрения борьбы с инфекционными заболеваниями проявилась как критический компонент8. Усилия ученых со всего мира позволили выпустить на рынок многие вакцины. Впервые в истории мРНК-вакцины продемонстрирова?...
Раскрытие информации
Авторам нечего раскрывать и нет конфликта интересов.
Благодарности
Финансовая поддержка со стороны МИНЕКО/ФЕДЕР (гранты SAF2015-64927-C2-2-R, RTI2018-094734-B-C22 и COV20/01100). CGF признал ее стипендию IQS PhD.
Материалы
| Name | Company | Catalog Number | Comments |
| 1,4-butanediol diacrylate | Sigma Aldrich | 123048 | |
| 1-hexylamine | Sigma Aldrich | 219703 | |
| 5-amino-1-pentanol | Sigma Aldrich | 411744 | |
| Acetone | Panreac | 141007 | |
| CD11b antibody | BD | 550993 | |
| CD86 antibody | Bioligend | 105007 | |
| Chlor hydroxhyde | Panreac | 181023 | |
| Chloroform-d | Sigma Aldrich | 151823 | |
| Cys-His-His-His peptide | Ontores | Custom | |
| Cys-Lys-Lys-Lys peptide | Ontores | Custom | |
| D2O | Sigma Aldrich | 151882 | |
| DEPC reagent for Rnase free water | Sigma Aldrich | D5758 | This reagent is important to treat MilliQ water to remove any RNases of the buffers |
| Diethyl eter | Panreac | 212770 | |
| dimethyl sulfoxide | Sigma Aldrich | 276855 | |
| HEPES | Sigma Aldrich | H3375 | |
| mRNA EGFP | TriLink Technologies | L-7601 | |
| mRNA OVA | TriLink Technologies | L-7610 | |
| RiboGreen kit | ThermoFisher | R11490 | |
| sodium acetate | Sigma Aldrich | 71196 | |
| sucrose | Sigma Aldrich | S0389 | |
| Trifluoroacetic acid | Sigma Aldrich | 302031 | |
| Trypsin-EDTA | Fisher Scientific | 11570626 | |
| α-mouse AlexaFluor488 antibody | Abcam | Ab450105 | |
| Equipment | |||
| Nanoparticle Tracking Analyzer | Malvern Panalytical | NanoSight NS300 | |
| Nuclear Magnetic Ressonance Spectrometer | Varian | 400 MHz | |
| ZetaSizer | Malvern Panalytical | Nano ZS | For zeta potential and hydrodynamic size determination |
| Software | |||
| NanoSight NTA software | Malvern Panalytical | MAN0515-02-EN-00 | |
| NovoExpress Software | Agilent | Not specified | |
| ZetaSizer software | Malvern Panalytical | DTS Application | To analyze surface charge and hydrodynamic sizes |
Ссылки
- Chumakov, K., Benn, C. S., Aaby, P., Kottilil, S., Gallo, R. Can existing live vaccines prevent COVID-19. Science. 368 (6496), 1187-1188 (2020).
- Zhang, C., Maruggi, G., Shan, H., Li, J. Advances in mRNA vaccines for infectious diseases. Frontiers in Immunology. 10, 1-13 (2019).
- Wherry, E. J., Jaffee, E. M., Warren, N., D'Souza, G., Ribas, A. How did we get a COVID-19 vaccine in less than 1 year. Clinical Cancer Research. 27 (8), 2136-2138 (2021).
- Folegatti, P. M., et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. The Lancet. 396 (10249), 467-478 (2020).
- Geall, A. J., Mandl, C. W., Ulmer, J. B. RNA: The new revolution in nucleic acid vaccines. Seminars in Immunology. 25 (2), 152-159 (2013).
- Ulmer, J. B., Geall, A. J. Recent innovations in mRNA vaccines. Current Opinion in Immunology. 41, 18-22 (2016).
- Kranz, L. M., et al. Systemic RNA delivery to dendritic cells exploits antiviral defence for cancer immunotherapy. Nature. 534 (7607), 396-401 (2016).
- Milane, L., Amiji, M. Clinical approval of nanotechnology-based SARS-CoV-2 mRNA vaccines: impact on translational nanomedicine. Drug Delivery and Translational Research. 1 (4), 3 (2020).
- Green, J. J., Langer, R., Anderson, D. G. A combinatorial polymer library approach yields insight into nonviral gene delivery. Accounts of Chemical Research. 41 (6), 749-759 (2008).
- Guerrero-Cázares, H., et al. Biodegradable polymeric nanoparticles show high efficacy and specificity at DNA delivery to human glioblastoma in vitro and in vivo. ACS Nano. 8 (5), 5141-5153 (2014).
- Kozielski, K. L., Tzeng, S. Y., Hurtado De Mendoza, B. A., Green, J. J. Bioreducible cationic polymer-based nanoparticles for efficient and environmentally triggered cytoplasmic siRNA delivery to primary human brain cancer cells. ACS Nano. 8 (4), 3232-3241 (2014).
- Segovia, N., Dosta, P., Cascante, A., Ramos, V., Borrós, S. Oligopeptide-terminated poly(β-amino ester)s for highly efficient gene delivery and intracellular localization. Acta Biomaterialia. 10 (5), 2147-2158 (2014).
- Dosta, P., Segovia, N., Cascante, A., Ramos, V., Borrós, S. Surface charge tunability as a powerful strategy to control electrostatic interaction for high efficiency silencing, using tailored oligopeptide- modified poly (beta-amino ester)s (PBAEs). Acta Biomaterialia. 20, 82-93 (2015).
- Fornaguera, C., et al. mRNA delivery system for targeting antigen-presenting cells in vivo. Advanced Healthcare Materials. 7 (17), 180033 (2018).
- Fornaguera, C., Castells-Sala, C., Lázaro, M. &. #. 1. 9. 3. ;., Cascante, A., Borrós, S. Development of an optimized freeze-drying protocol for OM-PBAE nucleic acid polyplexes. International Journal Pharmaceutics. 569, (2019).
- Fornaguera, C., Solans, C. Analytical methods to characterize and purify polymeric nanoparticles. International Journal of Polymer Science. , (2018).
- Fornaguera, C., Solans, C. Characterization of polymeric nanoparticle dispersions for biomedical applications: size, surface charge and stability. Pharmaceutical Nanotechnology. 6 (3), 147-164 (2018).
- Sahin, U., Karikó, K., Türeci, &. #. 2. 1. 4. ;. MRNA-based therapeutics-developing a new class of drugs. Nature Reviews Drug Discovery. 13 (10), 759-780 (2014).
- Fan, Y. N., et al. Cationic lipid-assisted nanoparticles for delivery of mRNA cancer vaccine. Biomaterials Science. 6 (11), 3009-3018 (2018).
- Le Moignic, A., et al. Preclinical evaluation of mRNA trimannosylated lipopolyplexes as therapeutic cancer vaccines targeting dendritic cells. Journal of Controlled Release. 278, 110-121 (2018).
- Banerji, A., et al. mRNA vaccines to prevent COVID-19 disease and reported allergic reactions: Current evidence and approach. Journal of Allergy and Clinical Immunology: In Practice. 9 (4), 1423-1437 (2021).
- Kaczmarek, J. C., Kowalski, P. S., Anderson, D. G. Advances in the delivery of RNA therapeutics: from concept to clinical reality. Genome Medicine. 9 (1), 1-16 (2017).
- Dosta, P., et al. Delivery of anti-microRNA-712 to inflamed endothelial cells using poly(β-amino ester) nanoparticles conjugated with VCAM-1 targeting peptide. Advanced Healthcare Materials. , 1-11 (2021).
- Segovia, N., et al. Hydrogel doped with nanoparticles for local sustained release of siRNA in breast cancer. Advanced Healthcare Materials. 4 (2), 271-280 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены