È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Sintesi e caratterizzazione di nanoparticelle poli(beta aminoesters) caricate con mRNA a fini vaccinali
In questo articolo
Riepilogo
Qui viene presentato un semplice protocollo per la produzione di nanoparticelle di mRNA basate su polimeri poli(beta aminoestere), facili da personalizzare cambiando l'mRNA incapsulato. Viene inoltre descritto il flusso di lavoro per la sintesi dei polimeri, le nanoparticelle e la loro caratterizzazione essenziale in vitro. Viene aggiunta anche una prova di concetto per quanto riguarda l'immunizzazione.
Abstract
La vaccinazione è stata uno dei maggiori successi della società moderna ed è indispensabile per controllare e prevenire le malattie. I vaccini tradizionali erano composti da interi o frazioni dell'agente infettivo. Tuttavia, le sfide rimangono e le nuove tecnologie vaccinali sono obbligatorie. In questo contesto, l'uso dell'mRNA a scopo immunizzante ha mostrato prestazioni migliorative, come dimostrato dalla rapida approvazione di due vaccini a mRNA che prevengono l'infezione da SARS-CoV-2. Oltre al successo nella prevenzione delle infezioni virali, i vaccini a mRNA possono anche essere utilizzati per applicazioni terapeutiche sul cancro.
Tuttavia, l'instabilità dell'mRNA e la sua rapida eliminazione dal corpo a causa della presenza di nucleasi rende impossibile la sua consegna nuda. In questo contesto, i nanofarmaci, e in particolare le nanoparticelle polimeriche, sono sistemi critici di rilascio di mRNA. Pertanto, lo scopo di questo articolo è quello di descrivere il protocollo per la formulazione e il test di un candidato vaccino a mRNA basato sulle nanoparticelle polimeriche proprietarie. La sintesi e la caratterizzazione chimica dei polimeri poli(beta aminoesteri) utilizzati, la loro complessazione con mRNA per formare nanoparticelle e la loro metodologia di liofilizzazione saranno discusse qui. Questo è un passo cruciale per ridurre i costi di stoccaggio e distribuzione. Infine, saranno indicati i test necessari per dimostrare la loro capacità di trasfettare in vitro e maturare cellule dendritiche modello. Questo protocollo andrà a beneficio della comunità scientifica che lavora sulla vaccinazione a causa della sua elevata versatilità che consente a questi vaccini di prevenire o curare un'ampia varietà di malattie.
Introduzione
Le malattie infettive hanno rappresentato una grave minaccia per milioni di esseri umani in tutto il mondo e sono ancora una delle principali cause di morte in alcuni paesi in via di sviluppo. La vaccinazione profilattica è stata uno degli interventi più efficaci della società moderna per prevenire e controllare le malattie infettive1,2. Queste pietre miliari critiche della scienza nella rilevanza del20 °secolo sono state osservate dalla recente pandemia mondiale di Covid-19 causata dal virus SARS-CoV-23. Riconoscendo l'importanza di avere vaccini efficienti per limitare la diffusione della malattia, gli sforzi di cooperazione di tutte le comunità biomediche hanno portato con successo a molti vaccini profilattici sul mercato in meno di un anno4.
Tradizionalmente, i vaccini erano composti da virus attenuati (vivi, a ridotta virulenza) o inattivati (particelle di morte). Tuttavia, per alcune malattie senza margine di errori di sicurezza, le particelle virali non sono possibili e vengono invece utilizzate subunità proteiche. Tuttavia, le subunità di solito non consentono la combinazione di più di un epitopo / antigene e gli adiuvanti sono necessari per migliorare la potenza della vaccinazione5,6. Pertanto, la necessità di nuovi tipi di vaccini è chiara.
Come dimostrato durante l'attuale pandemia, nuovi candidati vaccini a base di acidi nucleici possono essere vantaggiosi in termini di evitare lunghi processi di sviluppo e fornire un'elevata versatilità producendo, allo stesso tempo, un'immunizzazione vitale del paziente. Questo è il caso dei vaccini a mRNA, che sono stati inizialmente progettati come vaccini sperimentali contro il cancro. Grazie alla loro naturale capacità di produrre risposte antigene-specifiche delle cellule T3,5,6,7. Essendo l'mRNA la molecola che codifica la proteina antigenica, cambiando solo la stessa, il vaccino può essere rapidamente adattato per immunizzare altre varianti dello stesso microrganismo, ceppi diversi, altri microrganismi infettivi o addirittura diventare un trattamento immunoterapeutico del cancro. Inoltre, sono vantaggiosi in termini di costi di produzione su larga scala. Tuttavia, l'mRNA ha un ostacolo significativo che ostacola la loro somministrazione nuda: la sua stabilità e integrità sono compromesse in mezzi fisiologici, pieni di nucleasi. Per questo motivo, è richiesto l'uso di un vettore nanometrico che lo protegga e vettorizzi l'mRNA alle cellule che presentano l'antigene2,8.
In questo contesto, i poli(beta aminoesteri) (pBAE) sono una classe di polimeri biocompatibili e biodegradabili che hanno dimostrato una notevole capacità di complessare mRNA in particelle nanometriche, grazie alle loro cariche cationiche9,10,11. Questi polimeri sono composti da legami estere, che rendono facile la loro degradazione da parte delle esterasi in condizioni fisiologiche. Tra i candidati della libreria pBAE, quelli funzionalizzati con oligopeptidi cationici finali hanno mostrato una maggiore capacità di formare piccole nanoparticelle per penetrare in modo efficiente nelle cellule attraverso l'endocitosi e trasfettare il materiale genico incapsulato. Inoltre, grazie alla loro capacità tampone, l'acidificazione del compartimento endosomico permette la fuga endosomiale12,13. Vale a dire, un tipo specifico di pBAE, comprese le parti idrofobiche sulla loro spina dorsale (il cosiddetto PBAE C6) per migliorare la loro stabilità e la combinazione end-oligopeptide (60% del polimero modificato con una tri-lisina e il 40% del polimero con una tri-istidina) che trasfetta selettivamente le cellule che presentano l'antigene dopo somministrazione parenterale e producono la presentazione dell'antigene codificato mRNA seguita dall'immunizzazione dei topi è stato recentemente pubblicato14 . Inoltre, è stato anche dimostrato che queste formulazioni potrebbero aggirare uno dei principali passaggi di collo di bottiglia delle formulazioni di nanomedicina: la possibilità di liofilizzarle senza perdere la loro funzionalità, che consente una stabilità a lungo termine in ambienti morbidi e asciutti15.
In questo contesto, l'obiettivo dell'attuale protocollo è quello di mettere a disposizione della comunità scientifica la procedura per la formazione delle nanoparticelle di mRNA fornendo una descrizione delle fasi critiche del protocollo e consentendo la produzione di vaccini efficienti per la prevenzione delle malattie infettive e le applicazioni di trattamento dei tumori.
Il seguente protocollo descrive l'allenamento completo per sintetizzare poli(beta aminoesters) aerotessuti oligopeptidi modificati - polimeri OM-pBAE che saranno ulteriormente utilizzati per la sintesi di nanoparticelle. Nel protocollo è inclusa anche la formulazione di nanoparticelle. Inoltre, vengono forniti anche passaggi critici per il successo della procedura e risultati rappresentativi per garantire che le formulazioni risultanti soddisfino le caratteristiche di caratterizzazione del controllo di qualità richieste per definire un risultato positivo o negativo. Questo protocollo è riassunto nella Figura 1.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Sintesi del polimero pBAE con oligopeptidi terminali (OM-pBAE)
- Polimerizzazione di C6-pBAE
- Aggiungere 5-ammino-1-pentanolo (38 mmol; MW = 103,16 Da) 1-esilamine (38 mmol; MW = 101,19 Da) in un pallone di vetro a fondo tondo (100 ml). Quindi, aggiungere 1,4-butandiolo diacrilato (82 mmol; MW = 198,22 Da).
- Preriscaldare il bagno di olio siliconico a 90 °C, posizionare il matraccio a fondo tondo nel bagno d'olio e mescolare la miscela con l'aiuto di una barra magnetica per una notte (~18 h). Quindi, prendere il prodotto dal matraccio a fondo tondo e metterlo nel congelatore a -20 °C.
NOTA: Il prodotto è sotto forma di polvere appiccicosa e viene estratto dal pallone con l'aiuto di una spatola. È essenziale convalidare la struttura del polimero ottenuto attraverso 1H-NMR. Gli spettri NMR sono stati registrati in uno strumento a 400 MHz (vedi Tabella dei materiali)utilizzando cloroformio-d e D2O come solventi. Circa 10 mg di ciascun poliestere (β-ammino estere) sono stati prelevati e disciolti in 1 mL di solvente deuterato.
- Reazione con peptidi per ottenere OM-pBAE
- Aggiungere 25 ml di 0,1 M HCl a peptidi selezionati, ad esempio il peptide Cys-His-His-His con acido trifluoroacetico (TFA, 200 mg), in un tubo centrifugo da 50 mL precedentemente pesato che può sopportare la liofilizzazione e mescolare manualmente durante la notte per ottenere una soluzione chiara.
- Congelare la soluzione a -80 °C per 1 ora e liofilizzare il peptide cloridrato risultante.
NOTA: Verificare se il peso finale corrisponde al valore teorico. - Fare una soluzione di C6-pBAE (0,031 mmol) in dimetilsolfossido. Inoltre, fare una soluzione del peptide cloridrato (0,078 mmol) in dimetilsolfossido.
- Mescolare le due soluzioni in un tubo con tappo a vite e avvitare il cappuccio. Mescolare la soluzione di miscela a bagnomaria a temperatura controllata di 25 °C per 20 ore con una barra magnetica.
- Aggiungere la miscela a 7:3 (v/v) etere dietilico/acetone. Centrifugare la sospensione risultante a 25.000 x g a 4 °C per rimuovere il solvente. Quindi, lavare il solido con 7:3 (v/v) etere dietilico/acetone due volte. Quindi, asciugare il prodotto sotto vuoto (<0,2 atm).
- Fare una soluzione di 100 mg/ml del prodotto in dimetilsolfossido. Il prodotto risultante è chiamato C6-peptide-pBAE. È essenziale validare la struttura del polimero ottenuto attraverso 1H-NMR per confermare la scomparsa dei segnali olefinici associati agli acrilati terminali. Se non utilizzato, il polimero può essere congelato a -20 °C.
2. Formazione di poliplexi
NOTA: Tutte le procedure devono essere eseguite all'interno di una stanza condizionata per mantenere una temperatura costante.
- Scongelare i polimeri C6-peptide-pBAE e vorticare la soluzione.
- Pipettare la miscela polimerica su e giù e preparare una soluzione di 12,5 mM (V1) in acetato di sodio (NaAc). Quindi, vorticare la miscela e attendere 10 minuti.
- Preparare l'mRNA a 0,5 mg/mL e miscelare mediante pipettaggio (V2).
NOTA: È fondamentale evitare di vorticoso l'mRNA. - Vortice della miscela polimerica alla concentrazione finale per ottenere una soluzione omogenea tra lo stock polimerico in DMSO e il tampone di acetato.
NOTA: la concentrazione finale del polimero dipende dal rapporto N/P (gruppi azoto/fosfato) selezionato. Il rapporto N/P dipende da ogni mRNA specifico da utilizzare. Per l'incapsulamento eGFP, ad esempio, è stato utilizzato un rapporto 25:1, come riportato in precedenza14. - Mescolare la soluzione di materiale genetico e la soluzione di C6-peptidepBAE (25x della concentrazione di mRNA) in un rapporto di 1:1 (Vi = V1 + V2).
NOTA: C6-peptide-pBAE viene caricato in un tubo microcentrifuga in cui l'mRNA viene aggiunto mediante pipettaggio su e giù per la miscelazione. Una volta preparato, il poliplex, l'acido nucleico e le concentrazioni di C6-peptide-pBAE sono semidiluiti. - Incubare a 25 °C per 30 minuti in un termoblocco. Precipitare con acqua priva di RNase 1:2 aggiungendo il campione a un tubo microcentrifuga precaricato con acqua.
- Includere gli eccipienti. Aggiungere lo stesso volume della miscela di mRNA e pBAE (Vi) in HEPES 20 mM e saccarosio 4% mediante pipettaggio su e giù. A questo punto, il campione è stato diluito 3x.
3. Liofilizzazione dei poliplexi
- Congelare istantaneamente a -80 °C il congelatore della precedente soluzione di poliplex per 1 ora.
- Eseguire l'essiccazione primaria seguendo i passaggi: (1) 1 h a -60 °C e 0,001 hPa; (2) 1 ora a -40 °C e 0,0001 hPa; (3) 4 ore a -20 °C e 0,0001 hPa; (4) 12 ore a 5 °C e 0,0001 hPa.
- Conservare immediatamente a -20 °C per evitare reidratazioni fino all'uso.
4. Risospensione Polyplex
NOTA: Questo protocollo descrive il processo utilizzato per ricostruire le nanoparticelle liofilizzate C6-peptide-pBAE per il loro ulteriore utilizzo sia per la caratterizzazione, in vitro, o in vivo analisi.
- Prendere le nanoparticelle liofilizzate da -20 °C proprio al momento dell'uso e aggiungere rapidamente la quantità corrispondente di acqua depirogenata (DEPC) per ridisperpare il solido per ottenere la concentrazione desiderata.
NOTA: Il volume sarà uguale al volume iniziale delle nanoparticelle se è prevista la stessa concentrazione, ma sarà indicato per ogni esperimento. - Pipettare delicatamente fino alla totale risospensione, accompagnando il liquido con la pipetta.
NOTA: Assicurarsi che non rimanga materiale sulla parete del flaconcino. - Una volta sciolto, pipettare su e giù vigorosamente, evitando bolle.
NOTA: Il campione dovrebbe avere un aspetto da trasparente a traslucido, che è più evidente a concentrazioni più elevate - Conservare i campioni su ghiaccio o a 4 °C per un periodo massimo di 24 ore una volta ricostituiti. Evitare il congelamento.
5. Caratterizzazione dei poliplex
- Diffusione dinamica della luce
NOTA: Il diametro idrodinamico (nm), l'indice di polidispersità (PDI) e la carica superficiale delle nanoparticelle sono stati misurati a 25 °C, lunghezza d'onda laser di 633 nm e rilevatore di segnale a 173 °, utilizzando un analizzatore di potenziale Zeta (vedere Tabella dei materiali).- Diametro idrodinamico (nm)
- Preparare accuratamente le nanoparticelle mescolando mRNA e pBAE pipettando il materiale genico alla frazione polimerica fino a una concentrazione finale di mRNA di 0,25 mg/mL come precedentemente descritto sopra (fase 2).
- Pre-risciacquare una microcuvette con mezzo di diluizione filtrato per pulirla completamente dalle impurità. Quindi, riempire la cuvetta con almeno 50 μL della soluzione campione e tapparla. Quindi, introdurre il campione all'interno dello strumento DLS, assicurarsi che la cella sia inserita correttamente.
NOTA: il mezzo di diluizione viene filtrato utilizzando un filtro a siringa da 0,22 μm. - Aprire il file SOP (Standard Operation Procedure) creato e introdurre il nome di esempiodesiderato. Selezionare Misurazione dimensioni.
NOTA: tutti i parametri per creare una SOP per le misurazioni delle dimensioni sono forniti nella Tabella 1. - Eseguire la misurazione delle dimensioni delle particelle utilizzando DLS facendo clic su Riproduci.
NOTA: dopo il triplo segnale acustico, l'analisi è completa. - Selezionare i risultati corrispondenti al campione sul foglio di misurazione per ottenere la dimensione media delle particelle, la PDI media, la deviazione standard e la grafica. Una volta fatto, rimuovere la cella dall'apparecchiatura DLS.
- Rimuovere il campione, conservarlo per l'analisi del potenziale zeta e pulire e risciacquare la cella con acqua deionizzata. Infine, asciugare la cuvetta pulita sotto un flusso di gas di aria compressa.
- Carica superficiale (mV)
- Preparare accuratamente le nanoparticelle mescolando mRNA e pBAE pipettando il materiale genico alla frazione polimerica ad una concentrazione finale di mRNA di 0,25 mg/mL come precedentemente descritto sopra (fase 2, formazione di Poliplex). Quindi, congelare e asciugare la soluzione.
NOTA: In questo caso, per la misurazione della carica superficiale, la liofilizzazione del campione è fortemente consigliata prima di eseguire le misure per ridisperare il campione nell'apposito tampone, simulando condizioni corporee di pH e concentrazione di elettroliti. - Risospendare il campione liofilizzato usando acqua. Diluire il campione 1/10 in acqua (concentrazione finale 0,025 mg/ml).
- Pre-risciacquare una cellula capillare ripiegata monouso (cuvetta potenziale zeta) con mezzo di diluizione filtrato per pulirla completamente dalle impurità. Quindi, riempire la cuvetta con nanoparticelle diluite, usando una siringa da 1 mL e tappare entrambi i lati dei riempitivi.
NOTA: La dispersione delle nanoparticelle deve riempire il volume disponibile nella cuvetta (~1 mL), prestando particolare attenzione alla formazione della bolla, che potrebbe perturbare le misure. - Introdurre il campione all'interno di DLS; assicurarsi che la cella sia inserita correttamente.
- Aprire il file SOP creato per l'analisi del potenziale zeta e introdurre il nome di esempiodesiderato. Selezionare Misurazione del potenziale Zeta.
NOTA: i parametri per creare una SOP per le misurazioni del potenziale zeta sono riportati nella Tabella 2. - Esegui la misurazione del potenziale zeta usando DLS facendo clic su Riproduci.
NOTA: dopo il triplo segnale acustico, l'analisi è completa. - Selezionare i risultati corrispondenti al campione sul foglio di misurazione per ottenere il potenziale zeta medio, la deviazione standard e la grafica. Una volta fatto, rimuovere la cella dall'apparecchiatura DLS.
- Rimuovere il campione e conservarlo se necessario. Quindi, pulire e risciacquare la cella cuvetta con acqua deionizzata, seguita da etanolo e acqua di nuovo. Infine, asciugare la cuvetta pulita sotto un flusso di gas di aria compressa.
NOTA: per analizzare i dati, utilizzare il software consigliato.
- Preparare accuratamente le nanoparticelle mescolando mRNA e pBAE pipettando il materiale genico alla frazione polimerica ad una concentrazione finale di mRNA di 0,25 mg/mL come precedentemente descritto sopra (fase 2, formazione di Poliplex). Quindi, congelare e asciugare la soluzione.
- Diametro idrodinamico (nm)
- Analisi di tracciamento delle nanoparticelle (NTA)
NOTA: il diametro idrodinamico (nm) e la concentrazione di nanoparticelle sono stati misurati a 25 °C, 488 nm di lunghezza d'onda laser utilizzando un analizzatore di tracciamento delle nanoparticelle (vedere Tabella dei materiali).- NTA e preparazione del campione
- Accendere il computer e l'apparecchiatura. Innanzitutto, controlla se tutti i componenti sono collegati correttamente. Quindi, apri il software consigliato. Il software verificherà se tutti gli accessori sono collegati correttamente.
- Collegare la piastra superiore, qui, la cella O-ring, nel modulo laser.
NOTA: non sovraccaricare questa parte. - Caricare prima la camera con tampone e/o acqua deionizzata con una siringa da 1 mL. Ripetere la procedura almeno due volte. Evitare di introdurre bolle nella camera.
- Preparare il campione diluendo 1/1000 in acqua deionizzata dalla concentrazione utilizzata nella misurazione delle dimensioni DLS. Preparare almeno 1 mL e caricarlo in una siringa da 1 mL, evitando di introdurre bolle.
- Caricare i campioni nella camera usando una siringa. Quindi, collegare il modulo laser alla grande camera NTA.
NOTA: La camera grande indica lo spazio in cui è posizionata la camera per la misurazione.
- Ottimizzazione delle immagini
- Innanzitutto, nell'Hardware, controlla se la fotocamera e il laser appropriato sono selezionati.
NOTA: Qui, c'è solo una fotocamera e il Blue Laser 488 nm. - Inizia con il livello della fotocamera a 0 e premi Avvia fotocamera nella finestra Acquisizione.
NOTA: a questo punto, regolare i seguenti parametri. Posizione del fascio (può essere spostato su e giù sullo schermo). Livello fotocamera:evitare pixel sovrasaturati. Messa a fuoco (ruota laterale):cerca di mettere a fuoco il meglio possibile. È meglio avere particelle con un alone invece di particelle non focalizzate. Concentrazione: regolare la concentrazione in modo che abbia tra 10 e 100 particelle per campo.
- Innanzitutto, nell'Hardware, controlla se la fotocamera e il laser appropriato sono selezionati.
- Registrazione video
- Nel software, vai alla finestra Selezione misurazione- SOP (in basso a sinistra) e seleziona Misurazione standard.
NOTA: programma per eseguire tre misure di 30 s ciascuna (per consentire al software di eseguire calcoli di deviazione media e standard). Specificare un nome e un percorso di cartella (in Nome file di base) per salvare i record dell'esempio. Quando i parametri SOP sono impostati correttamente, premere Crea ed esegui script. Una volta misurata la prima replica, il programma chiederà di aggiungere un nuovo campione. Quindi, un'altra frazione del campione deve essere introdotta nella camera spingendo lo stantuffo della siringa. Infine, ripetere una terza volta per analizzare la terza replica.
- Nel software, vai alla finestra Selezione misurazione- SOP (in basso a sinistra) e seleziona Misurazione standard.
- Elaborazione video
- Regolare nuovamente la soglia di guadagno e rilevamento dello schermo una volta completate le tre misure per analizzare le particelle misurate. In questo momento, circa 100 particelle dovrebbero apparire in ogni fotogramma per eseguire l'analisi (sono previste croci rosse alte e croci blu basse).
- Esportare i risultati in un file pdf al termine dell'analisi. Inoltre, è possibile esportare come video e file excel.
- Pulizia dell'NTA
NOTA: Chiudere tutte le misurazioni aperte prima di studiare il seguente campione; poiché i file generati sono enormi e a seconda del computer, non è facile mantenerne più di uno aperto.- Pulire la camera NTA lavando ripetutamente l'acqua prima di eseguire la misurazione successiva fino a quando non si osservano particelle; successivamente, lavare il buffer utilizzato (PBS) per continuare con le misure.
- Sciacquare l'aria all'interno della camera e asciugarla con carta di qualità microscopica una volta completata l'ultima misurazione della giornata.
- Caratterizzare le dimensioni e la forma con la microscopia elettronica a trasmissione (TEM). Preparare i campioni. 30 μL del volume finale sono sufficienti per la caratterizzazione TEM.
NOTA: Sia le nanoparticelle fresche che quelle liofilizzate - dopo la risospensione - possono essere misurate. - Far cadere 10 μL di campione su una griglia di rame rivestita di carbonio. Lasciare asciugare per 10 minuti. Rimuovere il liquido in eccesso, se necessario, picchiettando delicatamente la carta da filtro.
- Goccia di 10 μL di acetato di uranile (2% p/v) soluzione per la colorazione negativa. Lasciare asciugare per 1 minuto. Rimuovere il liquido in eccesso, se necessario, picchiettando delicatamente la carta da filtro.
- Introdurre il campione nel microscopio e scansionare (tensione di funzionamento 80 kV).
NOTA: è possibile utilizzare un software appropriato per ulteriori analisi delle immagini.
- NTA e preparazione del campione
- Efficienza di incapsulamento
- Preparazione del campione
- Preparare le nanoparticelle alla concentrazione desiderata e congelarle e asciugarle. Quindi, risospesere le nanoparticelle e diluirle ad una concentrazione finale di 6 μg/ml.
- Preparare 1 buffer TE dalla soluzione stock 20x.
NOTA: Vt (volume totale) = (numero di campioni x 100 μL x 4) (numero di campioni x 290 μL) + 2 mL. - Preparare il tampone TE con 3 μg/μL di eparina dallo stock di 100 μg/μL.
NOTA: Vt = Numero di campioni x 50 μL x 2. - Preparare gli standard
- Preparare uno standard di RNA che va da 0,2 μg/mL a 0,025 μg/mL in 1x tampone Tris-EDTA (TE) (Tabella S1A).
NOTA: Utilizzare l'mRNA nello standard RNA nel caso in cui differisca dall'RNA ribosomiale. - Preparare lo standard RNA:pBAE con eparina (Tabella S1B). Preparare lo standard di eparina (Tabella S1C).
- Preparare un piatto da 96 pozzetti come segue.
- Caricare 295 μL di buffer TE nella prima corsia di una piastra a 96 pozzetti (tanti pozzi quanto campioni da analizzare). Quindi, caricare 50 μL di 1x te buffer nelle corsie B e C (duplicati per ciascun campione).
- Caricare 50 μL di 1x tbe buffer con 3 μg/μL di eparina nelle corsie D ed E (duplicati per ogni campione). Quindi, caricare 100 μL di ogni standard nelle corsie F, G e H (duplicati per ogni standard).
- Caricare 5 μL di ciascun campione nella corsia A (la concentrazione in ciascun pozzo è di 0,1 μg/mL). Miscelare correttamente mediante pipettaggio e caricare 50 μL di ciascun campione sui quattro pozzetti sottostanti (due di essi contenenti 50 μL di tampone 1x TE e altri due contenenti 1x tampone TE con 3 μg/μL di eparina).
- Incubare il campione per 30 minuti a 37 °C. Preparare il reagente RiboGreen secondo il protocollo del produttore (vedere Tabella dei materiali)in 1x tampone TE.
NOTA: Diluire 1:200 e vortice. Proteggere dalla luce. Vt = Numero di pozzetti pieni x 100 μL. - Caricare 100 μL di soluzione RiboGreen in ogni pozzetto. Rileva la fluorescenza utilizzando il lettore di micropiastre con una lunghezza d'onda di eccitazione di 500 nm e una lunghezza d'onda di emissione di 525 nm.
- Analisi dei risultati
- Preparare le tre curve di calibrazione
NOTA: In primo luogo, standard di RNA ribosomiale. Interpolare in questa curva di calibrazione i campioni che non contengono eparina. In secondo luogo, mRNA:pBAE con eparina. Interpolare in questa curva di calibrazione il campione che contiene eparina. Terzo, l'eparina. Utilizzato per garantire che la concentrazione di lavoro sia nell'intervallo lineare. - Calcolare l'efficienza di incapsulamento (EE%) come segue:
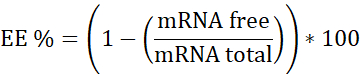
- Preparare le tre curve di calibrazione
- Preparazione del campione
6. Caratterizzazione in vitro
- Microscopia a fluorescenza per la valutazione qualitativa
- Posizionare la piastra a 96 pozzetti sul microscopio dopo 24 ore di trasfezione. Inizia a visualizzare le celle con l'obiettivo 10x.
NOTA: in questo caso vengono utilizzate le celle HeLa. Le celle sono localizzate utilizzando la modalità di trasmissione (campo luminoso) e la messa a fuoco deve essere regolata in questo momento.- Innanzitutto, applicare un bilanciamento del bianco per fare riferimento al software sullo sfondo degli esempi. Quindi, acquisire un'immagine per sovrapporla all'immagine di fluorescenza durante l'analisi.
- Cambiare la modalità microscopio in modalità di riflessione (fluorescenza) e spostare la ruota del filtro sul laser blu (488 nm) per visualizzare eGFP.
NOTA: a questo punto, il tempo di esposizione e il guadagno devono essere regolati. Il guadagno deve essere regolato in valori compresi tra 3 e 5 per evitare artefatti ed eccessi sul segnale di fondo. La regolazione del tempo di esposizione dipende dall'efficienza di trasfezione (da ms a 1 s). - Acquisire immagini per tutte le condizioni o pozzi impiegando lo stesso tempo di esposizione per confrontare tutti i campioni.
- Posizionare la piastra a 96 pozzetti sul microscopio dopo 24 ore di trasfezione. Inizia a visualizzare le celle con l'obiettivo 10x.
- Citometria a flusso (FC) per la valutazione quantitativa
- Utilizzare una pipetta multicanale per preparare la piastra a 96 pozzetti per l'esperimento di citometria a flusso.
NOTA: quando si lavora con celle semi-aderenti, ad esempio nella linea cellulare JAWSII, recuperare tutto il volume del supporto e memorizzarlo in un'altra piastra a 96 pozzetti. Non aspirare a questo mezzo poiché potrebbe contenere un numero significativo di cellule trasfettate. - Pulire le cellule (le cellule HeLa sono usate qui) con 100 μL / pozzetto di 1x PBS e aspirarlo. Quindi, aggiungere 25 μL/pozzetto di tripsina e incubarlo a 37 °C per 5 min.
- Una volta staccate le cellule, aggiungere il mezzo precedentemente recuperato per fermare l'azione della tripsina e fissare le cellule, aggiungendo 31,25 μL / pozzetto di formalina al 10% per 20 minuti (concentrazione finale 2,5%).
NOTA: A questo punto, è fondamentale visualizzare lo stato delle cellule al microscopio per garantire il distacco delle cellule. Si consiglia vivamente di pipettare su e giù più volte per aiutare le cellule a staccarsi ed evitare il loro agglomerazione. Ciò produrrà un risultato affidabile. - Accendere il citometro a flusso e il software. Nel software, impostare le condizioni corrette per l'esperimento (tipo di piastra, volume del campione e altri parametri come agitazione, risciacquo tra i campioni.
NOTA: per il passaggio 6.2.5, la portata deve essere di 120 μL/min. Mescolare un ciclo ogni 1 minuto e risciacquare un ciclo ogni bene. La miscelazione è essenziale per mantenere le cellule disperse nel mezzo e consentire una migliore analisi delle singole cellule. Inoltre, il risciacquo è necessario per pulire la microfluidica del citometro tra i campioni. Infine, verificare se ci sono abbastanza buffer e se tutti i componenti sono collegati correttamente. - Impostare i parametri appropriati per quantificare la percentuale di cellule trasfettate positivamente.
- Innanzitutto, visualizza i dati di flusso sul grafico a dispersione (Forward scattered light) FSC rispetto a SCC (Side scattered light) per distinguere le celle dai detriti. Quindi, un altro grafico a dispersione che confronta l'ampiezza (FSC-A) rispetto all'altezza (FSC-H) viene tracciato per bloccare e discriminare le singole celle.
NOTA: La popolazione non trattata permette di bloccare le popolazioni corrispondenti alle cellule trasfettate positivamente. Quindi, la quantificazione delle cellule trasfettate positivamente viene eseguita sul canale appropriato su un grafico a istogramma. Pertanto, le cellule trasfettate positivamente devono essere rappresentate come un continuum di eventi sull'istogramma.
- Innanzitutto, visualizza i dati di flusso sul grafico a dispersione (Forward scattered light) FSC rispetto a SCC (Side scattered light) per distinguere le celle dai detriti. Quindi, un altro grafico a dispersione che confronta l'ampiezza (FSC-A) rispetto all'altezza (FSC-H) viene tracciato per bloccare e discriminare le singole celle.
- Utilizzare una pipetta multicanale per preparare la piastra a 96 pozzetti per l'esperimento di citometria a flusso.
7. Test di funzionalità in vitro: capacità di attivare cellule immunitarie modello utilizzando l'ovoalbumina (OAV) come mRNA modello antigenico
- Piastra 10.000 cellule / pozzetto (le cellule JAWSII sono usate qui) in una piastra a 96 pozzetti il giorno prima della trasfezione.
NOTA: Placcare tutti i pozzetti necessari per avere triplicati per ogni condizione. Lasciare che le cellule si attacchino alla piastra almeno per 12 ore (si consiglia un'incubazione notturna). - Preparare le NP pBAE come descritto nella NOTA seguente per trasfettare 0,6 μg di mRNA per pozzetto.
NOTA: Come controllo positivo, trasfettare le cellule utilizzando un reagente di trasfezione. Qui, abbiamo usato 0,1 μg di mRNA per pozzo e 0,25 μL del reagente di trasfezione per pozzo. È stata acquistata la codifica dell'mRNA per gli OAV (vedi Tabella dei materiali). È poliadenilato, modificato con 5-metossiuridina e ottimizzato per sistemi di mammiferi, ed è protetto attraverso un end-capping con struttura Cap1, un metodo proprietario del fornitore. - Incubare la piastra a 96 pozzetti per 24 ore in un incubatore ad aria secca a 37 °C e 5% CO2.
NOTA: dopo questo tempo, non aspirare al supporto poiché potrebbe contenere un certo numero di celle. Recuperare le cellule e salvarle in un altro pozzo o piastra. - Lavare le cellule rimaste sul pozzetto con 25 μL di 1x PBS. Quindi, aspirarlo e aggiungere 25 μL di tripsina e incubare la piastra per 5 minuti a 37 ° C per staccare le cellule. Fermare la reazione della tripsina aggiungendo il supporto precedentemente recuperato sul corrispondente bene.
- Centrifugare la piastra a 400 x g per 5 min a 4 °C. Aspira ai media. Aggiungere 50 μL/pozzetto di un PBS 1x e il 2,5% di formalina. Incubarlo a 4 °C per 20 minuti per fissare le cellule.
- Ripetere i passaggi 7.5 e 7.5.1. Quindi, aggiungere 50 μL/pozzetto di 1x PBS e 3% BSA (tampone bloccante) e incubare per 30 min a 4 °C. Ancora una volta, ripetere i passaggi 7.5 e 7.5.1, quindi aggiungere 50 μL / pozzetto dell'anticorpo primario (α-OVA di topo) in 1x PBS e 3% BSA e incubare per 30 minuti a 4 °C.
- Ripetere i passaggi 7.5 e 7.5.1, quindi lavare le celle con 50 μL/pozzetto di 1x PBS. Aspire media, quindi aggiungere una soluzione di anticorpi secondari (α-mouse-AlexaFluor488/PerCP e Cy5.5-CD11b/APC-CD86) in 1x PBS e 3% BSA. Incubarlo per 1 ora a 4 °C.
- Centrifugare la piastra a 400 x g per 5 min. Quindi, lavare le cellule con 50 μL / pozzetto di 1x PBS. Successivamente, centrifugare (400 x g per 5 minuti), aspirare e quindi risospescere le cellule in 100 μL / pozzetto di 1x PBS e 2,5% di formalina.
- Analizzarlo mediante citometria a flusso, come descritto sopra (passaggio 6.2).
Access restricted. Please log in or start a trial to view this content.
Risultati
Sintesi e caratterizzazione dei polimeri
La procedura di sintesi OM-pBAE è riportata nella Figura 2. Come mostra la Figura 2A, il primo passo per ottenere l'OM-pBAE è sintetizzare il C6-pBAE aggiungendo le ammine (1-esilamine e 5-ammino-1-pentanolo, rapporto 1:1) al diacrilato (1,4-butandiolo diacrilato). Questa reazione viene effettuata a 90 °C per 20 ore e con agitazione costante. Successivamente, una soluzione di oligopeptidi viene aggi...
Access restricted. Please log in or start a trial to view this content.
Discussione
Dopo lo scoppio della pandemia di Covid-19 lo scorso anno, l'importanza dei vaccini in termini di controllo delle malattie infettive si è manifestata come componente critica8. Gli sforzi degli scienziati di tutto il mondo hanno permesso il rilascio sul mercato di molti vaccini. Per la prima volta nella storia, i vaccini a mRNA hanno dimostrato il loro successo precedentemente ipotizzato, grazie alla loro rapida progettazione a causa della loro capacità di adattarsi a qualsiasi nuovo antigene ent...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare né alcun conflitto di interessi.
Riconoscimenti
Viene riconosciuto il sostegno finanziario di MINECO/FEDER (sovvenzioni SAF2015-64927-C2-2-R, RTI2018-094734-B-C22 e COV20/01100). CGF ha riconosciuto la sua IQS PhD Fellowship.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 1,4-butanediol diacrylate | Sigma Aldrich | 123048 | |
| 1-hexylamine | Sigma Aldrich | 219703 | |
| 5-amino-1-pentanol | Sigma Aldrich | 411744 | |
| Acetone | Panreac | 141007 | |
| CD11b antibody | BD | 550993 | |
| CD86 antibody | Bioligend | 105007 | |
| Chlor hydroxhyde | Panreac | 181023 | |
| Chloroform-d | Sigma Aldrich | 151823 | |
| Cys-His-His-His peptide | Ontores | Custom | |
| Cys-Lys-Lys-Lys peptide | Ontores | Custom | |
| D2O | Sigma Aldrich | 151882 | |
| DEPC reagent for Rnase free water | Sigma Aldrich | D5758 | This reagent is important to treat MilliQ water to remove any RNases of the buffers |
| Diethyl eter | Panreac | 212770 | |
| dimethyl sulfoxide | Sigma Aldrich | 276855 | |
| HEPES | Sigma Aldrich | H3375 | |
| mRNA EGFP | TriLink Technologies | L-7601 | |
| mRNA OVA | TriLink Technologies | L-7610 | |
| RiboGreen kit | ThermoFisher | R11490 | |
| sodium acetate | Sigma Aldrich | 71196 | |
| sucrose | Sigma Aldrich | S0389 | |
| Trifluoroacetic acid | Sigma Aldrich | 302031 | |
| Trypsin-EDTA | Fisher Scientific | 11570626 | |
| α-mouse AlexaFluor488 antibody | Abcam | Ab450105 | |
| Equipment | |||
| Nanoparticle Tracking Analyzer | Malvern Panalytical | NanoSight NS300 | |
| Nuclear Magnetic Ressonance Spectrometer | Varian | 400 MHz | |
| ZetaSizer | Malvern Panalytical | Nano ZS | For zeta potential and hydrodynamic size determination |
| Software | |||
| NanoSight NTA software | Malvern Panalytical | MAN0515-02-EN-00 | |
| NovoExpress Software | Agilent | Not specified | |
| ZetaSizer software | Malvern Panalytical | DTS Application | To analyze surface charge and hydrodynamic sizes |
Riferimenti
- Chumakov, K., Benn, C. S., Aaby, P., Kottilil, S., Gallo, R. Can existing live vaccines prevent COVID-19. Science. 368 (6496), 1187-1188 (2020).
- Zhang, C., Maruggi, G., Shan, H., Li, J. Advances in mRNA vaccines for infectious diseases. Frontiers in Immunology. 10, 1-13 (2019).
- Wherry, E. J., Jaffee, E. M., Warren, N., D'Souza, G., Ribas, A. How did we get a COVID-19 vaccine in less than 1 year. Clinical Cancer Research. 27 (8), 2136-2138 (2021).
- Folegatti, P. M., et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. The Lancet. 396 (10249), 467-478 (2020).
- Geall, A. J., Mandl, C. W., Ulmer, J. B. RNA: The new revolution in nucleic acid vaccines. Seminars in Immunology. 25 (2), 152-159 (2013).
- Ulmer, J. B., Geall, A. J. Recent innovations in mRNA vaccines. Current Opinion in Immunology. 41, 18-22 (2016).
- Kranz, L. M., et al. Systemic RNA delivery to dendritic cells exploits antiviral defence for cancer immunotherapy. Nature. 534 (7607), 396-401 (2016).
- Milane, L., Amiji, M. Clinical approval of nanotechnology-based SARS-CoV-2 mRNA vaccines: impact on translational nanomedicine. Drug Delivery and Translational Research. 1 (4), 3(2020).
- Green, J. J., Langer, R., Anderson, D. G. A combinatorial polymer library approach yields insight into nonviral gene delivery. Accounts of Chemical Research. 41 (6), 749-759 (2008).
- Guerrero-Cázares, H., et al. Biodegradable polymeric nanoparticles show high efficacy and specificity at DNA delivery to human glioblastoma in vitro and in vivo. ACS Nano. 8 (5), 5141-5153 (2014).
- Kozielski, K. L., Tzeng, S. Y., Hurtado De Mendoza, B. A., Green, J. J. Bioreducible cationic polymer-based nanoparticles for efficient and environmentally triggered cytoplasmic siRNA delivery to primary human brain cancer cells. ACS Nano. 8 (4), 3232-3241 (2014).
- Segovia, N., Dosta, P., Cascante, A., Ramos, V., Borrós, S. Oligopeptide-terminated poly(β-amino ester)s for highly efficient gene delivery and intracellular localization. Acta Biomaterialia. 10 (5), 2147-2158 (2014).
- Dosta, P., Segovia, N., Cascante, A., Ramos, V., Borrós, S. Surface charge tunability as a powerful strategy to control electrostatic interaction for high efficiency silencing, using tailored oligopeptide- modified poly (beta-amino ester)s (PBAEs). Acta Biomaterialia. 20, 82-93 (2015).
- Fornaguera, C., et al. mRNA delivery system for targeting antigen-presenting cells in vivo. Advanced Healthcare Materials. 7 (17), 180033(2018).
- Fornaguera, C., Castells-Sala, C., Lázaro, M. Á, Cascante, A., Borrós, S. Development of an optimized freeze-drying protocol for OM-PBAE nucleic acid polyplexes. International Journal Pharmaceutics. 569, (2019).
- Fornaguera, C., Solans, C. Analytical methods to characterize and purify polymeric nanoparticles. International Journal of Polymer Science. , (2018).
- Fornaguera, C., Solans, C. Characterization of polymeric nanoparticle dispersions for biomedical applications: size, surface charge and stability. Pharmaceutical Nanotechnology. 6 (3), 147-164 (2018).
- Sahin, U., Karikó, K., Türeci, Ö MRNA-based therapeutics-developing a new class of drugs. Nature Reviews Drug Discovery. 13 (10), 759-780 (2014).
- Fan, Y. N., et al. Cationic lipid-assisted nanoparticles for delivery of mRNA cancer vaccine. Biomaterials Science. 6 (11), 3009-3018 (2018).
- Le Moignic, A., et al. Preclinical evaluation of mRNA trimannosylated lipopolyplexes as therapeutic cancer vaccines targeting dendritic cells. Journal of Controlled Release. 278, 110-121 (2018).
- Banerji, A., et al. mRNA vaccines to prevent COVID-19 disease and reported allergic reactions: Current evidence and approach. Journal of Allergy and Clinical Immunology: In Practice. 9 (4), 1423-1437 (2021).
- Kaczmarek, J. C., Kowalski, P. S., Anderson, D. G. Advances in the delivery of RNA therapeutics: from concept to clinical reality. Genome Medicine. 9 (1), 1-16 (2017).
- Dosta, P., et al. Delivery of anti-microRNA-712 to inflamed endothelial cells using poly(β-amino ester) nanoparticles conjugated with VCAM-1 targeting peptide. Advanced Healthcare Materials. , 1-11 (2021).
- Segovia, N., et al. Hydrogel doped with nanoparticles for local sustained release of siRNA in breast cancer. Advanced Healthcare Materials. 4 (2), 271-280 (2015).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon