A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تركيب وتوصيف متعدد الجسيمات النانوية المحملة بالحمض النووي الريبي (بيتا أمينوستر) لأغراض التطعيم
In This Article
Summary
هنا، يتم تقديم بروتوكول بسيط لإنتاج الجسيمات النانوية مرنا على أساس بولي (بيتا أمينويستر) البوليمرات، من السهل أن تكون مصممة عن طريق تغيير مرنا مغلفة. كما يتم وصف سير العمل لتجميع البوليمرات والجسيمات النانوية وتوصيفها الأساسي في المختبر. يضاف أيضا دليل على المفهوم فيما يتعلق بالتحصين.
Abstract
لقد كان التطعيم أحد النجاحات الرئيسية للمجتمع الحديث ولا غنى عنه في السيطرة على الأمراض والوقاية منها. وكانت اللقاحات التقليدية تتألف من كامل أو أجزاء من العامل المعدي. ومع ذلك، لا تزال هناك تحديات، وتكنولوجيات اللقاحات الجديدة إلزامية. وفي هذا السياق، أظهر استخدام الحمض النووي الريبي لأغراض التحصين أداء معززا، كما يتضح من الموافقة السريعة على لقاحين من لقاح الحمض النووي الريبي (مرنا) الوقاية من العدوى بالسارس -CoV-2. وإلى جانب النجاح في الوقاية من العدوى الفيروسية، يمكن أيضا استخدام لقاحات الحمض النووي الريبي لتطبيقات السرطان العلاجية.
ومع ذلك ، فإن عدم استقرار الحمض النووي الريبي وتخليصه السريع من الجسم بسبب وجود النيوكلياسيات يجعل تسليمه العاري غير ممكن. وفي هذا السياق، فإن الطب النانوي، وبالتحديد الجسيمات النانوية البوليمرية، هي نظم تسليم الحمض النووي الريبي الحرجة. وبالتالي ، فإن الهدف من هذه المادة هو وصف بروتوكول لصياغة واختبار لقاح مرنا مرشح على أساس الجسيمات النانوية البوليمرية الملكية. سيتم مناقشة التركيب والتوصيف الكيميائي للبولي (بيتا أمينيسترز) البوليمرات المستخدمة ، وتعقيدها مع مرنا لتشكيل الجسيمات النانوية ، ومنهجية الليسوفيليا الخاصة بهم هنا. وهذه خطوة حاسمة لخفض تكاليف التخزين والتوزيع. وأخيرا، سيتم الإشارة إلى الاختبارات المطلوبة لإثبات قدرتها على الخلايا التشعبية في المختبر والنموذج الناضج. وسيفيد هذا البروتوكول الأوساط العلمية العاملة في مجال التطعيم بسبب تعدد استخداماته العالية التي تمكن هذه اللقاحات من الوقاية من مجموعة واسعة من الأمراض أو علاجها.
Introduction
11 - وقد مثلت الأمراض المعدية تهديدا خطيرا لملايين البشر في جميع أنحاء العالم، ولا تزال أحد الأسباب الرئيسية للوفاة في بعض البلدان النامية. التطعيم الوقائي كان واحدا من التدخلات الأكثر فعالية في المجتمع الحديث لمنع ومكافحة الأمراض المعدية1،2. وقد لوحظت هذه المعالم الحاسمة للعلوم فيأهميةالقرن العشرين من قبل وباء كوفيد-19 في جميع أنحاء العالم مؤخرا الناجم عن فيروس سارس-كوف-23. وإدراكا لأهمية وجود لقاحات فعالة للحد من انتشار المرض، نجحت الجهود التعاونية التي بذلتها جميع المجتمعات الطبية الحيوية في إنتاج العديد من اللقاحات الوقائية في السوق في أقل من عام4.
وتقليديا، كانت اللقاحات تتألف من فيروسات مخففة (حية، أو منخفضة الفوعة) أو فيروسات (جزيئات الموت) المعطلة. ومع ذلك ، بالنسبة لبعض الأمراض التي لا يوجد بها هامش أخطاء السلامة ، فإن الجسيمات الفيروسية غير ممكنة ، وتستخدم وحدات البروتين الفرعية بدلا من ذلك. ومع ذلك، عادة لا تمكن الوحدات الفرعية من الجمع بين أكثر من ظهارة/ مستضد واحد، ويتعين على المساعدين تعزيز فعالية التطعيم5و6. ولذلك، فإن الحاجة إلى أنواع جديدة من اللقاحات واضحة.
وكما اتضح خلال الجائحة الحالية، يمكن أن يكون المرشحون للقاحات الجديدة القائمة على الأحماض النووية مفيدين من حيث تجنب عمليات التنمية الطويلة وتوفير تنوع كبير مع إنتاج تحصين حيوي للمرضى في الوقت نفسه. هذه هي حالة لقاحات الحمض النووي الريبي، التي صممت في البداية كلقاحات تجريبية للسرطان. بفضل قدرتها الطبيعية لإنتاج مستضد محددة الخلايا التائية الاستجابات3,5,6,7. يجري مرنا الجزيء الذي يشفر البروتين المضادة للجينات، وتغيير نفسه فقط، يمكن تصميم اللقاح بسرعة لتحصين المتغيرات الأخرى من نفس الكائنات الحية الدقيقة، وسلالات مختلفة، والكائنات الحية الدقيقة المعدية الأخرى، أو حتى تصبح علاج المناعة السرطان. وبالإضافة إلى ذلك، فهي مفيدة من حيث تكاليف الإنتاج على نطاق واسع. ومع ذلك ، فإن الحمض النووي الريبي لديه عقبة كبيرة تعوق إدارتهم العارية: يتم اختراق استقرارها وسلامتها في وسائل الإعلام الفسيولوجية ، المليئة بالنيوات. لهذا السبب، فإن استخدام الناقل نانومتري الذي يحميه وناقلات مرنا إلى خلايا تقديم مستضد مطلوب2،8.
في هذا السياق، بولي (بيتا أمينيسترز) (pBAE) هي فئة من البوليمرات المتوافقة بيولوجيا والقابلة للتحلل الحيوي التي أظهرت قدرة ملحوظة على مرنا معقدة في جزيئات نانومترية، وذلك بفضل التهم cationicبهم 9،10،11. وتتكون هذه البوليمرات من السندات إستر، مما يجعل تدهورها سهلة من قبل esterases في الظروف الفسيولوجية. من بين المرشحين مكتبة pBAE، تلك وظيفية مع oligopeptides cationic نهاية أظهرت قدرة أعلى لتشكيل الجسيمات النانوية الصغيرة لاختراق الخلايا بكفاءة من خلال الغدد الصماء وtransfect المواد الجينية المغلفة. وعلاوة على ذلك، وذلك بفضل قدرتها التخزين المؤقت، وتحمض مقصورة اندوسوم يسمح الهروب endosomal12،13. أي نوع محدد من pBAE، بما في ذلك moieties الكارهة للماء على العمود الفقري (ما يسمى C6 pBAE) لتعزيز استقرارها ومزيج نهاية oligopeptide (60٪ من البوليمر المعدلة مع ثلاثي ليسين و 40 ٪ من البوليمر مع ثلاثي الهستيدين) التي تحول انتقائي الخلايا التي تقدم مستضد بعد الإدارة بين قوسين وإنتاج عرض مستضد مرمزة مرنا تليها الفئران التحصين وقد نشرت مؤخرا14 . وبالإضافة إلى ذلك، فقد ثبت أيضا أن هذه التركيبات يمكن أن تتحايل على واحدة من خطوات عنق الزجاجة الرئيسية لصياغات الطب النانوي: إمكانية تجميد الجافة لهم دون أن تفقد وظائفها، والتي تمكن الاستقرار على المدى الطويل في البيئات الجافة الناعمة15.
وفي هذا السياق، يتمثل الهدف من البروتوكول الحالي في إتاحة إجراء تكوين الجسيمات النانوية الحمض النووي الريبي للأوساط العلمية من خلال إعطاء وصف للخطوات الحاسمة في البروتوكول وتمكين إنتاج لقاحات فعالة للوقاية من الأمراض المعدية وتطبيقات علاج الأورام.
يصف البروتوكول التالي تجريب كاملة لتجميع أوليغوبتيد نهاية تعديل بولي (بيتا aminoesters) - OM-pBAE البوليمرات التي سيتم استخدامها كذلك لتوليف الجسيمات النانوية. في البروتوكول، يتم تضمين صياغة الجسيمات النانوية أيضا. وبالإضافة إلى ذلك، يتم أيضا توفير خطوات حاسمة لنجاح الإجراء والنتائج التمثيلية لضمان أن الصياغات الناتجة عن ذلك تحقق الخصائص المطلوبة لتحديد الخصائص المطلوبة لتحديد نتيجة إيجابية أو سلبية. ويرد تلخيص هذا البروتوكول في الشكل 1.
Protocol
1. تركيب البوليمر pBAE مع أوليجوببتيدات نهاية (OM-pBAE)
- بلمرة C6-pBAE
- إضافة 5 الأمينية-1-pentanol (38 مليمول; ميغاواط = 103.16 دا) 1-هيكسيلامين (38 مليمول؛ MW = 101.19 دا) في قارورة زجاجية مستديرة القاع (100 مل). ثم، إضافة 1،4-البيوتانديول دياكريلات (82 مليمول؛ ميغاواط = 198.22 دا).
- قبل تسخين حمام زيت السيليكون في 90 درجة مئوية، ووضع قارورة مستديرة القاع في حمام الزيت وتحريك الخليط مع المعونة من شريط ضجة المغناطيسي بين عشية وضحاها (~ 18 ساعة). ثم، خذ المنتج من القارورة المستديرة السفلية وضعه في الثلاجة عند -20 درجة مئوية.
ملاحظة: المنتج هو في شكل مسحوق لزجة ويتم إخراجها من القارورة بمساعدة ملعقة. من الضروري التحقق من صحة بنية البوليمر الذي تم الحصول عليه من خلال 1H-NMR. وسجلت أطياف الرنين المغناطيسي في جهاز 400 ميغاهرتز (انظر جدول المواد)باستخدام الكلوروفورم -د و D2O كمذيبات. حول 10 ملغ من كل بولي (β الأمينية استر) واتخذت وحلت في 1 مل من المذيبات deuterated.
- رد فعل مع الببتيدات للحصول على OM-pBAE
- إضافة 25 مل من 0.1 M HCl إلى الببتيدات المختارة، على سبيل المثال، الببتيد Cys-His-His-His مع حمض تريفلورواستيك (TFA، 200 ملغ)، في أنبوب طرد مركزي وزنها سابقا 50 مل التي يمكن أن تقف تجميد التجفيف ويحرك يدويا بين عشية وضحاها للحصول على حل واضح.
- تجميد الحل في -80 درجة مئوية لمدة 1 ساعة وتجميد الجافة هيدروكلوريد الببتيد الناتجة.
ملاحظة: تحقق ما إذا كان الوزن النهائي يتوافق مع القيمة النظرية. - جعل حل C6-pBAE (0.031 مليمول) في ثنائي ميثيل كبريتسيد. أيضا، جعل حل هيدروكلوريد الببتيد (0.078 مليمول) في ثنائي ميثيل كبريتسيد.
- مزيج الحلين في أنبوب غطاء المسمار والمسمار على الغطاء. يحرك محلول الخليط في حمام مائي مع درجة حرارة مسيطر عليها من 25 درجة مئوية لمدة 20 ساعة مع شريط تحريك مغناطيسي.
- إضافة الخليط إلى 7:3 (v/v) ديثيل الأثير / الأسيتون. الطرد المركزي تعليق الناتجة في 25،000 × ز في 4 درجة مئوية لإزالة المذيبات. بعد ذلك، اغسل المادة الصلبة مع 7:3 (v/v) ديثيل الأثير / الأسيتون مرتين. ثم، وتجفيف المنتج تحت فراغ (<0.2 أجهزة الصراف الآلي).
- جعل حل من 100 ملغ / مل من المنتج في ثنائي ميثيل سلفوإكسيد. المنتج الناتج يدعى C6-الببتيد-pBAE. من الضروري التحقق من صحة بنية البوليمر الذي تم الحصول عليه من خلال 1H-NMR لتأكيد اختفاء إشارات الأوليفين المرتبطة بالأكريلات الطرفية. إذا لم يتم استخدامه، يمكن تجميد البوليمر عند -20 درجة مئوية.
2. تشكيل متعدد الضفيرات
ملاحظة: يجب أن يتم تنفيذ جميع الإجراءات داخل غرفة مكيفة للحفاظ على درجة حرارة ثابتة.
- إذابة البوليمرات C6-الببتيد-pBAE ودوامة الحل.
- Pipette البوليمر خلط صعودا وهبوطا وإعداد حل من 12.5 mM (V1) في خلات الصوديوم (NaAc). ثم دوامة الخليط وانتظر لمدة 10 دقيقة.
- إعداد مرنا في 0.5 ملغ / مل ومزيج عن طريق pipetting (V2).
ملاحظة: من المهم تجنب الدوامة في مرنا. - دوامة خليط البوليمر في التركيز النهائي لتحقيق حل متجانس بين مخزون البوليمر في DMSO وخلات العازلة.
ملاحظة: يعتمد تركيز البوليمر النهائي على نسبة N/P (مجموعات النيتروجين إلى الفوسفات) المحددة. تعتمد نسبة N/P على كل مرنا محدد لاستخدامه. لتغليف eGFP، على سبيل المثال، تم استخدام نسبة 25:1، كما ذكرت سابقا14. - مزيج من محلول المواد الوراثية والحل C6-الببتيدبيبا (25x من تركيز مرنا) في نسبة 1:1 (Vi = V1 + V2).
ملاحظة: يتم تحميل C6-الببتيد-pBAE في أنبوب الطرد المركزي الدقيق حيث يتم إضافة مرنا عن طريق الأنابيب صعودا وهبوطا لخلط. وبمجرد إعدادها، يتم تخفيف تركيزات البوليبلك وحمض النيوكليك وتركيزات C6-الببتيد-pBAE نصف المخففة. - احتضان في 25 درجة مئوية لمدة 30 دقيقة في كتلة حرارية. عجل مع 1:2 RNase المياه الحرة عن طريق إضافة العينة إلى أنبوب الطرد المركزي قبل تحميلها مع الماء.
- وتشمل الإكسيبات. إضافة نفس حجم خليط من مرنا وpBAE (Vi)في HEPES 20 mM والسكروز 4٪ عن طريق الأنابيب صعودا وهبوطا. عند هذه النقطة، تم تخفيف العينة 3x.
3. بوليبلس الليتوفيلية
- على الفور، تجميد في -80 درجة مئوية الفريزر من محلول polyplex السابقة لمدة 1 ساعة.
- إجراء التجفيف الأولي باتباع الخطوات التالية: (1) 1 ساعة عند -60 درجة مئوية و0.001 hPa؛ (1) 1 ساعة في -60 درجة مئوية و0.001 hPa؛ (1) 1 ساعة في 1000 ساعة؛ (2) 1 ساعة في 100 ساعة مئوية و0.001 ساعة؛ (2) 1 (2) ساعة واحدة عند -40 درجة مئوية و0.0001 ساعة؛ (3) 4 ساعة عند -20 درجة مئوية و0.0001 hPa؛ (4) 12 ساعة عند 5 درجات مئوية و0.0001 hPa.
- يخزن عند -20 درجة مئوية على الفور لتجنب الإماهة حتى الاستخدام.
4. إعادة الإنفاق متعدد الأطراف
ملاحظة: يصف هذا البروتوكول العملية المستخدمة لإعادة بناء الجسيمات النانوية C6-peptide-pBAE الليسفيلية لاستخدامها بشكل أكبر إما لتوصيفها أو في المختبر أو في تحليل الجسم الحي.
- خذ الجسيمات النانوية الليوفيلية من -20 درجة مئوية فقط في لحظة الاستخدام وأضف بسرعة الكمية المقابلة من مياه الديجينوجين (DEPC) لإعادة ظهور الصلبة لتحقيق التركيز المطلوب.
ملاحظة: سيكون الحجم هو نفس الحجم الأولي للجسيمات النانوية إذا كان التركيز نفسه متوخى، ولكن سيتم الإشارة إليه لكل تجربة. - ماصة بلطف حتى إعادة الإنفاق الكلي، يرافق السائل مع ماصة.
ملاحظة: تأكد من عدم وجود مواد على جدار القارورة. - مرة واحدة حلها، ماصة صعودا وهبوطا بقوة، وتجنب فقاعات.
ملاحظة: ينبغي أن يكون للعينة جانب شفاف وشفاف، وهو أكثر وضوحا عند التركيزات الأعلى - تخزين العينات على الجليد أو في 4 درجة مئوية لمدة أقصاها 24 ساعة مرة واحدة إعادة تشكيلها. تجنب التجميد.
5. توصيف متعدد الضفيرة
- تشتت الضوء الديناميكي
ملاحظة: تم قياس القطر الهيدروديناميكي (نانومتر) ومؤشر تعدد التشتت (PDI) وشحنة السطح للجسيمات النانوية عند 25 درجة مئوية وطول موجي ليزر 633 نانومتر وكاشف إشارة 173 درجة ، باستخدام محلل Zeta المحتمل (انظر جدول المواد).- القطر الهيدروديناميكي (نانومتر)
- إعداد الجسيمات النانوية خلط مرنا وpBAE جيدا عن طريق pipetting المواد الجينية إلى كسر البوليمر إلى تركيز نهائي من مرنا من 0.25 ملغم / مل كما هو موضح سابقا أعلاه (الخطوة 2).
- شطف قبل microcuvette مع وسائل الإعلام المخفف تصفيتها لتنظيف تماما من الشوائب. ثم، ملء cuvette مع ما لا يقل عن 50 ميكرولتر من الحل عينة وسقف عليه. بعد ذلك، أدخل العينة داخل أداة DLS، تأكد من إدراج الخلية بشكل صحيح.
ملاحظة: يتم تصفية وسائط التخفيف باستخدام فلتر حقنة 0.22 ميكرومتر. - افتح ملف إجراء العملية القياسية (SOP) إنشاء وتقديم اسم نموذجالمطلوب . حدد قياس الحجم.
ملاحظة: يتم توفير كافة المعلمات لإنشاء SOP لقياسات الحجم في الجدول 1. - تشغيل قياس حجم الجسيمات باستخدام DLS بالنقر على تشغيل.
ملاحظة: بعد أصوات الصفارة الثلاثية، اكتمال التحليل. - حدد النتائج المقابلة للعينة في ورقة القياس للحصول على متوسط حجم الجسيمات ومتوسط PDI والانحراف المعياري والرسومات. بمجرد الانتهاء، قم بإزالة الخلية من معدات DLS.
- إزالة العينة، والاحتفاظ بها لتحليل زيتا المحتملة، وتنظيف وشطف الخلية مع الماء deionized. وأخيرا، جفف الكوفيت النظيف تحت تيار غاز الهواء المضغوط.
- الشحن السطحي (mV)
- إعداد الجسيمات النانوية خلط مرنا وpBAE بدقة عن طريق pipetting المواد الجينية إلى كسر البوليمر إلى تركيز نهائي من مرنا من 0.25 ملغ / مل كما هو موضح سابقا أعلاه (الخطوة 2، تشكيل Polyplex). بعد ذلك، تجميد وتجفيف الحل.
ملاحظة: في هذه الحالة، لقياس الشحنة السطحية، ينصح بشدة بتجميد جفاف العينة قبل تنفيذ التدابير لإعادة عرض العينة في المخزن المؤقت المناسب، ومحاكاة ظروف الجسم من درجة الحموضة وتركيز المنحل بالكهرباء. - إعادة إنفاق العينة الليوفيلية باستخدام الماء. تمييع العينة 1/10 في الماء (التركيز النهائي 0.025 ملغم / مل).
- شطف مسبق لخلية شعرية مطوية يمكن التخلص منها (زيتا cuvette المحتملة) مع وسائل الإعلام المخففة المصفاة لتنظيفها تماما من الشوائب. ثم، ملء cuvette مع الجسيمات النانوية المخففة، وذلك باستخدام حقنة 1 مل، وسقف كلا الجانبين من الحشو.
ملاحظة: تشتت الجسيمات النانوية لديه لملء حجم المتاحة في cuvette (~ 1 مل)، مع إيلاء اهتمام خاص لتشكيل فقاعة، والتي يمكن أن تزعج التدابير. - إدخال العينة داخل DLS; تأكد من إدراج الخلية بشكل صحيح.
- فتح ملف SOP التي تم إنشاؤها للتحليل المحتمل zeta وتقديم اسم العينةالمطلوبة . حدد Zeta-المحتملة القياس.
ملاحظة: معلمات لإنشاء SOP للقياسات المحتملة زيتا يتم إعطاء في الجدول 2. - تشغيل قياس زيتا المحتملة باستخدام DLS عن طريق النقر على اللعب.
ملاحظة: بعد صوت زمارة الثلاثي، اكتمال التحليل. - حدد النتائج المقابلة للعينة في ورقة القياس للحصول على متوسط zeta المحتملة والانحراف المعياري والرسومات. بمجرد الانتهاء، قم بإزالة الخلية من معدات DLS.
- إزالة العينة والاحتفاظ بها إذا لزم الأمر. بعد ذلك، تنظيف وشطف الخلية cuvette مع الماء deionized، تليها الإيثانول والماء مرة أخرى. وأخيرا، جفف الكوفيت النظيف تحت تيار غاز الهواء المضغوط.
ملاحظة: لتحليل البيانات، استخدم البرنامج الموصى به.
- إعداد الجسيمات النانوية خلط مرنا وpBAE بدقة عن طريق pipetting المواد الجينية إلى كسر البوليمر إلى تركيز نهائي من مرنا من 0.25 ملغ / مل كما هو موضح سابقا أعلاه (الخطوة 2، تشكيل Polyplex). بعد ذلك، تجميد وتجفيف الحل.
- القطر الهيدروديناميكي (نانومتر)
- تحليل تتبع الجسيمات النانوية (NTA)
ملاحظة: تم قياس القطر الهيدروديناميكي (نانومتر) وتركيز الجسيمات النانوية عند الطول الموجي الليزري 25 درجة مئوية، 488 نانومتر باستخدام محلل تتبع الجسيمات النانوية (انظر جدول المواد).- NTA وإعداد العينة
- قم بتشغيل الكمبيوتر والمعدات. أولا، تحقق ما إذا كانت كافة المكونات موصولة بشكل صحيح. بعد ذلك، افتح البرنامج الموصى به. سيتحقق البرنامج مما إذا كانت جميع الملحقات متصلة بشكل صحيح.
- قم بتوصيل اللوحة العلوية، هنا، الخلية O-ring، في وحدة الليزر.
ملاحظة: لا تبالغ في هذا الجزء. - أولا تحميل الغرفة مع العازلة و / أو المياه deionized مع حقنة 1 مل. كرر الإجراء مرتين على الأقل. تجنب إدخال فقاعات في الغرفة.
- إعداد العينة عن طريق تخفيف 1/1000 في الماء deionized من التركيز المستخدم في قياس حجم DLS. إعداد ما لا يقل عن 1 مل وتحميله في حقنة 1 مل، وتجنب إدخال فقاعات.
- تحميل العينات في الغرفة باستخدام حقنة. ثم قم بتوصيل وحدة الليزر في غرفة NTA الكبيرة.
ملاحظة: تشير الغرفة الكبيرة إلى المساحة التي يتم فيها وضع الغرفة للقياس.
- تحسين الصورة
- أولا، في الأجهزة،تحقق ما إذا تم تحديد الكاميرا والليزر المناسب.
ملاحظة: هنا، هناك كاميرا واحدة فقط والليزر الأزرق 488 نانومتر. - ابدأ بمستوى الكاميرا عند 0 واضغط على بدء الكاميرا في نافذة الالتقاط.
ملاحظة: عند هذه النقطة، ضبط المعلمات التالية. موضع الحزمة (يمكن تحريكه لأعلى ولأعلى على الشاشة). مستوى الكاميرا: تجنب البكسلات المشبعة. التركيز (العجلة الجانبية):حاول التركيز على أفضل وجه ممكن. فمن الأفضل أن يكون الجسيمات مع هالة بدلا من الجسيمات غير المركزة. التركيز: ضبط التركيز ليكون بين 10 إلى 100 جسيم لكل حقل.
- أولا، في الأجهزة،تحقق ما إذا تم تحديد الكاميرا والليزر المناسب.
- تسجيل الفيديو
- في البرنامج، انتقل إلى تحديد القياس- نافذة SOP (أسفل اليسار) وحدد القياس القياسي.
ملاحظة: برنامج لتنفيذ ثلاثة مقاييس من 30 s لكل (لتمكين البرنامج من تنفيذ حسابات الانحراف المعياري والمتوسط). توفير اسم ومسار مجلد (على اسم الملف الأساسي) لحفظ سجلات العينة. عند إعداد معلمات SOP بشكل صحيح، اضغط على إنشاء وتشغيل البرنامج النصي. بمجرد قياس النسخ المتماثل الأول، سيطلب البرنامج إضافة عينة جديدة. ثم، يجب إدخال جزء آخر من العينة في الغرفة عن طريق دفع المكبس المحقنة. وأخيرا، كرر مرة ثالثة لتحليل النسخ المتماثل الثالث.
- في البرنامج، انتقل إلى تحديد القياس- نافذة SOP (أسفل اليسار) وحدد القياس القياسي.
- معالجة الفيديو
- إعادة ضبط عتبة كسب الشاشة والكشف عنها بمجرد الانتهاء من التدابير الثلاثة لتحليل الجسيمات المقاسة. في هذه اللحظة، يجب أن يظهر حوالي 100 جسيم في كل إطار لإجراء التحليل (من المتوقع ظهور الصلبان الحمراء العالية والصلبان الزرقاء المنخفضة).
- تصدير النتائج في ملف pdf بعد اكتمال التحليل. بالإضافة إلى ذلك ، من الممكن تصدير ملفات الفيديو والتفوق.
- تنظيف NTA
ملاحظة: إغلاق كافة القياسات المفتوحة قبل دراسة العينة التالية; نظرا لأن الملفات التي تم إنشاؤها هائلة واعتمادا على الكمبيوتر ، فليس من السهل الحفاظ على أكثر من ملف مفتوح.- تنظيف غرفة NTA عن طريق التنظيف المتكرر للمياه قبل إجراء القياس اللاحق حتى لا يلاحظ وجود جزيئات؛ بعد ذلك، مسح المخزن المؤقت المستخدم (PBS) لمتابعة مع التدابير.
- تدفق الهواء داخل الغرفة وتجفيفه بورق الصف المجهري بمجرد الانتهاء من القياس الأخير من اليوم.
- تميز حجم وشكل بواسطة الإرسال المجهر الإلكتروني (TEM). إعداد العينات. 30 ميكرولتر من الحجم النهائي يكفي لتوصيف TEM.
ملاحظة: يمكن قياس كل من الطازجة والليوفيليا - بعد إعادة الإنفاق- الجسيمات النانوية. - إسقاط 10 ميكرولتر من العينة على شبكة النحاس المغلفة بالكربون. دعه يجف لمدة 10 دقائق. قم بإزالة السائل الزائد، إذا لزم الأمر، عن طريق النقر بهدوء على ورق الفلتر.
- إسقاط 10 ميكرولتر من خلات أورانيل (2٪ ث / v) حل لتلطيخ السلبية. اتركه يجف لمدة دقيقة واحدة. قم بإزالة الفائض السائل، إذا لزم الأمر، عن طريق النقر بهدوء على ورق التصفية.
- أدخل العينة في المجهر والمسح الضوئي (عملية الجهد 80 كيلو فولت).
ملاحظة: يمكن استخدام البرامج المناسبة لإجراء مزيد من التحليل للصور.
- NTA وإعداد العينة
- كفاءة التغليف
- إعداد العينة
- إعداد الجسيمات النانوية في التركيز المطلوب وتجميد وتجفيفها. ثم، إعادة إنفاق الجسيمات النانوية وتمييعها بتركيز نهائي قدره 6 ميكروغرام/مل.
- قم بإعداد مخزن TE المؤقت 1x من حل المخزون 20x.
ملاحظة: Vt (إجمالي الحجم) = (عدد العينات × 100 ميكرولتر × 4) (عدد العينات × 290 ميكرولتر) + 2 مل. - إعداد العازلة TE مع 3 ميكروغرام / ميكرولتر من الهيبارين من المخزون من 100 ميكروغرام / ميكرولتر.
ملاحظة: Vt = عدد العينات × 50 ميكرولتر × 2. - إعداد المعايير
- إعداد معيار الحمض النووي الريبي تتراوح بين 0.2 ميكروغرام / مل إلى 0.025 ميكروغرام / مل في 1x تريس EDTA (TE) العازلة (الجدول S1A).
ملاحظة: استخدام مرنا في RNA القياسية في حالة التي تختلف عن الحمض النووي الريبي ريبوسومال. - إعداد RNA:pBAE القياسية مع الهيبارين (الجدول S1B). إعداد معيار الهيبارين (الجدول S1C).
- إعداد لوحة 96 جيدا على النحو التالي.
- تحميل 295 ميكرولتر من العازلة TE في الممر الأول من لوحة 96 جيدا (والعديد من الآبار وعينات لتحليل). ثم قم بتحميل 50 ميكرولتر من 1x TE العازلة في الممرات B و C (التكرارات لكل عينة).
- تحميل 50 ميكرولتر من 1x TBE العازلة مع 3 ميكروغرام / ميكرولتر من الهيبارين في حارات D و E (مكررة لكل عينة). بعد ذلك، قم بتحميل 100 ميكرولتر من كل معيار في الممرات F و G و H (التكرارات لكل معيار).
- تحميل 5 ميكرولتر من كل عينة في حارة A (التركيز في كل بئر هو 0.1 ميكروغرام / مل). مزيج بشكل صحيح عن طريق pipetting وتحميل 50 ميكرولتر من كل عينة على الآبار الأربعة أدناه (اثنان منهم يحتوي على 50 ميكروغرام من العازلة 1x TE واثنين آخرين تحتوي على 1x TE العازلة مع 3 ميكروغرام / ميكرولتر من الهيبارين).
- احتضان العينة لمدة 30 دقيقة عند 37 درجة مئوية. إعداد كاشف ريبوغرين وفقا لبروتوكول الشركة المصنعة (انظر جدول المواد)في 1x TE العازلة.
ملاحظة: تمييع 1:200 ودوامة. حماية من الضوء. Vt = عدد الآبار الكاملة × 100 ميكرولتر. - تحميل 100 ميكرولتر من الحل RiboGreen في كل بئر. الكشف عن الفلورسينس باستخدام قارئ microplate مع الطول الموجي الإثارة من 500 نانومتر وطول موجي انبعاث 525 نانومتر.
- تحليل النتائج
- إعداد منحنيات المعايرة الثلاثة
ملاحظة: أولا، معيار الحمض النووي الريبي ريبوسومال. الاستيفاء في هذا منحنى المعايرة العينات التي لا تحتوي على الهيبارين. ثانيا، ميرنا: pBAE مع الهيبارين. الاستيفاء في منحنى المعايرة هذا العينة التي لديها الهيبارين. ثالثا، (هيبارين). تستخدم لضمان تركيز العمل في النطاق الخطي. - حساب كفاءة التغليف (EE٪) على النحو التالي:
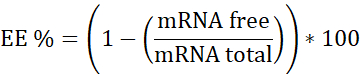
- إعداد منحنيات المعايرة الثلاثة
- إعداد العينة
6. في المختبر توصيف
- مضان المجهر للتقييم النوعي
- ضع لوحة 96 جيدا على المجهر بعد 24 ساعة من العدوى. بدء تصور الخلايا مع الهدف 10x.
ملاحظة: يتم استخدام خلايا HeLa في هذه الحالة. يتم ترجمة الخلايا باستخدام وضع الإرسال (حقل ساطع)، ويجب ضبط التركيز في هذا الوقت.- أولا، تطبيق توازن اللون الأبيض للإشارة إلى البرنامج حول خلفية العينات. ثم، الحصول على صورة لتراكب مع صورة مضان أثناء التحليل.
- تغيير وضع المجهر إلى وضع انعكاس (مضان) ونقل عجلة التصفية إلى الليزر الأزرق (488 نانومتر) لتصور eGFP.
ملاحظة: عند هذه النقطة، يجب تعديل وقت التعرض وكسب. يجب تعديل الربح في القيم بين 3 و 5 لتجنب القطع الأثرية والفائض على إشارة الخلفية. يعتمد تعديل وقت التعرض على كفاءة العدوى (من ms إلى 1 s). - الحصول على صور لجميع الشروط أو الآبار التي تستخدم نفس الوقت التعرض لمقارنة جميع العينات.
- ضع لوحة 96 جيدا على المجهر بعد 24 ساعة من العدوى. بدء تصور الخلايا مع الهدف 10x.
- قياس التدفق الخلوي (FC) للتقييم الكمي
- استخدم ماصة متعددة القنوات لإعداد لوحة 96 بئرا لتجربة قياس التدفق الخلوي.
ملاحظة: عند العمل مع خلايا شبه المنضمة، كما هو الحال في خط الخلية JAWSII، استرداد كافة حجم الوسائط وتخزينها في لوحة أخرى 96-well. لا تطمح إلى هذه الوسائط لأنها قد تحتوي على عدد كبير من الخلايا المصابة. - تنظيف الخلايا (وتستخدم خلايا هيلا هنا) مع 100 ميكرولتر / بئر من برنامج تلفزيوني 1x وتطمح إليها. بعد ذلك، أضف 25 ميكرولتر/بئر من التريبسين واحتضنه عند 37 درجة مئوية لمدة 5 دقائق.
- بمجرد فصل الخلايا، إضافة الوسائط المستردة سابقا لوقف عمل التريبسين وإصلاح الخلايا، مضيفا 31.25 ميكرولتر / بئر من الفورمالين 10٪ لمدة 20 دقيقة (التركيز النهائي 2.5٪).
ملاحظة: في هذه المرحلة، من المهم تصور حالة الخلايا عن طريق المجهر لضمان انفصال الخلايا. فمن المستحسن للغاية أن ماصة صعودا وهبوطا عدة مرات لمساعدة الخلايا فصل وتجنب التكتل. وهذا سوف يؤدي إلى نتيجة موثوق بها. - قم بتشغيل مقياس التدفق الخلوي والبرنامج. في البرنامج، قم بإعداد الشروط المناسبة للتجربة (نوع اللوحة وحجم العينة والمعلمات الأخرى مثل الاهتزاز والشطف بين العينات.
ملاحظة: بالنسبة للخطوة 6.2.5، يجب أن يكون معدل التدفق 120 ميكرولتر/دقيقة. تخلط دورة واحدة كل 1 دقيقة وشطف دورة واحدة كل واحد جيدا. خلط أمر ضروري للحفاظ على الخلايا المنتشرة في وسائل الإعلام والسماح لتحليل أفضل للخلايا الفردية. بالإضافة إلى ذلك ، الشطف ضروري لتنظيف microfluidics من السيتومتر بين العينات. وأخيرا، تحقق ما إذا كان هناك ما يكفي من المخازن المؤقتة وما إذا كانت كافة المكونات متصلة بشكل صحيح. - إعداد المعلمات المناسبة لتحديد نسبة الخلايا المصابة بشكل إيجابي.
- أولا، عرض بيانات التدفق على (ضوء مبعثر إلى الأمام) FSC مقابل SCC (الجانب المتناثرة ضوء) مؤامرة مبعثرة لتمييز الخلايا من الحطام. ثم، يتم رسم مؤامرة مبعثرة أخرى تقارن السعة (FSC-A) مقابل الارتفاع (FSC-H) لبوابة الخلايا الفردية والتمييز بينها.
ملاحظة: يسمح السكان غير المعالجة لبوابة السكان المقابلة للخلايا المصابة بشكل إيجابي. ثم يتم إجراء القياس الكمي للخلايا المصابة بشكل إيجابي على القناة المناسبة على مؤامرة المدرج التكراري. لذلك، يجب تمثيل الخلايا المصابة إيجابيا كسلسلة متصلة من الأحداث على المدرج التكراري.
- أولا، عرض بيانات التدفق على (ضوء مبعثر إلى الأمام) FSC مقابل SCC (الجانب المتناثرة ضوء) مؤامرة مبعثرة لتمييز الخلايا من الحطام. ثم، يتم رسم مؤامرة مبعثرة أخرى تقارن السعة (FSC-A) مقابل الارتفاع (FSC-H) لبوابة الخلايا الفردية والتمييز بينها.
- استخدم ماصة متعددة القنوات لإعداد لوحة 96 بئرا لتجربة قياس التدفق الخلوي.
7. في المختبر اختبارات الأداء الوظيفي: القدرة على تنشيط نموذج الخلايا المناعية باستخدام ovalbumin (OVA) كنموذج مضاد للجين مرنا
- لوحة 10،000 الخلايا / جيدا (وتستخدم خلايا JAWSII هنا) في لوحة 96 جيدا في اليوم السابق لالعاب.
ملاحظة: لوحة كما العديد من الآبار كما هو مطلوب أن يكون ثلاثة نسخ لكل شرط. دع الخلايا تعلق على اللوحة على الأقل لمدة 12 ساعة (ينصح باحتضان ليلي). - إعداد pBAEs NPs كما هو موضح في الملاحظة أدناه إلى 0.6 ميكروجرام مرنا لكل بئر.
ملاحظة: كعنصر تحكم موجب، تحويل الخلايا باستخدام كاشف إصابة. هنا، استخدمنا 0.1 ميكروغرام مرنا لكل بئر و0.25 ميكرولتر من كاشف العدوى لكل بئر. تم شراء mRNA التدوين لOVA (انظر جدول المواد). وهو متعدد الأضلاع ، تم تعديله باستخدام 5-methoxyuridine ، وتم تحسينه لأنظمة الثدييات ، وهو محمي من خلال وضع حد أقصى مع هيكل Cap1 ، وهي طريقة مملوكة من المورد. - احتضان لوحة 96 بئر لمدة 24 ساعة في حاضنة الهواء الجاف في 37 درجة مئوية و 5٪ CO2.
ملاحظة: بعد هذا الوقت، لا تطمح الوسائط لأنه قد يحتوي على عدد معين من الخلايا. استعادة الخلايا وحفظها في بئر آخر أو لوحة. - غسل الخلايا المتبقية على البئر مع 25 ميكرولتر من برنامج تلفزيوني 1x. بعد ذلك، تطمح إلى ذلك وإضافة 25 ميكرولتر من التريبسين واحتضان لوحة لمدة 5 دقائق في 37 درجة مئوية لفصل الخلايا. وقف رد فعل تريبسين عن طريق إضافة وسائل الإعلام التي تم استردادها سابقا على المراسل بشكل جيد.
- طرد مركزي لوحة في 400 × ز لمدة 5 دقائق في 4 درجة مئوية. أطمح إلى وسائل الإعلام. إضافة 50 ميكرولتر / بئر من برنامج تلفزيوني 1x و 2.5٪ من الفورمالين. احتضانه في 4 درجة مئوية لمدة 20 دقيقة لإصلاح الخلايا.
- كرر الخطوتين 7.5 و7.5.1. ثم، إضافة 50 ميكرولتر / بئر من برنامج تلفزيوني 1x و 3٪ BSA (حظر العازلة) واحتضان لمدة 30 دقيقة في 4 درجة مئوية. مرة أخرى، كرر الخطوتين 7.5 و 7.5.1، ثم أضف 50 ميكرولتر/بئر من الجسم المضاد الأساسي (الماوس α-OVA) في برنامج تلفزيوني 1x و3٪ BSA واحتضان لمدة 30 دقيقة عند 4 درجات مئوية.
- كرر الخطوتين 7.5 و 7.5.1، ثم اغسل الخلايا ب 50 ميكرولتر/بئر من 1x PBS. أسباير وسائل الإعلام ، ومن ثم إضافة حل الأجسام المضادة الثانوية (α الماوس - AlexaFluor488 / PerCP وCy5.5 - CD11b / APC - CD86) في برنامج تلفزيوني 1x و 3 ٪ جيش الشعب الفلسطيني. احتضنه لمدة ساعة واحدة عند 4 درجات مئوية.
- طرد مركزي لوحة في 400 × ز لمدة 5 دقائق. ثم، وغسل الخلايا مع 50 ميكرولتر / بئر من برنامج تلفزيوني 1x. بعد ذلك ، جهاز الطرد المركزي (400 × ز لمدة 5 دقائق) ، يطمح ، ثم يعيد إنفاق الخلايا في 100 ميكرولتر / بئر من برنامج تلفزيوني 1x و 2.5٪ في شكلي.
- تحليله حسب قياس التدفق الخلوي، كما هو موضح أعلاه (الخطوة 6.2).
النتائج
تركيب البوليمر وتوصيفه
يتم إعطاء الإجراء توليف OM-pBAE في الشكل 2. وكما يبين الشكل 2 ألف، فإن الخطوة الأولى للحصول على OM-pBAE هي توليف C6-pBAE عن طريق إضافة الأمينات (1-hexylamine و 5-amino-1-pentanol، نسبة 1:1) إلى دياكريلات (1،4-البيوتانديول diacrylate). يتم تنفيذ رد الفعل هذا ع...
Discussion
بعد تفشي وباء كوفيد-19 في العام الماضي، تجلت أهمية اللقاحات من حيث مكافحة الأمراض المعدية كعنصر حاسم8. وقد مكنت الجهود التي بذلها العلماء في جميع أنحاء العالم من إطلاق العديد من اللقاحات إلى السوق. لأول مرة في التاريخ، أثبتت لقاحات مرنا نجاحها المفترض سابقا، وذلك بفضل تصميمها ?...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه ولا أي تضارب في المصالح.
Acknowledgements
يتم الاعتراف بالدعم المالي من MINECO/FEDER (منح SAF2015-64927-C2-2-R وRTI2018-094734-B-C22 وCOV20/01100). اعترفت CGF لها IQS زمالة الدكتوراه.
Materials
| Name | Company | Catalog Number | Comments |
| 1,4-butanediol diacrylate | Sigma Aldrich | 123048 | |
| 1-hexylamine | Sigma Aldrich | 219703 | |
| 5-amino-1-pentanol | Sigma Aldrich | 411744 | |
| Acetone | Panreac | 141007 | |
| CD11b antibody | BD | 550993 | |
| CD86 antibody | Bioligend | 105007 | |
| Chlor hydroxhyde | Panreac | 181023 | |
| Chloroform-d | Sigma Aldrich | 151823 | |
| Cys-His-His-His peptide | Ontores | Custom | |
| Cys-Lys-Lys-Lys peptide | Ontores | Custom | |
| D2O | Sigma Aldrich | 151882 | |
| DEPC reagent for Rnase free water | Sigma Aldrich | D5758 | This reagent is important to treat MilliQ water to remove any RNases of the buffers |
| Diethyl eter | Panreac | 212770 | |
| dimethyl sulfoxide | Sigma Aldrich | 276855 | |
| HEPES | Sigma Aldrich | H3375 | |
| mRNA EGFP | TriLink Technologies | L-7601 | |
| mRNA OVA | TriLink Technologies | L-7610 | |
| RiboGreen kit | ThermoFisher | R11490 | |
| sodium acetate | Sigma Aldrich | 71196 | |
| sucrose | Sigma Aldrich | S0389 | |
| Trifluoroacetic acid | Sigma Aldrich | 302031 | |
| Trypsin-EDTA | Fisher Scientific | 11570626 | |
| α-mouse AlexaFluor488 antibody | Abcam | Ab450105 | |
| Equipment | |||
| Nanoparticle Tracking Analyzer | Malvern Panalytical | NanoSight NS300 | |
| Nuclear Magnetic Ressonance Spectrometer | Varian | 400 MHz | |
| ZetaSizer | Malvern Panalytical | Nano ZS | For zeta potential and hydrodynamic size determination |
| Software | |||
| NanoSight NTA software | Malvern Panalytical | MAN0515-02-EN-00 | |
| NovoExpress Software | Agilent | Not specified | |
| ZetaSizer software | Malvern Panalytical | DTS Application | To analyze surface charge and hydrodynamic sizes |
References
- Chumakov, K., Benn, C. S., Aaby, P., Kottilil, S., Gallo, R. Can existing live vaccines prevent COVID-19. Science. 368 (6496), 1187-1188 (2020).
- Zhang, C., Maruggi, G., Shan, H., Li, J. Advances in mRNA vaccines for infectious diseases. Frontiers in Immunology. 10, 1-13 (2019).
- Wherry, E. J., Jaffee, E. M., Warren, N., D'Souza, G., Ribas, A. How did we get a COVID-19 vaccine in less than 1 year. Clinical Cancer Research. 27 (8), 2136-2138 (2021).
- Folegatti, P. M., et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. The Lancet. 396 (10249), 467-478 (2020).
- Geall, A. J., Mandl, C. W., Ulmer, J. B. RNA: The new revolution in nucleic acid vaccines. Seminars in Immunology. 25 (2), 152-159 (2013).
- Ulmer, J. B., Geall, A. J. Recent innovations in mRNA vaccines. Current Opinion in Immunology. 41, 18-22 (2016).
- Kranz, L. M., et al. Systemic RNA delivery to dendritic cells exploits antiviral defence for cancer immunotherapy. Nature. 534 (7607), 396-401 (2016).
- Milane, L., Amiji, M. Clinical approval of nanotechnology-based SARS-CoV-2 mRNA vaccines: impact on translational nanomedicine. Drug Delivery and Translational Research. 1 (4), 3 (2020).
- Green, J. J., Langer, R., Anderson, D. G. A combinatorial polymer library approach yields insight into nonviral gene delivery. Accounts of Chemical Research. 41 (6), 749-759 (2008).
- Guerrero-Cázares, H., et al. Biodegradable polymeric nanoparticles show high efficacy and specificity at DNA delivery to human glioblastoma in vitro and in vivo. ACS Nano. 8 (5), 5141-5153 (2014).
- Kozielski, K. L., Tzeng, S. Y., Hurtado De Mendoza, B. A., Green, J. J. Bioreducible cationic polymer-based nanoparticles for efficient and environmentally triggered cytoplasmic siRNA delivery to primary human brain cancer cells. ACS Nano. 8 (4), 3232-3241 (2014).
- Segovia, N., Dosta, P., Cascante, A., Ramos, V., Borrós, S. Oligopeptide-terminated poly(β-amino ester)s for highly efficient gene delivery and intracellular localization. Acta Biomaterialia. 10 (5), 2147-2158 (2014).
- Dosta, P., Segovia, N., Cascante, A., Ramos, V., Borrós, S. Surface charge tunability as a powerful strategy to control electrostatic interaction for high efficiency silencing, using tailored oligopeptide- modified poly (beta-amino ester)s (PBAEs). Acta Biomaterialia. 20, 82-93 (2015).
- Fornaguera, C., et al. mRNA delivery system for targeting antigen-presenting cells in vivo. Advanced Healthcare Materials. 7 (17), 180033 (2018).
- Fornaguera, C., Castells-Sala, C., Lázaro, M. &. #. 1. 9. 3. ;., Cascante, A., Borrós, S. Development of an optimized freeze-drying protocol for OM-PBAE nucleic acid polyplexes. International Journal Pharmaceutics. 569, (2019).
- Fornaguera, C., Solans, C. Analytical methods to characterize and purify polymeric nanoparticles. International Journal of Polymer Science. , (2018).
- Fornaguera, C., Solans, C. Characterization of polymeric nanoparticle dispersions for biomedical applications: size, surface charge and stability. Pharmaceutical Nanotechnology. 6 (3), 147-164 (2018).
- Sahin, U., Karikó, K., Türeci, &. #. 2. 1. 4. ;. MRNA-based therapeutics-developing a new class of drugs. Nature Reviews Drug Discovery. 13 (10), 759-780 (2014).
- Fan, Y. N., et al. Cationic lipid-assisted nanoparticles for delivery of mRNA cancer vaccine. Biomaterials Science. 6 (11), 3009-3018 (2018).
- Le Moignic, A., et al. Preclinical evaluation of mRNA trimannosylated lipopolyplexes as therapeutic cancer vaccines targeting dendritic cells. Journal of Controlled Release. 278, 110-121 (2018).
- Banerji, A., et al. mRNA vaccines to prevent COVID-19 disease and reported allergic reactions: Current evidence and approach. Journal of Allergy and Clinical Immunology: In Practice. 9 (4), 1423-1437 (2021).
- Kaczmarek, J. C., Kowalski, P. S., Anderson, D. G. Advances in the delivery of RNA therapeutics: from concept to clinical reality. Genome Medicine. 9 (1), 1-16 (2017).
- Dosta, P., et al. Delivery of anti-microRNA-712 to inflamed endothelial cells using poly(β-amino ester) nanoparticles conjugated with VCAM-1 targeting peptide. Advanced Healthcare Materials. , 1-11 (2021).
- Segovia, N., et al. Hydrogel doped with nanoparticles for local sustained release of siRNA in breast cancer. Advanced Healthcare Materials. 4 (2), 271-280 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved