このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヒト股関節の微細構造破壊機構のイメージング
要約
このプロトコルは、大容量のマイクロCTスキャン、カスタムメイドの圧縮ステージ、および高度な画像処理ツールを組み合わせることにより、近位ヒト大腿骨全体の骨微細構造の変形とその靭性の測定を可能にします。
要約
負荷が徐々に増加した状態で骨の微細構造をイメージングすることで、骨の微細構造の破壊挙動を観察することができます。ここでは、大腿骨頸部の臨床的に関連する骨折を引き起こす、徐々に増加する変形下で大腿骨近位部全体の一連の3次元微細構造画像を取得するためのプロトコルについて説明します。プロトコルは人口の骨のミネラル密度の下端の66-80歳の女性ドナーからの4つの大腿骨を使用して実証される(Tスコアの範囲= −2.09から−4.75)。マイクロコンピュータ断層撮影(マイクロCT)イメージング中に加えられた荷重を記録しながら、片足の姿勢を再現した標本に荷重を載せるために、放射線透過性の圧縮ステージが設計されました。視野は幅146mm、高さ132mmで、等方性画素サイズは0.03mmであった。力の増分は、破壊荷重の有限要素予測に基づいていました。圧縮段階を使用して、試験片に変位を適用し、所定の力増分を適用しました。大腿骨頸部の開口とせん断による亜柱頭骨折は、4〜5回の荷重増分後に発生しました。マイクロCT画像と反力測定値を処理して、骨のひずみとエネルギー吸収能力を調べました。皮質の不安定性は、初期のローディングステップで現れました。大腿骨頭の軟骨下骨は、骨折前に16%に達する大きな変形を示し、骨折まで支持能力が徐々に増加しました。変形エネルギーは、破壊までの変位とともに直線的に増加し、剛性は破壊直前にほぼゼロ値まで減少しました。破壊エネルギーの4分の3は、最後の25%の力増分中に試験片によって取得されました。結論として、開発されたプロトコルは、顕著なエネルギー吸収能力、または損傷耐性、および高齢のドナー年齢での皮質骨と海綿骨の間の相乗的相互作用を明らかにしました。
概要
大腿骨頸部の骨折は、高齢化社会にとって大きな負担となっています。マイクロコンピュータ断層撮影(マイクロCT)イメージングとそれに付随する機械的検査により、骨の微細構造を観察し、骨強度、加齢に伴う変化、および負荷下での変位との関係を研究することができます1,2。しかし、最近まで、負荷がかかった状態での骨のマイクロCT研究は、切除された骨芯3、小動物4、およびヒト脊椎ユニット5に限定されていました。本プロトコルは、荷重下および骨折後の近位ヒト大腿骨全体の微細構造の変位を定量化することができる。
人間の大腿骨の障害を調査するためにいくつかの研究が行われており、時には対照的な結論に達しています。例えば、皮質構造および海綿構造の加齢に伴う薄化は、骨の弾性不安定性を引き起こすことによって加齢に伴う骨折感受性を決定すると考えられており6,7、これは、弾性不安定性がないと仮定した場合の皮質緊張および大腿骨強度予測の高い決定係数(R2 = 0.80-0.97)8,9とは明らかに対照的である.それにもかかわらず、そのような研究は体系的に大腿骨の強度を過小評価しており(21%〜29%)、したがって、モデルで実装された脆性および準脆性骨応答に疑問を投げかけています8,10。これらの明らかに対照的な所見の1つの可能な説明は、孤立した骨コアと比較して骨全体の骨折挙動が異なることにある可能性があります。したがって、大腿骨近位部全体の骨微細構造の変形と骨折応答を観察することは、大腿骨骨折力学および関連するアプリケーションに関する知識を深める可能性があります。
マイクロメトリック分解能で人骨全体をイメージングする現在の方法は限られています。ガントリーと検出器のサイズは、ヒトの大腿骨近位部をホストするのに適した作業容積(約13 cm x 10 cm、幅 x 長さ)と、関連するマイクロアーキテクチャの特徴を確実に捕捉できるように、場合によっては0.02〜0.03 mmのオーダーのピクセルサイズを提供する必要があります11。これらの仕様は、現在、一部の放射光施設1と市販の大容量マイクロCTスキャナー12,13で満たすことができる。圧縮段階は、人間の大腿骨に骨折を引き起こすのに十分な力(例えば、高齢の白人女性の場合0.9 kNから14.3 kNの間)を発生させながら、X線の減衰を最小限に抑えるために、放射線透過性でなければなりません14。この大きな破壊荷重変動は、破砕する荷重ステップ数、全体的な実験時間、およびそれに対応する生成されるデータ量の計画を複雑にします。この問題に対処するために、臨床コンピュータ断層撮影(CT)画像からの標本の骨密度分布を使用して、有限要素モデリングによって破壊荷重と位置を推定できます1,2。最後に、実験後、生成された大量のデータを処理して、人間の大腿骨全体の故障メカニズムとエネルギー散逸能力を研究する必要があります。
ここでは、大腿骨頸部の臨床的に関連する骨折を引き起こす、徐々に増加する変形の下で大腿骨近位部全体の一連の3次元微細構造画像を取得するためのプロトコルについて説明します2。このプロトコルには、検体圧縮の段階的な増分の計画、カスタムの放射線透過性圧縮ステージ を介した ロード、大容量のマイクロCTスキャナー による イメージング、および画像とロードプロファイルの処理が含まれます。
プロトコル
このプロトコルは、献体プログラムから受け取った12の大腿骨標本で開発およびテストされました。標本は新鮮に採取し、フリンダース大学(オーストラリア、南オーストラリア州トンズリー)のバイオメカニクスおよびインプラント研究所で-20°Cで保存しました。骨の水分は実験全体を通して維持されました。ドナーは白人女性(66-80歳)であった。倫理クリアランスは、フリンダース大学の社会的および行動研究倫理委員会(SBREC)から取得されました(プロジェクト#6380)。
1. 試験片固有の荷重ステップ増分の計画
- 大腿骨標本を臨床用CTスキャナーを使用して、スライスの厚さと約0.5〜0.7mmの面内ピクセルサイズをターゲットにしてスキャンします。このステップは、公共の画像診断施設の専門の放射線技師が、骨の視覚化のために標準的な事前に記録された画像プロトコルを使用して完了することができます。
- 標本と一緒に、5つの既知の濃度のリン酸水素二カリウム(K2HPO4、等価密度範囲約59 mg∙cm-3〜375 mg∙cm-3)でCT濃度測定校正ファントムをスキャンします。
- 臨床CT画像15から骨形状をセグメント化し、骨のセグメント化された形状をメッシュ化し、Schileoらによって報告された密度と弾性率の関係を使用して、要素ごとに等方性材料特性を校正された骨密度値にマッピングします8。有限要素ソフトウェアでさらに解析するためにメッシュを保存します。セグメンテーションおよび有限要素ソフトウェアに付属する関連ガイドラインに従って、各ステップを完了します。
- メッシュを有限要素ソフトウェアにインポートします。モデルの3〜6mmの遠位端を完全に拘束します。冠状面の大腿骨軸軸から8°内転し、大腿骨頭の中心を通過する1,000Nの公称力を加えます。この負荷条件は、静的な片足スタンスタスク(orthoload.com)を模倣しています。
- 組み込みの PCG ソルバーを使用して有限要素モデルを解きます (収束許容誤差: 1 x 10-7)。
注:ここでは、有限要素法ソフトウェアANSYSを使用しました。- 次のコマンドを実行して、要素の重心における第 1 主ひずみ成分と第 3 主ひずみ成分を含む要素テーブルを生成します。
/投稿1
ETABLE、、EPTO1,1
ETABLE、、EPTO3,3 - 次のコマンドを実行して、モデル内の第1主ひずみ成分と第3主ひずみ成分の間のひずみ比と、引張(0.73%ひずみ)および圧縮(1.04%ひずみ)8 (図 1)における骨降伏ひずみを計算します。
SMULT、RFT、EPTO1、、1/0.0074、1、
SMULT、RFT、EPTO3、、1/0.0104,1、
- 次のコマンドを実行して、要素の重心における第 1 主ひずみ成分と第 3 主ひずみ成分を含む要素テーブルを生成します。
- 引張と圧縮の両方のピークひずみ比で公称力をスケーリングし、破壊荷重の推定値を得るために、2 つのうち最大のものを破棄します。荷重増分を、計算された破壊荷重 1 の1/4 として決定します。
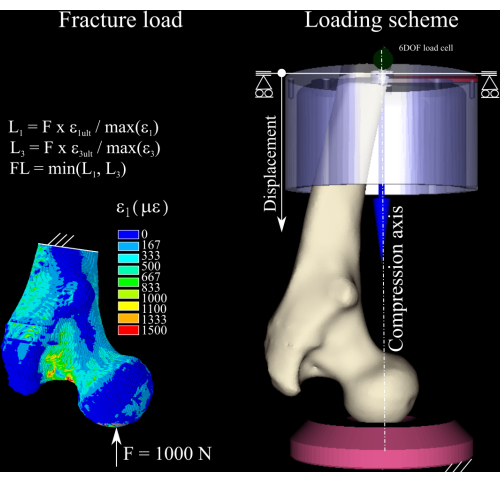
図1:破壊荷重の計算。 有限要素ひずみマップ、公称力を破壊荷重に変換するために使用される方程式(左)、大腿骨(中央右)、遠位アルミニウム(右上)カップ、ポリエチレン圧力ソケット(右下)を表示する荷重スキーム。 この図の拡大版をご覧になるには、ここをクリックしてください。
2.大腿骨標本アセンブリの準備(図2)
- 試料を冷凍庫(-20°C)から取り出します。
- 室温(RT)で24時間解凍し、検体を生理液に浸した吸収材で包んだ防水ビニール袋に入れたまま、骨の水分を保ちます。
- 大腿骨骨幹を近位大腿骨頭から180mmで切断します。
- 凹型のポリエチレン製圧力ソケット(図2D)と大腿骨頭を位置合わせすることにより、大腿骨頭をアライメントリグの垂直軸の中央に配置します。
- 大腿骨頸部と骨幹を含む平面を正面に合わせます(図2)。
- 骨幹軸を内転8°に回転させ、垂直軸が静的な片脚の立位時の股関節反力の向きを表すようにします(図2)。
- メーカーの指示に従って歯科用セメントを準備します。
- 深さ55mmのアルミ製ポッティングカップに試験片の遠位端をポットに入れ、アルミカップに歯科用セメントを充填します。セメントが硬化を完了するまで30分以上待ちます。
- 試験片アセンブリは-20°Cで保管してください。
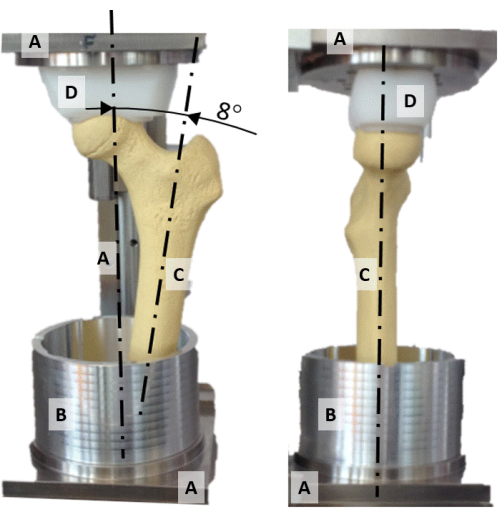
図2:アライメントリグ。 (A)フレーム、(B)アルミ製ポッティングカップ、(C)合成大腿骨モデル、(D)球形の圧力ソケットを表示したアライメントリグの正面(左)と側面(右)の写真。 この図の拡大版をご覧になるには、ここをクリックしてください。
3. 圧縮ステージの組み立て
注:圧縮ステージの外形寸法は、直径245mm、高さ576mm、重量14kg(サンプルを除く)です。圧縮ステージは、圧縮チャンバーとアクチュエーターの2つの主要部品で構成されており、次のように組み立てられています。
- 圧縮チャンバー
- ポリエチレン圧力ソケット(直径104 mm、高さ60 mm)をアルミニウムシリンダー(直径203 mm、肉厚3 mm)の下部に取り付け、一端(底面)を溶接アルミニウムプレートで閉じます。
- アクチュエータ
- ディスク、3本のロッド、三角板、垂直レールを使用して上部構造を組み立てます(図3)。
- スクリュージャッキ機構(ストローク:150mm、最大荷重:10,000N、ギヤ比:27:1、1回転当たり変位:0.148mm)を三角板に取り付けます。
- アンギュラアダプターをリニアレールに取り付けます。
- 低摩擦のx-yテーブルをアンギュラーアダプターに取り付けます。
- ロードセルのx-z平面を上部構造の正面に合わせ、6自由度ロードセル(最大測定誤差:0.005%、最大力:10,000 N、最大トルク:500 Nm)を低摩擦テーブルに取り付けます。
- アクチュエータのネジをアンギュラアダプターに接続します。

図3:カスタムメイドの放射線透過性圧縮ステージアセンブリ。 圧縮ステージの写真(左)と模型(右)。(A)圧縮室は、底部が閉じた厚さ3mmのアルミニウムシリンダーです。(b)上部構造を有するアクチュエータアセンブリと、(c)スクリュージャッキ機構と、(d)低摩擦x-yテーブル。(E)6軸ロードセルが表示され、モデルに表示されます。 この図の拡大版をご覧になるには、ここをクリックしてください。
4. 実験の設定
- 検体を生理液に浸した吸収材で包んだ防水ビニール袋に入れたまま、骨の水分を保ちながら、室温で24時間解凍します。
- アルミカップの試験片アセンブリをロードセルに取り付けるには、試験片アセンブリの正面をアクチュエータの正面に合わせます。
- 試験片を含む上部構造を圧縮チャンバーに組み立てます。大腿骨頭をポリエチレン圧力ソケットの球状の凹部に合わせるように注意してください。大腿骨頭がかみ合っているが、圧力ソケットの球形腔内で弛んでいることを確認します。
- 画像医用ビームライン(IMBL)のマイクロCTスキャナーの回転ステージに圧縮ステージを載せます。
- ロードセル(誤差<0.005%、最大力:10,000N、最大トルク:500Nm)をひずみ増幅器に接続します。
- ひずみ増幅器を、ロードセルに付属のアプリケーションソフトウェアを搭載したラップトップコンピュータにUSB 経由で 接続します。
- ラップトップのロードセルで測定された反力を監視しながら、試験片を圧力ソケットに向かって下方に動かすことにより、圧縮段階でスクリュー機構を作動させます。100 Nに等しい圧縮力が達成されたら、スクリュー機構を停止します。試験片を50 Nのプリロードでアンロードします。
- 単体pco.edgeセンサーレンズ結合型シンチレータ「Ruby」(http://archive.synchrotron.org.au/31-australian-synchrotron/imbl/811-preparation-for-imaging-experiments)を選択します。
- 視野を 76.31 mm x 64.39 mm に設定すると、2,560 ピクセル x 2,160 ピクセルの配列サイズで 29.81 μm のピクセル サイズになります。
- 回転ステージの軸を視野軸から8mm(水平)にすると(オフセットスキャンモード)、画素サイズ29.81μmで145.71mm×64.39mmに視野が広がります。
- スキャンパラメータを、ビームエネルギー60 keV、回転増分0.1°、180°回転のバッチ2バッチ(オフセットスキャン)、露光時間50 μs、回転位置ごとに2つのフレーム平均に設定します。
- スキャンボリュームの全高が132.2mmになり、合計スキャン時間が30分になるように、それぞれ26mmの垂直シフトで5つの連続した垂直スタックスキャンを取得するようにスキャンを設定します。
5. 微細構造イメージングを併用した機械的試験
- マイクロCT(画素サイズ:0.03mm)を基準条件(ゼロひずみ条件)で2回撮影します。
- スクリュージャッキ機構を1ラウンドあたり約1秒(0.1〜0.2 mm / s)の一定速度で手動で作動させて、力の増分を適用します。
- マイクロCTイメージングを実行します。
- ステップ5.2とステップ5.3を繰り返して、反力の急激な低下で示されるように、試験片の破壊を引き起こします。
- 破砕した標本のマイクロCTイメージングを行います。
- 1,800 個の投影画像 (サイズ 2,560 ピクセル x 896 ピクセル、幅 x 高さ 76.8 mm x 高さ、32 ビット浮動小数点画像) をステッチします。このプロセスでは、2 つの投影画像 (水平オフセット スキャン モードで撮影) と 5 つの垂直方向にシフトされた画像をつなぎ合わせ、1 つの投影画像を生成します。
- 断面画像 (4,407 枚の画像、各画像のサイズは 4,888 x 4,888 ピクセル) のボリュームを再構成し、32 ビット浮動小数点ファイルとして .TIFF形式(392GBのディスク容量を占有)。
- 3 x 3 ガウス フィルターを適用してノイズを低減します。画像を 8 ビットに変換します (256 グレーレベル画像、ビットマップ形式で保存、ボリュームあたり約 100 GB を占有)。
注:この作業では、IMBLのオペレーターの指導の下、オーストラリアのシンクロトロンで入手可能なソフトウェアを使用して画像の処理が行われました。
6. 変位場とひずみ場の計算
- 断面画像を 4 つ (120 μm/ピクセル) サブサンプリングして、計算時間を短縮します。
- 荷重がかかった試験片の画像と、無負荷の基準条件での試験片の画像を空間でしっかりと同時登録します。遠位骨幹を共同登録のターゲットとして使用します (補足ファイル 1 および 補足ファイル 2)。
- サーフェスの 3 次元モデル (.STLファイル)は、マイクロCT画像を2値化した後の可視化のために11.
- 50ピクセル(SDER = 0.076%ひずみ誤差、BoneDVC、https://bonedvc.insigneo.org/dvc/)に等しいグリッドサイズを使用して、画像ボリュームを参照ボリュームに弾性的に登録し、グリッドの節点での変位を決定します。
- グリッドを有限要素モデルに変換します。BoneDVCで計算した節点変位をモデルに適用します。モデルを解いて、骨体積全体のひずみテンソルを決定します。
- 最大ひずみレベルを示す領域で、フル解像度の画像を使用して解析を繰り返します。
- 関数 interp3 (Matlab)2 による 3 次内挿を使用して DVC ひずみマップをフル解像度イメージにマッピングします。
- 変位、ひずみ、微細構造のイメージを可視化して、大量の可視化とアニメーションを行う (Matlab)2.
7. 分析
- 骨の永久変形(損傷)を無負荷状態で得られた画像と骨折後の画像を重ね合わせて表示します2.
- 無負荷状態、荷重レベルの増加時、および骨折後の3次元モデルを重ね合わせることにより、骨の進行性の微細構造変形を表示します2。
- 骨折箇所2の骨のひずみを表示します。
- 変形エネルギー、剛性、変位を記述統計法と回帰法2を用いて解析します。
結果
画像には、大腿骨近位部全体、圧力ソケット、歯科用セメント、アルミカップ、およびラッピング組織が表示されます。骨のマイクロアーキテクチャは、骨折前と骨折後に荷重が増加するにつれて徐々に変形していることがわかります(図4)。

ディスカッション
本プロトコルは、股関節骨折の経過時間マイクロメカニクスをex vivoで3次元で研究することを可能にします。人間の大腿骨の近位部に漸進的な変形を加え、反力を測定できる放射線透過性(アルミニウム)圧縮ステージは、カスタム設計、製造、およびテストされています。このプロトコルでは、大容量のマイクロCTスキャナーが採用されており、大腿骨近位部全体をマイクロメトリック?...
開示事項
すべての著者は、利益相反がないことを宣言します。
謝辞
オーストラリア研究評議会(FT180100338;IC190100020)は感謝して認められます。
資料
| Name | Company | Catalog Number | Comments |
| Absorbent tissue | N/A | Maintain the bone moisture throughout the experiment | |
| Alignment rig | Custom-made | Rig for positioning the specimen in the potting cup | |
| Aluminium potting cup | Custom-made | Potting cup | |
| Bone saw | N/A | Cut the specimen to size | |
| Calibration phantom QCT Pro | Mindways Software, Inc., Austin, USA | CT Calibration 13002 | Calibrate grey levels in the images into equivalent bone mineral (ash) density levels |
| Clinical Computed-Tmography scanner | General Electric Medical Systems Co., Wisconsin, USA | Optima CT660 | Preliminary imaging for the prediction of the load step to fracture |
| Compressive stage | Custom-made | A 10 kg, radiotransparent compressive stage for applying and maintaining throught imaging a prescribed deformation to the specimen. | |
| Dental cement | Soesterberg, The Netherlands | Vertex RS | |
| Femur specimen | Science Care, Phoenix, USA | ||
| Finite-element analysis software | ANSYS Inc., Canonsburg, USA | ANSYS Mechanical APDL | Finite-element software package |
| Freezer | N/A | Store specimens at -20 °C | |
| Hard Drive | Dell | Disk space: 500 GB per volume | |
| Image bnarization and segmentation software | Skyscan-Bruker, Kontich, Belgium | CT analyzer | Image processing software |
| Image elastic segmentation | The University of Sheffield | Bone DVC | https://bonedvc.insigneo.org/dvc/ |
| Image processing and automation software | The MathWork Inc. | Matlab | Image processing software |
| Image registration software | Skyscan-Bruker, Kontich, Belgium | DataViewer | Image processing software |
| Image segmentation and FE modelling software | Simpleware, Exeter, UK | Scan IP | Bone egmentation software |
| Image stiching script | Australian syncrotron, Clayton, VIC, AU | The script is available at IMBL | |
| Image visualization | Kitware, Clifton Park, NY, USA | Paraview | Image visualization |
| Image visualization | Australian National University | Dristhi | Image visualization: doi:10.1117/12.935640 |
| Imaging and Medical beamline | Australian syncrotron, Clayton, VIC, AU | Large object micro-CT beamline at the Australian Synchrotron | |
| Laptop | Dell Inc., USA | ||
| Low-friction x-y table | THK Co., Tokyo, Japan | ||
| NI signal acquisition software | National Instruments, Austin, TX | NI-DAQmx | |
| Phosphate-buffered saline solution | Custom-made | Maintain the bone moisture throughout the experiment | |
| Plastic bag | N/A | Maintain the bone moisture throughout the experiment | |
| Rail | SKF Inc., Lansdale, PA, USA | ||
| Screw-jack mechanism | Benzlers, Örebro, Sweden | Serie BD (warm gear unit) | stroke: 150 mm, maximal load: 10,000 N, gear ratio: 27:1, a displacement per revolution: 0.148 mm |
| Single pco.edge sensor, lens coupled scintillator | Australian syncrotron, Clayton, VIC, AU | Detector Ruby FOV: 141 x 119 mm; 2560 x 2160 px; 55 µm/px; 50 fps | |
| Six axis load cell | ME-Meßsysteme GmbH, Hennigsdorf, GE | K6D6 | Maximal measurement error: 0.005%; maximal force: 10000 N; maximal torque: 500 Nm |
| Strain amplifier | ME-Meßsysteme GmbH, Hennigsdorf, GE | GSV-1A8USB K6D/M16 |
参考文献
- Martelli, S., Perilli, E. Time-elapsed synchrotron-light microstructural imaging of femoral neck fracture. Journal of the Mechanical Behavior of Biomedical Materials. 84, 265-272 (2018).
- Martelli, S., Giorgi, M., Dall' Ara, E., Perilli, E. Damage tolerance and toughness of elderly human femora. Acta Biomaterialia. 123, 167-177 (2021).
- Perilli, E., et al. Dependence of mechanical compressive strength on local variations in microarchitecture in cancellous bone of proximal human femur. Journal of Biomechanics. 41 (2), 438-446 (2008).
- Thurner, P. J., et al. Time-lapsed investigation of three-dimensional failure and damage accumulation in trabecular bone using synchrotron light. Bone. 39 (2), 289-299 (2006).
- Jackman, T. M. Quantitative, 3D visualization of the initiation and progression of vertebral fractures under compression and anterior flexion. Journal of Bone and Mineral Research. 31 (4), 777-788 (2016).
- Mayhew, P. M., et al. Relation between age, femoral neck cortical stability, and hip fracture risk. Lancet. 366 (9480), 129-135 (2005).
- Nazarian, A., Stauber, M., Zurakowski, D., Snyder, B. D., Müller, R. The interaction of microstructure and volume fraction in predicting failure in cancellous bone. Bone. 39 (6), 1196-1202 (2006).
- Schileo, E., et al. To what extent can linear finite element models of human femora predict failure under stance and fall loading configurations. Journal of Biomechanics. 47 (14), 3531-3538 (2014).
- Schileo, E., et al. An accurate estimation of bone density improves the accuracy of subject-specific finite element models. Journal of Biomechanics. 41 (11), 2483-2491 (2008).
- Dall'ara, E., et al. A nonlinear QCT-based finite element model validation study for the human femur tested in two configurations in vitro. Bone. 52 (1), 27-38 (2013).
- Perilli, E., Parkinson, I. H., Reynolds, K. J. Micro-CT examination of human bone: from biopsies towards the entire organ. Annali dell'Istituto Superiore di Sanità. 48 (1), 75-82 (2012).
- Wearne, L. S., Rapagna, S., Taylor, M., Perilli, E. Micro-CT scan optimisation for mechanical loading of tibia with titanium tibial tray: A digital volume correlation zero strain error analysis. Journal of the Mechanical Behavior of Biomedical Materials. 134, 105336 (2022).
- Bennett, K. J., et al. Ex vivo assessment of surgically repaired tibial plateau fracture displacement under axial load using large-volume micro-CT. Journal of Biomechanics. 144, 111275 (2022).
- Falcinelli, C., et al. Multiple loading conditions analysis can improve the association between finite element bone strength estimates and proximal femur fractures: A preliminary study in elderly women. Bone. 67, 71-80 (2014).
- Orthopedic Image Segmentation. Synopsys Available from: https://www.synopsys.com/simpleware/news-and-events/ortho-medical-image-segmentation.html (2020)
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved