È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Imaging del meccanismo di cedimento microstrutturale nell'anca umana
In questo articolo
Riepilogo
Il protocollo consente di misurare la deformazione della microstruttura ossea nell'intero femore umano prossimale e la sua tenacità combinando la scansione micro-TC di grandi volumi, uno stadio compressivo personalizzato e strumenti avanzati di elaborazione delle immagini.
Abstract
L'imaging della microstruttura ossea sotto carichi progressivamente crescenti consente di osservare il comportamento di cedimento microstrutturale dell'osso. In questo articolo descriviamo un protocollo per ottenere una sequenza di immagini microstrutturali tridimensionali dell'intero femore prossimale in deformazione progressivamente crescente, causando fratture clinicamente rilevanti del collo del femore. Il protocollo è stato dimostrato utilizzando quattro femori di donatrici di età compresa tra 66 e 80 anni all'estremità inferiore della densità minerale ossea nella popolazione (intervallo T-score = da -2,09 a -4,75). Uno stadio di compressione radiotrasparente è stato progettato per caricare i campioni replicando una posizione su una gamba, registrando al contempo il carico applicato durante l'imaging con tomografia microcomputerizzata (micro-CT). Il campo visivo era largo 146 mm e alto 132 mm, e la dimensione isotropa dei pixel era di 0,03 mm. L'incremento della forza si basava su previsioni agli elementi finiti del carico di frattura. La fase di compressione è stata utilizzata per applicare lo spostamento al provino e attuare gli incrementi di forza prescritti. Le fratture sub-capitali dovute all'apertura e al taglio del collo del femore si sono verificate dopo quattro o cinque incrementi di carico. Le immagini micro-TC e le misurazioni della forza di reazione sono state elaborate per studiare la deformazione ossea e la capacità di assorbimento dell'energia. L'instabilità della corteccia è apparsa nelle prime fasi di carico. L'osso subcondrale della testa del femore presentava grandi deformazioni che raggiungevano il 16% prima della frattura, e un progressivo aumento della capacità di sostegno fino alla frattura. L'energia di deformazione aumentava linearmente con lo spostamento fino alla frattura, mentre la rigidezza diminuiva a valori prossimi allo zero immediatamente prima della frattura. Tre quarti dell'energia di frattura sono stati prelevati dal provino durante l'incremento finale della forza del 25%. In conclusione, il protocollo sviluppato ha rivelato una notevole capacità di assorbimento dell'energia, o tolleranza al danno, e un'interazione sinergica tra l'osso corticale e quello trabecolare in età avanzata del donatore.
Introduzione
Le fratture del collo del femore sono un onere importante per la popolazione anziana. L'imaging con tomografia microcomputerizzata (micro-TC) e i conseguenti test meccanici consentono di osservare la microstruttura ossea e di studiarne la relazione con la resistenza ossea, i cambiamenti legati all'età e gli spostamenti sotto carico 1,2. Tuttavia, fino a poco tempo fa, gli studi di micro-TC dell'osso sotto carico erano limitati ai nuclei ossei asportati3, ai piccoli animali4 e alle unità della colonna vertebrale umana5. Il presente protocollo è in grado di quantificare lo spostamento della microstruttura dell'intero femore umano prossimale sotto carico e dopo una frattura.
Diversi studi sono stati condotti per indagare il cedimento del femore umano e, a volte, questi hanno raggiunto conclusioni contrastanti. Ad esempio, si ritiene che l'assottigliamento delle strutture corticali e trabecolari correlato all'età determini la suscettibilità alla frattura legata all'età causando instabilità elastica dell'osso6,7, che è in apparente contrasto con l'alto coefficiente di determinazione delle previsioni di deformazione corticale e forza femorale assumendo l'assenza di instabilità elastica (R2 = 0,80-0,97)8,9. Ciononostante, tali studi hanno sistematicamente sottostimato la resistenza femorale (del 21%-29%), mettendo così in discussione le risposte ossee fragili e quasi fragili implementate nei modelli 8,10. Una possibile spiegazione per questi risultati apparentemente contrastanti potrebbe risiedere in un diverso comportamento di frattura di intere ossa rispetto ai nuclei ossei isolati. Pertanto, l'osservazione delle risposte alla deformazione e alla frattura della microstruttura ossea in interi femori prossimali può far progredire la conoscenza della meccanica della frattura dell'anca e delle relative applicazioni.
I metodi attuali per l'imaging di intere ossa umane con risoluzione micrometrica sono limitati. Il gantry e le dimensioni del rivelatore devono fornire un volume di lavoro adeguato per ospitare il femore prossimale umano (circa 13 cm x 10 cm, larghezza x lunghezza) e possibilmente una dimensione dei pixel dell'ordine di 0,02-0,03 mm per garantire che le caratteristiche microarchitettoniche rilevanti possano essere catturate11. Queste specifiche possono attualmente essere soddisfatte da alcuni impianti di sincrotrone1 e da alcuni scanner micro-CT di grandi volumi disponibili in commercio12,13. La fase di compressione deve essere radiotrasparente per ridurre al minimo l'attenuazione dei raggi X e generare una forza sufficiente a causare una frattura al femore umano (ad esempio, tra 0,9 kN e 14,3 kN per le donne bianche anziane)14. Questa grande variazione del carico di frattura complica la pianificazione del numero di fasi di carico da fratturare, il tempo complessivo dell'esperimento e la corrispondente quantità di dati prodotti. Per risolvere questo problema, il carico e la posizione della frattura possono essere stimati tramite modellazione agli elementi finiti utilizzando la distribuzione della densità ossea del campione dalle immagini cliniche di tomografia computerizzata (TC) 1,2. Infine, dopo l'esperimento, il grande volume di dati generati deve essere elaborato per studiare i meccanismi di guasto e la capacità di dissipazione dell'energia nell'intero femore umano.
In questo articolo descriviamo un protocollo per ottenere una sequenza di immagini microstrutturali tridimensionali dell'intero femore prossimale in deformazione progressivamente crescente, che provoca fratture clinicamente rilevanti del collo del femore2. Il protocollo include la pianificazione dell'incremento graduale della compressione del campione, il caricamento tramite uno stadio di compressione radiotrasparente personalizzato, l'imaging tramite uno scanner micro-CT di grande volume e l'elaborazione delle immagini e dei profili di carico.
Protocollo
Il protocollo è stato sviluppato e testato con 12 campioni di femore ricevuti da un programma di donazione del corpo. I campioni sono stati ottenuti freschi e conservati a -20 °C presso il Laboratorio di Biomeccanica e Impianti della Flinders University (Tonsley, Australia Meridionale, Australia). L'umidità ossea è stata mantenuta per tutta la durata dell'esperimento. Le donatrici erano donne caucasiche (66-80 anni). L'autorizzazione etica è stata ottenuta dal Comitato Etico per la Ricerca Sociale e Comportamentale (SBREC) della Flinders University (Progetto # 6380).
1. Pianificazione di un incremento del passo di carico specifico del provino
- Scansiona il campione del femore utilizzando uno scanner TC clinico mirato a uno spessore della fetta e a una dimensione dei pixel nel piano di circa 0,5-0,7 mm. Questo passaggio può essere completato da un radiologo esperto in qualsiasi struttura di imaging pubblica utilizzando protocolli di imaging standard preregistrati per la visualizzazione ossea.
- Insieme al campione, eseguire la scansione di un fantoccio di calibrazione della densitometria TC con cinque concentrazioni note di idrogenofosfato dipotassico (K2HPO4, intervallo di densità equivalente approssimativamente compreso tra 59 mg∙cm−3 e 375 mg∙cm−3).
- Segmentare la geometria ossea dalle immagini TC cliniche15, mesh la geometria segmentata dell'osso e mappare le proprietà isotrope del materiale elemento per elemento ai valori di densità ossea calibrati utilizzando la relazione densità-modulo elastico riportata da Schileo et al.8. Salvare la mesh per ulteriori analisi nel software a elementi finiti. Completa ogni passaggio seguendo le linee guida pertinenti fornite con il software di segmentazione e agli elementi finiti.
- Importare la mesh nel software a elementi finiti. Vincolare completamente l'estremità distale di 3-6 mm del modello. Applicare una forza nominale di 1.000 N, addotta di 8° dall'asse dell'asta femorale nel piano coronale e passante per il centro della testa del femore. Questa condizione di carico simula un'attività di appoggio statico su una gamba (orthoload.com).
- Risolvi il modello a elementi finiti utilizzando il solutore PCG integrato (tolleranza di convergenza: 1 x 10−7).
NOTA: In questo caso è stato utilizzato il software agli elementi finiti ANSYS.- Generare una tabella degli elementi contenente il primo e il terzo componente di deformazione principale in corrispondenza del centroide dell'elemento eseguendo i seguenti comandi:
/POST1
COMMESTIBILE,, EPTO1,1
COMMESTIBILE,, EPTO3,3 - Calcolare il rapporto di deformazione tra la prima e la terza componente di deformazione principale nel modello e la deformazione di snervamento osseo in trazione (deformazione 0,73%) e compressione (deformazione 1,04%)8 (Figura 1) eseguendo i seguenti comandi:
SMULT, RFT, EPTO1, ,1/0.0074,1,
SMULT, RFT, EPTO3, ,1/0.0104,1,
- Generare una tabella degli elementi contenente il primo e il terzo componente di deformazione principale in corrispondenza del centroide dell'elemento eseguendo i seguenti comandi:
- Scalare la forza nominale in base al rapporto di deformazione di picco sia in tensione che in compressione e scartare il più grande dei due per ottenere una stima del carico di frattura. Determinare l'incremento di carico come 1/4 del carico di frattura calcolato1.
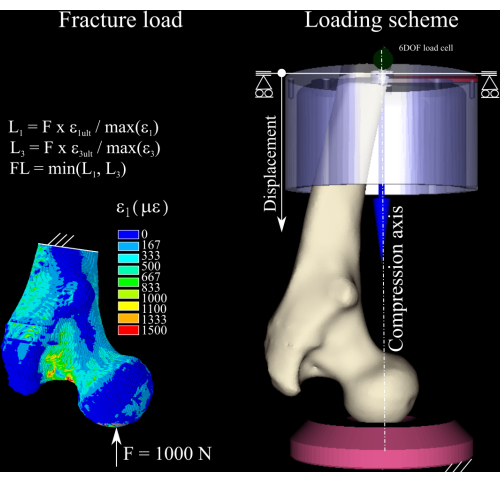
Figura 1: Il calcolo del carico di frattura. La mappa di deformazione agli elementi finiti, le equazioni utilizzate per convertire la forza nominale nel carico di frattura (a sinistra) e lo schema di carico che mostra il femore (al centro a destra), la coppa distale in alluminio (in alto a destra) e la presa di pressione in polietilene (in basso a destra). Fare clic qui per visualizzare una versione più grande di questa figura.
2. Preparazione dell'assemblaggio del campione del femore (Figura 2)
- Togliere il campione dal congelatore (−20 °C).
- Scongelare a temperatura ambiente (RT) per 24 ore conservando il campione in un sacchetto di plastica impermeabile avvolto in materiale assorbente imbevuto di una soluzione fisiologica per mantenere l'umidità ossea.
- Tagliare la diafisi femorale a 180 mm dalla testa prossimale del femore.
- Centrare la testa del femore sull'asse verticale del rig di allineamento allineando la presa a pressione in polietilene di forma concava (Figura 2D) e la testa del femore.
- Allineare il piano contenente il collo del femore e l'asse della diafisi con il piano frontale (Figura 2).
- Ruotare l'asse diafisario fino all'adduzione di 8° in modo che l'asse verticale rappresenti l'orientamento della forza di reazione dell'anca durante una posizione statica su una gamba sola (Figura 2).
- Preparare il cemento dentale seguendo le istruzioni del produttore.
- Invasare l'estremità distale del campione in una coppetta di alluminio profonda 55 mm, riempiendo la coppetta di alluminio con cemento dentale. Attendere non meno di 30 minuti affinché il cemento completi l'indurimento.
- Conservare il gruppo campione a −20 °C.
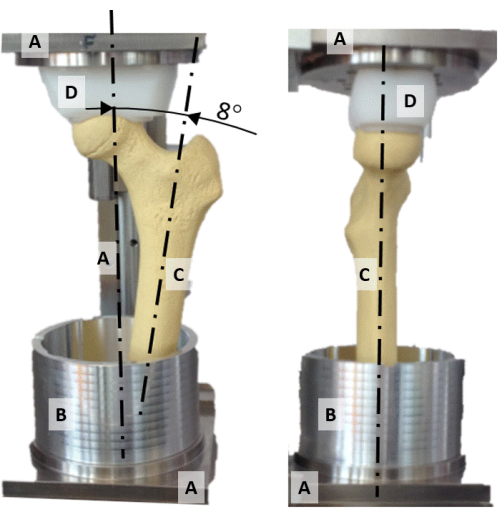
Figura 2: L'impianto di allineamento. Una foto frontale (a sinistra) e laterale (a destra) del rig di allineamento che mostra (A) il telaio, (B) la tazza di alluminio, (C) un modello di femore sintetico e (D) la presa di pressione di forma sferica. Fare clic qui per visualizzare una versione più grande di questa figura.
3. Assemblaggio dello stadio di compressione
NOTA: Le dimensioni esterne dello stadio di compressione sono 245 mm di diametro, 576 mm di altezza e 14 kg di peso, escluso il campione. Lo stadio di compressione è costituito da due parti principali: la camera di compressione e l'attuatore, che vengono assemblati come segue:
- Camera di compressione
- Montare la presa di pressione in polietilene (diametro 104 mm, altezza 60 mm) nella parte inferiore del cilindro in alluminio (diametro 203 mm, spessore parete 3 mm), che è chiuso da una piastra in alluminio saldata a un'estremità (in basso).
- Attuatore
- Assemblare la struttura superiore utilizzando il disco, le tre aste, la piastra triangolare e la guida verticale (Figura 3).
- Montare il meccanismo del martinetto a vite (corsa: 150 mm, carico massimo: 10.000 N, rapporto di trasmissione: 27:1, cilindrata per giro: 0,148 mm) sulla piastra triangolare.
- Montare l'adattatore angolare sulla guida lineare.
- Montare il tavolo x-y a basso attrito sull'adattatore angolare.
- Montare la cella di carico a sei gradi di libertà (errore di misura massimo: 0,005%; forza massima: 10.000 N; coppia massima: 500 Nm) sulla tavola a basso attrito allineando il piano x-z della cella di carico al piano frontale della struttura superiore.
- Collegare la vite dell'attuatore all'adattatore angolare.

Figura 3: Il gruppo dello stadio di compressione radiotrasparente su misura. Una foto (a sinistra) e un modello (a destra) della fase di compressione. (A) La camera di compressione, che è un cilindro di alluminio di 3 mm di spessore chiuso nella parte inferiore; (B) il gruppo attuatore con la struttura superiore; (C) il meccanismo del martinetto a vite; (D) la tavola x-y a basso attrito; e (E) la cella di carico a sei assi viene visualizzata e indicata sul modello. Fare clic qui per visualizzare una versione più grande di questa figura.
4. Impostazione dell'esperimento
- Scongelare il campione a RT per 24 ore conservandolo in un sacchetto di plastica impermeabile avvolto in materiale assorbente imbevuto di una soluzione fisiologica per mantenere l'umidità ossea.
- Montare il gruppo provino a tazza in alluminio sulla cella di carico allineando il piano frontale del gruppo provino con quello dell'attuatore.
- Assemblare la struttura superiore, compreso il campione, nella camera di compressione. Fare attenzione ad allineare la testa del femore con la concavità sferica sulla presa di pressione in polietilene. Assicurarsi che la testa del femore sia innestata ma allentata all'interno della cavità sferica dell'incavo di pressione.
- Posizionare lo stadio di compressione sullo stadio di rotazione dello scanner micro-CT su Imaging and Medical Beamline (IMBL).
- Collegare la cella di carico (errore < 0,005%; forza massima: 10.000 N; coppia massima: 500 Nm) all'amplificatore di deformazione.
- Collegare, tramite USB, l'amplificatore di deformazione ad un computer portatile dotato del software applicativo fornito con la cella di carico.
- Azionare il meccanismo a vite nella fase di compressione spostando il provino verso il basso verso la presa di pressione mentre si monitora la forza di reazione misurata dalla cella di carico nel laptop. Arrestare il meccanismo a vite una volta raggiunta una forza di compressione pari a 100 N. Scaricare il provino a 50 N di precarico.
- Selezionare lo scintillatore accoppiato a lente del sensore pco.edge singolo "Ruby" (http://archive.synchrotron.org.au/31-australian-synchrotron/imbl/811-preparation-for-imaging-experiments).
- Impostare il campo visivo su 76,31 mm x 64,39 mm, che per la dimensione della matrice di 2.560 pixel x 2.160 pixel fornisce una dimensione dei pixel di 29,81 μm.
- Impostare l'asse del tavolino rotante a 8 mm (orizzontalmente) dall'asse del campo visivo (modalità di scansione offset) per estendere il campo visivo a 145,71 mm x 64,39 mm con una dimensione dei pixel di 29,81 μm.
- Impostare i parametri di scansione su un'energia del fascio di 60 keV, un incremento di rotazione di 0,1°, due batch di rotazione di 180° (scansione off-set), un tempo di esposizione di 50 μs e una media dei fotogrammi di due per posizione di rotazione.
- Impostare la scansione in modo da acquisire cinque scansioni consecutive impilate verticalmente, con uno spostamento verticale di 26 mm ciascuna, in modo che l'altezza totale del volume scansionato sia di 132,2 mm per un tempo di scansione totale di 30 minuti.
5. Prove meccaniche con concomitante imaging microstrutturale
- Eseguire l'imaging micro-CT (dimensione dei pixel: 0,03 mm) due volte nella condizione di riferimento (considerata come condizione di deformazione zero).
- Applicare l'incremento di forza azionando manualmente il meccanismo del martinetto a vite a una velocità costante di circa 1 s per giro (0.1-0.2 mm/s).
- Eseguire l'imaging micro-CT.
- Ripetere i passaggi 5.2 e 5.3 fino a provocare la frattura del provino, come indicato da un improvviso calo della forza di reazione.
- Eseguire l'imaging micro-TC del campione fratturato.
- Unisci le 1.800 immagini di proiezione (dimensioni 2.560 x 896 pixel, 76,8 mm x 26,88 mm, larghezza x altezza, immagini in virgola mobile a 32 bit). Il processo unisce due immagini di proiezione (scattate in modalità di scansione offset orizzontale) e le cinque immagini spostate verticalmente, producendo così un'unica immagine di proiezione.
- Ricostruite il volume delle immagini in sezione trasversale (4.407 immagini, ciascuna immagine ha una dimensione di 4.888 x 4.888 pixel) e salvatele come file a virgola mobile a 32 bit in formato . Formato TIFF (occupa 392 GB di spazio su disco).
- Applicare un filtro gaussiano 3 x 3 per ridurre il rumore. Convertire le immagini in 8 bit (256 immagini con livello di grigio, salvate in formato bitmap, che occupano circa 100 GB per volume).
NOTA: In questo lavoro, l'elaborazione delle immagini è stata condotta utilizzando il software disponibile presso l'Australian Synchrotron sotto la guida dell'operatore dell'IMBL.
6. Calcolo del campo di spostamento e deformazione
- Sottocampionare le immagini in sezione trasversale di quattro (120 μm/pixel) per ridurre il tempo di calcolo.
- Co-registrare rigidamente nello spazio le immagini del provino sotto carico con quelle del provino nella condizione di riferimento scarica. Utilizzare la diafisi distale come bersaglio della co-registrazione (File supplementare 1 e File supplementare 2).
- Creazione di modelli tridimensionali di superficie (. STL) per la visualizzazione dopo la binarizzazione delle immagini micro-CT11.
- Registrare in modo elastico il volume dell'immagine nel volume di riferimento utilizzando una dimensione della griglia pari a 50 pixel (SDER = 0,076% di errore di deformazione, BoneDVC, https://bonedvc.insigneo.org/dvc/) per determinare gli spostamenti ai nodi della griglia.
- Convertire la griglia in un modello a elementi finiti. Applicare lo spostamento nodale calcolato da BoneDVC al modello. Risolvi il modello per determinare il tensore di deformazione sull'intero volume osseo.
- Ripetere l'analisi nella regione che mostra i livelli di deformazione più elevati utilizzando le immagini a piena risoluzione.
- Mappare le mappe di deformazione DVC alle immagini a piena risoluzione utilizzando l'interpolazione cubica con la funzione interp3 (Matlab)2.
- Visualizza gli spostamenti, la deformazione e le immagini microstrutturali per la visualizzazione e l'animazione di grandi volumi (Matlab)2.
7. Analisi
- Visualizzare la deformazione permanente dell'osso (danneggiamento) sovrapponendo le immagini ottenute nelle condizioni di scarico e dopo la frattura2.
- Visualizzare la progressiva deformazione microstrutturale dell'osso sovrapponendo i modelli tridimensionali in condizioni di carico, a livelli di carico crescenti e post-frattura2.
- Visualizzare la deformazione dell'osso nel punto di frattura2.
- Analizzare l'energia di deformazione, la rigidezza e lo spostamento utilizzando statistiche descrittive e metodi di regressione2.
Risultati
Le immagini mostrano l'intero femore prossimale, l'alveolo di pressione, il cemento dentale, la coppetta di alluminio e il tessuto di avvolgimento. La microarchitettura ossea può essere vista deformarsi progressivamente all'aumentare del carico prima e dopo la frattura (Figura 4).

Figura 4: La fase d...
Discussione
Il presente protocollo consente di studiare ex vivo la micromeccanica delle fratture dell'anca in tre dimensioni. Uno stadio di compressione radiotrasparente (alluminio) in grado di applicare una deformazione progressiva alla metà prossimale del femore umano e di misurare la forza di reazione è stato progettato, prodotto e testato su misura. In questo protocollo viene utilizzato uno scanner micro-CT di grande volume per fornire una sequenza temporale di volumi di immagine che visualizzano l'intero femore pross...
Divulgazioni
Tutti gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Finanziamento dell'Australian Research Council (FT180100338; IC190100020) è ringraziato.
Materiali
| Name | Company | Catalog Number | Comments |
| Absorbent tissue | N/A | Maintain the bone moisture throughout the experiment | |
| Alignment rig | Custom-made | Rig for positioning the specimen in the potting cup | |
| Aluminium potting cup | Custom-made | Potting cup | |
| Bone saw | N/A | Cut the specimen to size | |
| Calibration phantom QCT Pro | Mindways Software, Inc., Austin, USA | CT Calibration 13002 | Calibrate grey levels in the images into equivalent bone mineral (ash) density levels |
| Clinical Computed-Tmography scanner | General Electric Medical Systems Co., Wisconsin, USA | Optima CT660 | Preliminary imaging for the prediction of the load step to fracture |
| Compressive stage | Custom-made | A 10 kg, radiotransparent compressive stage for applying and maintaining throught imaging a prescribed deformation to the specimen. | |
| Dental cement | Soesterberg, The Netherlands | Vertex RS | |
| Femur specimen | Science Care, Phoenix, USA | ||
| Finite-element analysis software | ANSYS Inc., Canonsburg, USA | ANSYS Mechanical APDL | Finite-element software package |
| Freezer | N/A | Store specimens at -20 °C | |
| Hard Drive | Dell | Disk space: 500 GB per volume | |
| Image bnarization and segmentation software | Skyscan-Bruker, Kontich, Belgium | CT analyzer | Image processing software |
| Image elastic segmentation | The University of Sheffield | Bone DVC | https://bonedvc.insigneo.org/dvc/ |
| Image processing and automation software | The MathWork Inc. | Matlab | Image processing software |
| Image registration software | Skyscan-Bruker, Kontich, Belgium | DataViewer | Image processing software |
| Image segmentation and FE modelling software | Simpleware, Exeter, UK | Scan IP | Bone egmentation software |
| Image stiching script | Australian syncrotron, Clayton, VIC, AU | The script is available at IMBL | |
| Image visualization | Kitware, Clifton Park, NY, USA | Paraview | Image visualization |
| Image visualization | Australian National University | Dristhi | Image visualization: doi:10.1117/12.935640 |
| Imaging and Medical beamline | Australian syncrotron, Clayton, VIC, AU | Large object micro-CT beamline at the Australian Synchrotron | |
| Laptop | Dell Inc., USA | ||
| Low-friction x-y table | THK Co., Tokyo, Japan | ||
| NI signal acquisition software | National Instruments, Austin, TX | NI-DAQmx | |
| Phosphate-buffered saline solution | Custom-made | Maintain the bone moisture throughout the experiment | |
| Plastic bag | N/A | Maintain the bone moisture throughout the experiment | |
| Rail | SKF Inc., Lansdale, PA, USA | ||
| Screw-jack mechanism | Benzlers, Örebro, Sweden | Serie BD (warm gear unit) | stroke: 150 mm, maximal load: 10,000 N, gear ratio: 27:1, a displacement per revolution: 0.148 mm |
| Single pco.edge sensor, lens coupled scintillator | Australian syncrotron, Clayton, VIC, AU | Detector Ruby FOV: 141 x 119 mm; 2560 x 2160 px; 55 µm/px; 50 fps | |
| Six axis load cell | ME-Meßsysteme GmbH, Hennigsdorf, GE | K6D6 | Maximal measurement error: 0.005%; maximal force: 10000 N; maximal torque: 500 Nm |
| Strain amplifier | ME-Meßsysteme GmbH, Hennigsdorf, GE | GSV-1A8USB K6D/M16 |
Riferimenti
- Martelli, S., Perilli, E. Time-elapsed synchrotron-light microstructural imaging of femoral neck fracture. Journal of the Mechanical Behavior of Biomedical Materials. 84, 265-272 (2018).
- Martelli, S., Giorgi, M., Dall' Ara, E., Perilli, E. Damage tolerance and toughness of elderly human femora. Acta Biomaterialia. 123, 167-177 (2021).
- Perilli, E., et al. Dependence of mechanical compressive strength on local variations in microarchitecture in cancellous bone of proximal human femur. Journal of Biomechanics. 41 (2), 438-446 (2008).
- Thurner, P. J., et al. Time-lapsed investigation of three-dimensional failure and damage accumulation in trabecular bone using synchrotron light. Bone. 39 (2), 289-299 (2006).
- Jackman, T. M. Quantitative, 3D visualization of the initiation and progression of vertebral fractures under compression and anterior flexion. Journal of Bone and Mineral Research. 31 (4), 777-788 (2016).
- Mayhew, P. M., et al. Relation between age, femoral neck cortical stability, and hip fracture risk. Lancet. 366 (9480), 129-135 (2005).
- Nazarian, A., Stauber, M., Zurakowski, D., Snyder, B. D., Müller, R. The interaction of microstructure and volume fraction in predicting failure in cancellous bone. Bone. 39 (6), 1196-1202 (2006).
- Schileo, E., et al. To what extent can linear finite element models of human femora predict failure under stance and fall loading configurations. Journal of Biomechanics. 47 (14), 3531-3538 (2014).
- Schileo, E., et al. An accurate estimation of bone density improves the accuracy of subject-specific finite element models. Journal of Biomechanics. 41 (11), 2483-2491 (2008).
- Dall'ara, E., et al. A nonlinear QCT-based finite element model validation study for the human femur tested in two configurations in vitro. Bone. 52 (1), 27-38 (2013).
- Perilli, E., Parkinson, I. H., Reynolds, K. J. Micro-CT examination of human bone: from biopsies towards the entire organ. Annali dell'Istituto Superiore di Sanità. 48 (1), 75-82 (2012).
- Wearne, L. S., Rapagna, S., Taylor, M., Perilli, E. Micro-CT scan optimisation for mechanical loading of tibia with titanium tibial tray: A digital volume correlation zero strain error analysis. Journal of the Mechanical Behavior of Biomedical Materials. 134, 105336 (2022).
- Bennett, K. J., et al. Ex vivo assessment of surgically repaired tibial plateau fracture displacement under axial load using large-volume micro-CT. Journal of Biomechanics. 144, 111275 (2022).
- Falcinelli, C., et al. Multiple loading conditions analysis can improve the association between finite element bone strength estimates and proximal femur fractures: A preliminary study in elderly women. Bone. 67, 71-80 (2014).
- Orthopedic Image Segmentation. Synopsys Available from: https://www.synopsys.com/simpleware/news-and-events/ortho-medical-image-segmentation.html (2020)
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon