Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Imagerie du mécanisme de défaillance microstructurale de la hanche humaine
Dans cet article
Résumé
Le protocole permet de mesurer la déformation de la microstructure osseuse dans l’ensemble du fémur humain proximal et sa ténacité en combinant un micro-scanner de grand volume, une platine de compression sur mesure et des outils avancés de traitement d’image.
Résumé
L’imagerie de la microstructure osseuse sous des charges croissantes permet d’observer le comportement de défaillance microstructurale de l’os. Nous décrivons ici un protocole permettant d’obtenir une séquence d’images microstructurales tridimensionnelles de l’ensemble du fémur proximal sous déformation croissante, provoquant des fractures cliniquement pertinentes du col du fémur. Le protocole est démontré à l’aide de quatre fémurs de donneuses âgées de 66 à 80 ans à l’extrémité inférieure de la densité minérale osseuse dans la population (plage de score T = −2,09 à −4,75). Une platine de compression radio-transparente a été conçue pour charger les échantillons en reproduisant une position sur une jambe, tout en enregistrant la charge appliquée lors de l’imagerie par micro-tomodensitométrie (micro-TDM). Le champ de vision était de 146 mm de large et 132 mm de haut, et la taille des pixels isotropes était de 0,03 mm. L’incrément de force était basé sur des prédictions par éléments finis de la charge de rupture. L’étage de compression a été utilisé pour appliquer le déplacement à l’éprouvette et exécuter les incréments de force prescrits. Des fractures sous-capitales dues à l’ouverture et au cisaillement du col du fémur sont survenues après quatre à cinq incréments de charge. Les images micro-CT et les mesures de force de réaction ont été traitées pour étudier la déformation osseuse et la capacité d’absorption d’énergie. L’instabilité du cortex est apparue dès les premières étapes de la charge. L’os sous-chondral de la tête fémorale présentait de grandes déformations atteignant 16 % avant la fracture, et une augmentation progressive de la capacité de soutien jusqu’à la fracture. L’énergie de déformation augmentait linéairement avec le déplacement jusqu’à la rupture, tandis que la rigidité diminuait jusqu’à des valeurs proches de zéro immédiatement avant la rupture. Les trois quarts de l’énergie de rupture ont été absorbés par l’éprouvette au cours de l’incrément final de force de 25 %. En conclusion, le protocole développé a révélé une remarquable capacité d’absorption d’énergie, ou tolérance aux dommages, et une interaction synergique entre l’os cortical et trabéculaire à un âge de donneur avancé.
Introduction
Les fractures du col du fémur sont un fardeau majeur pour la population vieillissante. L’imagerie par micro-tomodensitométrie (micro-TDM) et les tests mécaniques concomitants permettent d’observer la microstructure osseuse et d’étudier sa relation avec la solidité des os, ses changements liés à l’âge et ses déplacements sous charge 1,2. Cependant, jusqu’à récemment, les études de micro-tomodensitométrie de l’os sous charge étaient limitées aux carottes osseuses excisées3, aux petits animaux4 et aux unités de la colonne vertébrale humaine5. Le présent protocole permet de quantifier le déplacement de la microstructure de l’ensemble du fémur humain proximal sous charge et après une fracture.
Plusieurs études ont été menées pour étudier la défaillance du fémur humain, et parfois, celles-ci ont abouti à des conclusions contrastées. Par exemple, on pense que l’amincissement des structures corticales et trabéculaires lié à l’âge détermine la susceptibilité à la fracture liée à l’âge en provoquant une instabilité élastique de l’os6,7, ce qui contraste apparemment avec le coefficient élevé de détermination de la déformation corticale et des prédictions de la force fémorale en supposant l’absence d’instabilité élastique (R2 = 0,80-0,97)8,9. Néanmoins, ces études ont systématiquement sous-estimé la force fémorale (de 21 % à 29 %), remettant ainsi en question les réponses osseuses fragiles et quasi-cassantes mises en œuvre dans les modèles 8,10. Une explication possible de ces résultats apparemment contrastés peut résider dans un comportement de fracture différent des os entiers par rapport aux noyaux osseux isolés. Par conséquent, l’observation de la déformation et des réponses fracturées de la microstructure osseuse dans des fémurs proximaux entiers peut faire progresser les connaissances sur la mécanique des fractures de la hanche et les applications connexes.
Les méthodes actuelles d’imagerie d’os humains entiers avec une résolution micrométrique sont limitées. La taille du portique et du détecteur doit fournir un volume de travail approprié pour accueillir le fémur proximal humain (environ 13 cm x 10 cm, largeur x longueur) et éventuellement une taille de pixel de l’ordre de 0,02 à 0,03 mm pour garantir que les caractéristiques micro-architecturales pertinentes puissent être capturées11. À l’heure actuelle,certaines installations synchrotron 1 et certains micro-tomodensitomètres à grand volume disponibles dans le commerce peuvent satisfaire à ces spécifications12,13. L’étage de compression doit être radio-transparent afin de minimiser l’atténuation des rayons X tout en générant une force suffisante pour provoquer une fracture du fémur humain (par exemple, entre 0,9 kN et 14,3 kN pour les femmes blanches âgées)14. Cette grande variation de la charge de rupture complique la planification du nombre d’étapes de charge à rompre, de la durée globale de l’expérience et de la quantité correspondante de données produites. Pour résoudre ce problème, la charge et l’emplacement de la fracture peuvent être estimés par modélisation par éléments finis en utilisant la distribution de la densité osseuse de l’échantillon à partir d’images de tomodensitométrie clinique (TDM) 1,2. Enfin, après l’expérience, le grand volume de données générées doit être traité pour étudier les mécanismes de défaillance et la capacité de dissipation d’énergie dans l’ensemble du fémur humain.
Nous décrivons ici un protocole permettant d’obtenir une séquence d’images microstructurales tridimensionnelles de l’ensemble du fémur proximal sous déformation croissante progressive, ce qui provoque des fractures cliniquement pertinentes du col fémoral2. Le protocole comprend la planification de l’incrément progressif de la compression de l’échantillon, le chargement via une platine de compression radio-transparente personnalisée, l’imagerie via un micro-scanner micro-CT grand volume et le traitement des images et des profils de charge.
Protocole
Le protocole a été élaboré et testé avec 12 échantillons de fémur reçus dans le cadre d’un programme de don de corps. Les échantillons ont été obtenus frais et stockés à −20 °C au laboratoire de biomécanique et d’implants de l’Université Flinders (Tonsley, Australie-Méridionale, Australie). L’humidité osseuse a été maintenue tout au long de l’expérience. Les donneuses étaient des femmes de race blanche (âgées de 66 à 80 ans). L’autorisation d’éthique a été obtenue auprès du Comité d’éthique de la recherche sociale et comportementale (SBREC) de l’Université Flinders (projet # 6380).
1. Planification d’un incrément de pas de charge spécifique à l’éprouvette
- Scannez l’échantillon de fémur à l’aide d’un tomodensitomètre clinique ciblant une épaisseur de tranche et une taille de pixel dans le plan d’environ 0,5 à 0,7 mm. Cette étape peut être effectuée par un radiographe expert dans n’importe quel établissement d’imagerie public à l’aide de protocoles d’imagerie préenregistrés standard pour la visualisation osseuse.
- Avec l’échantillon, scannez un fantôme d’étalonnage de densitométrie TDM avec cinq concentrations connues d’hydrogénophosphate dipotassique (K2HPO4, plage de densité équivalente approximativement comprise entre 59 mg∙cm−3 et 375 mg∙cm−3).
- Segmentez la géométrie osseuse à partir des images de tomodensitométrie clinique15, maillez la géométrie segmentée de l’os et mappez les propriétés isotropes du matériau élément par élément aux valeurs de densité osseuse calibrées en utilisant la relation densité/module élastique rapportée par Schileo et al.8. Enregistrez le maillage pour une analyse plus approfondie dans le logiciel d’éléments finis. Complétez chaque étape en suivant les instructions pertinentes fournies avec le logiciel de segmentation et d’éléments finis.
- Importez le maillage dans le logiciel d’éléments finis. Contraindez complètement l’extrémité distale de 3 à 6 mm du modèle. Appliquer une force nominale de 1 000 N, adductée de 8° à partir de l’axe de la diaphyse fémorale dans le plan coronal et passant par le centre de la tête fémorale. Cette condition de chargement imite une tâche statique de position sur une jambe (orthoload.com).
- Résolvez le modèle d’éléments finis à l’aide du solveur PCG intégré (tolérance de convergence : 1 x 10−7).
NOTE : Ici, le logiciel d’éléments finis ANSYS a été utilisé.- Générez une table d’éléments contenant les première et troisième composantes principales de la déformation au niveau du centroïde de l’élément en exécutant les commandes suivantes :
/POSTE1
ETABLE,, EPTO1,1
ETABLE,, EPTO3,3 - Calculez le rapport de déformation entre la première et la troisième composante principale de la déformation du modèle et la déformation de l’élasticité osseuse en traction (0,73 % de déformation) et en compression (1,04 % de déformation)8 (Figure 1) en exécutant les commandes suivantes :
SMULT,RFT,EPTO1, ,1/0.0074,1,
SMULT, RFT,EPTO3, ,1/0.0104,1,
- Générez une table d’éléments contenant les première et troisième composantes principales de la déformation au niveau du centroïde de l’élément en exécutant les commandes suivantes :
- Mettez à l’échelle la force nominale en fonction du rapport de déformation maximal en traction et en compression, et écartez la plus grande des deux afin d’obtenir une estimation de la charge de rupture. Déterminez l’incrément de charge comme 1/4 de la charge de rupture calculée1.
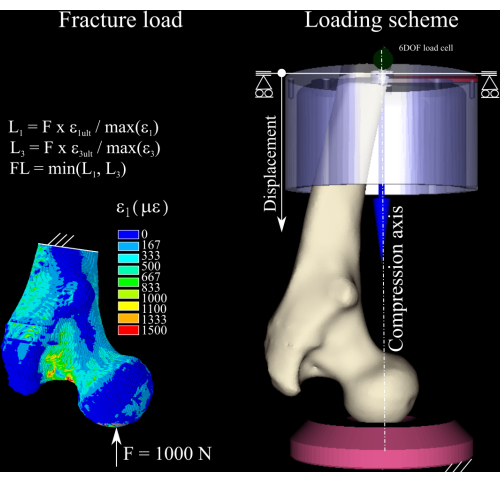
Figure 1 : Calcul de la charge de rupture. La carte de déformation par éléments finis, les équations utilisées pour convertir la force nominale en charge de rupture (à gauche) et le schéma de charge affichant le fémur (au centre à droite), la coupelle distale en aluminium (en haut à droite) et la douille de pression en polyéthylène (en bas à droite). Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Préparation de l’assemblage de l’échantillon de fémur (Figure 2)
- Sortez l’échantillon du congélateur (−20 °C).
- Décongeler à température ambiante (RT) pendant 24 h tout en conservant l’échantillon dans un sac en plastique imperméable enveloppé dans un matériau absorbant imbibé d’une solution physiologique pour maintenir l’humidité osseuse.
- Couper la diaphyse fémorale à 180 mm de la tête fémorale proximale.
- Centrez la tête fémorale sur l’axe vertical de la plate-forme d’alignement en alignant la douille de pression en polyéthylène de forme concave (Figure 2D) et la tête du fémur.
- Alignez le plan contenant le col du fémur et l’axe de la diaphyse avec le plan frontal (Figure 2).
- Faites pivoter l’axe diaphysaire à 8° d’adduction de sorte que l’axe vertical représente l’orientation de la force de réaction de la hanche lors d’une position statique sur une jambe (Figure 2).
- Préparez le ciment dentaire en suivant les instructions du fabricant.
- Mettez l’extrémité distale de l’échantillon dans un godet d’enrobage en aluminium de 55 mm de profondeur, en remplissant le gobelet en aluminium de ciment dentaire. Attendez au moins 30 minutes pour que le ciment durcisse complètement.
- Conserver l’ensemble d’éprouvettes à −20 °C.
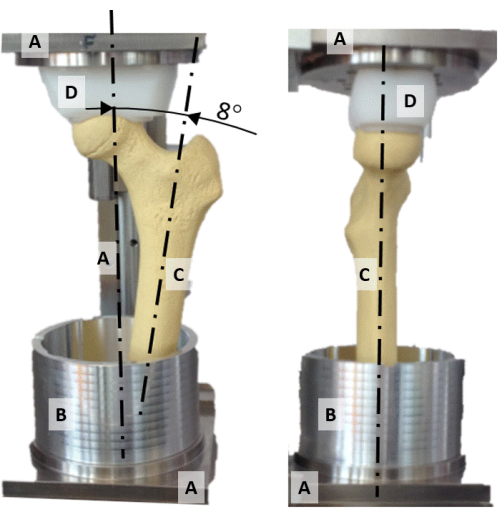
Figure 2 : Gréement d’alignement. Une photo frontale (à gauche) et latérale (à droite) de la plate-forme d’alignement montrant (A) le cadre, (B) le godet d’empotage en aluminium, (C) un modèle de fémur synthétique et (D) la douille de pression de forme sphérique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Assemblage de l’étage de compression
REMARQUE : Les dimensions extérieures de l’étage de compression sont de 245 mm de diamètre, 576 mm de hauteur et 14 kg de poids, à l’exclusion de l’échantillon. L’étage de compression se compose de deux parties principales : la chambre de compression et l’actionneur, qui sont assemblées comme suit :
- Chambre de compression
- Montez la douille de pression en polyéthylène (104 mm de diamètre, 60 mm de hauteur) au bas du cylindre en aluminium (203 mm de diamètre, 3 mm d’épaisseur de paroi), qui est fermé par une plaque d’aluminium soudée à une extrémité (en bas).
- Actionneur
- Assemblez la structure supérieure à l’aide du disque, des trois tiges, de la plaque triangulaire et du rail vertical (Figure 3).
- Montez le mécanisme à vis (course : 150 mm, charge maximale : 10 000 N, rapport de démultiplication : 27 :1, déplacement par tour : 0,148 mm) sur la plaque triangulaire.
- Montez l’adaptateur angulaire sur le rail linéaire.
- Montez la table x-y à faible frottement sur l’adaptateur angulaire.
- Montez le capteur de pesage à six degrés de liberté (erreur de mesure maximale : 0,005 % ; force maximale : 10 000 N ; couple maximal : 500 Nm) sur la table à faible frottement en alignant le plan x-z du capteur de pesage sur le plan frontal de la structure supérieure.
- Connectez la vis de l’actionneur à l’adaptateur angulaire.

Figure 3 : L’ensemble de l’étage de compression radiotransparent sur mesure. Une photo (à gauche) et un modèle (à droite) de l’étage de compression. (A) La chambre de compression, qui est un cylindre en aluminium de 3 mm d’épaisseur fermé par le bas ; (B) l’ensemble de l’actionneur avec la structure supérieure ; (C) le mécanisme du vérin à vis ; (D) la table x-y à faible frottement ; et (E) le capteur de pesage à six axes sont affichés et indiqués sur le modèle. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Mise en place de l’expérience
- Décongeler l’échantillon à RT pendant 24 h tout en le conservant dans un sac en plastique imperméable enveloppé d’un matériau absorbant imbibé d’une solution physiologique pour maintenir l’humidité de l’os.
- Montez l’ensemble d’éprouvette en aluminium sur le capteur de pesage en alignant le plan frontal de l’ensemble d’éprouvette avec celui de l’actionneur.
- Assemblez la structure supérieure, y compris l’échantillon, dans la chambre de compression. Prenez soin d’aligner la tête fémorale avec la concavité sphérique de la douille de pression en polyéthylène. Assurez-vous que la tête fémorale est engagée mais relâchée dans la cavité sphérique de la douille de pression.
- Placez la platine de compression sur la platine de rotation du micro-tomodensitomètre au niveau de la ligne de faisceau d’imagerie et médicale (IMBL).
- Connectez le capteur de pesage (erreur < 0,005 % ; force maximale : 10 000 N ; couple maximal : 500 Nm) à l’amplificateur de contrainte.
- Connectez, via USB, l’amplificateur de contrainte à un ordinateur portable équipé du logiciel d’application fourni avec le capteur de pesage.
- Actionnez le mécanisme de la vis dans l’étage de compression en déplaçant l’échantillon vers le bas vers la douille de pression tout en surveillant la force de réaction mesurée par le capteur de pesage de l’ordinateur portable. Arrêtez le mécanisme de la vis une fois qu’une force de compression égale à 100 N est atteinte. Décharger l’éprouvette à 50 N avant la charge.
- Sélectionnez le scintillateur à lentille couplé à une lentille à capteur unique pco.edge « Ruby » (http://archive.synchrotron.org.au/31-australian-synchrotron/imbl/811-preparation-for-imaging-experiments).
- Définissez le champ de vision sur 76,31 mm x 64,39 mm, ce qui, pour la taille de la matrice de 2 560 pixels x 2 160 pixels, donne une taille de pixel de 29,81 μm.
- Réglez l’axe de la platine rotative à 8 mm (horizontalement) par rapport à l’axe du champ de vision (mode de balayage décalé) pour étendre le champ de vision à 145,71 mm x 64,39 mm à une taille de pixel de 29,81 μm.
- Réglez les paramètres de balayage sur une énergie de faisceau de 60 keV, un incrément de rotation de 0,1°, deux lots de rotation de 180° (balayage décalé), un temps d’exposition de 50 μs et une moyenne d’images de deux par position de rotation.
- Configurez la numérisation pour acquérir cinq numérisations consécutives, empilées verticalement, avec un décalage vertical de 26 mm chacune, de sorte que la hauteur totale du volume numérisé soit de 132,2 mm pour une durée totale de numérisation de 30 minutes.
5. Essais mécaniques avec imagerie microstructurale concomitante
- Effectuez deux fois une imagerie micro-CT (taille de pixel : 0,03 mm) dans la condition de référence (prise comme condition de contrainte nulle).
- Appliquer l’incrément de force en actionnant manuellement le mécanisme du vérin à vis à une vitesse constante d’environ 1 s par tour (0,1-0,2 mm/s).
- Effectuer une micro-imagerie par tomodensitométrie.
- Répétez les étapes 5.2 et 5.3 jusqu’à provoquer la fracture de l’éprouvette, comme indiqué par une chute soudaine de la force de réaction.
- Effectuer une micro-imagerie par tomodensitométrie de l’échantillon fracturé.
- Assemblez les 1 800 images de projection (2 560 pixels x 896 pixels, 76,8 mm x 26,88 mm, largeur x hauteur, images à virgule flottante 32 bits). Le processus assemble deux images de projection (prises en mode de balayage horizontal décalé) et les cinq images décalées verticalement, produisant ainsi une seule image de projection.
- Reconstruisez le volume des images en coupe transversale (4 407 images, chaque image a une taille de 4 888 x 4 888 pixels) et enregistrez-les sous forme de fichiers à virgule flottante 32 bits au format . TIFF (occupant 392 Go d’espace disque).
- Appliquez un filtre gaussien 3 x 3 pour réduire le bruit. Convertissez les images en 8 bits (256 images de niveaux de gris, enregistrées au format bitmap, occupant environ 100 Go par volume).
NOTE : Dans ce travail, le traitement des images a été effectué à l’aide d’un logiciel disponible au Synchrotron australien sous la direction de l’opérateur de l’IMBL.
6. Calcul du champ de déplacement et de déformation
- Sous-échantillonnez les images en coupe transversale par quatre (120 μm/pixel) pour réduire le temps de calcul.
- Co-enregistrer de manière rigide dans l’espace les images de l’éprouvette sous charge avec celles de l’éprouvette dans l’état de référence non chargé. Utiliser la diaphyse distale comme cible de la co-inscription (Dossier supplémentaire 1 et Dossier supplémentaire 2).
- Création de modèles tridimensionnels de surface (. STL) pour la visualisation après binarisation des images micro-CT11.
- Enregistrez élastiquement le volume d’image sur le volume de référence à l’aide d’une taille de grille égale à 50 pixels (SDER = 0,076 % d’erreur de déformation, BoneDVC, https://bonedvc.insigneo.org/dvc/) pour déterminer les déplacements aux nœuds de la grille.
- Convertissez la grille en un modèle d’éléments finis. Appliquez le déplacement nodal calculé par BoneDVC au modèle. Résolvez le modèle pour déterminer le tenseur de déformation sur l’ensemble du volume osseux.
- Répétez l’analyse dans la région présentant les niveaux de déformation les plus élevés à l’aide des images en pleine résolution.
- Associez les cartes de déformation DVC aux images en pleine résolution à l’aide de l’interpolation cubique avec la fonction interp3 (Matlab)2.
- Visualisez les déplacements, les déformations et les images microstructurales pour la visualisation et l’animation de grands volumes (Matlab)2.
7. Analyse
- Afficher la déformation permanente de l’os (lésion) en superposant les images obtenues dans les conditions non chargées et après la fracture2.
- Affichez la déformation microstructurale progressive de l’os en superposant les modèles tridimensionnels dans des conditions non chargées, à des niveaux de charge croissants et après une fracture2.
- Affichez la déformation de l’os à l’endroit de la fracture2.
- Analyser l’énergie de déformation, la rigidité et le déplacement à l’aide de statistiques descriptives et de méthodes de régression2.
Résultats
Les images montrent l’ensemble du fémur proximal, l’alvéole de pression, le ciment dentaire, la cupule en aluminium et le tissu d’emballage. On observe que la micro-architecture osseuse se déforme progressivement au fur et à mesure que la charge augmente avant et après la fracture (Figure 4).

Figure 4
Discussion
Le présent protocole permet d’étudier ex vivo la micromécanique temporelle des fractures de la hanche en trois dimensions. Un étage de compression radiotransparent (aluminium) capable d’appliquer une déformation progressive à la moitié proximale du fémur humain et de mesurer la force de réaction a été conçu, fabriqué et testé sur mesure. Un micro-tomodensitomètre à grand volume est utilisé dans ce protocole pour fournir une séquence temporelle de volumes d’images affichant l’ensemble du...
Déclarations de divulgation
Tous les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Financement du Conseil australien de la recherche (FT180100338 ; IC190100020) est remercié.
matériels
| Name | Company | Catalog Number | Comments |
| Absorbent tissue | N/A | Maintain the bone moisture throughout the experiment | |
| Alignment rig | Custom-made | Rig for positioning the specimen in the potting cup | |
| Aluminium potting cup | Custom-made | Potting cup | |
| Bone saw | N/A | Cut the specimen to size | |
| Calibration phantom QCT Pro | Mindways Software, Inc., Austin, USA | CT Calibration 13002 | Calibrate grey levels in the images into equivalent bone mineral (ash) density levels |
| Clinical Computed-Tmography scanner | General Electric Medical Systems Co., Wisconsin, USA | Optima CT660 | Preliminary imaging for the prediction of the load step to fracture |
| Compressive stage | Custom-made | A 10 kg, radiotransparent compressive stage for applying and maintaining throught imaging a prescribed deformation to the specimen. | |
| Dental cement | Soesterberg, The Netherlands | Vertex RS | |
| Femur specimen | Science Care, Phoenix, USA | ||
| Finite-element analysis software | ANSYS Inc., Canonsburg, USA | ANSYS Mechanical APDL | Finite-element software package |
| Freezer | N/A | Store specimens at -20 °C | |
| Hard Drive | Dell | Disk space: 500 GB per volume | |
| Image bnarization and segmentation software | Skyscan-Bruker, Kontich, Belgium | CT analyzer | Image processing software |
| Image elastic segmentation | The University of Sheffield | Bone DVC | https://bonedvc.insigneo.org/dvc/ |
| Image processing and automation software | The MathWork Inc. | Matlab | Image processing software |
| Image registration software | Skyscan-Bruker, Kontich, Belgium | DataViewer | Image processing software |
| Image segmentation and FE modelling software | Simpleware, Exeter, UK | Scan IP | Bone egmentation software |
| Image stiching script | Australian syncrotron, Clayton, VIC, AU | The script is available at IMBL | |
| Image visualization | Kitware, Clifton Park, NY, USA | Paraview | Image visualization |
| Image visualization | Australian National University | Dristhi | Image visualization: doi:10.1117/12.935640 |
| Imaging and Medical beamline | Australian syncrotron, Clayton, VIC, AU | Large object micro-CT beamline at the Australian Synchrotron | |
| Laptop | Dell Inc., USA | ||
| Low-friction x-y table | THK Co., Tokyo, Japan | ||
| NI signal acquisition software | National Instruments, Austin, TX | NI-DAQmx | |
| Phosphate-buffered saline solution | Custom-made | Maintain the bone moisture throughout the experiment | |
| Plastic bag | N/A | Maintain the bone moisture throughout the experiment | |
| Rail | SKF Inc., Lansdale, PA, USA | ||
| Screw-jack mechanism | Benzlers, Örebro, Sweden | Serie BD (warm gear unit) | stroke: 150 mm, maximal load: 10,000 N, gear ratio: 27:1, a displacement per revolution: 0.148 mm |
| Single pco.edge sensor, lens coupled scintillator | Australian syncrotron, Clayton, VIC, AU | Detector Ruby FOV: 141 x 119 mm; 2560 x 2160 px; 55 µm/px; 50 fps | |
| Six axis load cell | ME-Meßsysteme GmbH, Hennigsdorf, GE | K6D6 | Maximal measurement error: 0.005%; maximal force: 10000 N; maximal torque: 500 Nm |
| Strain amplifier | ME-Meßsysteme GmbH, Hennigsdorf, GE | GSV-1A8USB K6D/M16 |
Références
- Martelli, S., Perilli, E. Time-elapsed synchrotron-light microstructural imaging of femoral neck fracture. Journal of the Mechanical Behavior of Biomedical Materials. 84, 265-272 (2018).
- Martelli, S., Giorgi, M., Dall' Ara, E., Perilli, E. Damage tolerance and toughness of elderly human femora. Acta Biomaterialia. 123, 167-177 (2021).
- Perilli, E., et al. Dependence of mechanical compressive strength on local variations in microarchitecture in cancellous bone of proximal human femur. Journal of Biomechanics. 41 (2), 438-446 (2008).
- Thurner, P. J., et al. Time-lapsed investigation of three-dimensional failure and damage accumulation in trabecular bone using synchrotron light. Bone. 39 (2), 289-299 (2006).
- Jackman, T. M. Quantitative, 3D visualization of the initiation and progression of vertebral fractures under compression and anterior flexion. Journal of Bone and Mineral Research. 31 (4), 777-788 (2016).
- Mayhew, P. M., et al. Relation between age, femoral neck cortical stability, and hip fracture risk. Lancet. 366 (9480), 129-135 (2005).
- Nazarian, A., Stauber, M., Zurakowski, D., Snyder, B. D., Müller, R. The interaction of microstructure and volume fraction in predicting failure in cancellous bone. Bone. 39 (6), 1196-1202 (2006).
- Schileo, E., et al. To what extent can linear finite element models of human femora predict failure under stance and fall loading configurations. Journal of Biomechanics. 47 (14), 3531-3538 (2014).
- Schileo, E., et al. An accurate estimation of bone density improves the accuracy of subject-specific finite element models. Journal of Biomechanics. 41 (11), 2483-2491 (2008).
- Dall'ara, E., et al. A nonlinear QCT-based finite element model validation study for the human femur tested in two configurations in vitro. Bone. 52 (1), 27-38 (2013).
- Perilli, E., Parkinson, I. H., Reynolds, K. J. Micro-CT examination of human bone: from biopsies towards the entire organ. Annali dell'Istituto Superiore di Sanità. 48 (1), 75-82 (2012).
- Wearne, L. S., Rapagna, S., Taylor, M., Perilli, E. Micro-CT scan optimisation for mechanical loading of tibia with titanium tibial tray: A digital volume correlation zero strain error analysis. Journal of the Mechanical Behavior of Biomedical Materials. 134, 105336 (2022).
- Bennett, K. J., et al. Ex vivo assessment of surgically repaired tibial plateau fracture displacement under axial load using large-volume micro-CT. Journal of Biomechanics. 144, 111275 (2022).
- Falcinelli, C., et al. Multiple loading conditions analysis can improve the association between finite element bone strength estimates and proximal femur fractures: A preliminary study in elderly women. Bone. 67, 71-80 (2014).
- Orthopedic Image Segmentation. Synopsys Available from: https://www.synopsys.com/simpleware/news-and-events/ortho-medical-image-segmentation.html (2020)
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon