É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Imagem do Mecanismo de Falha Microestrutural no Quadril Humano
Neste Artigo
Resumo
O protocolo permite a medição da deformação da microestrutura óssea em todo o fêmur humano proximal e sua tenacidade, combinando microtomografia computadorizada de grande volume, um estágio compressivo personalizado e ferramentas avançadas de processamento de imagem.
Resumo
A obtenção de imagens da microestrutura óssea sob cargas progressivamente crescentes permite observar o comportamento de falha microestrutural do osso. Descrevemos um protocolo para obtenção de uma sequência de imagens microestruturais tridimensionais de todo o fêmur proximal sob deformação progressivamente crescente, causando fraturas clinicamente relevantes do colo do fêmur. O protocolo é demonstrado utilizando quatro fêmures de doadoras do sexo feminino com idade entre 66 e 80 anos na extremidade inferior da densidade mineral óssea na população (T-score = −2,09 a −4,75). Um estágio compressivo radiotransparente foi projetado para carregar os espécimes replicando uma posição unipodal, enquanto registrava a carga aplicada durante a microtomografia computadorizada (micro-TC). O campo de visão era de 146 mm de largura e 132 mm de altura, e o tamanho isotrópico de pixel era de 0,03 mm. O incremento de força foi baseado em predições de elementos finitos da carga de fratura. O estágio compressivo foi utilizado para aplicar o deslocamento no corpo de prova e realizar os incrementos de força prescritos. As fraturas subcapitais por abertura e cisalhamento do colo do fêmur ocorreram após quatro a cinco incrementos de carga. As imagens de micro-TC e as medidas de força de reação foram processadas para estudar a deformação óssea e a capacidade de absorção de energia. A instabilidade do córtex apareceu nas primeiras etapas de carregamento. O osso subcondral da cabeça femoral apresentava grandes deformações chegando a 16% antes da fratura e aumento progressivo da capacidade de suporte até a fratura. A energia de deformação aumentou linearmente com o deslocamento até a fratura, enquanto a rigidez diminuiu para valores próximos a zero imediatamente antes da fratura. Três quartos da energia da fratura foram captados pelo espécime durante o incremento final de 25% de força. Em conclusão, o protocolo desenvolvido revelou uma notável capacidade de absorção de energia, ou tolerância a danos, e uma interação sinérgica entre o osso cortical e trabecular em uma idade avançada do doador.
Introdução
As fraturas do colo do fêmur constituem um grande fardo para o envelhecimento populacional. A microtomografia computadorizada (micro-TC) e o teste mecânico concomitante permitem observar a microestrutura óssea e estudar sua relação com a resistência óssea, suas alterações relacionadas à idade e deslocamentos sobcarga1,2. No entanto, até recentemente, os estudos de micro-TC de osso sob carga limitavam-se a núcleos ósseos excisados3, pequenos animais4 e unidades de coluna humana5. O presente protocolo pode quantificar o deslocamento da microestrutura de todo o fêmur humano proximal sob carga e após uma fratura.
Vários estudos foram realizados para investigar a falência do fêmur humano e, por vezes, chegaram a conclusões contrastantes. Por exemplo, acredita-se que o afinamento das estruturas corticais e trabeculares relacionado à idade determine a suscetibilidade à fratura relacionada à idade, causando instabilidade elástica do osso6,7, o que contrasta com o alto coeficiente de determinação da deformação cortical e as previsões de força femoral supondo que não haja instabilidade elástica (R2 = 0,80-0,97)8,9. No entanto, tais estudos têm sistematicamente subestimado a força femoral (21%-29%), colocando em questão as respostas ósseas quebradiças e quase quebradiças implementadas nos modelos 8,10. Uma possível explicação para esses achados aparentemente contrastantes pode residir em um comportamento diferente da fratura de ossos inteiros em comparação com núcleos ósseos isolados. Portanto, observar as respostas à deformação e à fratura da microestrutura óssea em fêmures proximais inteiros pode avançar no conhecimento da mecânica da fratura de quadril e aplicações relacionadas.
Os métodos atuais para obtenção de imagens de ossos humanos inteiros com resolução micrométrica são limitados. O pórtico e o tamanho do detector devem fornecer um volume de trabalho adequado para hospedar o fêmur proximal humano (aproximadamente 13 cm x 10 cm, largura x comprimento) e, possivelmente, um tamanho de pixel da ordem de 0,02-0,03 mm para garantir que as características microarquitetônicas relevantes possam ser capturadas11. Atualmente, essas especificações podem ser atendidas por algumas instalações síncrotron1 e alguns microtomógrafos de grande volume disponíveis comercialmente12,13. O estágio compressivo deve ser radiotransparente para minimizar a atenuação dos raios X e, ao mesmo tempo, gerar uma força suficiente para causar uma fratura no fêmur humano (por exemplo, entre 0,9 kN e 14,3 kN para mulheres brancas idosas)14. Essa grande variação na carga de fratura complica o planejamento do número de etapas de carga até a fratura, o tempo total do experimento e a quantidade correspondente de dados produzidos. Para resolver esse problema, a carga e a localização da fratura podem ser estimadas por meio da modelagem por elementos finitos usando a distribuição da densidade óssea do espécime a partir de imagens clínicas de tomografia computadorizada (TC)1,2. Finalmente, após o experimento, o grande volume de dados gerados precisa ser processado para estudar os mecanismos de falha e capacidade de dissipação de energia em todo o fêmur humano.
Descrevemos um protocolo para obtenção de uma sequência de imagens microestruturais tridimensionais de todo o fêmur proximal sob deformação progressivamente crescente, o que causa fraturas clinicamente relevantes do colo dofêmur2. O protocolo inclui o planejamento do incremento gradual da compressão da amostra, o carregamento por meio de um estágio de compressão radiotransparente personalizado, a obtenção de imagens por meio de um microtomógrafo de grande volume e o processamento das imagens e dos perfis de carga.
Protocolo
O protocolo foi desenvolvido e testado com 12 espécimes de fêmur recebidos de um programa de doação de corpos. Os espécimes foram obtidos frescos e armazenados a −20 °C no Laboratório de Biomecânica e Implantes da Universidade de Flinders (Tonsley, Austrália do Sul, Austrália). A umidade óssea foi mantida durante todo o experimento. As doadoras foram mulheres brancas (66-80 anos). A autorização ética foi obtida do Comitê de Ética em Pesquisa Social e Comportamental (SBREC) da Universidade Flinders (Projeto # 6380).
1. Planejando um incremento de etapa de carga específico do espécime
- Digitalize o espécime do fêmur usando um tomógrafo clínico visando uma espessura de corte e um tamanho de pixel no plano de aproximadamente 0,5-0,7 mm. Esta etapa pode ser concluída por um radiógrafo especialista em qualquer instalação de imagem pública usando protocolos de imagem pré-gravados padrão para visualização óssea.
- Juntamente com a amostra, digitalize um simulador de calibração de densitometria por TC com cinco concentrações conhecidas de hidrogenofosfato dipotássico (K2HPO4, faixa de densidade equivalente aproximadamente entre 59 mg∙cm−3 e 375 mg∙cm−3).
- Segmentar a geometria óssea a partir das imagens clínicas deTC15, malhar a geometria segmentada do osso e mapear as propriedades do material isotrópico elemento por elemento para os valores de densidade óssea calibrados usando a relação densidade-módulo elástico relatada por Schileo et al.8. Salve a malha para análise adicional no software de elementos finitos. Conclua cada etapa seguindo as diretrizes relevantes fornecidas com o software de segmentação e elementos finitos.
- Importe a malha para o software de elementos finitos. Restringir totalmente a extremidade distal de 3-6 mm do modelo. Aplicar uma força nominal de 1.000 N, aduzida por 8° do eixo da diáfise femoral no plano coronal e passando pelo centro da cabeça femoral. Essa condição de carregamento imita uma tarefa estática de postura de uma perna (orthoload.com).
- Resolva o modelo de elementos finitos usando o solucionador PCG integrado (tolerância de convergência: 1 x 10−7).
OBS: Aqui foi utilizado o software de elementos finitos ANSYS.- Gere uma tabela de elementos contendo o primeiro e o terceiro componentes de deformação principal no centroide do elemento executando os seguintes comandos:
/POST1
ATUALIZÁVEL,, EPTO1,1
ATUALIZÁVEL,, EPTO3,3 - Calcule a razão de deformação entre o primeiro e o terceiro componentes principais de deformação no modelo e o rendimento ósseo de deformação em tensão (0,73% deformação) e compressão (1,04% deformação)8 (Figura 1) executando os seguintes comandos:
SMULT, RFT, EPTO1, 1/0.0074,1,
SMULT, RFT, EPTO3, ,1/0.0104,1,
- Gere uma tabela de elementos contendo o primeiro e o terceiro componentes de deformação principal no centroide do elemento executando os seguintes comandos:
- Dimensionar a força nominal pela razão do pico de deformação, tanto na tensão quanto na compressão, e descartar o maior dos dois para obter uma estimativa da carga de fratura. Determine o incremento de carga como 1/4 da carga de fratura calculada1.
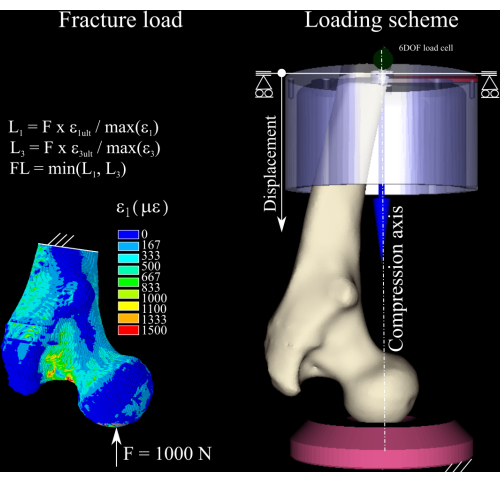
Figura 1: Cálculo da carga de fratura. O mapa de deformação de elementos finitos, as equações usadas para converter a força nominal na carga de fratura (esquerda) e o esquema de carregamento exibindo o fêmur (centro direito), o copo distal de alumínio (superior direito) e o soquete de pressão de polietileno (inferior direito). Clique aqui para ver uma versão maior desta figura.
2. Preparo da montagem do corpo de prova do fêmur (Figura 2)
- Retire a amostra do congelador (-20 °C).
- Descongelar à temperatura ambiente (TR) por 24 h, mantendo o espécime em um saco plástico impermeável envolto em material absorvente embebido em uma solução fisiológica para manter a umidade óssea.
- Cortar a diáfise femoral a 180 mm da cabeça femoral proximal.
- Centralize a cabeça femoral no eixo vertical da plataforma de alinhamento, alinhando o alvéolo de pressão de polietileno de forma côncava (Figura 2D) e a cabeça do fêmur.
- Alinhar o plano que contém o colo femoral e o eixo da diáfise com o plano frontal (Figura 2).
- Girar o eixo diafisário até 8° de adução de modo que o eixo vertical represente a orientação da força de reação do quadril durante uma postura estática unipodal (Figura 2).
- Prepare o cimento dentário seguindo as instruções do fabricante.
- Coloque a extremidade distal do espécime em um copo de vaso de alumínio com 55 mm de profundidade, preenchendo o copo de alumínio com cimento dental. Aguarde pelo menos 30 min para que o cimento complete a cura.
- Conservar o conjunto do espécime a -20 °C.
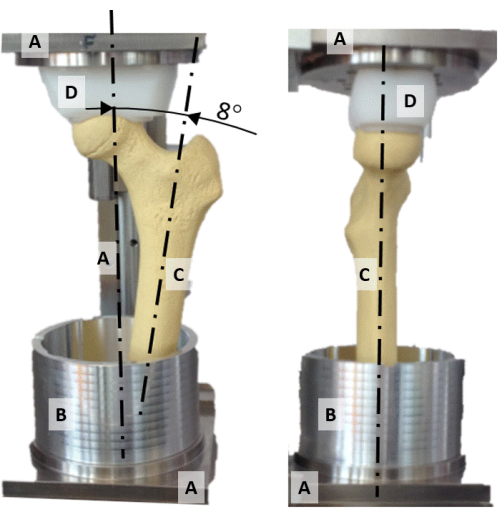
Figura 2: A plataforma de alinhamento. Uma foto frontal (esquerda) e lateral (direita) do equipamento de alinhamento exibindo (A) o quadro, (B) o copo de vaso de alumínio, (C) um modelo de fêmur sintético e (D) o soquete de pressão em forma esférica. Clique aqui para ver uma versão maior desta figura.
3. Montagem do estágio de compressão
NOTA: As dimensões externas do estágio de compressão são de 245 mm de diâmetro, 576 mm de altura e 14 kg de peso, excluindo a amostra. O estágio de compressão consiste em duas partes principais: a câmara de compressão e o atuador, que são montados da seguinte forma:
- Câmara de compressão
- Monte o soquete de pressão de polietileno (104 mm de diâmetro, 60 mm de altura) na parte inferior do cilindro de alumínio (203 mm de diâmetro, 3 mm de espessura de parede), que é fechado por uma placa de alumínio soldada em uma extremidade (fundo).
- Atuador
- Monte a estrutura superior usando o disco, as três hastes, a placa triangular e o trilho vertical (Figura 3).
- Monte o mecanismo screw-jack (curso: 150 mm, carga máxima: 10.000 N, relação da engrenagem: 27:1, deslocamento por rotação: 0,148 mm) na placa triangular.
- Monte o adaptador angular no trilho linear.
- Monte a mesa x-y de baixo atrito no adaptador angular.
- Monte os seis graus de liberdade da célula de carga (erro máximo de medição: 0,005%; força máxima: 10.000 N; torque máximo: 500 Nm) na mesa de baixo atrito alinhando o plano x-z da célula de carga ao plano frontal da estrutura superior.
- Conecte o parafuso do atuador ao adaptador angular.

Figura 3: O conjunto de estágio de compressão radiotransparente feito sob medida. Uma foto (esquerda) e um modelo (direita) do estágio compressivo. (A) A câmara de compressão, que é um cilindro de alumínio de 3 mm de espessura fechado na parte inferior; (B) o conjunto do atuador com a estrutura superior; (C) o mecanismo de parafuso; (D) a mesa x-y de baixo atrito; e (E) as células de carga de seis eixos são exibidas e indicadas no modelo. Clique aqui para ver uma versão maior desta figura.
4. Montagem do experimento
- Descongelar o espécime em TR por 24 h, mantendo-o em um saco plástico impermeável envolto em material absorvente embebido em uma solução fisiológica para manter a umidade óssea.
- Monte o conjunto da amostra de copo de alumínio na célula de carga alinhando o plano frontal do conjunto da amostra com o do atuador.
- Montar a estrutura superior, incluindo o corpo de prova, na câmara de compressão. Tome cuidado para alinhar a cabeça femoral com a concavidade esférica no soquete de pressão de polietileno. Certifique-se de que a cabeça femoral esteja engajada, mas frouxa dentro da cavidade esférica do soquete de pressão.
- Coloque o estágio compressivo no estágio de rotação do micro-tomógrafo na Imaging and Medical Beamline (IMBL).
- Conecte a célula de carga (erro < 0,005%; força máxima: 10.000 N; torque máximo: 500 Nm) ao amplificador de deformação.
- Conecte, via USB, o amplificador de tensão a um laptop equipado com o software aplicativo fornecido com a célula de carga.
- Acione o mecanismo do parafuso no estágio de compressão movendo a amostra para baixo em direção ao soquete de pressão enquanto monitora a força de reação medida pela célula de carga no laptop. Pare o mecanismo do parafuso quando uma força de compressão igual a 100 N for alcançada. Descarregar o espécime até 50 N de pré-carga.
- Selecione o único cintilador acoplado à lente do sensor pco.edge "Ruby" (http://archive.synchrotron.org.au/31-australian-synchrotron/imbl/811-preparation-for-imaging-experiments).
- Defina o campo de visão para 76,31 mm x 64,39 mm, que para o tamanho de matriz de 2.560 pixels x 2.160 pixels fornece um tamanho de pixel de 29,81 μm.
- Defina o eixo do estágio de rotação para 8 mm (horizontalmente) a partir do eixo do campo de visão (modo de varredura off-set) para estender o campo de visão para 145,71 mm x 64,39 mm a um tamanho de pixel de 29,81 μm.
- Ajuste os parâmetros de varredura para uma energia de feixe de 60 keV, um incremento rotacional de 0,1°, dois lotes de rotação de 180° (varredura off-set), um tempo de exposição de 50 μs e uma média de quadros de dois por posição rotacional.
- Configure a varredura para adquirir cinco varreduras verticais consecutivas, com um deslocamento vertical de 26 mm cada, de modo que a altura total do volume digitalizado seja de 132,2 mm para um tempo total de digitalização de 30 min.
5. Ensaios mecânicos com imagens microestruturais concomitantes
- Realizar micro-TC (tamanho do pixel: 0,03 mm) duas vezes na condição de referência (tomada como uma condição de tensão zero).
- Aplicar o incremento de força acionando manualmente o mecanismo screw-jack a uma taxa constante de aproximadamente 1 s por rodada (0,1-0,2 mm/s).
- Realizar micro-TC.
- Repetir os passos 5.2 e 5.3 até causar a fratura do espécime, conforme indicado por uma queda brusca da força de reação.
- Realizar micro-TC do espécime fraturado.
- Costurar as 1.800 imagens de projeção (2.560 pixels x 896 pixels de tamanho, 76,8 mm x 26,88 mm, largura x altura, imagens de ponto flutuante de 32 bits). O processo costura duas imagens de projeção (tiradas no modo de varredura off-set horizontal) e as cinco imagens deslocadas verticalmente, produzindo assim uma única imagem de projeção.
- Reconstrua o volume das imagens de seção transversal (4.407 imagens, cada imagem com 4.888 x 4.888 pixels) e salve-as como arquivos de ponto flutuante de 32 bits no . Formato TIFF (ocupando 392 GB de espaço em disco).
- Aplique um filtro Gaussiano 3 x 3 para reduzir o ruído. Converta as imagens em 8 bits (256 imagens de nível cinza, salvas em formato bitmap, ocupando aproximadamente 100 GB por volume).
OBS: Neste trabalho, o processamento das imagens foi realizado utilizando um software disponível no Síncrotron Australiano sob a orientação do operador do IMBL.
6. Cálculo do campo de deslocamento e deformação
- Subamostrar as imagens de seção transversal em quatro (120 μm/pixel) para reduzir o tempo de computação.
- Registar rigidamente no espaço as imagens do espécime sob carga com as do espécime na condição de referência descarregada. Utilizar a diáfise distal como alvo do co-registro (Arquivo Suplementar 1 e Arquivo Suplementar 2).
- Criar modelos tridimensionais de superfície (. STL) para visualização após binarização das imagens demicro-TC11.
- Registre elasticamente o volume da imagem no volume de referência usando um tamanho de grade igual a 50 pixels (SDER = 0,076% de erro de deformação, BoneDVC, https://bonedvc.insigneo.org/dvc/) para determinar os deslocamentos nos nós da grade.
- Converter a grade em um modelo de elementos finitos. Aplique o deslocamento nodal calculado pelo BoneDVC ao modelo. Resolva o modelo para determinar o tensor de deformação sobre todo o volume ósseo.
- Repita a análise na região que mostra os níveis de deformação mais altos usando as imagens de resolução total.
- Mapeie os mapas de deformação DVC para as imagens de resolução total usando interpolação cúbica com a função interp3 (Matlab)2.
- Visualize os deslocamentos, deformações e imagens microestruturais para visualização e animação de grande volume (Matlab)2.
7. Análise
- Mostrar a deformação permanente do osso (dano) sobrepondo as imagens obtidas nas condições de descarga e após a fratura2.
- Mostrar a deformação microestrutural progressiva do osso sobrepondo os modelos tridimensionais em condições de descarga, em níveis crescentes de carga e pós-fratura2.
- Mostre a tensão do osso no local da fratura2.
- Analisar a energia de deformação, rigidez e deslocamento usando estatística descritiva e métodos de regressão2.
Resultados
As imagens mostram todo o fêmur proximal, o alvéolo de pressão, o cimento dental, o copo de alumínio e o tecido envolvente. A microarquitetura óssea pode ser vista deformando progressivamente à medida que a carga aumenta antes e após a fratura (Figura 4).

Figura 4: O estágio compressivo conect...
Discussão
O presente protocolo permite estudar a micromecânica do tempo decorrido das fraturas de quadril em três dimensões ex vivo. Um estágio compressivo radiotransparente (alumínio) capaz de aplicar uma deformação progressiva na metade proximal do fêmur humano e medir a força de reação foi projetado, fabricado e testado sob medida. Um microtomógrafo de grande volume é empregado neste protocolo para fornecer uma sequência temporal de volumes de imagens exibindo todo o fêmur proximal com carga progressiva ...
Divulgações
Todos os autores declaram não haver conflitos de interesse.
Agradecimentos
Financiamento do Australian Research Council (FT180100338; IC190100020) é reconhecido com gratidão.
Materiais
| Name | Company | Catalog Number | Comments |
| Absorbent tissue | N/A | Maintain the bone moisture throughout the experiment | |
| Alignment rig | Custom-made | Rig for positioning the specimen in the potting cup | |
| Aluminium potting cup | Custom-made | Potting cup | |
| Bone saw | N/A | Cut the specimen to size | |
| Calibration phantom QCT Pro | Mindways Software, Inc., Austin, USA | CT Calibration 13002 | Calibrate grey levels in the images into equivalent bone mineral (ash) density levels |
| Clinical Computed-Tmography scanner | General Electric Medical Systems Co., Wisconsin, USA | Optima CT660 | Preliminary imaging for the prediction of the load step to fracture |
| Compressive stage | Custom-made | A 10 kg, radiotransparent compressive stage for applying and maintaining throught imaging a prescribed deformation to the specimen. | |
| Dental cement | Soesterberg, The Netherlands | Vertex RS | |
| Femur specimen | Science Care, Phoenix, USA | ||
| Finite-element analysis software | ANSYS Inc., Canonsburg, USA | ANSYS Mechanical APDL | Finite-element software package |
| Freezer | N/A | Store specimens at -20 °C | |
| Hard Drive | Dell | Disk space: 500 GB per volume | |
| Image bnarization and segmentation software | Skyscan-Bruker, Kontich, Belgium | CT analyzer | Image processing software |
| Image elastic segmentation | The University of Sheffield | Bone DVC | https://bonedvc.insigneo.org/dvc/ |
| Image processing and automation software | The MathWork Inc. | Matlab | Image processing software |
| Image registration software | Skyscan-Bruker, Kontich, Belgium | DataViewer | Image processing software |
| Image segmentation and FE modelling software | Simpleware, Exeter, UK | Scan IP | Bone egmentation software |
| Image stiching script | Australian syncrotron, Clayton, VIC, AU | The script is available at IMBL | |
| Image visualization | Kitware, Clifton Park, NY, USA | Paraview | Image visualization |
| Image visualization | Australian National University | Dristhi | Image visualization: doi:10.1117/12.935640 |
| Imaging and Medical beamline | Australian syncrotron, Clayton, VIC, AU | Large object micro-CT beamline at the Australian Synchrotron | |
| Laptop | Dell Inc., USA | ||
| Low-friction x-y table | THK Co., Tokyo, Japan | ||
| NI signal acquisition software | National Instruments, Austin, TX | NI-DAQmx | |
| Phosphate-buffered saline solution | Custom-made | Maintain the bone moisture throughout the experiment | |
| Plastic bag | N/A | Maintain the bone moisture throughout the experiment | |
| Rail | SKF Inc., Lansdale, PA, USA | ||
| Screw-jack mechanism | Benzlers, Örebro, Sweden | Serie BD (warm gear unit) | stroke: 150 mm, maximal load: 10,000 N, gear ratio: 27:1, a displacement per revolution: 0.148 mm |
| Single pco.edge sensor, lens coupled scintillator | Australian syncrotron, Clayton, VIC, AU | Detector Ruby FOV: 141 x 119 mm; 2560 x 2160 px; 55 µm/px; 50 fps | |
| Six axis load cell | ME-Meßsysteme GmbH, Hennigsdorf, GE | K6D6 | Maximal measurement error: 0.005%; maximal force: 10000 N; maximal torque: 500 Nm |
| Strain amplifier | ME-Meßsysteme GmbH, Hennigsdorf, GE | GSV-1A8USB K6D/M16 |
Referências
- Martelli, S., Perilli, E. Time-elapsed synchrotron-light microstructural imaging of femoral neck fracture. Journal of the Mechanical Behavior of Biomedical Materials. 84, 265-272 (2018).
- Martelli, S., Giorgi, M., Dall' Ara, E., Perilli, E. Damage tolerance and toughness of elderly human femora. Acta Biomaterialia. 123, 167-177 (2021).
- Perilli, E., et al. Dependence of mechanical compressive strength on local variations in microarchitecture in cancellous bone of proximal human femur. Journal of Biomechanics. 41 (2), 438-446 (2008).
- Thurner, P. J., et al. Time-lapsed investigation of three-dimensional failure and damage accumulation in trabecular bone using synchrotron light. Bone. 39 (2), 289-299 (2006).
- Jackman, T. M. Quantitative, 3D visualization of the initiation and progression of vertebral fractures under compression and anterior flexion. Journal of Bone and Mineral Research. 31 (4), 777-788 (2016).
- Mayhew, P. M., et al. Relation between age, femoral neck cortical stability, and hip fracture risk. Lancet. 366 (9480), 129-135 (2005).
- Nazarian, A., Stauber, M., Zurakowski, D., Snyder, B. D., Müller, R. The interaction of microstructure and volume fraction in predicting failure in cancellous bone. Bone. 39 (6), 1196-1202 (2006).
- Schileo, E., et al. To what extent can linear finite element models of human femora predict failure under stance and fall loading configurations. Journal of Biomechanics. 47 (14), 3531-3538 (2014).
- Schileo, E., et al. An accurate estimation of bone density improves the accuracy of subject-specific finite element models. Journal of Biomechanics. 41 (11), 2483-2491 (2008).
- Dall'ara, E., et al. A nonlinear QCT-based finite element model validation study for the human femur tested in two configurations in vitro. Bone. 52 (1), 27-38 (2013).
- Perilli, E., Parkinson, I. H., Reynolds, K. J. Micro-CT examination of human bone: from biopsies towards the entire organ. Annali dell'Istituto Superiore di Sanità. 48 (1), 75-82 (2012).
- Wearne, L. S., Rapagna, S., Taylor, M., Perilli, E. Micro-CT scan optimisation for mechanical loading of tibia with titanium tibial tray: A digital volume correlation zero strain error analysis. Journal of the Mechanical Behavior of Biomedical Materials. 134, 105336 (2022).
- Bennett, K. J., et al. Ex vivo assessment of surgically repaired tibial plateau fracture displacement under axial load using large-volume micro-CT. Journal of Biomechanics. 144, 111275 (2022).
- Falcinelli, C., et al. Multiple loading conditions analysis can improve the association between finite element bone strength estimates and proximal femur fractures: A preliminary study in elderly women. Bone. 67, 71-80 (2014).
- Orthopedic Image Segmentation. Synopsys Available from: https://www.synopsys.com/simpleware/news-and-events/ortho-medical-image-segmentation.html (2020)
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados