Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Визуализация механизма микроструктурного разрушения тазобедренного сустава человека
В этой статье
Резюме
Протокол позволяет измерять деформацию микроструктуры кости во всем проксимальном отделе бедренной кости человека и ее прочность, сочетая микрокомпьютерную томографию большого объема, компрессионную стадию, изготовленную по индивидуальному заказу, и передовые инструменты обработки изображений.
Аннотация
Визуализация микроструктуры кости при прогрессивно возрастающих нагрузках позволяет наблюдать за поведением микроструктурного разрушения кости. В данной работе мы описываем протокол получения последовательности трехмерных микроструктурных изображений всего проксимального отдела бедренной кости при прогрессивно нарастающей деформации, вызывающей клинически значимые переломы шейки бедренной кости. Протокол продемонстрирован на примере четырех бедренных костей доноров женского пола в возрасте 66-80 лет с нижней границей минеральной плотности костной ткани в популяции (диапазон Т-критерия = от −2,09 до −4,75). Радиопрозрачный компрессионный столик был разработан для нагружения образцов, воспроизводящих стойку на одной ноге, с одновременным регистрированием приложенной нагрузки при микрокомпьютерной томографии (микро-КТ). Поле зрения составляло 146 мм в ширину и 132 мм в высоту, а размер изотропного пикселя — 0,03 мм. Приращение силы было основано на конечно-элементных прогнозах нагрузки на разрушение. Стадия сжатия использовалась для приложения смещения к образцу и введения заданного приращения усилия. Субкапитальные переломы из-за вскрытия и сдвига шейки бедренной кости происходили после четырех-пяти приращений нагрузки. Микро-КТ-изображения и измерения силы реакции были обработаны для изучения деформации кости и способности поглощать энергию. Нестабильность коры головного мозга проявилась на ранних этапах нагрузки. Субхондральная кость головки бедренной кости демонстрировала большие деформации, достигавшие 16% до перелома, и прогрессирующее увеличение опорной способности вплоть до перелома. Энергия деформации линейно возрастала со смещением вплоть до разрушения, в то время как жесткость снижалась до околонулевых значений непосредственно перед разрушением. Три четверти энергии разрушения было поглощено образцом во время заключительного 25-процентного приращения силы. В заключение, разработанный протокол показал замечательную способность поглощать энергию, или устойчивость к повреждениям, а также синергетическое взаимодействие между кортикальной и трабекулярной костью в пожилом возрасте донора.
Введение
Переломы шейки бедренной кости являются серьезным бременем для стареющего населения. Микрокомпьютерная томография (микро-КТ) и сопутствующее механическое исследование позволяют наблюдать микроструктуру кости и изучать ее связь с прочностью кости, ее возрастными изменениями и смещениями под нагрузкой 1,2. Однако до недавнего времени микро-КТ исследований костей под нагрузкой ограничивались иссеченными костными ядрами3, мелкими животными4 и позвоночником человека5. Настоящий протокол позволяет количественно оценить смещение микроструктуры всего проксимального отдела бедренной кости человека под нагрузкой и после перелома.
Было проведено несколько исследований по изучению недостаточности бедренной кости человека, и иногда они приходили к противоположным выводам. Например, считается, что возрастное истончение кортикальных и трабекулярных структур определяет возрастную предрасположенность к переломам, вызывая эластическую нестабильность кости6,7, что явно контрастирует с высоким коэффициентом определения деформации коры и прогнозов прочности бедренной кости при условии отсутствия эластической нестабильности (R2 = 0,80-0,97)8,9. Тем не менее, такие исследования систематически недооценивали прочность бедренной кости (на 21%-29%), что ставит под сомнение хрупкие и квазихрупкие костные реакции, реализованные в моделях 8,10. Одно из возможных объяснений этих, казалось бы, противоречащих друг другу результатов может заключаться в различном поведении при переломе целых костей по сравнению с изолированными костными ядрами. Таким образом, наблюдение за реакцией на деформацию и перелом микроструктуры кости во всем проксимальном отделе бедренной кости может углубить знания о механике перелома бедра и связанных с ней приложениях.
Существующие методы визуализации целых костей человека с микрометрическим разрешением ограничены. Размер портала и детектора должен обеспечивать подходящий рабочий объем для размещения проксимального отдела бедренной кости человека (примерно 13 см x 10 см, ширина x длина) и, возможно, размер пикселя порядка 0,02-0,03 мм, чтобы обеспечить возможность захвата соответствующих микроархитектурных элементов11. В настоящее время этим спецификациям могут соответствовать некоторые синхротронныеустановки1 и некоторые коммерчески доступные микрокомпьютерные томографыбольшого объема 12,13. Компрессионная ступень должна быть радиопрозрачной, чтобы свести к минимуму ослабление рентгеновского излучения и создать силу, достаточную для того, чтобы вызвать перелом бедренной кости человека (например, от 0,9 кН до 14,3 кН для пожилых белых женщин)14. Такое большое изменение нагрузки на трещину усложняет планирование количества этапов нагружения до разрушения, общего времени эксперимента и соответствующего объема получаемых данных. Для решения этой проблемы нагрузка и локализация перелома могут быть оценены с помощью конечно-элементного моделирования с использованием распределения плотности костной ткани образца по изображениям клинической компьютерной томографии (КТ) 1,2. Наконец, после эксперимента большой объем полученных данных необходимо обработать для изучения механизмов отказа и способности к диссипации энергии во всей бедренной кости человека.
Здесь мы описываем протокол получения последовательности трехмерных микроструктурных изображений всего проксимального отдела бедренной кости при прогрессивно нарастающей деформации, которая вызывает клинически значимые переломы шейки бедренной кости2. Протокол включает в себя планирование ступенчатого приращения сжатия образца, нагружение с помощью специальной радиопрозрачной компрессионной ступени, визуализацию с помощью микрокомпьютерного томографа большого объема и обработку изображений и профилей нагрузки.
протокол
Протокол был разработан и протестирован на 12 образцах бедренной кости, полученных в рамках программы донорства тела. Образцы получали свежими и хранили при температуре −20 °C в Лаборатории биомеханики и имплантатов Университета Флиндерса (Тонсли, Южная Австралия, Австралия). Влажность костей поддерживалась на протяжении всего эксперимента. Донорами выступили женщины кавказской расы (66-80 лет). Этическое разрешение было получено от Комитета по этике социальных и поведенческих исследований (SBREC) Университета Флиндерса (Project # 6380).
1. Планирование шага нагрузки для конкретного образца
- Отсканируйте образец бедренной кости с помощью клинического компьютерного томографа, ориентируясь на толщину среза и размер пикселя в плоскости примерно 0,5-0,7 мм. Этот этап может быть выполнен экспертом-рентгенологом в любом общественном учреждении визуализации с использованием стандартных предварительно записанных протоколов визуализации для визуализации костей.
- Вместе с образцом отсканируйте калибровочный фантом для КТ-денситометрии с пятью известными концентрациями дикалийгидрофосфата (K2HPO4, эквивалентный диапазон плотности примерно от 59 мг∙см−3 до 375 мг∙см−3).
- Сегментируйте геометрию кости по клиническим КТ-изображениям15, создайте сетку сегментированной геометрии кости и сопоставьте изотропные свойства материала элемент за элементом с калиброванными значениями плотности костной ткани, используя зависимость плотности от модуля упругости, о которой сообщили Schileo et al.8. Сохраните сетку для дальнейшего анализа в программном обеспечении конечных элементов. Выполняйте каждый шаг, следуя соответствующим рекомендациям, прилагаемым к программному обеспечению сегментации и конечных элементов.
- Импортируйте сетку в конечно-элементное программное обеспечение. Полностью ограничьте дистальный конец модели на 3-6 мм. Приложите номинальное усилие 1000 Н, приводимое под углом 8° от оси бедренного стержня в корональной плоскости и проходящее через центр головки бедренной кости. Это условие нагружения имитирует статическую задачу стояния на одной ноге (orthoload.com).
- Решить конечно-элементную модель с помощью встроенного решателя PCG (допуск сходимости: 1 x 10−7).
ПРИМЕЧАНИЕ: Здесь использовалось конечно-элементное программное обеспечение ANSYS.- Сгенерируйте таблицу элементов, содержащую первый и третий компоненты главной деформации в центроиде элемента, выполнив следующие команды:
/ПОСТ1
ETABLE,, EPTO1,1
ETABLE,, EPTO3,3 - Рассчитайте коэффициент деформации между первым и третьим основными компонентами деформации в модели и деформацией текучести кости при растяжении (деформация 0,73%) и сжатии (деформация 1,04%)8 (рис. 1), выполнив следующие команды:
SMULT,RFT,EPTO1, ,1/0.0074,1,
СМУЛЬТ, РФТ, ЭПТО3, ,1/0,0104,1,
- Сгенерируйте таблицу элементов, содержащую первый и третий компоненты главной деформации в центроиде элемента, выполнив следующие команды:
- Масштабируйте номинальную силу по коэффициенту пиковой деформации как при растяжении, так и при сжатии и отбрасывайте наибольший из двух, чтобы получить оценку нагрузки на разрушение. Определите приращение нагрузки как 1/4 расчетной нагрузки разрушения1.
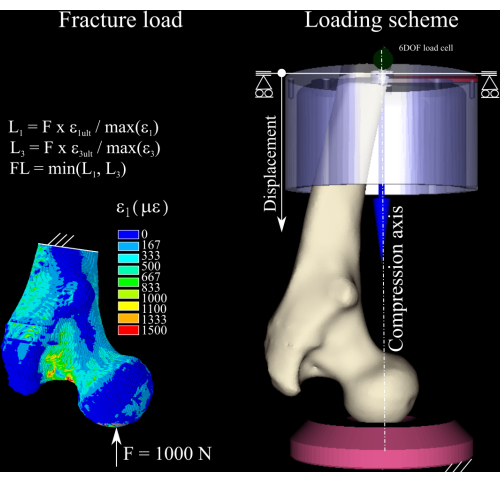
Рисунок 1: Расчет нагрузки на разрушение. Карта деформации конечных элементов, уравнения, используемые для преобразования номинальной силы в нагрузку на разрушение (слева), и схема нагружения, отображающая бедренную кость (в центре справа), дистальную алюминиевую чашку (вверху справа) и полиэтиленовую напорную раструбку (внизу справа). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
2. Подготовка образца бедренной кости в сборе (Рисунок 2)
- Достаньте образец из морозильной камеры (−20 °C).
- Разморозьте при комнатной температуре (RT) в течение 24 часов, держа образец в водонепроницаемом полиэтиленовом пакете, завернутом в абсорбирующий материал, пропитанный физиологическим раствором для поддержания влажности кости.
- Разрезают диафиз бедренной кости на расстоянии 180 мм от проксимального отдела головки бедренной кости.
- Центрируйте головку бедренной кости по вертикальной оси юстировочной установки, совместив вогнутое полиэтиленовое напорное гнездо (рис. 2D) и головку бедренной кости.
- Совместите плоскость, содержащую шейку бедренной кости и ось диафиза, с фронтальной плоскостью (рисунок 2).
- Поверните диафизарную ось до приведения 8° так, чтобы вертикальная ось представляла ориентацию силы реакции бедра во время статической стойки на одной ноге (рис. 2).
- Приготовьте стоматологический цемент, следуя инструкциям производителя.
- Поместите дистальный конец образца в алюминиевый стаканчик глубиной 55 мм, заполнив алюминиевый стаканчик стоматологическим цементом. Подождите не менее 30 минут, чтобы цемент полностью затвердел.
- Храните образец в сборе при температуре −20 °C.
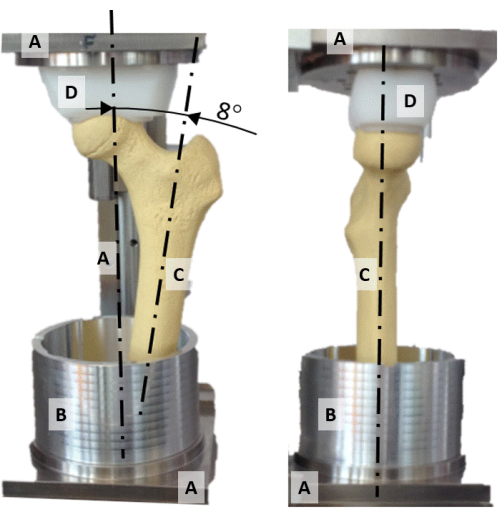
Рисунок 2: Юстировочная установка. Фронтальная (слева) и боковая (справа) фотография юстировочного стенда, на которой изображены (A) рама, (B) алюминиевый стаканчик для заливки, (C) синтетическая модель бедренной кости и (D) напорное гнездо сферической формы. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
3. Сборка ступени сжатия
ПРИМЕЧАНИЕ: Внешние размеры ступени сжатия составляют 245 мм в диаметре, 576 мм в высоту и вес 14 кг без учета образца. Ступень сжатия состоит из двух основных частей: камеры сжатия и привода, которые собраны следующим образом:
- Камера сжатия
- Установите полиэтиленовый напорный патрубок (диаметр 104 мм, высота 60 мм) в нижней части алюминиевого баллона (диаметр 203 мм, толщина стенки 3 мм), который закрывается приваренной алюминиевой пластиной с одного конца (снизу).
- Привод
- Соберите верхнюю конструкцию с помощью диска, трех стержней, треугольной пластины и вертикальной направляющей (Рисунок 3).
- Установите винтовой домкратный механизм (ход: 150 мм, максимальная нагрузка: 10 000 Н, передаточное число: 27:1, рабочий объем на оборот: 0,148 мм) на треугольной пластине.
- Установите угловой адаптер на линейную направляющую.
- Установите стол x-y с низким коэффициентом трения на угловой адаптер.
- Установите тензодатчик с шестью степенями свободы (максимальная погрешность измерения: 0,005%; максимальная сила: 10 000 Н; максимальный крутящий момент: 500 Нм) на стол с низким коэффициентом трения, совместив плоскость x-z тензодатчика с фронтальной плоскостью верхней конструкции.
- Подсоедините винт привода к угловому адаптеру.

Рисунок 3: Изготовленная по индивидуальному заказу радиопрозрачная ступень сжатия. Фотография (слева) и модель (справа) компрессионной ступени. (A) Камера сжатия, представляющая собой алюминиевый цилиндр толщиной 3 мм, закрытый снизу; (B) привод в сборе с верхней конструкцией; (C) винтовой домкратный механизм; (D) таблица x-y с низким коэффициентом трения; и (E) шестиосевой тензодатчик отображаются и указываются на модели. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
4. Постановка эксперимента
- Разморозьте образец в RT в течение 24 часов, храня его в водонепроницаемом пластиковом пакете, завернутом в абсорбирующий материал, пропитанный физиологическим раствором для поддержания влажности кости.
- Установите узел образца из алюминиевой чашки на тензодатчик, совместив фронтальную плоскость узла образца с плоскостью привода.
- Соберите верхнюю конструкцию, включая образец, в камеру сжатия. Позаботьтесь о том, чтобы головка бедренной кости совпадала со сферической вогнутостью на полиэтиленовом напорном гнезде. Убедитесь, что головка бедренной кости задействована, но провисает в сферической полости напорной впадины.
- Поместите компрессионный столик на вращающийся столик микро-КТ-сканера в центре визуализации и медицинского пучка (IMBL).
- Подключите тензодатчик (погрешность < 0,005%; максимальное усилие: 10 000 Н; максимальный крутящий момент: 500 Нм) к усилителю деформации.
- Подключите усилитель деформации через USB к портативному компьютеру, оснащенному прикладным программным обеспечением, поставляемым с тензодатчиком.
- Приводите в действие винтовой механизм на стадии сжатия, перемещая образец вниз к нажимному гнезду, одновременно контролируя силу реакции, измеряемую тензодатчиком в ноутбуке. Остановите винтовой механизм, как только будет достигнуто усилие сжатия, равное 100 Н. Выгрузите образец до предварительной нагрузки 50 Н.
- Выберите сцинтиллятор с одним датчиком pco.edge "Ruby" (http://archive.synchrotron.org.au/31-australian-synchrotron/imbl/811-preparation-for-imaging-experiments).
- Установите поле зрения 76,31 мм x 64,39 мм, что для размера массива 2 560 x 2 160 пикселей обеспечивает размер пикселя 29,81 мкм.
- Установите ось вращающегося столика на расстоянии 8 мм (по горизонтали) от оси поля зрения (режим сканирования со смещением), чтобы расширить поле зрения до 145,71 мм x 64,39 мм при размере пикселя 29,81 мкм.
- Установите параметры сканирования на энергию луча 60 кэВ, приращение вращения 0,1°, две партии поворота на 180° (сканирование со смещением), время экспозиции 50 мкс и усреднение кадров по два на положение вращения.
- Настройте сканирование на получение пяти последовательных вертикальных сканов со сдвигом по вертикали на 26 мм каждое, чтобы общая высота сканируемого тома составляла 132,2 мм при общем времени сканирования 30 минут.
5. Механические испытания с сопутствующей микроструктурной визуализацией
- Выполните микрокомпьютерную томографию (размер пикселя: 0,03 мм) дважды в эталонном состоянии (принятом как условие нулевой деформации).
- Приращение усилия осуществляется путем ручного приведения в действие винтового домкрата с постоянной скоростью примерно 1 с на патрон (0,1-0,2 мм/с).
- Выполните микрокомпьютерную томографию.
- Повторите шаги 5.2 и 5.3 до тех пор, пока образец не будет разрушен, на что указывает внезапное падение силы реакции.
- Выполните микрокомпьютерную томографию образца с переломом.
- Сшите 1 800 проекционных изображений (размер 2 560 пикселей x 896 пикселей, 76,8 мм x 26,88 мм, ширина x высота, 32-битные изображения с плавающей запятой). В ходе этого процесса сшиваются два проекционных изображения (снятых в режиме горизонтального офсетного сканирования) и пять изображений, сдвинутых по вертикали, в результате чего получается единое проекционное изображение.
- Восстановите объем изображений поперечного сечения (4 407 изображений, каждое изображение размером 4 888 x 4 888 пикселей) и сохраните их в виде 32-разрядных файлов с плавающей запятой в формате . Формат TIFF (занимающий 392 ГБ дискового пространства).
- Примените фильтр Гаусса 3 x 3 для уменьшения шума. Преобразуйте изображения в 8-битные (256 изображений с уровнями серого, сохраненных в растровом формате, занимающих примерно 100 ГБ на том).
ПРИМЕЧАНИЕ: В данной работе обработка изображений проводилась с использованием программного обеспечения, имеющегося на Австралийском синхротроне, под руководством оператора IMBL.
6. Расчет поля перемещений и деформаций
- Субдискретизация изображений поперечного сечения на четыре (120 мкм/пиксель) для сокращения времени вычисления.
- Жесткая совместная регистрация в пространстве изображений образца под нагрузкой с изображениями образца в ненагруженном эталонном состоянии. Используйте дистальный диафиз в качестве мишени для совместной регистрации (Дополнительный файл 1 и Дополнительный файл 2).
- Создание трехмерных моделей поверхностей (. STL) для визуализации после бинаризации микро-КТ изображений11.
- Упруго зарегистрируйте объем изображения до эталонного объема, используя размер сетки, равный 50 пикселям (SDER = 0,076% погрешности деформации, BoneDVC, https://bonedvc.insigneo.org/dvc/) для определения смещений в узлах сетки.
- Преобразуйте сетку в конечно-элементную модель. Примените к модели узловое смещение, рассчитанное с помощью BoneDVC. Решите модель, чтобы определить тензор деформации по всему объему кости.
- Повторите анализ в области, показывающей самые высокие уровни деформации, используя изображения с полным разрешением.
- Сопоставьте карты деформации DVC с изображениями с полным разрешением с помощью кубической интерполяции с функцией interp3 (Matlab)2.
- Визуализация изображений смещений, деформаций и микроструктур для визуализации больших объемов и анимации (Matlab)2.
7. Анализ
- Отображение остаточной деформации кости (повреждения) путем наложения изображений, полученных в ненагруженных условиях и после перелома2.
- Отображение прогрессирующей микроструктурной деформации кости путем наложения трехмерных моделей в ненагруженных условиях, при возрастающих уровнях нагрузки и после перелома2.
- Отобразите деформацию кости в месте перелома2.
- Анализ энергии деформации, жесткости и смещения с использованием описательной статистики и методов регрессии2.
Результаты
На изображениях видна вся проксимальная часть бедренной кости, прижимная впадина, зубной цемент, алюминиевая чашка и оберточная ткань. Микроархитектура кости прогрессивно деформируется по мере увеличения нагрузки до и после перелома (рис. 4).
Обсуждение
Настоящий протокол позволяет изучать микромеханику переломов шейки бедра в трех измерениях ex vivo. Радиопрозрачная (алюминиевая) компрессионная ступень, способная оказывать прогрессирующую деформацию на проксимальную половину бедренной кости человека и измерять силу реакции, бы?...
Раскрытие информации
Все авторы заявляют об отсутствии конфликта интересов.
Благодарности
Финансирование со стороны Австралийского исследовательского совета (FT180100338; IC190100020) с благодарностью.
Материалы
| Name | Company | Catalog Number | Comments |
| Absorbent tissue | N/A | Maintain the bone moisture throughout the experiment | |
| Alignment rig | Custom-made | Rig for positioning the specimen in the potting cup | |
| Aluminium potting cup | Custom-made | Potting cup | |
| Bone saw | N/A | Cut the specimen to size | |
| Calibration phantom QCT Pro | Mindways Software, Inc., Austin, USA | CT Calibration 13002 | Calibrate grey levels in the images into equivalent bone mineral (ash) density levels |
| Clinical Computed-Tmography scanner | General Electric Medical Systems Co., Wisconsin, USA | Optima CT660 | Preliminary imaging for the prediction of the load step to fracture |
| Compressive stage | Custom-made | A 10 kg, radiotransparent compressive stage for applying and maintaining throught imaging a prescribed deformation to the specimen. | |
| Dental cement | Soesterberg, The Netherlands | Vertex RS | |
| Femur specimen | Science Care, Phoenix, USA | ||
| Finite-element analysis software | ANSYS Inc., Canonsburg, USA | ANSYS Mechanical APDL | Finite-element software package |
| Freezer | N/A | Store specimens at -20 °C | |
| Hard Drive | Dell | Disk space: 500 GB per volume | |
| Image bnarization and segmentation software | Skyscan-Bruker, Kontich, Belgium | CT analyzer | Image processing software |
| Image elastic segmentation | The University of Sheffield | Bone DVC | https://bonedvc.insigneo.org/dvc/ |
| Image processing and automation software | The MathWork Inc. | Matlab | Image processing software |
| Image registration software | Skyscan-Bruker, Kontich, Belgium | DataViewer | Image processing software |
| Image segmentation and FE modelling software | Simpleware, Exeter, UK | Scan IP | Bone egmentation software |
| Image stiching script | Australian syncrotron, Clayton, VIC, AU | The script is available at IMBL | |
| Image visualization | Kitware, Clifton Park, NY, USA | Paraview | Image visualization |
| Image visualization | Australian National University | Dristhi | Image visualization: doi:10.1117/12.935640 |
| Imaging and Medical beamline | Australian syncrotron, Clayton, VIC, AU | Large object micro-CT beamline at the Australian Synchrotron | |
| Laptop | Dell Inc., USA | ||
| Low-friction x-y table | THK Co., Tokyo, Japan | ||
| NI signal acquisition software | National Instruments, Austin, TX | NI-DAQmx | |
| Phosphate-buffered saline solution | Custom-made | Maintain the bone moisture throughout the experiment | |
| Plastic bag | N/A | Maintain the bone moisture throughout the experiment | |
| Rail | SKF Inc., Lansdale, PA, USA | ||
| Screw-jack mechanism | Benzlers, Örebro, Sweden | Serie BD (warm gear unit) | stroke: 150 mm, maximal load: 10,000 N, gear ratio: 27:1, a displacement per revolution: 0.148 mm |
| Single pco.edge sensor, lens coupled scintillator | Australian syncrotron, Clayton, VIC, AU | Detector Ruby FOV: 141 x 119 mm; 2560 x 2160 px; 55 µm/px; 50 fps | |
| Six axis load cell | ME-Meßsysteme GmbH, Hennigsdorf, GE | K6D6 | Maximal measurement error: 0.005%; maximal force: 10000 N; maximal torque: 500 Nm |
| Strain amplifier | ME-Meßsysteme GmbH, Hennigsdorf, GE | GSV-1A8USB K6D/M16 |
Ссылки
- Martelli, S., Perilli, E. Time-elapsed synchrotron-light microstructural imaging of femoral neck fracture. Journal of the Mechanical Behavior of Biomedical Materials. 84, 265-272 (2018).
- Martelli, S., Giorgi, M., Dall' Ara, E., Perilli, E. Damage tolerance and toughness of elderly human femora. Acta Biomaterialia. 123, 167-177 (2021).
- Perilli, E., et al. Dependence of mechanical compressive strength on local variations in microarchitecture in cancellous bone of proximal human femur. Journal of Biomechanics. 41 (2), 438-446 (2008).
- Thurner, P. J., et al. Time-lapsed investigation of three-dimensional failure and damage accumulation in trabecular bone using synchrotron light. Bone. 39 (2), 289-299 (2006).
- Jackman, T. M. Quantitative, 3D visualization of the initiation and progression of vertebral fractures under compression and anterior flexion. Journal of Bone and Mineral Research. 31 (4), 777-788 (2016).
- Mayhew, P. M., et al. Relation between age, femoral neck cortical stability, and hip fracture risk. Lancet. 366 (9480), 129-135 (2005).
- Nazarian, A., Stauber, M., Zurakowski, D., Snyder, B. D., Müller, R. The interaction of microstructure and volume fraction in predicting failure in cancellous bone. Bone. 39 (6), 1196-1202 (2006).
- Schileo, E., et al. To what extent can linear finite element models of human femora predict failure under stance and fall loading configurations. Journal of Biomechanics. 47 (14), 3531-3538 (2014).
- Schileo, E., et al. An accurate estimation of bone density improves the accuracy of subject-specific finite element models. Journal of Biomechanics. 41 (11), 2483-2491 (2008).
- Dall'ara, E., et al. A nonlinear QCT-based finite element model validation study for the human femur tested in two configurations in vitro. Bone. 52 (1), 27-38 (2013).
- Perilli, E., Parkinson, I. H., Reynolds, K. J. Micro-CT examination of human bone: from biopsies towards the entire organ. Annali dell'Istituto Superiore di Sanità. 48 (1), 75-82 (2012).
- Wearne, L. S., Rapagna, S., Taylor, M., Perilli, E. Micro-CT scan optimisation for mechanical loading of tibia with titanium tibial tray: A digital volume correlation zero strain error analysis. Journal of the Mechanical Behavior of Biomedical Materials. 134, 105336 (2022).
- Bennett, K. J., et al. Ex vivo assessment of surgically repaired tibial plateau fracture displacement under axial load using large-volume micro-CT. Journal of Biomechanics. 144, 111275 (2022).
- Falcinelli, C., et al. Multiple loading conditions analysis can improve the association between finite element bone strength estimates and proximal femur fractures: A preliminary study in elderly women. Bone. 67, 71-80 (2014).
- Orthopedic Image Segmentation. Synopsys Available from: https://www.synopsys.com/simpleware/news-and-events/ortho-medical-image-segmentation.html (2020)
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены