Method Article
組織再生研究のプラットフォームとしてのヒト卵巣表面上皮オルガノイド
* これらの著者は同等に貢献しました
要約
このプロトコルは、初代ヒト卵巣表面上皮(hOSE)細胞からの三次元(3D)組織オルガノイドの確立を説明しています。このプロトコールには、新たに採取した卵巣からのhOSEの単離、hOSEの細胞増殖、凍結保存融解手順、およびオルガノイドの誘導が含まれます。免疫蛍光、定量分析、スクリーニングプラットフォームとしての有用性の紹介が含まれています。
要約
卵巣の最外層である卵巣表面上皮(OSE)は、排卵のたびに破裂し、卵巣の完全性を回復しながら卵巣の創傷治癒に重要な役割を果たします。さらに、OSEは上皮性卵巣がんの原因となる可能性があります。OSEの再生特性はマウスで十分に研究されていますが、ヒト卵巣の組織修復の正確なメカニズムを理解することは、ヒト卵巣へのアクセスが限られていることと、適切な in vitro 培養プロトコルによって妨げられています。組織特異的オルガノイドは、元の臓器の構造的および機能的側面の両方を再現する 小型のin vitro モデルであり、臓器生理学、疾患モデリング、および薬物試験の研究に新たな機会を提供します。
ここでは、全卵巣から初代ヒトOSE(hOSE)を単離し、hOSEオルガノイドを樹立する方法について述べます。ドナー間の不均一性を示す形態学的および細胞的特性評価を含めます。さらに、この培養法がOSEオルガノイドの成長に対するホルモンの影響を2週間にわたって評価する能力を実証します。この方法により、OSEの再生に寄与する因子の発見が可能になり、悪性OSEの患者特異的な薬物スクリーニングが容易になる可能性があります。
概要
卵巣は体内で最もダイナミックな器官の1つと考えられており、個人の生殖寿命を通じて創傷治癒とリモデリングの絶え間ないサイクルを経ています。各排卵周期後の卵巣組織の再生に関与する主なプレーヤーは、卵巣表面上皮(OSE)1です。OSEは、卵巣表面全体を覆う平坦な上皮細胞、直方体上皮細胞、円柱状上皮細胞を含む中皮由来の単層である2。排卵に先立って、排卵卵胞の表面にある卵巣間質組織はタンパク質分解性破壊を受け、卵丘-卵母細胞複合体の放出を可能にします。その後、排卵柱頭として知られる傷ついた領域が修復され、マウスでは72時間以内に卵巣表面が完全に閉鎖されます3。OSEが排卵創を増殖させ、閉鎖する非常に効率的な能力は、常在する幹細胞集団の推定存在を浮き彫りにしています4。生殖年齢のドナーからヒトの卵巣が入手できるものは限られているため、OSE修復のメカニズムに関する知識のほとんどは動物モデルから得られています。しかし、種特異的な特徴が、動物ベースの卵巣研究からヒトへの翻訳を妨げている5。
In vitro研究では、主にヒトOSEの2次元(2D)細胞培養が使用されており、その費用対効果と容易な培養のために、培養プレートの表面に付着した単層で細胞が増殖しました6,7,8。それにもかかわらず、このアプローチには、卵巣組織ダイナミクスの複雑さを再現する限界があります9。この点で、特に卵巣オルガノイドに焦点を当てた3D細胞培養プラットフォームは、卵巣研究に革命をもたらしました10。組織オルガノイドは、その由来となる臓器をin vitroで小型化し、3D自己組織化能力を示し、in vivo対応物の主要な機能と構造を模倣しています11。この技術は、ヒト卵巣10の発達、再生、および組織修復に関する基本的な問題に光を当てる可能性を提供します。近年、研究者は、疾患モデリングおよび個別化医療のための患者特異的卵巣癌(OC)オルガノイドの生成のために卵巣オルガノイドに関する知識も応用している12,13,14。
マウスOSEオルガノイドおよび卵管(FT)オルガノイド15,16、ならびにヒトOSEオルガノイド12およびFTオルガノイド17の作製に用いたさまざまな方法に基づき、ここでは、ヒト卵巣からのヒトOSEオルガノイドの作製のためのプロトコルと、OSE再生研究への応用の可能性について述べる。このプロトコールは、ヒト卵巣全体から初代OSE細胞を効率的に単離し、2D細胞増殖と3D hOSEオルガノイド生成の段階的な説明が含まれています。hOSEオルガノイドは、形態と成長に(ドナー特異的な)ばらつきを示し、個別化研究への有用性が浮き彫りになりました。さらに、このプロトコールには、同じ培養プレート内でのhOSEオルガノイドのメンテナンス、継代、および免疫蛍光が含まれます。さらに、hOSEオルガノイドが採用できるさまざまな形態の説明を提供し、培養中の免疫表現型の変化を特徴付けます。最後に、hOSEオルガノイドの数とサイズに基づいて、卵巣ホルモンなどの環境手がかりがhOSEオルガノイドの形成と成長に及ぼす影響を調査することにより、有用性を示します。
hOSEオルガノイド技術の応用により、卵巣の理解が深まり、特にその顕著な再生能力を担うメカニズムに重点が置かれます。3Dヒト卵巣モデルが進化し続けるにつれて、卵巣研究における動物モデルへの依存度は減少し、再生医療の分野で革新的な治療法が生まれるでしょう18。
プロトコル
この研究は、ヘルシンキ宣言のガイドラインに従って実施されました。研究デザインは、ライデン大学医療センター(LUMC)の医療倫理委員会に提出され、研究に先立って異議なしの手紙(B18.029)が得られました。使用された主要なヒト卵巣組織は、VUmc病院(オランダ、アムステルダム)で性別適合手術を受けたトランスマスキュリンの人々から採取されました。署名入りのインフォームドコンセントは、すべてのドナーから得られた。このプロトコルで使用されるすべての材料は、 材料表に記載されています。
1. ヒト初代OSE細胞の単離
- 卵巣摘出術後、卵巣を0.9%NaClまたは同様の滅菌生理食塩水に入れ、氷上で実験室に輸送します。
- 個々の卵巣を、2〜3 mLの消化培地(表1)または卵巣を覆うのに十分な量を含む50 mLの円錐形チューブに移します。
注意:卵巣が無傷でない場合(臓器の一部が組織学的分析のために切断されている場合)、この部分を消化培地で覆わないことが重要です。 - 予熱したビーズ浴(またはウォーターバス)にチューブを37°Cで30分間入れます。
- 卵巣を10 mLの収集培地を含む60 mmのシャーレに慎重に移します(表1)。
- hOSE細胞を含む卵巣表面を細胞スクレーパーで優しくこすり落とします。スクレーパーを培地で洗い、この手順を少なくとも3回繰り返します(図1)。
注意: 卵巣が無傷でない場合は、不要な細胞タイプによる汚染を最小限に抑えるために、損傷した領域をこすったり水没させたりしないでください。 - 収集培地中のhOSE細胞を15 mLチューブに移します。
- hOSE細胞を240 x g で5分間スピンダウンします。
- ペレットが赤色を示し、赤血球(RBC)による汚染を示している場合は、ペレットを1 mLのRBC溶解バッファーで再懸濁します。室温(RT)で3分間インキュベートし、ときどきピペッティングを行い、4 mLのPBSをカルシウムとマグネシウム(PBS+/+)とともに加え、240 x g で5分間遠心分離します。RBC が続く場合は、この手順を繰り返します。
- hOSE細胞ペレット(セクション2)を凍結保存し、2D培養(セクション3)または3Dオルガノイド(セクション4)(図1)に使用します。
2. hOSE細胞の凍結保存融解
- 凍結保存
- hOSE細胞ペレットを1 mLの細胞凍結培地に再懸濁します。
- 細胞懸濁液をクライオバイアル(卵巣あたり2xクライオバイアル)に移します。
- クライオバイアルを冷凍容器に入れ、-80°Cで一晩置きます。
- 凍結したクライオバイアルを液体窒素タンクに移し、長期保存します。
- 解凍:
- 液体窒素からクライオバイアルを取り出します。
- クライオバイアルを37°Cで予熱したビーズ浴(またはウォーターバス)に5分間、またはクライオバイアル内に小さな凍結コアが見えるまで置きます。
- hOSE細胞懸濁液を10 mLの収集培地を入れた15 mLチューブにピペットで移します(表1)。
- 240 x g で5分間遠心分離します。
- hOSE細胞ペレットは、2D培養(セクション3)または3Dオルガノイド(セクション4)に使用します。
3. 単分子膜における2D hOSE培養
- hOSEペレットを1 mLのOSE_2D培地に再懸濁し(表1)、12ウェルプレートから1つのウェルに移します。
- ウェルに培地OSE_2D 1 mLを追加で加え、加湿インキュベーター(5% CO2)で37°Cで72時間培養し、最初の培地交換前にhOSE細胞が付着することを確認します。
- hOSE細胞が70%〜90%のフルエント度(P0)に達するまで、2〜3日ごとに培地をリフレッシュします(図2A)。
注:RBCが培養物中にまだ存在する場合、最初の培地交換中にRBCは除去され、hOSE細胞のみがウェルに付着したままになります。 - hOSE細胞の継代については、以下で説明する手順に従ってください。
- ウェルから培地を取り出します。
- 滅菌PBS1 mLで洗浄します。
- PBSを取り外し、細胞を覆うのに十分な0.05%トリプシン/ EDTAを追加します。
- プレートを37°Cにした加湿インキュベーター(5% CO2)に4〜7分間置き、細胞が丸まってウェルから分離することに気づくまで待ちます。
- 1 mLの収集培地を追加して酵素反応を停止します。
- hOSE細胞を回収し、240 x g で5分間遠心分離します。
- 新しいウェルに細胞を所望の密度で播種し、hOSE細胞が70%〜90%のコンフルエントに達するまで2〜3日ごとに培地を更新し、ステップ3.4を繰り返します。
注:初代hOSE細胞は、最大3つの継代で培養できます。その後、ほとんどの細胞が老化します(図2A)。
- 拡大したhOSE細胞は、免疫蛍光法(図2B)を使用して培地(図2C)または3Dオルガノイド(セクション4)の効果を試験し、さらなる特性評価に使用します。
4. 3D hOSEオルガノイド培養
- 37°Cで予温されたマルチウェルチャンバースライド。
- hOSE細胞(単離したばかりまたは凍結融解した細胞)を自動セルカウンターでカウントするか、血球計算盤で手動でカウントします。
- 必要な数のhOSE細胞を、1.5 mLチューブ内の氷冷OSEオルガノイド塩基性培地(表1)に再懸濁します。
- 240 x g で5分間遠心分離します。
- hOSEペレットを所望量の氷冷原液基底膜抽出物(BME)溶液に再懸濁して、1 x 104 細胞/10 μLのBMEの細胞濃度を得ます。
- hOSE-BME溶液を上下にピペットで固定し、均質な分布を確保します。
- 予熱したマルチウェルチャンバースライドで、ウェルあたり10 μLのhOSE-BME溶液の液滴を作ります。
注意: 液滴の形状を得るには、各液滴がウェルの中心にあることを確認してください。 - 液滴を逆さまにして37°Cのプレートを加湿インキュベーター(5%CO2)に15分間置き、ゲルが固化します。
- 100 μLのOSE_3D培地(表1)を加え、加湿インキュベーター(5% CO2)で37°Cで培養します。
- 3〜4日ごとに培地をリフレッシュしてください。
注:hOSEオルガノイドは、少なくとも培養で28日間は増殖を続けますが(図3A、B)、細胞増殖とオルガノイドの生存を促進するためには、14〜28日ごとに継代することをお勧めします(増殖速度はドナーに依存し、新鮮hOSEとクライオhOSEの比較)。3つの独立したhOSEオルガノイド系統を少なくとも4回継代しましたが、老化の兆候は見られませんでした。hOSEオルガノイドは異なる形態を示します(図3C)。 - hOSEオルガノイドの継代用:
- 培地を取り出し、氷冷したアドバンスドDMEM/F12を各ウェルに100 μL加えます。
- P1000ピペットチップでウェルの底をこすり落とし、ゲル液滴を剥がします。
- 各フローティングゲル液滴を1.5mLチューブに移します。
- ゲル液滴を240 x g でチューブに5分間遠心分離します。
- 上清を取り除き、ペレットを300 μLの細胞解離バッファーに再懸濁し、チューブを37°Cで予熱したビーズ浴(または水浴)に5〜10分間置きます。
注:一部のオルガノイドが無傷のままである場合は、ウシ胎児血清でコーティングされた氷冷ピペットチップで数回ピペットを上下させ、機械的にオルガノイドを破壊します。ピペットチップにウシ胎児血清をコーティングすることで、オルガノイドがチップにくっつくのを防ぎます。 - 300 μLのhOSEオルガノイド塩基性培地を添加し、240 x g で5分間遠心分離します。
- ペレットを所望量の未希釈BME溶液に再懸濁し、適切な比率で再播種し(1液滴の含有量を1〜4滴に分配)、前述のように培養します。
注:オルガノイドは単一細胞に解離されないため、細胞を正確にカウントしてさらに継代することはできません。
5. 3D hOSEオルガノイドのホールマウント免疫蛍光法
注:顕微鏡技術に適したマルチウェルチャンバースライドを使用する場合、ホールマウント免疫蛍光法は同じ培養ウェル(液滴中)で行うことができます。
- hOSEオルガノイドを4%パラホルムアルデヒド(PFA)の液滴中に室温で20分間固定します。
- 回転/振とう台でRTでPBSで5分間2回洗浄します。
- 100 μLの透過処理バッファー(表1)を室温で15分間使用して、液滴中のhOSEオルガノイドを透過処理します。
- 100 μLのブロッキングバッファー(表1)で室温で15分間3回洗浄し、回転/振とうプラットフォームで4°Cで一晩(o / n)ブロックします。
- 100 μLの一次抗体ミックスをブロッキングバッファーで希釈し、4°C o/nで回転/振とうするプラットホームでインキュベートします。
注:使用した一次抗体のリスト、マークされた細胞タイプ、および発現の検証に使用した動物モデルについては、 表 を参照してください12、19、20、21、22、23、24、25。 - プレートをRTに持ち込み、回転/振とうプラットフォーム上でRTで100 μLのブロッキングバッファーで15分間3回洗浄します。
- ブロッキングバッファーで希釈した100 μLの二次抗体ミックスと室温で2時間インキュベートし、回転/振とうするプラットフォーム上で、光から保護します。
注:使用した二次抗体のリストについては、 材料の表 を参照してください。光から保護するには、プレートを暗い箱の中に置くか、アルミホイルで覆います。 - PBS100 μLで15分間、回転/振とうプラットフォーム上でRTで3回洗浄します。
- プレートをアルミホイルで覆った状態で4°Cに保管し、イメージングまで保存します(図4)。
6. hOSEオルガノイドサイズの定量化
- 顕微鏡で10倍の明視野写真(TIFF画像)を撮影します。
- フィジー(https://imagej.net/software/fiji/)26をダウンロードしてインストールします。
- ImageJソフトウェアFijiでhOSEオルガノイドの画像領域を測定:
- フィジーで画像TIFFファイルをロードします。
- アップロードされた明視野画像内のhOSEオルガノイド(暗い領域)をソフトウェアが認識するための閾値を作成するには 、Image > Adjust of > Thresholdをクリックします。背景の大部分が削除され、個々のオルガノイドが保持されるまで、上下の値を調整します。
- [Analyze of Test (> ツールの分析 > ROI)] をクリックして、ROI ツールを開きます。
- Wandツールを選択し、hOSEオルガノイドのある領域をクリックすると、オルガノイドの周囲を囲む黄色の線が表示されます。ROIパネルで、「追加」と「測定」をクリックして、そのOSEオルガノイドの面積値を取得します。
- 手順6.3.4を繰り返します。測定するすべてのhOSEオルガノイドについて。
結果
2D hOSEカルチャー
新たに単離したhOSE細胞を12ウェルプレートに播種し、3週間培養しました。この期間中、細胞を3回継代しました(図2A)。培養中の初代hOSE細胞は、継代3(P3)までは丸石のような形態を示したが、その後老化の兆候を示し始め、以前の結果によれば、hOSEは継代できる期間が限られていると報告している27。さらに、マウスOSEは、 in vitroで上皮間葉転換(EMT)を受けることが示されており、アクチン細胞骨格の再配列やコラーゲンIの沈着などの線維芽細胞様の特徴を示しています19。これに同意して、ACTA2+CD44+ hOSEは、P2とP3の間でCOL1A1の顕著なアップレギュレーションを示し(図2B)、hOSE細胞が培養中にEMTを受けることを示唆しています。
TGF-βシグナル伝達は、EMTの主要な調節因子であり、様々な上皮細胞型29にEMTを誘導することができる。TGF-βはOSE_2D培地に添加されなかったが、添加されたFBSは、このサイトカイン30,31の検出可能なレベルを含んでいる可能性がある。そこで、TGF-β阻害剤I型受容体SB-431542を追加することで、救急救命士を予防し、長時間の2D培養が可能になるかどうかを検討しました。驚くべきことに、OSE_2D培地に10 μMのSB-43154232を添加すると、細胞増殖が妨げられました(図2C)。私たちは、TGF-βシグナル伝達がOSEの増殖に不可欠であると結論付け、阻害剤なしでさらに2D培養実験を行いました。
3D hOSEオルガノイド培養
ヒトOSEオルガノイド12を増殖させるための公表された培養条件に基づいて、BMEの液滴に包埋し、OSE_3D培地(標準濃度100 nMのエストラジオールを含む)で最大28日間増殖させたhOSEオルガノイドを導き出しました。7日以内に、新たに単離されたOSE細胞に由来する多くのhOSEオルガノイドは、平均直径130 mmの嚢胞性でした(図3A、B)。これらの結果は、細かく刻まれたヒト卵巣組織および酵素的に消化されたヒト卵巣組織からのhOSEオルガノイドの誘導についてKopperらによって報告されたものと同様でした12。興味深いことに、新たに単離されたOSE細胞に由来するhOSEオルガノイドは、培養14日後に2D増殖OSE細胞(平均直径100mm)のhOSEオルガノイドよりも大きく成長しました(平均直径160mm)(図3B)。これは、おそらく2D増殖したOSE細胞が増殖を減少させる傾向があったためです。さらに、多くの3D hOSEオルガノイドは、平らな上皮細胞の単層で構成されていましたが(図3C 左上パネル)、立方体単層の細胞を示したもの(図3C 右上パネル)、多層化したもの(図3C 右下パネル)、または非内腔化細胞クラスターを形成したもの(図3C 左下パネル)がありました。
OSE_2D培地を使用してhOSEオルガノイドも得られるかどうかを調べるために、新たに単離されたhOSE細胞をBMEの液滴に埋め込み、OSE_2D培地で12日間増殖させました。6日後、紡錘体様細胞が見られ、液滴中でhOSE細胞がEMTを受けていることが示唆されました。重要なことは、OSE_2D培地を使用してhOSEオルガノイドを形成できなかったことです(図3D)。
hOSEオルガノイドの細胞特性
ヒトの成体卵巣では、ケラチン8(KRT8)がOSE集団を特異的にマークし(図4A)、したがって、hOSEオルガノイドはKRT8の発現を保持し、その細胞同一性を検証しました(図4B)。マウスOSE細胞では、Yes1関連タンパク質(YAP1)の核局在は、排卵後に損傷領域を拡大し治癒することができるOSE幹細胞/前駆細胞と特異的に関連していた24,33。YAPは、hOSEオルガノイドの細胞の大部分で、そのサイズに関係なく核局在を示しました(図4B)。マウスOSE細胞で発現することが報告されている他のマーカー、例えばCD4420およびLGR522も調査した。興味深いことに、CD44とLGR5の両方が小さなhOSEオルガノイド(直径<100μm)で発現していたのに対し、より大きなオルガノイドでは、CD44とLGR5はダウンレギュレーションされているように見えました(図4B)。
次に、hOSEオルガノイドがBME包埋オルガノイド(アピカルイン)34で一般的に観察されるアピカル基底極性を示すかどうかを調査した。基底外側タンパク質インテグリンβ1(ITGB1)と頂端タンパク質ポドカリキシン(PODXL)を使用して、hOSEオルガノイドの細胞極性を示し、hOSEオルガノイドのサイズに依存しない明確なアピカルイン極性を確認しました(図4B)。
ヒトOSEは間葉系マーカーN-カドヘリン(CDH2)を発現することが知られていますが、上皮マーカーE-カドヘリン(CDH1)の発現は柱状OSE細胞に限定されています(図4A)2。興味深いことに、この研究で得られたhOSEオルガノイドは間葉系マーカーCDH2とビメンチン(VIM)を発現し、立方体/円柱上皮を持つ大型の嚢胞性hOSEオルガノイドはCDH1+とCDH2+VIM+の両方でした(図4C)。CDH1+ hOSEオルガノイドが初代CDH1+ OSE細胞に由来するのか、それともin vitroで上皮分化または(腫瘍性)形質転換を受けたCDH1-OSE細胞に由来するのかは不明である25,35。
hOSEオルガノイドの使用の紹介:hOSEオルガノイドに対する排卵の手がかりの影響
ホルモンの卵胞刺激ホルモンおよび人間の絨毛性ゴナドトロピンは卵胞の成長および排卵を誘発するのに、排卵の後で、プロゲステロンおよびエストラジオール36のような卵巣作り出されたホルモンの集中の顕著な増加があるが、使用することができる。hOSEオルガノイドのスクリーニングプラットフォームとしての有用性を示すために、オルガノイドの数とサイズを定量出力として使用して、これらのホルモンがhOSEオルガノイドに及ぼす影響を調べました(フィジーを使用)。このために、エストラジオールを欠く(ホルモンを含まない)培地と、FSH、hCG、エストラジオール、またはプロゲステロンを異なる濃度で含有するOSE_3D OSE_3D培地でhOSEオルガノイドを導き出しました(図5A)。
3つの異なるドナー(n = 3)の凍結融解(非拡大)hOSE細胞に由来するhOSEオルガノイドの数を、培養7日後の液滴あたりの定量化を行いました(図5A、B)。培地は3日ごとに交換しました。中程度含有ホルモンで形成された液滴当たりのhOSEオルガノイドの総数は、ホルモンを含まない中程度と比較して有意差は認められませんでした(図5A、B)。オルガノイドサイズに対するホルモンの影響を定量化するために、培養に14日後、各液滴(各条件から)を画像化し、フィジーを使用して4つの最大のhOSEオルガノイドの面積を測定しました。興味深いことに、プロゲステロン(1000 nM)またはエストラジオール(200 nM)の存在下で2つの異なるドナー(n = 2)からhOSEオルガノイドを生成すると、液滴ごとに少なくとも1つの非常に大きなオルガノイド(直径約700 μm)が得られました(図5C、D)。
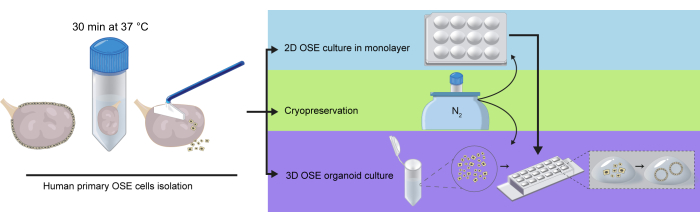
図1:卵巣全体からのhOSE細胞単離の概略図。 卵巣を消化溶液中で37°Cで30分間インキュベートし、hOSE細胞を卵巣表面から穏やかに掻き取って凍結保存し、単層の2D OSE培養物に直接プレーティングするか、3D hOSEオルガノイド培養用の基底膜抽出物(BME)に包入しました。凍結融解したhOSE細胞は2D培養や3Dオルガノイド形成に、2D増殖したhOSE細胞は3D hOSEオルガノイドの作製に利用できます。 この図の拡大版を表示するには、ここをクリックしてください。

図2:hOSE細胞の2D初代培養。 (A)継代0(P0)、2(P2)、および3(P3)のhOSE細胞の明視野画像で、典型的な上皮の丸石の形態を示しています。スケールバーは、上部パネルが750μm、下部パネルが125μmです。(B)P2およびP3の2D hOSE細胞上のACTA2、CD44、COL1A1の免疫蛍光法。スケールバーは50μmです。(C)P0、P2、およびP3でSB-431542を10μMで培養したhOSE細胞の明視野画像。細胞はP2から老化の兆候を示し、培養中に高いコンフルエントに達しませんでした。スケールバーは、上部パネルが750μm、下部パネルが125μmです。 この図の拡大版を表示するには、ここをクリックしてください。
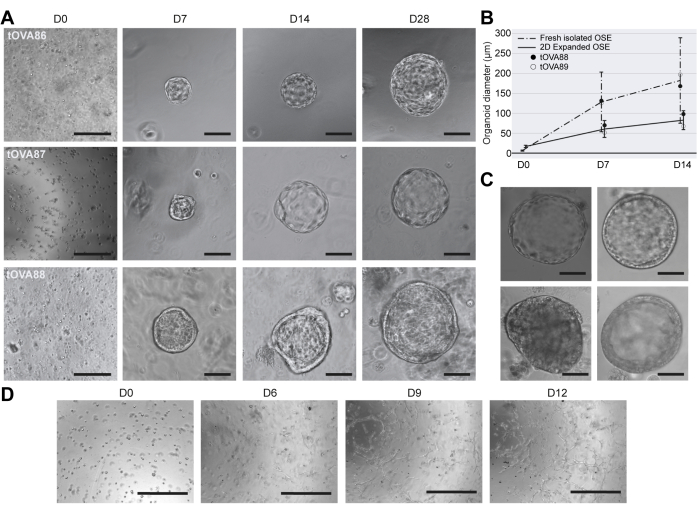
図3:hOSEオルガノイドの形態学的特性 評価 (A)3つの異なるドナー(tOVA86、tOVA87、tOVA88)からの3つの独立したhOSEオルガノイド誘導の明視野画像。画像は、細胞埋め込み(D0)、7日目(D7)、14日目(D14)、および28日目(D28)の培養後に撮影されました。スケールバーはD0で750 μm、残りのスケールバーは50 μmです。(B)新たに単離されたhOSE細胞(破線)および2D拡大hOSE細胞(実線)に由来するhOSEオルガノイドの直径。示されているのは、D0、D7、および D14 で測定された平均サイズ±標準偏差です。2つの異なるドナー(tOVA88およびtOVA89)の結果が示されています。(C)hOSEオルガノイドの明視野画像は、単一の平坦な層(左上)、単一の柱状層(右上)、多層(右下)、および非ルーメン化細胞凝集体(左下)の異なる形態を示しています。スケールバーは100μmです。(D)BMEに包埋し、OSE_2D培地で12日間培養したhOSE細胞の明視野画像。画像は、細胞埋め込み後(D0)、6日目(D6)、9日目(D9)、および12日目(D12)に撮影されました。線維芽細胞様細胞が培養物を追い越し、オルガノイド様構造は形成されませんでした。スケールバーは750μmです。 この図の拡大版を表示するには、ここをクリックしてください。
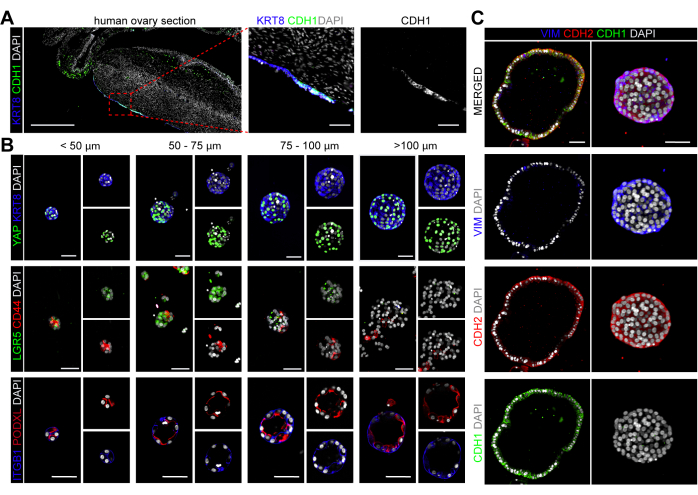
図4:hOSEオルガノイドの細胞特性評価。 (A)ヒト卵巣切片におけるKRT8およびCDH1の免疫蛍光法。(B)異なるサイズ(<50μm、50-75μm、75-100μm、>100μm)のhOSEオルガノイドにおけるKRT8とYAP、LGR5とCD44、ITGB1とPODXLの免疫蛍光法。スケールバーは50 μmです。 (C) hOSEオルガノイド中のVIM、CDH1、CDH2の免疫蛍光。スケールバーは50μmです。 この図の拡大版を表示するには、ここをクリックしてください。
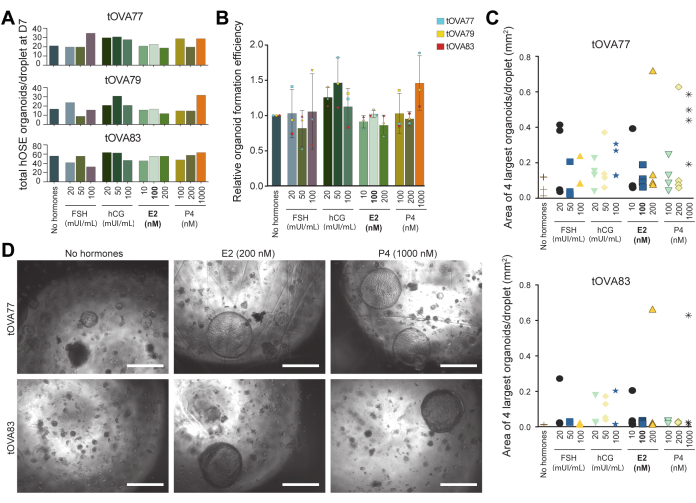
図5:排卵の手がかりがhOSEオルガノイド形成に及ぼす影響 (A)異なる培地で7日目に形成された液滴あたりのhOSEオルガノイドの総数。hOSEオルガノイドは、3つの異なるドナー(tOVA77、tOVA79、tOVA83)に由来しました。太字はオルガノイドの導出に使用されるOSE_3D培地です。(B)ホルモンを含まない培地と比較した相対的なオルガノイド形成。hOSEオルガノイドのプール値は、3つの異なるドナー(tOVA77、tOVA79、tOVA83)から導き出されました。(C)2つの異なるドナー(tOVA77、tOVA83)から試験された各実験条件における14日目の4つの最大のhOSEオルガノイドの画像領域を示すグラフ。(D)2つの異なるドナー(tOVA77、tOVA83)からのホルモンを含まない培地、200 nM E2、および1000 nM P4を使用した14日目培養時のhOSEオルガノイドを示す明視野画像。スケールバーは750μmです。 この図の拡大版を表示するには、ここをクリックしてください。
表1:研究で使用された作業溶液の構成。この表をダウンロードするには、ここをクリックしてください。
ディスカッション
3Dオルガノイド技術は、医学研究に不可欠なツールとして浮上しています。一方では、このin vitroプラットフォームは、組織再生、創傷治癒、および発生に関する基本的なメカニズムの問題を研究する可能性を提供します18。一方、患者サンプルから得られる3Dオルガノイドは、診断、薬物検査、細胞療法などの個別化医療研究を可能にします12,13,14,37,38。卵巣研究の分野では、hOSEは上皮性卵巣癌の起源としてその意味合い以来、大きな関心を集めています39。最も一般的な上皮性卵巣癌の1つであるほとんどの高悪性度漿液性卵巣癌(HGSOC)は卵管から発生すると考えられていますが40、マウスの3D卵巣オルガノイドに関する現在の研究では、OSEと卵管15,16からのHGSOCの二重起源の可能性が提案されています。
ここでは、hOSE 3Dオルガノイドの導出のためのプロトコルについて説明し、卵巣組織再生における新しいメカニズムの知識をもたらすためのその応用について概説しました。このプロトコールには、ヒト卵巣から初代hOSE細胞を単離し、3D hOSEオルガノイドを生成するための段階的な方法が含まれています。効率的なhOSEオルガノイドの導出を確保するためには、卵巣の操作を最小限に抑えることが重要です。hOSEは、卵巣表面および単層組織上に位置するため、卵巣摘出術および臓器操作中に損傷および損失を受けやすい。このため、hOSE 2,8を単離するために卵巣全体に適用される酵素的および掻き取り法を好んでいました。現在のプロトコルでは、軽度の酵素処理を適用してhOSE細胞間接続を破壊し、続いて卵巣表面を穏やかにこすり落としました。
2D培養と3D培養を比較すると、2D培養ではhOSE細胞の初期増殖速度が高いにもかかわらず、EMTによって細胞特性が変化し、適用された2D培養条件が上皮形態を維持するのに適していないことに注意することが重要です。対照的に、3D hOSEオルガノイドは、老化の兆候なしに少なくとも4回継代することができました。使用したOSE_3Dオルガノイド培地は、KopperらがOCおよび健康なhOSEオルガノイド12の導出に使用したオルガノイド培地12 、KesslerらがヒトFTオルガノイド17の導出に使用したオルガノイド培地に基づいている。主な違いは、ヒトのWnt3aおよびR-Spondin-1で馴染ませた培地を市販の組換えタンパク質で置き換えて再現性を高めたことです。
免疫蛍光法では、通常、培養プレートから組織サンプルを取り出し、パラフィン切片またはクライオ切片処理に処理します。非常に小さな構造を扱う場合、サンプル処理中に構造を失うリスクが高くなります。このプロトコルでは、hOSEオルガノイドの導出は、BMEマトリックスからhOSEオルガノイドを除去することなく、直接顕微鏡イメージングを可能にする細胞培養プレートで行われます。さらに、ここで使用した全マウント免疫蛍光法は、Rezanejadらが膵管オルガノイドについて報告した41もので、形態学的に無傷のオルガノイド内のタンパク質局在の in situ 観察を可能にしました。この免疫蛍光法をマルチウェルチャンバースライドに由来するhOSEオルガノイドで実施すると、非常に低いバックグラウンドシグナルで非常に効率的な抗体浸透が得られることを示しました。
この方法を用いて得られたhOSEオルガノイドのほとんどはCDH1発現を欠いていましたが、一部のCDH1+ hOSEオルガノイドは形成され、CDH1-hOSEオルガノイドと比較してより大きなサイズに達しました。CDH1の発現は、腫瘍性hOSE表現型と関連しています2,35。hOSE単離に用いた卵巣は、生殖年齢(27.1歳±5歳)の健康なトランスマスキュリンドナーから提供された。これらのドナーは、卵巣摘出術の38か月±15か月前にテストステロン治療を受けていました。卵巣表面のCDH1+ hOSE細胞がテストステロン治療に起因する可能性を捨てることはできません。アンドロゲン治療は、無排卵42、皮質領域の過形成43、および皮質硬直の増加44などの卵巣の変化に関連しているが、一般的な卵巣の病理は、テストステロン45を使用している間、良性のままである。
要約すると、このプロトコルは、卵巣組織再生に関するメカニズムの問題を解読するためにhOSE 3Dオルガノイドを生成する可能性を強調しています。重要なことに、この方法は、がん発症のリスクがある患者の卵巣生検に存在する悪性細胞の検出にも適用できる可能性があります。全体として、この方法は、この革新的な in vitro プラットフォームの、基本的な卵巣機能研究と個別化医療の臨床応用の両方への潜在的な応用をサポートします。
開示事項
何一つ。
謝辞
この研究のために組織を提供してくださったすべての患者様、有益なディスカッションを提供してくださったChuva de Sousa Lopesグループのメンバー、図1で使用した漫画をデザインしてくださったI. De Poorterに感謝いたします。この研究は、欧州研究会議、助成金番号ERC-CoG-2016-725722(OVOGROWTH)によってJ.S.D.V.およびS.M.C.d.S.L.に資金提供されました。ノボ ノルディスク財団(reNEW)、J.S.D.V.およびS.M.C.d.S.L.の助成金番号NNF21CC0073729
資料
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin/EDTA | Invitrogen | 25200-056 | |
| 12-well Culture Plate | Corning | 3336 | Sterile |
| 15 mL tubes | Greiner | 188271 | Sterile |
| 28cm Cell Scraper | Greiner Bio-One | 541070 | |
| 50 mL tubes | Greiner | 227261 | Sterile |
| 60 mm Petri dish | Greiner Bio-One | 628160 | |
| A83-01 | Stem Cell Technologies | 72024 | |
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| B27 supplement (50x) | ThermoFisher Scientific | 17504-044 | |
| Bead bath | M714 | ||
| Bovine serum albumin (BSA) | Sigma Aldrich | 10735086001 | |
| Cell Dissociation Buffer | ThermoFisher Scientific | 13151014 | |
| Cryo-container "Mr. Frosty" | BD Falcom | 479-3200 | |
| DMEM Medium | ThermoFisher Scientific | 41966-029 | |
| Donkey anti-Goat IgG Alexa Fluor 647 | Invitrogen | A-21447 | |
| Donkey anti-Mouse IgG Alexa Fluor 488 | Invitrogen | A-21202 | |
| Donkey anti-Mouse IgG Alexa Fluor 647 | Invitrogen | A-31571 | |
| Donkey anti-Rabbit IgG Alexa Fluor 488 | Invitrogen | A-21206 | |
| Donkey anti-Rabbit IgG Alexa Fluor 594 | Invitrogen | A-21207 | |
| Donkey anti-Sheep IgG Alexa Flour 647 | Invitrogen | A-21448 | |
| Fetal Bovine Serum (FBS) | ThermoFisher Scientific | A4736401 | |
| Follicle Stimulating Hormone (FSH) | Sigma Aldrich | F4021 | |
| Forskolin | Peprotech | 6652995 | |
| Glutamax (100x) | Gibco | 35050-038 | |
| Goat anti-CDH2 (N/R-cadherin) | Santa Cruz | SC-1502 | Mesenchymal Cells; Wong et al 1999 (human)25 |
| Goat anti-PODXL (podocalyxin of GP135) | R&D Systems | AF1658 | Apical Polarity; Bryant et al 2014 (canine)21 |
| Goat anti-Rat IgG Alexa Fluor 555 | Invitrogen | A-21434 | |
| hEGF | R&D Systems | 263-EG | |
| HEPES | Gibco | 15630-056 | |
| Hydrocortisone | Sigma Aldrich | H0888 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS-X; 100x) | ThermoFisher Scientific | 51500-056 | |
| Liberase DH Research Grade | Sigma Aldrich | A4736401 | |
| Luna-II cell counter | Logos Biosystems | L40001 | |
| Matrigel | Sigma Aldrich | 354277 | |
| McCoy’s 5A Medium | ThermoFisher Scientific | 26600-023 | |
| Mouse anti-ITGB1 (integrin beta 1) | Santa Cruz | SC-53711 | Basolateral Polarity; Bryant et al 2014 (canine)21 |
| Mouse anti-KRT8 (cytokeratin 8) | Santa Cruz | SC-101459 | OSE Cells; Kopper et al 2019 (human)12 |
| Mouse anti-VIM (vimentin) | Abcam | AB0809 | Mesenchymal Cells; Abedini et al 2020 (mouse)19 |
| Mycozap Plus-CL | Lonza | V2A-2011 | |
| N-Acetyl-L-cysteine | Sigma Aldrich | A9165 | |
| Nicotinamide | Sigma Aldrich | N0636-100G | |
| OVITRELLE-Choriogonadotropin alfa (hCG) | Merk | G03GA08 | |
| Progesterone (P4) | Sigma Aldrich | P8783 | |
| Rabbit anti-ACTA2 (alpha smooth muscle actin) | Abcam | AB5694 | Mesenchymal Cells; Abedini et al 2020 (mouse)19 |
| Rabbit anti-CDH1 (E-cadherin) | Cell Signaling | CST 3195S | Epithelial Cells; Wong et al 1999 (human)25 |
| Rabbit anti-LGR5 | Abcam | AB75850 | OSE Progenitor Cells; Flesken-Nikitin et al 2013 (mouse)22 |
| Rabbit anti-YAP | Cell Signaling | 14074S | Proliferative OSE; Wang et al 2022 (mouse)24 |
| Rat anti-CD44 PE-conjugated | eBioscience | 12-0441-81 | OSE Progenitor Cells; Bowen et al 2009 (human)20 |
| Recombinant Human Heregulinβ-1 | Peprotech | 100-03 | |
| Recombinant Human Noggin | Peprotech | 120-10C | |
| Recombinant Human Wnt3a | R&D Systems | 5036-WN-010 | |
| Recombinant Rspondin-1 | Peprotech | 120-38 | |
| Red blood cells lysis buffer | eBiosciences | 00-4333-57 | |
| Revitacell Supplement (100x) | ThermoFisher Scientific | A26445-01 | |
| RNAse free DNAse | Qiagen | 79254 | |
| SB-431542 | Tocris Bioscience | 1624/10 | |
| Sheep anti-COL1A1 (pro-collagen 1 alpha 1) | R&D Systems | AF6220 | Mesenchymal Cells; Hosper et al 2013 (human)23 |
| Y-27632 | StemCell Technologies | 72304 | |
| β-Estradiol (E2) | Sigma-Aldrich | E8875 | |
| μ-Slide 18-well culture plate | Ibidi | 8181 | Sterile |
参考文献
- Ng, A., Barker, N. Ovary and fimbrial stem cells: biology, niche and cancer origins. Nat Rev Mol Cell Biol. 16 (10), 625-638 (2015).
- Auersperg, N., Wong, A. S., Choi, K. C., Kang, S. K., Leung, P. C. Ovarian surface epithelium: biology, endocrinology, and pathology. Endocr Rev. 22 (2), 255-288 (2001).
- Tan, O. L., Fleming, J. S. Proliferating cell nuclear antigen immunoreactivity in the ovarian surface epithelium of mice of varying ages and total lifetime ovulation number following ovulation. Biol Reprod. 71 (5), 1501-1507 (2004).
- Carter, L. E., et al. Transcriptional heterogeneity of stemness phenotypes in the ovarian epithelium. Commun Biol. 4 (1), 527 (2021).
- Chumduri, C., Turco, M. Y. Organoids of the female reproductive tract. J Mol Med (Berl). 99 (4), 531-553 (2021).
- Edmondson, R. J., Monaghan, J. M., Davies, B. R. The human ovarian surface epithelium is an androgen responsive tissue. Br J Cancer. 86 (6), 879-885 (2002).
- Karlan, B. Y., Jones, J., Greenwald, M., Lagasse, L. D. Steroid hormone effects on the proliferation of human ovarian surface epithelium in vitro. Am J Obstet Gynecol. 173 (1), 97-104 (1995).
- Nakamura, M., Katabuchi, H., Ohba, T., Fukumatsu, Y., Okamura, H. Isolation, growth and characteristics of human ovarian surface epithelium. Virchows Arch. 424 (1), 59-67 (1994).
- Horvath, P., et al. Screening out irrelevant cell-based models of disease. Nat Rev Drug Discov. 15 (11), 751-769 (2016).
- Del Valle, J. S., Chuva de Sousa Lopes, S. M. Bioengineered 3D ovarian models as paramount technology for female health management and reproduction. Bioengineering (Basel). 10 (7), 832 (2023).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Kopper, O., et al. An organoid platform for ovarian cancer captures intra- and interpatient heterogeneity. Nat Med. 25 (5), 838-849 (2019).
- Maenhoudt, N., et al. Developing organoids from ovarian cancer as experimental and preclinical models. Stem Cell Reports. 14 (4), 717-729 (2020).
- Senkowski, W., et al. A platform for efficient establishment and drug-response profiling of high-grade serous ovarian cancer organoids. Dev Cell. 58 (12), 1106-1121.e7 (2023).
- Lohmussaar, K., et al. Assessing the origin of high-grade serous ovarian cancer using CRISPR-modification of mouse organoids. Nat Commun. 11 (1), 2660 (2020).
- Zhang, S., et al. Both fallopian tube and ovarian surface epithelium are cells-of-origin for high-grade serous ovarian carcinoma. Nat Commun. 10 (1), 5367 (2019).
- Kessler, M., et al. The Notch and Wnt pathways regulate stemness and differentiation in human fallopian tube organoids. Nat Commun. 6, 8989 (2015).
- Kim, J., Koo, B. K., Knoblich, J. A. Human organoids: model systems for human biology and medicine. Nat Rev Mol Cell Biol. 21 (10), 571-584 (2020).
- Abedini, A., Sayed, C., Carter, L. E., Boerboom, D., Vanderhyden, B. C. Non-canonical WNT5a regulates Epithelial-to-Mesenchymal Transition in the mouse ovarian surface epithelium. Sci Rep. 10 (1), 9695 (2020).
- Bowen, N. J., et al. Gene expression profiling supports the hypothesis that human ovarian surface epithelia are multipotent and capable of serving as ovarian cancer-initiating cells. BMC Med Genomics. 2, 71 (2009).
- Bryant, D. M., et al. A molecular switch for the orientation of epithelial cell polarization. Dev Cell. 31 (2), 171-187 (2014).
- Flesken-Nikitin, A., et al. Ovarian surface epithelium at the junction area contains a cancer-prone stem cell niche. Nature. 495 (7440), 241-245 (2013).
- Hosper, N. A., et al. Epithelial-to-mesenchymal transition in fibrosis: collagen type I expression is highly upregulated after EMT, but does not contribute to collagen deposition. Exp Cell Res. 319 (19), 3000-3009 (2013).
- Wang, J., et al. Selective YAP activation in Procr cells is essential for ovarian stem/progenitor expansion and epithelium repair. Elife. 11, e75449 (2022).
- Wong, A. S., et al. Constitutive and conditional cadherin expression in cultured human ovarian surface epithelium: influence of family history of ovarian cancer. Int J Cancer. 81 (2), 180-188 (1999).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Shepherd, T. G., Theriault, B. L., Campbell, E. J., Nachtigal, M. W. Primary culture of ovarian surface epithelial cells and ascites-derived ovarian cancer cells from patients. Nat Protoc. 1 (6), 2643-2649 (2006).
- Xu, J., Lamouille, S., Derynck, R. TGF-beta-induced epithelial to mesenchymal transition. Cell Res. 19 (2), 156-172 (2009).
- Miettinen, P. J., Ebner, R., Lopez, A. R., Derynck, R. TGF-beta induced transdifferentiation of mammary epithelial cells to mesenchymal cells: involvement of type I receptors. J Cell Biol. 127 (6 Pt 2), 2021-2036 (1994).
- Danielpour, D., et al. Sandwich enzyme-linked immunosorbent assays (SELISAs) quantitate and distinguish two forms of transforming growth factor-beta (TGF-beta 1 and TGF-beta 2) in complex biological fluids. Growth Factors. 2 (1), 61-71 (1989).
- Oida, T., Weiner, H. L. Depletion of TGF-beta from fetal bovine serum. J Immunol Methods. 362 (1-2), 195-198 (2010).
- Halder, S. K., Beauchamp, R. D., Datta, P. K. A specific inhibitor of TGF-beta receptor kinase, SB-431542, as a potent antitumor agent for human cancers. Neoplasia. 7 (5), 509-521 (2005).
- Wang, J., Wang, D., Chu, K., Li, W., Zeng, Y. A. Procr-expressing progenitor cells are responsible for murine ovulatory rupture repair of ovarian surface epithelium. Nat Commun. 10 (1), 4966 (2019).
- Kawata, M., et al. Polarity switching of ovarian cancer cell clusters via SRC family kinase is involved in the peritoneal dissemination. Cancer Sci. 113 (10), 3437-3448 (2022).
- Davies, B. R., Worsley, S. D., Ponder, B. A. Expression of E-cadherin, alpha-catenin and beta-catenin in normal ovarian surface epithelium and epithelial ovarian cancers. Histopathology. 32 (1), 69-80 (1998).
- Skory, R. M., Xu, Y., Shea, L. D., Woodruff, T. K. Engineering the ovarian cycle using in vitro follicle culture. Hum Reprod. 30 (6), 1386-1395 (2015).
- Boretto, M., et al. Patient-derived organoids from endometrial disease capture clinical heterogeneity and are amenable to drug screening. Nat Cell Biol. 21 (8), 1041-1051 (2019).
- Phan, N., et al. A simple high-throughput approach identifies actionable drug sensitivities in patient-derived tumor organoids. Commun Biol. 2, 78 (2019).
- Ducie, J., et al. Molecular analysis of high-grade serous ovarian carcinoma with and without associated serous tubal intra-epithelial carcinoma. Nat Commun. 8 (1), 990 (2017).
- Lee, Y., et al. A candidate precursor to serous carcinoma that originates in the distal fallopian tube. J Pathol. 211 (1), 26-35 (2007).
- Rezanejad, H., Lock, J. H., Sullivan, B. A., Bonner-Weir, S. Generation of pancreatic ductal organoids and whole-mount immunostaining of intact organoids. Curr Protoc Cell Biol. 83 (1), e82 (2019).
- Asseler, J. D., et al. One-third of amenorrheic transmasculine people on testosterone ovulate. Cell Rep Med. 5 (3), 101440 (2024).
- Ikeda, K., et al. Excessive androgen exposure in female-to-male transsexual persons of reproductive age induces hyperplasia of the ovarian cortex and stroma but not polycystic ovary morphology. Hum Reprod. 28 (2), 453-461 (2013).
- De Roo, C., et al. Texture profile analysis reveals a stiffer ovarian cortex after testosterone therapy: a pilot study. J Assist Reprod Genet. 36 (9), 1837-1843 (2019).
- Grimstad, F. W., et al. Ovarian histopathology in transmasculine persons on testosterone: A multicenter case series. J Sex Med. 17 (9), 1807-1818 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved