Method Article
조직 재생을 연구하기 위한 플랫폼으로서의 인간 난소 표면 상피 오가노이드
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜은 일차 인간 난소 표면 상피(hOSE) 세포에서 3차원(3D) 조직 오가노이드를 확립하는 방법을 설명합니다. 이 프로토콜에는 갓 채취한 난소에서 hOSE 분리, hOSE의 세포 확장, 동결 보존-해동 절차 및 오가노이드 유도가 포함됩니다. 면역형광(Immunofluorescence), 정량 분석(quantitative analysis) 및 스크리닝 플랫폼으로서의 유용성 입증(showcasing utility as a screening platform)이 포함되어 있습니다.
초록
난소의 가장 바깥층인 난소 표면 상피(OSE)는 각 배란 중에 파열을 겪으며 난소 상처를 치유하고 난소 무결성을 회복하는 데 중요한 역할을 합니다. 또한 OSE는 상피성 난소암의 원인이 될 수 있습니다. 생쥐에서 OSE 재생 특성에 대한 연구가 잘 이루어졌지만, 인간 난소에 대한 접근이 제한적이고 적합한 체외 배양 프로토콜로 인해 인간 난소의 정확한 조직 복구 메커니즘을 이해하는 데 여전히 어려움이 있습니다. 원래 장기의 구조적 측면과 기능적 측면을 모두 복제하는 소형 in vitro 모델인 조직 특이적 오가노이드는 장기 생리학, 질병 모델링 및 약물 검사를 연구할 수 있는 새로운 기회를 제공합니다.
여기에서는 전체 난소에서 일차 인간 OSE(hOSE)를 분리하고 hOSE 오가노이드를 확립하는 방법을 설명합니다. 우리는 기증자 간의 이질성을 보여주는 형태학적 및 세포 특성화를 포함합니다. 또한 2주 동안 OSE-오가노이드 성장에 대한 호르몬 효과를 평가할 수 있는 이 배양 방법의 능력을 입증합니다. 이 방법을 사용하면 OSE 재생에 기여하는 요인을 발견하고 악성 OSE에 대한 환자 맞춤형 약물 스크리닝을 용이하게 할 수 있습니다.
서문
난소는 신체에서 가장 역동적인 기관 중 하나로 간주되며, 개인의 생식 수명 동안 상처 치유와 리모델링의 끊임없는 주기를 겪습니다. 각 배란 주기 후 난소 조직의 재생에 관여하는 주요 역할은 난소 표면 상피(OSE)입니다1. OSE는 난소 표면 전체를 덮고 있는 편평한 직육면체 세포, 원주형 상피세포를 포함하는 중피 유래 단일층이다2. 배란에 앞서, 배란난포 표면의 난소 기질 조직은 적운-난모세포 복합체의 방출을 허용하기 위해 단백질 분해 파괴를 겪습니다. 배란 암술머리(obvulatory stigma)로 알려진 상처 부위를 복구한 후 생쥐3에서 72시간 이내에 난소 표면을 완전히 봉합한다. 배란상처를 증식시키고 봉합하는 OSE의 매우 효율적인 능력은 상주하는 줄기세포 집단의 존재를 강조한다4. 가임기 기증자로부터 인간 난소를 이용할 수 있는 것이 제한되어 있기 때문에 OSE 복구 메커니즘에 대한 대부분의 지식은 동물 모델에서 비롯됩니다. 그러나 종 특이적 특징은 동물 기반 난소 연구에서 인간으로의 전환을 방해한다5.
시험관 내 연구는 주로 인간 OSE의 2차원(2D) 세포 배양을 사용했으며, 비용 효율성과 쉬운 배양으로 인해 배양 플레이트 표면에 부착된 단층에서 세포가 성장했습니다 6,7,8. 그럼에도 불구하고, 이 접근법은 난소 조직 역학(ovarian tissuedynamics)9의 복잡성을 복제하는 데 한계가 있다. 이와 관련하여 난소 오가노이드에 특히 중점을 둔 3D 세포 배양 플랫폼은 난소 연구에 혁명을 일으켰습니다10. 조직 오가노이드는 파생된 장기의 in vitro 표현으로 소형화되어 3D 자기 조직화 능력을 나타내고 in vivo 오가노이드의 주요 기능과 구조를 모방합니다11. 이 기술은 인간 난소의 발달, 재생 및 조직 복구에 관한 근본적인 질문을 밝힐 수 있는 가능성을 제공한다10. 최근 몇 년 동안 연구자들은 질병 모델링 및 맞춤형 의학을 위한 환자 특이적 난소암(OC) 오가노이드 생성을 위해 난소 오가노이드에 대한 지식을 적용했습니다 12,13,14.
인간 OSE 오가노이드 12및 FT 오가노이드 17뿐만 아니라 마우스 OSE 오가노이드 및 나팔관(FT) 오가노이드 15,16의 생성에 사용되는 다양한 방법을 기반으로 OSE 재생 연구에서 잠재적으로 응용할 수 있는 인간 난소에서 인간 OSE 오가노이드를 유도하기 위한 프로토콜을 설명합니다. 이 프로토콜은 전체 인간 난소에서 일차 OSE 세포를 효율적으로 분리하고 2D 세포 확장 및 3D hOSE 오가노이드 생성에 대한 단계별 설명을 포함합니다. hOSE 오가노이드는 형태 및 성장에서 (공여자별) 변동성을 나타내어 맞춤형 연구에 대한 유용성을 강조했습니다. 또한 이 프로토콜에는 동일한 배양 플레이트 내에서 hOSE 오가노이드 유지, 패시징 및 면역형광이 포함됩니다. 또한 hOSE 오가노이드가 채택할 수 있는 다양한 형태에 대한 설명을 제공하고 배양 중 면역표현형의 변화를 특성화합니다. 마지막으로, 난소 호르몬과 같은 환경적 단서가 hOSE 오가노이드 수 및 크기를 기반으로 hOSE 오가노이드 형성 및 성장에 미치는 영향을 조사하여 유용성을 보여줍니다.
hOSE 오가노이드 기술의 적용은 난소에 대한 이해를 높일 것이며, 특히 난소의 놀라운 재생 능력을 담당하는 메커니즘에 중점을 둘 것입니다. 3D 인간 난소 모델이 계속 발전함에 따라 난소 연구에서 동물 모델에 대한 의존도가 줄어들어 재생 의학 분야에서 혁신적인 치료법으로 이어질 것입니다18.
프로토콜
이 연구는 헬싱키 선언의 지침에 따라 수행되었습니다. 연구 설계는 Leiden University Medical Center(LUMC)의 의료 윤리 위원회에 제출되었으며 연구 전에 이의 없음 서신(B18.029)을 받았습니다. 사용된 주요 인간 난소 조직은 VUmc 병원(네덜란드 암스테르담)에서 성별 확인 수술을 받는 트랜스남성으로부터 수집되었습니다. 모든 기증자로부터 서명된 정보에 입각한 동의서를 받았습니다. 이 프로토콜에 사용된 모든 재료는 재료 목차에 나열되어 있습니다.
1. 인간 1차 OSE 세포 분리
- 난소 절제술 후 난소를 0.9% NaCl 또는 이와 유사한 멸균 식염수에 넣고 얼음에 담아 실험실로 운반합니다.
- 개별 난소를 2-3mL의 소화 배지(표 1)가 들어 있거나 난소를 덮을 수 있을 만큼 충분한 50mL 원추형 튜브로 옮깁니다.
주의: 난소가 온전하지 않은 경우(조직학적 분석을 위해 장기의 일부를 절단한 경우) 이 부분을 소화 배지로 덮지 않는 것이 중요합니다. - 37°C에서 30분 동안 예열된 비드 수조(또는 수조)에 튜브를 넣습니다.
- 난소를 10mL의 수집 배지가 들어 있는 60mm 페트리 접시에 조심스럽게 옮깁니다(표 1).
- 세포 스크레이퍼를 사용하여 hOSE 세포가 포함된 난소 표면을 부드럽게 긁어냅니다. 스크레이퍼를 매체에서 세척하고 이 단계를 세 번 이상 반복합니다(그림 1).
주의: 난소가 온전하지 않은 경우 원치 않는 세포 유형으로 인한 오염을 최소화하기 위해 손상된 부위를 긁거나 물에 담그지 마십시오. - 수집 배지의 hOSE 세포를 15mL 튜브에 옮깁니다.
- 240 x g 에서 5분 동안 hOSE 세포를 스핀다운합니다.
- 펠릿이 적혈구(RBC)로 오염되었음을 나타내는 빨간색을 나타내는 경우 펠릿을 1mL의 RBC 용해 완충액으로 재현탁시킵니다. 가끔 피펫팅을 통해 실온(RT)에서 3분 동안 배양하고, 칼슘 및 마그네슘(PBS+/+)과 함께 PBS 4mL를 추가하고, 240 x g 에서 5분 동안 원심분리합니다. 적혈구가 지속되면 이 단계를 반복합니다.
- hOSE 세포 펠릿을 냉동 보존하고(섹션 2), 2D 배양(섹션 3) 또는 3D 오가노이드(섹션 4)에 사용합니다(그림 1).
2. hOSE 세포의 동결보존-해동
- 냉동 보존
- hOSE 세포 펠릿을 1mL의 세포 동결 매체에 재현탁시킵니다.
- 세포 현탁액을 극저온으로 전달(난소당 2x 극저온).
- 극저온을 냉동 용기에 넣고 밤새 -80°C에서 둡니다.
- 장기 보관을 위해 얼어붙은 극저온을 액체 질소 탱크로 옮깁니다.
- 녹고:
- 액체 질소에서 극저온을 제거합니다.
- 37°C에서 5분 동안 또는 극저온 내부에 작은 동결 코어만 보일 때까지 예열된 비드 수조(또는 수조)에 극저온을 넣습니다.
- hOSE 세포 현탁액을 10mL의 수집 배지가 있는 15mL 튜브에 피펫으로 넣습니다(표 1).
- 240 x g 에서 5분 동안 원심분리기
- 2D 배양(섹션 3) 또는 3D 오가노이드(섹션 4)에 hOSE 세포 펠릿을 사용합니다.
3. 단층의 2D hOSE 배양
- hOSE 펠릿을 1mL의 OSE_2D 배지에 재현탁시키고 12웰 플레이트에서 하나의 웰로 옮깁니다.
- 1mL의 OSE_2D 배지를 웰에 추가하고 가습 인큐베이터(5% CO2)에서 37°C에서 72시간 동안 배양하여 첫 번째 배지 교체 전에 hOSE 세포가 부착되도록 합니다.
- hOSE 세포가 70%-90% 밀도(P0)에 도달할 때까지 2-3일마다 배지를 새로 고칩니다(그림 2A).
참고: 배양에 적혈구가 여전히 존재하는 경우, 첫 번째 배지 교체 시 제거되고 hOSE 세포만 웰에 부착된 상태로 유지됩니다. - hOSE 세포를 패시징하려면 아래 설명된 단계를 따르십시오.
- 웰에서 배양 배지를 제거합니다.
- 멸균 PBS 1mL로 세척합니다.
- PBS를 제거하고 세포를 덮을 수 있도록 0.05% 트립신/EDTA를 충분히 추가합니다.
- 세포가 둥글게 올라와 웰에서 분리될 때까지 가습 인큐베이터(5% CO2)에서 37°C의 플레이트를 4-7분 동안 놓습니다.
- 1mL의 수집 배지를 추가하여 효소 반응을 중지합니다.
- hOSE 세포를 수집하고 240 x g 에서 5분 동안 원심분리합니다.
- 원하는 밀도로 새 웰에 세포를 종자하고 hOSE 세포가 70%-90% 밀도에 도달할 때까지 2-3일마다 배지를 새로 고치고 3.4단계를 반복합니다.
참고: 일차 hOSE 세포는 최대 3개의 통로까지 배양할 수 있습니다. 그 후 대부분의 세포가 노화됩니다(그림 2A).
- 면역형광(그림 2B)을 사용한 추가 특성 분석을 위해 확장된 hOSE 세포를 사용하여 배양 배지(그림 2C)의 효과를 테스트하거나 3D 오가노이드(섹션 4)에 대해 테스트하십시오.
4. 3D hOSE 오가노이드 배양
- 37 °C에서 멀티 웰 챔버 슬라이드를 사전 데우십시오.
- (갓 분리하거나 냉동 보존-해동한) hOSE 세포를 자동 세포 카운터를 사용하거나 혈구계를 사용하여 수동으로 계수합니다.
- 1.5mL 튜브에서 원하는 수의 hOSE 세포를 1mL의 얼음처럼 차가운 OSE 오가노이드 염기성 배지(표 1)에 재현탁시킵니다.
- 240 x g 에서 5분 동안 원심분리기
- 원하는 양의 얼음처럼 차가운 희석되지 않은 기저막 추출물(BME) 용액에 hOSE 펠릿을 재현탁시켜 BME의 1 x 104 cells/10 μL의 세포 농도를 얻습니다.
- 균일한 분포를 보장하기 위해 hOSE-BME 용액을 위아래로 피펫팅합니다.
- 사전 예열된 다중 웰 챔버 슬라이드에서 웰당 10μL의 hOSE-BME 용액 방울을 만듭니다.
알림: 물방울 모양을 얻으려면 각 물방울이 우물 중앙에 있는지 확인하십시오. - 액적이 37°C에서 거꾸로 된 플레이트를 가습 인큐베이터(5% CO2)에 15분 동안 놓아 겔 응고를 허용합니다.
- 100 μL의 OSE_3D 배지 (표 1)를 추가하고 가습 인큐베이터 (5 % CO2)에서 37 ° C에서 배양합니다.
- 3-4일마다 매체를 새로 고칩니다.
참고: hOSE 오가노이드는 배양 후 최소 28일까지 계속 성장하지만(그림 3A, B), 세포 증식과 오가노이드 생존을 자극하기 위해 14-28일마다(성장 속도는 donor에 따라 다름, fresh, cryo hOSE)하는 것이 좋습니다. 3개의 독립적인 hOSE 오가노이드 라인이 노화의 징후 없이 최소 4회 통과되었습니다. hOSE 오가노이드는 다양한 형태를 보여줍니다(그림 3C). - hOSE 오가노이드 passaging의 경우:
- 배지를 제거하고 각 웰에 100μL의 얼음처럼 차가운 고급 DMEM/F12를 추가합니다.
- P1000 피펫 팁으로 웰 바닥을 긁어 겔 방울을 분리합니다.
- 각 부유 겔 방울을 1.5mL 튜브에 옮깁니다.
- 겔 방울이 있는 튜브를 240 x g 에서 5분 동안 원심분리합니다.
- 상층액을 제거하고, 펠릿을 300μL의 세포 해리 완충액에 재현탁시키고, 튜브를 37°C에서 5-10분 동안 예열된 비드 수조(또는 수조)에 넣습니다.
참고: 일부 오가노이드가 손상되지 않은 경우 소 태아 혈청 코팅된 얼음처럼 차가운 피펫 팁으로 위아래로 몇 번 피펫팅하여 기계적으로 파괴합니다. 피펫 팁에 소 태아 혈청을 코팅하면 오가노이드가 팁에 달라붙는 것을 방지할 수 있습니다. - 300μL의 hOSE 오가노이드 염기성 배지를 추가하고 240 x g 에서 5분 동안 원심분리기를 추가합니다.
- 원하는 양의 희석되지 않은 BME 용액에 펠릿을 재현탁시키고 적절한 비율로 다시 파종하고(1방울의 내용물을 1-4개의 방울로 분배) 앞서 언급한 대로 배양합니다.
참고: 오가노이드는 단일 세포로 분리되지 않으므로 추가 통과를 위해 세포를 정확하게 계수할 수 없습니다.
5. 3D hOSE 오가노이드의 전체 마운트 면역형광
참고: 전체 장착 면역형광은 현미경 기술에 적합한 다중 웰 챔버 슬라이드를 사용하는 경우 동일한 배양 웰(액적 상태)에서 수행할 수 있습니다.
- RT에서 20분 동안 4% 파라포름알데히드(PFA)의 액적에 있는 hOSE 오가노이드를 고정합니다.
- 회전/진탕 플랫폼에서 RT에서 5분 동안 PBS로 두 번 세척합니다.
- RT에서 15분 동안 100μL의 투과화 완충액(표 1)을 사용하여 액적의 hOSE 오가노이드를 투과시킵니다.
- 100μL의 차단 버퍼(표 1)로 RT에서 15분 동안 3회 세척하고 회전/진탕 플랫폼에서 4°C에서 밤새(o/n) 차단합니다.
- 회전/진탕 플랫폼에서 4°C o/n에서 차단 완충액에 희석한 100μL의 1차 항체 혼합물과 함께 배양합니다.
참고: 사용된 1차 항체 목록, 표시된 세포 유형 및 발현 12,19,20,21,22,23,24,25를 검증하는 데 사용된 동물 모델 목록은 재료 표를 참조하십시오. - 플레이트를 RT로 가져오고 회전/진탕 플랫폼에서 RT에서 15분 동안 100μL의 차단 버퍼로 3회 세척합니다.
- 차단 완충액에 희석한 100μL의 2차 항체 혼합물로 회전/진탕 플랫폼에서 RT에서 2시간 동안 배양하되 빛으로부터 보호됩니다.
참고: 사용된 2차 항체 목록은 Table of Materials 를 참조하십시오. 빛으로부터 보호하려면 플레이트를 어두운 상자 안에 넣거나 알루미늄 호일로 덮으십시오. - 회전/진탕 플랫폼에서 RT에서 15분 동안 100μL의 PBS에서 3회 세척합니다.
- 이미징할 때까지 알루미늄 호일로 덮인 플레이트를 4°C에서 보관하십시오(그림 4).
6. hOSE 오가노이드 크기의 정량화
- 현미경으로 10x 명시야 사진(TIFF 이미지)을 촬영합니다.
- Fiji (https://imagej.net/software/fiji/)26을 다운로드하여 설치합니다.
- ImageJ 소프트웨어 Fiji를 사용하여 hOSE 오가노이드 이미지 영역을 측정합니다.
- 피지에서 이미지 TIFF 파일을 로드합니다.
- Image(이미지) > Adjust > Threshold(임계값 조정)를 클릭하여 업로드된 명시야 이미지에서 hOSE 오가노이드(어두운 영역)를 인식할 수 있도록 소프트웨어에 대한 임계값을 생성합니다. 대부분의 배경이 제거되고 개별 오가노이드가 유지될 때까지 아래 및 위 값을 조정합니다.
- ROI 분석 > 도구를 클릭하여 ROI 도구를 >.
- 지팡이 도구를 선택하고 전체 오가노이드 둘레를 둘러싼 노란색 선이 보일 때까지 hOSE 오가노이드가 있는 영역을 클릭합니다. ROI 패널에서 Add and Measure를 클릭하여 해당 OSE 오가노이드의 면적 값을 구합니다.
- 6.3.4단계를 반복합니다. 모든 hOSE 오가노이드를 측정할 수 있습니다.
결과
2D hOSE 배양
갓 분리한 hOSE 세포를 12웰 플레이트에 도우려 플레이하고 3주 동안 배양했습니다. 이 기간 동안 세포는 세 번 통과되었습니다(그림 2A). 배양 중인 일차 hOSE 세포는 통로 3(P3)까지 조약돌과 같은 형태를 보였으나 그 이후에는 노화의 징후를 보이기 시작했으며, 이는 제한된 기간 hOSE가 통로될 수 있다고 보고한 이전 결과에 따른것이다 27. 또한, 쥐 OSE는 시험관 내에서 상피에서 중간엽으로의 전환(EMT)을 겪으며, 액틴 세포골격의 재배열 및 콜라겐 I19의 침착과 같은 섬유아세포와 유사한 특징을 나타내는 것으로 나타났습니다. 이에 따라 ACTA2+CD44+ hOSE는 P2와 P3 사이에서 COL1A1의 뚜렷한 상향조절을 보였으며(그림 2B), 이는 hOSE 세포가 배양 중에 EMT를 겪는다는 것을 시사합니다.
TGF-β 신호전달은 다양한 상피세포 유형(29)에서 EMT를 유도할 수 있는 EMT28의 주요 조절자이다. TGF-β가 OSE_2D 매체에 첨가되지 않았지만, 첨가된 FBS는 이 사이토카인(30,31)의 검출 가능한 수준을 함유할 수 있었다. 이러한 이유로 TGF-β inhibitor type I receptor SB-431542를 추가하면 EMT를 예방하여 장시간의 2D 배양이 가능한지 여부를 테스트했습니다. 놀랍게도, OSE_2D 배지에 10μM의 SB-43154232를 보충하면 세포 증식이 억제되었습니다(그림 2C). TGF-β 신호전달이 OSE 증식에 필수적이라는 결론을 내렸고, 억제제 없이 추가 2D 배양 실험을 수행했습니다.
3D hOSE 오가노이드 배양
인간 OSE 오가노이드12를 성장시키기 위해 발표된 배양 조건을 기반으로 BME 방울에 매립된 hOSE 오가노이드를 도출하고 최대 28일 동안 OSE_3D배지(표준 농도 100nM의 에스트라디올 포함)에서 성장시켰습니다. 7일 이내에 갓 분리한 OSE 세포에서 유래한 많은 hOSE 오가노이드가 평균 직경이 130mm인 낭포성이었습니다(그림 3A,B). 이러한 결과는 Kopper와 동료들이 다지고 효소로 소화된 인간 난소 조직12에서 hOSE 오가노이드를 유도하는 것에 대해 보고한 것과 유사했습니다. 흥미롭게도 배양 14일 후 갓 분리된 OSE 세포에서 유래한 hOSE 오가노이드가 2D 확장 OSE 세포의 hOSE 오가노이드(평균 직경 100mm)보다 더 커졌는데(평균 직경 160mm), 이는 2D 확장 OSE 세포가 증식을 줄이는 경향 때문일 수 있습니다. 또한, 많은 3D hOSE 오가노이드는 편평한 상피 세포의 단층으로 구성되었지만(그림 3C 왼쪽 상단 패널), 일부는 세포의 직육면체 단층을 나타냈고(그림 3C 오른쪽 상단 패널), 다른 일부는 다층(그림 3C 오른쪽 하단 패널)이었거나(그림 3C 왼쪽 하단 패널) 비월격화 세포 클러스터를 형성했습니다.
OSE_2D 배지를 사용하여 hOSE 오가노이드를 유도할 수 있는지 테스트하기 위해 갓 분리한 hOSE 세포를 BME의 액적에 매립하고 12일 동안 OSE_2D 배지에서 성장시켰습니다. 6일 후, 방추체 모양의 세포가 보였는데, 이는 hOSE 세포가 액적에서 EMT를 겪고 있음을 시사합니다. 중요한 것은 OSE_2D 매체를 사용하여 hOSE 오가노이드가 형성되지 않았다는 것입니다(그림 3D).
hOSE 오가노이드의 세포 특성
인간 성인 난소에서 케라틴 8(KRT8)은 OSE 집단을 특이적으로 표시하며(그림 4A), 이에 따라 hOSE 오가노이드는 KRT8 발현을 유지하여 세포 정체성을 검증했습니다(그림 4B). 마우스 OSE 세포에서 Yes1 관련 단백질(YAP1)의 핵 국소화는 배란 후 상처 부위를 확장하고 치유할 수 있는 OSE 줄기/전구 세포와 특이적으로 연관되었습니다24,33. YAP는 크기에 관계없이 hOSE 오가노이드의 대다수 세포에서 핵 국소화를 보여주었습니다(그림 4B). CD4420 및 LGR522와 같은 마우스 OSE 세포에서 발현되는 것으로 보고된 다른 마커도 조사되었습니다. 흥미롭게도 CD44와 LGR5는 모두 작은 hOSE 오가노이드(직경 <100μm)에서 발현된 반면, 더 큰 오가노이드에서는 CD44와 LGR5가 하향 조절된 것처럼 보였습니다(그림 4B).
다음으로, hOSE 오가노이드가 BME 내장 오가노이드(apical-in)에서 일반적으로 관찰되는 apical-basal 극성을 나타내는지 조사했습니다34. 기저측 단백질 인테그린 베타 1(ITGB1) 및 정점 단백질 포도칼릭신(PODXL)을 사용하여 hOSE 오가노이드의 세포 극성을 표시하여 hOSE 오가노이드 크기와 무관하게 명확한 apical-in 극성을 확인했습니다(그림 4B).
인간 OSE는 중간엽 마커 N-cadherin(CDH2)을 발현하는 것으로 알려져 있는 반면, 상피 마커 E-cadherin(CDH1)의 발현은 원주형 OSE 세포로 제한됩니다(그림 4A)2. 흥미롭게도 이 연구에서 파생된 hOSE 오가노이드는 중간엽 마커 CDH2 및 비멘틴(VIM)을 발현했으며, 직육면체/원주 상피가 있는 큰 낭포성 hOSE 오가노이드는 모두 CDH1+ 및 CDH2+VIM+였습니다(그림 4C). CDH1+ hOSE 오가노이드가 1차 CDH1+ OSE 세포에서 유래했는지 아니면 시험관 내 상피 분화 또는 (종양성) 형질전환을 거친 CDH1-OSE 세포에서 유래했는지는 불분명합니다 25,35.
hOSE 오가노이드 사용 소개: hOSE 오가노이드에 대한 배란 신호의 효과
난포 자극 호르몬과 인간 융모성 성선 자극 호르몬은 난포 성장과 배란을 유도하는 데 사용할 수 있으며, 배란 후에는 프로게스테론 및 에스트라디올36과 같은 난소 생성 호르몬의 농도가 현저하게 증가합니다. 스크리닝 플랫폼으로서의 hOSE 오가노이드의 유용성을 보여주기 위해 오가노이드의 수와 크기를 정량화 출력(Fiji 사용)으로 사용하여 이러한 호르몬이 hOSE 오가노이드에 미치는 영향을 조사했습니다. 이를 위해 에스트라디올이 결핍된(호르몬 없음) OSE_3D 배지와 FSH, hCG, 에스트라디올 또는 프로게스테론이 다양한 농도로 함유된 OSE_3D 배지에서 hOSE 오가노이드를 도출했습니다(그림 5A).
3개의 서로 다른 공여체(n=3)의 동결 보존-해동된(비팽창) hOSE 세포에서 파생된 hOSE 오가노이드의 수를 배양 7일 후 액적당 정량화했습니다(그림 5A,B). 배양 배지는 3일마다 교체되었습니다. 배지 함유 호르몬에서 형성된 액적당 hOSE 오가노이드의 총 수는 호르몬이 없는 배지와 비교하여 유의한 차이가 관찰되지 않았습니다(그림 5A,B). 오가노이드 크기에 대한 호르몬의 효과를 정량화하기 위해 배양 14일 후 각 방울(각 조건에서)을 이미지화하고 피지를 사용하여 4개의 가장 큰 hOSE 오가노이드의 면적을 측정했습니다. 흥미롭게도 프로게스테론(1000nM) 또는 에스트라디올(200nM)의 존재 하에 두 개의 서로 다른 공여체(n = 2)에서 hOSE 오가노이드를 생성하면 액적당 하나 이상의 매우 큰 오가노이드(약 700μm 직경)가 생성되었습니다(그림 5C,D).
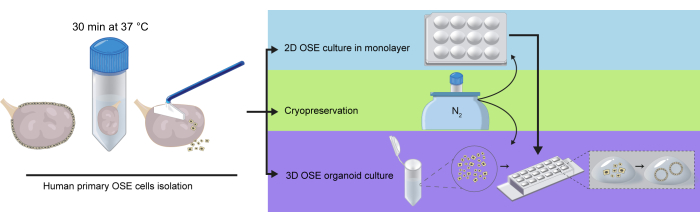
그림 1: 전체 난소에서 분리된 hOSE 세포의 개략도. 난소를 37°C에서 30분 동안 소화액에서 배양하고, hOSE 세포를 부드럽게 긁어내어 난소 표면에서 분리한 후 동결 보존하고, 단층의 2D OSE 배양에 직접 도금하거나, 3D hOSE 오가노이드 배양을 위해 기저막 추출물(BME)에 삽입했습니다. 동결 보존-해빙된 hOSE 세포는 2D 배양 또는 3D 오가노이드 형성에 사용할 수 있으며, 2D 확장 hOSE 세포는 3D hOSE 오가노이드를 생성하는 데 사용할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: hOSE 세포의 2D 1차 배양. (A) 전형적인 상피 조약돌 형태를 묘사하는 통로 0 (P0), 2 (P2) 및 3 (P3)에서 hOSE 세포의 명시야 이미지. 스케일 바는 상단 패널에서 750 μm, 하단 패널에서 125 μm입니다. (B) P2 및 P3의 2D hOSE 세포에서 ACTA2, CD44, COL1A1에 대한 면역형광. 스케일 바는 50 μm입니다. (C) P0, P2 및 P3에서 10 μM의 SB-431542로 배양한 hOSE 세포의 명시야 이미지. 세포는 P2에서 노화의 징후를 보였으며 배양 중에 높은 밀도에 도달하지 않았습니다. 스케일 바는 상단 패널에서 750 μm, 하단 패널에서 125 μm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
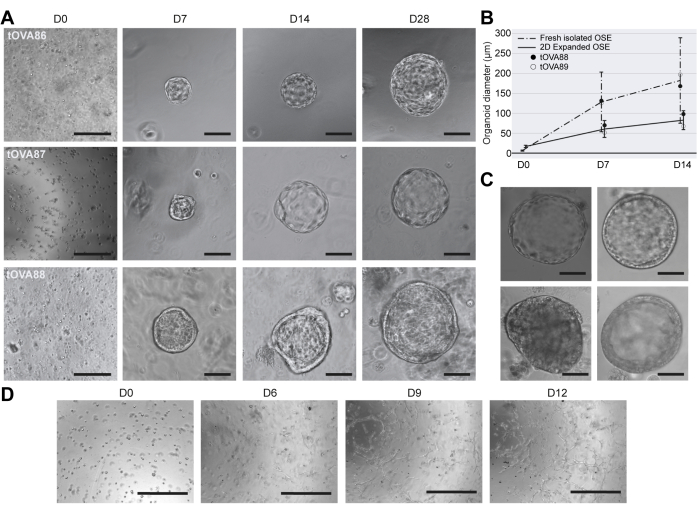
그림 3: hOSE 오가노이드의 형태학적 특성 분석. (A) 3개의 서로 다른 공여체(tOVA86, tOVA87, tOVA88)에서 유래한 3개의 독립적인 hOSE 오가노이드 유도체의 명시야 이미지. 이미지는 세포 임베딩(D0), 7일(D7), 14일(D14) 및 28일(D28) 배양 후 촬영되었습니다. 스케일 바는 D0에서 750 μm이고 나머지는 50 μm입니다. (B) 갓 분리한 hOSE 세포(점선) 및 2D 확장 hOSE 세포(실선)에서 파생된 hOSE 오가노이드의 직경. D0, D7 및 D14에서 측정± 평균 크기 표준 편차가 표시되어 있습니다. 두 가지 다른 공여체(tOVA88 및 tOVA89)의 결과가 표시됩니다. (C) 다양한 형태를 보여주는 hOSE 오가노이드의 명시야 이미지: 단일 평면층(왼쪽 상단), 단일 원주형 층(오른쪽 상단), 다층(오른쪽 하단) 및 비루메나이즈드 세포 응집체(왼쪽 하단). 스케일 바는 100 μm입니다. (D) BME에 매립되고 OSE_2D 배지로 12일 동안 배양된 hOSE 세포의 명시야 이미지. 이미지는 세포 임베딩(D0), 6일(D6), 9일(D9) 및 12일(D12) 후에 촬영되었습니다. 섬유아세포(Fibroblast)와 같은 세포가 배양을 추월했고, 오가노이드(organoid)와 같은 구조는 형성되지 않았습니다. 스케일 바는 750 μm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
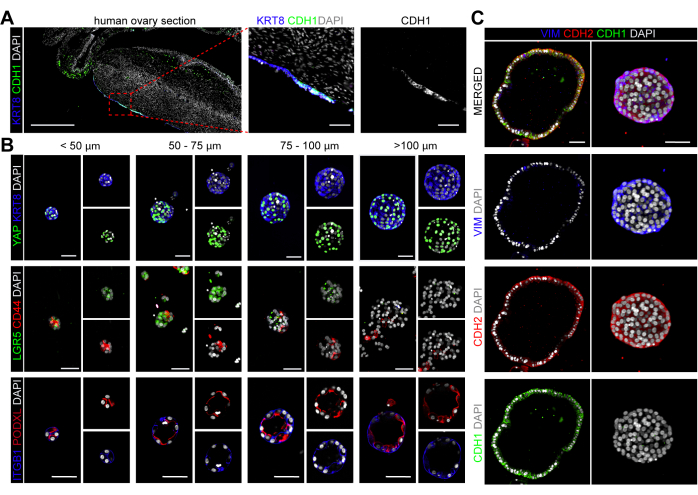
그림 4: hOSE 오가노이드의 세포 특성 분석. (A) 인간 난소 절편에서 KRT8 및 CDH1에 대한 면역형광. 왼쪽 패널의 눈금 막대는 500 μm이고 중간 및 오른쪽 패널은 50 μm입니다. (B) 다양한 크기(<50 μm, 50-75 μm, 75-100 μm, >100 μm)의 hOSE 오가노이드에서 KRT8 및 YAP, LGR5 및 CD44, ITGB1 및 PODXL에 대한 면역형광. 스케일 바는 50 μm입니다. (C) hOSE 오가노이드의 VIM, CDH1, CDH2에 대한 면역형광. 스케일 바는 50 μm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
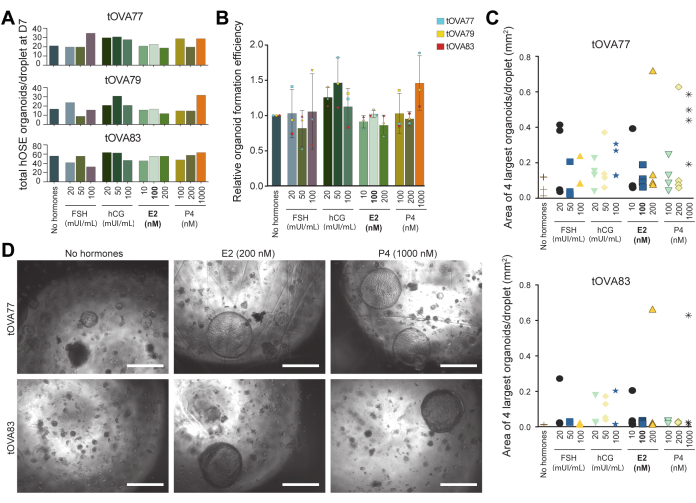
그림 5: 배란 신호가 hOSE 오가노이드 형성에 미치는 영향. (A) 서로 다른 배양 배지에서 7일째에 형성된 액적당 총 hOSE 오가노이드 수. hOSE 오가노이드는 3개의 서로 다른 공여체(tOVA77, tOVA79, tOVA83)에서 파생되었습니다. 굵은 글씨체는 오가노이드 유도에 사용되는 OSE_3D 매체입니다. (B) 호르몬이 없는 배지와 비교한 상대적 오가노이드 형성. hOSE 오가노이드의 통합 값은 세 가지 다른 공여체(tOVA77, tOVA79, tOVA83)에서 파생되었습니다. (C) 두 개의 다른 공여체(tOVA77, tOVA83)에서 테스트한 각 실험 조건에서 14일째에 가장 큰 hOSE 오가노이드 4개의 이미지 영역을 나타내는 그래프. (D) 두 명의 다른 공여자(tOVA77, tOVA83)로부터 호르몬이 없는 배지, 200nM E2 및 1000nM P4를 사용한 14일차 배양 시 hOSE 오가노이드를 보여주는 명시야 이미지. 스케일 바는 750 μm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 연구에 사용된 작업 솔루션의 구성. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
3D 오가노이드 기술은 의학 연구에 없어서는 안 될 도구로 부상하고 있습니다. 한편으로, 이 체외 플랫폼은 조직 재생, 상처 치유 및 발달에 대한 근본적인 기계론적 질문을 연구할 수 있는 가능성을 제공한다18. 반면에 환자 샘플에서 파생된 3D 오가노이드는 진단, 약물 검사 및 세포 치료를 포함한 맞춤형 의학 연구를 가능하게 합니다 12,13,14,37,38. 난소 연구 분야에서, hOSE는 상피성 난소암(epithelial ovarian carcinomas)의 기원으로 밝혀진 이후 상당한 관심을 받고 있다39. 가장 흔한 상피성 난소암 중 하나인 대부분의 고급 장액성 난소암(HGSOC)은 나팔관(40)에서 발생하는 것으로 생각되지만, 마우스 3D 난소 오가노이드에 대한 현재 연구는 OSE와 나팔관15,16에서 HGSOC의 잠재적인 이중 기원을 제안했습니다.
여기에서는 hOSE 3D 오가노이드 유도를 위한 프로토콜을 설명하고 난소 조직 재생에 새로운 기계론적 지식을 제공하기 위한 응용 분야에 대해 설명했습니다. 이 프로토콜에는 인간 난소에서 일차 hOSE 세포를 분리하고 3D hOSE 오가노이드를 생성하는 단계별 분석법이 포함되어 있습니다. 효율적인 hOSE 오가노이드 유도를 위해서는 난소 조작을 최소화하는 것이 중요합니다. hOSE는 난소 표면과 단층 조직에 위치하기 때문에 난소 절제술 및 장기 조작 중에 손상과 손실이 발생하기 쉽습니다. 이러한 이유로, 우리는 hOSE 2,8을 분리하기 위해 전체 난소에 적용되는 효소 및 긁는 방법을 선호했습니다. 본 프로토콜에서는 hOSE 세포간 연결을 파괴하기 위해 순한 효소 치료를 적용한 후 난소 표면을 부드럽게 긁어냈습니다.
2D와 3D hOSE 배양을 비교할 때, 2D 배양에서 hOSE 세포의 초기 높은 증식 속도에도 불구하고 EMT로 인해 세포 특성이 변경되었다는 점에 유의해야 하며, 이는 적용된 2D 배양 조건이 상피 형태를 유지하는 데 적합하지 않다는 것을 시사합니다. 대조적으로, 3D hOSE 오가노이드는 노화 징후 없이 최소 4회 통과할 수 있었습니다. 사용된 OSE_3D 오가노이드 배양 배지는 Kopper와 동료들이 OC 및 건강한 hOSE 오가노이드12 를 유도하기 위해 사용한 것과 Kessler와 동료들이 인간 FT 오가노이드17을 유도하기 위해 사용한 것을 기반으로 했습니다. 주요 차이점은 인간 Wnt3a 및 R-Spondin-1 컨디셔닝 배지를 재현성을 용이하게 하기 위해 상업적으로 이용 가능한 재조합 단백질로 대체했다는 것입니다.
면역형광 기법은 일반적으로 배양 플레이트에서 조직 샘플을 제거하고 파라핀 또는 냉동 절편을 위해 처리하는 것을 포함합니다. 매우 작은 구조로 작업할 때 샘플 처리 중에 손실될 위험이 높습니다. 이 프로토콜에서 hOSE 오가노이드의 유도는 BME 매트릭스에서 hOSE 오가노이드를 제거할 필요 없이 직접 현미경 이미징이 가능한 세포 배양 플레이트에서 이루어집니다. 또한, Rezanejad와 동료들이 췌관 오가노이드41에 대해 설명한 여기에 사용된 전장 면역형광 분석법은 형태학적으로 온전한 오가노이드 내에서 단백질 국소화를 현장에서 관찰할 수 있게 해주었습니다. 우리는 다중 웰 챔버 슬라이드에서 파생된 hOSE 오가노이드에 대해 이 면역형광 프로토콜을 수행할 때 매우 낮은 배경 신호로 매우 효율적인 항체 침투가 있음을 입증했습니다.
이 방법을 사용하여 유도된 대부분의 hOSE 오가노이드는 CDH1 발현이 부족했지만 일부 CDH1+ hOSE 오가노이드가 형성되어 CDH1-hOSE 오가노이드에 비해 더 큰 크기에 도달했습니다. CDH1의 발현은 종양성 hOSE 표현형 2,35와 관련이 있습니다. hOSE 분리에 사용된 난소는 가임기(27.1세 ± 5세)의 건강한 트랜스남성 기증자에 의해 기증되었습니다. 이 기증자들은 난소 절제술을 받기 전 38개월 ± 15개월 동안 테스토스테론 치료를 받고 있었습니다. 난소 표면의 CDH1+ hOSE 세포가 테스토스테론 치료에 기인할 수 있다는 가능성을 배제할 수 없습니다. 안드로겐 치료는 무배란42, 피질 영역(43)의 증식, 피질 경직 증가(44)와 같은 난소 변화와 관련이 있지만, 테스토스테론(45)을 사용하는 동안 일반적인 난소 병리는 양성으로 유지된다.
요약하면, 이 프로토콜은 난소 조직 재생에 대한 기계론적 질문을 해독하기 위해 hOSE 3D 오가노이드를 생성할 수 있는 잠재력을 강조합니다. 중요한 것은 이 방법이 암 발병 위험이 있는 환자의 난소 생검에 존재하는 악성 세포를 검출하는 데에도 적용될 수 있다는 것입니다. 총체적으로, 이 방법은 기본적인 난소 기능 연구와 개별화된 의료 치료를 위한 임상 응용 프로그램 모두를 위한 이 혁신적인 체외 플랫폼의 잠재적 응용 프로그램을 지원합니다.
공개
없음.
감사의 말
이 연구를 위해 조직을 기증한 모든 환자, 유용한 토론을 해준 Chuva de Sousa Lopes 그룹 구성원, 그림 1에 사용된 만화를 디자인해 준 I. De Poorter에게 감사의 말씀을 전합니다. 이 연구는 J.S.D.V. 및 S.M.C.d.S.L.에 대한 유럽 연구 위원회(European Research Council)의 725722자금 지원을 받았습니다. Novo Nordisk Foundation(reNEW), J.S.D.V. 및 S.M.C.d.S.L.에 대한 보조금 번호 NNF21CC0073729
자료
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin/EDTA | Invitrogen | 25200-056 | |
| 12-well Culture Plate | Corning | 3336 | Sterile |
| 15 mL tubes | Greiner | 188271 | Sterile |
| 28cm Cell Scraper | Greiner Bio-One | 541070 | |
| 50 mL tubes | Greiner | 227261 | Sterile |
| 60 mm Petri dish | Greiner Bio-One | 628160 | |
| A83-01 | Stem Cell Technologies | 72024 | |
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| B27 supplement (50x) | ThermoFisher Scientific | 17504-044 | |
| Bead bath | M714 | ||
| Bovine serum albumin (BSA) | Sigma Aldrich | 10735086001 | |
| Cell Dissociation Buffer | ThermoFisher Scientific | 13151014 | |
| Cryo-container "Mr. Frosty" | BD Falcom | 479-3200 | |
| DMEM Medium | ThermoFisher Scientific | 41966-029 | |
| Donkey anti-Goat IgG Alexa Fluor 647 | Invitrogen | A-21447 | |
| Donkey anti-Mouse IgG Alexa Fluor 488 | Invitrogen | A-21202 | |
| Donkey anti-Mouse IgG Alexa Fluor 647 | Invitrogen | A-31571 | |
| Donkey anti-Rabbit IgG Alexa Fluor 488 | Invitrogen | A-21206 | |
| Donkey anti-Rabbit IgG Alexa Fluor 594 | Invitrogen | A-21207 | |
| Donkey anti-Sheep IgG Alexa Flour 647 | Invitrogen | A-21448 | |
| Fetal Bovine Serum (FBS) | ThermoFisher Scientific | A4736401 | |
| Follicle Stimulating Hormone (FSH) | Sigma Aldrich | F4021 | |
| Forskolin | Peprotech | 6652995 | |
| Glutamax (100x) | Gibco | 35050-038 | |
| Goat anti-CDH2 (N/R-cadherin) | Santa Cruz | SC-1502 | Mesenchymal Cells; Wong et al 1999 (human)25 |
| Goat anti-PODXL (podocalyxin of GP135) | R&D Systems | AF1658 | Apical Polarity; Bryant et al 2014 (canine)21 |
| Goat anti-Rat IgG Alexa Fluor 555 | Invitrogen | A-21434 | |
| hEGF | R&D Systems | 263-EG | |
| HEPES | Gibco | 15630-056 | |
| Hydrocortisone | Sigma Aldrich | H0888 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS-X; 100x) | ThermoFisher Scientific | 51500-056 | |
| Liberase DH Research Grade | Sigma Aldrich | A4736401 | |
| Luna-II cell counter | Logos Biosystems | L40001 | |
| Matrigel | Sigma Aldrich | 354277 | |
| McCoy’s 5A Medium | ThermoFisher Scientific | 26600-023 | |
| Mouse anti-ITGB1 (integrin beta 1) | Santa Cruz | SC-53711 | Basolateral Polarity; Bryant et al 2014 (canine)21 |
| Mouse anti-KRT8 (cytokeratin 8) | Santa Cruz | SC-101459 | OSE Cells; Kopper et al 2019 (human)12 |
| Mouse anti-VIM (vimentin) | Abcam | AB0809 | Mesenchymal Cells; Abedini et al 2020 (mouse)19 |
| Mycozap Plus-CL | Lonza | V2A-2011 | |
| N-Acetyl-L-cysteine | Sigma Aldrich | A9165 | |
| Nicotinamide | Sigma Aldrich | N0636-100G | |
| OVITRELLE-Choriogonadotropin alfa (hCG) | Merk | G03GA08 | |
| Progesterone (P4) | Sigma Aldrich | P8783 | |
| Rabbit anti-ACTA2 (alpha smooth muscle actin) | Abcam | AB5694 | Mesenchymal Cells; Abedini et al 2020 (mouse)19 |
| Rabbit anti-CDH1 (E-cadherin) | Cell Signaling | CST 3195S | Epithelial Cells; Wong et al 1999 (human)25 |
| Rabbit anti-LGR5 | Abcam | AB75850 | OSE Progenitor Cells; Flesken-Nikitin et al 2013 (mouse)22 |
| Rabbit anti-YAP | Cell Signaling | 14074S | Proliferative OSE; Wang et al 2022 (mouse)24 |
| Rat anti-CD44 PE-conjugated | eBioscience | 12-0441-81 | OSE Progenitor Cells; Bowen et al 2009 (human)20 |
| Recombinant Human Heregulinβ-1 | Peprotech | 100-03 | |
| Recombinant Human Noggin | Peprotech | 120-10C | |
| Recombinant Human Wnt3a | R&D Systems | 5036-WN-010 | |
| Recombinant Rspondin-1 | Peprotech | 120-38 | |
| Red blood cells lysis buffer | eBiosciences | 00-4333-57 | |
| Revitacell Supplement (100x) | ThermoFisher Scientific | A26445-01 | |
| RNAse free DNAse | Qiagen | 79254 | |
| SB-431542 | Tocris Bioscience | 1624/10 | |
| Sheep anti-COL1A1 (pro-collagen 1 alpha 1) | R&D Systems | AF6220 | Mesenchymal Cells; Hosper et al 2013 (human)23 |
| Y-27632 | StemCell Technologies | 72304 | |
| β-Estradiol (E2) | Sigma-Aldrich | E8875 | |
| μ-Slide 18-well culture plate | Ibidi | 8181 | Sterile |
참고문헌
- Ng, A., Barker, N. Ovary and fimbrial stem cells: biology, niche and cancer origins. Nat Rev Mol Cell Biol. 16 (10), 625-638 (2015).
- Auersperg, N., Wong, A. S., Choi, K. C., Kang, S. K., Leung, P. C. Ovarian surface epithelium: biology, endocrinology, and pathology. Endocr Rev. 22 (2), 255-288 (2001).
- Tan, O. L., Fleming, J. S. Proliferating cell nuclear antigen immunoreactivity in the ovarian surface epithelium of mice of varying ages and total lifetime ovulation number following ovulation. Biol Reprod. 71 (5), 1501-1507 (2004).
- Carter, L. E., et al. Transcriptional heterogeneity of stemness phenotypes in the ovarian epithelium. Commun Biol. 4 (1), 527 (2021).
- Chumduri, C., Turco, M. Y. Organoids of the female reproductive tract. J Mol Med (Berl). 99 (4), 531-553 (2021).
- Edmondson, R. J., Monaghan, J. M., Davies, B. R. The human ovarian surface epithelium is an androgen responsive tissue. Br J Cancer. 86 (6), 879-885 (2002).
- Karlan, B. Y., Jones, J., Greenwald, M., Lagasse, L. D. Steroid hormone effects on the proliferation of human ovarian surface epithelium in vitro. Am J Obstet Gynecol. 173 (1), 97-104 (1995).
- Nakamura, M., Katabuchi, H., Ohba, T., Fukumatsu, Y., Okamura, H. Isolation, growth and characteristics of human ovarian surface epithelium. Virchows Arch. 424 (1), 59-67 (1994).
- Horvath, P., et al. Screening out irrelevant cell-based models of disease. Nat Rev Drug Discov. 15 (11), 751-769 (2016).
- Del Valle, J. S., Chuva de Sousa Lopes, S. M. Bioengineered 3D ovarian models as paramount technology for female health management and reproduction. Bioengineering (Basel). 10 (7), 832 (2023).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Kopper, O., et al. An organoid platform for ovarian cancer captures intra- and interpatient heterogeneity. Nat Med. 25 (5), 838-849 (2019).
- Maenhoudt, N., et al. Developing organoids from ovarian cancer as experimental and preclinical models. Stem Cell Reports. 14 (4), 717-729 (2020).
- Senkowski, W., et al. A platform for efficient establishment and drug-response profiling of high-grade serous ovarian cancer organoids. Dev Cell. 58 (12), 1106-1121.e7 (2023).
- Lohmussaar, K., et al. Assessing the origin of high-grade serous ovarian cancer using CRISPR-modification of mouse organoids. Nat Commun. 11 (1), 2660 (2020).
- Zhang, S., et al. Both fallopian tube and ovarian surface epithelium are cells-of-origin for high-grade serous ovarian carcinoma. Nat Commun. 10 (1), 5367 (2019).
- Kessler, M., et al. The Notch and Wnt pathways regulate stemness and differentiation in human fallopian tube organoids. Nat Commun. 6, 8989 (2015).
- Kim, J., Koo, B. K., Knoblich, J. A. Human organoids: model systems for human biology and medicine. Nat Rev Mol Cell Biol. 21 (10), 571-584 (2020).
- Abedini, A., Sayed, C., Carter, L. E., Boerboom, D., Vanderhyden, B. C. Non-canonical WNT5a regulates Epithelial-to-Mesenchymal Transition in the mouse ovarian surface epithelium. Sci Rep. 10 (1), 9695 (2020).
- Bowen, N. J., et al. Gene expression profiling supports the hypothesis that human ovarian surface epithelia are multipotent and capable of serving as ovarian cancer-initiating cells. BMC Med Genomics. 2, 71 (2009).
- Bryant, D. M., et al. A molecular switch for the orientation of epithelial cell polarization. Dev Cell. 31 (2), 171-187 (2014).
- Flesken-Nikitin, A., et al. Ovarian surface epithelium at the junction area contains a cancer-prone stem cell niche. Nature. 495 (7440), 241-245 (2013).
- Hosper, N. A., et al. Epithelial-to-mesenchymal transition in fibrosis: collagen type I expression is highly upregulated after EMT, but does not contribute to collagen deposition. Exp Cell Res. 319 (19), 3000-3009 (2013).
- Wang, J., et al. Selective YAP activation in Procr cells is essential for ovarian stem/progenitor expansion and epithelium repair. Elife. 11, e75449 (2022).
- Wong, A. S., et al. Constitutive and conditional cadherin expression in cultured human ovarian surface epithelium: influence of family history of ovarian cancer. Int J Cancer. 81 (2), 180-188 (1999).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Shepherd, T. G., Theriault, B. L., Campbell, E. J., Nachtigal, M. W. Primary culture of ovarian surface epithelial cells and ascites-derived ovarian cancer cells from patients. Nat Protoc. 1 (6), 2643-2649 (2006).
- Xu, J., Lamouille, S., Derynck, R. TGF-beta-induced epithelial to mesenchymal transition. Cell Res. 19 (2), 156-172 (2009).
- Miettinen, P. J., Ebner, R., Lopez, A. R., Derynck, R. TGF-beta induced transdifferentiation of mammary epithelial cells to mesenchymal cells: involvement of type I receptors. J Cell Biol. 127 (6 Pt 2), 2021-2036 (1994).
- Danielpour, D., et al. Sandwich enzyme-linked immunosorbent assays (SELISAs) quantitate and distinguish two forms of transforming growth factor-beta (TGF-beta 1 and TGF-beta 2) in complex biological fluids. Growth Factors. 2 (1), 61-71 (1989).
- Oida, T., Weiner, H. L. Depletion of TGF-beta from fetal bovine serum. J Immunol Methods. 362 (1-2), 195-198 (2010).
- Halder, S. K., Beauchamp, R. D., Datta, P. K. A specific inhibitor of TGF-beta receptor kinase, SB-431542, as a potent antitumor agent for human cancers. Neoplasia. 7 (5), 509-521 (2005).
- Wang, J., Wang, D., Chu, K., Li, W., Zeng, Y. A. Procr-expressing progenitor cells are responsible for murine ovulatory rupture repair of ovarian surface epithelium. Nat Commun. 10 (1), 4966 (2019).
- Kawata, M., et al. Polarity switching of ovarian cancer cell clusters via SRC family kinase is involved in the peritoneal dissemination. Cancer Sci. 113 (10), 3437-3448 (2022).
- Davies, B. R., Worsley, S. D., Ponder, B. A. Expression of E-cadherin, alpha-catenin and beta-catenin in normal ovarian surface epithelium and epithelial ovarian cancers. Histopathology. 32 (1), 69-80 (1998).
- Skory, R. M., Xu, Y., Shea, L. D., Woodruff, T. K. Engineering the ovarian cycle using in vitro follicle culture. Hum Reprod. 30 (6), 1386-1395 (2015).
- Boretto, M., et al. Patient-derived organoids from endometrial disease capture clinical heterogeneity and are amenable to drug screening. Nat Cell Biol. 21 (8), 1041-1051 (2019).
- Phan, N., et al. A simple high-throughput approach identifies actionable drug sensitivities in patient-derived tumor organoids. Commun Biol. 2, 78 (2019).
- Ducie, J., et al. Molecular analysis of high-grade serous ovarian carcinoma with and without associated serous tubal intra-epithelial carcinoma. Nat Commun. 8 (1), 990 (2017).
- Lee, Y., et al. A candidate precursor to serous carcinoma that originates in the distal fallopian tube. J Pathol. 211 (1), 26-35 (2007).
- Rezanejad, H., Lock, J. H., Sullivan, B. A., Bonner-Weir, S. Generation of pancreatic ductal organoids and whole-mount immunostaining of intact organoids. Curr Protoc Cell Biol. 83 (1), e82 (2019).
- Asseler, J. D., et al. One-third of amenorrheic transmasculine people on testosterone ovulate. Cell Rep Med. 5 (3), 101440 (2024).
- Ikeda, K., et al. Excessive androgen exposure in female-to-male transsexual persons of reproductive age induces hyperplasia of the ovarian cortex and stroma but not polycystic ovary morphology. Hum Reprod. 28 (2), 453-461 (2013).
- De Roo, C., et al. Texture profile analysis reveals a stiffer ovarian cortex after testosterone therapy: a pilot study. J Assist Reprod Genet. 36 (9), 1837-1843 (2019).
- Grimstad, F. W., et al. Ovarian histopathology in transmasculine persons on testosterone: A multicenter case series. J Sex Med. 17 (9), 1807-1818 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유