Method Article
Gli organoidi dell'epitelio della superficie ovarica umana come piattaforma per studiare la rigenerazione dei tessuti
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive la creazione di organoidi tissutali tridimensionali (3D) da cellule primarie di epitelio ovarico umano (hOSE). Il protocollo include l'isolamento dell'hOSE dalle ovaie appena raccolte, l'espansione cellulare dell'hOSE, le procedure di crioconservazione-scongelamento e la derivazione degli organoidi. Sono inclusi l'immunofluorescenza, l'analisi quantitativa e l'utilità di presentazione come piattaforma di screening.
Abstract
L'epitelio della superficie ovarica (OSE), lo strato più esterno dell'ovaio, subisce una rottura durante ogni ovulazione e svolge un ruolo cruciale nella guarigione delle ferite ovariche, ripristinando al contempo l'integrità ovarica. Inoltre, l'OSE può fungere da fonte di tumori ovarici epiteliali. Sebbene le proprietà rigenerative dell'OSE siano state ben studiate nei topi, la comprensione del preciso meccanismo di riparazione dei tessuti nell'ovaio umano rimane ostacolata dall'accesso limitato alle ovaie umane e da adeguati protocolli di coltura in vitro . Gli organoidi tessuto-specifici, modelli in vitro miniaturizzati che replicano sia gli aspetti strutturali che funzionali dell'organo originale, offrono nuove opportunità per lo studio della fisiologia degli organi, la modellazione delle malattie e i test sui farmaci.
Qui, descriviamo un metodo per isolare l'OSE umano primario (hOSE) da ovaie intere e stabilire organoidi hOSE. Includiamo una caratterizzazione morfologica e cellulare che mostra l'eterogeneità tra i donatori. Inoltre, dimostriamo la capacità di questo metodo di coltura di valutare gli effetti ormonali sulla crescita degli organoidi OSE per un periodo di 2 settimane. Questo metodo può consentire la scoperta di fattori che contribuiscono alla rigenerazione dell'OSE e facilitare gli screening farmacologici specifici per il paziente per l'OSE maligna.
Introduzione
L'ovaio è considerato uno degli organi più dinamici del corpo, sottoposto a cicli costanti di guarigione e rimodellamento delle ferite per tutta la durata della vita riproduttiva dell'individuo. Uno dei principali attori coinvolti nella rigenerazione del tessuto ovarico dopo ogni ciclo ovulatorio è l'epitelio della superficie ovarica (OSE)1. L'OSE è un singolo strato derivato dal mesotelio contenente cellule epiteliali piatte, cuboidali e colonnari che coprono l'intera superficie ovarica2. Prima dell'ovulazione, il tessuto stromale ovarico sulla superficie del follicolo ovulatorio subisce un'interruzione proteolitica per consentire il rilascio del complesso cumulo-ovocita. L'area ferita, nota come stigma ovulatorio, viene quindi riparata, con la chiusura completa della superficie ovarica ottenuta in meno di 72 ore nei topi3. La capacità altamente efficiente dell'OSE di proliferare e chiudere la ferita ovulatoria evidenzia la presunta esistenza di una popolazione di cellule staminali residente4. A causa della limitata disponibilità di ovaie umane da donatori in età riproduttiva, la maggior parte delle conoscenze sui meccanismi di riparazione dell'OSE proviene da modelli animali. Tuttavia, le caratteristiche specie-specifiche ostacolano la traduzione dalla ricerca ovarica su base animale all'uomo5.
Gli studi in vitro hanno utilizzato prevalentemente colture cellulari bidimensionali (2D) di OSE umano, in cui le cellule sono cresciute in un monostrato attaccato alla superficie di una piastra di coltura, grazie alla sua economicità e alla facilità di coltura 6,7,8. Tuttavia, questo approccio ha dei limiti nel replicare la complessità della dinamica del tessuto ovarico9. A questo proposito, le piattaforme di coltura cellulare 3D con particolare attenzione agli organoidi ovarici hanno rivoluzionato la ricerca ovarica10. Gli organoidi tissutali sono rappresentazioni miniaturizzate in vitro dell'organo da cui derivano, esibendo capacità di auto-organizzazione 3D e imitando le funzioni e le strutture chiave delle loro controparti in vivo 11. Questa tecnologia offre la possibilità di far luce su questioni fondamentali riguardanti lo sviluppo, la rigenerazione e la riparazione dei tessuti nell'ovaio umano10. Negli ultimi anni, i ricercatori hanno anche applicato le conoscenze sugli organoidi ovarici per la generazione di organoidi di carcinoma ovarico (OC) paziente-specifici per la modellazione della malattia e la medicina personalizzata 12,13,14.
Sulla base di diversi metodi utilizzati per la generazione di organoidi OSE di topo e organoidi delle tube di Falloppio (FT)15,16, nonché di organoidi OSE umani12 e FT17, descriviamo qui un protocollo per la derivazione di organoidi OSE umani da ovaie umane con potenziali applicazioni negli studi di rigenerazione OSE. Questo protocollo isola in modo efficiente le cellule OSE primarie da ovaie umane intere e include una descrizione dettagliata dell'espansione cellulare 2D e della generazione di organoidi hOSE 3D. Gli organoidi hOSE hanno mostrato variabilità (specifica del donatore) nella morfologia e nella crescita, evidenziando la loro utilità per studi personalizzati. Inoltre, questo protocollo include il mantenimento, il passaggio e l'immunofluorescenza degli organoidi hOSE all'interno della stessa piastra di coltura. Inoltre, fornisce una descrizione della diversa morfologia che gli organoidi hOSE possono adottare e caratterizza i cambiamenti nell'immunofenotipo durante la coltura. Infine, mostra l'utilità studiando l'influenza di stimoli ambientali, come gli ormoni ovarici, sulla formazione e la crescita degli organoidi hOSE in base al numero e alle dimensioni degli organoidi hOSE.
L'applicazione della tecnologia degli organoidi hOSE migliorerà la nostra comprensione dell'ovaio, con un'enfasi specifica sui meccanismi responsabili della sua notevole capacità rigenerativa. Con la continua evoluzione dei modelli ovarici umani 3D, la dipendenza dai modelli animali nella ricerca ovarica diminuirà, portando a terapie innovative nel campo della medicina rigenerativa18.
Protocollo
Lo studio è stato condotto secondo le linee guida della Dichiarazione di Helsinki. Il disegno dello studio è stato presentato al Comitato Etico Medico del Leiden University Medical Center (LUMC) ed è stata ottenuta una lettera di non obiezione (B18.029) prima dello studio. Il tessuto ovarico umano primario utilizzato è stato raccolto da persone transmascoline sottoposte a chirurgia di affermazione di genere presso l'ospedale VUmc (Amsterdam, Paesi Bassi). Il consenso informato firmato è stato ottenuto da tutti i donatori. Tutti i materiali utilizzati in questo protocollo sono elencati nella Tabella dei materiali.
1. Isolamento di cellule OSE primarie umane
- Dopo l'ovariectomia, immergere le ovaie in NaCl allo 0,9% o in una soluzione salina sterile simile e trasportarle in laboratorio su ghiaccio.
- Trasferire le singole ovaie in una provetta conica da 50 ml contenente 2-3 ml di terreno di digestione (Tabella 1) o quanto basta per coprire l'ovaio.
ATTENZIONE: Se l'ovaio non è integro (parte dell'organo è stata tagliata per l'analisi istologica), è fondamentale non coprire questa parte con il mezzo di digestione. - Mettere il tubo in un bagno di perle preriscaldato (o bagnomaria) a 37 °C per 30 minuti.
- Trasferire con cura l'ovaio in una capsula di Petri da 60 mm contenente 10 ml di terreno di raccolta (Tabella 1).
- Raschiare delicatamente la superficie ovarica contenente le cellule hOSE utilizzando un raschietto cellulare. Lavare il raschietto nel mezzo e ripetere questo passaggio almeno tre volte (Figura 1).
ATTENZIONE: Se l'ovaio non è intatto, evitare sia di raschiare che di immergere l'area danneggiata per ridurre al minimo la contaminazione con tipi di cellule indesiderate. - Trasferire le cellule hOSE nel terreno di raccolta in una provetta da 15 mL.
- Centrifugare le cellule hOSE a 240 x g per 5 minuti.
- Se il pellet mostra un colore rosso, indicativo di contaminazione con globuli rossi (RBC), risospendere il pellet con 1 mL di tampone di lisi RBC. Incubare per 3 minuti a temperatura ambiente (RT) con pipettaggio occasionale, aggiungere 4 mL di PBS con calcio e magnesio (PBS+/+) e centrifugare a 240 x g per 5 min. Se RBC persiste, ripetere questo passaggio.
- Crioconservare il pellet di cellule hOSE (Sezione 2), utilizzarlo per colture 2D (Sezione 3) o organoidi 3D (Sezione 4) (Figura 1).
2. Crioconservazione-scongelamento di cellule hOSE
- Crioconservazione
- Risospendere il pellet di cellule hOSE in 1 mL di terreno di congelamento cellulare.
- Trasferire la sospensione cellulare ai crioviali (2x crioviali per ovaio).
- Mettere i crioviali in un contenitore di congelamento e metterli a -80 °C per una notte.
- Trasferire i crioviali congelati in un serbatoio di azoto liquido per la conservazione a lungo termine.
- Scongelamento:
- Rimuovere il crioviale dall'azoto liquido.
- Mettere il crioviale in un bagno di perle preriscaldato (o bagnomaria) a 37 °C per 5 minuti o fino a quando all'interno del crioviale è visibile solo un piccolo nucleo congelato.
- Pipettare la sospensione cellulare hOSE in una provetta da 15 mL con 10 mL di terreno di raccolta (Tabella 1).
- Centrifugare a 240 x g per 5 min.
- Utilizzare il pellet cellulare hOSE per colture 2D (Sezione 3) o organoidi 3D (Sezione 4).
3. Coltura 2D hOSE in monostrato
- Risospendere il pellet hOSE in 1 mL di OSE_2D terreno (Tabella 1) e trasferirlo in un pozzetto da una piastra a 12 pozzetti.
- Aggiungere 1 mL di OSE_2D terreno in più nel pozzetto e coltivare a 37 °C in un incubatore umidificato (5% CO2) per 72 ore per garantire che le cellule hOSE si attacchino prima del primo cambio del terreno.
- Aggiornare il terreno ogni 2-3 giorni fino a quando le celle hOSE raggiungono la confluenza del 70%-90% (P0) (Figura 2A).
NOTA: Se i globuli rossi sono ancora presenti nella coltura, verranno rimossi durante il primo cambio del terreno e solo le cellule hOSE rimarranno attaccate al pozzetto. - Per il passaggio delle celle hOSE, seguire i passaggi descritti di seguito.
- Rimuovere i terreni di coltura dal pozzetto.
- Lavare con 1 mL di PBS sterile.
- Rimuovere il PBS e aggiungere abbastanza 0,05% di tripsina/EDTA per coprire le cellule.
- Porre la piastra a 37 °C in un incubatore umidificato (5% CO2) per 4-7 minuti fino a quando non si nota che le cellule si arrotondano e si staccano dal pozzetto.
- Arrestare la reazione enzimatica aggiungendo 1 mL di terreno di raccolta.
- Raccogliere le cellule hOSE e centrifugare a 240 x g per 5 min.
- Seminare le cellule in un nuovo pozzetto alla densità desiderata, aggiornare il terreno ogni 2-3 giorni fino a quando le cellule hOSE raggiungono la confluenza del 70%-90% e ripetere il passaggio 3.4.
NOTA: Le cellule hOSE primarie possono essere coltivate fino a tre passaggi. In seguito, la maggior parte delle cellule diventerà senescente (Figura 2A).
- Utilizzare le cellule hOSE espanse per un'ulteriore caratterizzazione utilizzando l'immunofluorescenza (Figura 2B) per testare gli effetti dei terreni di coltura (Figura 2C) o per gli organoidi 3D (Sezione 4).
4. 3D coltura di organoidi hOSE
- Preriscaldare il vetrino a camera multipozzetto a 37 °C.
- Contare le cellule hOSE (appena isolate o crioconservate-scongelate) con un contatore di cellule automatizzato o manualmente con un emocitometro.
- Risospendere il numero desiderato di cellule hOSE in 1 mL di terreno basico per organoidi OSE ghiacciato (Tabella 1) in una provetta da 1,5 mL.
- Centrifugare a 240 x g per 5 min.
- Risospendere il pellet hOSE nella quantità desiderata di soluzione ghiacciata di estratto di membrana basale (BME) non diluita per ottenere una concentrazione cellulare di 1 x 104 cellule/10 μL di BME.
- Pipettare la soluzione hOSE-BME su e giù per garantire una distribuzione omogenea.
- Produrre 10 μL di goccioline di soluzione hOSE-BME per pozzetto nel vetrino a camera multipozzetto preriscaldato.
NOTA: Assicurati che ogni goccia sia al centro del pozzetto per ottenere una forma a goccia. - Posizionare la piastra con le goccioline capovolte a 37 °C in un'incubatrice umidificata (5% CO2) per 15 minuti per consentire la solidificazione del gel.
- Aggiungere 100 μl di OSE_3D terreno (Tabella 1) e coltivare a 37 °C in un incubatore umidificato (5% CO2).
- Rinfrescare il terreno ogni 3-4 giorni.
NOTA: gli organoidi hOSE continuano a crescere almeno fino a 28 giorni in coltura (Figura 3A, B), ma si consiglia un passaggio ogni 14-28 giorni (il tasso di crescita è dipendente dal donatore, fresco rispetto a crio) per stimolare la proliferazione cellulare e la sopravvivenza degli organoidi. Tre linee indipendenti di organoidi hOSE sono state passate almeno 4 volte senza segni di senescenza. Gli organoidi hOSE mostrano morfologie diverse (Figura 3C). - Per il passaggio di organoidi hOSE:
- Rimuovere il terreno e aggiungere 100 μL di DMEM/F12 avanzato ghiacciato a ciascun pozzetto.
- Raschiare il fondo dei pozzetti con un puntale per pipetta P1000 per staccare le goccioline di gel.
- Trasferire ogni gocciolina di gel galleggiante in una provetta da 1,5 mL.
- Centrifugare le provette con le goccioline di gel a 240 x g per 5 min.
- Rimuovere il surnatante, risospendere il pellet in 300 μL di tampone di dissociazione cellulare e porre le provette in un bagno di perle preriscaldate (o bagnomaria) a 37 °C per 5-10 minuti.
NOTA: Se alcuni organoidi rimangono intatti, pipettare su e giù un paio di volte con la punta della pipetta ghiacciata rivestita di siero fetale bovino per interromperli meccanicamente. Il rivestimento delle punte delle pipette con siero fetale bovino impedisce agli organoidi di attaccarsi alla punta. - Aggiungere 300 μl di terreno basico dell'organoide hOSE e centrifugare a 240 x g per 5 minuti.
- Risospendere il pellet nella quantità desiderata di soluzione BME non diluita, riseminarli in un rapporto adeguato (distribuire il contenuto di 1 goccia in 1-4 goccioline) e coltivare come sopra.
NOTA: Gli organoidi non sono dissociati in singole cellule e, quindi, le cellule non possono essere contate con precisione per un ulteriore passaggio.
5. Immunofluorescenza a montaggio intero di organoidi 3D hOSE
NOTA: L'immunofluorescenza a montaggio intero può essere eseguita nello stesso pozzetto di coltura (in goccioline) se si utilizzano vetrini a camera multipozzetto adatti per le tecniche di microscopia.
- Fissare gli organoidi hOSE nelle goccioline in paraformaldeide al 4% (PFA) per 20 minuti a RT.
- Lavare due volte con PBS per 5 minuti a RT su una piattaforma rotante/agitante.
- Permeabilizzare gli organoidi hOSE nelle goccioline utilizzando 100 μL di tampone di permeabilizzazione (Tabella 1) per 15 minuti a RT.
- Lavare tre volte con 100 μL di tampone bloccante (Tabella 1) per 15 minuti a RT e bloccare per una notte (o/n) a 4 °C su una piattaforma rotante/agitante.
- Incubare con 100 μl di miscela di anticorpi primari diluita in tampone bloccante a 4 °C o/n su una piattaforma rotante/agitante.
NOTA: Consultare la Tabella dei materiali per un elenco degli anticorpi primari utilizzati, il tipo di cellula marcato e il modello animale utilizzato per convalidare l'espressione 12,19,20,21,22,23,24,25. - Portare la piastra in RT e lavarla tre volte con 100 μL di tampone bloccante per 15 minuti a RT su una piattaforma rotante/agitante.
- Incubare con 100 μL di miscela di anticorpi secondari diluita in tampone bloccante per 2 ore a RT su una piattaforma rotante/agitante, ma al riparo dalla luce.
NOTA: Vedere la Tabella dei materiali per un elenco degli anticorpi secondari utilizzati. Per proteggerlo dalla luce, posizionare la piastra all'interno di una scatola scura o coprirla con un foglio di alluminio. - Lavare tre volte in 100 μl di PBS per 15 minuti a RT su una piattaforma rotante/agitante.
- Conservare la lastra a 4 °C coperta da un foglio di alluminio fino all'imaging (Figura 4).
6. Quantificazione della dimensione dell'organoide hOSE
- Scatta foto in campo chiaro 10x (immagine TIFF) su un microscopio.
- Scarica e installa Fiji (https://imagej.net/software/fiji/)26.
- Misura l'area dell'immagine degli organoidi hOSE con il software ImageJ Fiji:
- Carica i file TIFF delle immagini nelle Fiji.
- Crea una soglia per il software per riconoscere gli organoidi hOSE (area più scura) nell'immagine in campo chiaro caricata facendo clic su Immagine > Regola > soglia. Regolare i valori sotto e sopra fino a quando la maggior parte dello sfondo non viene rimossa e i singoli organoidi vengono mantenuti.
- Apri lo strumento ROI facendo clic su Analizza > strumento > ROI.
- Seleziona lo strumento Bacchetta e fai clic sulla regione con un organoide hOSE fino a vedere una linea gialla che circonda l'intero perimetro dell'organoide. Nel pannello ROI, fare clic su Aggiungi e misura per ottenere il valore dell'area dell'organoide OSE.
- Ripetere il passaggio 6.3.4. per ogni organoide hOSE da misurare.
Risultati
Cultura hOSE 2D
Le cellule hOSE appena isolate sono state piastrate su una piastra a 12 pozzetti e coltivate per 3 settimane. Durante questo periodo, le celle sono state fatte passare tre volte (Figura 2A). Le cellule primarie di hOSE in coltura hanno mostrato una morfologia simile a quella di un ciottolo fino al passaggio 3 (P3), ma successivamente hanno iniziato a mostrare segni di senescenza, in accordo con i risultati precedenti che riportavano il periodo limitato in cui l'hOSE può essere passata27. Inoltre, è stato dimostrato che l'OSE murina va incontro a transizione da epitelio a mesenchimale (EMT) in vitro, mostrando caratteristiche simili ai fibroblasti come il riarrangiamento del citoscheletro di actina e la deposizione di collagene I19. In accordo, ACTA2+CD44+ hOSE ha mostrato una pronunciata sovraregolazione di COL1A1 tra P2 e P3 (Figura 2B), suggerendo che le cellule hOSE subiscono EMT durante la coltura.
Il segnale del TGF-β è un importante regolatore dell'EMT28 in grado di indurre EMT in vari tipi di cellule epiteliali29. Sebbene il TGF-β non sia stato aggiunto al terreno di OSE_2D, l'FBS aggiunto potrebbe contenere livelli rilevabili di questa citochina 30,31. Per questo motivo, abbiamo testato se l'aggiunta del recettore SB-431542, inibitore del TGF-β di tipo I, potesse prevenire l'EMT, consentendo una coltura 2D prolungata. Sorprendentemente, l'integrazione del terreno di OSE_2D con 10 μM di SB-43154232ha ostacolato la proliferazione cellulare (Figura 2C). Abbiamo concluso che la segnalazione del TGF-β è essenziale per la proliferazione dell'OSE e sono stati eseguiti ulteriori esperimenti di coltura 2D senza l'inibitore.
Coltura 3D di organoidi hOSE
Sulla base delle condizioni di coltura pubblicate per la coltivazione di organoidi OSE umani12, abbiamo derivato organoidi hOSE incorporati in goccioline di BME e cresciuti in OSE_3D terreno (contenente una concentrazione standard di 100 nM di estradiolo) per un massimo di 28 giorni. Entro 7 giorni, molti organoidi hOSE derivati da cellule OSE appena isolate erano cistici con un diametro medio di 130 mm (Figura 3A, B). Questi risultati sono stati simili a quelli riportati da Kopper e colleghi sulla derivazione di organoidi hOSE da tessuto ovarico umano tritato e digerito enzimaticamente12. È interessante notare che gli organoidi hOSE derivati da cellule OSE appena isolate sono cresciuti più grandi (diametro medio di 160 mm) rispetto agli organoidi hOSE provenienti da cellule OSE espanse 2D (diametro medio di 100 mm) dopo 14 giorni di coltura (Figura 3B), probabilmente a causa della propensione delle cellule OSE espanse 2D a diminuire la proliferazione. Inoltre, mentre molti organoidi 3D hOSE consistevano in un monostrato di cellule epiteliali piatte (Figura 3C in alto a sinistra), alcuni mostravano un monostrato cuboidale di cellule (Figura 3C in alto a destra), altri erano multistrato (Figura 3C in basso a destra) o formavano un cluster di cellule non lumizzate (Figura 3C in basso a sinistra).
Per verificare se gli organoidi hOSE potessero essere derivati anche utilizzando OSE_2D terreno, le cellule hOSE appena isolate sono state incorporate in goccioline di BME e coltivate in OSE_2D terreno per 12 giorni. Dopo 6 giorni, erano visibili cellule simili a fusi, suggerendo che le cellule hOSE erano sottoposte a EMT nelle goccioline. È importante sottolineare che non si sono formati organoidi hOSE utilizzando OSE_2D terreno (Figura 3D).
Caratteristiche cellulari degli organoidi hOSE
Nell'ovaio adulto umano, la cheratina 8 (KRT8) contrassegna specificamente la popolazione OSE (Figura 4A) e, di conseguenza, gli organoidi hOSE hanno mantenuto l'espressione di KRT8, convalidando la loro identità cellulare (Figura 4B). Nelle cellule OSE di topo, la localizzazione nucleare della proteina associata a Yes1 (YAP1) è stata specificamente associata a cellule staminali/progenitrici OSE in grado di espandere e guarire l'area ferita dopo l'ovulazione24,33. YAP ha mostrato una localizzazione nucleare nella maggior parte delle cellule negli organoidi hOSE indipendentemente dalle loro dimensioni (Figura 4B). Sono stati studiati anche altri marcatori espressi nelle cellule OSE di topo, come CD4420 e LGR522. È interessante notare che sia CD44 che LGR5 erano espressi in piccoli organoidi hOSE (<100 μm di diametro), mentre in organoidi più grandi, CD44 e LGR5 sembravano sottoregolati (Figura 4B).
Successivamente, abbiamo studiato se gli organoidi hOSE mostrassero la polarità apicale-basale tipicamente osservata negli organoidi incorporati in BME (APICAL-IN)34. L'integrina beta 1 della proteina basolaterale (ITGB1) e la proteina apicale podocaglixina (PODXL) sono state utilizzate per mostrare la polarità cellulare negli organoidi hOSE, confermando una chiara polarità apicali-in indipendente dalla dimensione dell'organoide hOSE (Figura 4B).
È noto che l'OSE umano esprime il marcatore mesenchimale N-caderina (CDH2), mentre l'espressione del marcatore epiteliale E-caderina (CDH1) è limitata alle cellule OSE colonnari (Figura 4A)2. È interessante notare che gli organoidi hOSE derivati in questo lavoro esprimevano i marcatori mesenchimali CDH2 e vimentina (VIM), mentre i grandi organoidi hOSE cistici con epiteli cuboidali/colonnari erano entrambi CDH1+ e CDH2+VIM+ (Figura 4C). Non è chiaro se gli organoidi CDH1+ hOSE siano derivati da cellule OSE CDH1+ primarie o da cellule OSE CDH1- che hanno subito differenziamento epiteliale o trasformazione (neoplastica) in vitro25,35.
Presentazione dell'uso di organoidi hOSE: effetto dei segnali ovulatori sugli organoidi hOSE
Gli ormoni ormone follicolo-stimolante e gonadotropina corionica umana possono essere utilizzati per indurre la crescita follicolare e l'ovulazione, mentre, dopo l'ovulazione, si verifica un marcato aumento della concentrazione di ormoni prodotti dalle ovaie, come il progesterone e l'estradiolo36. Per mostrare l'usabilità degli organoidi hOSE come piattaforma di screening, abbiamo esaminato l'effetto di questi ormoni sugli organoidi hOSE, utilizzando il numero e la dimensione degli organoidi come output di quantificazione (utilizzando Fiji). Per questo, abbiamo derivato organoidi hOSE in terreni OSE_3D privi di estradiolo (senza ormoni) e in terreni OSE_3D contenenti FSH, hCG, estradiolo o progesterone a diverse concentrazioni (Figura 5A).
Il numero di organoidi hOSE derivati da cellule hOSE crioconservate-scongelate (non espanse) da 3 diversi donatori (n=3) è stato quantificato per gocciolina dopo 7 giorni di coltura (Figura 5A, B). I terreni di coltura venivano cambiati ogni 3 giorni. Non sono state osservate differenze significative nel numero totale di organoidi hOSE per gocciolina che si sono formati negli ormoni contenenti terreno rispetto al terreno senza ormoni (Figura 5A, B). Per quantificare l'effetto degli ormoni sulla dimensione dell'organoide, dopo 14 giorni di coltura, è stata analizzata ogni gocciolina (di ciascuna condizione) e l'area dei 4 più grandi organoidi hOSE è stata misurata utilizzando Fiji. È interessante notare che la generazione di organoidi hOSE da due diversi donatori (n = 2) in presenza di progesterone (1000 nM) o estradiolo (200 nM) ha portato ad almeno un organoide molto grande (circa 700 μm di diametro) per gocciolina (Figura 5C, D).
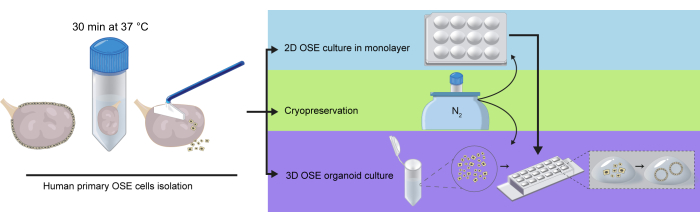
Figura 1: Rappresentazione schematica dell'isolamento delle cellule hOSE da ovaie intere. Le ovaie sono state incubate in soluzione digestiva per 30 minuti a 37 °C. Le cellule hOSE sono state staccate dalla superficie ovarica raschiando delicatamente e successivamente crioconservate, piastrate direttamente su coltura 2D OSE in monostrato o incorporate nell'estratto di membrana basale (BME) per la coltura 3D di organoidi hOSE. Le cellule hOSE crioconservate-scongelate possono essere utilizzate per la coltura 2D o la formazione di organoidi 3D, mentre le cellule hOSE espanse 2D possono essere utilizzate per generare organoidi hOSE 3D. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Coltura primaria 2D di cellule hOSE. (A) Immagini in campo chiaro di cellule hOSE ai passaggi 0 (P0), 2 (P2) e 3 (P3) raffiguranti la tipica morfologia epiteliale dei ciottoli. Le barre di scala sono di 750 μm sui pannelli superiori e di 125 μm sui pannelli inferiori. (B) Immunofluorescenza per ACTA2, CD44, COL1A1 su cellule hOSE 2D a P2 e P3. Le barre della scala sono di 50 μm. (C) Immagini in campo chiaro di cellule hOSE coltivate con 10 μM di SB-431542 a P0, P2 e P3. Le cellule hanno mostrato segni di senescenza da P2 e non hanno raggiunto un'elevata confluenza durante la coltura. Le barre di scala sono di 750 μm sui pannelli superiori e di 125 μm sui pannelli inferiori. Clicca qui per visualizzare una versione più grande di questa figura.
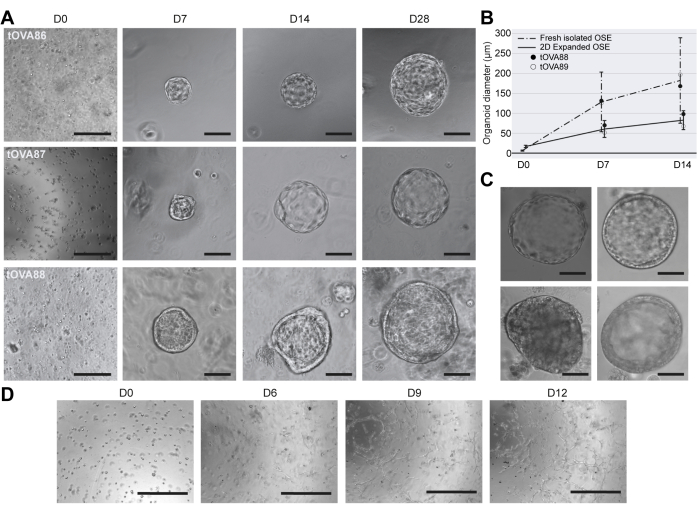
Figura 3: Caratterizzazione morfologica di organoidi hOSE. (A) Immagini in campo chiaro di tre derivazioni indipendenti di organoidi hOSE da tre diversi donatori (tOVA86, tOVA87, tOVA88). Le immagini sono state scattate dopo l'inclusione cellulare (D0), il giorno 7 (D7), il giorno 14 (D14) e il giorno 28 (D28) della coltura. Le barre di scala sono di 750 μm a D0 e 50 μm per il resto. (B) Diametro degli organoidi hOSE derivati da celle hOSE appena isolate (linea tratteggiata) e celle hOSE espanse 2D (linea continua). Viene illustrata la dimensione media ± la deviazione standard misurata a D0, D7 e D14. Vengono mostrati i risultati di due diversi donatori (tOVA88 e tOVA89). (C) Immagini in campo chiaro di organoidi hOSE che mostrano diverse morfologie: singolo strato piatto (in alto a sinistra), singolo strato colonnare (in alto a destra), multistrato (in basso a destra) e aggregato cellulare non lumenizzato (in basso a sinistra). Le barre della scala sono di 100 μm. (D) Immagini in campo chiaro di cellule hOSE incorporate in BME e coltivate per 12 giorni con OSE_2D terreno. Le immagini sono state scattate dopo l'inclusione delle cellule (D0), il giorno 6 (D6), il giorno 9 (D9) e il giorno 12 (D12). Le cellule simili ai fibroblasti hanno superato la coltura e non si sono formate strutture simili a organoidi. Le barre della scala sono di 750 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
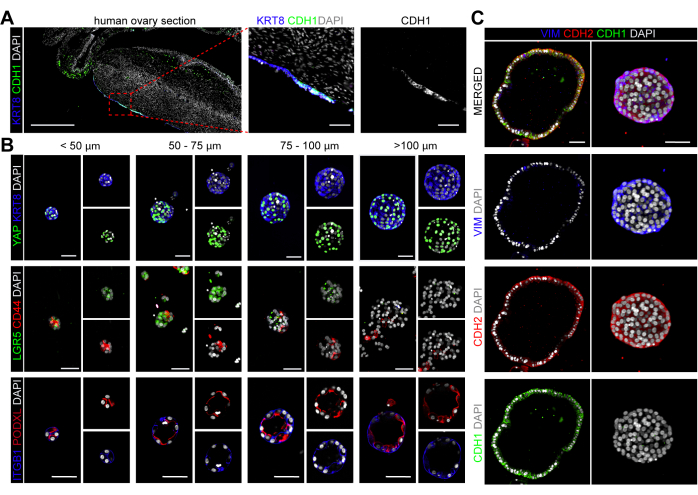
Figura 4: Caratterizzazione cellulare di organoidi hOSE. (A) Immunofluorescenza per KRT8 e CDH1 in sezione ovarica umana. La barra della scala sul pannello sinistro è di 500 μm e i pannelli centrale e destro sono di 50 μm. (B) Immunofluorescenza per KRT8 e YAP, LGR5 e CD44 e ITGB1 e PODXL in organoidi hOSE di diverse dimensioni (<50 μm, 50-75 μm, 75-100 μm, >100 μm). Le barre della scala sono di 50 μm. (C) Immunofluorescenza per VIM, CDH1, CDH2 in organoidi hOSE. Le barre della scala sono di 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
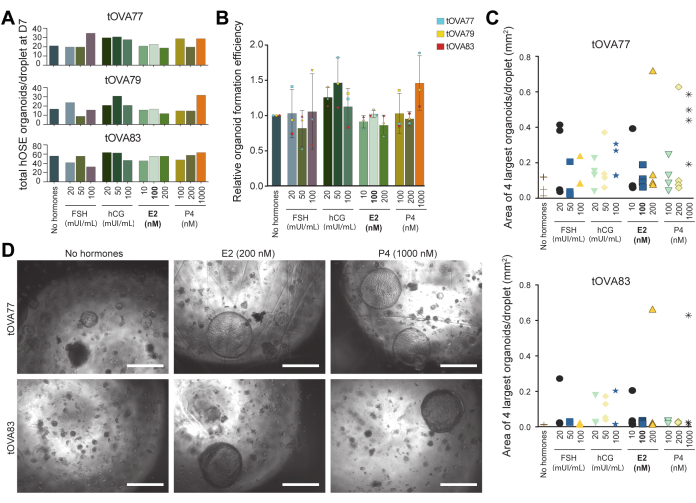
Figura 5: Effetto dei segnali ovulatori sulla formazione di organoidi hOSE. (A) Numero totale di organoidi hOSE per gocciolina formata al giorno 7 in diversi terreni di coltura. Gli organoidi hOSE sono stati derivati da tre diversi donatori (tOVA77, tOVA79, tOVA83). In grassetto è il mezzo OSE_3D utilizzato per la derivazione degli organoidi. (B) Formazione relativa di organoidi rispetto al terreno senza ormoni. I valori aggregati degli organoidi hOSE sono stati derivati da tre diversi donatori (tOVA77, tOVA79, tOVA83). (C) Grafico che raffigura l'area dell'immagine dei 4 più grandi organoidi hOSE al giorno 14 in ciascuna delle condizioni sperimentali testate da due diversi donatori (tOVA77, tOVA83). (D) Immagini in campo chiaro che mostrano organoidi hOSE al giorno 14 in coltura con terreno senza ormoni, 200 nM E2 e 1000 nM P4 da due diversi donatori (tOVA77, tOVA83). Le barre della scala sono di 750 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Tabella 1: Composizione delle soluzioni di lavoro utilizzate nello studio. Clicca qui per scaricare questa tabella.
Discussione
La tecnologia degli organoidi 3D sta emergendo come uno strumento indispensabile per la ricerca medica. Da un lato, questa piattaforma in vitro offre la possibilità di studiare questioni meccanicistiche fondamentali sulla rigenerazione dei tessuti, la guarigione delle ferite e lo sviluppo18. D'altra parte, gli organoidi 3D derivati da campioni di pazienti consentono studi di medicina personalizzata, tra cui diagnostica, test di farmaci e terapia cellulare 12,13,14,37,38. Nel campo della ricerca ovarica, l'hOSE ha guadagnato un notevole interesse a partire dalla sua implicazione come origine dei carcinomi ovarici epiteliali39. Sebbene si pensi che la maggior parte del carcinoma ovarico sieroso di alto grado (HGSOC), uno dei tumori ovarici epiteliali più comuni, derivi dalle tube di Falloppio40, l'attuale ricerca su organoidi ovarici 3D di topi ha proposto una potenziale doppia origine dell'HGSOC dall'OSE e dalle tube di Falloppio 15,16.
Qui, abbiamo descritto un protocollo per la derivazione di organoidi hOSE 3D e ne abbiamo delineato l'applicazione per portare nuove conoscenze meccanicistiche nella rigenerazione del tessuto ovarico. Questo protocollo include un metodo passo-passo per isolare le cellule hOSE primarie dalle ovaie umane e generare organoidi hOSE 3D. Per garantire un'efficiente derivazione degli organoidi hOSE, è fondamentale ridurre al minimo la manipolazione ovarica. A causa della sua posizione sulla superficie ovarica e dell'organizzazione monostrato, l'hOSE è soggetto a danni e perdite durante l'ovariectomia e la manipolazione degli organi. Per questo motivo, abbiamo privilegiato un metodo enzimatico e raschiante applicato a tutto l'ovaio per isolare hOSE 2,8. Nel presente protocollo, è stato applicato un trattamento enzimatico delicato per interrompere le connessioni intercellulari hOSE, seguito da un leggero raschiamento della superficie ovarica.
Confrontando la coltura 2D con la coltura 3D di hOSE, è importante notare che, nonostante l'alto tasso di proliferazione iniziale delle cellule hOSE nella coltura 2D, le loro caratteristiche cellulari sono alterate a causa dell'EMT, suggerendo che le condizioni di coltura 2D applicate non sono adatte a mantenere una morfologia epiteliale. Al contrario, gli organoidi 3D hOSE potrebbero essere passati almeno 4 volte senza segni di senescenza. I OSE_3D terreni di coltura degli organoidi utilizzati si basavano su quelli utilizzati da Kopper e colleghi per la derivazione di OC e organoidi hOSE sani12 e da Kessler e colleghi per la derivazione di organoidi FT umani17. La differenza principale è stata la sostituzione dei terreni condizionati umani Wnt3a e R-spondin-1 con proteine ricombinanti disponibili in commercio per facilitare la riproducibilità.
Le tecniche di immunofluorescenza in genere comportano la rimozione del campione di tessuto dalla piastra di coltura e il suo trattamento per la paraffina o la criosezione. Quando si lavora con strutture molto piccole, il rischio di perderle durante l'elaborazione dei campioni è elevato. In questo protocollo, la derivazione degli organoidi hOSE avviene in piastre di coltura cellulare che consentono l'imaging diretto al microscopio senza la necessità di rimuovere gli organoidi hOSE dalla matrice BME. Inoltre, il metodo di immunofluorescenza a montatura intera utilizzato qui, descritto da Rezanejad e colleghi per organoidi duttali pancreatici41, ha permesso l'osservazione in situ della localizzazione delle proteine all'interno di organoidi morfologicamente intatti. Abbiamo dimostrato che, quando si esegue questo protocollo di immunofluorescenza su organoidi hOSE derivati in vetrini a camera multipozzetto, si ha una penetrazione anticorpale altamente efficiente con un segnale di fondo molto basso.
Sebbene la maggior parte degli organoidi hOSE derivati con questo metodo mancasse dell'espressione di CDH1, si sono formati alcuni organoidi hOSE CDH1+, raggiungendo dimensioni maggiori rispetto agli organoidi hOSE CDH1-. L'espressione di CDH1 è stata associata ai fenotipi neoplastici hOSE 2,35. Le ovaie utilizzate per l'isolamento hOSE sono state donate da donatrici transmascoline sane in età riproduttiva (27,1 ± 5 anni). Questi donatori erano in trattamento con testosterone per un periodo di 38 ± 15 mesi prima dell'ovariectomia. Non possiamo scartare la possibilità che le cellule CDH1+ hOSE sulla superficie ovarica possano essere attribuite al trattamento con testosterone. Sebbene il trattamento con androgeni sia stato collegato a cambiamenti ovarici, come l'anovulazione42, l'iperplasia dell'area corticale43 e l'aumento della rigidità corticale44, la patologia ovarica generale rimane benigna durante l'uso del testosterone45.
In sintesi, questo protocollo evidenzia il potenziale della generazione di organoidi 3D hOSE per decodificare domande meccanicistiche sulla rigenerazione del tessuto ovarico. È importante sottolineare che questo metodo potrebbe essere applicato anche per il rilevamento di cellule maligne presenti nelle biopsie ovariche di pazienti a rischio di sviluppo del cancro. Nel complesso, questo metodo supporta le potenziali applicazioni di questa innovativa piattaforma in vitro sia per gli studi fondamentali sulla funzione ovarica che per le applicazioni cliniche per trattamenti medici individualizzati.
Divulgazioni
Nessuno.
Riconoscimenti
Vorremmo ringraziare tutti i pazienti che hanno donato tessuto per questo studio, i membri del gruppo Chuva de Sousa Lopes per le utili discussioni e I. De Poorter per aver progettato i cartoni animati utilizzati nella Figura 1. Questa ricerca è stata finanziata dal Consiglio Europeo della Ricerca, numero di sovvenzione ERC-CoG-2016-725722 (OVOGROWTH) per J.S.D.V. e S.M.C.d.S.L.; e la Novo Nordisk Foundation (reNEW), sovvenzione numero NNF21CC0073729 per J.S.D.V. e S.M.C.d.S.L.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin/EDTA | Invitrogen | 25200-056 | |
| 12-well Culture Plate | Corning | 3336 | Sterile |
| 15 mL tubes | Greiner | 188271 | Sterile |
| 28cm Cell Scraper | Greiner Bio-One | 541070 | |
| 50 mL tubes | Greiner | 227261 | Sterile |
| 60 mm Petri dish | Greiner Bio-One | 628160 | |
| A83-01 | Stem Cell Technologies | 72024 | |
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| B27 supplement (50x) | ThermoFisher Scientific | 17504-044 | |
| Bead bath | M714 | ||
| Bovine serum albumin (BSA) | Sigma Aldrich | 10735086001 | |
| Cell Dissociation Buffer | ThermoFisher Scientific | 13151014 | |
| Cryo-container "Mr. Frosty" | BD Falcom | 479-3200 | |
| DMEM Medium | ThermoFisher Scientific | 41966-029 | |
| Donkey anti-Goat IgG Alexa Fluor 647 | Invitrogen | A-21447 | |
| Donkey anti-Mouse IgG Alexa Fluor 488 | Invitrogen | A-21202 | |
| Donkey anti-Mouse IgG Alexa Fluor 647 | Invitrogen | A-31571 | |
| Donkey anti-Rabbit IgG Alexa Fluor 488 | Invitrogen | A-21206 | |
| Donkey anti-Rabbit IgG Alexa Fluor 594 | Invitrogen | A-21207 | |
| Donkey anti-Sheep IgG Alexa Flour 647 | Invitrogen | A-21448 | |
| Fetal Bovine Serum (FBS) | ThermoFisher Scientific | A4736401 | |
| Follicle Stimulating Hormone (FSH) | Sigma Aldrich | F4021 | |
| Forskolin | Peprotech | 6652995 | |
| Glutamax (100x) | Gibco | 35050-038 | |
| Goat anti-CDH2 (N/R-cadherin) | Santa Cruz | SC-1502 | Mesenchymal Cells; Wong et al 1999 (human)25 |
| Goat anti-PODXL (podocalyxin of GP135) | R&D Systems | AF1658 | Apical Polarity; Bryant et al 2014 (canine)21 |
| Goat anti-Rat IgG Alexa Fluor 555 | Invitrogen | A-21434 | |
| hEGF | R&D Systems | 263-EG | |
| HEPES | Gibco | 15630-056 | |
| Hydrocortisone | Sigma Aldrich | H0888 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS-X; 100x) | ThermoFisher Scientific | 51500-056 | |
| Liberase DH Research Grade | Sigma Aldrich | A4736401 | |
| Luna-II cell counter | Logos Biosystems | L40001 | |
| Matrigel | Sigma Aldrich | 354277 | |
| McCoy’s 5A Medium | ThermoFisher Scientific | 26600-023 | |
| Mouse anti-ITGB1 (integrin beta 1) | Santa Cruz | SC-53711 | Basolateral Polarity; Bryant et al 2014 (canine)21 |
| Mouse anti-KRT8 (cytokeratin 8) | Santa Cruz | SC-101459 | OSE Cells; Kopper et al 2019 (human)12 |
| Mouse anti-VIM (vimentin) | Abcam | AB0809 | Mesenchymal Cells; Abedini et al 2020 (mouse)19 |
| Mycozap Plus-CL | Lonza | V2A-2011 | |
| N-Acetyl-L-cysteine | Sigma Aldrich | A9165 | |
| Nicotinamide | Sigma Aldrich | N0636-100G | |
| OVITRELLE-Choriogonadotropin alfa (hCG) | Merk | G03GA08 | |
| Progesterone (P4) | Sigma Aldrich | P8783 | |
| Rabbit anti-ACTA2 (alpha smooth muscle actin) | Abcam | AB5694 | Mesenchymal Cells; Abedini et al 2020 (mouse)19 |
| Rabbit anti-CDH1 (E-cadherin) | Cell Signaling | CST 3195S | Epithelial Cells; Wong et al 1999 (human)25 |
| Rabbit anti-LGR5 | Abcam | AB75850 | OSE Progenitor Cells; Flesken-Nikitin et al 2013 (mouse)22 |
| Rabbit anti-YAP | Cell Signaling | 14074S | Proliferative OSE; Wang et al 2022 (mouse)24 |
| Rat anti-CD44 PE-conjugated | eBioscience | 12-0441-81 | OSE Progenitor Cells; Bowen et al 2009 (human)20 |
| Recombinant Human Heregulinβ-1 | Peprotech | 100-03 | |
| Recombinant Human Noggin | Peprotech | 120-10C | |
| Recombinant Human Wnt3a | R&D Systems | 5036-WN-010 | |
| Recombinant Rspondin-1 | Peprotech | 120-38 | |
| Red blood cells lysis buffer | eBiosciences | 00-4333-57 | |
| Revitacell Supplement (100x) | ThermoFisher Scientific | A26445-01 | |
| RNAse free DNAse | Qiagen | 79254 | |
| SB-431542 | Tocris Bioscience | 1624/10 | |
| Sheep anti-COL1A1 (pro-collagen 1 alpha 1) | R&D Systems | AF6220 | Mesenchymal Cells; Hosper et al 2013 (human)23 |
| Y-27632 | StemCell Technologies | 72304 | |
| β-Estradiol (E2) | Sigma-Aldrich | E8875 | |
| μ-Slide 18-well culture plate | Ibidi | 8181 | Sterile |
Riferimenti
- Ng, A., Barker, N. Ovary and fimbrial stem cells: biology, niche and cancer origins. Nat Rev Mol Cell Biol. 16 (10), 625-638 (2015).
- Auersperg, N., Wong, A. S., Choi, K. C., Kang, S. K., Leung, P. C. Ovarian surface epithelium: biology, endocrinology, and pathology. Endocr Rev. 22 (2), 255-288 (2001).
- Tan, O. L., Fleming, J. S. Proliferating cell nuclear antigen immunoreactivity in the ovarian surface epithelium of mice of varying ages and total lifetime ovulation number following ovulation. Biol Reprod. 71 (5), 1501-1507 (2004).
- Carter, L. E., et al. Transcriptional heterogeneity of stemness phenotypes in the ovarian epithelium. Commun Biol. 4 (1), 527 (2021).
- Chumduri, C., Turco, M. Y. Organoids of the female reproductive tract. J Mol Med (Berl). 99 (4), 531-553 (2021).
- Edmondson, R. J., Monaghan, J. M., Davies, B. R. The human ovarian surface epithelium is an androgen responsive tissue. Br J Cancer. 86 (6), 879-885 (2002).
- Karlan, B. Y., Jones, J., Greenwald, M., Lagasse, L. D. Steroid hormone effects on the proliferation of human ovarian surface epithelium in vitro. Am J Obstet Gynecol. 173 (1), 97-104 (1995).
- Nakamura, M., Katabuchi, H., Ohba, T., Fukumatsu, Y., Okamura, H. Isolation, growth and characteristics of human ovarian surface epithelium. Virchows Arch. 424 (1), 59-67 (1994).
- Horvath, P., et al. Screening out irrelevant cell-based models of disease. Nat Rev Drug Discov. 15 (11), 751-769 (2016).
- Del Valle, J. S., Chuva de Sousa Lopes, S. M. Bioengineered 3D ovarian models as paramount technology for female health management and reproduction. Bioengineering (Basel). 10 (7), 832 (2023).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Kopper, O., et al. An organoid platform for ovarian cancer captures intra- and interpatient heterogeneity. Nat Med. 25 (5), 838-849 (2019).
- Maenhoudt, N., et al. Developing organoids from ovarian cancer as experimental and preclinical models. Stem Cell Reports. 14 (4), 717-729 (2020).
- Senkowski, W., et al. A platform for efficient establishment and drug-response profiling of high-grade serous ovarian cancer organoids. Dev Cell. 58 (12), 1106-1121.e7 (2023).
- Lohmussaar, K., et al. Assessing the origin of high-grade serous ovarian cancer using CRISPR-modification of mouse organoids. Nat Commun. 11 (1), 2660 (2020).
- Zhang, S., et al. Both fallopian tube and ovarian surface epithelium are cells-of-origin for high-grade serous ovarian carcinoma. Nat Commun. 10 (1), 5367 (2019).
- Kessler, M., et al. The Notch and Wnt pathways regulate stemness and differentiation in human fallopian tube organoids. Nat Commun. 6, 8989 (2015).
- Kim, J., Koo, B. K., Knoblich, J. A. Human organoids: model systems for human biology and medicine. Nat Rev Mol Cell Biol. 21 (10), 571-584 (2020).
- Abedini, A., Sayed, C., Carter, L. E., Boerboom, D., Vanderhyden, B. C. Non-canonical WNT5a regulates Epithelial-to-Mesenchymal Transition in the mouse ovarian surface epithelium. Sci Rep. 10 (1), 9695 (2020).
- Bowen, N. J., et al. Gene expression profiling supports the hypothesis that human ovarian surface epithelia are multipotent and capable of serving as ovarian cancer-initiating cells. BMC Med Genomics. 2, 71 (2009).
- Bryant, D. M., et al. A molecular switch for the orientation of epithelial cell polarization. Dev Cell. 31 (2), 171-187 (2014).
- Flesken-Nikitin, A., et al. Ovarian surface epithelium at the junction area contains a cancer-prone stem cell niche. Nature. 495 (7440), 241-245 (2013).
- Hosper, N. A., et al. Epithelial-to-mesenchymal transition in fibrosis: collagen type I expression is highly upregulated after EMT, but does not contribute to collagen deposition. Exp Cell Res. 319 (19), 3000-3009 (2013).
- Wang, J., et al. Selective YAP activation in Procr cells is essential for ovarian stem/progenitor expansion and epithelium repair. Elife. 11, e75449 (2022).
- Wong, A. S., et al. Constitutive and conditional cadherin expression in cultured human ovarian surface epithelium: influence of family history of ovarian cancer. Int J Cancer. 81 (2), 180-188 (1999).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Shepherd, T. G., Theriault, B. L., Campbell, E. J., Nachtigal, M. W. Primary culture of ovarian surface epithelial cells and ascites-derived ovarian cancer cells from patients. Nat Protoc. 1 (6), 2643-2649 (2006).
- Xu, J., Lamouille, S., Derynck, R. TGF-beta-induced epithelial to mesenchymal transition. Cell Res. 19 (2), 156-172 (2009).
- Miettinen, P. J., Ebner, R., Lopez, A. R., Derynck, R. TGF-beta induced transdifferentiation of mammary epithelial cells to mesenchymal cells: involvement of type I receptors. J Cell Biol. 127 (6 Pt 2), 2021-2036 (1994).
- Danielpour, D., et al. Sandwich enzyme-linked immunosorbent assays (SELISAs) quantitate and distinguish two forms of transforming growth factor-beta (TGF-beta 1 and TGF-beta 2) in complex biological fluids. Growth Factors. 2 (1), 61-71 (1989).
- Oida, T., Weiner, H. L. Depletion of TGF-beta from fetal bovine serum. J Immunol Methods. 362 (1-2), 195-198 (2010).
- Halder, S. K., Beauchamp, R. D., Datta, P. K. A specific inhibitor of TGF-beta receptor kinase, SB-431542, as a potent antitumor agent for human cancers. Neoplasia. 7 (5), 509-521 (2005).
- Wang, J., Wang, D., Chu, K., Li, W., Zeng, Y. A. Procr-expressing progenitor cells are responsible for murine ovulatory rupture repair of ovarian surface epithelium. Nat Commun. 10 (1), 4966 (2019).
- Kawata, M., et al. Polarity switching of ovarian cancer cell clusters via SRC family kinase is involved in the peritoneal dissemination. Cancer Sci. 113 (10), 3437-3448 (2022).
- Davies, B. R., Worsley, S. D., Ponder, B. A. Expression of E-cadherin, alpha-catenin and beta-catenin in normal ovarian surface epithelium and epithelial ovarian cancers. Histopathology. 32 (1), 69-80 (1998).
- Skory, R. M., Xu, Y., Shea, L. D., Woodruff, T. K. Engineering the ovarian cycle using in vitro follicle culture. Hum Reprod. 30 (6), 1386-1395 (2015).
- Boretto, M., et al. Patient-derived organoids from endometrial disease capture clinical heterogeneity and are amenable to drug screening. Nat Cell Biol. 21 (8), 1041-1051 (2019).
- Phan, N., et al. A simple high-throughput approach identifies actionable drug sensitivities in patient-derived tumor organoids. Commun Biol. 2, 78 (2019).
- Ducie, J., et al. Molecular analysis of high-grade serous ovarian carcinoma with and without associated serous tubal intra-epithelial carcinoma. Nat Commun. 8 (1), 990 (2017).
- Lee, Y., et al. A candidate precursor to serous carcinoma that originates in the distal fallopian tube. J Pathol. 211 (1), 26-35 (2007).
- Rezanejad, H., Lock, J. H., Sullivan, B. A., Bonner-Weir, S. Generation of pancreatic ductal organoids and whole-mount immunostaining of intact organoids. Curr Protoc Cell Biol. 83 (1), e82 (2019).
- Asseler, J. D., et al. One-third of amenorrheic transmasculine people on testosterone ovulate. Cell Rep Med. 5 (3), 101440 (2024).
- Ikeda, K., et al. Excessive androgen exposure in female-to-male transsexual persons of reproductive age induces hyperplasia of the ovarian cortex and stroma but not polycystic ovary morphology. Hum Reprod. 28 (2), 453-461 (2013).
- De Roo, C., et al. Texture profile analysis reveals a stiffer ovarian cortex after testosterone therapy: a pilot study. J Assist Reprod Genet. 36 (9), 1837-1843 (2019).
- Grimstad, F. W., et al. Ovarian histopathology in transmasculine persons on testosterone: A multicenter case series. J Sex Med. 17 (9), 1807-1818 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon