Method Article
Basófilos Teste de ativação de Investigação de IgE-mediada Mecanismos Hipersensibilidade a Drogas
Neste Artigo
Resumo
Basófilos teste de ativação é uma potente ferramenta para a detecção de IgE-dependente alergias In vitro. Aqui, um protocolo otimizado para a ativação de basófilos teste é utilizado para investigar hipersensibilidade a drogas. Um método para a produção eficiente de drogas covalente de proteínas e seus conjugados de caracterização físico-química é descrito.
Resumo
Reações de hipersensibilidade contra os não-esteróides anti-inflamatórios não esteróides (AINE), como propyphenazone (PP) e diclofenaco (DF) pode se manifestar como Tipo I-como reações alérgicas 1. Na prática clínica, o diagnóstico de hipersensibilidade a drogas é realizado principalmente pelo histórico do paciente, como testes de pele não é de confiança e testes de provocação oral tem risco de vida riscos para o paciente 2. Daí, a evidência de uma pathomechanism IgE mediada subjacente é difícil de obter.
Aqui, apresentamos um método in vitro baseado no uso de basófilos humano, derivados de drogas pacientes hipersensíveis que imita a reação alérgica efetoras in vivo. Como basófilos de drogas pacientes alérgicos transportar moléculas de IgE específica para a droga culpado, eles se tornam ativados durante a IgE crosslinking receptor e liberar alérgica moléculas efetoras. A ativação de basófilos pode ser monitorado pela determinação da expressão de CD63 upregulation de superfície por citometria de fluxo 3.
No caso de drogas baixo peso molecular, conjugados são projetados para permitir IgE crosslinking receptor em basófilos. Como mostrado na Figura 1, dois representantes de AINEs, PP e DF, são covalentemente ligado à albumina sérica humana (HSA), através de um grupo carboxila reagem com o grupo primário amino de resíduos de lisina. DF transporta um grupo carboxila intrínseca e, portanto, pode ser usado diretamente 4, enquanto um grupo carboxila contendo derivados do PP teve de ser sintetizada organochemically antes do estudo 1.
O grau de acoplamento dos compostos de baixo peso molecular da molécula de proteína transportadora e sua distribuição espacial é importante para garantir crosslinking de duas moléculas de receptor IgE. O protocolo aqui descrito aplica-se cromatografia de exclusão de alto desempenho de tamanho (HPSEC) equipado com um índice de refração seqüencial (RI) e ultra-violeta (UV) sistema de detecção para a determinação do grau de acoplamento.
Como a metodologia descrita pode ser aplicada para outras drogas, o teste de activação de basófilos (BAT) tem o potencial para ser utilizado para a determinação de IgE mediada por mecanismos de hipersensibilidade a drogas. Aqui, nós determinamos como PP hipersensibilidade mediadas por IgE e hipersensibilidade DF como não-IgE mediada pela BAT.
Protocolo
1. Preparação de conjugados de medicamentos
- Dissolver 10 mg DF em 1 ml dH 2 O em um tubo de reação de 1,5 ml. No uso de prosseguir 95 mL desta solução DF. Conjugar PP para HSA dissolver 30,4 mg de derivados PP (304 g / mol) em 500 mL de hidróxido de sódio 0,3 M (NaOH).
- Adicionar 430,6 mL dH 2 O e 100 l 0,5 M 2 - (N-morfolino) etanosulfónico (MES) pH 6,5-95 mL de DF dissolvido. Adicionar 33,1 mL dH 2 O e 140 mL de 2 M MES pH 2,9 para a amostra PP.
- Adicionar 57,5 mL de uma recém-preparados N-etil-N '- (3-dimetilaminopropil) carbodiimida cloridrato de solução-mãe (EDC) dissolvido em dH 2 O com uma concentração de 100 mg / ml de amostra DF, ou 10 mL de solução EDC a amostra PP. Vortex as amostras para um minuto.
- Adicionar 16,9 ml de solução HSA com uma concentração de 118 mg / ml para cada amostra.
- Incubar as amostras por 2 horas em temperatura ambiente, agitando a 300 rounds / min.
- Diálise do DF e amostras de PP 3 vezes contra 2 litros de tampão fosfato-salina pH (PBS) 7,4 por várias horas cada. Executar todas as etapas diálise a 4 ° C.
- Centrifugar a amostra de 10 minutos a 14.000 xg e recolher o sobrenadante contendo DF ou PP conjugado com HSA.
- Verifique sobrenadante para as proteínas através da realização de um SDS-PAGE, utilizando géis de 12%. Carga de cerca de 12 microgramas de HSA conjugado em um slot de gel.
2. Determinar a taxa de acoplamento de conjugados de medicamentos (Figura 2)
- Para a análise da taxa de acoplamento do DF e conjugados PP por HPSEC usar um de sódio 100 mM de tampão fosfato pH 6,5 contendo NaCl 150 mM e azida sódica 0,05%. Use um x 7.8 300 milímetros TSK-Gel-G2000 coluna SWXL.
- Realizar a detecção de sinais usando um RI-online acoplada e um sistema de detector UV.
- Preparar uma amostra HSA padrão com uma concentração de 1 mg / ml em dH 2 O. Para a calibração de detector injetar 50 ul HSA solução padrão.
- Calcular o RI RI k constante ea UV UV k constante para o detector. Use a área de RI fórmulas = RI k * [(dn / dc) HSA * c (HSA)] e área de UV UV = k * [(dA / dc) HSA * c (HSA)] com (dn / dc) HSA = 0,185 e (dA / dc) HSA = 0,518 5.
- Prepare DF e padrões PP derivados para HPSEC que 5, 10 e 30 nmol quantidades de ambos os padrões podem ser facilmente injetado.
- Calcule os valores médios de (dn / dc) de drogas e (dA / dc) de drogas para ambos os padrões. Para DF, a (dn / dc) de 0,235 ± 0,010 e um (dA / dc) de 39,000 ± 0,493 foi determinado. Para PP, a (dn / dc) de 0,328 ± 0,016 e um de (dA / dc) 53,155 ± 2,464 foi determinado.
- Injetar conjugados de medicamentos em HPSEC e determinar o seu RI e UV áreas dos picos.
- Calcular a concentração de DF, derivado PP, e HSA, resolvendo as duas equações área RI RI = k * [(dn / dc) de drogas * c (droga) + (dn / dc) HSA * c (HSA)] UV área e = k UV * [(dA / dc) de drogas * c (droga) + (dA / dc) HSA * c (HSA)] para as incógnitas.
3. BAT usando conjugados de medicamentos
- Prepare sete taças citometria de fluxo e rotulá-las dependendo do seu conteúdo: controle sem manchas, controle negativo, controle positivo, e conjugados de drogas.
- Pipetar 50 ul de B-CCR-STB buffer de estimulação (Flow2 CAST, Bühlmann Laboratories, Schönenbuch, CH) nos frascos reservados para o controle imaculada e negativos. Como controle positivo, use 50 ul de uma solução anti-FcεRI fornecido pelo kit CAST Flow2. Adicionar as quantidades apropriadas de solução do conjugado aos frascos reservado para a conjugados de medicamentos através da criação de uma série diluição de 1:10 de 0,02 -20 mg / ml DF conjugado e PP conjugada (concentração final no ensaio de um volume de 200 mL). Estes experimentos de titulação deve ser realizada para determinar a concentração de activação de basófilos ideal para cada amostra.
- Adicionar 100 mL de buffer estimulação a cada tubo e sangue de 50 mL de EDTA paciente todo. Misture as amostras com cuidado.
- Pipetar 20 l Flow2 reagente coloração CAST contendo anticorpos anti-CCR3 marcado com ficoeritrina (PE) e anticorpos anti-CD63 marcado com isotiocianato de fluoresceína (FITC) a cada tubo e misture novamente. Não pipetar reagentes coloração na amostra imaculada!
- Incubar as amostras por 45 minutos em banho-maria a 37 ° C.
- Reação de parada no gelo por 5 minutos.
- Lisar eritrócitos pela adição de 2,0 ml de reagente de lise CAST Flow2 a cada frasco e vortex suavemente. Incubar as amostras no escuro por 10 minutos em temperatura ambiente.
- Centrifugar amostras por 5 minutos a 500 xg eo sobrenadante cuidadosamente decantar.
- Ressuspender as células em 500 mL de tampão de lavagem Flow2 CAST e armazenar em gelo até citometria de fluxo.
- S Ajuste o citômetro de fluxo de tensãoettings para dispersão de frente e de lado (FSC, SSC), enquanto a aquisição da amostra imaculada.
- Porta das células como linfócitos previsto da parcela SSC-FSC para a trama SSC-PE. Basófilos são identificados por um PE-anticorpo marcado anti-CCR3 como CCR3 oi SSC lo e porta-los para o enredo FITC-PE. O anticorpo anti-CD63 detectar basófilos ativados é marcado com FITC.
- Definir o corte de no máximo 2,5% de basófilos CD63 como oi no controle negativo. Uma amostra é considerada positiva para a ativação de basófilos se> 5% são basófilos CD63 oi eo índice médio de fluorescência (IMF) da amostra dividido pelo MFI do controle negativo superior a 2 (Figura 3).
4. Resultados representativos:
Este experimento avalia BAT como uma ferramenta útil para detectar IgE-dependente hipersensibilidade a drogas. Conjugados de proteína de AINEs são usados para a ativação de basófilos. Por HPSEC com RI e do estado de agregação de detecção UV, o grau de acoplamento, e de rendimento efetivo dos conjugados são determinados. A Figura 4 mostra como, 43,5% dos conjugados DF permaneceu monomérica com um grau de acoplamento de 5,0 DF / HSA. Para os agregados um grau de acoplamento de 9,5 foi determinado. O conjugado propyphenazone mostrou consistem em monômeros 68,5% com um grau de acoplamento de 21,2. O grau de acoplamento dos agregados foi de 27,9. No total, o grau de acoplamento determinada de conjugados DF foi de 7,6 DF e que de conjugados de PP foi de 23,2.
BAT realizada com conjugados em condições otimizadas (concentração de conjugados, tempo de estimulação) permitiu a investigação da IgE-dependente reações de hipersensibilidade em AINE. Conforme mostrado na Figura 5, apenas o conjugado PP foi capaz de desencadear a activação de basófilos visualizado por uma upregulation na expressão de CD63 de superfície: 20,6% de basófilos foram ativados caracterizada por uma mudança de log-in intensidade de fluorescência. A IFM aumentou por um fator de 4,9 de 386 (controle negativo) para 1893. Em contraste, usando o conjugado DF apenas 3,1% dos basófilos foram ativadas que estava abaixo dos 5% de corte. Além disso, o IFM aumentou apenas por um fator 1,1 (limite de 2.0) a partir de 197 (controle negativo) para 210. Validade do ensaio é dado por (i) 50% basófilos ativados (controle positivo).
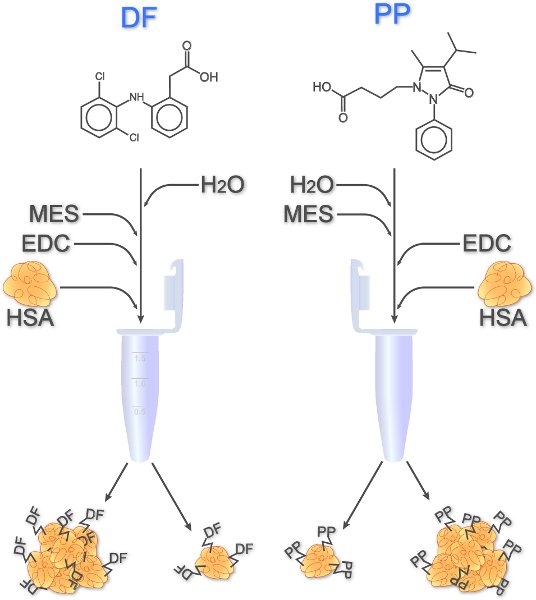
Figura 1. Acoplamento de derivados DF e PP para HSA. Depois de dissolver a droga, a água, MES buffer, e EDC (reagente de acoplamento) são adicionados. As amostras são agitadas durante 1 minuto antes HSA é pipetado para as soluções de drogas. Dentro de duas horas agitando à temperatura ambiente as drogas covalentemente se ligam a HSA. Monômeros, bem como agregados podem resultar.

Figura 2. Cálculo de graus de acoplamento. Em primeiro lugar, as constantes k RI e UV k são determinados. Portanto, HSA padrão com concentração conhecida é injetada no sistema HPSEC. (Dn / dc) e (dA / dc) de HSA são dados os valores de 0,185 e 0,518, respectivamente 5. As áreas dos picos são usados para calcular as constantes. Segundo, para cada três padrões de drogas são injetadas para determinar droga e da concentração específicos e áreas de RI UV. Uma vez que o RI k e constantes UV k são conhecidos a partir das etapas acima, os derivados de drogas específicas (dn / dc) e (dA / dc) pode ser calculado. Terceiro, drogas HSA conjugados são injetadas em HPSEC. As áreas dos picos resultantes são usados para calcular as concentrações de drogas e por HSA de pico, resolvendo as duas equações com duas variáveis desconhecidas.
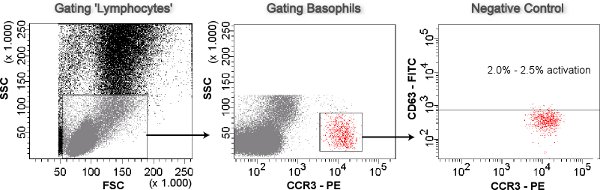
Figura 3. Gating Basófilo. Células previsto como linfócitos são dispersão lado gated relação ao dispersor de frente (SSC-enredo FSC). Os basófilos são identificados como CCR3 oi SSC lo a partir dos linfócitos gated (SSC-CCR3-PE enredo). Basófilos são analisados para ativação (CD63 oi) na parcela CD63-FITC-CCR3-PE. O controle negativo é usado para definir o corte de no máximo 2,5% restantes basófilos CD63 oi.
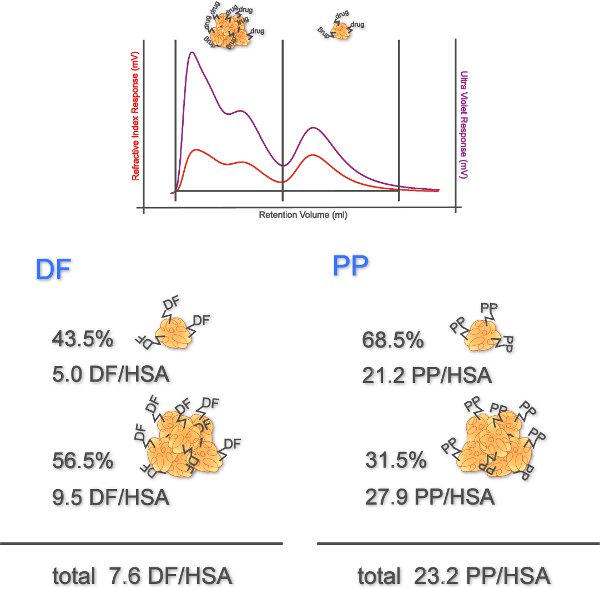
Figura 4. Graus de acoplamento Determinado de conjugados de medicamentos. RI e os sinais UV mostram dois picos representando agregados (eluição com um volume de retenção baixa) e monômeros (eluição com um volume de retenção de altura) de drogas HSA conjugados. Percentagens de monômeros e agregados (determinado a partir de sinais de RI) e seus graus de acoplamento são retratados (n = 1).
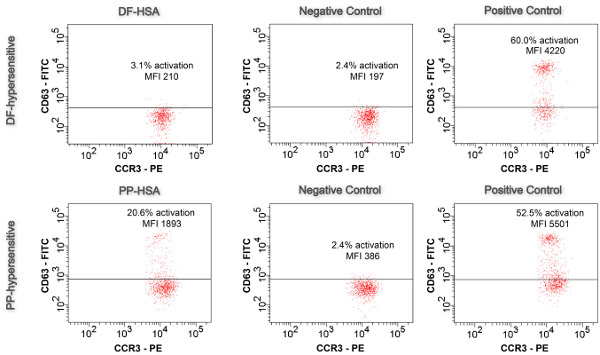
Figura 5. Basófilo Activatiem teste. Resultados da droga conjugada ativado amostras, controles negativos e controles positivos são mostrados na CD63-FITC-CCR3-PE parcelas (n = 1).
Discussão
BAT é um bem estabelecida, embora ainda não utilizado rotineiramente método para diagnóstico de IgE mediada doença alérgica 6,7. Para hipersensibilidade a drogas, no entanto, sua aplicabilidade é comprometida, como compostos de baixo peso molecular não são capazes de receptores IgE crosslink, um pré-requisito para a ativação de basófilos 8. Portanto, as drogas sob investigação precisam ser covalentemente acoplado a proteínas de transporte adequado (por exemplo HSA). Importante, o grau de acoplamento (ie número de moléculas de droga por proteína transportadora) precisa ser controlada para garantir a atividade imunológica (ie receptor IgE cross-linking) de conjugados. Teoricamente, dois haptenos por molécula transportadora deve ser suficiente para o receptor de IgE de ligação cruzada e apenas cinco moléculas DF por HSA foram mostrados para desencadear a liberação de mediador em um ensaio baseado em células 4. Ambos os conjugados, PP-HSA e DF-HSA, foram determinados para mostrar um grau suficientemente elevado de acoplamento (HPSEC) e ser imunologicamente ativas tornando-os reagentes adequados para uso em BAT. Outro problema pode ser que os metabolitos de drogas pode ter um papel, como um metabólito em vez do fármaco pode causar a reação de hipersensibilidade. No caso do DF, essa possibilidade tem sido avaliada em detalhes anteriormente usando cinco principais Fase I metabólitos e uma variante de ligação 4. Fatores importantes para dominar a técnica descrita incluem a qualidade da amostra de sangue (<12 horas desde a coleta de sangue, número de basófilos detectado> 500) e otimização das condições de estimulação (dose, tempo). Além disso, os chamados não-respondedores, que nem sequer reagem com o controle positivo (anticorpos dirigidos contra o receptor IgE) têm de ser identificados. Portanto, critérios de validação tem que incluir um anticorpo anti-FcεRI como controle positivo. Uma vantagem importante do uso de conjugados de medicamentos é o fato de que eles parecem não tóxicos, em contraste com as drogas pura, como mostra a DF-HSA conjugado por co-estimulação com anticorpo anti-FcεRI na BAT 4. Pure DF, em contraste, exibe efeitos citotóxicos em uma concentração de 1,25 mg / ml causando problemas com a interpretabilidade da BAT 9. Geralmente, testes para citotoxicidade potencial é fortemente recomendado para cada conjugado droga recém-produzidos.
Aqui, nós mostramos o potencial do PP-HSA conjugado usado em BAT para revelar hipersensibilidade mediadas por IgE. Em contraste, DF hipersensibilidade não está associada com IgE demonstrado pela falta de ativação de basófilos em resposta a DF-HSA conjugado. Importante, em caso de incerteza sobre um mecanismo IgE mediada, conjugados têm de ser avaliados para a atividade imunológica por ensaio in vitro em sistemas baseados em células como tem sido demonstrado por DF 4.
Usando a configuração descrita de conjugar baixo peso molecular drogas covalentemente a proteína transportadora adequada moléculas uma série de reações de hipersensibilidade à droga, incluindo antibióticos, outros AINEs, radiocontrast mídia, relaxantes musculares, anestésicos, etc pode ser investigado por um envolvimento de uma mediada por IgE mecanismo. Assim, BAT pode servir como um complemento para os métodos existentes para o diagnóstico (teste cutâneo, o teste de provocação oral).
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado pelo Fundo de Ciência Austríaco (FWF) conceder P18820-B13.
Declaração de ética:
O estudo foi aprovado (PLUS_Ethik_090514) pelo Comitê de Ética de experimentos envolvendo seres humanos e / ou Animais da Universidade de Salzburg cumprimento das Declaraction de Helsínquia revista em 1983 e todos os pacientes participantes deram seu consentimento informado.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente / dispositivo | Companhia | Número de catálogo | Comentários |
|---|---|---|---|
| 2 - (N-Morfolino) etanosulfónico | Sigma | M3671 | - |
| 7,8 x 300 mm TSK Gel -G2000SWXL coluna | Tosoh Bioscience | 08540 | - |
| BD FACSCanto II | Becton Dickinson | 338962 | - |
| Centrífuga de bancada | Sigma | - | - |
| Diclofenaco de sódio | Sigma | D6899 | - |
| EDTA-Vacutainer | Becton Dickinson | 368589 | - |
| Flow2 Kit CAST | Bühlmann Laboratories | FK-CCR | Kit CAST eficazes 14 de junho de 2011 Flow2 agora é CAST Fluxo |
| HP1100 sistema HPLC | Hewlett Packard | - | - |
| Albumina de soro humano | Sigma | A9511 | - |
| Centrifugadora de laboratório | Eppendorf | - | - |
| N-etil-N'-(3-dimetilaminopropil) cloridrato de carbodiimida (EDC) | Sigma | E6383 | - |
| Comprimidos PBS | AppliChem | A9199 | - |
| Derivados Propyphenazone | Departamento de Biologia Molecular, Universidade de Salzburg, Áustria | - | - |
| Sacudidor | Eppendorf | - | - |
| Azida de sódio | Sigma | S8032 | - |
| Cloreto de sódio (NaCl) | Sigma | S1679 | - |
| Bicarbonato de sódio | Sigma | 90421C | - |
| Hidróxido de sódio | Sigma | S5881 | - |
| Fosfato de sódio | Sigma | 342483 | - |
| Conjunto detector triplo | Viscotek | TDA302 | - |
| BioVortex pessoal V-1 mais | Peqlab | 90-V-1 | - |
| Banho-maria 1012 | GFL | 1012 | - |
Referências
- Himly, M. IgE-mediated immediate-type hypersensitivity to the pyrazolone drug propyphenazone. J Allergy Clin Immunol. 111, 882-888 (2003).
- Demoly, P., Pichler, W., Pirmohamed, M., Romano, A. Important questions in Allergy: 1--drug allergy/hypersensitivity. Allergy. 63, 616-619 (2008).
- Ebo, D. G., Hagendorens, M. M., Bridts, C. H., Schuerwegh, A. J., Clerck, L. S., Stevens, W. J. Flow cytometric analysis of in vitro activated basophils, specific IgE and skin tests in the diagnosis of pollen-associated food allergy. Cytometry Part B (Clinical Cytometry). 64B, (2005).
- Harrer, A. Diclofenac hypersensitivity: antibody responses to the parent drug and relevant metabolites. PLoS One. 5, e13707-e13707 (2010).
- Wen, J., Arakawa, T., Philo, J. S. Size-exclusion chromatography with on-line light-scattering, absorbance, and refractive index detectors for studying proteins and their interactions. Anal Biochem. 240, 155-166 (1996).
- De Weck, A. L., Sanz, M. L., Gamboa, P. M., Aberer, W., Bienvenu, J., Blanca, M., Demoly, P., Ebo, D. G., Mayorga, L., Monneret, G., Sainte Laudy, J. Diagnostic tests based on human basophils: more potentials and perspectives than pitfalls. II. Technical issues. J Investig Allergol Clin Immunol. 18, 143-155 (2008).
- Ebo, D. G. Flow-assisted allergy diagnosis: current applications and future perspectives. Allergy. 61, 1028-1039 (2006).
- Poulsen, L. K., Quan, S., Kragh, C., Platzer, M. H., Skov, P. S. The basophil granulocyte in allergic reactions: experimental models and their use for the identification of drugs with effects or side effects on basophils. Curr Med Chem - Anti-inflammatory & Anti-Allergy Agents. 3, 167-180 (2004).
- Sanz, M. L., Gamboa, P., de Weck, A. L. A new combined test with flowcytometric basophil activation and determination of sulfidoleukotrienes is useful for in vitro diagnosis of hypersensitivity to aspirin and other nonsteroidal anti-inflammatory drugs. Int Arch Allergy Immunol. 136, 58-72 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados