É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Ensaio clínico randomizado e controlado para estudar os efeitos agudos do exercício de força sobre a sensibilidade à insulina em adultos obesos
Neste Artigo
Resumo
Este estudo descreve um protocolo de ensaio clínico randomizado e controlado com o objetivo de avaliar os efeitos agudos do volume de exercício de força sobre a sensibilidade à insulina em indivíduos obesos.
Resumo
Uma sessão aguda de exercício de força (EE) melhora a sensibilidade à insulina (EI) por várias horas; no entanto, os efeitos do volume de SE (i.e., número de séries) não foram estudados completamente. Embora seja intuitivo que alguns AE são melhores do que nenhum, e mais é melhor do que alguns para a melhora do EI, sessões de alto volume podem ser desafiadoras para populações doentes, especialmente adultos obesos, para os quais até mesmo uma caminhada rápida pode ser desafiadora. Este protocolo detalha um ensaio clínico randomizado para avaliar os efeitos agudos da EEF sobre a EI em adultos obesos. Os critérios de inclusão foram índice de massa corporal >30 kg/m2, obesidade central (circunferência da cintura >88 cm e >102 cm para mulheres e homens, respectivamente) e idade >40 anos. Os participantes serão familiarizados com o AE (7 exercícios direcionados aos principais grupos musculares) e, em seguida, realizarão três sessões em ordem aleatória: sessão 1 - sessão de alto volume (3 séries/exercício); sessão 2 - sessão de baixo volume (1 série/exercício); Sessão 3 - Sessão Controle (sem exercício). A dieta será controlada no dia anterior e no dia das sessões. As sessões serão concluídas à noite, e um teste oral de tolerância à glicose será realizado na manhã seguinte, do qual vários índices de SI serão derivados, como a área sob a curva (AUC) de glicose e insulina, o índice de Matsuda, o índice de Cederholm, o índice de SI muscular e o índice de Gutt. Com base em estudos piloto, esperamos ~15% de melhora no SI (AUC da insulina e índices de Matsuda e Cederholm) após a sessão de alto volume e ~8% de melhora após a sessão de baixo volume em comparação com a sessão de controle. Este estudo beneficiará indivíduos que acham as sessões de AE de alto volume desafiadoras, mas ainda assim visam melhorar seu SI investindo 1/3 de seu tempo e esforço.
Introdução
Embora os efeitos crônicos do treinamento de força sobre a sensibilidade à insulina tenham sido repetidamente demonstrados 1,2,3, mesmo uma sessão aguda de exercício de força pode melhorar a ação da insulina por até 48 h4. Esse efeito tem sido demonstrado em indivíduos saudáveis5,6,7,8, obesos9, idosos 10, resistentes à insulina 4 e diabéticos tipo 2 11. Outros não relataram efeitos positivos 12,13,14,15,16,17, e não está claro por que essas diferenças ocorrem.
Em recente revisão narrativa18, foi sugerido que o volume do exercício de força (número de séries por exercício) é essencial para melhorar a sensibilidade à insulina. Por exemplo, uma recente revisão sistemática e metanálise demonstrou que sessões compostas por 21 séries ou mais levaram a uma maior melhora na ação da insulina em comparação com sessões com menos de 21 séries19. No entanto, apenas evidências limitadas da literatura apoiam diretamente essa noção. Por exemplo, maior volume de exercício de força (30 séries) melhorou mais o metabolismo glicídico do que menor volume (10 séries)20. Mas vale ressaltar que este estudo implementou exercícios de força no estilo circuito, o que limita a comparação com exercícios de força tradicionais. Em outro estudo, foi observada melhor sensibilidade à insulina após um protocolo de exercício de força de 32 séries em comparação com um protocolo de 8 séries21. No entanto, o grau de esforço após as séries não foi relatado, e presumivelmente foi maior após o protocolo de alto volume. Isso é importante porque o grau de esforço (ou proximidade de falência muscular concêntrica, caracterizada como a incapacidade de continuar a série devido à falha no movimento concêntrico de uma dada repetição) também tem sido considerado uma variável importante para melhorar o metabolismo da insulina e da glicose18. Assim, os limitados estudos disponíveis sobre o tema, juntamente com suas limitações metodológicas, impossibilitam maiores inferências sobre os efeitos do volume de exercício de força sobre a sensibilidade à insulina.
Outro ponto interessante quando se discute o volume do exercício de força é que ele está intrinsecamente ligado ao comprometimento do tempo. Um menor volume de exercícios, por design, significa menos tempo gasto na academia. Entre os motivos para não aderir a um programa de exercícios, a falta de tempo está no topo da lista22. Assim, uma sessão de exercício de força de baixo volume que efetivamente melhora a sensibilidade à insulina significa menor comprometimento de tempo23 e pode resultar em maior adesão a longo prazo. Além disso, sentimentos subjetivos, como a autoeficácia (autopercepção da capacidade de realizar algo) e as sensações de prazer e diversão (prazer), também estão relacionados à adesão ao exercício24,25,26. É razoável especular que as pessoas podem se sentir mais confiantes e desfrutar mais de sua experiência de exercício quando realizam uma sessão de exercícios de força de baixo volume que se traduz em melhora da saúde.
Para suprir as lacunas na literatura resumidas acima, descrevemos um protocolo para um ensaio clínico randomizado, controlado, cruzado, com o objetivo primário de avaliar os efeitos do volume de exercício de força sobre a sensibilidade à insulina em indivíduos obesos. Como objetivo secundário, avaliamos os efeitos do volume do exercício de força sobre sentimentos subjetivos (autoeficácia, afeto e prazer).
O protocolo descreve um ensaio clínico randomizado, controlado, de 3 vias, cruzado. A sequência cronológica do protocolo inclui: avaliação pré-participação do histórico de saúde e das medidas antropométricas (massa corporal, estatura, circunferência da cintura e composição corporal); consulta com nutricionista certificada da equipe; um período de familiarização com os exercícios de força e questionários de sentimentos subjetivos; avaliação da força em cada exercício; alocação aleatória da ordem das sessões; realização das 3 sessões (separadas por 7-28 dias), que é imediatamente seguida pela resposta aos questionários de sentimentos subjetivos; teste oral de tolerância à glicose (TOTG) na manhã seguinte; e análise dos dados. A Figura 1 delineia o desenho do protocolo.
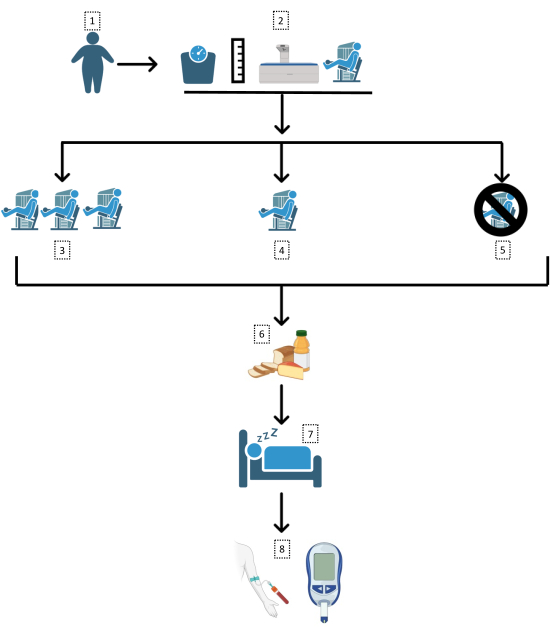
Figura 1: Desenho do estudo. Seguiu-se aqui um fluxograma da metodologia do ensaio. 1: Obesos (índice de massa corporal [IMC] >30 kg/m2; circunferência da cintura >102/88 cm); 2: Avaliação antropométrica e familiarização; alocação aleatória para 3: sessão de exercício de força de alto volume (21 séries), 4: sessão de exercício de força de baixo volume (7 séries) ou 5: dia de controle; 6: refeição padrão após as sessões; 7: sono e jejum noturno; 8: teste oral de tolerância à glicose. Clique aqui para ver uma versão maior desta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Obter autorização ética para o estudo submetendo o protocolo do estudo e o documento de consentimento informado ao Comitê de Ética em Pesquisa (CEP) local ou ao Comitê de Ética em Pesquisa (CEP) local. O estudo só pode começar após a aprovação do CEP ou CEP. Os resultados apresentados a seguir são provenientes de um estudo piloto, para o qual os sujeitos assinaram um termo de consentimento livre e esclarecido antes da inscrição. Após a aprovação do CEP ou CEP, registre prospectivamente o protocolo em um repositório público, como o Clinical Trials (https://clinicaltrials.gov). Se o seu país tem um repositório nacional, registre o protocolo lá (por exemplo, no Brasil, existe o Brazilian Clinical Trials (https://ensaiosclinicos.gov.br). O presente estudo foi aprovado pelo IRB local (certificado número CAAE 63190422.0.0000.5108) e foi prospectivamente registrado em um registro de ensaios clínicos (ReBEC #RBR-3vj5dc5 https://ensaiosclinicos.gov.br/rg/RBR-3vj5dc5).
1. Seleção e preparação dos voluntários
- Calcular o tamanho da amostra necessária para os ensaios
- Selecionar sujeitos que: são obesos (índice de massa corporal >30 kg/m2); ter obesidade central (circunferência da cintura > 102/88 cm em homens/mulheres); têm idade >40 anos; são capazes de realizar exercícios de força.
- Excluir indivíduos que: apresentem sinais, sintomas ou presença de diabetes ou qualquer outra doença metabólica, doença cardiovascular, doença cerebrovascular, doença renal, doença respiratória e doença osteoarticular27; referir uso de qualquer medicamento que possa influenciar nos resultados esperados (inclusive anticoncepcionais orais28); relato de uso de esteroides anabolizantes; estejam grávidas ou pretendam engravidar no decorrer do estudo; Descrever a ingestão de suplementos alimentares conhecidos por afetar o desempenho ao exercício, como cafeína, beta-alanina, creatina e bicarbonato de sódio29.
- Obtenha a assinatura do participante no termo de consentimento livre e esclarecido e guarde-a em um armário privado.
2. Medir a composição corporal do participante
- Para este estudo, avaliar-se a composição corporal por meio da absorciometria de raios-X de dupla energia, seguindo as instruções do fabricante para análise de massa gorda, massa livre de gordura. No entanto, qualquer outro método estabelecido (i.e., Bod Pod, sob pesagem de água, dobra cutânea) pode ser usado.
3. Controle dietético
- Agende uma consulta com o nutricionista certificado da equipe de pesquisa para instruir os participantes sobre como registrar sua dieta de 3 dias (2 dias da semana, 1 fim de semana).
- Desenvolver um plano alimentar com o nutricionista baseado nas necessidades energéticas dos participantes e na ingestão alimentar, para garantir uma dieta isocalórica no dia anterior e no dia das sessões30.
4. Familiarização
- Peça aos participantes que realizem 5 sessões de familiarização, separadas por pelo menos 2 dias.
- Sessão de familiarização 1
- Instruir o participante sobre a forma de levantamento: amplitude de movimento, duração das fases concêntrica e excêntrica (~3 s de duração total da repetição) em cada um dos 7 exercícios de força (1 - agachamento em barra hexadecimal; 2 - supino reto; 3 - leg press; 4 - puxada de lata; 5 - extensão de pernas; 6 - shoulder press; 7 - rosca direta).
- Instruir o participante sobre como classificar seu esforço com base na escala OMNI-RES30.
- Peça ao participante que realize um aquecimento de 5 min caminhando em uma esteira a ~3-4 km/h.
- Peça ao participante que realize 3 séries de 8 repetições em cada um dos 7 exercícios que considere fáceis ou entre os níveis 3 e 4 de acordo com a escala OMNI-RES.
- Permitir recuperação de 90 a 120 s entre séries e exercícios.
- Sessão de familiarização 2
- Instruir o participante sobre como responder à escala de afeto31,32, à escala de prazer na atividade física (PACES)32,33 e à escala de autoeficácia 34.
- Peça ao participante que responda à escala de afeto antes da sessão de familiarização.
- Peça ao participante que realize um aquecimento de 5 min caminhando em uma esteira a 3-4 km/h.
- Peça ao participante que realize 3 séries de 8 repetições em cada um dos 7 exercícios, que considere duros ou entre os níveis 5 e 7 de acordo com a escala OMNI-RES.
- Permitir recuperação de 90 a 120 s entre séries e exercícios.
- Peça ao participante que responda à escala de afeto, ao PACES e à escala de autoeficácia após a sessão de familiarização.
- Sessão de familiarização 3
- Peça ao participante que responda à escala de afeto antes da sessão de familiarização.
- Peça ao participante que realize um aquecimento de 5 min caminhando em uma esteira a ~3-4 km/h.
- Peça ao participante que realize 3 séries de 8 repetições em cada um dos 7 exercícios, que considere duros, ou entre os níveis 7 e 9 de acordo com a escala OMNI-RES.
- Permitir recuperação de 90 a 120 s entre séries e exercícios.
- Peça ao participante que responda à escala de afeto, ao PACES e à escala de autoeficácia após a sessão de familiarização.
- Sessão de familiarização 4
- Peça ao participante que responda à escala de afeto antes da sessão de familiarização.
- Peça ao participante que realize um aquecimento de 5 min caminhando em uma esteira a 3-4 km/h.
- Peça ao participante que realize 3 séries de 8 repetições em cada um dos 7 exercícios, que considere duros e extremamente duros ou entre os níveis 9 e 10 de acordo com a escala OMNI-RES.
- Permitir recuperação de 90 a 120 s entre séries e exercícios.
- Peça ao participante que responda à escala de afeto, ao PACES e à escala de autoeficácia após a sessão de familiarização.
- Sessão de familiarização 5
- Peça aos participantes que imitem os testes de força (veja detalhes na etapa 5). O intervalo entre as sessões de familiarização pode ser de até 7 dias e pode ser agendado com base na presença de dor muscular de início tardio.
NOTA: Esta última sessão de familiarização destina-se a familiarizar o participante com os testes de força. Neste estudo, é de extrema importância um período de familiarização minucioso 1) para garantir que o participante possa realizar as séries com falha concêntrica ou muito próximadela18 e 2) para evitar o efeito negativo do dano muscular sobre a sensibilidade à insulina35,36,37.
- Peça aos participantes que imitem os testes de força (veja detalhes na etapa 5). O intervalo entre as sessões de familiarização pode ser de até 7 dias e pode ser agendado com base na presença de dor muscular de início tardio.
- Sessão de familiarização 1
5. Testes de força (máximo de 8 repetições)
- Realizar os testes de força (8 repetições máximas [RM]) em cada um dos 7 exercícios por um total de pelo menos 72 h (mas não mais de 7 dias) após a última sessão de familiarização.
- Peça ao participante que realize um aquecimento por 5 min caminhando em uma esteira a 3-4 km/h.
- Peça ao participante que realize 1 série com baixa carga (12 repetições, 40%-50% de RM, escala OMNI 3-4) antes de cada exercício.
- Ajustar o peso à carga prevista na qual o participante será capaz de realizar 8, mas não 9, repetições com boa forma. Registre essa carga.
- Se o participante for incapaz de realizar 8 repetições devido à perda de boa forma, à falha muscular concêntrica, ou se o participante parar a série voluntariamente devido à fadiga, reduza a carga em 5-10%, deixe-os descansar por 3-5 min e faça outra tentativa.
- Se o participante for capaz de realizar 9 repetições, aumente a carga em 5-10%, deixe-o descansar por 3-5 min e faça outra tentativa.
- Repita os passos 5.1.4 e 5.1.5 até que o participante seja capaz de realizar 8 mas não 9 repetições e registrar a carga.
NOTA: Para evitar a variabilidade entre avaliadores, o mesmo membro da equipe de pesquisa deve realizar testes de força com todos os participantes. - Realizar os testes na mesma ordem dos exercícios descritos acima 1 - agachamento em barra hexadecimal; 2 - supino; 3 - leg press; 4 - puxada lat; 5 - extensão de perna; 6 - ombreira; 7 - rosca direta, permitindo pelo menos 3 min entre os exercícios.
OBS: Baseie a carga prevista no desempenho da quinta sessão de familiarização, quando os testes de força serão mimetizados. Para evitar fadiga excessiva, o ideal é encontrar a carga de 8 RM na primeira tentativa de cada exercício, mas 2 tentativas são aceitáveis.
6. Alocação aleatória de sessões
- Imprima sequências aleatórias com os números 1, 2 e 3 que representam alto, baixo volume e controle, respectivamente, e insira cada uma dentro de envelope opaco e numerado sequencialmente e lacre os envelopes.
- Abra os envelopes para revelar a ordem da sessão após os testes de força.
OBS: A etapa 6.1 deve ser realizada por um colaborador de pesquisa não envolvido diretamente na coleta de dados, ou responsável pela abertura dos envelopes.
7. Coleta de dados às cegas
- Instruir o participante a não divulgar qual sessão realizou na noite anterior aos funcionários do laboratório clínico onde será realizado o TOTG.
- Peça a um colaborador de pesquisa, não envolvido diretamente na coleta e análise dos dados, que faça dupla digitação dos dados do TOTG em planilhas separadas, utilizando códigos para ocultar a identidade do participante e a sessão realizada.
OBS: Devido às características inerentes ao desenho deste estudo (exercício), não é possível cegar tanto o participante quanto o terapeuta.
8. Sessões de exercícios
- Sessão 1 - alto volume
- Instrua o participante a não se envolver em exercícios de intensidade moderada a alta por pelo menos 2 dias antes da sessão.
- Instruir o participante a seguir a dieta prescrita pela nutricionista no dia anterior e no dia da sessão. A última refeição é às 18h30
- Instrua o participante a comparecer à academia às 19h30.
- Peça ao participante que responda à escala de afeto antes da sessão de exercícios, às 19h55.
- Peça ao participante que realize um aquecimento por 5 min caminhando em uma esteira a 3-4 km/h.
- Peça ao participante que realize 3 séries com o máximo de repetições que puder (até a falência muscular concêntrica ou até que o participante pare a série voluntariamente) em cada um dos 7 exercícios com a carga do teste de 8 RM e registre o número de repetições em cada série.
- Peça ao participante que classifique seu esforço com base na escala OMNI-RES após cada conjunto e registro. Permitir 120 s de recuperação entre séries e exercícios.
- Peça ao participante que responda à escala de afeto, ao PACES e à escala de autoeficácia após o término da sessão.
- Peça ao participante que ingira a refeição pós-sessão entre 21:00 e 21:30 e instrua o participante a não ingerir mais nada (exceto água) até a manhã seguinte, quando o TOTG será realizado, e enviá-lo para casa.
- Sessão 2 - baixo volume
- Repita as etapas 8.1.1 a 8.1.3. Peça aos participantes que respondam à escala de afeto às 20h35. Repita a etapa 8.1.5.
- Peça ao participante que realize 1 série com o máximo de repetições possível (até a falência muscular concêntrica ou até que o participante pare a série voluntariamente) em cada um dos 7 exercícios com a carga do teste de 8 RM e registre o número de repetições em cada série.
- Repita as etapas 8.1.7 a 8.1.9
- Sessão 3 - dia de controle
- Repetir os procedimentos dos pontos 8.1.1 a 8.1.4.
- Posicionar o participante em cada exercício/equipamento por 30 s (mimetizando o período da série ativa), mas instruí-lo a não realizar nenhuma contração muscular (ou simplesmente permanecer imóvel no exercício/equipamento).
- Repita o passo 8.3.2 para 3 séries falsas para todos os 7 exercícios (imitando a sessão 1, mas sem qualquer contração muscular).
- Repita as etapas 8.1.7 a 8.1.9
9. TOTG e análise dos dados
- Instrua os participantes a se apresentarem ao laboratório entre 7:00 e 7:30 am.
- Coletar amostra de sangue em jejum, conforme descrito em38,39.
- Peça aos participantes que ingeram 75 g de glicose em 300 mL de solução. Coletar amostras de sangue aos 30 min, 60 min, 90 min e 120 min após a ingestão de glicose.
- Medir a glicose plasmática e a concentração sérica de insulina em todas as amostras de sangue, conforme descrito em38,39. Plotar dados do OGTT.
- Calcular a) a AUC para glicose e insulina seguindo a regra trapezoidal40; b) índice de sensibilidade à insulina via glicose,por via oral41; c) índice de sensibilidade à insulina de Matsuda42; d) o índice de Cederholm43; e) índice de sensibilidade à insulina muscular44,45; f) índice de Gutt46; g) o índice de Avignon etal.47; e h) o índice de Stumvoll etal.48.
10. Análise estatística
- Analise dados cegos para alocação usando planilhas codificadas da etapa 7.2.
- Expresse os dados como média e desvio padrão. Avaliar a normalidade dos dados com o teste de Shapiro-Wilk. Para dados normalmente distribuídos, analise os dados com análises de variância unidirecionais, se um efeito principal significativo for observado, use o teste post hoc de Tukey.
- Para dados não paramétricos, utilizar o teste de Kruskal-Wallis ou o teste de Friedman. Considerar significância quando os valores de p forem menores que 0,05.
- Revele a alocação depois que todas as estatísticas forem executadas.
Access restricted. Please log in or start a trial to view this content.
Resultados
A Figura 2 mostra respostas representativas (de um estudo piloto) para glicose (Figura 2A) e insulina (Figura 2B) durante o TOTG. Geralmente, os picos para os valores de glicose e insulina são observados aos 30 minutos de medição, que é seguido por uma diminuição constante até 120 minutos de medição. Quanto menor o pico de glicose, melhor o resultado, o que é indicativo de inibição da produção hepática de glicose. Qua...
Access restricted. Please log in or start a trial to view this content.
Discussão
Este artigo detalhou os passos de um ensaio clínico randomizado e controlado que teve como objetivo avaliar os efeitos do volume de exercício de força sobre a sensibilidade à insulina em adultos obesos. Os ensaios clínicos randomizados são os melhores protocolos de pesquisa para estabelecer causa e efeito de um tratamento de forma imparcial49,50. Especificamente, neste estudo, empregaremos um desenho crossover, o que significa que cada sujeito recrutado rea...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Este estudo é financiado pelo Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPQ: Processo#407975/2018-7 e #402091/2021-3) e pela Agência Estadual de Pesquisa e Desenvolvimento de Minas Gerais (FAPEMIG: Bolsa# APQ-00008-22). Os financiadores não desempenharam nenhum papel no desenho deste estudo e não desempenham qualquer papel na condução do estudo, interpretação dos dados ou relato dos resultados. Este estudo está sediado na Universidade Federal dos Vales do Jequitinhonha e Mucuri (Diamantina-MG, Brasil) que fornece os equipamentos e o espaço (DXA, sala de musculação, equipamentos de musculação, etc.) necessários para a realização da pesquisa.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| dual-energy X-ray absorptiometry | GE | DXA, Lunar, iDXA Advanced | for assessing body composition |
| G*Power program | Heinrich-Heine-Universität Düsseldorf, Germany | version 3.1.9.6 | for calculating sample size |
Referências
- Ismail, A. D., et al. The effect of short-duration resistance training on insulin sensitivity and muscle adaptations in overweight men. Experimental physiology. 104 (4), 540-545 (2019).
- Jiahao, L., Jiajin, L., Yifan, L. Effects of resistance training on insulin sensitivity in the elderly: A meta-analysis of randomized controlled trials. Journal of Exercise Science and Fitness. 19 (4), 241-251 (2021).
- Liu, Y., et al. Resistance exercise intensity is correlated with attenuation of HbA1c and insulin in patients with type 2 diabetes: A systematic review and meta-analysis. International Journal of Environmental Research and Public Health. 16 (1), (2019).
- van Dijk, J. W., et al. Both resistance- and endurance-type exercise reduce the prevalence of hyperglycaemia in individuals with impaired glucose tolerance and in insulin-treated and non-insulin-treated type 2 diabetic patients. Diabetologia. 55 (5), 1273-1282 (2012).
- Koopman, R., et al. A single session of resistance exercise enhances insulin sensitivity for at least 24 in healthy men. European Journal of Applied Physiology. 94 (1-2), 180-187 (2005).
- Andersen, E., Høstmark, A. T. Effect of a Single Bout of Resistance Exercise on Postprandial Glucose and Insulin Response the Next Day in Healthy, Strength-Trained Men. The Journal of Strength and Conditioning Research. 21 (2), 487(2007).
- Tong, T. K., Kong, Z., Shi, X., Shi, Q. Comparable Effects of Brief Resistance Exercise and Isotime Sprint Interval Exercise on Glucose Homeostasis in Men. Journal of Diabetes Research. 2017, (2017).
- Monroe, J. C., Naugle, K. M., Naugle, K. E. Effect of Acute Bouts of Volume-Matched High-Intensity Resistance Training Protocols on Blood Glucose Levels. Journal of Strength and Conditioning Research. 34 (2), 445-450 (2020).
- Bittel, A. J., et al. A Single Bout of Premeal Resistance Exercise Improves Postprandial Glucose Metabolism in Obese Men with Prediabetes. Medicine and science in sports and exercise. 53 (4), (2021).
- Fluckey, J. D., et al. Effects of resistance exercise on glucose tolerance in normal and glucose-intolerant subjects. Journal of Applied Physiology. 77 (3), 1087-1092 (1994).
- Fenicchia, L. M., et al. Influence of resistance exercise training on glucose control in women with type 2 diabetes. Metabolism: Clinical and Experimental. 53 (3), 284-289 (2004).
- Gordon, B. A., Fraser, S. F., Bird, S. R., Benson, A. C. Insulin sensitivity not modulated 24 to 78h after acute resistance exercise in type 2 diabetes patients. Diabetes, Obesity and Metabolism. 15 (5), 478-480 (2013).
- Gordon, B. A., Fraser, S. F., Bird, S. R., Benson, A. C. Insulin sensitivity in response to a single resistance exercise session in apparently healthy individuals. Journal of Endocrinological Investigation. 35 (7), 665-669 (2012).
- Malin, S. K., Hinnerichs, K. R., Echtenkamp, B. G., Evetovich, T. K., Engebretsen, B. J. Effect of adiposity on insulin action after acute and chronic resistance exercise in non-diabetic women. European Journal of Applied Physiology. 113 (12), 2933-2941 (2013).
- Moreno-Cabañas, A., et al. One Bout of Resistance Training Does Not Enhance Metformin Actions in Prediabetic and Diabetic Individuals. Medicine and Science in Sports and Exercise. 54 (7), (2022).
- Luebbers, P. E., et al. Glucose Uptake After Resistance Training of Different Intensities but of Equal Work Volume. Journal of Strength and Conditioning Research. 22 (4), 1094-1100 (2008).
- Chapman, J., Garvin, A. W., Ward, A., Cartee, G. D. Unaltered insulin sensitivity after resistance exercise bout by postmenopausal women. Medicine & Science in Sports & Exercise. 34 (6), 936-941 (2002).
- Brown, E. C., Franklin, B. A., Regensteiner, J. G., Stewart, K. J. Effects of single bout resistance exercise on glucose levels, insulin action, and cardiovascular risk in type 2 diabetes: A narrative review. Journal of Diabetes and its Complications. 34 (8), (2020).
- Ishiguro, H., et al. In Search of the Ideal Resistance Training Program to Improve Glycemic Control and its Indication for Patients with Type 2 Diabetes Mellitus: A Systematic Review and Meta-Analysis. Sports Medicine. 46 (1), 67-77 (2016).
- Reed, M. E., Ben-Ezra, V., Biggerstaff, K. D., Nichols, D. L. The Effects of Two Bouts of High- and Low-Volume Resistance Exercise on Glucose Tolerance in Normoglycemic Women. Journal of Strength and Conditioning Research. 26 (1), 251-260 (2012).
- Black, L. E., Swan, P. D., Alvar, B. A. Effects of Intensity and Volume on Insulin Sensitivity During Acute Bouts of Resistance Training. Journal of Strength and Conditioning Research. 24 (4), 1109-1116 (2010).
- Carballo-Fazanes, A., et al. Physical Activity Habits and Determinants, Sedentary Behaviour and Lifestyle in University Students. International Journal of Environmental Research and Public Health. 17 (9), 3272(2020).
- SCHOENFELD, B. J., et al. Resistance Training Volume Enhances Muscle Hypertrophy but Not Strength in Trained Men. Medicine & Science in Sports & Exercise. 51 (1), 94-103 (2019).
- Neupert, S. D., Lachman, M. E., Whitbourne, S. B. Exercise Self-Efficacy and Control Beliefs: Effects on Exercise Behavior after an Exercise Intervention for Older Adults. Journal of Aging and Physical Activity. 17 (1), 1-16 (2009).
- Gjestvang, C., Abrahamsen, F., Stensrud, T., Haakstad, L. A. H. Motives and barriers to initiation and sustained exercise adherence in a fitness club setting—A one-year follow-up study. Scandinavian Journal of Medicine and Science in Sports. 30 (9), (2020).
- Collado-Mateo, D., et al. Key factors associated with adherence to physical exercise in patients with chronic diseases and older adults: An umbrella review. International Journal of Environmental Research and Public Health. 18 (4), (2021).
- Riebe, D., et al. Updating ACSM’s Recommendations for Exercise Preparticipation Health Screening. Medicine & Science in Sports & Exercise. 47 (11), 2473-2479 (2015).
- Cortés, M. E., Alfaro, A. A. The effects of hormonal contraceptives on glycemic regulation. Linacre Quarterly. 81 (3), (2014).
- Kerksick, C. M., et al. ISSN exercise & sports nutrition review update: research & recommendations. , 1-57 (2018).
- ROBERTSON, R. J., et al. Concurrent Validation of the OMNI Perceived Exertion Scale for Resistance Exercise. Medicine & Science in Sports & Exercise. 35 (2), 333-341 (2003).
- Hardy, C. J., Rejeski, W. J. Not What, but How One Feels: The Measurement of Affect during Exercise. Journal of Sport and Exercise Psychology. 11 (3), (2016).
- Alves, E. D., Panissa, V. L. G., Barros, B. J., Franchini, E., Takito, M. Y. Translation, adaptation, and reproducibility of the Physical Activity Enjoyment Scale (PACES) and Feeling Scale to Brazilian Portuguese. Sport Sciences for Health. 15 (2), (2019).
- Kendzierski, D., DeCarlo, K. J. Physical Activity Enjoyment Scale: Two Validation Studies. Journal of Sport and Exercise Psychology. 13 (1), (2016).
- McAuley, E., Lox, C., Duncan, T. E. Long-term maintenance of exercise, self-efficacy, and physiological change in older adults. Journals of Gerontology. 48 (4), (1993).
- Chen, T. C., et al. Changes in Insulin Sensitivity and Lipid Profile Markers Following Initial and Secondary Bouts of Multiple Eccentric Exercises. Frontiers in Physiology. 13, (2022).
- Jimenez, C., Santiago, M., Sitler, M., Boden, G., Homko, C. Insulin-Sensitivity Response to a Single Bout of Resistive Exercise in Type 1 Diabetes Mellitus. Journal of Sport Rehabilitation. 18 (4), 564-571 (2009).
- Gonzalez, J. T., Barwood, M. J., Goodall, S., Thomas, K., Howatson, G. Alterations in whole-body insulin sensitivity resulting from repeated eccentric exercise of a single muscle group: A pilot investigation. International Journal of Sport Nutrition and Exercise Metabolism. 25 (4), 405-410 (2015).
- Ismail, A. D., et al. The effect of short-duration resistance training on insulin sensitivity and muscle adaptations in overweight men. Experimental Physiology. 104 (4), 540-545 (2019).
- de Matos, M. A., et al. High-Intensity Interval Training Improves Markers of Oxidative Metabolism in Skeletal Muscle of Individuals With Obesity and Insulin Resistance. Frontiers in Physiology. 9 (OCT), (2018).
- Carbohydrate Homeostasis. New England Journal of Medicine. 283 (5), 237-246 (1970).
- Mari, A., Pacini, G., Murphy, E., Ludvik, B., Nolan, J. J. A Model-Based Method for Assessing Insulin Sensitivity From the Oral Glucose Tolerance Test. Diabetes Care. 24 (3), 539-548 (2001).
- Matsuda, M., DeFronzo, R. A. Insulin sensitivity indices obtained from oral glucose tolerance testing: comparison with the euglycemic insulin clamp. Diabetes Care. 22 (9), 1462-1470 (1999).
- Cederholm, J., Wibell, L. Insulin release and peripheral sensitivity at the oral glucose tolerance test. Diabetes Research and Clinical Practice. 10 (2), 167-175 (1990).
- Abdul-Ghani, M. A., Matsuda, M., Balas, B., DeFronzo, R. A. Muscle and Liver Insulin Resistance Indexes Derived From the Oral Glucose Tolerance Test. Diabetes Care. 30 (1), 89-94 (2007).
- de Matos, M. A., et al. High-Intensity Interval Training Improves Markers of Oxidative Metabolism in Skeletal Muscle of Individuals With Obesity and Insulin Resistance. Frontiers in Physiology. 9, (2018).
- Gutt, M., et al. Validation of the insulin sensitivity index (ISI0,120): comparison with other measures. Diabetes Research and Clinical Practice. 47 (3), 177-184 (2000).
- Avignon, A., Bœgner, C., Mariano-Goulart, D., Colette, C., Monnier, L. Assessment of insulin sensitivity from plasma insulin and glucose in the fasting or post oral glucose-load state. International Journal of Obesity. 23 (5), (1999).
- Stumvoll, M., van Haeften, T., Fritsche, A., Gerich, J. Oral Glucose Tolerance Test Indexes for Insulin Sensitivity and Secretion Based on Various Availabilities of Sampling Times. Diabetes Care. 24 (4), 796-797 (2001).
- Kendall, J. M. Designing a research project: Randomised controlled trials and their principles. Emergency Medicine Journal. 20 (2), (2003).
- Moher, D., et al. CONSORT 2010 explanation and elaboration: updated guidelines for reporting parallel group randomised trials. BMJ (Clinical research ed.). 340, (2010).
- Sibbald, B., Roberts, C. Understanding controlled trials Crossover trials. BMJ. 316 (7146), (1998).
- Lim, C. Y., In, J. Considerations for crossover design in clinical study. Korean Journal of Anesthesiology. 74 (4), (2021).
- Taylor, H. L., et al. Post-exercise carbohydrate-energy replacement attenuates insulin sensitivity and glucose tolerance the following morning in healthy adults. Nutrients. 10 (2), (2018).
- Johnson-Bonson, D. A., et al. Interactive effects of acute exercise and carbohydrate-energy replacement on insulin sensitivity in healthy adults. Applied physiology, nutrition, and metabolism = Physiologie appliquee, nutrition et metabolisme. 46 (10), (2021).
- Patarrão, R. S., Wayne Lautt, W., Paula Macedo, M. Assessment of methods and indexes of insulin sensitivity. Revista Portuguesa de Endocrinologia, Diabetes e Metabolismo. 9 (1), 65-73 (2014).
- DeFronzo, R. A., Tobin, J. D., Andres, R. Glucose clamp technique: A method for quantifying insulin secretion and resistance. American Journal of Physiology Endocrinology Metabolism and Gastrointestinal Physiology. 6 (3), (1979).
- Monzillo, L. U., Hamdy, O. Evaluation of Insulin Sensitivity in Clinical Practice and in Research Settings. Nutrition Reviews. 61 (12), 397-412 (2003).
- Radziuk, J. Insulin Sensitivity and Its Measurement: Structural Commonalities among the Methods 1. The Journal of Clinical Endocrinology & Metabolism. 85 (12), (2000).
- Gordon, B. A., Fraser, S. F., Bird, S. R., Benson, A. C. Reproducibility of multiple repeated oral glucose tolerance tests. Diabetes Research and Clinical Practice. 94 (3), (2011).
- Beaudry, K. M., Surdi, J. C., Mari, A., Devries, M. C. Exercise mode influences post-exercise glucose sensitivity and insulin clearance in young, healthy males and females in a sex-dependent manner: A randomized control trial. Physiological Reports. 10 (13), (2022).
- Aguiar, S. daS., et al. Acute metabolic responses following different resistance exercise protocols. Applied Physiology, Nutrition and Metabolism. 43 (8), 838-843 (2018).
- Venables, M. C., Shaw, C. S., Jeukendrup, A. E., Wagenmakers, A. J. M. Effect of acute exercise on glucose tolerance following post-exercise feeding. European Journal of Applied Physiology. 100 (6), 711-717 (2007).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados