Purificação de Compostos por Recristalização
Visão Geral
Fonte: Laboratório do Dr. Jimmy Franco - Merrimack College
A recristalização é uma técnica usada para purificar compostos sólidos. 1 Os sólidos tendem a ser mais solúveis em líquidos quentes do que em líquidos frios. Durante a recristalização, um composto sólido impuro é dissolvido em um líquido quente até que a solução esteja saturada, e então o líquido é permitido esfriar. 2 O composto deve então formar cristais relativamente puros. Idealmente, quaisquer impurezas presentes permanecerão na solução e não serão incorporadas aos cristais em crescimento (Figura 1). Os cristais podem então ser removidos da solução por filtragem. Nem todo o composto é recuperável — alguns permanecerão na solução e serão perdidos.
A recristalização não é geralmente considerada como uma técnica de separação; em vez disso, é uma técnica de purificação na qual uma pequena quantidade de uma impureza é removida de um composto. No entanto, se as propriedades de solubilidade de dois compostos forem suficientemente diferentes, a recristalização pode ser usada para separá-los, mesmo que estejam presentes em quantidades quase iguais. A recristalização funciona melhor quando a maioria das impurezas já foram removidas por outro método, como extração ou cromatografia de coluna.
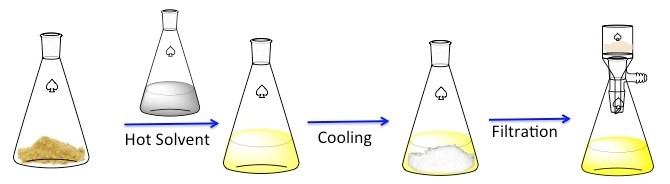
Figura 1. O esquema geral de recriminarização.
Princípios
Uma recristalização bem sucedida depende da escolha adequada do solvente. O composto deve ser solúvel no solvente quente e insolúvel no mesmo solvente quando está frio. Para fins de recristalização, considere 3% c/v a linha divisória entre solúvel e insolúvel: se 3 g de um composto dissolve em 100 mL de um solvente, é considerado solúvel. Na escolha de um solvente, maior a diferença entre solubilidade quente e solubilidade fria, mais produto recuperável da recristalização.
A taxa de resfriamento determina o tamanho e a qualidade dos cristais: o resfriamento rápido favorece pequenos cristais, e o resfriamento lento favorece o crescimento de cristais grandes e geralmente mais puros. A taxa de recristalização é geralmente maior em cerca de 50 °C abaixo do ponto de fusão da substância; a formação máxima de cristais ocorre a cerca de 100 °C abaixo do ponto de fusão.
Embora os termos "cristalização" e "recrisstallização" às vezes sejam usados de forma intercambiável, eles tecnicamente se referem a diferentes processos. Cristalização refere-se à formação de um novo produto insolúvel por uma reação química; este produto então precipita-se fora da solução de reação como um sólido amorfo contendo muitas impurezas presas. A recristalização não envolve uma reação química; o produto bruto é simplesmente dissolvido em solução, e então as condições são alteradas para permitir que os cristais se re formem. A recristalização produz um produto final mais puro. Por essa razão, procedimentos experimentais que produzem um produto sólido por cristalização normalmente incluem uma etapa final de recristalização para dar o composto puro.
Procedimento
Realize todas as etapas em um capô de fumaça para evitar a exposição a vapores solventes.
1. Selecionando um Solvente
- Coloque 50 mg da amostra (N-bromosuccinimida) em um frasco de Erlenmeyer.
- Adicione 0,5 mL de solvente fervente (água). Se a amostra se dissolver completamente, a solubilidade no solvente frio é muito alta para ser um bom solvente de recristalização.
- Se a amostra não se dissolver no solvente frio, aqueça o tubo de ensaio até que o solvente ferva.
- Se a amostra não tiver se dissolvido completamente neste momento, adicione mais solvente fervente em termos de gota, até que todo o sólido se dissolva. Se for preciso mais de 3 mL para dissolver a amostra no solvente quente, a solubilidade neste solvente é provavelmente muito baixa para torná-lo um bom solvente de recristalização.
- Se a primeira escolha de solvente não for um bom solvente de recristalização, tente outros. Se um único solvente que funciona não puder ser encontrado, tente um sistema de dois solventes.
- Se você não encontrar um sistema de solvente único adequado, então um par de solventes pode ser necessário. Ao identificar um par de solventes, existem várias considerações-chave 1) O primeiro solvente deve prontamente dissolver o sólido. 2) O segundo solvente deve ser miscível com o solvente1º, mas ter uma solubilidade muito menor para o soluto.
- Como regra geral , "gosta de dissolver likes" significando que compostos polares tendem a ser solúveis em solventes polares e compostos não polares são frequentemente compostos não polares solúveis.
- Pares de solventes comuns(Tabela 1)
- Certifique-se de que o solvente tenha um ponto de ebulição de pelo menos 40 °C, para que haja uma diferença razoável de temperatura entre solvente fervente e solvente de temperatura ambiente.
- Certifique-se de que o solvente tenha um ponto de ebulição abaixo de 120 °C, por isso é mais fácil remover os últimos traços de solvente dos cristais.
- Certifique-se também de que o ponto de ebulição do solvente seja menor do que o ponto de fusão do composto, de modo que o composto se forme como cristais sólidos em vez de como um óleo insolúvel.
- Confirme que as impurezas são insolúveis no solvente quente (para que possam ser filtradas a quente, uma vez que o composto é dissolvido) ou solúveis no solvente frio (para que permaneçam dissolvidos durante todo o processo).
2. Dissolvendo a amostra em solvente quente
- Coloque o composto para ser recristalizado em um frasco de Erlenmeyer. Esta é uma escolha melhor do que um béquer, uma vez que os lados inclinados ajudam a prender vapores solventes e retardar a taxa de evaporação.
- Coloque o solvente (água) em um frasco erlenmeyer separado, e adicione lascas ferventes ou uma barra de mexida para mantê-lo fervendo suavemente. Aqueça-o para ferver em uma placa quente.
- Adicione solvente quente a um frasco à temperatura ambiente contendo o composto em pequenas porções, girando após cada adição, até que o composto seja completamente dissolvido.
- Durante o processo de dissolução, mantenha a solução quente o tempo todo, descansando-a na placa quente, também. Não adicione mais solvente quente do que o necessário - apenas o suficiente para dissolver a amostra.
- Se uma parte do sólido não parece se dissolver, mesmo depois de mais solvente quente ter sido adicionado, é provável que seja devido à presença de impurezas muito insolúveis. Se isso acontecer, pare de adicionar solvente e faça uma filtragem quente antes de prosseguir.
- Para realizar uma filtragem quente, dobre um pedaço de papel filtro em uma forma de cone fluted e coloque-o em um funil sem haste de vidro.
- Adicione um excesso de 10-20% de solvente quente à solução quente para permitir a evaporação no procedimento.
- Despeje a solução através do papel. Se os cristais começarem a se formar a qualquer momento durante o processo, adicione uma pequena porção de solvente quente para dissolvê-los.
3. Resfriamento da solução
- Coloque o frasco contendo o composto dissolvido em uma superfície que não conduza o calor muito rapidamente, como um conjunto de papel toalha em um banco.
- Cubra levemente o frasco enquanto esfria para evitar a evaporação e para evitar que a poeira caia na solução.
- Deixe o frasco intacto até esfriar à temperatura ambiente.
- Uma vez formados os cristais, coloque a solução em um banho de gelo para garantir que a quantidade máxima de cristais seja obtida. As soluções devem ser deixadas intactas no banho de gelo por 30 minutos a 1 h, ou até que o composto pareça ter cristalizado completamente fora de solução.
- Se nenhuma formação de cristal for evidente, ela pode ser induzida arranhando as paredes internas do frasco com uma haste de vidro ou adicionando um pequeno cristal de sementes do mesmo composto.
- Se isso ainda não funcionar, então muito solvente foi provavelmente usado. Reaqueça a solução, deixe alguns solventes ferverem e depois esfrie-a.
4. Isolar e Secar os Cristais
- Coloque o frasco frio contendo os cristais recém-formados em um banco.
- Cubra levemente o frasco para evitar a evaporação e para evitar que a poeira caia na solução.
- Isole os cristais por filtragem de vácuo, usando um funil Büchner ou Hirsch (aperte o frasco em um suporte de anel primeiro).
- Enxágüe os cristais no funil Büchner com uma pequena quantidade de solvente fresco e frio (o mesmo solvente usado para a recristalização) para remover quaisquer impurezas que possam estar grudando nos cristais.
- Para secar os cristais, deixe-os no funil do filtro e desenhe ar através deles por vários minutos. Os cristais também podem ser secos ao ar, permitindo que eles fiquem descobertos por várias horas ou dias. Métodos mais eficientes incluem secagem a vácuo ou colocação em um desiccador.
| Solvente Polar | Menos Solvente Polar |
| Acetato de etila | Hexano |
| Metanol | Cloreto de metileno |
| Água | Etanol |
| Tolueno | Hexano |
Mesa 1. Pares de solventes comuns.
Resultados
Um exemplo dos resultados da recristalização é mostrado na Figura 2. As impurezas amarelas presentes no composto bruto foram removidas, e o produto puro é deixado como um sólido off-white. A pureza do composto recristalizado pode agora ser verificada pela espectroscopia de ressonância magnética nuclear (NMR) ou, se for um composto com um ponto de fusão publicado, pelo quão semelhante é seu ponto de fusão ao ponto de fusão da literatura. Se necessário, várias recriminarizações podem ser realizadas até que a pureza seja aceitávelmente alta.

Figura 2. 2a) Um composto bruto (esquerda), 2b) produto recristalizado antes da filtragem (meio) e 2c) o mesmo composto após a recristalização (direita).
Aplicação e Resumo
A recristalização é um método de purificação de um composto removendo quaisquer impurezas que possam ser misturadas com ele. Funciona melhor quando o composto é muito solúvel em um solvente quente, mas muito insolúvel na versão fria do mesmo solvente. O composto deve ser sólido à temperatura ambiente. A recristalização é frequentemente usada como um passo final de limpeza, após outros métodos (como extração ou cromatografia de coluna) que são eficazes na remoção de quantidades maiores de impurezas, mas que não elevam a pureza do composto final a um nível suficientemente alto.
A recristalização é a única técnica que pode produzir cristais únicos absolutamente puros e perfeitos de um composto. Esses cristais podem ser usados para análise de raios-X, que é a autoridade máxima na determinação da estrutura e forma tridimensional de uma molécula. Nesses casos, a recristalização é permitida a proceder muito lentamente, ao longo de semanas a meses, para permitir que a rede cristalina se forme sem a inclusão de quaisquer impurezas. É necessário vidro especial para permitir que o solvente evapore o mais lentamente possível durante este tempo, ou para permitir que o solvente se misture muito lentamente com outro solvente no qual o composto é insolúvel (chamado adição antisolvente).
A indústria farmacêutica também faz uso pesado da recristalização, uma vez que é um meio de purificação mais facilmente dimensionada do que a cromatografia da coluna. 3 A importância da recristalização em aplicações industriais tem acionado os educadores para enfatizar a recristalização no currículo laboratorial. 4 Por exemplo, a droga Stavudine, que é usada para reduzir os efeitos do HIV, é tipicamente isolada pela cristalização. 5 Muitas vezes, as moléculas têm múltiplas estruturas de cristal diferentes disponíveis, por isso é necessário que a pesquisa avalie e entenda qual forma de cristal está isolada em quais condições, como taxa de resfriamento, composição de solventes, e assim por diante. Essas diferentes formas de cristal podem ter propriedades biológicas diferentes ou serem absorvidas no corpo a taxas diferentes.
Um uso mais comum de recristalização é na fabricação de doces de rocha. Os doces de rocha são feitos dissolvendo o açúcar em água quente ao ponto de saturação. As varas de madeira são colocadas na solução e a solução é permitida para esfriar e evaporar lentamente. Depois de vários dias, grandes cristais de açúcar cresceram por todas as varas de madeira.
Referências
- Mayo, D. W.; Pike, R. M.; Forbes, D. C., Microscale organic laboratory : with multistep and multiscale syntheses. 5th ed.; J. Wiley & Sons: Hoboken, NJ, p xxi, 681 p (2011).
- Armarego, W. L. F.; Chai, C. L. L., Purification of laboratory chemicals. 5th ed.; Butterworth-Heinemann: Amsterdam ; Boston; p xv, 609 p (2003).
- Ray, P. C.; Tummanapalli, J. M. C.; Gorantla, S. R., Process for the large scale production of Stavudine. Google Patents: (2011).
- Hightower, T. R.; Heeren, J. D., Using a Simulated Industrial Setting for the Development of an Improved Solvent System for the Recrystallization of Benzoic Acid: A Student-Centered Project. Journal of Chemical Education 83 (11), 1663 (2006).
- Rohani, S.; Horne, S.; Murthy, K., Control of Product Quality in Batch Crystallization of Pharmaceuticals and Fine Chemicals. Part 1: Design of the Crystallization Process and the Effect of Solvent. Organic Process Research & Development 9 (6), 858-872 (2005).
Declarações
- Mayo, D.W.; Pike, R.M.; Forbes, D.C., laboratório orgânico de microescala : com sintetizadores multicamado e multiescala. 5ª ed.; J. Wiley & Sons: Hoboken, NJ, p xxi, 681 p (2011).
- Armarego, W.L. F.; Chai, C.L.L., Purificação de produtos químicos de laboratório. 5ª ed.; Butterworth-Heinemann: Amsterdã; Boston; p xv, 609 p (2003).
- Ray, P.C.; Tummanapalli, J.M.C.; Gorantla, S.R., Processo para a produção em larga escala de Stavudine. Patentes do Google: (2011).
- Hightower, T.R.; Heeren, J. D., Utilizando um Cenário Industrial Simulado para o Desenvolvimento de um Sistema de Solvente Melhorado para a Recristalização do Ácido Benzoico: Um Projeto Centrado no Estudante. Revista de Educação Química 83 (11), 1663 (2006).
- Rohani, S.; Horne, S.; Murthy, K., Controle da Qualidade do Produto em Cristalização em Lote de Produtos Farmacêuticos e Produtos Químicos Finos. Parte 1: Projeto do Processo de Cristalização e o Efeito do Solvente. Pesquisa & Desenvolvimento de Processos Orgânicos 9 (6), 858-872 (2005).
Tags
Pular para...
Vídeos desta coleção:

Now Playing
Purificação de Compostos por Recristalização
Organic Chemistry
709.9K Visualizações

Introdução à Catálise
Organic Chemistry
34.6K Visualizações

Montagem de um sistema de refluxo para reações químicas aquecidas
Organic Chemistry
168.3K Visualizações

Condução de reações abaixo da temperatura ambiente
Organic Chemistry
70.7K Visualizações

Transferência de Solventes usando Linhas Schlenk
Organic Chemistry
41.7K Visualizações

Desgaseificação de Líquidos com Ciclagem de Congelamento-Bombeamento-Descongelamento
Organic Chemistry
56.3K Visualizações

Preparação de Reagentes e Equipamentos Anidros
Organic Chemistry
79.4K Visualizações

Separação de Misturas por Precipitação
Organic Chemistry
158.0K Visualizações

Extração sólido-líquido
Organic Chemistry
238.0K Visualizações

Evaporação rotativa para remover solvente
Organic Chemistry
212.9K Visualizações

Destilação Fracionária
Organic Chemistry
334.7K Visualizações

Crescimento de Cristais para Análise de Difração de Raios-X
Organic Chemistry
32.9K Visualizações

Realização de Cromatografia de Camada Fina 1D
Organic Chemistry
290.1K Visualizações

Cromatografia em coluna
Organic Chemistry
360.8K Visualizações

Espectroscopia de ressonância magnética nuclear (NMR)
Organic Chemistry
248.9K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados