Reinigen von Verbindungen durch Umkristallisation
Überblick
Quelle: Labor von Dr. Jimmy Franco - Merrimack College
Rekristallisation ist eine Technik verwendet, um feste Verbindungen zu reinigen. 1 Feststoffe tendenziell besser löslich in heißer Flüssigkeiten als in kalten Flüssigkeiten. Während Rekristallisation ist eine unreine solide Verbindung in eine heiße Flüssigkeit aufgelöst, bis die Lösung gesättigt ist, und dann die Flüssigkeit darf abkühlen lassen. 2 die Verbindung sollte dann relativ reines Kristalle bilden. Im Idealfall Verunreinigungen, die vorhanden sind in der Lösung bleiben und fließen nicht in die wachsenden Kristalle (Abbildung 1). Die Kristalle können dann die Lösung durch Filtration entfernt werden. Nicht alle der Verbindung ist wiederherstellbar – einige bleiben in der Lösung und werden verloren gehen.
Rekristallisation wird im Allgemeinen als eine Trennung Technik nicht gedacht; Vielmehr ist es eine Reinigung-Technik, bei der eine kleine Menge einer Verunreinigung von einer Verbindung entfernt wird. Jedoch wenn die Löslichkeit Eigenschaften der beiden Verbindungen ausreichend unterscheiden, Rekristallisation lässt sich trennen, auch wenn sie in fast gleicher Höhe vorhanden sind. Rekristallisation funktioniert am besten, wenn die meisten Verunreinigungen bereits durch eine andere Methode, wie z. B. Extraktion oder Spalte Chromatographie entfernt wurden.
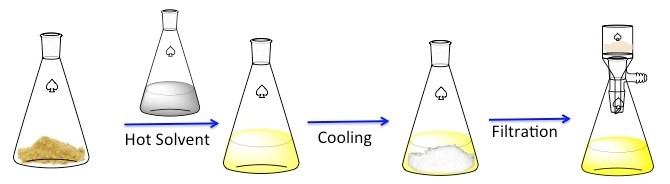
Abbildung 1. Der allgemeinen Regelung für Rekristallisation.
Grundsätze
Eine erfolgreiche Rekristallisation hängt die richtige Wahl des Lösungsmittels. Die Verbindung muss in die heiße Lösungsmittel und unlöslich in dem gleichen Lösungsmittel löslich sein, wenn es kalt ist. Für die Zwecke der Rekristallisation, 3 % w/V betrachten die Trennlinie zwischen löslichen und unlöslichen: Wenn 3 g eines Stoffes in 100 mL Lösungsmittel auflöst, wird es als löslich. Bei der Wahl eines Lösungsmittels, je größer der Unterschied zwischen heißen Löslichkeit und kalten Löslichkeit, das mehr Produkt erzielbare von Rekristallisation.
Die Rate des Abkühlens bestimmt die Größe und Qualität der Kristalle: schnelle Abkühlung begünstigt kleine Kristalle und langsame Abkühlung begünstigt das Wachstum der großen und in der Regel reiner Kristalle. Rekristallisation beträgt in der Regel größte bei ca. 50 ° C unterhalb des Schmelzpunktes des Stoffes; die maximale Bildung von Kristallen tritt bei etwa 100 ° C unterhalb des Schmelzpunktes.
Obwohl die Begriffe "Kristallisation" und "Rekristallisation" manchmal synonym verwendet werden, beziehen sie sich technisch auf unterschiedliche Prozesse. Kristallisation bezieht sich auf die Bildung eines neuen, unlöslichen Produktes durch eine chemische Reaktion; Dieses Produkt fällt dann aus der Reaktionslösung aus als eine amorphe Festkörper mit vielen eingeschlossenen Verunreinigungen. Rekristallisation ist nicht erforderlich, eine chemische Reaktion. Das Rohprodukt wird einfach in der Lösung aufgelöst, und dann die Bedingungen geändert werden, um Kristalle zu re-form zu ermöglichen. Rekristallisation produziert ein reineres Endprodukt. Aus diesem Grund gehören experimentelle Verfahren, die ein solides Produkt durch Kristallisation normalerweise produzieren einen endgültige Rekristallisation Schritt um die reine Verbindung zu geben.
Verfahren
Führen Sie alle Schritte in einer Dampfhaube, Belastung durch Lösemitteldämpfe zu verhindern.
1. Auswahl eines Lösungsmittels
- Legen Sie 50 mg der Probe (N-Bromsuccinimid) in einen Erlenmeyerkolben.
- Hinzugeben Sie 0,5 mL kochendes Lösungsmittel (Wasser). Wenn die Probe vollständig auflöst, ist die Löslichkeit in den kalten Lösungsmittel zu hoch, um eine gute Rekristallisation Lösungsmittel.
- Wenn die Probe nicht im kalten Lösungsmittel löst, erhitzen Sie das Reagenzglas, bis das Lösungsmittel kocht.
- Wenn die Probe nicht zu diesem Zeitpunkt vollständig aufgelöst hat, fügen Sie mehr kochendes Lösungsmittel tropfenweise, bis alle festen auflöst. Wenn es mehr als 3 mL die Probe in die heiße Lösungsmittel auflösen dauert, ist die Löslichkeit in diesem Lösungsmittel vermutlich zu gering zu machen, eine gute Rekristallisation Lösungsmittel.
- Ist die erste Wahl des Lösungsmittels nicht gut Rekristallisation Lösungsmittel, versuchen Sie andere. Wenn ein einziges Lösungsmittel, das funktioniert nicht gefunden werden kann, versuchen Sie zwei Lösungsmittelsystem.
- Wenn Sie ein geeignetes Lösungsmittels System nicht finden können, kann ein Lösungsmittel paar erforderlich sein. Wenn ein Lösungsmittel paar identifizieren, gibt es mehrere wichtige Überlegungen 1) das erste Lösungsmittel sollten leicht festen auflösen. (2) das zweite Lösungsmittel muss mit 1St Lösungsmittel mischbar, aber haben eine viel geringere Löslichkeit für die gelösten.
- Als allgemeine Regel "likes" gerne auflösen was bedeutet, dass die polare Verbindungen sind in der Regel löslich in polaren Lösungsmitteln und unpolaren Verbindungen sind oft mehr lösliche unpolaren Verbindungen.
- Allgemeine Lösungsmittel Paare (Tabelle 1)
- Stellen Sie sicher, dass das Lösungsmittel hat einen Siedepunkt von mindestens 40 ° C, so gibt es ein angemessene Temperatur-Unterschied zwischen kochendes Lösungsmittel und Raumtemperatur Lösungsmittel.
- Stellen Sie sicher, dass das Lösungsmittel einen Siedepunkt unter ca. 120 ° C, hat so ist es einfacher, die letzten Spuren des Lösungsmittels aus der Kristalle zu entfernen.
- Stellen Sie außerdem sicher, dass der Siedepunkt des Lösungsmittels ist niedriger als der Schmelzpunkt der Verbindung, so dass die Verbindung als feste Kristalle nicht als unlösliche Öl bildet.
- Bestätigen, dass die Verunreinigungen entweder sind in die heiße Lösungsmittel (so heiß-herausgefiltert, können sie die Verbindung aufgelöst ist) unlöslich oder löslich in kalten Lösungsmittel (so dass sie während des gesamten Prozesses gelösten bleiben).
(2) auflösen die Probe in heiße Lösungsmittel
- Legen Sie die Masse in einen Erlenmeyerkolben umkristallisiert werden. Dies ist eine bessere Wahl als ein Becherglas, da die abfallenden Seiten Falle Lösungsmitteldämpfe helfen und die Rate von Verdampfung verlangsamen.
- Das Lösungsmittel (Wasser) in einem separaten Erlenmeyer-Kolben, geben Sie und kochendes Chips oder Stir Bar kochendem glatt zu halten. Bis zum Sieden auf einer Kochplatte erhitzen.
- Fügen Sie heiße Lösungsmittel in einem Kolben bei Raumtemperatur, enthält die Substanz in kleinen Portionen, nach jeder Zugabe, wirbeln, bis die Verbindung vollständig gelöst ist.
- Halten Sie bei der Auflösung die Lösung heiß aller Zeiten durch ruht es auf der Herdplatte zu. Fügen Sie mehr heiße Lösungsmittel als nötig - nicht gerade genug, um die Probe auflöst.
- Wenn ein Teil des Festkörpers nicht aufzulösen scheint, auch nach mehr heiße Lösungsmittel hinzugefügt wurde, dürfte aufgrund der Anwesenheit von sehr unlösliche Verunreinigungen. In diesem Fall stoppen Sie, Hinzufügen von Lösungsmittel und machen Sie eine heiße Filtration, bevor Sie fortfahren.
- Eine heiße Filtration, Falten ein Stück Filterpapier in eine geriffelte Kegelform und legen Sie sie in ein Glas stammlose Trichter.
- Die heiße Lösung, um Verdampfung im Verfahren ermöglichen fügen Sie eine 10-20 % Überschuss an heiße Lösungsmittel hinzu.
- Gießen Sie die Lösung durch das Papier. Wenn Kristalle jederzeit während des Prozesses zu bilden beginnen, fügen Sie einen kleinen Teil des warmen Lösungsmittel um sie aufzulösen.
3. Kühllösung die
- Legen Sie die Flasche mit der gelösten Verbindung auf eine Oberfläche, die nicht die Wärme Weg zu schnell, wie ein Papiertuch legen auf eine Tischplatte zu leiten.
- Decken Sie leicht die Küvette abkühlen um Verdunstung zu verhindern und zu verhindern, dass Staub in die Lösung fallen.
- Lassen Sie den Kolben ungestört, bis es auf Raumtemperatur abkühlt.
- Sobald die Kristalle gebildet haben, legen Sie die Lösung in ein Eisbad um sicherzustellen, dass der Höchstbetrag der Kristalle gewonnen wird. Die Lösungen sollten Links ungestört im Eisbad für 30 min bis 1 h, oder bis die Verbindung scheint völlig aus der Lösung kristallisieren haben.
- Wenn keine Kristallbildung ersichtlich ist, kann es durch Kratzen innen induziert werden Wände des Kolbens mit einem Glasstab oder durch das Hinzufügen einer kleinen Impfkristall der gleichen Verbindung.
- Wenn dies noch nicht funktioniert, dann wahrscheinlich zu viel Lösungsmittel verwendet wurde. Erwärmen der Lösung, erlauben einige des Lösungsmittels aus Kochen, dann abkühlen.
(4) zu isolieren und die Kristalle trocknen
- Legen Sie die kalte Flasche enthält die neu gebildeten Kristalle auf einem Benchtop.
- Decken Sie leicht die Flasche um Verdunstung zu verhindern und zu verhindern, dass Staub in die Lösung fallen.
- Isolieren Sie die Kristalle durch Vakuumfiltration mit Büchner oder Hirsch Trichter (Klemme der Kolben zu einem Ring stehen zuerst).
- Spülen Sie die Kristalle auf den Büchner-Trichter mit einer kleinen Menge von frischen, kalten Lösungsmittel (die gleichen Lösungsmittels für Rekristallisation) um eventuelle Verunreinigungen zu entfernen, die auf die Kristalle stecken kann.
- Um die Kristalle zu trocknen, lassen Sie sie in den Trichtereinsatz und ziehen Sie Luft durch sie für einige Minuten. Kristalle können auch luftgetrocknet werden, indem sie sich für mehrere Stunden oder Tage unbedeckt stehen. Eine effizientere Methoden gehören Vakuumtrocknung oder Platzierung in den Exsikkator gestellt.
| Polares Lösungsmittel | Weniger polares Lösungsmittel |
| Ethylacetat | Hexan |
| Methanol | Methylenchlorid |
| Wasser | Ethanol |
| Toluol | Hexan |
Tabelle 1. Allgemeine Lösungsmittel Paare.
Ergebnisse
Ein Beispiel für die Ergebnisse der Rekristallisation ist in Abbildung 2dargestellt. Die gelbe Verunreinigungen in die krude Mischung vorhanden wurde entfernt, und das reine Produkt bleibt als eine wollweiße Feststoff. Die Reinheit der umkristallisiert Verbindung nun von Kernresonanzspektroskopie (NMR) überprüft werden kann, oder wenn es eine Verbindung mit einem veröffentlichten Schmelzpunkt ist, wie ähnlich seinem Schmelzpunkt wird auf den Literatur-Schmelzpunkt. Bei Bedarf können mehrere Recrystallizations durchgeführt werden, bis die Reinheit akzeptabel hoch ist.

Abbildung 2. 2a) eine grobe Verbindung (links), 2 b) umkristallisiert Produkt vor der Filtration (Mitte) und 2 c) die gleiche Verbindung nach Rekristallisation (rechts).
Anwendung und Zusammenfassung
Rekristallisation ist eine Methode der Reinigung einer Verbindung durch die Beseitigung von Verunreinigungen, die mit ihm gemischt werden könnte. Es funktioniert am besten, wenn die Verbindung sehr gut in eine heiße Lösungsmittel löslich, aber in der kalten Version des gleichen Lösungsmittels sehr unlöslich ist. Die Verbindung muss eine solide bei Raumtemperatur. Rekristallisation dient oft als letzter Schritt bereinigen, nach anderen Methoden (z. B. Extraktion oder Spalte Chromatographie), die effektiv bei der Beseitigung größerer Mengen von Verunreinigungen, aber, dass nicht die Reinheit der letzten Verbindung auf ein ausreichend hohes Niveau erhöhen.
Rekristallisation ist die einzige Technik, die absolut rein, perfekte Einkristalle einer Substanz produzieren kann. Diese Kristalle einsetzbar für Röntgenstrahlanalyse, die die höchste Autorität in der Bestimmung der Struktur und dreidimensionale Form eines Moleküls ist. In diesen Fällen darf die Rekristallisation sehr langsam im Laufe von Wochen bis Monaten, erlauben das Kristallgitter zu bilden, ohne die Aufnahme von Verunreinigungen umgesetzt. Spezielle Glaswaren wird benötigt, um das Lösungsmittel so langsam wie möglich während dieser Zeit verdunsten, oder das Lösungsmittel mit einem anderen Lösungsmittel sehr langsam mischen in dem die Verbindung unlöslich ist (so genannte antisolvent Zusatz) zu ermöglichen.
Die Pharmaindustrie macht intensiven Gebrauch von Rekristallisation, auch, da es ein Mittel der Reinigung mehr als Säulenchromatographie leicht skaliert ist. 3 die Bedeutung der Rekristallisation in industriellen Anwendungen hat ausgelöst, Erzieher um Rekristallisation im Labor Curriculum zu betonen. 4 zum Beispiel ist das Medikament Stavudin, die verwendet wird, zur Verringerung der Auswirkungen von HIV in der Regel durch Kristallisation isoliert. 5 oft Moleküle haben mehrere verschiedene Kristallstrukturen vorhanden, so ist es notwendig für die Forschung zu beurteilen und zu verstehen, unter welchen Bedingungen, wie Kühlung, Preis, solvent Zusammensetzung und So weiter die Kristallform isoliert ist. Diese verschiedenen Kristallformen möglicherweise unterschiedliche biologische Eigenschaften oder in den Körper unterschiedlich schnell aufgenommen werden.
Ein häufiger Einsatz von Rekristallisation ist bei der Herstellung von Kandiszucker. Kandiszucker erfolgt durch Auflösen von Zucker in heißem Wasser bis hin zur Sättigung. Holzstäbchen befinden sich in der Lösung und die Lösung darf abkühlen lassen und langsam verdunsten. Nach einigen Tagen sind große Kristalle des Zuckers überall auf die Holzstäbchen gewachsen.
Referenzen
- Mayo, D. W.; Pike, R. M.; Forbes, D. C., Microscale organic laboratory : with multistep and multiscale syntheses. 5th ed.; J. Wiley & Sons: Hoboken, NJ, p xxi, 681 p (2011).
- Armarego, W. L. F.; Chai, C. L. L., Purification of laboratory chemicals. 5th ed.; Butterworth-Heinemann: Amsterdam ; Boston; p xv, 609 p (2003).
- Ray, P. C.; Tummanapalli, J. M. C.; Gorantla, S. R., Process for the large scale production of Stavudine. Google Patents: (2011).
- Hightower, T. R.; Heeren, J. D., Using a Simulated Industrial Setting for the Development of an Improved Solvent System for the Recrystallization of Benzoic Acid: A Student-Centered Project. Journal of Chemical Education 83 (11), 1663 (2006).
- Rohani, S.; Horne, S.; Murthy, K., Control of Product Quality in Batch Crystallization of Pharmaceuticals and Fine Chemicals. Part 1: Design of the Crystallization Process and the Effect of Solvent. Organic Process Research & Development 9 (6), 858-872 (2005).
Offenlegungen
- Mayo, D. W.; Pike, R. M.; Forbes, D. C., Microscale organic laboratory : with multistep and multiscale syntheses. 5th ed.; J. Wiley & Sons: Hoboken, NJ, p xxi, 681 p (2011).
- Armarego, W. L. F.; Chai, C. L. L., Purification of laboratory chemicals. 5th ed.; Butterworth-Heinemann: Amsterdam ; Boston; p xv, 609 p (2003).
- Ray, P. C.; Tummanapalli, J. M. C.; Gorantla, S. R., Process for the large scale production of Stavudine. Google Patents: (2011).
- Hightower, T. R.; Heeren, J. D., Using a Simulated Industrial Setting for the Development of an Improved Solvent System for the Recrystallization of Benzoic Acid: A Student-Centered Project. Journal of Chemical Education 83 (11), 1663 (2006).
- Rohani, S.; Horne, S.; Murthy, K., Control of Product Quality in Batch Crystallization of Pharmaceuticals and Fine Chemicals. Part 1: Design of the Crystallization Process and the Effect of Solvent. Organic Process Research & Development 9 (6), 858-872 (2005).
Tags
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Reinigen von Verbindungen durch Umkristallisation
Organic Chemistry
710.1K Ansichten

Einführung in die Katalyse
Organic Chemistry
34.6K Ansichten

Montage eines Reflux-Systems für beheizte chemische Reaktionen
Organic Chemistry
168.3K Ansichten

Durchführung von Reaktionen unterhalb der Raumtemperatur
Organic Chemistry
70.7K Ansichten

Übertragen von Lösungmitteln mit der Schlenk-Technik
Organic Chemistry
41.7K Ansichten

Entgasung von Flüssigkeiten mittels Freeze-Pump-Thaw Cycling
Organic Chemistry
56.3K Ansichten

Vorbereiten von wasserfreien Reagenzien und Geräten
Organic Chemistry
79.4K Ansichten

Trennen von Gemischen durch Ausfällung
Organic Chemistry
158.0K Ansichten

Fest-Flüssig-Extraktion
Organic Chemistry
238.1K Ansichten

Entfernung von Lösungsmitteln mit dem Rotationsverdampfer
Organic Chemistry
213.0K Ansichten

Fraktionierte Destillation
Organic Chemistry
334.8K Ansichten

Züchten von Kristallen für die Röntgenbeugungsanalyse
Organic Chemistry
32.9K Ansichten

Performing 1D Thin Layer Chromatography
Organic Chemistry
290.1K Ansichten

Säulenchromatographie
Organic Chemistry
360.9K Ansichten

Kernspinresonanzspektroskopie (NMR-Spektroskopie)
Organic Chemistry
248.9K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten