Method Article
Идентификация Kinesin-1 Грузы с помощью флуоресцентной микроскопии
В этой статье
Резюме
Здесь, протокол представлен для идентификации Кинезин-1 грузов. Безмоторных мутант тяжелой цепи Кинезин-1 (KIF5B) агрегирует в цитоплазме и индуцирует агрегацию его грузов. Оба агрегаты обнаруживаются при флуоресцентной микроскопии. Аналогичный подход может быть использован для идентификации грузов других моторных белков.
Аннотация
Fluorescence microscopy is employed to identify Kinesin-1 cargos. Recently, the heavy chain of Kinesin-1 (KIF5B) was shown to transport the nuclear transcription factor c-MYC for proteosomal degradation in the cytoplasm. The method described here involves the study of a motorless KIF5B mutant for fluorescence microscopy. The wild-type and motorless KIF5B proteins are tagged with the fluorescent protein tdTomato. The wild-type tdTomato-KIF5B appears homogenously in the cytoplasm, while the motorless tdTomato-KIF5B mutant forms aggregates in the cytoplasm. Aggregation of the motorless KIF5B mutant induces aggregation of its cargo c-MYC in the cytoplasm. Hence, this method provides a visual means to identify the cargos of Kinesin-1. A similar strategy can be utilized to identify cargos of other motor proteins.
Введение
Кинезин-1 представляет собой белок двигатель, который опосредует транспорт антероградную своих грузов 1,2. Это гетеротетрамер из двух субъединиц Кинезин легкой цепи 1 (KLC1) и двух субъединиц Кинезин тяжелых цепей (KHCs). KIF5B 1, а KHC, содержит домен электродвигателя с его N-терминала, который гидролизует АТФ и преобразует химическую энергию в механическую энергию для движения вдоль микротрубочек. Его С-концевая область содержит домен димеризации, который взаимодействует с KLC1, который связывает с грузами. Кинезин-1 транспортирует грузы, такие как пузырьки, органелл и мРНК 3,4. Недавно было показано, KIF5B транспортировать ядерного фактора транскрипции с-Мус для Протеосомальная деградации в цитоплазме 5. Были использованы три методики (химическая ингибитор, миРНК / shRNA и доминантно-негативный мутант) ингибировать Кинезин-1 функцию. Они все индуцированной агрегации с-Мус в цитоплазме. За последние методологии, с-Мус был затронут только доминирующей negatив мутант KIF5B, но не с тем, что из другой смежной KIF5A двигателя белка, предполагая, что мутант не оказывает общее воздействие на внутриклеточные компоненты (например, нарушения микротрубочек) или агрегации белка. Доминантно-негативный мутант KIF5B также не влияет другой фактор транскрипции, предполагая, что это не оказывает влияния на общие факторы транскрипции. Скорее всего, это говорит о том, что доминантно-негативный мутант оказывает специфическое воздействие на ее грузов.
Применение доминантных негативных мутантов распространен в области моторных белков. Похожие безмоторные мутанты кинезинов и миозинов ранее использовались. Они были в основном используется для демонстрации влияния мутантов на субклеточных локализаций их грузов или на клеточных функций 6-12. Меньше внимания уделялось пространственной взаимосвязи между мутантами и грузов, пострадавших от них. Тем не менее, в некоторых инцидентов, наблюдались мутанты со-локализуется с их саrgos 6,10.
Взаимодействие между KIF5B и связанных с ним белков была ранее подтверждена дрожжей в естественных условиях дигибридная анализа и биохимические выпадающие анализов, таких как совместное иммунопреципитации и в пробирке раскрывающихся анализов 13-16. В этой статье, дополнительный визуальный метод с использованием флуоресцентной микроскопии описана для идентификации KIF5B грузовых белков. Метод дает использование безмоторных KIF5B мутанта, который действует как доминантный негативный мутант. Это агрегаты в цитоплазме и индуцирует агрегацию его грузов.
Мечение дикого типа и безмоторных KIF5B мутанта с флуоресцентным белком tdTomato 17 позволяет их визуализацию с помощью флуоресцентной микроскопии. Маркированные KIF5B белки могут быть совместно выражены с белок-кандидат, слитого с другом флуоресцентного белка с спектральными свойствами соответствующим отделенных от KIF5B тега. Помеченные белки наблюдаются непосредственно в живых клеткахпод флуоресцентной микроскопии. Индукционная агрегации белка кандидата по безмоторных KIF5B мутанта подтвердит, что кандидат белок представляет собой грузов в естественных условиях KIF5B. Кроме того, tdTomato-меченных белков KIF5B может быть выражено в покое в клетках для изучения их воздействия на эндогенных грузовых белков. Позже, иммунофлюоресценции микроскопии проводится в котором трансфицированные клетки фиксировали и окрашивали специфическим антителом против эндогенного белка-кандидата с последующим соответствующим вторичным антителом, конъюгированным с флуоресцентным красителем. В этом случае, эндогенный белок-кандидат на ее физиологическом уровне изучена. Похожие безмоторные мутанты других моторных белков могут быть получены в целях выявления их грузов.
протокол
1. Клонирование tdTomato-меченый дикого типа и безмоторных KIF5B белков
- Amplify кДНК для человеческого дикого типа и безмоторных KIF5B белков с использованием праймеров в таблице 1, Taq ДНК-полимеразы (5 единиц для 100 мкл), дНТФ смесь (2 мМ каждого дезоксинуклеотид) и его буфер 10X в течение 30 циклов. Каждый цикл состоит из стадии денатурации (95 ° C в течение 30 сек), стадии отжига (45 ° С в течение 30 сек) и дополнительному этапу (72 ° C в течение 3 мин).
- Экстракт амплифицированного продукта ДНК равным объемом смеси фенол / хлороформ (1: 1).
Примечание: Фенол является горючим и может вызвать ожоги. Хлороформ является опасным. Избегайте прямого контакта с ними и использовать их под химическом вытяжном шкафу. Альтернативно, ПЦР-продукты могут быть очищены с помощью различных наборов.- Спин при 18000 х г в микроцентрифуге при комнатной температуре в течение 1 мин. Передача водный раствор в новую пробирку и экстрагировали равным объемом хлороформа.
- Вращениепри 18000 х г в микроцентрифуге при комнатной температуре в течение 0,5 мин. Передача водный раствор в новую пробирку.
- Смешайте водного раствора с одной десятой объема 3 М Na-ацетата и двух объемов абсолютного этанола.
- Спин при 18000 х г в микроцентрифуге при комнатной температуре в течение 5 мин. Отменить водного раствора.
- Промыть ДНК гранул с двумя объема 75% этанола. Отменить водного раствора и просушить на воздухе осадка ДНК при комнатной температуре в течение 5 мин. Ресуспендируют ДНК гранул в 34 мкл воды.
- Дайджест амплифицированных продуктов в конечном объеме 40 мкл с рестриктазами SalI (10 единиц) и BamHI (10 единиц) и 4 мкл 10X буфера их при 37 ° С в течение двух часов. Решить переваренных продуктов в агарозном геле (1,0% при 100 V), содержащих этидий бромид (0,2 мкг / мл).
Примечание: этидий бромид является мощным мутагенным и может всасываться через кожу. Поэтому, важно, чтобы избежать прямого или косвенного контакта шIth этидийбромид. - Вырежьте правильные полосы для очистки колоннами. Взвесить агарозном геле, содержащий фрагмент ДНК. Затем растворить его в солюбилизации буфером (300 мкл для 0,1 г) при 37 ° С в течение около 20 мин.
- Добавить получившуюся раствора в колонку и спина в микроцентрифуге при комнатной температуре в течение 5 сек. Откажитесь от проточных.
- Промыть колонку с буфером для солюбилизации 0,5 мл, повторяя шаг 1.5. Промыть колонку снова 0,75 мл промывочного буфера путем повторения этапов с 1.5. Спин колонку в течение 2 мин, чтобы избавиться от оставшегося промывочного буфера.
- Элюции фрагмент ДНК с 50 мкл воды, повторяя шаг 1.5. Оценить концентрацию фрагмента ДНК, запустив аликвоты ней против размера ДНК лестнице в агарозном геле (1,0% при 100 V), содержащего бромид этидия (0,2 мкг / мл).
- Перевязывать очищенные продукты (около 100 нг) с вектором ptdTomato-C1 17 (около 100 нг), предварительно расщепленной гое же ферменты рестрикции в 10 мкл с использованием ДНК-лигазы Т4 (2000 единиц) и 1 мкл 10х буфера для лигирования при комнатной температуре в течение 16 ч.
Примечание: дикого типа и безмоторных мутант содержит аминокислоты от 2 до 963 и 584 до 963, соответственно. Ранее большая безмоторных KIF5B мутант был использован для идентификации его функции 9. Меньший безмоторных KIF5B мутант был использован для настоящих исследований, чтобы увеличить свои уровни экспрессии.
2. Иммунофлуоресценции микроскопия
- Для живых клеток или косвенного флуоресценции визуализации с увеличением при температуре не выше 40Х, семена 0,2-0,3 млн HeLa клеток в 1 мл полной среды [Дульбекко в модификации Дульбекко (DMEM), с добавлением 10% фетальной телячьей сыворотки (FBS)] в каждую лунку шесть-луночного планшета. Grow при 37 ° С с 5% CO 2.
- Для косвенных исследований иммунофлюоресценции с увеличениях выше 40Х, мыть покровные стекла (18 мм х 18 мм; 1,5 толщины) в абсолютном кратко этанола и воздушно-сухой их влунки шесть-луночного планшета, внутри шкафа биобезопасности, чтобы избежать загрязнения.
- Семенной 0,2-0,3 миллиона клеток в 1 мл DMEM завершить среду в каждую лунку шесть-луночного планшета.
- Подготовка трансфекции комплекса
- На следующий день, в шкафу биологической безопасности, разбавленные 0,6 мкг (всего) из плазмиды экспрессии для tdTomato-меченой дикого типа или безмоторных KIF5B в присутствии или в отсутствие плазмиды экспрессии для кандидата грузов белка (pTagCFP-с-Мус 5 ) с 0,1 мл трансфекции среды в 1,6 мл трубки микроцентрифужных.
Примечание: Вектор pTagCFP-с-Мус выражает TagCFP-меченый с-Мус. - Добавить 1,8 мкл реагента для трансфекции до 0,1 мл трансфекции среду в другом 1,6 мл микроцентрифужных трубки. Как правило, подготовить мастер смеси разбавленного трансфекции реагента достаточно для 12 образцов.
- Инкубируйте в течение 5 мин, при комнатной температуре.
- Добавить разбавленный 0,1 мл трансфекции реагента разбавленных 0,1 мл ДНК. мих содержимое путем обращения трубки. Спин пробирки в течение 5 сек в микроцентрифуге.
- Инкубируйте в течение 45 мин, при комнатной температуре.
- На следующий день, в шкафу биологической безопасности, разбавленные 0,6 мкг (всего) из плазмиды экспрессии для tdTomato-меченой дикого типа или безмоторных KIF5B в присутствии или в отсутствие плазмиды экспрессии для кандидата грузов белка (pTagCFP-с-Мус 5 ) с 0,1 мл трансфекции среды в 1,6 мл трубки микроцентрифужных.
- Мойка клеток
- Промыть затравочный клеткам трижды фосфатно-солевым буфером (PBS) в течение инкубационного периода для формирования трансфекции комплекса.
- Заменить посредство посеянных клеток в каждой лунке с 0,8 мл подогретого трансфекции средних. Возврат пластин в инкубатор при 37 ° С.
- Трансфекции клеток
- После инкубации 45 мин, добавить 0,2 мл комплекса реагента ДНК / трансфекции (полученного на стадии 2.3) по каплям в каждую лунку пластины.
- Рок 6-луночного планшета мягко в течение 5 сек, прежде чем они будут возвращены в инкубаторе при температуре 37 ° С.
- После 6-8 ч, заменить жидкость с полной среде DMEM.
- Для живых клеток флуоресцентной томографии 18
- После дополнительного 16 ч инкубации ат 37 ° С, добавить ДНК интеркалирования пятно Hoechst 33342 к среде до конечной концентрации 1 мкМ.
Примечание: Hoechst 33342 представляет собой клетку-проницаема, ДНК Интеркалирующий краситель, который окрашивает клеточные ядра. - Инкубируйте трансфицированных клеток в течение 10 мин в инкубаторе при 37 ° С, прежде чем рассматривать их для выражения флуоресцентных белков методом флуоресцентной микроскопии с использованием объектива 40X. Наборы фильтров для DAPI, CFP, FITC и Су3 являются (Ex350 нм / Em460 нм), (Ex436 нм / Em480 нм), (Ex470 нм / Em525 нм) и (Ex545 нм / Em605 нм), соответственно.
Примечание: Если фон достаточно высок из автофлуоресценции части полной среде DMEM, используется среда без фенола красного.
- После дополнительного 16 ч инкубации ат 37 ° С, добавить ДНК интеркалирования пятно Hoechst 33342 к среде до конечной концентрации 1 мкМ.
3. Для непрямой иммунофлуоресценции исследований
- Получение параформальдегида
- Взвесьте параформальдегида порошок (4 г на 100 мл PBS) и добавить его в PBS.
Примечание: параформальдегид является легковоспламеняющимся твердым и потенциальный Хазарский ракд. Это раздражает глаза, дыхательные пути и кожу. Поэтому, важно, чтобы избежать контакта с пылью или вдыхание параформальдегида. - Добавить NaOH к раствору (150 мкл 10 N NaOH / 100 мл).
- Хранить раствор при 37 до 42 ° С в течение 2-3 ч при периодическом встряхивании.
- Регулировка рН до 7,0 путем добавления ледяной уксусной кислоты к раствору (около 75 мкл / 100 мл), после порошка параформальдегида растворяли.
- Взвесьте параформальдегида порошок (4 г на 100 мл PBS) и добавить его в PBS.
- Белки-мишени Окрашивание
- После дальнейшей инкубации в течение 16 ч при 37 ° С, мыть трансфектированных клеток при комнатной температуре один раз ЗФР с закрученной шесть-луночного планшета в течение 5 сек.
- Fix клеток с 1 мл свежеприготовленного, 4% раствора параформальдегида на лунку. Инкубируйте при комнатной температуре в течение 30 мин.
- Вымойте клеток с PBS один раз, вращая в течение 5 сек шесть-луночного планшета. Отменить решение.
- Инкубируйте клетки с 1 мл 0,1% Тритон-Х 100 (в PBS) при комнатной температуре в течение 30 мин. Detergent Triton-X 100 будет проницаемыми клеточные мембраны, чтобы разрешить доступ антител к их внутриклеточных мишеней.
- Вымойте клеток с PBS четыре раза взбалтывая шесть-луночного планшета в течение 5 секунд каждый раз. Отменить решение после каждой стирки.
- Инкубируйте клетки с 1 мл первичных антител (C-MYC кролика антителом или р53 мыши; 0,1 мкг / мл) в 10% FBS в растворе PBS при комнатной температуре с помощью качалки в течение 4 ч.
- Промыть PBS четыре раза взбалтывая шесть-луночного планшета в течение 5 секунд каждый раз. Отменить решение после каждой стирки.
- Инкубируйте 1 мл флуоресцентных красителей, конъюгированных вторичных антител (Alexa Fluor 488-сопряженных анти-кроличьими или анти-мышиного IgG антитела; 0,5 мкг / мл) в 10% FBS в PBS при комнатной температуре в темноте покачиванием в течение 2 ч.
- Промыть PBS четыре раза взбалтывая шесть-луночного планшета в течение 5 секунд каждый раз. Отменить решение после каждой стирки.
- Ядерное окрашивание и монтажа
- Инкубируйте клетки с 1 мл ДНК интеркалирующего красителя 4 ', 6-диамидино-2-фенилиндола (DAPI; 0,5 мкг / мл) в PBS при комнатной температуре, в темноте в течение 10 мин. Перейдите к шагу 3.4, когда не используются ни одной покровные стекла.
- Применить 10 мкл решение для монтажа на каждом предметном стекле микроскопа. Установите каждый покровного стекла над монтажной раствора на предметном стекле.
- Инкубируйте при комнатной температуре в темноте в течение ночи.
- Печать края покровного стекла с лаком для ногтей. Поместите в темноте внутри вытяжного шкафа в течение ночи, чтобы удалить лак для ногтей паров.
Примечание: DAPI является ДНК Интеркалирующий краситель, который окрашивает клеточные ядра. - Флуоресцентной микроскопии 19
- На следующий день, изучить клетки от флуоресцентной микроскопии с использованием объектива 40X. Наборы фильтров для DAPI, CFP, FITC и Су3 являются (Ex350 нм / Em460 нм), (Ex436 нм / Em480 нм), (Ex470 нм / Em525 нм) и (Ex545 нм / Em605 нм), соответственно.
Результаты
Выражается Экзогенно дикого типа KIF5B появились гомогенно в цитоплазме, в то время как с-Мус появились в основном в ядре (фиг.1А). Тем не менее, безмоторные KIF5B мутант комочков в цитоплазме (рис 1А). Агрегация безмоторных KIF5B индуцированной агрегации с-Мус. Процент клеток, экспрессирующих агрегируются TagCFP-меченый с-Мус в клетках, экспрессирующих дикого типа KIF5B была низкой. Тем не менее, он был значительно выше, когда безмоторных KIF5B был совместно выразили (рис 1а). Наблюдается совместная локализация мутантного KIF5B с с-Мус (Рисунок 1) показывает, что KIF5B регулирует внутриклеточную локализацию с-Мус и с-Мус является груз Kinesin-1. Отрицательные контроли, в которых были выражены в покое конструкты включены в нижней панели фиг.1А. Полученные результаты показывают, что не было никакого существенного проступание флуоресцентной emissioп. Безмоторных KIF5B также индуцированной агрегации эндогенного с-Мус (Фиг.1В) и фактора транскрипции р53 (Рис.2), что указывает на с-Мус и р53 являются как грузы кинезина-1 и KIF5B регулирует внутриклеточную локализацию обоих эндогенных белков. Вместе с результатами, что ингибитор Кинезин-1 бенгалроза лактон (RBL) образование 20 индуцирует видов с высокой молекулярной массой и для с-Мус и p53 5, p53, скорее всего, груз Kinesin-1. Интересно отметить, что ядерный фактор транскрипции р53, как с-Мус, также экспортируется из ядра в цитоплазму для деградации протеосомной 21,22. Движение факторов транскрипции по KIF5B кажется, быть конкретными, поскольку выражение безмоторных KIF5B мутанта не влияет на внутриклеточную локализацию с-Fos, или вызывать его агрегировать (рисунок 3). Приведенные данные показывают, что метоd занятых в этой публикации позволяет идентифицировать высокого специфичности Кинезин-1 грузов. Аналогичный подход может быть применен к другим моторных белков, а также.
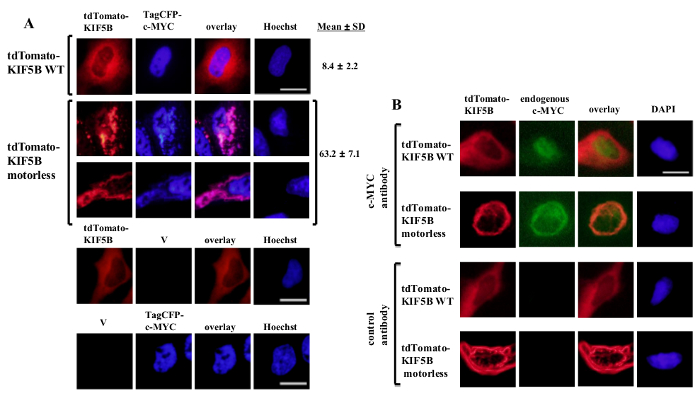
Рисунок 1: Экспрессия безмоторных KIF5B мутанта вызывает агрегацию с-Мус в цитоплазме (A) клетки HeLa трансфицировали tdTomato-меченый дикого типа (WT) KIF5B (красный) и TagCFP-меченой с-Мус (синий).. tdTomato-меченый WT KIF5B появились в основном в цитоплазме, в то время как TagCFP-меченый с-Мус появились в основном в ядре. Тем не менее, tdTomato-меченый безмоторных KIF5B мутант (красный) формируется нитевидные или точечные агрегатов в цитоплазме. Экспрессия безмоторных KIF5B индуцированной агрегации с-Мус. Мутант KIF5B и с-Мус колокализуются вместе (розовый). Проценты клеток (%) указали, агрегаты CFP-с-Мус (%) приведены. Результаты показаны в± стандартное отклонение (N = 3). Отрицательные контроли с выражением tdTomato-меченых белков или KIF5B TagCFP-меченой с-Мус вместе с пустыми векторы (V) приведены в нижней панели. (B) Аналогичные результаты были получены с эндогенным с-Мус (зеленый), когда были выражены tdTomato-меченый WT или безмоторные KIF5B белки (красный). TdTomato-меченый безмоторных KIF5B мутант комочков в цитоплазме и индуцированной агрегации эндогенного с-Мус. Оба вида агрегатов колокализуются вместе в цитоплазме (оранжевый). Ядра окрашивали красителем Hoechst 33342 или DAPI. Измерительная линейка; 20 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуре.

Рисунок 2: Экспрессия безмоторных KIF5B мутанта вызывает агрегацию эндогенного p53 в тон цитоплазме. В клетках HeLa, экзогенный tdTomato-меченый дикого типа (WT) KIF5B (красный) появились в основном в цитоплазме, в то время как эндогенные p53 (зеленый) появились в основном в ядре. В противоположность этому, tdTomato-меченый безмоторных KIF5B мутант (красный) формируется агрегатов в цитоплазме. Экспрессия безмоторных KIF5B индуцированной агрегации р53, в результате чего совместно локализации KIF5B и р53 в цитоплазме (желтый). Эксперимент проводился трижды. Ядра окрашивали DAPI красителя. Измерительная линейка; 20 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуре.
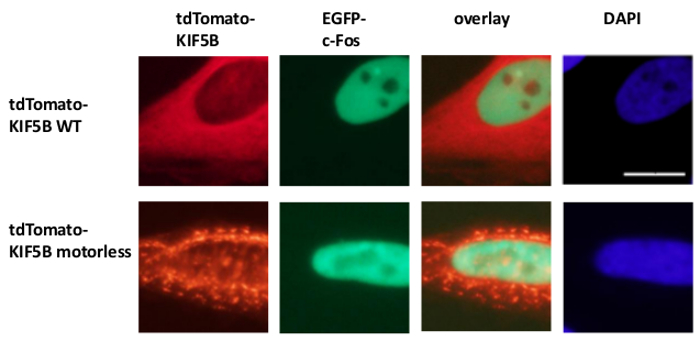
Рисунок 3:. Экспрессия безмоторных KIF5B мутанта не индуцирует агрегацию с-Fos в цитоплазме tdTomato-меченый дикого типа (WT) KIF5B (красный) появилисьв основном в цитоплазме клеток HeLa, в то время как EGFP-с-Fos (зеленый) появились в основном в ядре. Напротив, то tdTomato-меченый безмоторных KIF5B мутант (красный) формируется агрегатов в цитоплазме. Экспрессия безмоторных KIF5B не вызывает агрегацию с-Fos. Эксперимент проводился в четыре раза. Ядра клеток окрашивали DAPI красителя. Измерительная линейка; 20 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуре.
| общий обратный праймер | 5'-AGAGGATCCTTACACTTGTTTGCCTCCTC-3 ' |
| дикого типа KIF5B прямой праймер | 5'AGAGTCGACGCGGACCTGGCCGAGTGCAACATCAAAGT-3 ' |
| безмоторных KIF5B прямой праймер | 5'AGAGTCGACGATGAAGAGTTCACTGTTGC-3 ' |
Таблица 1: Последовательности праймеров для клонирования мышей дикого типа и безмоторных KIF5B белки.
Обсуждение
Описанный способ использует свойства безмоторных KIF5B мутанта, в котором отсутствует способность двигаться вдоль микротрубочек, но сохраняет способность образовывать димеры с дикого типа KIF5B и, тем самым, позволит Тетрамерная белок взаимодействовать с теми же грузовых белков как дикого типа KIF5B. Безмоторных KIF5B, следовательно, выступает в качестве доминантной негативной мутанта и форм mislocalized агрегатах с ее грузов. Этот метод доказал, чтобы определить Кинезин-1 грузовой с-Мус (рисунок 1) 5. В этой статье, то же самое безмоторных KIF5B мутант был использован для идентификации р53 в качестве еще одного потенциального грузом Kinesin-1 (рисунок 2). Это показывает, что технология целесообразной для выявления других грузов из Kinesin-1. Кроме того, специфичность мутанта обеспечивается отсутствием эффекта мутанта на отрицательном контрольного белка с-Fos (рисунок 3).
В этом протоколе, tdTomato-меченый дикого тиПЭ или безмоторных белок KIF5B является коэкспрессируются с другим флуоресцентным белком-меченый кандидат грузового белка. В этом случае, живых клеток флуоресцентной микроскопии и визуализации выполняются. Образование агрегатов можно проследить покадровой обработки. Альтернативно, tdTomato-меченый белок экспрессируется в покое и белок грузов кандидат на своих физиологических уровней визуализируется путем косвенного иммунофлуоресцентного микроскопии с использованием специфических антител. Флуоресцентный белок tdTomato выбран за его яркости и светостойкости 17. Если фон достаточно высок из автофлуоресценции части полной среде DMEM, используется среда без фенола красного.
Безмоторных KIF5B мутантных форм димеры с дикого типа KIF5B стехиометрически. Поэтому крайне важно, чтобы выразить достаточное количество безмоторных KIF5B мутанта с образованием димеров с дикого типа аналога ингибировать свою функцию и образовывать агрегаты. Чтобы решить эту проблему, оптимизацию выражession из безмоторных мутанта является существенным. Это достигается с помощью небольшого безмоторных мутант, содержащий домен димеризации. Кроме того, оптимизация соответствующей трансфекции реагента и протокола также необходим. Продолжительность инкубации клеток HeLa с реагентом ДНК / трансфекции оптимизировали в клетках HeLa для экспрессии экзогенных белков и жизнеспособности клеток. Продолжительность инкубации может должны быть оптимизированы для других клеточных линий.
Для увеличениях между 4х до 40х, никаких покровные стекла не требуется. Клетки могут быть непосредственно рассмотрены в лунках. Следовательно, в этом случае протокол является недорогой и удобной. Для увеличениях выше 40Х, клетки выращивают на покровных стекол в скважинах и после окрашивания, смонтированы на предметных стеклах для исследования под целей масло погружения.
Наблюдение агрегатов безмоторных белка KIF5B ограничена размером цитоплазме. Нетрудно обнаружитьагрегаты во многих клетках млекопитающих. Тем не менее, это относительно трудно наблюдать агрегаты в нейрональных клетках, когда объем цитоплазмы невелик вокруг ядер и в невритов.
Протокол используется, чтобы показать связь между KIF5B и ее грузов в дополнение к в естественных дрожжей двух гибридных и биохимических раскрывающихся анализов 13-16. Все эти анализы определения связи при различных физических условиях и их результаты могут дополнять друг друга. Кроме того, преимуществом этого флуоресценции анализа над другим анализам, что он может показать регуляцию внутриклеточной локализации грузов по KIF5B (фиг.1 и 2).
Протокол не ограничивается KIF5B и может быть использован для идентификации грузов других моторных белков, таких как некоторые другие кинезиновых двигателей 3 и некоторые из миозина двигателей 23,24 используемых в внутриклеточного транспорта грузов 3, Эти моторные белки также содержат двигательные домены для движения вдоль микротрубочек для кинезиновых двигателей и микрофиламентов для миозина двигателей и сегментов биспиральных для олигомеризации. Большинство из них образуют гомодимеры 3,23. Поэтому, аналогичную стратегию можно применить к ним посредством создания их безмоторных доминантных негативных мутантов, чтобы определить их грузов.
Раскрытие информации
Свободная публикация доступа и производство этой статье осуществляется за счет Roche.
Благодарности
Roche's Publication Grant covered the Free Access publication and production of this article. The author also thanks E. Premkumar Reddy, Richard V. Mettus, Stephen C. Cosenza, Sau Ying Yip and Sol D. Gloria for their support and critical reading of the manuscript.
Материалы
| Name | Company | Catalog Number | Comments |
| absolute ethanol (200 proof) | Fisher Scientific | BP2818 | |
| DAPI | Sigma-Aldrich | D9542 | |
| Hoechst 33342 | Sigma-Aldrich | B2261 | |
| Opti-MEM-I (transfection medium) | Life Technologies | 51985 | |
| ProLong Diamond Antifade Mountant | Life Technologies | P36961 | |
| formaldehyde, para | Fisher Scientific | O4042-500 | |
| Triton-X100 | Fisher Scientific | BP151-500 | |
| X-tremeGENE 9 DNA Transfection Reagent | Roche | 6365787001 | |
| Taq DNA polymerase | Life Technologies | 10342020 | |
| PCR Grade Nucleotide Mix (dNTP Mix) | Roche | 12111424 | |
| Microscope cover glass | Fisher Scientific | 12-541A | |
| GeneRuler 1 kb Plus DNA ladder | Life Technologies | SM1333 | |
| PureLink Quick Gel Extraction kit | Life Technologies | K210012 | |
| BamHI | New England Biolab | R0136 | |
| SalI | New England Biolab | R0138 | |
| T4 DNA ligase | New England Biolab | M0202T | |
| Ethidium bromide | Thermo Scientific | 17898 | |
| DMEM | Life Technologies | 11995-065 | |
| c-MYC rabbit antibody | Cell Signaling | 5606 | |
| p53 mouse antibody | Santa Cruz | sc-126 | |
| Alexa Fluor 488-conjugated anti-rabbit IgG antibody | Life Technologies | A11008 | |
| Alexa Fluor 488-conjugated anti-mouse IgG antibody | Life Technologies | A11059 | |
| fluorescent microscope | Olympus IX71_Fluoview | ||
| computer software for imaging | cellSens |
Ссылки
- Hirokawa, N., Niwa, S., Tanaka, Y. Molecular motors in neurons: transport mechanisms and roles in brain function, development, and disease. Neuron. 68, 610-638 (2010).
- Yu, Y., Feng, Y. M. The role of kinesin family proteins in tumorigenesis and progression: potential biomarkers and molecular targets for cancer therapy. Cancer. 116, 5150-5160 (2010).
- Verhey, K. J., Hammond, J. W. Traffic control: regulation of kinesin motors. Nat Rev Mol Cell Biol. 10, 765-777 (2009).
- Hirokawa, N., Noda, Y., Tanaka, Y., Niwa, S. Kinesin superfamily motor proteins and intracellular transport. Nat Rev Mol Cell Biol. 10, 682-696 (2009).
- Lee, C. M. Transport of c-MYC by Kinesin-1 for proteasomal degradation in the cytoplasm. Biochim Biophys Acta. 1843, 2027-2036 (2014).
- Bittins, C. M., Eichler, T. W., Hammer, J. A., Gerdes, H. H. Dominant-negative myosin Va impairs retrograde but not anterograde axonal transport of large dense core vesicles. Cell Mol Neurobiol. 30, 369-379 (2010).
- Kimura, T., Watanabe, H., Iwamatsu, A., Kaibuchi, K. Tubulin and CRMP-2 complex is transported via Kinesin-1. J Neurochem. 93, 1371-1382 (2005).
- Lindsay, A. J., McCaffrey, M. W. Myosin Va is required for the transport of fragile X mental retardation protein (FMRP) granules. Biol Cell. 106, 57-71 (2014).
- Rivera, J., Chu, P. J., Lewis, T. L., Arnold, D. B. The role of Kif5B in axonal localization of Kv1 K(+) channels. Eur J Neurosci. 25, 136-146 (2007).
- Roland, J. T., Kenworthy, A. K., Peranen, J., Caplan, S., Goldenring, J. R. Myosin Vb interacts with Rab8a on a tubular network containing EHD1 and EHD3. Mol Biol Cell. 18, 2828-2837 (2007).
- Uchida, A., Alami, N. H., Brown, A. Tight functional coupling of kinesin-1A and dynein motors in the bidirectional transport of neurofilaments. Mol Biol Cell. 20, 4997-5006 (2009).
- Zadeh, A. D., et al. Kif5b is an essential forward trafficking motor for the Kv1.5 cardiac potassium channel. J Physiol. 587, 4565-4574 (2009).
- Su, Y. Y., et al. KIF5B promotes the forward transport and axonal function of the voltage-gated sodium channel Nav1.8. J Neurosci. 33, 17884-17896 (2013).
- Lalioti, V. S., Vergarajauregui, S., Tsuchiya, Y., Hernandez-Tiedra, S., Sandoval, I. V. Daxx functions as a scaffold of a protein assembly constituted by GLUT4, JNK1 and KIF5B. . J Cell Physiol. 218, 416-426 (2009).
- Cho, K. I., et al. Association of the kinesin-binding domain of RanBP2 to KIF5B and KIF5C determines mitochondria localization and function. Traffic. 8, 1722-1735 (2007).
- Diefenbach, R. J., Diefenbach, E., Douglas, M. W., Cunningham, A. L. The ribosome receptor, p180, interacts with kinesin heavy chain, KIF5B. Biochem Biophys Res Commun. 319, 987-992 (2004).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat Biotechnol. 22, 1567-1572 (2004).
- Waters, J. C. Live-cell fluorescence imaging. Methods Cell Biol. 114, 125-150 (2013).
- Sanderson, M. J., Smith, I., Parker, I., Bootman, M. D. Fluorescence microscopy. Cold Spring Harb Protoc. 2014, (2014).
- Hopkins, S. C., Vale, R. D., Kuntz, I. D. Inhibitors of kinesin activity from structure-based computer screening. Biochemistry. 39, 2805-2814 (2000).
- Zhang, Y., Xiong, Y. Control of p53 ubiquitination and nuclear export by MDM2 and ARF. Cell Growth Differ. 12, 175-186 (2001).
- Michael, D., Oren, M. The p53-Mdm2 module and the ubiquitin system. Semin Cancer Biol. 13, 49-58 (2003).
- Kneussel, M., Wagner, W. Myosin motors at neuronal synapses: drivers of membrane transport and actin dynamics. Nat Rev Neurosci. 14, 233-247 (2013).
- Maravillas-Montero, J. L., Santos-Argumedo, L. The myosin family: unconventional roles of actin-dependent molecular motors in immune cells. J Leukoc Biol. 91, 35-46 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены