Method Article
Валидируемый анализ капельной цифровой полимеразной цепной реакции для обнаружения аденоассоциированных вирусных векторов в исследованиях биопролития слез
В этой статье
Резюме
Здесь мы представляем протокол для разработки и валидации надлежащей лабораторной практики в области совместимого обнаружения аденоассоциированных вирусных векторов в слезах человека с помощью капельной цифровой полимеразной цепной реакции в поддержку клинической разработки векторов генной терапии.
Аннотация
Использование вирусных векторов для лечения генетических заболеваний значительно возросло в последние годы, и на сегодняшний день зарегистрировано более 2000 исследований. Аденоассоциированные вирусные (AAV) векторы нашли особый успех в лечении заболеваний, связанных с глазами, о чем свидетельствует одобрение voretigene neparvovec-rzyl. Чтобы вывести на рынок новые методы лечения, регулирующие органы обычно запрашивают квалифицированные или подтвержденные исследования биовыделения для оценки высвобождения переносчика в окружающую среду. Тем не менее, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США не выпустило никаких официальных руководств по разработке молекулярных анализов для поддержки таких исследований выделения, что позволяет разработчикам определять для себя лучшие практики. Целью этого протокола является представление валидируемого протокола для обнаружения векторов AAV в слезах человека с помощью капельной цифровой полимеразной цепной реакции (ddPCR) в поддержку клинических исследований биовыделения. В этой рукописи обсуждаются современные отраслевые подходы к валидации молекулярного анализа и демонстрируется, что метод превосходит целевые критерии приемлемости анализа, предложенные в настоящее время в официальных документах. Наконец, обсуждаются шаги, имеющие решающее значение для выполнения любого анализа ddPCR, независимо от применения.
Введение
Определения генной терапии варьируются, но, как правило, индуцируют преднамеренное и часто ожидаемое постоянное чередование определенной последовательности ДНК клеточного генома для модификации или манипулирования экспрессией гена или для изменения биологических свойств живой клетки с клинической целью 1,2. Вирусные векторы все чаще используются в качестве носителей для генной терапии из-за их эффективности трансдукции, при этом в одном отчете предполагается, что более 70% текущих клинических испытаний генной терапии используют вирусные векторы3. Интерес к вирусным векторам для генной терапии неуклонно растет. В ежеквартальном отчете за 4 квартал 2022 года о ландшафте генной, клеточной и РНК-терапии от Американского общества генной и клеточной терапии сообщается, что в 2022 году конвейер генной, клеточной и РНК-терапии от доклинической до предварительной регистрации вырос на 7%, в результате чего общее количество разрабатываемых методов лечения достигло 3 726, из которых 2 053 (55%) были генной терапией4. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (США FDA) в настоящее время одобрило 27 клеточных и генных терапий для клинического использования у людей, пять из которых специально используют вирусные векторы5.
Аденоассоциированные вирусы (AAV) приобрели особый интерес в качестве носителей генной терапии. Недавний метаанализ показал, что за последние два десятилетия было проведено около 136 клинических испытаний, в которых изучалось использование AAV6. Кроме того, три из пяти США одобренных FDA генных терапий основаны на AAV. Это связано с их высокой редактируемостью, широким диапазоном хозяев, который может быть настроен на основе использования конкретных встречающихся в природе или искусственно модифицированных векторов, низкой патогенностью и токсичностью для людей и, как правило, низкой иммуногенностью 7,8. AAV также успешно используются для лечения глазных заболеваний в утвержденных клинических условиях. Voretigene neparvovec-rzyl — это терапия на основе AAV2, которая была одобрена США FDA в 2017 году и Европейским агентством по лекарственным средствам (EMA) в 2018 году для лечения биаллельной дистрофии сетчатки, связанной с мутацией RPE65 9.
С ростом интереса к разработке методов лечения на основе AAV возникает необходимость в нормативном руководстве по анализам. Точное обнаружение и количественная оценка любого вирусного вектора является неотъемлемой частью этапов открытия, производства и доклинических/клинических испытаний разработки продукта. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) США приступило к выпуску некоторых руководств по генной терапии, в том числе по химии, производству и контролю за применением новых лекарственных препаратов в области генной терапиичеловека 10, долгосрочному наблюдению после введения генной терапии11, тестированию ретровирусов с функциейрепликации 12 и рекомендациям по микробным векторам, используемым в генной терапии13. EMA также выпустило ряд руководящих принципов, касающихся разработки продуктов генной терапии, которые в целом соответствуют рекомендациям FDA, хотя существуют некоторые различия14. Важно отметить, что, хотя эти рекомендации не устанавливают юридически обязательных обязанностей, за исключением случаев, когда упоминаются конкретные правила, они вносят ясность в текущее мышление регулирующих органов по этой теме и их ожидания в отношении анализов, необходимых для подачи заявок на лекарственные средства и одобрения регулирующими органами.
FDA специально рекомендует проводить исследования для оценки распределения, стойкости и клиренса вектора от места введения к целевым и неглазным тканям, внутриглазным жидкостям и крови15. Они принимают форму исследований биораспределения и линьки. Исследования биораспределения оценивают воздействие, исследуя, как продукт распространяется по всему телу пациента от места введения. Линька специально оценивает высвобождение продукта пациентом в окружающую среду и повышает вероятность передачи переносчика нелеченным лицам16. FDA дает рекомендации по разработке исследований биораспределения и выделения в отношении частоты сбора образцов, продолжительности сбора образцов, типов собранных образцов и условий хранения.
Кроме того, FDA рекомендует использовать количественную полимеразную цепную реакцию (кПЦР или ПЦР в реальном времени) для количественного обнаружения векторных геномов из-за ее простоты выполнения, высокопроизводительного формата, быстрого времени обработки и чувствительности анализа. Тем не менее, существует относительное отсутствие рекомендаций по разработке и оценке эффективности молекулярных методов по сравнению с теми, которые существуют для малых и больших молекул. Многие из руководящих принципов для таких исследований трудно применить к молекулярным методам из-за уникального и сложного дизайна как продуктов, так и самих анализов, что вызывает вопросы относительно уместности доступных платформ для рекомендуемых оценок и соответствующих методов проверки анализа. На сегодняшний день FDA не требует формальной валидации анализов на основе ПЦР, хотя EMA ввело это требование17. В свете этого пробела различные группы и семинары выпустили официальные документы и рекомендации, которым производители и контрактные исследовательские организации стремились следовать 18,19,20,21,22,23,24,25. Большинство из этих рекомендаций написаны специально с учетом анализов qPCR, с предложениями или изменениями для новых платформ, таких как капельная цифровая ПЦР (ddPCR), включенными только в том случае, если это будет сочтено уместным. Более поздние рекомендации были сосредоточены на соображениях для анализов ddPCR, но в основном были сосредоточены на их применении для количественной оценки векторного генома в производственных условиях, а не в сложных биологических матрицах, встречающихся в исследованиях биовыделения.
В зависимости от клинического применения и целей ддПЦР может быть предпочтительнее кПЦР для поддержки исследований биораспределения и выделения из-за повышенной чувствительности ddPCR и способности обрабатывать матричную интерференцию по сравнению с кПЦР. Кроме того, благодаря разделению образцов примерно на 20 000 капель точная количественная оценка числа копий может быть достигнута без использования стандартной кривой с использованием статистики Пуассона, что упрощает разработку и проверку метода. Целью этого протокола является описание стандартизированного подхода к разработке и валидации метода на основе ddPCR для обнаружения векторов AAV в слезах, собранных с поверхности глаза, в поддержку клинических исследований биовыделения.
протокол
1. Получение синтетического фрагмента ДНК
- Разработать и заказать синтетический фрагмент ДНК, содержащий целевую область амплификации, для использования в качестве контроля качества.
- Убедитесь, что последовательность содержит всю последовательность ампликона от прямого праймера до обратного праймера интересующего гена-мишени, с расширением от четырех до шести пар оснований последовательности на 5'-концах каждой последовательности связывания праймера.
- Избегайте гомополимеров аденина и тимина с более чем 12 парами оснований или пар оснований гуанина и цитозина с более чем восемью парами оснований, так как длинные гомополимеры могут мешать синтезу фрагмента гена.
ПРИМЕЧАНИЕ: Если ампликоны содержат такие последовательности, замена оснований может производиться до тех пор, пока сохраняются места отжига для грунтовок и зондов. - В качестве альтернативы готовят линеаризованную плазмиду, содержащую ампликон, используя типичные стратегии клонирования.
- Центрифугируйте пробирку, содержащую синтетический фрагмент ДНК, в микроцентрифуге в течение ~ 10 с, чтобы обеспечить сбор материала на дне пробирки.
- Ресуспендировать синтетический фрагмент ДНК с помощью буфера трис-ЭДТА (ТЭ) до концентрации 1,0 ×10-10 копий/мкл или, при необходимости, в зависимости от целевого диапазона анализа.
- Кратковременно встряхните, затем инкубируйте при 50 °C в течение 20 ± 5 минут. Остудить на льду.
- Приготовьте несколько, в идеале одноразовых аликвот и храните при температуре от -70 до -90 °C до использования.
ПРИМЕЧАНИЕ: Синтетические фрагменты ДНК, полученные таким образом, обычно стабильны в течение не менее 24 месяцев с даты ресуспендирования. - При желании определите точную концентрацию полученного синтетического материала ДНК перед использованием в качестве контроля качества или оцените номинальную концентрацию на основе используемой ресуспензии.
2. Подготовка грунтовок и зонда
- Разработка и заказ праймеров и зонда гидролиза для нацеливания на желаемую область амплификации с использованием типичных стратегий проектирования26,27.
- Используйте 5'флуоресцентный репортерный краситель (например, FAM) и 3'-гаситель (например, темный гаситель Iowa Black), совместимые с системой ddPCR.
ПРИМЕЧАНИЕ: Существует множество пакетов программного обеспечения для разработки ПЦР-анализов, и любой из них может быть использован. Например, Primer-BLAST Национального центра биотехнологической информации28 широко используется из-за надежных вариантов дизайна анализа и простоты, с которой специфичность может быть биоинформационно оценена для выявления возможных нецелевых эффектов. Следует отметить, что подготовка грунтовок и зондов может отличаться от перечисленных здесь этапов в зависимости от формата, в котором они поставляются.
- Используйте 5'флуоресцентный репортерный краситель (например, FAM) и 3'-гаситель (например, темный гаситель Iowa Black), совместимые с системой ddPCR.
- Центрифугируйте пробирки, содержащие прямую грунтовку, обратную грунтовку и зонд, в микроцентрифуге в течение ~ 10 с, чтобы гранулировать материал на дно пробирки.
- Ресуспендируют праймеры до 20 мкМ с помощью буфера TE. Вихрь ненадолго.
- Ресуспендируйте зонд до 10 мкМ с помощью буфера TE. Вихрь ненадолго.
- Приготовьте несколько, в идеале одноразовых аликвот и храните при температуре не менее -20 °C до использования.
ПРИМЕЧАНИЕ: Грунтовки и зонды, приготовленные таким образом, обычно стабильны в течение не менее 24 месяцев с даты ресуспендирования.
3. Подготовка буфера для разбавления образца
- Разморозьте буфер ПЦР и ДНК сперматозоидов лосося при комнатной температуре. Тщательно перемешайте.
- Подготовьте буфер для разбавления образца в соответствии с таблицей 1.
- Тщательно перемешайте. Хранить при температуре 2-8 °C в течение 1 месяца после приготовления.
Таблица 1: Подготовка буфера для разбавления пробы. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
4. Приготовление мастер-микса
- Разморозьте основную смесь ddPCR для зондов, прямого праймера, обратного праймера и зонда при комнатной температуре и дайте нагреться не менее 10 минут после оттаивания перед использованием. Хранить при комнатной температуре до использования.
ПРИМЕЧАНИЕ: Эти реагенты должны быть полностью доведены до комнатной температуры, чтобы обеспечить эффективное образование капель. Не держите реактивы на льду во время приготовления.- Тщательно и ненадолго перемешайте центрифугу в мини-центрифуге перед использованием.
ПРИМЕЧАНИЕ: Рестрикционные ферменты обычно поставляются в виде глицерина и должны быть удалены из хранилища непосредственно перед использованием. Аккуратно перемешайте. Не вихревые.
- Тщательно и ненадолго перемешайте центрифугу в мини-центрифуге перед использованием.
- Подготовьте мастер-микс для ПЦР для каждой мишени амплификации. Рекомендуемый состав основной смеси для ПЦР см. в таблице 2 и при необходимости изменяйте концентрации праймеров и зондов.
- Тщательно встряхните и кратковременно центрифугу перед добавлением фермента рестрикции. Добавьте фермент рестрикции и перемешайте.
ПРИМЕЧАНИЕ: На этом этапе требуется 22 мкл реакции ПЦР для получения конечного объема 40 мкл реакции ПЦР после образования капель (состоящей из 15 мкл основной смеси для ПЦР, 5,0 мкл матрицы и 20 мкл масла для генерации капель).
- Тщательно встряхните и кратковременно центрифугу перед добавлением фермента рестрикции. Добавьте фермент рестрикции и перемешайте.
- Добавьте 16,5 мкл мастер-смеси в каждую скважину в соответствии с картой пластин. На рисунке 1 приведен пример карты пластин для проверки точности и прецизионного прогона.
- Убедитесь, что пластина содержит три независимых препарата серии контроля качества (КК), три независимо протестированных эндогенных аликвота слезы, с шипами до высокого и низкого уровня и без шипов, а также три независимых элемента управления без шаблонов (NTC).
- Изменяйте расположение этих скважин по всей плите, где набор 1 загружается в порядке убывания концентрации, набор 2 загружается в порядке возрастания концентрации, а набор 3 загружается в случайном порядке, чтобы оценить, есть ли какие-либо эффекты, зависящие от местоположения плиты.
- Сгруппируйте образцы, чтобы заполнить как можно большую часть колонны, и заполните неиспользуемые скважины внутри колонны контрольным буфером. При желании включите несколько эндогенных контрольных партий (например, больше луж слез или слез, собранных у людей) в оставшиеся лунки.
- Заклейте пластину прозрачной клейкой пленкой. Держите тарелку при комнатной температуре во время приготовления шаблона. В качестве альтернативы подержите пластину до 4 часов при температуре 2-8 °C, но доведите ее до комнатной температуры не менее чем за 10 минут до добавления шаблона.
Таблица 2: Пример приготовления мастер-смеси для ПЦР. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
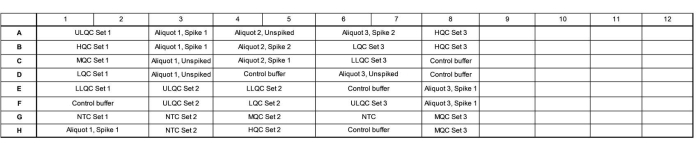
Рисунок 1: Пример карты пластин для проверки точности и прецизионного прогона. Сокращения: ULQC = верхний предел контроля качества; HQC = высокий контроль качества; MQC = средний контроль качества; LQC = низкий контроль качества; LLQC = нижний предел контроля качества; NTC = нет элемента управления шаблоном. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Подготовка КК
- Разморозьте синтетические фрагменты ДНК или линеаризованные плазмиды при комнатной температуре и дайте им нагреться в течение не менее 10 минут после оттаивания перед использованием. Доведите шаблоны до комнатной температуры, чтобы обеспечить эффективное образование капель.
- Хранить при комнатной температуре до использования. Тщательно и ненадолго перемешайте центрифугу в мини-центрифуге перед использованием.
- Приготовьте разбавления для контроля качества, используя буфер для разбавления образца в качестве разбавителя. Пример рекомендуемых концентраций для подготовки к валидационной точности и прецизионному прогону представлен в таблице 3.
ПРИМЕЧАНИЕ: После успешного завершения проверок точности и прецизии на каждой пластине необходимо выполнять только контроль высокого качества (HQC), контроль среднего качества (MQC) и контроль низкого качества (LQC). Для точности и прецизионных прогонов включаются по крайней мере три независимых разведения КК для оценки точности и прецизионности внутри анализа. После точности и прецизионных запусков необходимо включить только одну серию разбавления. - После приготовления храните разбавления при комнатной температуре до добавления в тарелку.
- Храните разбавления на льду или при температуре 2-8 °C, если это необходимо. Перед последующим использованием дайте разведениям нагреться до комнатной температуры в течение не менее 10 минут перед использованием. Откажитесь от контроля качества в конце дня.
Таблица 3: Пример препарата контроля качества (КК) с использованием синтетических двухцепочечных фрагментов ДНК. Сокращения: ULQC = верхний предел контроля качества; HQC = высокий контроль качества; MQC = средний контроль качества; LQC = низкий контроль качества; LLQC = нижний предел контроля качества; NTC = нет элемента управления шаблоном. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
6. Подготовка образцов
- Разморозьте образцы слез, собранные в ходе клинических испытаний, при комнатной температуре до размораживания и дайте нагреться в течение не менее 10 минут после оттаивания перед использованием.
- Хранить при комнатной температуре до использования. Тщательно и ненадолго встряхните центрифугу в микроцентрифуге перед использованием.
- Разбавьте слезные образцы в соотношении 1:10 (или более), используя буфер для разбавления образца в качестве разбавителя в пробирки для ПЦР объемом 0,2 мл или 8-луночные полоски для ПЦР. Загерметизируйте трубки.
ПРИМЕЧАНИЕ: В зависимости от ожидаемой концентрации мишени в слезах может потребоваться дальнейшее разбавление образцов или испытание нескольких разведений каждого образца. - Нагрейте образцы в термоциклере при температуре 95 °C в течение 10 мин, а затем выдержите при температуре 4 °C в течение не менее 5 минут для охлаждения. Используйте скорость нарастания 3 °C/с.
ПРИМЕЧАНИЕ: Образцы могут оставаться в термоциклере при температуре 4 °C до использования в тот же день или могут быть заморожены при температуре от -70 до -90 °C для более длительного хранения. Этот шаг служит для денатурации векторного капсида, высвобождая геном. Поскольку синтетические фрагменты ДНК QC или линеаризованные плазмиды являются двухцепочечными, они не должны подвергаться этой стадии нагрева. - Верните образцы после охлаждения до комнатной температуры (или, если они заморожены, разморозьте при комнатной температуре) и дайте им нагреться не менее 10 минут.
ПРИМЕЧАНИЕ: Образцы должны быть полностью доведены до комнатной температуры, чтобы обеспечить эффективное образование капель.
7. Добавление шаблона
- Извлеките планшет ddPCR, содержащий мастер-микс. Тщательно встряхните каждый образец или пробирку для разбавления контроля качества и кратковременно центрифугу для сбора материала.
- Удалите клейкую пленку и добавьте 5.5 мкл КК или образцов в соответствующие лунки 96-луночной пластины в соответствии с картой пластины.
ПРИМЕЧАНИЕ: Обратитесь к шагу 4.2.1 для объяснения требуемых объемов - Добавьте 5,5 мкл буфера для разбавления пробы в лунки NTC.
- Генерация капель требует, чтобы все лунки колонны имели реакционный или буферный контроль. Если какие-либо лунки колонны не содержат реакций с образцами, разбавьте 2x буфера ddPCR в соотношении 1:2 водой, не содержащей нуклеаз. Добавьте 22 мкл 1x ddPCR буферного контроля в любые пустые лунки колонны.
ПРИМЕЧАНИЕ: Если не используется целая колонна, нет необходимости добавлять буферный контроль в эти скважины. - Добавьте на тарелку прокалываемую фольгу. Поместите пластину в запайщик пластин и запечатайте на 5 с при 180 °C.
- В качестве альтернативы можно загерметизировать планшет в соответствии с рекомендациями производителя системы ddPCR.
- Вихревите пластину с максимальной скоростью не менее 30 с (используя настройку непрерывного вихряния; не используйте сенсорное вихревое движение) и кратковременно центрифугу в пластинчатом вращателе.
ПРИМЕЧАНИЕ: Тщательное и полное перемешивание планшета на этом этапе имеет решающее значение для правильного разделения реакции ПЦР на капли. Следите за тем, чтобы в лунках не было видно пузырьков. При необходимости планшет можно держать при температуре 2-8 °C до образования капель не более 4 часов. Если пластину держат, дайте пластине нагреться до комнатной температуры в течение как минимум 10 минут до образования капель.
8. Автоматическая генерация капель, термоциклирование и считывание капель
- Сгенерируйте капли в автоматическом генераторе капель следующим образом.
- На сенсорном экране выберите столбцы на карте табличек, содержащие образцы. Дека прибора загорится, указывая, какие расходные материалы (картриджи DG32, наконечники, контейнер для отходов, масло для генерации капель) требуются. Желтые индикаторы указывают на то, что необходимо добавить расходный материал, а зеленые индикаторы указывают на наличие достаточного количества расходных материалов.
- Загрузите генератор капель сзади вперед.
- Для зондов гидролиза убедитесь, что масло для генерации капель для зондов установлено и остается достаточное количество нефти для количества скважин. Если используются альтернативные химические составы ПЦР, убедитесь, что установлено совместимое масло для генерации капель.
- Поместите холодный блок в держатель пластины для капель. Убедитесь, что блок полностью синего цвета и не виден розовый. Поместите новую 96-луночную пластину ddPCR в холодный блок.
- Поместите подготовленную ПЦР-пластину в держатель планшета для образцов. Закройте крышку машины. Нажмите «Старт» для генерации капель.
- После образования капель в общей сложности 40 мкл на реакцию автоматически переносится на новую ПЦР-пластину.
- В течение 30 минут после завершения генерации капель извлеките пластину, содержащую капли, из холодного блока. Работайте осторожно, так как капли наиболее хрупкие на этом этапе.
- Добавьте на тарелку прокалываемую фольгу. Поместите пластину в запайщик пластин и запечатайте на 5 с при 180 °C.
- В качестве альтернативы можно загерметизировать планшет в соответствии с рекомендациями производителя системы ddPCR.
- Поместите пластину в совместимый термоциклер. Введите условия езды на велосипеде (см. таблицу 4).
- После окончания термоциклирования подержите пластину в термоциклере, переведите на 2-8 °C или сразу же прочтите ее.
ПРИМЕЧАНИЕ: Хранение планшета в течение 12 часов при температуре 4-12 °C может улучшить количество капель, но это не обязательно. Достаточное количество капель должно быть получено без удержания. - Загрузите пластину в считыватель капель, убедившись, что в считывателе остается достаточно масла, а в контейнере для отходов достаточно места. Читайте капельки. Выполните считывание капель в течение 24 часов после начала термоциклирования.
Таблица 4: Типичные условия термоциклирования. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
9. Анализ данных
ПРИМЕЧАНИЕ: Минимум 10 000 капель на лунку необходимо для правильного расчета концентрации с использованием статистики Пуассона. Не пытайтесь проводить анализ на лунках с содержанием капель менее 10 000.
- Порог необходим для определения капель как положительных или отрицательных. Программное обеспечение для анализа ddPCR автоматически применяет пороговое значение, которое может варьироваться в зависимости от скважины. Тем не менее, вручную установите пороговое значение для всех лунок пластины на уровне немного выше интенсивности флуоресценции лунок NTC для получения более последовательных, точных и точных результатов.
ПРИМЕЧАНИЕ: Правильное размещение порога может потребовать оптимизации в зависимости от разделения положительных и отрицательных капель и количества капельного дождя (см. рис. 2). В этом примере на графике амплитуды капель показаны примеры лунок на каждом уровне контроля качества и NTC. Фиолетовая линия указывает на порог в 1,000, установленный немного выше отрицательной популяции капель. - Статистическое моделирование Пуассона требует, по крайней мере, трех положительных капель для расчета концентрации с 95% достоверностью. Считайте, что все лунки, содержащие ноль, одну или две положительные капли, являются отрицательными и имеют концентрацию ноль27.
- Вычислите количество копий в каждом образце разрыва.
- Концентрация в копиях/мкл указана в отчете о данных. Используйте это значение для определения концентрации в копиях/мкл исходного образца (т. е. в слезном образце).
- Чтобы рассчитать разведение реакции ddPCR, разделите исходный объем реакции ПЦР до образования капель на объем добавленного шаблона. При использовании объемов, представленных в этом методе, получается значение 4.
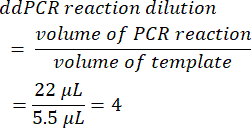
- Определите серийный коэффициент разбавления из исходного образца (этап 6.2).
- Чтобы определить количество копий/мкл в образце, умножьте копии/мкл на разведение реакции ddPCR, затем на коэффициент серийного разбавления. Например, концентрация в копиях/мкл, полученная в отчете о данных, составила 966; На 22 мкл реакции добавляли 5,5 мкл шаблона. Использовали серийное разведение образца в масштабе 1:50 000.
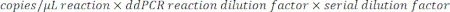
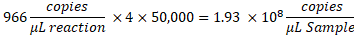
- Если было протестировано несколько разведений одного и того же образца, проанализируйте все допустимые разведения в диапазоне и рассчитайте среднее значение.
- Для каждого КК рассчитайте ожидаемое количество копий/мкл ПЦР-реакции, разделив концентрацию данного разведения КК (в копиях/мкл) на объем реакции ddPCR (20 мкл). Это позволяет напрямую сравнивать это номинальное значение со значением копий/мкл, приведенным в отчете о данных, без дополнительных расчетов.
ПРИМЕЧАНИЕ: Этот подход также использовался для анализа образцов слезы с шипами, использованных в репрезентативных результатах. - Определите среднее значение, стандартное отклонение, коэффициент вариации (% CV) и процент относительной погрешности по отношению к номинальной концентрации (% RE) пробы или значения контроля качества с помощью повторных скважин (включая многократные разведения, если применимо).
- Для оценки межскважинной точности определите ее для каждого из дубликатов скважин, если они включены.
- Для оценки точности и прецизионности внутрианализового анализа определите это для каждой серии разведения или аликвоты, используемой в партии.
- Для оценки точности и точности межанализового анализа определите это, используя внутрипробные средства каждой из включенных партий.
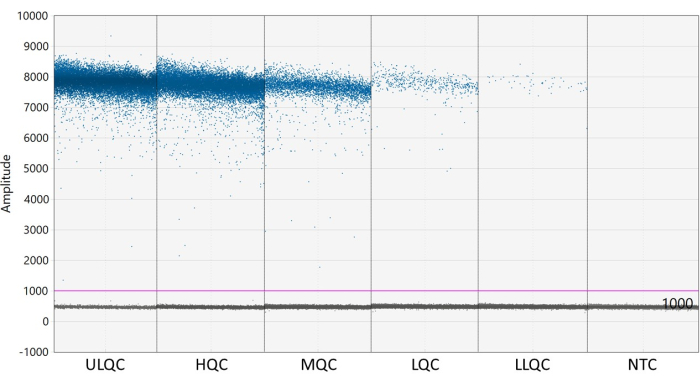
Рисунок 2: Пример установки порога. Сокращения: ULQC = верхний предел контроля качества; HQC = высокий контроль качества; MQC = средний контроль качества; LQC = низкий контроль качества; LLQC = нижний предел контроля качества; NTC = нет элемента управления шаблоном. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
10. Критерии приемки проб
- Используйте следующие спецификации для расчетных данных для каждой партии, чтобы определить, является ли партия приемлемой. Если эти условия не выполняются, аннулируйте и повторите пакет.
ПРИМЕЧАНИЕ: Эти критерии были определены в качестве консенсуса из опубликованных официальных документов по валидации анализа на основе ПЦР 18,19,20,21,22,23,24,25. Может потребоваться изменить целевые критерии в соответствии с клиническим применением. - Нет шаблонного элемента управления (NTC)
- Убедитесь, что в каждой лунке NTC содержится не менее 10 000 капель.
- Убедитесь, что в каждой лунке NTC содержится менее 3 положительных капель.
- КК и диапазон анализа
- Убедитесь, что в каждой скважине контроля качества содержится не менее 10 000 капель.
- Убедитесь, что точность повторных скважин с концентрацией КК составляет ≤25,0% CV, за исключением верхнего и нижнего пределов количественного определения, где допустимо ≤30,0%. Оцените это независимо для каждого набора КК и уровня концентрации.
- Убедитесь, что относительная погрешность рассчитанной назад концентрации на каждом среднем уровне контроля качества находится в пределах ±25,0% RE от номинальной концентрации (копии/реакция ПЦР), за исключением верхнего и нижнего пределов количественного определения, где допустимо значение RE ±30,0%. Оцените это независимо для каждого набора КК и уровня концентрации.
- Убедитесь, что по крайней мере 2/3 образцов контроля качества (например, четыре из шести результатов) и 50% образцов контроля качества на каждом уровне (низкий, средний, высокий) соответствуют этим рекомендациям.
- Образцы
- Убедитесь, что в анализируемых лунках для образцов содержится не менее 10 000 капель.
- Убедитесь, что точность реплицируемых скважин анализируемого разбавления образца составляет ≤25,0% CV.
- Убедитесь, что по крайней мере одно включенное разбавление данного образца находится в пределах определенного диапазона количественного определения анализа, как определено выше на основе верхнего и нижнего пределов КК.
- Если все разведения включали результаты, превышающие определенный верхний предел количественного определения, и если остается достаточный объем образца, повторите анализ, используя более высокое разбавление образца.
- Если все включенные разведения дают результат ниже нижнего предела количественного определения, и если остается достаточный объем образца, повторите анализ, используя более низкое разбавление образца.
ПРИМЕЧАНИЕ: Образцы, содержащие более трех положительных капель, но имеющие концентрацию ниже нижнего предела количественного определения, могут быть описаны как обнаруживаемые, но не поддающиеся количественной оценке.
Результаты
В демонстрационных целях был разработан анализ, предназначенный для обнаружения коммерчески доступного, усиленного зеленого флуоресцентного белка (eGFP), экспрессирующего вектор AAV2, с синтетическим двухцепочечным фрагментом ДНК, содержащим eGFP в качестве контроля качества. В настоящее время продолжаются дебаты о том, является ли сам вектор или синтетический фрагмент ДНК или линеаризованная плазмида наиболее подходящими для использования в качестве КК. Как правило, синтетический фрагмент ДНК или линеаризованная плазмида могут быть использованы, если эквивалентность вектору продемонстрирована при разработке метода (данные не показаны). Праймеры и зонды были разработаны и оптимизированы для обнаружения трансгена eGFP. Последовательности, используемые в этой работе, см. в дополнительной таблице S1 . Концентрацию запаса фрагментов КК определяли эмпирически с помощью ddPCR. Все анализы проводились с использованием концентраций и условий ПЦР, приведенных в качестве примеров в разделе протокола.
Для анализов кПЦР рекомендуется оценивать линейность, чувствительность, динамический диапазон, точность и прецизионность стандартной кривой. Поскольку ddPCR не полагается на стандартную кривую для количественной оценки цели, эти рекомендации должны быть изменены. Вместо этого КК, состоящие из синтетических двухцепочечных фрагментов ДНК, разбавленных до различных концентраций, чтобы охватить ожидаемый количественный диапазон реакции ddPCR на основе статистического моделирования Пуассона, использовались 29,30,31,32 для определения динамического диапазона и чувствительности, а также для оценки точности и прецизионности. Выбор концентраций КК основывался главным образом на ожидаемом соотношении положительных и общих капель в лунке при данной концентрации. Математически ddPCR теоретически наиболее точна, когда примерно 80% разделов положительно усиливаются. По мере того, как положительное отношение капель к общему количеству увеличивается выше 0,8, точность снижается из-за насыщения перегородок, при этом количественная оценка невозможна, когда 100% капель положительные. На низком уровне, теоретически, может быть обнаружена и количественно определена только одна положительная капля, хотя точность ниже, и анализ подвержен ложноположительным результатам низкого уровня. Как правило, по крайней мере три капли должны быть положительными, чтобы результат был рассчитан с 95% достоверностью, что является порогом для расчета концентрации, которую мы использовали здесь.
Была подготовлена серия из пяти различных концентраций КК, при этом рассчитанное целевое число копий/мкл ПЦР-реакции, как ожидается, даст положительное отношение капель к общему количеству, охватывающее поддающийся количественной оценке диапазон ddPCR, как показано в таблице 5. Они использовались для оценки точности и прецизионности анализа. При оценке здесь верхняя и нижняя границы количественного определения не были доведены до теоретического максимума, возможного в ddPCR. Точная количественная оценка может быть возможна на более высоких и более низких уровнях, чем показано здесь. Ассортимент должен быть разработан в соответствии с последующими применениями этого метода.
В общей сложности три независимо приготовленные серии разбавления этих КК были приготовлены в буфере для разбавления проб для каждой партии для оценки точности и прецизионности внутри анализа. Были включены дублирующиеся скважины каждого разведения КК. Чтобы смоделировать фактический протокол проверки, в общей сложности шесть партий точности и точности были выполнены несколькими аналитиками в течение нескольких дней. Результаты этих шести партий были проанализированы для определения точности и точности метода внутри и между анализами, а также для определения динамического диапазона анализа.
Эффективность внутрипробного анализа оценивалась для каждой партии на каждом уровне контроля качества. Мы ожидали, что все скважины QC и NTC будут иметь не менее 10 000 капель. Это было достигнуто в 216 из 216 скважин, испытанных во всех шести партиях, со средним количеством капель 19 748 капель на скважину (таблица 6). Далее, межскважинный %CV каждого набора дублирующих скважин каждого КК должен был составить ≤25,0%, за исключением верхнего и нижнего пределов КК, где ожидалось ≤30,0%. Это было достигнуто в наборах из 90 из 90 скважин, испытанных по всем шести партиям для КК, при этом средний межскважинный %CV составил 3,9% на всех уровнях КК (таблица 7). Все КК дали среднее положительное отношение к общему количеству капель в ожидаемых диапазонах, указанных выше (таблица 6).
В каждой партии было рассчитано среднее значение и стандартное отклонение для каждой из независимо приготовленных серий разбавлений, и они использовались для расчета среднего значения внутри анализа для каждой концентрации в каждом анализе. Это было использовано для оценки точности и прецизионности анализа (таблица 8). Точность относится к изменчивости данных из реплик одного и того же однородного образца в нормальных условиях анализа и оценивается путем вычисления % CV множественных включенных аликвот. Мы ожидали, что три аликвоты, протестированные в каждой партии, дадут внутрипробный %CV ≤25,0%, за исключением верхнего и нижнего предела КК, где ожидалось ≤30,0%. Это было выполнено для всех пяти уровней контроля качества в каждой из 60 партий (30 из 30 общих показателей). Как правило, может быть достигнута более высокая точность внутрианализа, чем целевые критерии, при этом средний процент CV внутри анализа составляет 7,7% на всех уровнях КК. Точность относится к близости согласия между экспериментально определенным значением и номинальным значением. Это оценивается путем вычисления процентной относительной погрешности (%RE или %смещения) между расчетными концентрациями каждого КК и их теоретически ожидаемыми номинальными концентрациями. Ожидалось, что среднее значение трех аликвот составит ±25,0% RE от номинальной концентрации, за исключением верхнего и нижнего пределов КК, где ожидалось ±30,0%. Это было выполнено для всех пяти уровней контроля качества в каждой из 60 партий (30 из 30 общих показателей). Как правило, может быть достигнута более высокая точность внутрианализа, чем наша цель, при этом средний абсолютный внутрианалитический % RE составляет 4,2% на всех уровнях контроля качества. Во всех показателях NTC (всего 30) положительных капель обнаружено не было.
Точность и прецизионность между анализами также рассчитывались с использованием среднего значения внутри анализа каждого уровня контроля качества в каждой партии. Ожидалось, что точность межанализового анализа составит ≤25,0% CV, за исключением верхнего и нижнего предела КК, где ожидалось ≤30,0%. Аналогичным образом, для точности между анализами ожидалось ±25,0% RE, за исключением верхнего и нижнего пределов КК, где ожидалось ±30,0%. Наблюдалась значительно более высокая точность и прецизионность между анализами, чем эти целевые показатели (таблица 9), с точностью между анализами в диапазоне от 4,0% до 8,5% и абсолютной точностью между анализами в диапазоне от 1,0% до 3,2%. В совокупности эти результаты показывают, что этот метод может обеспечить достаточную точность и прецизионность внутри и между анализами в соответствии с текущими отраслевыми целями. На основе этих результатов можно определить динамический диапазон этого анализа 2,500-2.5 копий на мкл реакции ПЦР с общей чувствительностью анализа 2.5 копий на мкл реакции ПЦР. Как упоминалось ранее, можно проверить более широкие динамические диапазоны.
Далее необходимо было оценить точность анализа и прецизионность в пределах целевой матрицы - в данном случае разрывов. Как правило, анализы проверяются до начала клинических исследований, а это означает, что слезы, собранные у пациентов, получавших вектор, вряд ли будут доступны для целей валидации. Это может быть искусственно создано, вставив целевой вектор AAV в слезы, собранные у доноров-добровольцев, для создания матричных КК. Объединенные человеческие слезы были собраны третьей стороной (BioIVT). Для доказательства принципа был использован экспрессирующий eGFP вектор AAV2, полученный из коммерческого источника. Концентрацию векторного фонда AAV2 определяли эмпирически с помощью ddPCR, без использования этапа выделения ДНК, как описано в этом протоколе. В каждом прогоне AAV2 независимо входил в три аликвоты слезы на высоком (ожидаемая реакция ПЦР 1,41 x 103 копии/мкл) и низком (реакция ПЦР 28,2 копии/мкл) уровне. В качестве контроля были включены аликвоты без шипов, чтобы продемонстрировать специфичность метода.
Эффективность внутрианализового анализа оценивалась для каждой партии на каждом уровне всплеска. Ожидалось, что все образцы слезы будут содержать не менее 10 000 капель. Это было достигнуто в 108 из 108 скважин, испытанных во всех шести партиях, со средним общим количеством капель 20 208 капель на скважину (таблица 10). Далее, ожидалось, что межскважинный %CV каждого набора дублирующихся скважин каждого КК составит ≤25,0% для высокого и низкого пиковых уровней. Это было выполнено в 36 из 36 наборов скважин, испытанных на всех шести партиях для КК, при этом средний межскважинный %CV составил 3,2% (таблица 11).
В каждой партии среднее значение и стандартное отклонение были рассчитаны для каждого из независимо подготовленных слезных шипов, и они использовались для расчета среднего значения внутри анализа для каждой концентрации в каждом анализе. Это было использовано для оценки точности и прецизионности анализа в матрице (таблица 12). Мы ожидали, что внутрианалитический %CV составит ≤25,0%, а также высокие и низкие спайковые уровни. Это было выполнено в шести из шести партий для каждого уровня. Как правило, может быть достигнута более высокая точность внутрианализового анализа в матрице, чем целевой показатель, при этом средний процент CV в результате анализа составляет 3,7% на высоком уровне и 12,2% на низком уровне (в целом 8,0%). Также ожидалось, что внутрианалитический %RE составит ±25,0% на обоих уровнях всплеска. Это было выполнено в шести из шести партий для каждого уровня. Аналогичным образом, в целом было обнаружено, что может быть достигнута более высокая точность внутрианалитического анализа в матрице, чем целевой показатель, при этом средний абсолютный процент RE внутри анализа составляет 8,1% на низком уровне и 11,3% на высоком уровне (в целом 9,7%). Для контроля без шипов ни в одной из аликвот не было обнаружено сигнала eGFP (таблица 12), что свидетельствует о специфичности метода в слезной матрице человека.
Точность межанализового анализа и точность слезной матрицы также были рассчитаны с использованием среднего значения внутри анализа каждого уровня всплеска в каждой партии. Ожидалось, что точность между анализами составит ≤25,0% CV, а для точности между анализами мы ожидали ±25,0% RE. Наблюдалась значительно более высокая точность и прецизионность между анализами, чем эти целевые показатели (таблица 13), с точностью межанализа 5,5% на высоком уровне и 7,1% на низком уровне и с абсолютной точностью межанализа 11,3% на высоком уровне и 8,1% на низком уровне. В совокупности эти результаты демонстрируют точность, прецизионность и специфичность метода в матрице разрыва.
Таблица 5: Контроль качества, используемый для определения динамического диапазона анализа. Сокращения: ULQC = верхний предел контроля качества; HQC = высокий контроль качества; MQC = средний контроль качества; LQC = низкий контроль качества; LLQC = нижний предел контроля качества; NTC = нет элемента управления шаблоном. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 6: Общее количество капель и положительное отношение капель к общему количеству синтетических двухцепочечных ДНК контроля качества и NTC. Сокращения: ULQC = верхний предел контроля качества; HQC = высокий контроль качества; MQC = средний контроль качества; LQC = низкий контроль качества; LLQC = нижний предел контроля качества; NTC = нет элемента управления шаблоном. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 7: Межскважинная статистика контроля качества (мишени копирования/мкл реакции ПЦР). Сокращения: ULQC = верхний предел контроля качества; HQC = высокий контроль качества; MQC = средний контроль качества; LQC = низкий контроль качества; LLQC = нижний предел контроля качества; NTC = нет элемента управления шаблоном. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 8: Внутрианализовая точность и прецизионность КК (мишени копирования/мкл ПЦР-реакции). Сокращения: ULQC = верхний предел контроля качества; HQC = высокий контроль качества; MQC = средний контроль качества; LQC = низкий контроль качества; LLQC = нижний предел контроля качества; NTC = нет элемента управления шаблоном. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 9: Межанализовая точность и прецизионность КК (мишени копирования/мкл ПЦР-реакции). Сокращения: ULQC = верхний предел контроля качества; HQC = высокий контроль качества; MQC = средний контроль качества; LQC = низкий контроль качества; LLQC = нижний предел контроля качества; NTC = нет элемента управления шаблоном. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 10: Общее количество капель в образцах слезы. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 11: Статистика разрывных образцов между скважинами (мишени копирования/мкл реакции ПЦР). Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 12: Точность внутрианализового анализа и прецизионность образцов слезы (мишени копии/мкл реакции ПЦР). Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 13: Межанализовая точность и прецизионность слезных образцов (мишени копирования/мкл реакции ПЦР). Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Дополнительная таблица S1: Последовательности праймера, зондов и контроля качества синтетической двухцепочечной ДНК, использованных в этом исследовании. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
Существует несколько этапов протокола ddPCR, которые имеют решающее значение для правильного выполнения анализа. Первым важным шагом является проектирование и оптимизация праймеров и зонда. Как правило, рекомендуется использовать химию на основе зонда гидролиза по сравнению с химией на основе красителя (например, SYBR Green) в доклинических или клинических условиях из-за их превосходной специфичности. Кроме того, выбор мишени усиления имеет решающее значение. Как правило, трансген интересующего вектора является целевым. Однако на более ранних доклинических стадиях или в векторах, где может быть невозможно отличить трансген вектора от геномной ДНК, может быть целесообразно использовать стандартизированные векторные мишени. Например, можно нацелиться на инвертированную концевую область повтора, промотор, поли-А-хвост или межсегментные соединения между этими векторными компонентами. Выбор цели будет варьироваться в зависимости от векторного дизайна. Традиционные стратегии проектирования праймеров и зондов для qPCR, а также программное обеспечение обычно подходят для ddPCR. Расчетные параметры, которые, как ожидается, обеспечат постоянную температуру отжига (например, 60 ° C), должны быть выбраны, чтобы уменьшить требуемую оптимизацию. Также было рекомендовано разработать, заказать и оценить не менее трех различных наборов для каждой цели. Затем следует выбрать набор, который показывает наибольшую специфичность (отсутствие амплификации в отрицательной контрольной яме или в матрице родственной целевой ДНК) и чувствительность (т.е. предел обнаружения)20.
Если выгодно иметь возможность переходить анализ между кПЦР и ддПЦР, рекомендуется сначала оптимизировать условия анализа с помощью кПЦР и определить условия для выбранного набора, которые приводят к эффективности амплификации 90%-110% с R2 ≥ 0,98. Однако ddPCR как метод конечной точки обычно менее чувствителен, чем qPCR, из-за различий в эффективности амплификации. Как минимум, рекомендуется использовать температурный градиент на этапе отжига/расширения, чтобы охватить температуры выше и ниже ожидаемых температур отжига и оценить разделение амплитуды дождя и флуоресценции между отрицательным и положительным кластерами капель в зависимости от температуры. Если рабочее пространство позволяет, рекомендуется иметь отдельные выделенные рабочие места для подготовки мастер-микса, добавления шаблонов и усиления. Там, где это возможно, они должны быть физически разделены однонаправленным рабочим процессом со встроенными инженерными элементами управления, такими как контролируемый доступ и перепад давления воздуха, чтобы снизить риск перекрестного загрязнения и ложных срабатываний. Если это невозможно, необходимо соблюдать крайнюю осторожность, чтобы предотвратить перекрестное заражение.
В этом протоколе есть два этапа, которые могут показаться необычными для тех, кто более привык к разработке анализа кПЦР. Во-первых, это включение рестрикционного фермента в мастер-микс ПЦР. Во время амплификации ddPCR каждая капля термоциклируется до конечной точки. В правильно оптимизированном анализе это приводит к двум популяциям капель, одна из которых демонстрирует неизменно высокий уровень флуоресцентных сигналов - положительные, а другая последовательно отображает низкий уровень флуоресцентного сигнала - отрицательные. Если происходит интерференция ПЦР, она может десинхронизировать начало амплификации ПЦР, в результате чего капля не достигнет плато амплификации и, следовательно, непоследовательные флуоресцентные конечные точки. В этом случае капли будут распределяться между негативами и положительными результатами, что приведет к явлению, называемому дождем ddPCR. Это может привести к неточной количественной оценке целевого показателя и непоследовательному и субъективно применяемому пороговым значениям. Мы рекомендуем установить пороговое значение немного выше сигнала NTC, что должно свести к минимуму влияние дождя при окончательной количественной оценке, поскольку все капли по-прежнему считаются положительными, даже если они не полностью циклически дошли до конечной точки. AAV имеют очень сложную вторичную структуру, которая, в зависимости от мишени амплификации, может снизить доступ к праймерам и зондам, что приводит к ПЦР-интерференции и, следовательно, к дождю. Включение фермента рестрикции в мастер-смесь расщепляет эту вторичную структуру, увеличивая доступ праймеров и зондов, уменьшая дождь, что может тем самым повысить точность анализа. Эффекты включения фермента рестрикции в реакцию ddPCR были описаны ранее25,32. Можно использовать любой рестрикционный фермент, если подтверждено, что он не пересекается в целевой области амплификации. Никаких этапов предварительного сбраживания или альтернативных буферных композиций не требуется.
Вторым необычным этапом является подготовка образца слезы, содержащего AAV. В этом протоколе использовалось соотношение слез 1:10 (или более), а затем образец нагревали. Как правило, когда слезы собираются через капиллярную трубку, которая является широко используемым методом сбора, в среднем можно собрать около 10,0 мкл33. Разбавление помогает решить проблему ограниченного объема пробы и обеспечить достаточное количество материала для повторных исследований скважин. Несмотря на то, что это снижает теоретический предел обнаружения, надежная чувствительность ddPCR все же должна приводить к обнаружению всех, кроме очень небольшого числа векторных частиц. Такой подход дополнительно создает «резервный» колодец на случай, если кто-то неожиданно выйдет из строя. В этом случае или в случаях недостаточного объема образца для запуска двух скважин ошибка Пуассона может быть использована для оценки точности. Кроме того, в тех случаях, когда концентрация ниже предела обнаружения, это создает возможность объединить скважинные данные для определения концентрации. Необходимо освободить векторы AAV от вирусных капсидов для обнаружения ddPCR. Некоторые методы количественной оценки AAV включали стадию расщепления протеиназы К для удаления вирусного капсида34,35,36. Все встречающиеся в природе серотипы AAV имеют температуру плавления примерно 90 °C или ниже, при этом большинство из них опускается ниже 80 °C; Таким образом, это представляется ненужным включением37. Одного нагревания, по-видимому, достаточно для высвобождения векторной ДНК.
Кроме того, ddPCR, как правило, менее восприимчив к ингибиторам ПЦР, которые могут присутствовать в образце, который может повлиять на анализ кПЦР. Если включен конкретный этап выделения ДНК, это также потребует специальной проверки, чего избегают в этом протоколе. Образцы разбавляют перед нагреванием из-за кинетики диффузии векторных геномов в жидкости. Во время процесса нагрева и последующего охлаждения положительные и отрицательные смысловые нити одноцепочечного генома ДНК могут отжигаться вместе, образуя двухцепочечный промежуточный продукт, если концентрации достаточно высоки. Разбавление перед нагреванием снижает концентрации и делает математически маловероятным, что образуется достаточное количество двухцепочечных промежуточных продуктов, чтобы оказать неблагоприятное влияние на точность количественного определения. Следует отметить, что синтетические фрагменты ДНК или линеаризованные плазмиды, используемые в качестве контроля качества, не должны подвергаться этой стадии нагревания. Поскольку они двухжильные, нагрев приведет к преобразованию в одноцепочечные промежуточные продукты. Ожидается, что после независимого разделения этих одноцепочечных КК на капли это приведет к двукратному увеличению концентрации КК по сравнению с номинальной концентрацией. В качестве альтернативы, если КК необходимо нагреть для стандартизации метода, это должно быть учтено при восстановлении и назначении номинальной концентрации.
Наконец, что касается пробоподготовки, многие протоколы также рекомендуют включать этап обработки ДНКазой для удаления любой неинкапсулированной векторной ДНК. Этот шаг имеет решающее значение в тех случаях, когда нежелательно количественно определять свободную ДНК, связанную с векторным препаратом (например, во время количественного определения для целей дозирования). Однако в контексте исследований биораспределения и биовыделения, как правило, требуется знать, куда прошла какая-либо векторная ДНК, независимо от того, инкапсулирована она или нет. Поэтому рекомендуется, как правило, не выполнять этап лечения ДНКазой во время таких исследований. Если определено, что необходимо включить стадию ДНКазы, эта стадия должна быть до разведения и нагревания.
В этой статье представлены данные, репрезентативные для подхода к оценке динамического диапазона, чувствительности, точности и точности метода в контексте валидации, соответствующей назначению, надлежащей лабораторной практике. В настоящее время отсутствие руководства по этой теме заставляет валидационные лаборатории определять для себя целевые критерии анализа в соответствии с текущим отраслевым мышлением. В разных группах были установлены как более высокие, так и более низкие целевые критерии, чем использовались в этом исследовании 19,20,21,22,23,24,25. Целевые критерии анализа, пока они не будут более жестко определены, должны быть выбраны до валидации на основе предполагаемого клинического применения метода. В зависимости от последующих решений, которые должны быть приняты на основе данных, может потребоваться более высокий уровень точности и точности. И наоборот, простого положительного или отрицательного результата может быть достаточно.
В этом подходе также учитываются рекомендации по оценке специфичности и матричного эффекта. Пул слез, собранных у необработанных людей, не дал положительного результата в этом анализе, в то время как мишень могла быть обнаружена, когда вектор был введен в слезы в высокой и низкой концентрации в пределах рекомендуемых скоростей восстановления. В идеале матрица, содержащая эндогенный вектор (например, собранная после обработки вирусным вектором), также должна быть включена в эти оценки. Однако маловероятно, что такие образцы будут доступны для использования в валидации. Чтобы повысить надежность валидации, можно оценить несколько пулов слез или слез, собранных у разных людей, чтобы определить, возникает ли матричный эффект, специфичный для пациента. Наконец, рекомендуется оценить стабильность. В рабочих процессах, где экстракция ДНК происходит из биологической матрицы, может потребоваться оценить стабильность как образца, так и извлеченной ДНК. В этом рабочем процессе образец тестируется непосредственно в анализе без необходимости выделения ДНК. Поэтому, принимая во внимание оценку стабильности этого метода, необходимо оценить стабильность образцов слезы. Как правило, рекомендуются настольные, холодильные, морозильные/оттаивающие и долгосрочные оценки стабильности. Они не были выполнены в рамках этого исследования, но методы, разработанные здесь, могут быть использованы в этой оценке после манипуляций с входными образцами.
В целом, было продемонстрировано, что этот метод является надежным, воспроизводимым и валидируемым анализом для обнаружения векторов на основе AAV в образцах слезы. Он может служить платформой для адаптации к конкретным векторам для поддержки клинических испытаний и обеспечивает основу для валидации анализа в соответствии с надлежащей лабораторной практикой.
Раскрытие информации
Все авторы являются сотрудниками KCAS Bioanalytical and Biomarker Services, контрактной исследовательской организации, предоставляющей комплексные услуги по разработке в соответствии с надлежащей лабораторной практикой / надлежащей клинической практикой от поддержки раннего обнаружения до регистрации продукта, включая поддержку анализов на основе AAV, как описано в этом протоколе. KCAS финансировал этот проект и публикацию этого протокола. Несмотря на то, что в настоящее время нет руководящих принципов FDA по разработке и проверке экспериментов, представленных в этой статье, эксперты и лидеры мнений, разрабатывающие такие исследования в KCAS, приняли этот подход в качестве базового подхода. Дополнительные критерии и параметры обсуждаются по каждому проекту и могут быть включены в зависимости от предполагаемого использования.
Благодарности
Мы хотели бы поблагодарить Ника Рассела и Брэндона МакКетана из Bio-Rad за их полезные обсуждения во время разработки этого метода.
Материалы
| Name | Company | Catalog Number | Comments |
| AAV-eGFP Vector | Charles River Laboratories | RS-AAV2-FL | Lot AAV2-0720-FL, used as a proof of principle vector |
| AutoDG Droplet Digital PCR system | Bio-Rad | QX200 | Alternative ddPCR system may be used following manufacturer’s protocol. |
| AutoDG Oil for Probes | Bio-Rad | 1864110 | Or use material compatible with ddPCR system. |
| ddPCR Buffer Control for Probes | Bio-Rad | 1863052 | Or use material compatible with ddPCR system and PCR chemistry. |
| ddPCR Droplet Reader Oil | Bio-Rad | 1863004 | Or use material compatible with ddPCR system. |
| ddPCR Piercable Foil Seals | Bio-Rad | 1814040 | Or use material compatible with ddPCR system. |
| ddPCR Plates 96-Well, Semi-Skirted | Bio-Rad | 12001925 | Or use material compatible with ddPCR system. |
| ddPCR Supermix for Probes (no dUTP) | Bio-Rad | 1863023, 1863024, or 1863025 | Use master mix compatible with primers/probes and ddPCR system. |
| DG32 AutoDG Cartidges | Bio-Rad | 1864108 | Or use material compatible with ddPCR system. |
| Droplet Reader | Bio-Rad | QX200 | Alternative ddPCR system may be used following manufacturer’s protocol. |
| GeneAmp PCR Buffer | Applied Biosystems | N8080129 | N/A |
| Nuclease-Free Water | Ambion | AM9906 | N/A |
| PCR Plate Sealer | Bio-Rad | PX1 | Or use material compatible with ddPCR system. |
| Pipet Tips for AutoDG | Bio-Rad | 1864120 | Or use material compatible with ddPCR system. |
| Pluronic F-68 Non-ionic Surfactant | Gibco | 24040 | N/A |
| Primer and Hydrolysis Probes | Various | Various | Design based on target sequence using general approaches for primer/probe design. Select fluorphores and quenchers compatible with ddPCR system. |
| Restriction Enzyme | Various | Various | Varies with target amplification sequence. Use restriction enzyme that does not cut in the amplified sequence |
| Sheared salmon sperm DNA | ThermoFisher | AM9680 | N/A |
| Synthetic DNA gene fragment or linearized plasmid | Various | Various | Design a synthetic DNA fragment containing the target amplification region for use as a quality control |
| TE Buffer | Teknova | T0224 | Ensure prepared or purchases nuclease free. 10 mM Tris-HCl, 1.0 mM EDTA, pH=8.0 |
| Touch Thermal Cycler | Bio-Rad | C1000 | Or use material compatible with ddPCR system. |
Ссылки
- Sherkow, J. S., Zettler, P. J., Greeley, H. T. Is it 'gene therapy. Journal of Law and the Biosciences. 5 (3), 786-793 (2018).
- Ginn, S. L., Amaya, A. K., Alexander, I. E., Edelstein, M., Abedi, M. R. Gene therapy clinical trials worldwide to 2017: an update. The Journal of Gene Medicine. 20 (5), 3015 (2018).
- Ghosh, S., Brown, A. M., Jenkins, C., Campbell, K. Viral vector systems for gene therapy: a comprehensive literature review of progress and biosafety challenges. Applied Biosafety. 25 (1), 7-18 (2020).
- Gene, Cell, & RNA therapy landscape, Q4 2022 quarterly data report. American Society for Gene & Cell Therapy Available from: https://asgct.org/global/documents/asgct_citeline-q4-2022-report_final.aspx (2022)
- Approved Cellular and Gene Therapy Products. United States Food and Drug Administration Available from: https://www.fda.gov/vaccines-blood-biologics/cellular-gene-therapy-products/approved-cellular-and-gene-therapy-products (2022)
- Au, H. K. E., Isalan, M., Meilcarek, M. Gene therapy advances: a meta-analysis of AAV usage in clinical settings. Frontiers in Medicine. 8, 809118 (2022).
- Lundstrom, K. Viral vectors in gene therapy. Diseases. 6 (2), 42 (2018).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-associated virus (AAV) as a vector for gene therapy. BioDrugs. 31, 317-334 (2017).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: a randomized, controlled, open-label, phase 3 trial. Lancet. 390 (10097), 849-860 (2017).
- Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drugs (INDs). United States Food and Drug Administration Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/chemistry-manufacturing-and-control-cmc-information-human-gene-therapy-investigationsal-new-drug (2020)
- Long term follow-up after administration of human gene therapy products. United States Food and Drug Administration Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/long-term-follow-after-adminstration-human-gene-therapy-products (2020)
- Testing of retroviral vector-based human gene therapy products for replication competent retrovirus during product manufacture and patient follow-up. United States Food and Drug Administration Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/testing-retroviral-vector-based-human-gene-therapy-products-replication-competent-retrovirus-during (2020)
- Recommendations for microbial vectors used in gene therapy. United States Food and Drug Administration Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/recommendations-microbial-vectors-used-gene-therapy (2016)
- Multidisciplinary: gene therapy. European Medicines Agency Available from: https://www.europa.eu/en/human-regulatory-development/scientific-guidelines/multidisciplinary/multidisciplinary-gene-therapy (2023)
- Human gene therapy for retinal disorders. United States Food and Drug Administration Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/human-gene-therapy-retinal-disorders (2020)
- Design and analysis of shedding studies for virus or bacterial-based gene therapy and oncolytic products. United States Food and Drug Administration Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/design-and-analysis-shedding-studies-virus-or-bacteria-based-gene-therapy-and-oncolytic-products (2015)
- Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products. European Medicines Agency Available from: https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-quality-non-clinical-clinical-aspects-gene-therapy-medicinal-products_en.pdf (2018)
- Kaur, S. white paper on recent issues in bioanalysis: mass spec of proteins, extracellular vesicles, CRISPR, chiral assays, oligos; nanomedicines bioanalysis; ICH M10 section 7.1; non-liquid & rare matrices; regulatory inputs (part 1A - recommendations on endogenous compounds, small molecules, complex methods, regulated mass spec of large molecules, small molecule, PoC & part 1B - regulatory agencies' inputs on bioanalysis, biomarkers, immunogenicity, gene & cell therapy and vaccine). Bioanalysis. 14 (9), 505-580 (2022).
- Hays, A., Islam, R., Matys, K., Williams, D. Best practices in qPCR and qPCR validation in regulated bio analytical laboratories. The AAPS Journal. 24 (2), 36 (2022).
- Ma, H., Bell, K. N., Loker, R. N. qPCR and qRT-PCR analysis: Regulatory points to consider when conducting biodistribution and vector shedding studies. Molecular Therapy. Methods & Clinical Development. 17 (20), 152-168 (2020).
- Wissel, M. Recommendations on qPCR/ddPCR assay validation by GCC. Bioanalysis. 14 (12), 853-863 (2022).
- Expectations for biodistribution (BD) assessments for gene therapy (GT) products. International Pharmaceutical Regulators Programme Available from: https://admin.iprp.global/sites/default/files/2018-09/IPRP_GTWG_ReflectionPaper_BD_Final_2018_0713.pdf (2018)
- Pinheiro, L., Emslie, K. R. Basic concepts and validation of digital PCR measurements. Methods in Molecular Biology. 1768, 11-24 (2018).
- Tzonev, S. Fundamentals of counting statistics in digital PCR: I measured two target copies-what does it mean. Methods in Molecular Biology. 1768, 25-43 (2018).
- Prantner, A., Marr, D. Genome concentration, characterization, and integrity analysis of recombinant adeno-associated viral vectors using droplet digital PCR. PLoS One. 18, 0280242 (2023).
- Primer-BLAST. National Library of Medicine, National Center for Biotechnology Information Available from: https://www.ncbi.nim.nih.gov/tools/primer-blast/ (2023)
- Koressaar, T., Remm, M. Enhancements and modifications of primer design program Primer 3. Bioinformatics. 23 (10), 1289-1291 (2007).
- Ye, J. Primer-BLAST: A tool to design target-specific primers for polymerase chain reaction. BMC Bioinformatics. 13, 134 (2012).
- Droplet Digital PCR Application Guide. Bio-Rad Available from: https://www.bio-rad.com/webroot/we/pdf/lsr/literature/Bulletin_6407.pdf (2023)
- Qian, P. L., Sauzade, M., Brouzes, E. dPCR: A technology review. Sensors. 18 (4), 1271 (2018).
- Basu, A. Digital assays part I: portioning statistics and digital PCR. SLAS Technology. 22 (4), 369-386 (2017).
- Sanmiguel, J., Gao, G., Vandeberghe, L. H. Quantitative and digital droplet-based AAV genome titration. Methods in Molecular Biology. 1950, 51-83 (2019).
- Bachhuber, F., Huss, A., Senel, M., Tumani, H. Diagnostic biomarkers in tear fluid: from sampling to preanalytical processing. Scientific Reports. 11, 10064 (2021).
- Martinez-Fernandez de la Camara, C., McClements, M. E., MacLaren, R. E. Accurate quantification of AAV vector genomes by quantitative PCR. Genes. 12 (4), 601 (2021).
- Ai, J., Ibraheim, R., Tai, P. W. L., Gao, G. A scalable and accurate method for quantifying vector genomes of recombinant adeno-associated viruses in crude lysate. Human Gene TherapyMethods. 28 (3), 139-147 (2017).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Frontiers in Microbiology. 10, 1570 (2019).
- Bennett, A., et al. Thermal stability as a determinant of AAV serotype identity. Molecular Therapy Methods and Clinical Development. 6, 171-182 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены