Method Article
T波イオンモビリティー質量分析:タンパク質複合体解析のための基本的な実験手順
要約
イオンモビリティー質量分析法は、その衝突断面積と質量に基づいて、イオンを分離する新興気相技術です。方法は、タンパク質複合体の全体的なトポロジーと形状の三次元情報を提供します。ここで、我々は、機器設定や最適化、ドリフト時間のキャリブレーション、およびデータ解釈のための基本的な手順を概説する。
要約
イオンモビリティ(IM)は、弱電界の影響下で加圧セルを通過するイオンにかかる時間を測定する方法です。イオンがドリフト領域を横断これにより、速度はその大きさに依存します:大規模なイオンがバックグラウンド不活性ガス(通常はN 2)との衝突の大きい数を経験し、その結果、より小さいを構成するこれらのイオンよりもIMのデバイスを介して、よりゆっくりと旅する断面。一般的に、イオンが濃いガスの相も移行するのにかかる時間は、その衝突断面積(Ω)によると、それらを分離する。
最近、IM分析法は質量分析法と結合され、進行波(T波)SYNAPTイオンモビリティー質量分析計(IM - MS)がリリースされました。イオン移動度と質量分析を統合することで三次元スペクトルを(電荷の質量、強度、およびドリフトの時間)を得た、サンプルの分離と定義の余分な次元が可能になります。この分離技術は、スペクトルの重複が減少することができます、と非常に似て質量、または質量対電荷比が、異なるドリフト時間を持つ異種複合体の分解能を可能にします。また、ドリフト時間の測定値は、Ωがイオンの全体的な形状とトポロジーに関連しているとして、構造情報の重要なレイヤを提供しています。測定されたドリフトの時間値とΩの間に相関関係が定義されているクロスセクション1の較正タンパク質から生成された検量線を用いて計算されます。
IM - MSのアプローチのパワーは、サブユニットのパッキングとマイクロモル濃度でタンパク質のアセンブリの全体的な形状を定義する能力にあります、そして近い生理的な条件は1。成功したタンパク質四次構造を気相で維持、および未知の幾何学のタンパク質集合体の研究ではこのアプローチの可能性をハイライト表示されていることを明らかに個々の蛋白質2,3および非共有結合タンパク質複合体4-9、両方の最近のいくつかのIMの研究。 10;ここで、我々は、SYNAPT(四重極イオンモビリティ-飛行時間型)HDMSの楽器(現在入手可能な唯一の商用IM - MSの楽器ウォーターズ株式会社)を用いて、タンパク質複合体のIMS - MS分析の詳細な説明を提供しています。我々は、基本的な最適化の手順、衝突断面のキャリブレーション、およびデータの処理および解釈するための方法を説明します。プロトコルの最後のステップは、理論上のΩ値を算出する方法を説明します。全体的に、プロトコルは、タンパク質のアセンブリのIM - MSの特性評価のあらゆる側面をカバーしようとするのではなく、その目標は、フィールドでの新たな研究者に法の実用的側面を導入することである。
プロトコル
我々が説明する手順は、単にタンパク質複合体のIM - MS分析に焦点を当てています。したがって、我々は構造的なMSの分野で面識のない研究者は、サンプル調製のステップ、計器のキャリブレーションとKirshenbaum らに記載されてMSおよびタンデムMSの最適化手順を参照していることを示唆し、2009年https://www.jove.com/index/detailsを。 STP?ID = 1954。一般的には、このプロトコルは、酢酸アンモニウム( - 1 M、pHは6〜8 0.005)のような揮発性緩衝液中で複合体の低マイクロモル濃度(1〜20μM)を含む。 1〜2μLをキャピラリーナノフローあたりに消費されていることを考えると、MS条件の最適化を有効にするために、最小体積として10〜20μlを示唆している。
第1部:イオンモビリティー質量分析法のスペクトルを取得
- モビリティ- TOF、正イオンの買収、およびV -モード:次の操作モードでの質量分析計を設定します。
- (API、トラップおよびIMS)すべてのガスをオンにします。我々は、トラップ/転送のためにIMの分離のためのN 2、及びArを使用してください。推奨される初期値は、1.5トラップ領域のml /分、及びIMSデバイス用の24 ml / minのガス流量です。
- m / zの取得範囲を設定します。未知のタンパク質複合体のために、我々は、所望の値に低減することができる広い質量範囲の最初の使用を、示唆している。並行して、最大の伝送効率のためのMSプロファイルを調整します。大規模な複合体の場合は、取得の質量範囲は1,000から設定する必要があります - 32,000のm / z、および自動のMSプロファイルを。そうでない場合は、プロファイルは以下のチャートに従って、設定することができます。
のm / z ドウェル(%) ランプ(%) 960 10 20 3200 30 40 10667 - したがって、RFの設定を確認し、必要に応じ、大規模なタンパク質複合体の適切な値に調整します。
元 トラップ IMS 転送 RFオフセット 450 380 380 380 RFゲイン 0 0 0 0 RFリミット 450 380 380 380 - キャピラリー電圧(1,050-1,400 V)と低ナノフローの圧力(0.00から0.03のバー)を適用します。一度スプレーが開始される、最小限の値にナノフローの圧力を減らすことを試みて下さい。さらに、円錐を基準にして、キャピラリーの位置を調整します。
- すべての関連付けられているに詳述(最適化する必要がある、楽器に沿って圧力勾配、およびサンプリングコーンと同様に抽出コーン、バイアス、トラップおよび潜在的な設定を転送する:よく分解MSスペクトルを得るために、MSの買収のパラメータを調整JoveのプロトコルKirshenbaum ら、2009年https://www.jove.com/index/details.stp?ID=1954)。これらのパラメータはサンプルに依存しているが、ペプチドからタンパク質複合体への我々は様々なイオン質量のMSスペクトルを取得するために使用される条件は、、(また、図1を参照)、表1に概説されています。複合体の活性化を最小限に抑えるために、徐々にピークの位置を変えずに(〜10 Vのステップで)サンプルコーン、トラップとバイアス電圧を低減してみてください。
- 最適な質量スペクトルが得られればドリフトの時間プロファイルを調整する必要があります。蛋白質のアセンブリを分析する際に、質量とモビリティの両方の測定に最適な条件は、しばしば互換性がありませんので、両者の間の適切なバランスを取ることが重要です。全体的に、イオン移動度のプロットは、ピークが全体のドリフト時間の範囲に分布し、ピークプロファイルが滑らかである、ガウス分布(図2A、2B)に近づいているように最適化する必要があります。重要なピークは、複数のコンフォメーションの貧しい分離に関連することができる非対称。
- 一般的なルールとして、三つのパラメータ、T波速度、T波の高さとIMSのガス流量は、モビリティ分離を最適化するために調整することができます。の増加、T波の高さの値はそれを狭くする一方、T -波の速度を大きくすると、ドリフト時間分布のプロファイルを広げる予定。同様に、IMSのガス流量を増加させることはより高い値(最小のIMSのガス流量が10ml /分になるはず)に向かってドリフト時間のプロファイルをシフトします。我々は、(図2B)に固定、およびIMスペクトルが十分に解決されるまで三分の一を最適化可能な3つの変数の2つを残してお勧めします。この目的のために、250 m / sで、24 ml /分、再にT -波の速度とガスの流量を設定するspectively。その後、出発点として、3 VのT波の高さを設定し、段階的に、1 V刻みでそれを増加させる。一般的には、大きなイオンは高い波の高さが必要になります。通常は、IMSの圧力を変更する必要はありませんが、ときに高いバイアス電圧がバイアス電圧値の低下と、その結果、タンパク質複合体活性化の減少を可能にするIMSのガスを減らすこと、チューニングのために必要とされています。全体的に、10〜12トン/Δtの最大解像度に到達することができます。
- 条件は(低T波の高さまたは高T波速度および/または高いIMの圧力)に最適化されていないときは、イオンが効果的にIMのデバイスを介して通過しませんし、彼らの旅は、次のイオンのために必要な時間よりも時間がかかることがありますモビリティの細胞中に放出されるパケット。前のパケットがプッシャーの地域に配信される前に、結果として、新しいイオンのパケットがトラップ領域から解放されます。これは、ドリフト時間のスペクトルの最初の部分で観察されたピークがテーリングエッジ(図2C)中のイオンのそれと同一である"ロールオーバー"効果、につながる。このアーティファクトは、T波の高さを増加し、T波速度とIMSの圧力を減少させることによって除去することができます。さらに、トラップのリリースタイムを調整することができます。また、それにTransfer T波の高さはIMSセルに向かってイオンの漏れを防止するために少なくとも5 Vに設定されていることを検証するために重要であり、我々は、モビリティのトラップの高さは最大レベル(30 V)に維持することをお勧めします。
- 転送T -波の低速度と高振幅はドリフト時間分布のプロファイル(図2D)の"さざ波"につながる可能性があります。イオン(イオン到着/ドリフト時間)のモビリティ分離を転送し、TOFの領域を介して維持されていない場合は、このアーティファクトは、プッシャーの周波数と転送T波速度との間の部分的な同期のために、発生します。この影響を排除するために、プッシャーの時間または転送T -波の速度を調整する必要があるのどちらか。プッシャー周波数は質量の範囲に関連しているので、このパラメータが変更された場合、このアーティファクトが再び表示されます。その削減にも波紋を排除するために役立つかもしれませんが、T波の高さは、マイナーな効果を発揮する。
- 前述のパラメータが最適化されると、IM - MSのデータを取得することができます。
パート2:ネイティブ構造のモビリティ測定を保証するために実験条件をスクリーニング
高度に解決したMSのピークを達成するために、タンパク質複合体は、多くの場合、残留水やバッファー成分11の除去を促進するため、質量分析計内でアクティブ化されます。活性化エネルギーが展開部分、しきい値を超えて増加されている場合には、ネイティブ、解決状態の構造(図3A - C)に対応しにくい、複数の中間状態12を形成誘導することができる。その結果、ドリフト時間のピークが折りたたま構造の不均一な集団を反映し、シフトと広げることができる。
液相の構造と一貫性のあるドリフト時間のデータを得るためには、それは分離してIMをする前に加速するイオンのために使用される電圧を、慎重に制御することが不可欠です。また、高いMSの解決には、転送ではなく、トラップの電圧を増加させることが望ましい。 IMのデバイスが配置されているとして、MSの精度を高めることができる一方、最初に、転写領域とTOFアナライザに続く、従って、活性化がIM測定とイオン以下は、影響を受けません。
そのデータの取得が複雑なのネイティブ構造を維持する条件下で行われる検証するためには、データはパラメータのセット、単一の、最適化に基づいて実験的な解決策の条件の範囲ではなく、以上を記録することを推奨する。
- ドリフト時間のスペクトルへの影響を監視しながら、段階的に毛細血管とコーン電圧を増加させる。
- ステップ1と同様に、段階的にトラップの衝突の電圧を増加し、10 Vの間隔でデータを取得する。
- 展開したコンフォメーションを識別し、取得したデータを評価するために、手動で2-7のpH範囲にわたって酢酸で試料を滴定することによってタンパク質複合体の解離を誘導し、データ(図3B)を記録。
パート3:ドリフト時間の値と断面積の間の関連付け
測定されたドリフト時間の値が直線的にΩに関連する従来のIMの測定とは異なり、T波のIMSシステムでは、断面積は、キャリブレーションアプローチによって定義されます。このように、むしろ絶対的な測定よりも、相対的な指数の相関が測定されたドリフト時間とΩ1,13の間に生成されます。 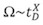
ここで、t、Dは測定されたドリフト時間であり、そしてXは、検量線から抽出することができる比例定数です。キャリブレーションが実行され既知のΩ(従来のIMの実験から測定)とイオンのドリフト時間を測定することにより、ED。
- ドリフト時間の測定は、変性タンパク質馬のチトクロームC、馬の心臓ミオグロビンおよび既知の衝突断面積を持つウシユビキチンを使用して校正されています。この目的のために、49/49/2に10μM、体積比のソリューションは、水/メタノール/酢酸は(使用する試薬は表3に概説されている)準備する必要があります。
- 標的タンパク質またはタンパク質複合体のために使用されて全く同じ楽器の条件の下で較正タンパク質のIM - MSのデータを取得する:
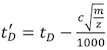 (その1)。すべての電圧と圧力の値は、IM分離の設定を維持するために、同一である必要があります。
(その1)。すべての電圧と圧力の値は、IM分離の設定を維持するために、同一である必要があります。 - 較正タンパク質の各荷電状態のために実験的なドリフト時間の値(T D)を (パート4で説明されている)を解凍します。
- 以下の式を用いて較正ドリフト時間(T D)(表2)のそれぞれを修正します。
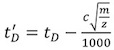 、ここでm / zは観測されたイオンの質量対電荷比であり、cは強化されたデューティサイクル(EDC)の遅延係数は1です。一般的に1.4と1.6の間でその値は、測定器に依存します。アクイジションの設定| |アクイジションSetupタブEDCの値は、システム内に示されています。
、ここでm / zは観測されたイオンの質量対電荷比であり、cは強化されたデューティサイクル(EDC)の遅延係数は1です。一般的に1.4と1.6の間でその値は、測定器に依存します。アクイジションの設定| |アクイジションSetupタブEDCの値は、システム内に示されています。 - 教授デビッドクレマーのクロスセクションのデータベースの使用:
http://www.indiana.edu/〜クレマー/リサーチ/クロス%20section%20database/Proteins/protein_cs.htm 14は、イオンの電荷状態と換算質量の両方の断面較正のそれぞれを修正。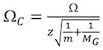
、Ω、Cは断面が修正されているところ、Ωは、文学の断面であり、zはイオンの電荷状態であり、mは較正イオンの分子量であり、そしてM Gは、IMのバックグラウンドガス(通常は分子量です。 N 2)。 - で反対のプロット(T D)(ΩC)(図4A)。
- 結果の曲線は次式に対応しています。
 パラメータXと直線関係にプロットをフィッティングすることにより抽出することができます。スロープXは指数関数的比例係数に対応し、フィットに決められた定数を表します。
パラメータXと直線関係にプロットをフィッティングすることにより抽出することができます。スロープXは指数関数的比例係数に対応し、フィットに決められた定数を表します。 - ピアソンの式を用いて、近似相関係数R 2を計算します。
 。 R 2の許容値は0.95(図4B)よりも大きいです。低い相関係数の値が原因である可能性があります。
。 R 2の許容値は0.95(図4B)よりも大きいです。低い相関係数の値が原因である可能性があります。 - タンパク質のcalibrantsの展開が不完全。これは中間状態の異機種混在アセンブリのために拡大をピークにつながる。
- 我々の経験では、高齢者のサンプルは、IMスペクトルを悪化させることができる。
- 別の較正のタンパク質で使用されている異種の実験条件。この場合、それぞれのタンパク質のデータをプロットすると、個別にそれぞれが0.95よりも高くなるはずですが、様々な相関係数を生成する必要があります。
- ノイズの多いデータと平滑化とドリフト時間分布の中心が正しくない。
- 計算エラー。
- 手順7で得られた決定指数因子、Xを 、使用して較正ドリフト時間をRecorrect:
- 検証のステップとして、replotはΩはC対
 と相関係数を定義する。 0.95より高い値は予想されています。
と相関係数を定義する。 0.95より高い値は予想されています。 - 手順4で説明した手順にしたがって、標的タンパク質またはタンパク質複合体の測定されたドリフトの時間を修正します。
- 手順7で定義されている指数因子、Xを使用して、標的タンパク質/タンパク質複合体のドリフト時間のキャリブレーション:
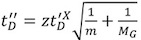
- 手順7で定義されている、、フィットに決められた定数を用いて標的タンパク質/タンパク質複合体のΩを計算します。
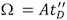 。
。 - 各実験条件については、13〜ステップ2を繰り返す必要があります。未知のタンパク質やタンパク質複合体の断面積を定義するときに、我々は、各実験は少なくとも3回繰り返し、そしてこれら3回の測定の標準偏差を決定することをお勧めします。
パート4:ドリフト時間の値を定義する
必要なソフトウェア:MassLynxとDriftscope(ウォーターズ)。
- Driftscopeソフトウェアを使用してIM - MSスペクトルを開きます。
- メインメニューから、Viを選択します。EWとチェックを外してクロマトグラム、ドリフト時間とスペクトラム(オプション)、アクティブなドリフト時間対のm / zを表示している場合にのみ、2Dマップを残す
- オプション| |ディスプレイエディタパネルとバックグラウンドノイズを(ほとんどの場合、この設定は最小= 30から40パーセントと最大値= 100%カウントとして定義することができます)最小限に抑えるために強度のしきい値を調整するメニューバーから、表示を選択します。
- Displayを選択| 2Dマップの輝度スケールを、そして3つのオプションが表示されます:、リニアスケールをログスケールと平方根のスケール。ログスケールの選択は、(対数のデータは変換)(のような線形と平方根のオプションとは対照的に、唯一の最も強いピークが可視になるかと)の強度のカラーコードを圧縮し、強度の広範囲の同時出現を可能にする。
- ツールバーのパネルから、[選択ツール]ボタンを使用してください。このオプションは、さまざまな選択オプションを有効にし、スペクトル内の関連する領域の選択が可能になります。最も精密なツールは、境界がそれによってすべての不要なデータとノイズのピークを除いて、関心領域の周囲に描画されるかもしれないにより、金利の選択の領域を有効にすることです。同様に、直交とバンド選択オプションは、関心領域が冗長な山々に囲まれていないときに、便利です。
- 関心領域を選択すると、不必要な情報を削除するには、受け入れる現在の選択範囲のコマンドを使用します。
- ドリフト時間の情報を保持しながら、MassLynxにデータをエクスポートします。
- MassLynx内に、保存されてドリフトの時間スペクトルのクロマトグラムを開き、時間ビンを組み合わせる。対応する質量スペクトルが自動的に開きます。
- 滑らかなパラメータ(最小の値を使用して、各スペクトルのために特別にチューニングする必要があります)のウィンドウのサイズと数を定義することによって平滑化関数を適用する。
- 必要に応じて、ベースライン減算を適用します。
- センターでは、スペクトルおよび質量を測定し、蛋白質のアイデンティティーと質量精度を検証する。
- それぞれの充電状態の場合は、m / z範囲を組み合わせる。対応するドリフト時のスペクトルが自動的に表示されます。スムーズと中心ドリフト時間のプロファイル、および各ピークの重心を示すことで、ドリフト時間の値を定義します。
パート5:代表的な結果

図1。 IMS - MSの買収の主要な調整可能なパラメータを示すSYNAPT HDMS器の模式図 。 IM - MSの測定に使用される実験のパラメータは、機器内での位置に従ってラベル表示されています。イオンビームは赤で着色され、そして各地域での圧力はカラーコードを使用して指定されています。下部にあるパネルには楽器とトラップと転送の衝突エネルギーだけでなく、バイアス電位を定義する潜在的な相違点に沿って電位勾配を示しています。すべての電位は、通常120Vに設定されている静的なオフセット電圧を基準としているバックを読んで。

図2。 Gβυタンパク質のイオンモビリティの到着時間分布。
A.高いT波速度はドリフト時間のプロファイルの狭い分布につながる。プロットはの到着時間分布を示しています。 16 +(赤)、15 +(緑)、14 +(青)、及び13 +(マゼンタ)の電荷状態だけでなく、Gのβυタンパク質の合計ドリフトの時間プロファイル(黒で)。
B.滑らかなガウスピーク形状最適化されたドリフト時間スペクトル。と同様のカラーラベル。
C.モビリティのセルを通過するイオンにかかる時間は、デバイスに新しいイオンのパケットの注射の間隔よりも遅い場合に発生する"ロールオーバー"効果、。結果として、拡張版のドリフト時間のピークは、スペクトルの先頭に表示されます。この効果は、T波の高さを増加し、T波速度とIMSの圧力を減少させることによって除去することができます。
転送T波速度とプッシャーの周波数が部分的に同期されるときにD.人工"波紋"が引き起こされます。この効果は、プッシャーの周波数または転送T波速度のどちらかを調整することによって克服することができます。
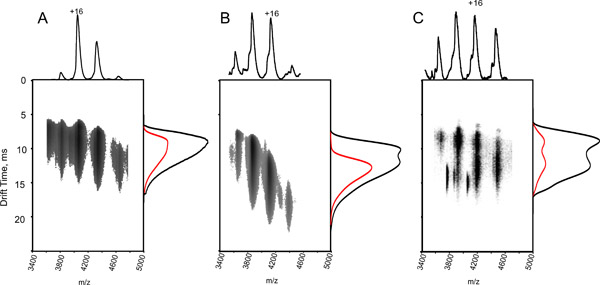
図3。ヘモグロビンのIM - MSスペクトルのイオン活性化し、部分的な変性条件の影響。量体ヘモグロビン複合体のためのm / z対ドリフト時間のプロット、10mMの酢酸アンモニウム(pH = 7.6)を(A、C)の水溶液を使用してと0.1%酢酸(B)の加算。データは、トラップの衝突エネルギーの13 V(A、B)の電圧、35 V(C)すべての3つのパネルで、質量スペクトルが(上に投影さ)4,000のm / zを中心とする四量の電荷シリーズで、同じように見えますが、を使用して取得ドリフトの時間プロファイルは、(両側に投影)とは異なります(総ドリフト時間の分布は黒、そして16 +のプロフィールに)赤になります。 Cで得られたBで得られた部分的に変性したサンプルの長いドリフト時間、、と気相アクティブイオンが、、展開のある程度の指標となる。この観察結果は、測定された質量はそのままに、複雑に対応していても、その溶液構造が破壊されていることを示しています。結果として、実験条件の注意深い制御が必要である。
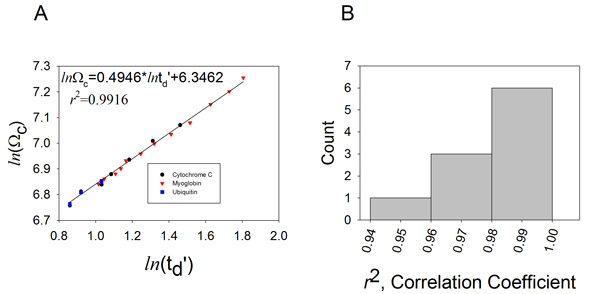
図4。検量線を生成することにより、ドリフト時間の測定値との衝突断面を相関させることができる 。
A.は、イオンの電荷状態と換算質量の両方を補正した文献Ωの値に対してプロットされた馬のチトクロームC(丸)、馬の心臓ミオグロビン(三角形)と(四角)ユビキチンウシの複数の電荷状態のドリフト時間の値を測定。 LN(ΩC)= XLN(T D')+ A.:フィットに対応する線形関数が得られます決定した指数因子(X)、()フィットに決められた定数、および相関係数は、350 m / sのT波速度、および11 V. Bの静的な波の高さで取得したデータのプロット上に表示されます。 10連続キャリブレーションの実験から得られた相関係数の分布のヒストグラム。
| タンパク質サンプル/技術的な変数 | GluFibrino - ペプチド 単量体 1.6 kDaの | ミオグロビン 単量体 17kDaの | ヘモグロビン 四量体 67 kDaの | トランスフェリン 単量体 80kDaの | GroELは 14 - merの 801 kDaの |
| バッキングの圧力、ミリバール | 4.4 | 5.0 | 5.1 | 5.1 | 6.5 |
| トラップの圧力、ミリバール | 1.6 × 10 -2 | 2.4x10 -2 | 2.4x10 -2 | 2.6 × 10 -2 | 2.8x10 -2 |
| IMSの圧力、ミリバール | 4.4x10 -1 | 4.4x10 -1 | 4.4x10 -1 | 4.4x10 -1 | 4.2x10 -1 |
| サンプリングコーン電圧、V | 46 | 80 | 80 | 80 | 118 |
| 抽出コーン電圧、V | 1.7 | 1 | 1 | 1 | 3 |
| バイアス電圧、V | 20 | 20 | 25 | 25 | 50 |
| トラップの衝突エネルギー、V | 20 | 15 | 15 | 15 | 80 |
| 転送衝突エネルギー、V | 5 | 12 | 12 | 12 | 15 |
表1。高分子の分析に使用される実験条件。
| 標準タンパク質 | 分子量(M) | 電荷(Z) | のm / z | 衝突断面積(2の) |
| チトクロームC | 12213 | 10 | 1222.3 | 2226 |
| 11 | 1111.3 | 2303 | ||
| 12 | 1018.8 | 2335 | ||
| 13 | 940.5 | 2391 | ||
| 14 | 873.4 | 2473 | ||
| 15 | 815.2 | 2579 | ||
| 16 | 764.3 | 2679 | ||
| 17 | 719.4 | 2723 | ||
| 18 | 679.5 | 2766 | ||
| ミオグロビン | 16952 | 11 | 1542.1 | 2942 |
| 12 | 1413.7 | 3044 | ||
| 13 | 1305.0 | 3136 | ||
| 14 | 1211.9 | 3143 | ||
| 15 | 1131.1 | 3230 | ||
| 16 | 1060.5 | 3313 | ||
| 17 | 998.2 | 3384 | ||
| 18 | 942.8 | 3489 | ||
| 19 | 893.2 | 3570 | ||
| 20 | 848.6 | 3682 | ||
| 21 | 808.2 | 3792 | ||
| 22 | 771.6 | 3815 | ||
| ユビキチン | 8565 | 8 | 1071.6 | 1442 |
| 8 | 1071.6 | 1622 | ||
| 9 | 952.7 | 1649 | ||
| 10 | 857.5 | 1732 | ||
| 11 | 779.6 | 1802 | ||
従来のIMSのmeasurments 14で決定表2。キャリタンパク質とそれらの衝突断面積の値。
| デバイス | 会社 | カタログ番号 |
| SYNAPT HDMS - 32K RFジェネレータ | ウォーターズ(株) | |
| P - 97フレーミング - ブラウンマイクロピペットプラー | サターインスツルメンツ | P - 97 |
| コーターをスパッタ | 電子顕微鏡学 | EMS550 |
| 双眼顕微鏡 | ニコン | |
| 試薬 | 会社 | カタログ番号 |
| 酢酸アンモニウム | シグマアルドリッチ | シグマ、A2706 |
| CsIの99.999パーセント | シグマアルドリッチ | アルドリッチ、203033 |
| メタノール | シグマアルドリッチ | フルカ、34966 |
| 酢酸 | フィッシャーサイエンティフィック | AC12404 |
| ウマミオグロビン(ウマ心臓から) | シグマアルドリッチ | M1882 |
| ウマシトクロムc(ウマ心臓から) | シグマアルドリッチ | C - 2506 |
| (赤血球から)ユビキチンウシ | シグマアルドリッチ | U6253 |
| ヘモグロビン | シグマアルドリッチ | H2625 |
| ガス | コメント | |
| 窒素、99.999%の純粋な | 8立方メートルのシリンダー | |
| アルゴン、99.999%の純粋な | 8.8立方meterscylinder | |
表3。試薬及び機器。
ディスカッション
ここで説明するプロトコルは、その全体の形状、ユニットのパッキンとトポロジーに関する情報を提供する目的で、未知の三次元構造を持つタンパク質やタンパク質複合体の衝突断面積を定義することができます。この目的のために衝突断面積の値は一度それが構造的な細部にこれらの値を数値に変換する必要が描かれている。このプロセスは、追加の実験的な取り組みだけでなく、以下に簡単に説明されている計算分析を、必要になります。
で始まるには、公知の構造を持つタンパク質やタンパク質複合体を分析することをお勧めします。これらの測定は、方法論の有用な品質管理を提供することができますし、理論と実測Ωの値を比較することにより、取得パラメータの精度評価を可能にします。理論的な断面積は、結晶構造から計算することができますMOBCAL 15,16ソフトウェアを使用して座標を、オペレータのニーズに応じてコードの編集を可能にするオープンソースFORTRANベースのソフトウェアである。このような計算を実行するためには、入力構造ごとに実行反復計算の数が増えると原子の多数を含む座標ファイルは、1を受け入れていることをされるようにプログラムを変更するために必要です。
多成分のアセンブリ内でサブユニットの位相的な取り決めを定義するためのIM - MSの戦略は、最近4,6に提案されている。メソッドは小さいコンポーネントにタンパク質のアセンブリの解離経路の監視を行います。この解離は、アセンブリの"ビルディングブロック"の反射subcomplexesの分布を生じさせる溶液相の条件の制御による調整、によって達成されます。無傷の複雑かつ分解製品の両方のΩ値の同時測定は、タンパク質複合体の位相モデルを計算するために使用されている構造的な制約を生成します。この方法論の根底にある基本的な前提は、生成されたsubcomplexesが母国のような確認を保持することであり、そして実際に最近の研究では、分解製品の溶液構造が維持されることが実証されていると、溶液または気相のどちらかに大きな転位4,6を発生していません。
気相タンパク質の錯イオンに四次構造の割り当ての最後のステップは、コンピュータが生成モデルに衝突断面積の値は継手です。モデリングのアプローチが異なる可能トポロジーサブユニットの手配、彼らのシリコ Ωの値での計算と実験値と比較さを探求するために採用されています。現在はわずか数計算のアプローチはサブユニット1,8の直径に近似するspheretype粗粒度方式と同様に、使用されています。全体的に、このフィールドは、初期の頃のままであり、さらなる発展は、このアプローチは一般的な、そして複合体の広い範囲に適用可能にするために必要です。
開示事項
謝辞
著者は彼らの批判的検討のため、および原稿への彼らの貢献のためにシャロンのグループメンバーに感謝。我々は、イスラエル科学財団(助成番号1823から1807と378/08)、生体膜研究のためのヨーゼフコーンミネルバセンター、新しい科学者のためのChaisファミリーフェロープログラム、アブラハムMorashaとBikuraプログラムの支援に感謝していますとソニアRochlin財団、ウォルフソンのファミリー公益信託、ヘレンと生体分子の構造や組立のためのミルトンA. Kimmelmanセンター、シュロモとサビーヌBeirzwinskyの不動産、MEILデボタンエインズレイ、そしてカレンシェムリアップ、英国。
参考文献
- Ruotolo, B. T. Ion mobility-mass spectrometry analysis of large proteincomplexes. Nat Protoc. 3 (7), 1139-1152 (2008).
- Scarff, C. A., Thalassinos, K., Hilton, G. R., Scrivens, J. H. Travelling wave ion mobility mass spectrometry studies of protein structure: biological significance and comparison with X-ray crystallography and nuclear magnetic resonance spectroscopy measurements. Rapid Commun Mass Spectrom. 22 (20), 3297-3304 (2008).
- Smith, D. P. Deciphering drift time measurements from travelling wave ion mobility spectrometry-mass spectrometry studies. Eur J Mass Spectrom (Chichester, Eng). 15 (2), 113-130 (2009).
- Leary, J. A. Methodology for measuring conformation of solvent-disrupted protein subunits using T-WAVE ion mobility MS: an investigation into eukaryotic initiation factors. J Am Soc Mass Spectrom. 20 (9), 1699-1706 (2009).
- Lorenzen, K. Determination of stoichiometry and conformational changes in the first step of the P22 tail assembly. J Mol Biol. 379 (2), 385-396 (2008).
- Pukala, T. L. Subunit architecture of multiprotein assemblies determined using restraints from gas-phase measurements. Structure. 17 (9), 1235-1243 (2009).
- van Duijn, E. Chaperonin complexes monitored by ion mobility mass spectrometry. J Am Chem Soc. 131 (4), 1452-1459 (2009).
- Ruotolo, B. T. Evidence for macromolecular protein rings in the absence of bulk water. Science. 310 (5754), 1658-1661 (2005).
- Ruotolo, B. T., Robinson, C. V. Aspects of native proteins are retained in vacuum. Curr Opin Chem Biol. 10 (5), 402-408 (2006).
- Giles, K. Applications of a travelling wave-based radio-frequency-only stacked ring ion guide. Rapid Commun Mass Spectrom. 18 (20), 2401-2414 (2004).
- McKay, A. R., Ruotolo, B. T., Ilag, L. L., Robinson, C. V. Mass measurements of increased accuracy resolve heterogeneous populations of intact ribosomes. J Am Chem Soc. 128 (35), 11433-11442 (2006).
- Ruotolo, B. T. Ion mobility-mass spectrometry reveals long-lived, unfolded intermediates in the dissociation of protein complexes. Angew Chem Int Ed Engl. 46 (42), 8001-8004 (2007).
- Morton, V. L., Stockley, P. G., Stonehouse, N. J., Ashcroft, A. E. Insights into virus capsid assembly from non-covalent mass spectrometry. Mass Spectrom Rev. 27 (6), 575-595 (2008).
- Valentine, S. J., Counterman, A. E., Clemmer, D. E. A database of 660 peptide ion cross sections: use of intrinsic size parameters for bona fide predictions of cross sections. J Am Soc Mass Spectrom. 10 (11), 1188-1211 (1999).
- Mesleh, M. F. Structural information from ion mobility measurements: effects of the long-range potential. J Phys Chem. 100, 16082-16086 (1996).
- Shvartsburg, A. A., Jarrold, M. F. An exact hard-spheres scattering model for the mobilities of polyatomic ions. Chem Phys Lett. 261, 86-91 (1996).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved