Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
In-vivo-Elektroporation von Entwicklung Maus Retina
In diesem Artikel
Zusammenfassung
Eine Methode für die Einbeziehung von Plasmid-DNA in murinen Zellen der Netzhaut zum Zwecke der Durchführung entweder gewinnen oder Verlust der Funktion Studien In vivo Vorgestellt. Diese Methode nutzt die vorübergehende Erhöhung der Durchlässigkeit der Zelle Plasmamembranen durch die Anwendung eines äußeren elektrischen Feldes induziert.
Zusammenfassung
Die funktionelle Charakterisierung von Genen während der Säugetier-Retina-Entwicklung ausgedrückt bleibt eine große Herausforderung. Gene-Targeting, um konstitutive oder bedingten Verlust der Funktion Knockouts generieren bleibt Kosten-und arbeitsintensiv, wie auch zeitaufwendig. Zusätzlich zu diesen Herausforderungen, ausgedrückt Netzhaut Gene können wesentliche Aufgaben außerhalb der Netzhaut, was zu unbeabsichtigten verwirrt, wenn sie eine Knockout-Ansatz. Darüber hinaus kann die Fähigkeit zur ektopisch Ausdruck eines Gens in einer gain of function Experiment extrem wertvoll sein, wenn versucht wird, eine Rolle in Zellschicksal Spezifikation und / oder terminale Differenzierung zu identifizieren.
Wir stellen eine Methode zur schnellen und effizienten Einbau von DNA-Plasmiden in das Neugeborenen-Maus Netzhaut durch Elektroporation. Die Anwendung von kurzen, elektrischen Impulsen über einem bestimmten Feldstärke ergibt sich ein vorübergehender Anstieg der Plasma-Durchlässigkeit der Membran, die Erleichterung der Übertragung von Material durch die Membran 1,2,3,4. Bahnbrechende Arbeiten zeigten, dass der Elektroporation als Methode des Gentransfers in Säugerzellen könnte durch Induktion der Bildung von hydrophilen Plasmamembran Poren erlauben den Durchtritt von hoch geladenen DNA durch die Lipid-Doppelschicht 5 genutzt werden. Kontinuierliche technische Entwicklung hat in der Lebensfähigkeit der Elektroporation als Methode zur in-vivo-Gentransfer in mehreren Maus Gewebe einschließlich der Netzhaut, die Methode für die hier 6, 7, 8, 9, 10 ist beschrieben, geführt.
DNA-Lösung wird in den subretinalen Raum injiziert, so dass DNA zwischen dem retinalen Pigmentepithel und Netzhaut des Neugeborenen (P0) Maus und elektrische Impulse gesetzt ist, sind unter Verwendung einer Pinzette Elektrode. Die seitliche Stellung der Augen in der Maus erlaubt die einfache Ausrichtung der Pinzette Elektrode, die notwendigen Minuspol-DNA-Retina-Pluspol Ausrichtung. Umfangreiche Einarbeitung und Ausdruck der übertragenen Gene können durch postnatalen Tag 2 (P2) identifiziert werden. Durch das Fehlen eines signifikanten seitlichen Migration von Zellen in der Netzhaut sind elektroporiert und Nicht-elektroporiert Regionen erzeugt. Non-elektroporiert Regionen können als interne histologischen Kontrollen gegebenenfalls zu dienen.
Retinal Elektroporation kann ein Gen unter einem allgegenwärtigen Promotor, wie CAG auszudrücken, oder um Genfunktionen mittels shRNA Konstrukte oder Cre-Rekombinase stören. Weitere gezielte Expression kann durch die Gestaltung Konstrukte mit Zell-spezifische Gen-Promotoren erreicht werden. Visualisierung von elektroporierten Zellen erfolgt über bicistronischen Konstrukte, die GFP oder durch Co-Elektroporation einem GFP-Expressionsvektor zu konstruieren. Darüber hinaus können mehrere Konstrukte für die Untersuchung von kombinatorischen Gen-Effekte oder die gleichzeitige Gewinn und Verlust der Funktion von Genen elektroporiert werden. Retinal Elektroporation kann auch für die Analyse von genomischen cis-regulatorische Elemente durch die Erzeugung geeigneter Expressionskonstrukte und Deletionsmutanten eingesetzt werden. Solche Experimente können verwendet werden, um cis-regulatorische Regionen ausreichend oder für zellspezifische Genexpression 11 erforderlich zu identifizieren. Mögliche Experimente sind nur durch bauen die Verfügbarkeit begrenzt ist.
Protokoll
1. Plasmid-Präparation für die Elektroporation
Die DNA-Konzentration für die Elektroporation erforderlich ist 5μg/μl. Dies erfordert in der Regel die gewünschten Plasmide zu verstärkende mit einem Maxi-Prep (Qiagen) oder vergleichbares Verfahren durch eine Reinigung und Konzentrierung der DNA, um die Arbeiterklasse Menge zu beachten. Die folgenden Schritte beschreiben die Herstellung von DNA, die arbeiten Menge.
- Aliquot 100 ug DNA (aus Maxi-Prep oder gleichwertig) und verdünnen das Volumen auf 100 ul für eine einfache Manipulation.
- Add Phenol, die Menge von Phenol zu berechnen, um eine etwa 60% DNA / Volumen-Verhältnis (ug DNA: Gesamtvolumens) erhalten werden, dh: 100 ug DNA (in 100 ul) plus 67 ul Phenol (100 ug: 167 ul). Gründlich mischen; nicht Pipette auf und ab, da dies starke Scherung der DNA führen können.
- Drehen Sie die DNA für 5 Minuten bei 14000 RPM bei Raumtemperatur.
- Sammeln Überstand und fügen Chloroform mit dem gleichen DNA: Gesamtvolumen Verhältnis in Schritt 1,2; mischen, wie in Schritt 1,2 und Spin bei 14000 RPM beschrieben für 5 Minuten bei Raumtemperatur.
- Sammeln Sie die überstehende, fügen Sie 10% Überstand Volumen 3 M Natriumacetat, um die DNA-Lösung, vorsichtig mischen und fügen 2.5 X Überstand Volumen von 100% Ethanol. Durch Umdrehen mischen. DNA sollte aus der Lösung ausfallen beim Mischen.
- Drehen Sie die DNA bei 4 ° C für 10 Minuten bei 14000 RPM.
- Spülen mit 350 ul 70% Ethanol, Spin bei 14000 rpm für 5 Minuten bei 4 ° C.
- An der Luft trocknen Pellet dann lösen sich die DNA in 1 X PBS (Zellbiologie grade) zu 5μg/μL. Nicht übertrocknen der Probe, da dies macht es sehr schwierig, in PBS auflösen.
- Add Fast Green Farbstoff (10% Aktien), um die DNA-Lösung wird die endgültige Konzentration des Farbstoffes 0,1%, als eine Injektion Tracer zu handeln.
2. Subretinalen Injektion von DNA
Die folgenden Schritte sind mit der Hilfe von einem Stereomikroskop durchgeführt. Sobald praktiziert den Prozess der Augenöffnung, Schnitt und Injektion dauert weniger als 1,5 Minuten, die nicht genug Zeit für eine richtig betäubt Welpe sich zu erholen. Mit einem scharfen 30-Gauge-Nadel, vorsichtig öffnen das Auge durch Schneiden entlang der verschmolzenen Saumepithels (Abb. 1C). Wenden Sie keine übermäßige Kraft, da dies bei der Reduzierung der zugrunde liegenden Augen führen kann. Vermeiden Sie Schnitte über den Bereich des Augenlids Kreuzung, da dies in Blutungen, die die Injektion obskuren können die Folge sein wird.
- Anesthetize die neugeborenen Mäusen auf Eis für mehrere Minuten (Abb. 1A), nicht begraben Welpen in das Eis, da dies in der Sterblichkeit führen kann. Die Länge der Zeit auf Eis ist variabel von Welpen zu Welpen, in der Regel 5 Minuten ist ausreichend, aber Mäuse sollten sorgfältig überwacht werden als Individuen sehr schnell reagieren kann oder auch längere Belichtungszeiten erfordern, geeignete Anästhesie zu gewährleisten. Führen Sie eine Pfote Prise mit Arterienklemmen für den Abzug Reflex zu überprüfen.
- Um die Injektion von DNA zu den subretinalen Raum zu erleichtern muss das Auge zuerst geöffnet werden. Swab das Auge mit einem 70% igem Isopropylalkohol prep (Tyco Healthcare) injiziert werden und Identifizierung der fusionierten Saumepithels, wo die beiden Augenlider zusammen kommen (Abb. 1B).
- Mit einem scharfen 30 Gauge-Nadel, vorsichtig öffnen das Auge durch Schneiden entlang der verschmolzenen Saumepithels (Abb. 1C). Wenden Sie keine übermäßige Kraft, da dies bei der Reduzierung der zugrunde liegenden Augen führen kann. Vermeiden Sie Schnitte über den Bereich des Augenlids Kreuzung, da dies in Blutungen, die die Injektion obskuren können die Folge sein wird.
- Um das Eindringen des Auges durch das stumpfe Ende Injektionsnadel mit der Spitze eines 30-guage Nadel einen kleinen Einschnitt in die Lederhaut in der Nähe der Kreuzung mit der Hornhaut (Abb. 1E) zu erleichtern. Dringen nicht zu tief, da dies in einer Punktion der Linse führen kann.
- Draw 0,3 ul der DNA-Lösung in einer 33-Gauge stumpfen Ende Injektionsnadel mit der Spritze Gradienten, um die Lautstärke individuell Maß für jede Injektion (Nadel Außendurchmesser 0,52 mm, Innendurchmesser 0,13 mm; Exmire Mikrospritze; Ito corp). Legen Sie die Nadel in der Einschnitt, bis der Widerstand der gegnerischen skleralen Wand zu spüren ist. Seien Sie vorsichtig und vermeiden Eindringen in die Linse, wie die Nadel durch den Glaskörper Kammer (Abb. 2B) übergeben wird.
- Langsam injizieren 0,3 ul der DNA-Lösung in den subretinalen Raum mit dem Zeigefinger oder dem Daumen auf den Spritzenkolben drücken. Der Versuchsleiter muss vorsichtig sein, um die Geschwindigkeit des Kolbens Depression, so dass die Rate, mit der die DNA-Lösung in den subretinalen Raum injiziert wird nicht schneller als der Rate, mit der die DNA-Lösung verteilt innerhalb subretinalen Raum (Abb. 2C) zu kontrollieren. Die DNA-Lösung ist zähflüssig, so ist es wichtig, dass die Nadel nicht zu dicht an der gegnerischen skleralen Wand gedrückt, da dies in der DNA nicht gespritzt oder nicht verbreitet gleichmäßig führen kann. Eine erfolgreiche Injektion wird in ein gleichmäßiges ErgebnisAusbreitung der DNA-Lösung in einem Teil des subretinalen Raum. Regionen der Netzhaut mit und ohne zugrunde liegende grüne Tracer sollte klar sein, beim Drehen des injizierten Tieres.
3. Elektroporation
- Die Elektroporation erfolgt mit einem Durchmesser von 10 mm Pinzette Elektrode (Modell # 522; BTX Instruments). Weichen Sie die Pinzette Elektrode in PBS, um die elektrische Leitfähigkeit von der Elektrode auf das Tier zu maximieren und platzieren Sie den Kopf des injizierten pup zwischen den Elektroden mit dem injizierten Auge neben dem Plus-Pol-Elektrode und der nicht-injizierten Auge neben dem Minuspol Elektrode (Abb. 3B).
- Bewerben fünf Quadratmeter Impulse mit einem Impulsgeber: jeder Impuls beträgt 80 Volt und 50 Millisekunden Dauer mit einem 950 ms Intervall zwischen den Impulsen.
- Die Elektroporation Welpen müssen nun erwärmt, bis sie aus dem Eis Narkose zu erholen. Dies kann durch die Welpen unter einer wärmenden Lampe oder auf einer Folie wärmer gemacht werden. Wenn Sie ein Bild wärmer sicherstellen, dass geeignete Unterlage zwischen der Metalloberfläche und der Wiederherstellung Welpen gelegt wird. Nach Wiederaufnahme Rückkehr der Elektroporation Welpen zu ihrer Mutter.
4. Vorbereitung der Augen für die Analyse
- Der Zeitpunkt der Ernte und Analyse der Elektroporation Netzhaut erfolgt vorbehaltlich der Ziele des Experiments. GFP-Expression kann grob visualisiert 3 Tage nach der Elektroporation. Für cryoembedding und Schnitte wie folgt vorgehen.
- Sacrifice elektroporiert Tiere an der gewünschten Zeitpunkt. Disect die Elektroporation Auge und fix in 4% Paraformaldehyd bei 4 ° C für 50 Minuten.
- Entfernen Sie vorsichtig die Netzhaut des Auges durch Mikro-Zerlegung entfernt die Sklera, Hornhaut, Linse, Aderhaut und Netzhaut-Pigmentepithel. Die seziert Netzhaut kann unter Fluoreszenz analysiert werden, um grob bestimmen die Effizienz der Elektroporation. Übertragen Sie die Netzhaut zu 30% Saccharose-Lösung über Nacht bei 4 ° C.
- Freeze-Netzhaut in Oktober Kryo-Einbetten von Medien (Sakura Finetek USA) und bei -80 ° C. Netzhaut kann jetzt geschnitten auf einem Kryotom und eroberte auf Glas-Objektträger.
5. Repräsentative Ergebnisse:
Beispiele für P0 Neugeborenen Netzhaut mit einem pCAG-EGFP Expressionsplasmid elektroporiert sind 3 Tage nach der Elektroporation (P3) und 14 Tage nach der Elektroporation (P14) in Abbildung 4 dargestellt. Der Bereich der Retina elektroporiert ist variabel von Experiment zu Experiment in Abhängigkeit vom Ausmaß der Gewebeschädigung bei der Injektion und Gleichmäßigkeit der Verteilung der DNA-Lösung in den subretinalen Raum entstehen. In der Regel 90-100% der Elektroporation Netzhaut wird Feature-Zellen, die erfolgreich integriert haben und äußerte die eingeführten Plasmid. Allerdings, wenn Factoring in Gewebemorphologie und Elektroporation Wirkungsgrad nur 40-60% der Elektroporation Netzhaut wird geeignet sein für eine vergleichende Analyse. Rosette Bildung und Netzhautablösung am Ort der Nadelpenetration ist fast immer beobachtet und dieser Region sollten nicht für die Analyse verwendet werden. Erfolgreiche DNA während der Mikroinjektion Ergebnisse in effizienter elektroporiert Gewebe lateral an den Ort der Nadelpenetration frei von Rosetten und Distanz zu verbreiten. Gliose ist auch ein wichtiges Anliegen experimentellen und fast immer tritt an der Stelle der Nadelpenetration. Jedoch, wie mit Rosette Bildung und Netzhautablösung ist Gliose in der Regel nicht in seitlich elektroporiert Gewebe von Bedeutung. Immunhistochemische Marker wie saures Gliafaserprotein (GFAP) kann genutzt werden, um festzustellen, ob Ebenen der reaktiven Gliose in analysierten Regionen innerhalb akzeptabler Grenzwerte fallen. Geteilter Netzhaut zeigen, dass die Morphologie der Elektroporation Netzhaut intakt und die EGFP-Expression Etiketten einzelnen elektroporierten Zellen präsentiert werden bleibt. Beispiele 3 Tagen nach einer P0 Elektroporation (Abb. 4A-C) und 14 Tage nach einer P0 Elektroporation (Abb. 4D-F) werden vorgestellt.
In P3 Netzhaut die Mehrheit der Elektroporation Zellen sind in der neuroblastic Schicht (NBL) der Netzhaut befindet, und zeigen nicht deutliche morphologische Eigenschaften einer differenzierten neuronalen oder glialen Zellen der Retina (Abb. 4B, C). Mit P14 elektroporiert Zellen können in der äußeren Körnerschicht (ONL) und die innere Körnerschicht (INL) der Netzhaut gefunden werden. Darüber hinaus die verschiedenen markierten Zellen zeigen nun charakteristischen morphologischen Merkmale der differenzierten Neuronen einschließlich Interneuronen des INL, Photorezeptoren und Müller Gliazellen (Abb. 4E, F).
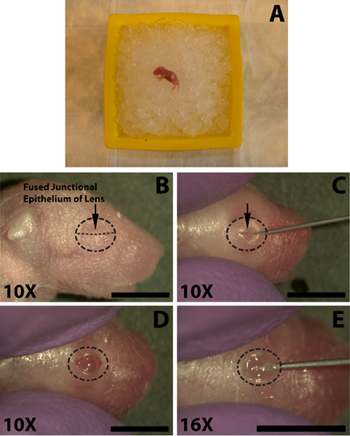
Abbildung 1. Anesthesia eines Neugeborenen (P0) Maus Welpen und die Öffnung des Auges zur subretinalen Injektion von DNA-Lösung. A) Neonatal pup am platziertein Bett aus zerstoßenem Eis für Betäubung. Eye injiziert werden nach unten gegen das Eis gelegt. B) Die Lage der fusionierten Saumepithels (B, Pfeil) der Augenlider nach Öffnen der Augen geschnitten werden. C) Schneiden der Augenlider entlang der fusionierten Saumepithels (C, Pfeil) auf das Auge setzen. D) Das geöffnete Auge nach Schneiden mit dem geschmolzenen Kreuzung. E) wird ein Schnitt in das Auge unter in der Lederhaut unter der Hornhaut, um ein leichtes Einführen der stumpfen Ende Mikro-Injektionsspritze zu erleichtern. Maßstabsbalken, B, C, D, E: 4mm.
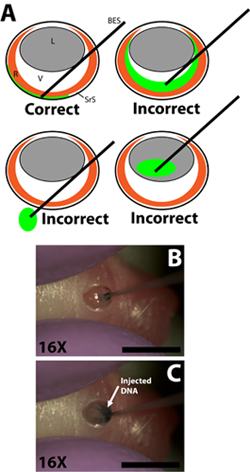
Abbildung 2. Insertion der stumpfen Ende Mikro-Injektionsspritze und Injektion von DNA-Plasmid-Lösung in den subretinalen Raum. A) Cartoon schematische Nachweis der korrekten Einbringung der Mikro-Injektion Spritze in das Auge und den Ausgleich der Spitze der Spritze in den subretinalen Raum. Die Injektion des DNA-Lösung in den Glaskörperraum, wird Passage von der Spritze durch das Auge in die Steckdose, oder Injektion in das Objektiv in gescheiterten Experimenten mit wenig oder gar keine elektroporierten Zellen führen. B) Penetration der Spritze in der Einschnitt in der skleralen Wand und Abrechnung der Spitze der Spritze in den subretinalen Raum gemacht. C) Injektion der DNA-Lösung in den subretinalen Raum. Maßstabsbalken, B, C: 4mm. Abkürzungen wie folgt: R-Retina-, L-Objektiv, V-Glaskörper, SRS-subretinalen Raum, BES-stumpf endende Spritze.

Abbildung 3. Ausrichtung der Pinzette Elektrode auf die Maus für die Elektroporation. A) Cartoon schematische zeigt die Ausrichtung der positiven und negativen Paddel der Pinzette Elektrode relativ zur elektroporiert Auge. Grün steht für den Speicherort der injizierten DNA in den subretinalen Raum. Eine gestrichelte Pfeile stellen die elektrophoretische Bewegung der negativ geladenen DNA injiziert in Richtung der positiven Elektrode. DNA-Elektrophorese tritt aus dem subretinalen Raum neben der negativen Elektrode in die Netzhaut, die ausgerichtet ist auf die positive Elektrode. B) Die positive Paddel der Pinzette platziert wird neben der DNA mikroinjiziert Auge und die negativen Paddel ist benachbart zu der nicht-injizierten Auge. C) Hohe Vergrößerung Bild Pinzette Platzierung der Elektroden auf der Neugeborenen-Maus. Die gestrichelten Linien stellen die Richtung der elektrophoretischen Bewegung der DNA in Richtung der positiven Elektrode. Maßstabsbalken, C: 5mm.

Abbildung 4. Neonatal Maus Netzhaut (P0) mit pCAG-EGFP elektroporiert und analysiert postnatalen Tag 3 (P3) und postnatalen Tag 14 (P14). AC) Konfokale Bilder von einer geschnittenen P3 Netzhaut mit pCAG-EGFP bei P0 elektroporiert. Die Mehrheit der Elektroporation Zellen sitzen in der Netzhaut neuroblastic Schicht (NBL). (DF) Konfokale Bilder von einer geschnittenen P14 Netzhaut mit pCAG-EGFP bei P0 elektroporiert. Elektroporiertem Zellen können in der äußeren Körnerschicht (ONL) und die innere Körnerschicht (INL) der Netzhaut identifiziert werden. Scale-Bars, AF: 50 pm.
Diskussion
In-vivo-Elektroporation stellt eine schnelle und effiziente Methode für die Transformation von Zellen der Netzhaut mit DNA-Expressionsplasmide. Diese Methode ermöglicht es dem Experimentator zu gain of function Studien ektopisch ein Gen von Interesse unter der Kontrolle eines ubiquitär exprimierten Veranstalter oder Verlust der Funktion Studien mit shRNA Konstrukte gezielt Gene von Interesse wahrnehmen können. Darüber hinaus können mehrere DNA-Plasmide gleichzeitig elektroporiert werden, so dass der Exper...
Offenlegungen
Danksagungen
Diese Arbeit wurde vom NIH R01EY020560-01 und von einer WM Keck Young Scholar in Medical Research Award finanziert. Die Autoren bedanken sich bei Joseph Bedont für seine Unterstützung danken, bei der Abbildung der Netzhaut Präparate und Injektionen.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenz | Firma | Katalog-Nummer | Kommentare |
|---|---|---|---|
| Buffer gesättigtem Phenol | Invitrogen | 15513-039 | N / A |
| Chloroform | JT Baker | 9180-03 | N / A |
| Natriumacetat | JT Baker | 3470-05 | 3 M Lager |
| Fast Green FCF | Fisher Biotech | BP123-10 | 10% Aktien |
| Isopropylalkohol prep | Tyco Healthcare | 6918 | N / A |
| 30-guage Nadel | Terumo Medical Corp | SG2-3013 | N / A |
| Exmire Mikrospritze | Ito Inc. | MS * E05 | N / A |
| Tweezertrode (Pinzette Elektrode) | BTX Instrument, Genetronics Inc. | 522 | N / A |
| Electro-Platz Porator (Elektroporator) | BTX Instrument, Genetronics Inc. | ECM 830 | N / A |
| OCT-Verbindung | Sakura Finetek USA | 4583 | N / A |
Referenzen
- Neumann, E., Rosenheck, K. Permeability changes induced by electric impulses in vesicular membranes. J. Membr. Biol. 10, 279-290 (1972).
- Turnbull, R. J. Letter: Letter: An alternate explanation for the permeability changes induced by electrical impulses in vesicular membranes. J. Membr. Biol. 14, 193-196 (1973).
- Zimmermann, U., Schulz, J., Pilwat, G. Transcellular ion flow in Escherichia coli B and electrical sizing of bacterias. Biophys. J. 13, 1005-1013 (1973).
- Kinosita, K., Tsong, T. Y. Voltage-induced pore formation and hemolysis of human erythrocytes. Biochim. Biophys. Acta. 471, 227-242 (1977).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Hofschneider, P. H. Gene transfer into mouse lyoma cells by electroporation in high electric fields. EMBO J. 1, 841-845 (1982).
- Swartz, M., Eberhart, J., Mastick, G. S., Krull, C. E. Sparking new frontiers: using in vivo electroporation for genetic manipulations. Dev. Biol. 233, 13-21 (2001).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc. Natl. Acad. Sci. U. S. A. 101, 16-22 (2004).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc. Natl. Acad. Sci. U. S. A. 104, 1027-1032 (2007).
- Onishi, A. Pias3-dependent SUMOylation directs rod photoreceptor development. Neuron. 61, 234-246 (2009).
- Onishi, A. The orphan nuclear hormone receptor ERRbeta controls rod photoreceptor survival. Proc. Natl. Acad. Sci. U. S. A. 107, 11579-11584 (2010).
- Kim, D. S. A Core Paired-Type and POU Homeodomain-Containing Transcription Factor Program Drives Retinal Bipolar Cell Gene Expression. J. Neurosci. 28, 7748-7764 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten