Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La visualización de la función respiratoria mitocondrial utilizando citocromo C Oxidasa / Succinato Deshidrogenasa (COX / SDH) de doble etiquetado Histoquímica
En este artículo
Resumen
El citocromo c oxidasa / deshidrogenasa de sodio (COX / SDH) de doble etiquetado método permite la visualización directa de las deficiencias de las enzimas respiratorias mitocondriales en secciones de tejido fresco congelado. Esta es una técnica histoquímica directa y es útil en la investigación de las enfermedades mitocondriales, el envejecimiento y los trastornos relacionados con el envejecimiento.
Resumen
El ADN mitocondrial (ADNmt) los defectos son una causa importante de enfermedad y puede ser la base del envejecimiento y el envejecimiento, alteraciones 1,2. La teoría mitocondrial del envejecimiento sugiere un papel de mutaciones en el ADNmt, que pueden alterar la homeostasis de la bioenergética y la función celular, en el proceso de envejecimiento 3. Una gran cantidad de pruebas ha sido elaborado en apoyo de esta teoría de 1,4, siendo un ejemplo el ADN mitocondrial mutador ratón 5, sin embargo, el papel preciso de daño mitocondrial en el envejecimiento no es completamente entendido 6,7.
Observando la actividad de las enzimas respiratorias es un método directo para la investigación de la disfunción mitocondrial. Complejo IV o citocromo c oxidasa (COX), es esencial para la función mitocondrial. Las subunidades catalíticas de la COX son codificadas por el ADNmt y son esenciales para el ensamblaje del complejo (Figura 1). Por lo tanto, la síntesis y funcionamiento se basan principalmente en la integridad del ADNmt 2.Aunque otros complejos respiratorios podrían ser investigados, complejos IV y II son los más susceptibles de examen histoquímico 8,9. Complejo II o succinato deshidrogenasa (SDH), es totalmente codificada por el ADN nuclear (Figura 1), y su actividad no suele ser afectada por un deterioro del ADNmt, a pesar de un aumento puede indicar la biogénesis mitocondrial 10-12. El ADNmt deterioro observado en las enfermedades mitocondriales, el envejecimiento y las enfermedades relacionadas con la edad a menudo conduce a la presencia de células con actividad de la COX bajo o ausente 2,12-14. Aunque las actividades de la COX y SDH pueden ser investigados de forma individual, la secuencial de doble etiquetado método de 15,16 ha demostrado ser ventajoso en la localización de las células con la disfunción mitocondrial 12,17-21.
Muchas de las constituciones óptimo del test, se han determinado, como por ejemplo la concentración de sustrato, receptores de electrones / donantes, intermediarios transportadores de electrones, la influencia del pH, y la reacción time 9,22,23. 3,3 '-diaminobencidina (DAB) es un donador de electrones eficaz y fiable 22. En las células con el funcionamiento de la COX, la indamine marrón polímero producto va a localizar en crestas mitocondriales y saturar las células 22. Aquellas células que tienen disfuncionales COX por lo tanto no estar saturado por el producto DAB, lo que permite la visualización de la actividad SDH por la reducción de nitroazul de tetrazolio (NBT), un receptor de electrones, a un producto final azul formazán 9,24. Citocromo c y sustratos succinato sódico son añadidos para normalizar los niveles endógenos entre el control y los tejidos enfermos / mutante 9. Catalasa se añade como medida de precaución para evitar posibles reacciones contaminantes de la actividad de peroxidasa 9,22. Metosulfato fenazina (PMS), un transportador de electrones intermedia, se utiliza en conjunción con azida sódica, un inhibidor de la cadena respiratoria, para aumentar la formación de los productos de reacción final de 9,25. A pesar de este informeción, algunos detalles importantes que afectan el resultado de este ensayo sencillo decorosa, además de los controles de especificidad y los avances en la técnica, aún no se han presentado.
Protocolo
1. Preparación de tejidos para muestras criostáticas
- El sacrificio del animal por dislocación cervical o decapitación, en conformidad con el permiso ético disponibles.
- Rápidamente recoger tejidos de interés (por ejemplo. Cerebral) y la velocidad de congelación del hielo seco (tejidos puede requerir congelación en isopentano o propano refrigerado con nitrógeno líquido para obtener la morfología óptima). Tejidos almacenar en papel de aluminio a -80 ° C hasta que esté listo a la sección.
- Insertar tejido congelado en la preparación de muestras criostáticas.
- Recoger de 14 micras secciones congeladas a -21 ° C (puede ser necesario ajustar la temperatura de ± 2.1 ° C). Secciones de deshielo en las diapositivas con un calentador, y se desliza tienda sin cubreobjetos a -20 ° C hasta su utilización.
2. COX histoquímica
- Permitir que se sequen a temperatura ambiente durante 1 hora. Poner los portaobjetos en una cámara de diapositivas-tinción con papel de filtro húmedo, cortada en tiras. Para obtener consistenciaresultados t en cada experimento, se recomienda para procesar un máximo de diez diapositivas por experimento para reducir al mínimo los retrasos.
- Prepare en una campana química 1X DAB, 100 mM citocromo c en PBS 0,1 M pH = 7,0. Vortex rápidamente.
- Añadir 2 g de bovino catalasa (2 mg ml -1 o IU aproximadamente 4 ml -1). Mezclar adecuadamente por agitación para romper todos los granos de la catalasa.
- Aplicar 150 a 200 l de medio de incubación en cada diapositiva, utilice punta de la pipeta para repartir uniformemente en todas las secciones.
- Incubar los portaobjetos durante 40 minutos a 37 º C.
- Retire el exceso de solución de las diapositivas. Lavar los portaobjetos 4 veces, 10 minutos cada vez, en PBS 0,1 M pH = 7,0.
- Volver a la cámara de diapositivas diapositivas-tinción con tiras de papel mojado.
3. SDH histoquímica
- Prepare en una campana química 1,5 mM de NBT, 130 mM succinato de sodio, 0,2 mM de PMS, y 1,0 mM de azida sódica en PBS 0,1 M pH = 7,0. Tome la precaución de proteger a losPMS de la luz. Vortex rápidamente.
- Aplicar 150-200 L de medio de incubación en cada diapositiva, utilice punta de la pipeta para repartir uniformemente en todas las secciones.
- Incubar los portaobjetos durante 40 minutos a 37 º C.
- Retire el exceso de solución de las diapositivas. Lavar los portaobjetos 4 veces, 10 minutos cada vez, en PBS 0,1 M pH = 7,0.
- Deshidratar las diapositivas durante 2 minutos en las siguientes concentraciones de etanol: 70%, 70%, 95%, 95%, el 99,5%. A continuación, espere 10 minutos en un paso adicional del 99,5%.
- Coloque los portaobjetos en xileno durante 10 minutos. Montar con Entellan y cubreobjetos. Deje que el que se sequen horas de la noche, o 2.1 por lo menos en un área ventilada.
4. Determinación de la disfunción mitocondrial
- El monto de la disfunción mitocondrial se indica por la cantidad de manchas azules celular. Para semi-cuantificar estas cantidades, las diapositivas debe ser codificado y se visualizó bajo el microscopio de campo brillante. Semi-cuantificación se debe realizar en una persiana base en una escala, por ejemplo, 0-4 (0, ausencia de manchas azules, 4, sólo la tinción de azul). Lo mejor es realizar este tipo de semi-cuantificación de varias secciones de un tema determinado / animal para calcular un valor medio para cada sujeto / animal.
- Las estadísticas se debe realizar mediante una prueba no paramétrica, como la de Mann-Whitney o Kruskal-Wallis.
5. Controles apropiados especificidad
- Para los controles de la especificidad de la actividad COX, repita "COX histoquímica" pasos, y añadir 2,5 mM de azida sódica, un inhibidor de la cadena respiratoria terminal.
- Para los controles de la especificidad de la actividad SDH, repita "SDH histoquímica" medidas con la eliminación de succinato de sodio y la adición de 50 mM malonato, un inhibidor competitivo de la SDH.
- Lave y deshidratar las secciones en una serie de etanol, y luego montar y cubreobjetos las diapositivas tal como se describe en los pasos 3,4 a 3,6.
6. Los resultados representativos:
tienda de campaña "> El esquema general de los ejemplos representativos COX / SDH doble etiquetado ensayo histoquímico se ilustra en la Figura 2. apropiado de la COX / SDH doble etiquetado histoquímica en secciones de cerebro de tipo salvaje y envejecimiento prematuro de los ratones mutadores ADNmt se muestra en la Figura 3. Las manchas de color marrón oscuro en ratones de tipo salvaje (Figura 3, panel izquierdo) mostraron actividad normal de la COX. Las células con deficiencias de la cadena respiratoria, indicada por la tinción de azul, se dieron a conocer en 12 semanas de edad, los ratones mutadores ADNmt, y se convirtió en estas deficiencias más amplia que los ratones mutadores ADNmt entre a 46 semanas (Figura 3, el centro y el panel de la derecha).Ejemplos de inadecuado COX / SDH de doble etiquetado en las secciones de cerebro de ratones de tipo salvaje debido a la falta de etiquetado COX se muestran en la Figura 4. Tiempo de incubación inadecuados para la demostración de la actividad de la COX, o la reducción de la disponibilidad de oxígeno molecular por el cubreobjetos de la diapositiva durante la incubación, se tradujo en una reducción de la deposición de la reacción DABproducto de iones, y por lo tanto permite la formación del producto final azul formazán durante la incubación SDH.
Actividades COX y SDH también puede ser investigado por separado (Figura 5, izquierda y centro), sin embargo, el etiquetado secuencial es útil para identificar las células con deficiencias de la COX, debido a la formación del precipitado de color azul durante la incubación SDH (Figura 3, el centro y derecha). Los controles de la especificidad de las actividades COX y SDH también se puede hacer (Figura 5, derecha).
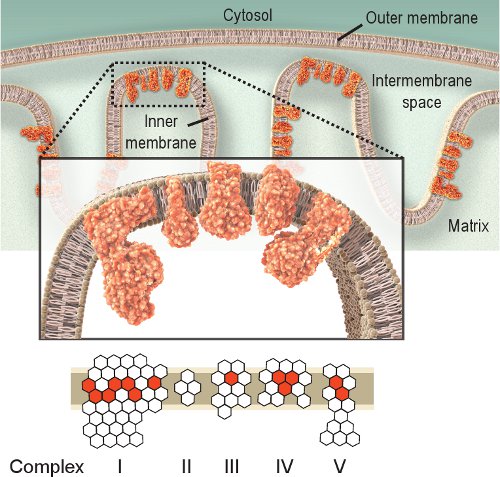
Figura 1. Respiratoria mitocondrial IV complejos. La cadena respiratoria mitocondrial se encuentra dentro de la membrana interna e incluye cinco complejos. El propósito de la cadena respiratoria es el transporte de electrones del Complejo I a IV, y al hacerlo se crea un gradiente de protones a través de la membrana interna utilizada por el complejo V (ATPasa) para producir ATP. Hexágonos represe Rednt subunidades codificadas por el ADNmt. Hexágonos blancos representan las subunidades codificadas por el ADN nuclear (tenga en cuenta que el complejo II está completamente codificada del genoma nuclear). Por lo tanto, las mutaciones en el genoma mitocondrial pueden causar una disfunción de la cadena respiratoria debida a mutaciones en las subunidades de los complejos de la cadena respiratoria.
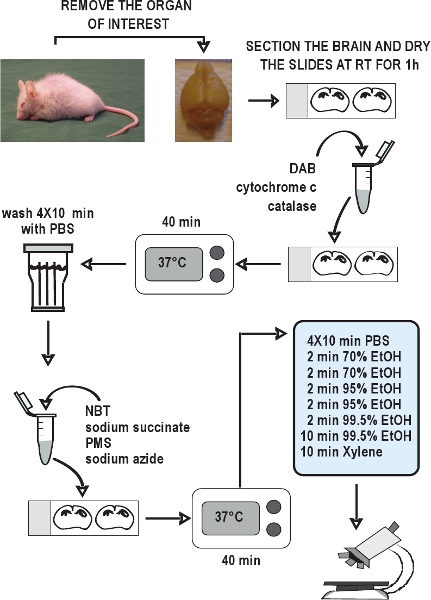
Figura 2. Diagrama de flujo del ensayo de COX / SDH de doble etiquetado de histoquímica. Diseccionar los órganos de interés, congelar rápidamente los tejidos en hielo seco, y almacenarlas a - 80 ° C. Recoger secciones de criostato y mantener a - 20 ° C hasta su uso. Permitir que las secciones se sequen al aire a temperatura ambiente durante 1 hora. Preparar el medio de incubación para la histoquímica de la COX, que se aplican a las diapositivas, y se incuba durante 40 minutos a 37 º C. Lavar las secciones en PBS 4 veces durante 10 minutos cada lavado. Preparar el medio de incubación para la histoquímica SDH, que se aplican a la slides, y de nuevo se incuba durante 40 minutos a 37 ° C. Lavar las secciones de nuevo en PBS, se deshidrata en una serie de etanol, y luego montar y cubreobjetos de las diapositivas. La COX / SDH de doble etiquetado secciones está listo para ver en el microscopio de campo brillante en 1-2 horas.

Figura 3. Ejemplos representativos de la COX / SDH de doble etiquetado. Secciones de cerebro de tipo salvaje y envejecimiento prematuro de los ratones mutadores ADNmt se etiquetarán secuencialmente para las actividades de la COX y SDH. (Barra de escala:. 200 micras) normal actividad de la COX (indicado por el color marrón oscuro) se muestra en el hipocampo de ratones de tipo salvaje (izquierda). Las deficiencias de la COX (indicado por el color azul) se dieron a conocer en el hipocampo de los ratones mutadores ADNmt (centro y derecha). Hubo una nueva disminución en la actividad de la COX por 46 semanas de edad en el ADNmt ratones mutadores, lo que sugiere la exacerbación de la disfunción generalizada de la cadena respiratoria. El mito observadoLa disfunción mitocondrial en los ratones mutadores ADNmt 12 es causada por niveles altos de mutaciones puntuales del mtDNA, así como mayores niveles de eliminaciones lineal 5.

Figura 4. Ejemplos de inadecuado COX / SDH de doble etiquetado. Secciones de cerebro de ratones de tipo salvaje fueron etiquetados de forma secuencial para las actividades de la COX y SDH. (Barra de escala:. 200 micras) veces inadecuada de incubación (10 y 25 minutos) para la demostración de la actividad COX dio lugar a una reducción de la deposición del producto de reacción marrón DAB, en comparación con el tiempo de incubación de 40 minutos (izquierda y centro). El acortar los tiempos de incubación permitió la formación del producto final azul formazán durante la incubación SDH, engañosamente que sugiere la presencia de células con deficiencias de la COX. Cubreobjetos las diapositivas durante la incubación de la COX también dio lugar a la formación de inexacta y la deposición de la reacción DABiones producto (derecha).
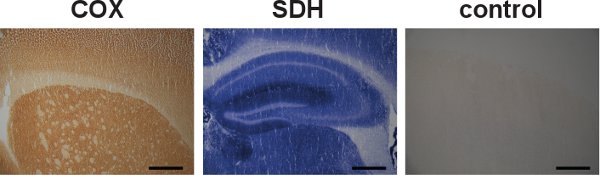
Figura 5. INDIVIDUALES COX y SDH etiquetado y el control de la especificidad. Secciones de cerebro de ratones de tipo salvaje fueron etiquetados por separado para las actividades COX y SDH, indicado por el color marrón oscuro y el color azul, respectivamente (izquierda y centro). Aunque las actividades de la COX y SDH puede ser etiquetados individualmente, el etiquetado secuencial ha demostrado ser ventajoso en la localización de las células con la disfunción mitocondrial. Un ejemplo de un control específico de la COX y SDH actividades en el cerebro de un ratón de tipo salvaje mostró ausencia de etiquetado (derecha). (Barra de escala:. 200 micras)
Discusión
La combinación de la COX / SDH método histoquímico permite la visualización de las células con la disfunción mitocondrial. Esta técnica, con los primeros estudios se remontan a 1968, sigue siendo popular, con muchos teniendo en cuenta el "gold standard" para la identificación de las enfermedades mitocondriales en los pacientes 14,19,26,27. Ahora se utiliza con frecuencia para investigar ADNmt mutación impulsada por el envejecimiento y el envejecimiento de los trastornos relacionados con
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por el Instituto Nacional del Envejecimiento (AG04418), Instituto Nacional sobre Abuso de Drogas, Instituto Nacional de Salud-Karolinska Institutet Programa de Postgrado asociaciones, Karolinska Institutet, Consejo de Investigación sueco, el poder del cerebro de Suecia, y la Fundación Cerebro de Suecia. Muchas gracias a Mattias Karlen y el Dr. Giuseppe Coppotelli de apoyo creativo con la Figura 1 y 2, respectivamente; Karin Pernold de asistencia técnica, y los Dres. Barry J. Hoffer, Lars Olson, y Nils-Göran Larsson para muchos consejos útiles y la discusión.
Materiales
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
| De hielo seco | AGA Gas AB | bloque de forma | |
| Isopentano (2-metilbutano) | Sigma-Aldrich | 277258 CAS: 78-78-4 | |
| Cyrostat solución incrustación | Sakura Finetek | Tissue Tek 4583 | |
| Criostato | Microm | Microm modelo HM 500M | |
| Diapositivas | Thermo Scientific | Además súper helada Menzel Gläser J1800AMWZ | |
| Cubreobjetos Vidrio de borosilicato | VWR International | 16004-098 | 24 x 50 mm |
| El filtro de papel | Munktell filtro AB | Calidad: 1350 ArtículoNúmero: 242 001 | 430 x 430 mm |
| 3,3 '-diaminobenzidina tetrahidrocloruro (DAB) | Sigma-Aldrich | Sigma sistema de sustrato líquido, D7304 | |
| Citocromo c (tipo III, del corazón de equino) | Sigma-Aldrich | C2506 CAS: 9007-43-6 | |
| Bovina catalasa (de hígado) | Sigma-Aldrich | C9322 CAS: 9001-05-2 | |
| Nitroazul de tetrazolio (NBT) | Sigma-Aldrich | N6876 CAS: 298-83-9 | |
| Succinato sódico | Sigma-Aldrich | S2378 CAS: 6106-21-4 | |
| Fenazina metosulfato (PMS) | Sigma-Aldrich | P9625 CAS: 299-11-6 | PMS es sensible a la luz. Escudo de la luz. |
| Azida de sodio | Sigma-Aldrich | S8032 CAS: 26628-22-8 | |
| Xileno | VWR International | EM-XX0060-4 | |
| Entellan | VWR International | 100503-870 | |
| Malonato (Ácido malónico) | Sigma-Aldrich | M1296 CAS: 141-82-2 |
Referencias
- Larsson, N. G. Somatic mitochondrial DNA mutations in mammalian aging. Annu. Rev. Biochem. 79, 683-706 (2010).
- Cottrell, D. A. Role of mitochondrial DNA mutations in disease and aging. Ann. NY Acad. Sci. 908, 199-207 (2000).
- Harman, D. The biologic clock: the mitochondria. J. Am. Geriatr. Soc. 20, 145-147 (1972).
- Wallace, D. C. Mitochondrial genetics - a paradigm for aging and degenerative diseases. Science. 256, 628-632 (1992).
- Trifunovic, A. Premature ageing in mice expressing defective mitochondrial DNA polymerase. Nature. 429, 417-423 (2004).
- Ameur, A. Ultra-deep sequencing of mouse mitochondrial DNA: mutational patterns and their origins. PLoS Genet. 7, e1002028-e1002028 (2011).
- Safdar, A. Endurance exercise rescues progeroid aging and induces systemic mitochondrial rejuvenation in mtDNA mutator mice. Proc. Natl. Acad. Sci. U. S. A. 108, 4135-4140 (2011).
- DiMauro, S., Bonilla, E., Zeviani, M., Nakagawa, M., DeVivo, D. C. Mitochondrial myopathies. Ann. Neurol. 17, 521-538 (1985).
- Old, S. L., Johnson, M. A. Methods of microphotometric assay of succinate dehydrogenase and cytochrome c oxidase activities for use on human skeletal muscle. Histochem. J. 21, 545-555 (1989).
- Chaturvedi, R. K. Impaired PGC-1alpha function in muscle in Huntington's disease. Hum. Mol. Genet. 18, 3048-3065 (2009).
- Edgar, D. Random point mutations with major effects on protein-coding genes are the driving force behind premature aging in mtDNA mutator mice. Cell. Metab. 10, 131-138 (2009).
- Ross, J. M. High brain lactate is a hallmark of aging and caused by a shift in the lactate dehydrogenase A/B ratio. Proc. Natl. Acad. Sci. U. S. A. 107, 20087-20092 (2010).
- Crugnola, V. Mitochondrial respiratory chain dysfunction in muscle from patients with amyotrophic lateral sclerosis. Arch. Neurol. 67, 849-854 (2010).
- Nonaka, I. Muscle pathology in cytochrome c oxidase deficiency. Acta. Neuropathol. 77, 152-160 (1988).
- DiMauro, S. Mitochondrial encephalomyopathies. Neurol. Clin. 8, 483-506 (1990).
- Bonilla, E. New morphological approaches to the study of mitochondrial encephalomyopathies. Brain. Pathol. 2, 113-119 (1992).
- Brierley, E. J., Johnson, M. A., Lightowlers, R. N., James, O. F., Turnbull, D. M. Role of mitochondrial DNA mutations in human aging: implications for the central nervous system and muscle. Ann. Neurol. 43, 217-223 (1998).
- Borthwick, G. M., Johnson, M. A., Ince, P. G., Shaw, P. J., Turnbull, D. M. Mitochondrial enzyme activity in amyotrophic lateral sclerosis: implications for the role of mitochondria in neuronal cell death. Ann. Neurol. 46, 787-790 (1999).
- Gellerich, F. N. Mitochondrial respiratory rates and activities of respiratory chain complexes correlate linearly with heteroplasmy of deleted mtDNA without threshold and independently of deletion size. Biochim. Biophys. Acta. 1556, 41-52 (2002).
- Larsson, N. G. Mitochondrial transcription factor A is necessary for mtDNA maintenance and embryogenesis in mice. Nat. Genet. 18, 231-236 (1998).
- Ekstrand, M. I. Progressive parkinsonism in mice with respiratory-chain-deficient dopamine neurons. Proc. Natl. Acad. Sci. U. S. A. 104, 1325-1330 (2007).
- Seligman, A. M., Karnovsky, M. J., Wasserkrug, H. L., Hanker, J. S. Nondroplet ultrastructural demonstration of cytochrome oxidase activity with a polymerizing osmiophilic reagent, diaminobenzidine (DAB). J. Cell. Biol. 38, 1-14 (1968).
- Dubowitz, V., Brooke, M. Muscle Biopsy: A Modern Approach. , (1973).
- Cottrell, D. A. Cytochrome c oxidase deficient cells accumulate in the hippocampus and choroid plexus with age. Neurobiol. Aging. 22, 265-272 (2001).
- Blanco, C. E., Sieck, G. C., Edgerton, V. R. Quantitative histochemical determination of succinic dehydrogenase activity in skeletal muscle fibres. Histochem. J. 20, 230-243 (1988).
- Moraes, C. T., Ricci, E., Bonilla, E., DiMauro, S., Schon, E. A. The mitochondrial tRNA(Leu(UUR)) mutation in mitochondrial encephalomyopathy, lactic acidosis, and strokelike episodes (MELAS): genetic, biochemical, and morphological correlations in skeletal muscle. Am. J. Hum. Genet. 50, 934-949 (1992).
- Petruzzella, V. Extremely high levels of mutant mtDNAs co-localize with cytochrome c oxidase-negative ragged-red fibers in patients harboring a point mutation at nt 3243. Hum. Mol. Genet. 3, 449-454 (1994).
- Tulinius, M. H., Holme, E., Kristiansson, B., Larsson, N. G., Oldfors, A. Mitochondrial encephalomyopathies in childhood. I. Biochemical and morphologic investigations. J. Pediatr. 119, 242-250 (1991).
- Haas, R. H. The in-depth evaluation of suspected mitochondrial disease. Mol. Genet. Metab. 94, 16-37 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados