Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
In-vivo-Elektrophysiologische Messungen an Maus Ischiasnerven
In diesem Artikel
Zusammenfassung
Messungen der Nervenleitungseigenschaften in vivo beispielhaft ein leistungsfähiges Werkzeug, um verschiedene Tiermodellen für neuromuskuläre Erkrankungen zu charakterisieren. Hier präsentieren wir eine einfache und zuverlässige Protokoll, mit dem elektrophysiologische Analysen über Ischiasnerven von betäubten Mäusen durchgeführt werden.
Zusammenfassung
Elektrophysiologische Untersuchungen ermöglichen eine rationelle Einteilung der verschiedenen neuromuskulären Erkrankungen und der Hilfe, zusammen mit neuropathologischen Techniken, im Verständnis der Pathophysiologie ein. Hier beschreiben wir eine Methode, um elektrophysiologische Untersuchungen an Maus Ischiasnerven in vivo durchzuführen.
Die Tiere werden mit Isofluran, um Analgesie für die getesteten Mäuse gewährleisten betäubt und ungestört Arbeitsumgebung während der Messungen, die ca. 30 min / Tier zu nehmen. Eine konstante Körpertemperatur von 37 ° C wird durch eine Heizplatte gehalten und kontinuierlich durch eine rektale Thermosonde 2 gemessen. Zusätzlich wird ein Elektrokardiogramm (ECG) routinemßig während der Messungen, um aufgezeichnet, um den physiologischen Zustand der untersuchten Tiere zu überwachen.
Elektrophysiologische Aufzeichnungen werden auf den Ischiasnerv, der größten Nerv-ten durchgeführtE peripheren Nervensystem (PNS), die Versorgung der Hintergliedmaße Maus sowohl mit motorischen und sensorischen Nervenbahnen. In unserem Protokoll, bleiben Ischiasnerven in situ und müssen daher nicht extrahiert oder ausgesetzt werden, so dass Messungen ohne negative Nervenreizungen zusammen mit aktuellen Aufnahmen. Mit entsprechenden Nadelelektroden 3 führen wir sowohl die proximalen und distalen Nervenstimulationen, die Registrierung der Potentiale übertragen mit Messelektroden an Wadenmuskulatur. Nach der Datenverarbeitung, zuverlässig und sehr konsistent Werte für die Nervenleitgeschwindigkeit (NLG) und der Verbindung Motor Aktionspotential (CMAP), die Schlüsselparameter für die Quantifizierung des Brutto peripheren Nervenfunktionsfähigkeit, erreicht werden kann.
Einleitung
Elektrophysiologische Messungen sind ein unverzichtbares Werkzeug für die Untersuchung der funktionellen Integrität der peripheren Nerven in beiden klinischen und Laborumgebungen. Beim Menschen wird eine große Anzahl von neuromuskulären Störungen und Neuropathien diagnostisch beruhen auf elektrophysiologischen Messungen. Durch Messen Nerven Eigenschaften wie Leitungsgeschwindigkeit oder mögliche Amplituden des Signals ist es möglich, den ungefähren Ausgangs von peripheren Nervenerkrankungen zu charakterisieren.
Die Nervenleitungsgeschwindigkeit ist stark abhängig von der schnellen Signalausbreitung durch Myelinisierung aktiviert. Daher demyelinisierende Prozesse zeigen in der Regel verringert Leitungsgeschwindigkeiten 4. Die Verbindung Motor Aktionspotential (CMAP) - Korrelation mit der Anzahl der Funktions Axone - ist ein Indikator für axonalen Schaden, wenn deutlich reduziert 5.
Somit wird mittels der elektrophysiologischen Methoden die Ätiologie von peripheren Nervenschädenunterschieden werden kann, wie zum erblichen Neuropathien 6,7, diabetische Neuropathie 8,9, chronisch inflammatorische demyelinisierende Polyneuropathie (CIDP) 10, 11 oder metabolische Neuropathien.
Normalerweise in der Anwendung am Menschen nicht-invasive Aufnahmen auf der Nervus ulnaris oder bevorzugt werden. Bei Mäusen ist es einfach zu Nerven Eigenschaften der Ischiasnerv, der größte Nerv des peripheren Nervensystem (PNS), die sowohl große analysieren - und Kleinkaliber Axone der motorischen und sensorischen Systems.
Die wie hier gezeigt Verfahren ist eine schnelle, einfache und zuverlässige Methode, um alle für die Elektrophysiologie an peripheren Nerven in der intakten Maus relevanten Standardwerte zu messen. Durch die Aufnahmen aus einer geschützten Organismus werden physiologischen Bedingungen des Nerven-Umgebung gewährleistet.
Protokoll
Die vorliegende Studie wurde nach dem Tierschutzgesetz der Bundesrepublik Deutschland (Tierschutzgesetz der Bundesrepublik Deutschland) durchgeführt und wurde durch das Thüringer Landesamt für Lebensmittelsicherheit und Verbraucherschutz (Thüringer Landesamt für Verbraucherschutz und Lebensmittelsicherheit) zugelassen.
1. Einrichten der Messungen
- Betäuben die Mäuse durch Isofluran / O 2-Inhalations - zur Einleitung der Anästhesie 3%, 2% für die Wartung Isofluran in 100% Sauerstoff (Abbildung 1). Bestätigen ausreichende Anästhesie durch Testen einfache Reflexe wie Bewegung Reflexe und Prüfung von Sensibilität für Low-grade-Schmerzen. Verwendung der Salbe auf die Augen zu Trockenheit während der Narkose zu vermeiden wird empfohlen, aber nicht unbedingt notwendig, weil das Verfahren dauert in der Regel nur 30 min / Tier insgesamt. Im Falle der Überlebensversuche, verwalten rechtzeitige länger wirkenden Analgetika für die Verwaltung von postoperativen Schmerzen.
- Rasieren Sie das Fell mit einem elektrischen Rasierer Abdeckung der hinteren Gliedmaßen und durchzuführen, Enthaarung mit einem handelsüblichen Haarentfernungscreme während Tiere sind bereits im Analgesie. Um pathogen-freien Status während des gesamten Verfahrens zu erhalten, tragen aseptischen Handschuhe und Instrumente immer sorgfältig mit 70% Ethanol gereinigt.
- Kontrolle der Körpertemperatur Stabilität durch eine Rückkopplung gesteuert Heizplatte und rektale Thermosonde (Abbildung 2). Falls erforderlich, verwenden Sie bitte ein steriles Tuch, um die Wärmeplatte zwischen den Tieren, um eine sterile experimentellen Umgebung halten zu decken. Darüber hinaus ist es empfehlenswert, eine Heizplatte, die elektronisch über einen integrierten Sensor gesteuert wird, die Erwärmungstemperatur, um Gewebeschäden zu vermeiden ≤ 40 ° C zu begrenzen verwenden.
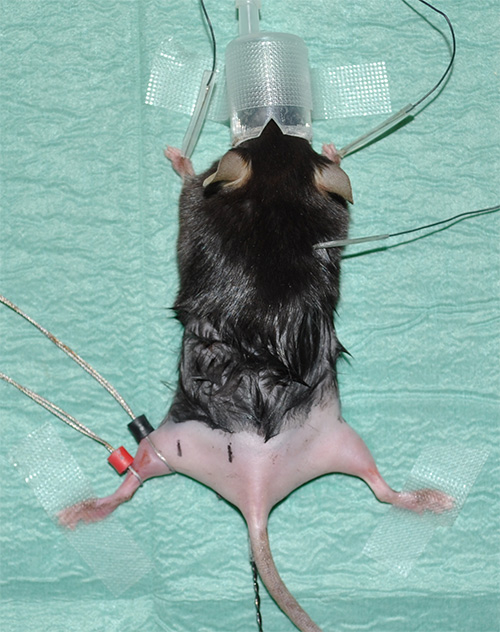
Abbildung 1. Experimental Setup, das ein narkotisierten Maus mit rasierten Hinterbeine. - Nehmen Elektrokardiographie (EKG)-Aufnahmen, die Herzfrequenz als Vitalparameter zu überwachen. Legen Sie drei Elektroden für EKG-Aufzeichnungen, wie folgt: eine Elektrode unter die Haut jedes Vorderbein und eine Elektrode unter der Haut im Nackenbereich.
- Kontakt mit Gel für optimale Leitfähigkeit / Übergangswiderstand Platz Ringelektroden. Die Sensorelektrode (schwarz markiert) an der Position, wo der Gastrocnemius-Muskel seinen maximalen Durchmesser angeordnet. Die Referenzelektrode (rot gekennzeichnet) wird direkt unter der Sensorelektrode platziert.
Hinweis: Bitte siehe 'Werkstofftabelle "für Ausstattungsdetails. - Markieren Sie die richtigen Messpositionen mit vorgegebenen, aber konsistente Entfernung zwischen dem proximalen und distalen Ischiasnervenstimulation und die Bleielektrode. Experimentelle Vorschlag: Bei einem Abstand von 4 mm von der Sensorelektrode, wird die distale Stimulation statt.In einem Abstand von 16 mm zur Sensorelektrode wird das proximale Stimulation aus (Fig. 2) durchgeführt werden.

2. Repräsentatives Bild, das die experimentelle Situation unmittelbar vor Beginn der Messungen. Der weiße Pfeil zeigt die Position des Sensor (schwarz) und Referenz (rot) Elektrode am Gastrocnemius-Muskel des linken Hinterbein. Die Stimulation von Nadelelektroden werden an definierten Positionen in Bezug auf den schwarzen Sensorelektrode durchgeführt werden. Der Punkt, der distal Stimulation (schwarze Markierung mit "DS" an der linken Hinterbein) einen Abstand von 4 mm von der Fühlerelektrode; der Ort der proximalen Stimulation (schwarze Markierung mit "ps") ist 16 mm entfernt. Die rote Linie auf der rechten Hintergliedmaße zeigt die ca. iMate anatomischen Verlauf des Ischiasnervs. Darüber hinaus werden die groben Positionen der relevanten Hinterbeinmuskeln als Landmarken dargestellt. Das Sternchen zeigt die rektale Temperatursonde.
2. Mess
- Prinzip: Führen Sie eine Reihe von Nervenstimulationen mit Einzel wiederholt erzeugt Rechteckimpulse von 0,1 ms Dauer von Einweg-28 G monopolare Nadelelektroden (Wiederholungsrate 200 ms, siehe Abbildung 3A). Für Offline-Datenanalyse, empfiehlt es sich, gleichzeitig gemeinsam erwerben Stimulationssignale mit der neuromuskulären Funktion Wirkungs-Kurve (3B) durch Nervenstimulation. Durchschnittlich eine Reihe von Maximalreaktionen ("Vertreter der neuromuskulären Funktion response") für die anschließende Datenanalyse. Um zuverlässige Daten, aufzeichnen und später durchschnittlich mindestens 3 unabhängige, optimale Reaktionskurven pro Stimulationsstelle und Tier zu produzieren.
p_upload/51181/51181fig3highres.jpg "src =" / files/ftp_upload/51181/51181fig3.jpg "/>
Abbildung 3. Verfahren für die Datenerfassung und Analyse (schematische Darstellung). Wiederholt erzeugten Impulse werden auf den Ischiasnerv über Nadelelektroden (obere Reihe in Abbildung 3A) aufgebracht. Gleichzeitig werden mehrere entsprechende neuromuskuläre Antwort-Kurven aufgezeichnet (untere Reihe in Abbildung 3A). Wenn gemittelt und vergrößert, neuromuskuläre Reaktionskurven durch Stimulationsimpulse (obere Reihe in 3B) zeigen die folgenden charakteristischen Eigenschaften (untere Reihe in Abbildung 3B): Latenz der Signalantwort sowie Dauer und Amplitude des Signals werden angezeigt und können für nachfolgende Berechnungen und Statistiken erhalten werden. Unregelmäßige Signalleitung und / oder suboptimalen Aufnahmen in der Regel in verschiedenen Signal Verformungen führen mit mehr als nur eine positive und eine negative Ablenkung oder Signal Verformung(Bimodale Form) mit reduzierter Amplitude (3C). - Führen proximalen Stimulation mit einer Nadelelektrode bei bestimmten Position ("PS" in Fig. 2).
- Um beste Aufnahmebedingungen mit Maximalamplituden zu erreichen, visualisieren die tatsächlichen Wirkungs-Kurven auf die gleichzeitige Stimulation Prozess. Damit ist der Experimentator in der Lage, die Form der Antwortkurven als auch die Größe der Amplitude sofort zu beurteilen.
- Wenn nötig, leicht und genau die Position und / oder den Winkel des Stimulations-Nadel in Bezug auf den Ischiasnerv zu manipulieren. Diese schonende Optimierung der Stimulationsbedingungen ermöglicht Erreichen konstanter Amplituden mit der größtmöglichen Wert und einem Wirkungs-Kurve von typischen zweiphasigen Form (Abbildung 4).
- Führen distalen Stimulation mit einer Nadelelektrode bei bestimmten Position ("ds" in Fig. 2).
- Nach completion der Messung, übertragen Sie die Maus getestet zu einem separaten Käfig, bis er das Bewusstsein wiedererlangt, um ausreichend Brustlage zu halten. Ein Tier nicht unbeaufsichtigt und in der Gesellschaft von anderen Tieren, bis es vollständig von der Narkose erholt. Verwalten Sie rechtzeitig länger wirkenden Analgetika für die Verwaltung von postoperativen Schmerzen. Die systemische Verabreichung von nichtsteroidalen Antirheumatika (NSAR) und Opioide sind für 1-3 Tage empfohlen.
- Alternativ zu opfern, die noch narkotisierten Maus in eine schnelle und humane Art und Weise ohne weitere Schmerzen für das Tier, zB durch Hals-Luxation.
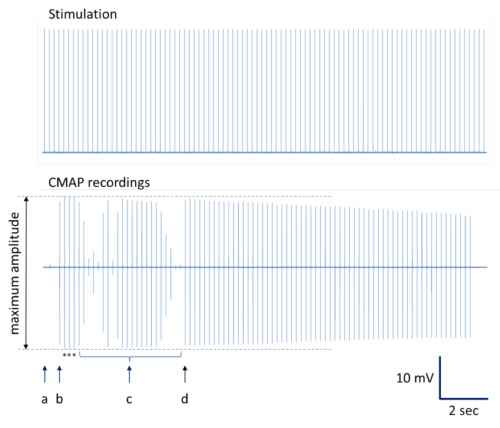
Abbildung 4. Illustration, die CMAP Aufnahmen mit Maximalamplituden zu bestimmen. Eine vollständige Anmeldung Serie vorgestellt. (A ) Insertion Punkt mit minimalem CMAP Antwort. (B) Leichte Stimulationsnadel Bewegung führt CMAP Aufnahmen mit maximalen Amplituden. (C) Weitere Änderungen in Nadelplatzierung produzieren CMAP Aufnahmen mit unterschiedlichen Amplituden darunter nahezu maximale Amplitude. (D) Stimulation Nadel-Ersatz mit Serien CMAP Aufnahmen von nahezu maximale Amplitude. Hinweis: Typische Abnahme in CMAP Amplituden während wiederholter Stimulation bei optimalen Stimulationsstelle 12, 13 auf. Sternchen zeigen CMAP Aufnahmen mit für die Mittelung dargestellten Maximalamplituden.
3. Analyse
- Auszug Nervenleitungsparameter auf der Grundlage der repräsentativen neuromuskuläre Funktion Antwort-Datensatzes unter Verwendung eines geeigneten Software-Paket (zB AtisaPro).
Hinweis: Bitte behandeln Sie zeitbezogene Datenermittlung mit besonderer Sorgfalt, da Wendepunkt Bestimmung der Verbindung motorische Aktion Topfrenz (CMAP) Beginn und Beendigung kann schwierig sein. Ein Verfahren, mit prüft Reproduzierbarkeit ist in Fig. 3B, wo die Tangenten an Signalausschläge nach Beginn und vor Beendigung verwendet werden angegeben. - Berechnen 'Signal Latenz "und" CMAP' Werte.
- Latency 'stellt die Zeitverzögerung zwischen Anregung und CMAP Beginn, während der Zeitspanne zwischen CAMP Beginn der erste negative Ausschlag nach Rückkehr zum Ausgangswert wird als initial' CMAP Dauer. Verwenden der Differenz zwischen den distalen und proximalen Latenzen zu Leitungsgeschwindigkeit mit dem Abstand zwischen den distalen und proximalen Stimulationsstellen berechnen.
Leitungsgeschwindigkeit = Latenz / Abstand zwischen Stimulationsorte - CMAP '(Verbindung Motor Aktionspotential) Amplitude stellt die Größe zwischen maximalen positiven und negativen Wendepunkt des CMAP Signal (in mV).
CMAP = Wert "positiven Wendepunkt" - negativen Trendwende po-Wert 'int '
- Latency 'stellt die Zeitverzögerung zwischen Anregung und CMAP Beginn, während der Zeitspanne zwischen CAMP Beginn der erste negative Ausschlag nach Rückkehr zum Ausgangswert wird als initial' CMAP Dauer. Verwenden der Differenz zwischen den distalen und proximalen Latenzen zu Leitungsgeschwindigkeit mit dem Abstand zwischen den distalen und proximalen Stimulationsstellen berechnen.
Ergebnisse
Wir haben eine Reihe von in-vivo-elektrophysiologische Messungen an Ischiasnerven von 12 Mäusen in dieser Studie insgesamt: 6 Tieren jedes Geschlechts. Die Messungen wurden mit der dargestellten Protokoll durchgeführt und lieferte die folgenden Ergebnisse:
Sowohl männliche als auch weibliche Mäuse zeigen eine mittlere Ischiasnervenleitungsgeschwindigkeit von ca. 20 m / s (Abbildung 5). Dies steht im Einklang mit anderen Messungen in der Literatur. Darüber...
Diskussion
Die beschriebenen Protokoll bietet eine einfache und zuverlässige Methode, um Ischiasnerv Leitungseigenschaften an narkotisierten Mäusen ohne die Notwendigkeit, den Nerv der Zinsen aussetzen zu bestimmen. Dennoch bewirkt diese experimentelle Verfahren Gewebeverletzungen durch Nadelpunktion. Es ist daher eine sinnvolle Option, um die Tiere nach Abschluss der Aufnahmen zu opfern. , Im Vergleich zu anderen invasiven Verfahren, die die Belichtung des Nerven vor Aufnahmen erfordern, ist jedoch Gewebeschäden vergleichsweis...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde vom SFB 604, DFG MO 1421/2-1 und Krebshilfe 107.089 (HM) unterstützt. AS ist Empfänger eines Young Investigator Award von der Kinder Tumor Foundation (New York, USA).
Materialien
| Name | Company | Catalog Number | Comments |
| Concentric Needle Electrodes (Stimulation) | Natus Medical Incorporated San Carlos, CA 94070, USA | 9013S0901 | |
| Digital Ring Electrodes (Recording) | Natus Medical Incorporated San Carlos, CA 94070, USA | 9013S0302 | |
| ToM - Tower of Measurement (A/D converter) | GJB Datentechnik GmbH, Langewiesen, Germany | ||
| AtisaPro, Data acquisition & analysis software | GJB Datentechnik GmbH, Langewiesen, Germany | ||
| HSE-Stimulator T | Hugo Sachs Elektronik, Hugstetten, Germany | ||
Referenzen
- Kimura, J. 3rd ed. Electrodiagnosis in Diseases of Nerve and Muscle. , (2001).
- Rutkove, S. B. Effects of temperature on neuromuscular electrophysiology. Muscle Nerve. 24, 867-882 (2001).
- Xia, R. H., Yosef, N., Ubogu, E. E. Dorsal caudal tail and sciatic motor nerve conduction studies in adult mice: technical aspects and normative data. Muscle Nerve. 41, 850-856 (2010).
- Zielasek, J., Martini, R., Toyka, K. V. Functional abnormalities in P0-deficient mice resemble human hereditary neuropathies linked to P0 gene mutations. Muscle Nerve. 19, 946-952 (1996).
- Raynor, E. M., Ross, M. H., Shefner, J. M., Preston, D. C. Differentiation between axonal and demyelinating neuropathies: identical segments recorded from proximal and distal muscles. Muscle Nerve. 18, 402-408 (1995).
- Pareyson, D., Scaioli, V., Laura, M. Clinical and electrophysiological aspects of Charcot-Marie-Tooth disease. Neuromol. Med. 8, 3-22 (2006).
- Schulz, A., et al. Merlin isoform 2 in neurofibromatosis type 2-associated polyneuropathy. Nat. Neurosci. 16, 426-433 (2013).
- Lamontagne, A., Buchthal, F. Electrophysiological studies in diabetic neuropathy. J. Neurol. Neurosurg. Psychiatry. 33, 442-452 (1970).
- Andersen, H., Nielsen, J. F., Nielsen, V. K. Inability of insulin to maintain normal nerve function during high-frequency stimulation in diabetic rat tail nerves. Muscle Nerve. 17, 80-84 (1994).
- Magda, P., et al. Comparison of electrodiagnostic abnormalities and criteria in a cohort of patients with chronic inflammatory demyelinating polyneuropathy. Arch. Neurol. 60, 1755-1759 (2003).
- Lindberg, R. L., et al. Motor neuropathy in porphobilinogen deaminase-deficient mice imitates the peripheral neuropathy of human acute porphyria. J. Clin. Invest. 103, 1127-1134 (1999).
- Massey, J. M. Electromyography in disorders of neuromuscular transmission. Sem. Neurol. 10, 6-11 (1990).
- Stalberg, E., Falck, B. The role of electromyography in neurology. Electroencephalogr. Clin. Neurophysiol. 103, 579-598 (1997).
- Osuchowski, M. F., Teener, J., Remick, D. Noninvasive model of sciatic nerve conduction in healthy and septic mice: reliability and normative data. Muscle Nerve. 40, 610-616 (2009).
- Oh, S. S., Hayes, J. M., Sims-Robinson, C., Sullivan, K. A., Feldman, E. L. The effects of anesthesia on measures of nerve conduction velocity in male C57Bl6/J mice. Neurosci. Lett. 483, 127-131 (2010).
- Dilley, A., Lynn, B., Pang, S. J. Pressure and stretch mechanosensitivity of peripheral nerve fibres following local inflammation of the nerve trunk. Pain. 117, 462-472 (2005).
- Vleggeert-Lankamp, C. L., et al. Electrophysiology and morphometry of the alpha- and beta-fiber populations in the normal and regenerating rat sciatic nerve. Exp. Neurol. 187, 337-349 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten