È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Monocanale Analisi e Imaging di calcio nei podociti del Freshly Isolato glomeruli
In questo articolo
Riepilogo
Changes in the intracellular calcium levels in the podocytes are one of the most important means to control the filtration function of glomeruli. Here we explain a high-throughput approach that allows detection of real-time calcium handling and single ion channels activity in the podocytes of the freshly isolated glomeruli.
Abstract
Podocytes (renal glomerular epithelial cells) are known to regulate glomerular permeability and maintain glomerular structure; a key role for these cells in the pathogenesis of various renal diseases has been established since podocyte injury leads to proteinuria and foot process effacement. It was previously reported that various endogenous agents may cause a dramatic overload in intracellular Ca2+ concentration in podocytes, presumably leading to albuminuria, and this likely occurs via calcium-conducting ion channels. Therefore, it appeared important to study calcium handling in the podocytes both under normal conditions and in various pathological states. However, available experimental approaches have remained somewhat limited to cultured and transfected cells. Although they represent a good basic model for such studies, they are essentially extracted from the native environment of the glomerulus. Here we describe the methodology of studying podocytes as a part of the freshly isolated whole glomerulus. This preparation retains the functional potential of the podocytes, which are still attached to the capillaries; therefore, podocytes remain in the environment that conserves the major parts of the glomeruli filtration apparatus. The present manuscript elaborates on two experimental approaches that allow 1) real-time detection of calcium concentration changes with the help of ratiometric confocal fluorescence microscopy, and 2) the recording of the single ion channels activity in the podocytes of the freshly isolated glomeruli. These methodologies utilize the advantages of the native environment of the glomerulus that enable researchers to resolve acute changes in the intracellular calcium handling in response to applications of various agents, measure basal concentration of calcium within the cells (for instance, to evaluate disease progression), and assess and manipulate calcium conductance at the level of single ion channels.
Introduzione
I reni mantenere l'equilibrio omeostatico per varie sostanze e regolare il volume di sangue in un modo che determina la pressione totale di sangue. Disturbi della filtrazione renale, riassorbimento o secrezione causare o accompagnare stati patologici, che vanno da iper- o ipotensione per terminare malattia renale allo stadio che alla fine richiede il trapianto di rene. L'unità di filtrazione renale (glomerulo) consiste di tre strati - l'endotelio capillare, membrana basale e uno strato cella singola di cellule epiteliali - podociti, che svolgono un ruolo importante nel mantenimento dell'integrità e della funzione 1 fessura diaframma. Disfunzione nel filtro glomerulare permselective causa la perdita urinaria di macromolecole, come la proteinuria. Vari agenti possono influenzare la struttura dei podociti ei processi piede, che determinano l'integrità della barriera di filtrazione glomerulare.
I podociti sono coinvolti nel mantenimento della glomfunzione di filtrazione Eruli. È stato stabilito che la movimentazione calcio improprio dal podociti porta a danno cellulare e svolge un ruolo importante nella progressione di varie forme di nefropatie 2,3. Pertanto, lo sviluppo di un modello che permette di misurazione diretta dei cambiamenti concentrazione intracellulare di calcio sarà determinante per lo studio della funzione podocita. Isolati glomeruli erano già stati utilizzati in numerosi studi, tra cui la misurazione del coefficiente di riflessione albumina cambia 4 e la valutazione delle correnti cellulari integrali nelle cellule intere elettrofisiologiche misurazioni patch-clamp 5,6. Nel presente lavoro si descrive il protocollo che consente al ricercatore di misurare le variazioni della concentrazione di calcio intracellulare in risposta a richieste di agenti farmacologici, stimare i livelli basali di calcio all'interno delle cellule, e valutare l'attività canali del calcio individuale. Misure della concentrazione di calcio Ratometric e patch-clamp electrophysiology sono stati usati per determinare le variazioni della concentrazione intracellulare di calcio nell'ambito dell'attività podocita e il canale, rispettivamente.
Protocollo
Uso e benessere degli animali dovrebbero aderire alla guida NIH per la cura e l'uso di animali da laboratorio seguendo protocolli esaminato e approvato dalla cura e l'uso degli animali Comitato Istituzionale (IACUC).
1. Rene Flush
- Utilizzare da 8 a 12 settimane di età topo maschio (consigliato è un ceppo Sprague Dawley, ma altri ceppi di età e sesso diverso possono essere utilizzati con le opportune modifiche).
- Anestetizzare l'animale secondo la procedura consentita dal protocollo IACUC; monitorare profondità dell'anestesia e controllare l'animale. La descrizione dettagliata della chirurgia da eseguire in 1,3-1,8 possono essere trovati in Ilatovskaya et al 7.
- Dopo anestesia corretta, posizionare l'animale su un tavolo operatorio temperatura controllata, fare una incisione mediana dell'addome (fino a 3 pollici di lunghezza), e scoprire la vena cava e l'aorta.
- Inserire legatura intorno ai celiaci e mesenterica superiore arterie e gli addominaliaorta sopra di quelli; non legare.
- Blunt sezionare l'aorta addominale al di sotto delle arterie renali, e mettere due legature attorno ad esso, ma non legare, quindi bloccare l'aorta sopra le legature e legare il filo inferiore.
- Cateterizzarla l'aorta con un tubo di polietilene PE50 (collegato a una pompa a siringa riempita con PBS) sotto il morsetto e fissare il catetere con la seconda legatura; rimuovere il morsetto, accendere la pompa, e legare l'aorta e le arterie mesenterica con celiaci. Fare rapidamente incisione nella vena renale per alleviare la pressione.
- Infondere l'aorta con PBS pre-raffreddata per 2 o 3 minuti ad una velocità di 6 ml / min.
- Smettere di perfusione, accise e decapsulate 7 i reni, e metterli sul ghiaccio in soluzione PBS. Euthanize l'animale secondo il protocollo approvato da IACUC.
2. Isolamento del Topo glomeruli
- Preparare 30 ml di soluzione fresca di 5% BSA in RPMI 1640.
- Utilizzando una lama di rasoio e forbici,isolare la corteccia di entrambi i reni, e poi sminuzzare fino omogeneo. Questa procedura è stata descritta in precedenza 7.
- Spingere il tessuto tritato durante la fase precedente al setaccio in acciaio inossidabile 100 mesh (pre-imbevuto di 5% di BSA soluzione / RPMI) con una spatola. Raccogliere il flusso continuo e dalla forza di gravità consentono il flusso continuo di passare attraverso un setaccio di 140 mesh.
- Filtrare il flow-through raccolti dalle maglie 140 setaccio con un vaglio da 200 pre-impregnato, scartare il filtrato, e lavare la parte superiore del vaglio a 10 - 15 ml della soluzione di BSA / RPMI preparati a raccogliere i glomeruli che sedimenti il setaccio.
- Mettere la soluzione BSA / RPMI contenente glomeruli su ghiaccio in una provetta da 15 ml e lasciare il sedimento glomeruli sul fondo del tubo fino a 20 min. Il concentrato glomeruli sul fondo del tubo sarà visto chiaramente. Rimuovere la soluzione in eccesso, lasciando circa 2 ml nel tubo.
3. monocanale patch-clamp Electrophysiology
- Preparare 5 x 5 mm frammenti di vetro di copertura da rivestimento con 70.000 MW - 150.000 poli-ʟ-lisina, e lasciare asciugare. Usare circa 30 ml di 0,01% sterile soluzione filtrata in acqua al vetro di copertura.
- Riscaldare le soluzioni sperimentali RT e riempire la camera patch-clamp e pipetta. Per il monitoraggio canali TRPC, utilizzare una soluzione del bagno, in mm: 126 NaCl, 1 CaCl 2, 10 HEPES, 2 MgCl 2, 10 glucosio, pH 7.4; pipetta: 126 NaCl, 1,5 CaCl 2, 10 HEPES, 10 glucosio; pH 7.4.
- Aggiungere inibitori alla soluzione pipetta per bloccare l'attività di canali endogeni, che non sono rilevanti per gli studi (consigliate sono: 100 micron niflumico o DIDS (per bloccare Ca 2+ -activated Cl - canali), TEA 10 mm (per inibire la grande-conduttanza Ca 2 + - K + dipendente canale), 10 nM iberiotoxin (per bloccare gli Ca 2 + K + canali -activated), 10 mM nicardipina (per bloccare tipo N Ca2+ canali)) direttamente prima dell'esperimento patch-clamp.
- Mescolare delicatamente la soluzione contenente glomeruli, e quindi applicare circa 50 ml di al coperchio rivestito chip di vetro poli-ʟ-lisina. Lasciate che i glomeruli attribuiscono per circa 5 minuti.
- Spostare i chip di vetro con glomeruli alla camera di patch-clamp pre-riempite con la soluzione del bagno; profumato camera ad una velocità di 3 ml / min per 1 min per assicurare la rimozione dei glomeruli separati.
- Condurre un esperimento patch-clamp convenzionale in una modalità cella-attached 7. Con una pipetta di vetro (7 - 10 MW resistenza pipetta) formare una tenuta ad alta resistenza tra una pipetta e una membrana podocyte applicando aspirazione delicata (una pipetta collegata ad un podocyte sulla superficie del glomerulo isolato è mostrato in figura 2, sulla la sinistra).
- Per le misure di cella-attached, passa-basso le correnti a 300 Hz da un filtro a otto poli Bessel.
- Use isolata glomeruli in esperimenti di patch-clamp per un massimo di 4-6 ore. Mantenere la frazione magazzino glomeruli sul ghiaccio.
4. Raziometrico confocale misure di fluorescenza intracellulare concentrazione di calcio nelle podociti
- Mettere 500 ml di frazione glomeruli (descritto in 2.5) a 0,5 ml tubo conico e aggiungere coloranti calcio Fura Red, AM e Fluo-4, AM. Utilizzare 2mM e 1 mm concentrazioni di stock di Fura Red, AM e Fluo-4, AM, rispettivamente (conservare a -20 ° C, sciolto in DMSO) e l'uso di 2,5 ml di ciascun colorante per 500 ml di frazione glomeruli. Immediatamente dopo l'aggiunta dei coloranti coprire il tubo con un foglio di alluminio.
- Porre le provette su un agitatore rotante per almeno 20 minuti fino a 1 ora a temperatura ambiente.
Nota: Agenti farmacologici possono essere aggiunti durante questa fase. - Preparare vetrini, coprirli con poli-ʟ-lisina e permettere l'asciugatura utilizzando set piatto riscaldato a 70 ° C.
- Una volta che il carico di coloranti calcio è complete, applicare 100 ml di i glomeruli contenenti soluzione ai vetrini rivestiti di poli-ʟ-lisina e farli aderire alla superficie per circa 5 minuti. Montare i coprioggetti glomeruli-schiera in una camera di imaging, e profumato con la soluzione del bagno (contenente (in mM): 145 NaCl, KCl 4,5, 2 MgCl 2, 10 HEPES, pH 7,35) ad una velocità di 3 ml / min per rimuovere i glomeruli assegnata e le restanti coloranti.
- Impostare il microscopio confocale a scansione laser ad una lunghezza d'onda di eccitazione 488 nm e filtri di emissione (525/25 e 650/25 nm per Fluo-4 e Fura Red, rispettivamente). Impostare il software di imaging per una frequenza e risoluzione desiderata.
- Trovate i glomeruli in campo chiaro e poi accendere il rilevamento del segnale di fluorescenza. Regolare l'intensità del laser per ciascun colorante per evitare la saturazione del segnale. Scegliere il piano focale con podociti che sono direttamente collegati al vetro. Ciò minimizza l'effetto causato dalla contrazione di un glomerulo in risposta a farmaciapplicazione. Doppio controllo che glomerulo di scelta è ben attaccato al vetro;
- Avviare l'imaging piano focale scelta (prendere 512 x 512 immagini con la frequenza impostata a 4 secondi per visualizzare Ca 2+ veloce cambiamenti transitori. Usare un 60X / NA 1.4 o simile lente dell'obiettivo immagine ad alta risoluzione per), si applicano le droghe di interesse, e registrare la risposta.
- Selezionare un piano focale desiderata (il più vicino alla superficie del vetro come possibile, per assicurare l'imaging di podociti sulla superficie del glomerulo). Controllare l'intensità della fluorescenza sul Fluo4 canali FuraRed, e assicurarsi che il glomerulo si vede chiaramente in campo chiaro.
- Inizia imaging. Prima dell'applicazione di qualsiasi droga, record di almeno 1 min di riferimento di fluorescenza per assicurarsi che il segnale è stabile (non ci sono picchi improvvisi o dissolvenza del segnale).
- Applicare farmaci desiderati con l'aiuto di una micropipetta; fare attenzione e verificare che il farmaco è stato in grado di diffondere bene e raggiungere il glomerUlus. Mescolare delicatamente la soluzione del bagno, se necessario, controllare il piano focale selezionata e verificare che non si muoveva fuori fuoco a causa della domanda di droga.
- Registrare i cambiamenti di intensità di fluorescenza per i segnali Fluo4 e FuraRed. Assicurarsi che la registrazione è abbastanza lungo, aspettando fino a quando il segnale raggiunge il livello di plateau o raggiunge un picco e poi ritorna al basale. Eseguire cambiamento soluzione o l'aggiunta di altri farmaci se necessario.
- Interrompere la registrazione, e salvare il file nel formato nativo del software.
5. Image Analysis per le Misure di calcio
- Eseguire l'analisi delle immagini con il software ImageJ attrezzata con il plugin Utility ND che consente di importare le immagini nel formato ND2 nativo.
- Importare la sequenza di immagini; assicurarsi di dividere i canali e utilizzare una modalità HyperStack scala di grigi.
- Seguire la → Strumenti → ROI percorso Analizzare manager nel software ImageJ per openna un window manager ROI. Seleziona più regioni di interesse (podociti) utilizzando uno strumento di selezione ovale e il "(t) Aggiungi" funzione nel ROI Manager. Come l'ultimo ROI, selezionare l'area in background; salvare il ROI selezionate (More → Salva).
- Evidenziare la finestra contenente il canale selezionato per le analisi. Utilizzare la More → funzione Multi Measure nella ROI Manager, selezionare la casella "una riga per ogni slice" nel dialogo che si apre, e quindi fare clic su OK. I risultati saranno mostrati nel formato che può essere impostato nella finestra dei risultati: entrare nei risultati opzione di menu → Set misurazioni, selezionare "Mean valore di grigio" e calcolare i valori di intensità dei pixel per ogni ROI, che verrà visualizzato nella finestra Risultati in colonne separate per ogni ROI.
- Copiare i valori di intensità ROI misurati per ogni canale (Fluo-4 e Fura Red) nel comodo software di analisi dei dati; sottrazione di valori di intensità di fondo di ogni datun punto.
- Per ogni punto di tempo calcolare il rapporto di intensità del Fluo-4 a canali Fura rossi. Trama scatter / linea point-tempo cambia di Ca 2+ transitoria per ogni ROI. Calcolare i valori medi / SE per glomeruli selezionati.
Nota: colonna Ora deve essere impostato in base alla frequenza di imaging selezionato a 4.5.
6. intracellulari Calcoli calcio Concentrazione Uso Fluo-4 fluorescenza del segnale
- Prelevare un campione dei glomeruli ed eseguire il protocollo sperimentale fino al punto 4.7. Dopo la registrazione della fluorescenza di fondo aggiungere Ionomicina (concentrazione finale nella camera vasca dovrebbe essere 10 pM) per la soluzione del bagno, e aumento dell'intensità di fluorescenza registrare. Una volta che l'intensità raggiunge il suo massimo e il decadimento comincia, aggiungere MnCl 2 (concentrazione finale dovrebbe essere 5 mM) per estinguere la fluorescenza 8.
- Analizzare i dati ottenuti in 6.1. Copiare il Fluo-4 valori di intensità di segnale ROI ottenuti secondoil protocollo descritto a 5,1-5,5 da software di analisi preferito.
- Calcolare la concentrazione di calcio intracellulare (in nm) nella podocita corrispondente alla ROI utilizzando una formula:
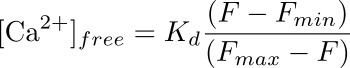
dove K d è una dissociazione predeterminato costante Fluo-4 (345 nM), F è l'intensità alla prima rilevazione che si sta calcolando la concentrazione di calcio per (basale) e F min e F max sono i valori di intensità del punto di carico massimo calcio (dopo l'applicazione ionomicina) e dopo quenching della fluorescenza (con MnCl 2), rispettivamente (vedere Figura 3).
Risultati
Qui abbiamo affrontato il problema di misurare variazioni acute dei livelli di calcio nei podociti. La Figura 1 mostra una rappresentazione schematica del protocollo sperimentale progettata per eseguire alta risoluzione confocale a fluorescenza diretta di imaging e singole registrazioni attività del canale ionico in podociti del fresco isolati glomeruli roditori. In breve, dopo che il ratto è anestetizzato, i reni devono essere lavati con PBS per eliminarli del sangue. Poi, i reni vengono escissi e de...
Discussione
L'approccio qui descritto permette l'analisi di movimentazione calcio dai podociti dei glomeruli roditori. Questa tecnica consente l'applicazione di patch-clamp elettrofisiologia singolo canale e imaging di fluorescenza confocale raziometrico. Tuttavia, entrambi gli approcci possono essere utilizzati separatamente, per conto proprio. Il protocollo proposto ha diverse relativamente semplici passaggi, tra cui a livello 1) del rene; 2) l'isolamento dei glomeruli da vagliatura differenziale; 3) l'esecuzi...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori desiderano ringraziare Glen Slocum (Medical College of Wisconsin) e Colleen A. Lavin (Nikon Instruments, Inc.) per un'eccellente assistenza tecnica con gli esperimenti di microscopia. Gregory Blass è riconosciuto per la correzione critica del manoscritto. Questa ricerca è stata sostenuta dal National Institutes of Health HL108880 concessione e American Diabetes Association concedere 1-15-BS-172 (AS), e il Ben J. Lipps Research Fellowship dalla Società Americana di Nefrologia (DVI).
Materiali
| Name | Company | Catalog Number | Comments |
| Fluo4 AM | Life Technologies | F14217 | 500 µl in DMSO |
| FuraRed AM | Life Technologies | F-3020 | |
| Poly-ʟ-lysine | Sigma-Aldrich | P4707 | |
| Pluronic acid | Sigma-Aldrich | F-68 | solution |
| Ionomycin | Sigma-Aldrich | I3909-1ML | |
| Tube rotator | Miltenyi Biotec GmbH | 130-090-753 | Germany |
| Nikon confocal microscope (inverted) | Nikon | Nikon A1R | Laser exitation 488 nm. Emission filters 500-550 nm and 570-620 nm |
| Objective | Nikon | Plan Apo 60x/NA 1.4 Oil | |
| Cover Glass | Thermo Scientific | 6661B52 | |
| High vacuum grease | Dow Corning | Silicone Compound | |
| Software | Nikon | Nikon NIS-Elements | |
| Recording/perfusion chamber | Warner Instruments | RC-26 | |
| Patch clamp amplifier | Molecular Devices | MultiClamp 700B | |
| Data acquisition system | Molecular Devices | Digidata 1440A | Axon Digidata® System |
| Low pass filter | Warner Instruments | LPF-8 | 8 pole Bessel |
| Borosilicate glass capillaries | World Precision Instruments | 1B150F-4 | |
| Micropipette puller | Sutter Instrument Co | P-97 | Flaming/Brown type micropipette puller |
| Microforge | Narishige | MF-830 | Japan |
| Motorized micromanipulator | Sutter Instrument Co | MP-225 | |
| Inverted microscope | Nikon | Eclipse Ti | |
| Microvibration isolation table | TMC | equipped with Faraday cage | |
| Multichannel valve perfusion system | AutoMake Scientific | Valve Bank II | |
| Recording/perfusion chamber | Warner Instruments | RC-26 | |
| Software | Molecular Devices | pClamp 10.2 | |
| Nicardipine | Sigma-Aldrich | N7510 | |
| Iberiotoxin | Sigma | I5904-5UG | |
| Niflumic acid | Sigma-Aldrich | N0630 | |
| DIDS | Sigma-Aldrich | D3514-25MG | |
| TEA chloride | Tocris | T2265 | |
| RPMI 1640 | Life Technologies | 11835030 | without antibiotics |
| BSA | Sigma-Aldrich | A8327 | 30% albumin solution |
| Temperature controlled surgical table | MCW core | for rodents | |
| Steel sieves: | #100 (150 μm), 140 (106 μm) | ||
| Gilson, Inc SIEVE 3 SS FH NO200 | Fisher Sci | 50-871-316 | |
| Gilson, Inc SIEVE 3 SS FH NO270 | Fisher Sci | 50-871-318 | |
| Gilson, Inc SIEVE 3 SS FH NO400 | Fisher Sci | 50-871-320 | |
| mesh 200 | Sigma-Aldrich | s4145 | screen for CD-1 |
| Binocular microscope | Nikon | Eclipse TS100 | |
| Binocular microscope | Nikon | SMZ745 | |
| Syringe pump-based perfusion system | Harvard Apparatus | ||
| Polyethylene tubing | Sigma-Aldrich | PE50 | |
| Isofluorane anesthesia |  VetEquip, Inc. VetEquip, Inc. | 911103 | |
| Other basic reagents | Sigma-Aldrich |
Riferimenti
- Machuca, E., Benoit, G., Antignac, C. Genetics of nephrotic syndrome: connecting molecular genetics to podocyte physiology. Hum. Mol. Genet. 18, R185-R194 (2009).
- Haraldsson, B., Nystrom, J., Deen, W. M. Properties of the glomerular barrier and mechanisms of proteinuria. Physiol. Rev. 88, 451-487 (2008).
- Patrakka, J., Tryggvason, K. New insights into the role of podocytes in proteinuria. Nat. Rev. Nephrol. 5, 463-468 (2009).
- Savin, V. J., Sharma, R., Lovell, H. B., Welling, D. J. Measurement of albumin reflection coefficient with isolated rat glomeruli. J. Am. Soc. Nephrol. 3, 1260-1269 (1992).
- Gloy, J., et al. Angiotensin II depolarizes podocytes in the intact glomerulus of the Rat. J. Clin. Invest. 99, 2772-2781 (1997).
- Nitschke, R., et al. Angiotensin II increases the intracellular calcium activity in podocytes of the intact glomerulus. Kidney Int. 57, 41-49 (2000).
- Ilatovskaya, D., Staruschenko, A. Single-channel analysis of TRPC channels in the podocytes of freshly isolated glomeruli. Methods Mol Biol. 998, 355-369 (2013).
- Snitsarev, V. A., McNulty, T. J., Taylor, C. W. Endogenous heavy metal ions perturb fura-2 measurements of basal and hormone-evoked Ca2+ signals. Biophys. J. 71, 1048-1056 (1996).
- Fukuda, A., Fujimoto, S., Iwatsubo, S., Kawachi, H., Kitamura, K. Effects of mineralocorticoid and angiotensin II receptor blockers on proteinuria and glomerular podocyte protein expression in a model of minimal change nephrotic syndrome. Nephrology (Carlton). 15, 321-326 (2010).
- Abramowitz, J., Birnbaumer, L. Physiology and pathophysiology of canonical transient receptor potential channels). FASEB J. 23, 297-328 (2009).
- Heeringa, S. F., et al. A novel TRPC6 mutation that causes childhood FSGS. PLoS ONE. 4, e7771 (2009).
- Zhang, X., Song, Z., Guo, Y., Zhou, M. The novel role of TRPC6 in vitamin D ameliorating podocyte injury in STZ-induced diabetic rats. Mol. Cell. Biochem. 399, 155-165 (2015).
- Bohrer, M. P., et al. Mechanisms of the puromycin-induced defects in the transglomerular passage of water and macromolecules. J. Clin. Invest. 60, 152-161 (1977).
- Olson, J. L., Rennke, H. G., Venkatachalam, M. A. Alterations in the charge and size selectivity barrier of the glomerular filter in aminonucleoside nephrosis in rats. Lab. Invest. 44, 271-279 (1981).
- Schiessl, I. M., Castrop, H. Angiotensin II AT2 receptor activation attenuates AT1 receptor-induced increases in the glomerular filtration of albumin: a multiphoton microscopy study. Am J Physiol Renal Physiol. 305, F1189-F1200 (2013).
- Ilatovskaya, D. V., Levchenko, V., Ryan, R. P., Cowley, A. W., Staruschenko, A. NSAIDs acutely inhibit TRPC channels in freshly isolated rat glomeruli. Biochem. Biophys. Res. Commun. 408, 242-247 (2011).
- Peti-Peterdi, J. Calcium wave of tubuloglomerular feedback. Am. J. Physiol. Renal Physiol. 291, F473-F480 (2006).
- Peti-Peterdi, J., Warnock, D. G., Bell, P. D. Angiotensin II directly stimulates ENaC activity in the cortical collecting duct via AT(1) receptors. J. Am. Soc. Nephrol. 13, 1131-1135 (2002).
- Ilatovskaya, D. V., Palygin, O., Levchenko, V., Staruschenko, A. Pharmacological characterization of the P2 receptors profile in the podocytes of the freshly isolated rat glomeruli. Am. J. Physiol. Cell Physiol. 305, C1050-C1059 (2013).
- Ilatovskaya, D. V., et al. Angiotensin II has acute effects on TRPC6 channels in podocytes of freshly isolated glomeruli. Kidney Int. 305, C1050-C1059 (2014).
- Schaldecker, T., et al. Inhibition of the TRPC5 ion channel protects the kidney filter. J. Clin. Invest. 123, 5298-5309 (2013).
- Roshanravan, H., Dryer, S. E. ATP acting through P2Y receptors causes activation of podocyte TRPC6 channels: role of podocin and reactive oxygen species. Am. J. Physiol. Renal Physiol. 306, F1088-F1097 (2014).
- Anderson, M., Roshanravan, H., Khine, J., Dryer, S. E. Angiotensin II activation of TRPC6 channels in rat podocytes requires generation of reactive oxygen species. J. Cell. Physiol. 229, 434-442 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon