このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
神経の分析のための成体マウスのV-SVZにおける細胞の安定的かつ効率的な遺伝子改変幹細胞自律と非自律効果
要約
Here we describe a procedure based on the use of lentiviral particles for the long-term genetic modification of neural stem cells and/or their adjacent ependymal cells in the adult ventricular-subventricular neurogenic niche which allows the separate analysis of cell autonomous and non-autonomous, niche-dependent effects on neural stem cells.
要約
比較的静止体性幹細胞は、大部分の成体組織における生涯細胞の再生をサポートしています。成人の哺乳類の脳内の神経幹細胞は、2つの特定の神経因性ニッチに制限されている:海馬における歯状回および心室-脳室下帯の顆粒下ゾーン(V-SVZを、また、上衣ゾーンまたはSEZと呼ばれる)の横の壁に心室。長期幹細胞における所望の導入遺伝子の発現およびそれらの派生子孫を生じる( すなわち、哺乳動物の脳のもの)成体幹細胞集団のためのin vivo遺伝子導入戦略の開発は、現在、生物医学及びバイオテクノロジー研究において重要なツールです。ここでは、直接in vivo法は、LVのによる細胞周期に依存しない感染症およびV-SVZニッチの専門性の高い細胞構築を活用して成体マウスV-SVZ細胞の安定な遺伝的改変のために提示されています。具体的には、現在のプロトコルが関与しますV-SVZ自体のいずれかに特異的な導入遺伝子発現カセットをコードする空のLV(対照)またはのLVの注入は、上衣のターゲティングのために、in vivoでのニッチ内の細胞のすべてのタイプのターゲティングのために、または側脳室の内腔に、よ細胞のみ。発現カセットは、次にできるよう、またのLVによってコード導入された細胞と蛍光タンパク質のゲノムに組み込まれている標識された細胞とにおける細胞自律非自律、ニッチ依存効果の分析のための形質導入された細胞の検出、それら子孫。
概要
マウス心室脳室下帯(V-SVZ)、線条体に面した側脳室の壁には、嗅球の持続的な生産における前駆細胞の複製と分化の結果の中で継続的なプロセス(OB非常にアクティブな胚領域であり、 )介在ニューロンと脳梁オリゴデンドロサイト1。 、星状細胞抗原グリア線維性酸性タンパク質(GFAP)を発現し、このようなネスチン、Id1のような細胞マーカー幹;これらの細胞の生涯の生成は、神経幹細胞(別名B1細胞のNSC)のこの領域に存在することによってサポートされているように見えます及びSox2の2。 GFAP発現B1細胞は、トランジット増幅前駆細胞転写がDLX2(遠位レスホメオボックス2)及びASCL1(哺乳類achaete-schuteホモログ1)を係数表現(TAP)細胞(C細胞)を、生成し、それらが生じる前に、急速に数回を分割神経芽細胞(A細胞)またはoligodendroblasts 3を移行します。新たに生成されたproliferative神経芽細胞は、彼らが粒状と差別化抑制性などの糸球体層に統合OBへの吻側渡り鳥ストリーム(RMS)を形成し、前方に移行します。移行若いoligodendroblastsは、彼らが局所的に分割または成熟ミエリン形成オリゴデンドロサイト1,4に分化していき未熟NG2陽性細胞となるCC、に移動。
胎児の放射状グリア細胞に由来B1細胞は、前任者の細長い偏光形態を保持し、それらのニッチで専門性の高い関係を示します。彼らはどのラインアップ心室とV-SVZニッチを灌漑血管のネットワークを上衣の間にまたがります。 multiciliated ependymocytes間のB1細胞のインターカレーションの小さな頂端プロセスおよび単一の非運動性の一次繊毛で終了し、その基礎プロセスはb。で、このニッチな結末を灌漑平面血管叢に近づくために長い距離を拡張し、一方、叢毛細血管2,5-8のASALラミナ。
無傷のV-SVZニッチでも、GFAP +である非神経性アストロサイトからB1-のNSCを区別するための最も確実な方法は、全マウント心室側壁の準備と3次元共焦点顕微鏡によるそれらの分析の後に基づいています各繊毛5,8の程度を標識するcilial基礎体またはアセチル化αチューブリンのマーカーとして細胞膜を描写するために、βカテニンを薄B1-NSC頂端プロセスにラベルを付け、およびγチューブリンのいずれかのためにGFAPの免疫染色。心室の表面からこれらの全マウントの観察は、B1及び上衣細胞は、1つまたは複数のGFAP + B1細胞の頂端uniciliatedプロセスはmulticiliated上衣細胞のロゼットで囲まれている中で「風車」5に配置されていることが示されています。
B1細胞の特徴的な形態は、実験的証拠と相関する私NSCを2,6,9-11に作用する可溶性シグナルの調節源を構成している血管/内皮細胞ndicatingおよび脳脊髄液(CSF)を心室。心室表面では、上衣とB1細胞が関与する同型と異apico-横相互作用がタイトジャンクションが含まれており、接合部5,12をアドヘレン。また、例えば、N-カドヘリン及びV-CAMとしてB1と上衣細胞との間の接合部複合体に関与する接着分子は、高度に組織化されたV-SVZニッチにおけるB1の位置決めだけでなく、それらの静止12だけでなく、調節することが示されています、13。上衣-B1細胞単層は、CSFから水および小分子の調節されたフラックスを可能にする拡散バリアとして機能するように見えますが、大きなタンパク質10,11の間の通路を制限します。実験的証拠は、一意に位置付けB1細胞頂端繊毛は、CSF 2に存在するポリペプチドシグナリングのセンサーとしての役割を果たし得ることを示しています5-7。上衣細胞はまた、それ自体が、NSCの挙動14,15の調節における役割と可溶性および膜結合信号の源です。
例えばブロモデオキシウリジン(BrdUの)、またはレトロウイルスなどの追跡可能なヌクレオシドは、広くインビボでのNSCを含む前駆細胞を標識するために使用されてきました。 BrdUの信号が繰り返される細胞分裂およびレトロウイルスを介して希薄しかし、これらの方法は、長期的な運命のトレースには最適ではない優先的に一過性に形質導入16,17のための細胞増殖のそれらの要件のために増幅する細胞を標的とするように見えます。 B1-NSCのは、主に静止状態であり、その近隣の上衣細胞は、生理的条件3の下で分裂したことがないようにニッチなコンポーネントとの相互作用を含む、in vivoで NSCの生理機能を調べるために、稀に分割していない細胞を標識し、追跡する方法を確立することが重要です。ここでは、レンチウイルスベクター(LVの)は、高効率遺伝子マークを可能にすることを示していまする最も合理形質導入すると、細胞周期に依存しない方法で標的細胞のゲノム中に統合するそれらの能力のために、成体のNSCおよび非分裂上衣細胞の長期的修飾、。さらに、私達は配達、特に上衣細胞を形質導入するウイルス力価のヘルプのルートが、B1ない細胞は、それによってのNSCにニッチに依存し、上衣効果の分析を可能にする方法を示しています。
プロトコル
倫理の声明:このプロトコルは、欧州指令63分の2010 / EUに準拠したバレンシア大学の動物のケアのガイドラインに従います。
研究をマーキングインビボのためのLVの1世代(図1aを参照してください)
注意:本明細書に記載された手順は、したがって、バイオハザードフード内のすべての次の手順を実行し、バイオセーフティーレベル2です。研究担当者は、適切な資格と、すべての手順の研修を受けていることを確認してください。ガウン、二重の手袋と適切な眼の保護を含め、個人用保護具を着用してください。最後に、完全に(70%エタノール、10%の漂白剤および/またはオートクレーブ処理で拭いて)承認された施設の消毒慣行に従ってウイルスと接触していたかもしれないすべてのツールとの表面を除染します。
- ヒト胎児腎臓293T細胞におけるLVの生産
- トランスフェクションのために純粋なDNAを調製することにより、このプロトコルを起動します。準備し、二重のCsCl卒業生によって各プラスミドを精製しient遠心分離またはエンドトキシンフリーDNAを得た他の市販のカラム法。このプロトコルでは、トランスファーベクタープラスミドpRRL-SIN-PPT.PGK.EGFP.Wpreを使用しています。推奨されるコアパッケージングプラスミドは、pMDLg / pRREとpRSV.REVとエンベローププラスミドpMD2G 13,18,19です。
- 二十四時間トランスフェクション前に、イスコフ改変ダルベッコ培地(IMDM)でプレートに5×10 6 293T細胞がために約1/4 1/3までコンフルエントな培養を得るために、10cmのプラスチック皿に(材料の表を参照してください )トランスフェクション。 5〜7%のCO 2雰囲気中、加湿インキュベーター中、37℃でインキュベートします。
- トランスフェクションの前に新鮮な培地2時間で培地を交換してください。
- 滅菌1.5ミリリットルマイクロチューブのpRSV.REV2.5μgのとpMDLg / pRREのパッケージングプラスミド5μgのとトランスファーベクタープラスミドのミックス10μgの(導入遺伝子のcDNAまたは送達されるのshRNAを含む)、および3.5では& #181;エンベローププラスミドpMD2Gのグラム。 0.1×TEバッファーで450μlの最終体積にプラスミド溶液を作る(材料の表を参照してください )/のdH 2 0(2:1)。その後、2.5 MのCaCl 2の50μlを添加します。
- フルスピードでボルテックスしながら2倍のHepes緩衝生理食塩水を500μlを滴下することにより沈殿物を形成する500μlのDNA-TE-のCaCl 2混合物に溶液(HBSを、材料の表を参照してください)。
- すぐに293T細胞に沈殿物を追加します。穏やかに混合するためにプレートを渦巻きます。インキュベーターにセルを返し、トランスフェクション後の媒体14-16時間を変更します。
- メディアを変更した後、細胞上清を30時間を収集します。孔径0.22μmのニトロセルロースフィルターを通して上清を濾過し、濃縮に進みます。
- LVの濃度
- 2のために50,000 XG(SW-28超遠心機のローターで19000 rpm)で超遠心分離することにより馴化培地を集中30ミリリットルのポリプロピレン透明円錐ローター管中の室温(RT)でhr。
注:円錐形のローターチューブ用使用超遠心分離機アダプタ(材料の表を参照)。 - デカンテーションにより上澄み液を捨て、(一つだけの遠心分離を行った場合に200μl以下)少量のペレットを再懸濁し、リン酸緩衝生理食塩水(PBS; 材料 の表を参照)。そして、アップピペットと約20倍ダウン。
- プール懸濁し、室温で2時間も50,000のx グラム (SW-55超遠心機のローターで23000 rpm)で、超遠心分離によって再び集中します。 (材料の表を参照)5ミリリットルの公称容量を有するポリプロピレン透明ローターチューブを使用してください。
- 滅菌PBSの非常に少量(媒体の出発体積の1/500または1 /千)で最終ペレットを再懸濁し、室温で1時間、回転ホイール上に振ります。少量のアリコート(5-20μL)とfに分割-80℃でそれらをreeze。
- 廃棄する前に、10%の漂白剤ですべての空のチューブを扱います。
- 2のために50,000 XG(SW-28超遠心機のローターで19000 rpm)で超遠心分離することにより馴化培地を集中30ミリリットルのポリプロピレン透明円錐ローター管中の室温(RT)でhr。
- フローサイトメトリーを使用したレンチウイルス滴定
- 前日、プレート2ダルベッコ改変イーグル培地(DMEM)溶液に加え、6ウェル組織培養プレート中にウェル当たり5×10 4個のHeLa細胞を、(材料の表を参照のこと)。 24時間5〜7%CO 2の雰囲気中、加湿インキュベーター中、37℃でインキュベートします。
- 滴定の日に、ウイルスストックのアリコートを解凍し、DMEM中で、10 -3から10 -8に、連続希釈液を準備します。
- これを行うには、24ウェルプレートを取ると、次のウェルに最初のウェルに2mlのDMEMと1.8ミリリットルを追加します。そして、(:1,000または10 -3 1の最終希釈に)最初のウェルに濃縮されたウイルスストックの2μlを添加します。
- 徹底的に解決、変更先と転送10 -3希釈液200μlを混合するために、数回ピペッティングした後、第2のウェルに。 10 -8希釈が行われるまで、次のウェル内に直列に手順を繰り返します。
- HeLa細胞をインキュベーターから前日メッキてください。注意深くウェルから培地を除去します。 HeLa細胞を含むウェルに8 mg / mlとヘキサジメトリン臭化1μlのと一緒に、各ウイルス希釈液の1ミリリットルを追加します。穏やかに混合するためにプレートを渦巻きます。
注:臭化ヘキサジメトリンは、培養中の細胞へのウイルスの吸着を高めるために添加されます。 - インキュベーターにセルを返し、感染は72時間進行させます。各ウェルに(材料の表を参照)その後、培地を除去し、PBSで細胞を1回洗浄し、トリプシンEDTAの200μlを添加します。
- 37℃で5分後、試験管フローサイトメトリーで各ウェル収穫細胞にPBSの2ミリリットルを追加します。
- 室温で5分間、300×gで遠心分離し、上清を吸引します。
- soluti固定1mlでペレットを再懸濁(PBS中の1%ホルムアルデヒド電子顕微鏡グレードおよび2%ウシ胎児血清)に、次にチューブをボルテックス。
- 15 mWのパワーで488 nmのアルゴンionlaserを使用して、フローサイトメーターで細胞を分析します。
- 前方散乱(FS)、側方散乱光(SS)、およびGFPのための蛍光(40分の525 nm)の標準設定でインストゥルメントを設定します。細胞集合体と破片を除外するためにSSのドットプロット対 FSで細胞集団のゲーティングを選択します。対数スケールでの蛍光を収集します。各試料中のGFP +細胞の数を計算します。
- 次の式を使用して、ベクター力価を計算します。x希釈係数を感染させた細胞(DF)の%のGFP + / 100 x個=形質導入単位(TU)/ mlです。
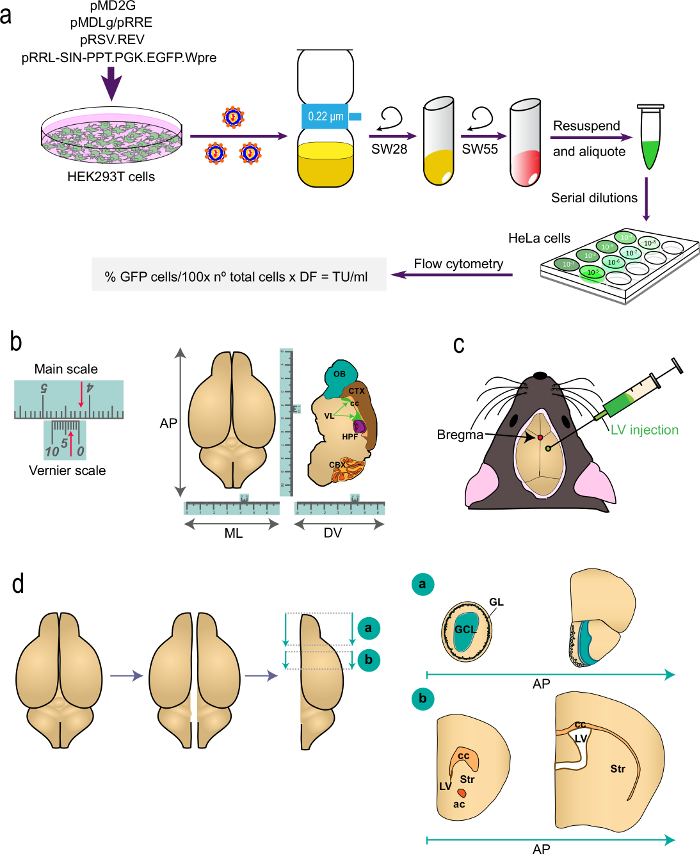
図1:手順のさまざまな部分の概略図で 、Tの(a)の第1部。彼は、プロトコル:適切なプラスミドを用いたHEK293T細胞のトランスフェクションからのin vivo標識研究のためのLVの生成が示された式を用いてフローサイトメトリーによりウイルス力価の決意にLVを生成します。プラスミドおよび遠心ロータの名前が示されています。 (b及びc)プロトコルのパート2:のLVの定位注射。 「b」はバーニヤ目盛、定位固定器具の一部であり、微細な測定のために機能する装置の例を示します。例として、矢印は4.23センチメートルを示しています。トップビュー(左)のために、サジタル断面(権利のために示すように、バーニアスケールは、(DV)軸、前後(AP)の座標を決定するために使用される内外方向(ML)、および背腹されます)脳の。 「c」は、矢状および冠状縫合との交点としてブレグマの位置を示しています。 LVSは、シリンジを用いて注入されます。どのように脳の私を示す(d)の模式図分析のために処理秒。 2つの半球に分割され、それぞれが2つのブロックに分割されています。 (;参考のためPaxinos'アトラスを参照してくださいブレグマ2.46ミリメートル)のOBを含むブロックの「a」は、すぐに終脳とOB接合に後方APレベルで冠状切断によって生成されます。ブロック「B」は2冠状カットすることにより製造される、レベルの1は、単に脳梁 (ブレグマ1.7ミリメートル)の最も吻側側面と2側脳室(ブレグマ-0.22の接合部のレベルで第1の前方ミリメートル)。 GL、糸球体層; GCL、顆粒細胞層。 ST、線条体。 ccで、 脳梁 。交流、前交連。 lvの、側脳室。
2. LVの定位注射V-SVZ /線条体ボーダーにまたは側脳室へ(図1bを参照してください)
- 準備
- プランジャーで70%エタノールで本体と針を下に噴霧することにより、33ゲージの針で5μlの容量のシリンジを滅菌しますすべての方法を引き抜きます。繰り返し1.5ミリリットルマイクロチューブからエタノールを吸引し、数回のすべての方法をそれを取り出して、その後滅菌水で十分にシリンジをすすぎます。培養フードに安全な場所に置き、注射器を置き、乾燥させます。
- この手順からのすべての廃棄物を浸漬するのに適したボリュームに10%の漂白剤とバイオハザード廃棄物容器を準備します(一般的に500ミリリットル容器内の200ミリリットル)。
- 水で密閉可能なプラスチック製の収納袋を充填し、37℃に加温して37℃のウォーターベッドを準備し、予熱。これは、マウスが注射後に回復することができます。
- 注射を開始する前に、Cの冷凍庫で1時間-80℃からウイルスストックを取り外し、室温で回転ホイール上でバイアルを置きます。解凍後、注射の時間の間に氷の上でウイルスストックを維持します。 LVの定位注射の前に、10 6 TUに濃縮されたウイルスストックを希釈/培養フードにPBSを使用してμlの。
- 70%エタノールで手術を行うための選択された領域を消毒。
- LVのマイクロインジェクション
- 選択し、手術(メス、ドリル、および小型のピンセット)のために必要なツールを殺菌。
- 腹腔内(IP)はケタミンおよびメデトミジンの獣医学的に監修混合物を注入することにより、6-8週齢のマウスを麻酔。各動物を計量し、50から75 mgのケタミンと( マウス当たりケタミン/メデトミジン作業溶液の100から125μlの周り)は、マウスの体重1kgあたり0.5〜1ミリグラムのメデトミジンで各用量。
- つま先、尾や耳をつまんし、動物が全く反応を示さないことを確実にすることによって、麻酔面を評価します。
- マウスを麻酔したら、手術後の痛みを最小限にするためにキロマウスの体重当たり0.4〜0.5ミリグラムの最終用量でブトルファノールの皮下注射。
- 耳の間の領域を剃るし、ヨードホールなどiodopovidoneまたは70%エタノールを使用して皮膚を消毒。滅菌綿を使用してクレンズ-tippedアプリケーター。これは低体温症を悪化させることができるように過度に動物を濡らさないように注意してください。
- 定位フレーム上の腹臥位で動物を置き、慎重に耳のバーや装置の口蓋サポートを使用してヘッドを固定します。 37℃に設定した加熱パッドでマウスを維持し、目への眼科用潤滑剤を適用します。
- 縦方向にメスを用いて頭皮上の長さ1cmの切開を行い、そして優しく細かいピンセットを使って頭蓋骨を露出させるために、皮膚を撤回。
- 慎重に滅菌綿棒で骨の表面を清掃してください。任意の残りの組織の露出した頭蓋骨を清め。
- シリンジホルダーを用いた定位装置上の滅菌注射器をマウントします。
- 注射針の先端がブレグマ、矢状(縦および内側)縫合糸が垂直に冠状縫合と交差する連動ポイントに配置されるまで(FigurをシリンジホルダX、Y及びZ軸を移動させます電子図1b)。背腹(DV)軸の「ゼロ」の位置はブレグマで頭蓋骨の表面であることを確認してください。
- xとy先の座標( 表1及び図1bを参照)に注射器を移動します。
| 注射の地域 | 座標 | ||
| 前後(AP) | 内外方向(ML) | 背腹(DV) | |
| SEZ /線条体の境界線 | 0.6ミリメートル | 1.2ミリメートル | -3.0ミリメートル |
| 側脳室 | -0.3ミリメートル | 1.0ミリメートル | -2.6ミリメートル |
表1:定位がで座標jections。AP及びML軸、x、y座標については、ブレグマからの距離(mm)として与えられています。 " - " "後方に向けて」を示しています。 DVは「ゼロ」を座標のブレグマ点で頭蓋骨の表面であるとDV座標がダウンし、この点から距離(mm)を示しています。
- Xに注釈を付け、y、zの目的地は、後に注射部位に戻ってくることができるようにするために、バーニアスケールで調整します。手術用マーカーペンを使用して、x、y座標でマーク骨。
- 作業領域から離れた注射器を移動します。
- 電動ドリルを使用すると、脳に損傷を与えないよう慎重に頭蓋骨に穴を作ります。これは脳の表面に損傷を与える可能性がある軟膜表面を開けないでください。
- 10 6 TU /μlのウイルス液の1μlのシリンジをロードします。その先端10から12°の角度を有する33ゲージの鋭い斜めの針を使用してください。 90°のANGで注射針を置きル脳表面に対する。
- バック注射部位に注射器を移動し、先端が軟膜表面に接触するまで、それを下に移動。
- DV軸にz座標に注射器で脳を貫通しています。
- ゆっくり過大流体圧力に起因する脳組織への損傷を最小限にするために、0.2マイクロリットル/分の速度で、ウイルス懸濁液を放出します。
- ウイルス懸濁液の逆流を最小限にするために5〜10分待ってから、非常にゆっくりと注射器を後退させます。ワイプラボを使用して、注射器の後退の結果として表面に現れ、漂白剤含有生物学的安全性廃棄物容器にすぐにそれを置くことができる液体のいずれかの過剰分を吸い取ります。
- 、定位セットから動物を取る暖かいパッドの上に置き、そして皮膚接着剤を使用して傷を閉じます。 0.1から1.0 mg / kg体重のアチパメゾールを使用して鎮静を逆にします。
- 、キロマウスの重量当たり0.1ミリグラムの最終用量で皮下ごとに12時間をBupenorphrineを注入短い持続ブトルファノールの鎮痛剤の投与後4時間を開始します。
- 暖かいパッドで個別ケージに動物を置き、マウスが麻酔から回復するまで綿密に監視します。回復後、動物の水和物を助けるためにケージにヒドロゲルの1袋を置きます。
- 液体漂白剤バイオハザード廃棄内のすべての生物汚染廃棄物を処分。エタノールの吸引、吐出することにより、注射器をきれいにし、水ですすいでください。エリア、定位セットと漂白剤と70%エタノールで使用されている外科用材料を消毒します。
- 彼らは、従来の住宅施設に転送することができた後24〜48時間のためのバイオセーフティーレベル2室に分離された注射したマウスを保ちます
3.組織学的解析
- 灌流、組織収集、および切片
- 深くメデトミジンとケタミンの獣医学的に監修混合物を使用してマウスをanaesthetize(トンをつまんで麻酔面を評価しますOES、尾や耳)、前述したように。
- 経同じ速度17においてPB中4%PFAを75ml、続いて食塩水25mlでマウスを灌流。
- 脳を抽出し、1-16時間、PBで冷たい4%PFAの少なくとも10倍のボリュームに浸漬することによってそれをポスト修正(増加後の固定時間は、いくつかの抗原の免疫反応性を減少させることができます)。 PBで十分に残っているPFAを洗ってください。
- 図1dの兆候後の脳をカットし、シアノアクリレートを使用して、ビブラのホルダーに得られたブロックを接着。
- ビブラトームを用いて、厚さ30μmの連続冠状断面を収集します。 4℃でPBで24マルチウェルプレート中の脳切片を保管してください。汚染を防ぐために、0.05%アジ化ナトリウムは、PB溶液に添加することができます。
- 免疫組織化学
- 0.05%アジ化ナトリウム、1%グリシン、5%正常ヤギ血清を緩衝液(PBをブロッキング自由浮遊切片をインキュベートし、0.1%トリットロッキングプラットフォームで穏やかに振とうしながら室温で1時間の場合)X-100について。
- 慎重に、ブロッキング緩衝液中の抗GFPウサギの一次抗体(材料の表を参照)の適切な希釈を追加し、ピペットでブロッキング緩衝液を除去し、穏やかに振盪しながら4℃で48時間、この希釈液で組織をインキュベートします。
- 一次抗体溶液をPBで3回、1回の洗浄ごとに10分の最小値を洗い流します。
- ブロッキング溶液中のフルオロフォア結合二次抗体の適切な希釈によるフリーフローティングセクション)をインキュベート(RTと穏やかに振とうで1時間)材料の表を参照してください 。インキュベーションの間に直接光からセクションを保護します。
- PB、3回ごとに10分間二次抗体溶液を洗浄し、5分間水中での1mg / mlのDAPI(4 '、6-ジアミジノ-2-フェニルインドール)を用いて切片をインキュベートすることによって、組織を対比染色。 2回迅速にウィットをすすぐことによってDAPI液を洗い流します時間水。
- 静かに細かいペイントブラシを使用して、顕微鏡スライド上にセクションを配置。組織の上に(材料の表を参照)、蛍光の準備のための媒体の装着数滴を入れ、慎重にマウントソリューションが正しく表面全体に分布されており、気泡がないことを確認し、上にカバースリップを配置。ゆっくりメディアの装着過剰を排出するためのカバースリップを下に絞ります。
- マウントソリューションは、(2-16時間)乾くときは、488 nmのレーザー共焦点レーザー走査顕微鏡によってサンプルを分析します。
結果
LV媒介遺伝子送達系は、増殖、遊走および分化の間にそれらの追跡及び遺伝的改変を可能にする、成体マウスのV-SVZにおける細胞の in vivo形質導入の長期に使用することができます。感染および発現は、非常に有効であり、含まれるレポーターの発現により他の非感染細胞の間で容易に区別することができる多数の細胞を得ました。我々は、これまで広範に発現ホスホグリセリン...
ディスカッション
LVSは大人のNSC 16,18の遺伝的改変のための他のウイルスシステムに比べて重要な利点を提供します。 V-SVZニッチへのレンチウイルスの定位配信は、ラベルを付け、そのような複数の細胞分裂後に希釈されたBrdU、またはレトロウイルスなどの他の一般的に使用される方法の限界を克服B1-のNSCを分割まれにトレースし、細胞のみを標的とするための効率的な方法を表し、それは、アプリケ...
開示事項
すべての操作はバイオセーフティーレベル2部屋で行われました。動物プロトコルは、バレンシア大学の倫理委員会によって承認され、すべての欧州指令63分の2010 / EUに準拠してありました。
謝辞
私たちは、MJパロップと大学・デ・バレンシアのSCSIEの技術支援の助けを認めます。我々はまた、有用なコメントや原稿の議論のためアントニアFollenziに感謝します。フンダシオンBotinのによってサポートされている場合は、そのサンタンデール大学グローバル部門を通じてバンコ・サンタンデールによると、Generalitatのバレンシア(PROGRAMAプロメテオ、ACOMP、およびISIC)とMINISTERIOデエコノミアのy Competitividad(:SAF2011-23331、CIBERNED及びRETICターセルMINECO)からの助成金によって、 。この作品は、また、(260511- MINECO と欧州研究評議会(ERC)2012-STGからBFU2010-21823とRETICターセル助成金によってサポートされていました AC BM-P へのPD-HUMMODEL)。 MINECOのスペインFPIの交わりの受信者です。
資料
| Name | Company | Catalog Number | Comments |
| Part 1: Generation of LV for in vivo delivery. | |||
| Equipment: | |||
| Ultracentrifuge | Beckman Coulter | Optima XL-100K | |
| Ultracentrifuge rotor | Beckman Coulter | SW-28 | |
| Ultracentrifuge rotor | Beckman Coulter | SW-55 | |
| Ultracentrifuge tubes | Beckman Coulter | 358126 | 25X89 mm |
| Ultracentrifuge tubes | Beckman Coulter | 326819 | 13X51 mm |
| Ultracentrifuge adapters | Beckman Coulter | 358156 | |
| 6-well plate | SPL | PLC-30006 | |
| 24-well plate | SPL | PLC-30024 | |
| 10 cm dish | SPL | PLC-20101 | 100x20 style |
| FACS tubes | Afora | DE400800 | 12x75 mm, 5 ml |
| Cup sterile FACS filter | BD | 340626 | 30 µm |
| Nitrocellulose filter | Millipore | SCGPU05RE | 0.22 μm |
| Flow cytometer | BD | LSR Fortessa | Blue laser 488 nm |
| Steritop filter | Biofil | FPE-204-500 | 0.22 µm |
| Reagents: | |||
| pMDLg/pRRE plasmid | Addgene | #12251 | Core packaging plasmid |
| pRSV.REV plasmid | Addgene | #12253 | Core packaging plasmid |
| pMD2G plasmid | Addgene | #12259 | Envelope plasmid |
| pRRL-SIN-PPT.PGK.EGFP.Wpre plasmid | Addgene | #12252 | Transfer vector plasmid |
| Dulbecco's Modified Eagle's Medium | Biowest | L0101-500 | For HeLa cell culture |
| Iscove's Modified Dulbecco's Medium | Life technologies | 12440-053 | For 293T cell culture |
| Tris-EDTA (TE) | Tris-HCl (sigma, T5941), 0.1 mM EDTA (sigma, E5134), pH 7.6, DNAse/RNAse-free, 0.2 µm sterile-filtered | ||
| 2X HBS | 0.28 M NaCl (Sigma, S7653), 0.05 M HEPES (Sigma, H7523), 1.5 mM anhydrous Na2HPO4 (Sigma, S7907) in dH2O (preferably not MilliQ). Adjust pH to 7.0 with NaOH solution (Calbiochem, 567530). | ||
| Fetal bovine serum (FBS) | Biowest | S181B-500 | Stock solution at 100X, used to prepare HeLa and 293T culture medium at a final concentration of 10X. |
| Glutamine | Sigma-Aldrich | G7513-100 | Stock solution at 200 mM, used to prepare HeLa and 293T culture medium at a final concentration of 6 mM. |
| Sodium pyruvate | Life technologies | 11360-039 | Stock solution at 100 mM, used to prepare HeLa and 293T culture medium at a final concentration of 1 mM. |
| GlutaMAX Supplement | Life technologies | 35050-061 | Used to prepare 293T culture medium at a final concentration of 1%. |
| Penicillin/streptomycin | Sigma-Aldrich | P4458 | Stock solution contains 5,000 units/ml penicillin and 5 mg/ml streptomycin. Used to prepare HeLa and 293T culture medium at a final concentration of 1%. |
| Trypsin-EDTA | Life Technologies | 25200-056 | With phenol red, contains 2.5 g porcine trypsin and 0.2 g EDTA 4Na/L HBSS. |
| Phosphate buffered saline (PBS) | Sigma-Aldrich | D1408 | Without calcium chloride and magnesium chloride, 10X, liquid, sterile-filtered, suitable for cell culture. Stock solution used to prepare 1X PBS in cell culture grade water. |
| Polybrene (hexadimethrine bromide) | Sigma-Aldrich | H9268 | Powder. Prepare a 1000X stock solution at 8 mg/ml in dH2O |
| Paraformaldehyde EM grade 16% | EM Sciences | 15710 | |
| Name | Company | Catalog Number | Comments |
| Part 2: Sterotaxic injection of LV into the SEZ proper or the lateral ventricle. | |||
| Equipment: | |||
| Vernier stereotaxic instrument | NeuroLab, Leica | 39463001 | |
| Cunningham mouse and neonatal rat adaptor | NeuroLab, Leica | 39462950 | |
| Syringe holder | KD Scientific | KDS-311-CE | |
| 33-gauge syringe | Hamilton | P/N 84851/00 | #85RN |
| Electric drill | Fine Science Tool | 98096 | |
| Thermal blanket | Ufesa | AL5512/01 | 230-240 V, 100-110 W, type C_AL01 |
| Shaver | Jata | MP373N | Model: beauty, 3 V, 300 mA, type HT-03. |
| Reagents: | |||
| Medetomidine | Esteve | DOMTOR | Comercial solution at 1 mg/ml. |
| Ketamine | Merial | Imalgene 500 | Comercial solution at 50 mg/ml |
| Medetomidina/ketamine mixture | Prepare a working mixture of medetomidine at a final concentration of 0.2 mg/ml dilution and ketamine at a final concentration of 15 mg/ml in saline solution. Use as anesthesia injecting a volume to get a final concentration of 0.5-1 mg medetomidina per kg body weight and 50-75 mg ketamine per kg body weight | ||
| Butorphanol | Pfizer | Torbugesic | Stock solution at 10 mg/ml. Used as analgesia at 1 mg/ml in saline solution. |
| Atipamezole | Esteve | Antisedan | Stock solution at 5 mg/ml, used in a final concentration of 0.5 mg/ml in saline solution to exit from anesthesia. |
| 0.9% saline solution | Braun | 13465412 | |
| Histoacryl | Braun | 1050052 | Topical skin adhesive |
| HydroGel | Clear H2O | 70-01-5022 | |
| Kimwipes | Kimberly-Clark | 34120 | 11x21 cm |
| Bleach/Virkon | Dupont | ||
| Surgical marker pen | Staedler | 313-9 | Permanent lumocolor |
| Ophthalmic lubricant | SICCAFLUID | 0.5 g/dosis, carbomer 974P | |
| Povidone-iodine | Betadine | 694109.6 | 10% povidone-iodine |
| Name | Company | Catalog Number | Comments |
| Part 3: Histological analysis. | |||
| Equipment: | |||
| Automatic peristaltic pump | Cole-Parmer Inst. Co. | HV-07524-55 | Masterflex L/S variable-speed economy drive, 1.6-100 rpm, 230 V |
| Pump head | Cole-Parmer Inst. Co. | HV-07518-00 | Masterflex L/S Easy-Load pump head for precision tubing; PSF housing, CRS rotor |
| Silicone tube | Cole-Parmer Inst. Co. | HV-96410-16 | Platinum L/S 16 |
| Scalp vein set | Vygon V-green | 70246.05T | 25G, 30 cm tube length |
| Vibratome | Leica | VT1000 | |
| Confocal microscope | Olympus | FluoView FV10i | |
| Hot plate | Tehtnica | SHP-10 | |
| Reagents: | |||
| Phosphate buffer (PB) | 0.2 M PB: 0.2 M Na2HPO4 (Sigma, S7907) and 0.2 M NaH2PO4 (Panreac, 141965.1211) in dH2O, adjust pH to 7.2-7.4 | ||
| Paraformaldehyde (PFA) | Panreac | 141451.1211 | Prepare fresh every time. Heat dH2O up to 55–60 °C using a hot plate placed in a fume hood and pour PFA powder while stirring to obtain an 8% solution. The solution is cloudy white as PFA does not dissolve easily. Add 1N NaOH drop by drop just until the solution clears. Cool down, filter through Whatman paper and add an equivalent volume of 0.2 M PB. |
| Saline solution | 0.9% NaCl in dH2O | ||
| Superglue | LOCTITE | 767547 | |
| Sodium azide | Panreac | 122712.1608 | |
| Glycine | Sigma-Aldrich | G7126-100 | |
| Normal goat serum | Millipore | S30-100 | |
| Triton X-100 | Sigma-Aldrich | T9284 | Detergent |
| Anti-GFP rabbit antibody | ROCKLAND | 600-401-215 | Use at a 1:500 dilution |
| Alexa Fluor 488 Donkey Anti-Rabbit IgG (H+L) Antibody | Molecular probes | A-21206 | Use at a 1:750 dilution |
| 6-Diamindino-2-phenylindole dihydrochloride hydrate (DAPI) | Sigma-Aldrich | D9542 | Fluorescent nuclear staining. Use at 2 mg/ml in ddH2O. Keep in the dark at 4 °C. |
| Fluoromount-G | EM Sciences | 17984-25 | Mounting medium for fluorescent preparations |
参考文献
- Fuentealba, L. C., Obernier, K., Alvarez-Buylla, A. Adult neural stem cells bridge their niche. Cell Stem Cell. 10 (6), 698-708 (2012).
- Silva-Vargas, V., Crouch, E. E., Doetsch, F. Adult neural stem cells and their niche: a dynamic duo during homeostasis, regeneration, and aging. Curr Opin Neurobiol. 23 (6), 935-942 (2013).
- Ponti, G., Obernier, K., Alvarez-Buylla, A. Lineage progression from stem cells to new neurons in the adult brain ventricular-subventricular zone. Cell Cycle. 12 (11), 1649-1650 (2013).
- Menn, B., Garcia-Verdugo, J. M., Yaschine, C., Gonzalez-Perez, O., Rowitch, D., Alvarez-Buylla, A. Origin of oligodendrocytes in the subventricular zone of the adult brain. J Neurosci. 26 (30), 7907-7918 (2006).
- Mirzadeh, Z., Merkle, F. T., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Neural stem cells confer unique pinwheel architecture to the ventricular surface in neurogenic regions of the adult brain. Cell Stem Cell. 3 (3), 265-278 (2008).
- Shen, Q., et al. Adult SVZ stem cells lie in a vascular niche: a quantitative analysis of niche cell-cell interactions. Cell Stem Cell. 3 (3), 289-300 (2008).
- Tavazoie, M., et al. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3 (3), 279-288 (2008).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal flow. J Vis Exp. (39), (2010).
- Ramirez-Castillejo, C., et al. Pigment epithelium-derived factor is a niche signal for neural stem cell renewal. Nat Neurosci. 9 (3), 331-339 (2006).
- Falcao, A. M., Marques, F., Novais, A., Sousa, N., Palha, J. A., Sousa, J. C. The path from the choroid plexus to the subventricular zone: go with the flow!. Front Cell Neurosci. 6, (2012).
- Delgado, A. C., et al. Endothelial NT-3 delivered by vasculature and CSF promotes quiescence of subependymal neural stem cells through nitric oxide induction. Neuron. 83 (3), 572-585 (2014).
- Kokovay, E., et al. VCAM1 is essential to maintain the structure of the SVZ niche and acts as an environmental sensor to regulate SVZ lineage progression. Cell Stem Cell. 11 (2), 220-230 (2012).
- Porlan, E., et al. MT5-MMP regulates adult neural stem cell functional quiescence through the cleavage of N-cadherin. Nat Cell Biol. 16 (7), 629-638 (2014).
- Ihrie, R. A., Alvarez-Buylla, A. Lake-front property: a unique germinal niche by the lateral ventricles of the adult brain. Neuron. 70 (4), 674-686 (2011).
- Porlan, E., Perez-Villalba, A., Delgado, A. C., Ferròn, S. R. Paracrine regulation of neural stem cells in the subependymal zone. Arch Biochem Biophys. 1-2 (534), 11-19 (2013).
- Mamber, C., Verhaagen, J., Hol, E. M. In vivo targeting of subventricular zone astrocytes. Prog Neurobiol. 92 (1), 19-32 (2010).
- Ferron, S. R., Andreu-Agullo, C., Mira, H., Sanchez, P., Marques-Torrejon, M. A., Fariñas, I. A combined ex/in vivo assay to detect effects of exogenously added factors in neural stem cells. Nat Protoc. 2 (4), 849-859 (2007).
- Consiglio, A., et al. Robust in vivo gene transfer into adult mammalian neural stem cells by lentiviral vectors. Proc Natl Acad Sci U S A. 101 (41), 14835-14840 (2004).
- Dull, T., et al. A Third-Generation Lentivirus Vector with a Conditional Packaging System. J. Virol. 72 (11), 8463-8471 (1998).
- Bomsel, M., Alfsen, A. Entry of viruses through the epithelial barrier: pathogenic trickery. Nat Rev Mol Cell Biol. 4 (1), 57-68 (2003).
- Castellani, S., Di Gioia, S., Trotta, T., Maffione, A. B., Conese, M. Impact of lentiviral vector-mediated transduction on the tightness of a polarized model of airway epithelium and effect of cationic polymer polyethylenimine. J Biomed Biotechnol. , (2010).
- Bonazzi, M., Cossart, P. Impenetrable barriers or entry portals? The role of cell-cell adhesion during infection. J Cell Biol. 195 (3), 349-358 (2011).
- Padmashali, R., You, H., Karnik, N., Lei, P., Andreadis, S. T. Adherens junction formation inhibits lentivirus entry and gene transfer. PLoS One. 8 (11), (2013).
- Yamashita, T., et al. Subventricular zone-derived neuroblasts migrate and differentiate into mature neurons in the post-stroke adult striatum. J Neurosci. 26 (24), 6627-6636 (2006).
- Platt, R. J., et al. CRISPR-Cas9 knockin mice for genome editing and cancer modeling. Cell. 159 (2), 440-455 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved