Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Использование капиллярный электрофорез для Количественно органических кислот из растительных тканей: Случай испытания экспертизы
В этой статье
Резюме
В данной статье представлен метод обнаружения и количественного определения органических кислот из растительного сырья с использованием бесплатного зонального капиллярного электрофореза. Примером потенциального применения этого метода, определяющего влияния вторичного брожения на уровнях органических кислот в семенах кофе, обеспечивается.
Аннотация
Карбоновые кислоты представляют собой органические кислоты, содержащие одну или более концевых карбоксильных (COOH) функциональных групп. Короткие цепи карбоновых кислот (SCCAs; карбоновые кислоты, содержащие от трех до шести атомов углерода), такие как малат и цитрат, имеют решающее значение для правильного функционирования многих биологических систем, в которых они функционируют в клеточном дыхании и могут служить индикаторами здоровья клеток. В пищевых продуктах, содержание органических кислот может оказывать существенное влияние на вкус, с повышенными уровнями SCCA приводит к кислым или "кислотный" вкус. Из-за этого, методы экспресс-анализа уровней органических кислот представляют особый интерес для пищевых продуктов и напитков. К сожалению, однако, большинство методов, используемых для SCCA количественной оценки зависят от затрат времени протоколов, требующих дериватизации образцов с опасными реагентами, с последующим хроматографическим дорогостоящую и / или масс-спектрометрических анализов. Этот метод подробно альтернативный метод для обнаружения и определения количества орги неорганические кислоты из растительного материала и образцов пищевых продуктов с использованием свободного зонального капиллярного электрофореза (CZE), иногда называют просто капиллярного электрофореза (СЕ). CZE обеспечивает экономически эффективный метод измерения SCCAs с низким пределом обнаружения (0,005 мг / мл). В данной статье подробно извлечение и количественное определение SCCAs из образцов растений. В то время как метод при условии, фокусируется на измерении SCCAs из кофейных зерен, метод, может быть применена к нескольким пищевых материалов на растительной основе.
Введение
Carboxylic acids are organic compounds containing one or more terminal carboxyl functional groups, each attached to an R-group containing one or more carbons (R-C[O]OH). Short chain, low molecular weight carboxylic acids (short chain carboxylic acids, SCCAs) containing between one and six carbons, are essential components of cellular respiration, and function in several biochemical pathways necessary for cell growth and development. SCCAs play critical roles in cellular metabolism1, cell signaling2, and organismal responses to the environment (such as antibiosis3). Because of this, SCCAs can serve as useful indicators of disruptions to cellular metabolism, plant stress responses4,5, and fruit quality6,7. To date, SCCAs have been quantified primarily through chromatographic techniques such as high performance liquid chromatography (HPLC) or gas chromatography-mass spectroscopy (GC-MS). While these methods, are capable of achieving very low limits of detection, they can be expensive, require the derivatization of target SCCAs using caustic and/or toxic reagents, and include lengthy separation runs on the GC or HPLC. Because of this, interest in the use of free zonal capillary electrophoresis (CZE), which does not require sample derivatization, to quantify organic acids has steadily increased8.
Free zonal capillary electrophoresis (CZE) is a chromatographic separation methodology that, due to its high number of theoretical plates, speed, and relative ease-of-use, is increasingly replacing both GC-MS and high-pressure liquid chromatography as an analytical method for the quantification (particularly for quality control purposes) of anions, cations, amino acids, carbohydrates, and short chain carboxylic acids (SCCAs)8,9,10. CZE-based separation of small molecules, including SCCAs, is based two primary principles: the electrophoretic movement of charged ions in an electrical field established across the buffer filling the capillary; and the electro-osmotic movement of the entire buffer system from one end of the capillary to the other, generally towards the negative electrode. In this system, small molecules move towards the negative electrode at varying speeds, with the speed of each molecule determined by the ratio of the net charge of the molecule to the molecular mass. As the movement of each individual molecule in this system is dependent on the charge state of the molecule and the overall rate of electro-osmotic flow (which is itself based on the ion content of the buffer used to fill the capillary), the buffer pH and ionic composition heavily impact the degree to which molecules can be efficiently separated using CZE. Because of this, SCCAs, with their relatively high charge-to-mass ratios, are ideal targets for CZE-based separation. Metabolites separated using CZE can be detected using a variety of methods, including UV absorbance, spectral absorbance (which is generally performed using a photo-diode array [PDA]), and/or mass spectroscopy (CE-MS or CE-MS/MS)8. The diversity of separation and detection methods provided by CZE makes it an extremely flexible and adaptable technique. Because of this, CZE has been increasingly applied as a standard method of analysis in the areas of food safety and quality11,12, pharmaceutical research13, and environmental monitoring13,14.
Capillary electrophoresis has been used to detect and quantify short chain carboxylic acids for nearly two decades13. The resolving power (particularly for small, charged molecules), short run time, and low per sample cost of CZE analyses make CZE an ideal technique for the separation and quantification of SCCAs13. This method presents a protocol to utilize CZE to measure the concentration of organic acids from plant tissues. Example data was generated through the successful implementation of this protocol to measure the change in organic acid levels in coffee seeds following a secondary fermentation treatment. The protocol details the critical steps and common errors of CZE-based separation of SCCAs, and discusses the means by which this protocol can be successfully applied to quantify SCCAs in additional plant tissues.
протокол
1. Подготовка образцов
- Собрать образцы для карбоновой кислоты (SCCA) экстракции с короткой цепью. Подготовьте 1,0 г семян кофе в то время, чтобы обеспечить достаточное количество пробы будет оставаться после обработки.
- Если образцы были заморожены до процесса измельчения, держать ткань замороженный по всей обработки для предотвращения замораживания / оттаивания повреждение и окисление образца. Удалить образец из морозильной камеры или минусовых хранения только по мере необходимости для измельчения.
- Вспышка замораживать свежие образцы в жидком азоте непосредственно перед образец измельчения. Чтобы свести к минимуму обработку проб, флэш-образцы, замороженные, помещая их в ступке, предварительно заполненных жидким азотом.
- Анализ жидких проб сразу же после генерации, или флэш-замораживание в жидком азоте и хранят при -20 ° С или -80 ° С до анализа. Перед проведением анализа удалите замороженные образцы из хранилища и позволяют оттепели. Для жидких образцов перейдите к шагу (3.5) для обработки.
- Носите APPROтаже средства индивидуальной защиты (в том числе защитные очки, перчатки и лабораторный халат) перед началом работы с жидким азотом.
- Тройной размолоть образцы тканей к равномерно тонкого порошка (т.е. одинакового размера частиц) в жидком азоте с использованием керамического ступки и пестика.
Примечание: Достигнув однородный размер частиц, имеет важное значение для максимизации эффективности экстракции SCCA.- Предварительно охладить ступки и пестика с жидким азотом перед добавлением образца. Хранить раствор, заполненный небольшим объемом жидкого азота в качестве добавляется образец.
- Используя ковшик, добавьте достаточное количество жидкого азота в ступке, чтобы полностью погрузить образец.
- Добавьте легко измельчить образцы, такие как листья или обжаренного кофе, в жидком азоте и раздавить с использованием движение кругового шлифования. Начните шлифовать образцы, когда уровень жидкого азота уменьшается до точки, где она едва покрывает образцы.
- Добавьте трудно шлифовать образцы, такойS сырые семена кофе, жидкий азот и позволить им заморозить в течение 10-30 сек (или пока жидкий азот перестанет энергично кипячения) перед помолом. Перерыв ткани на более мелкие фрагменты, используя вертикальное движение по дроблению, а затем полное ткани шлифование с помощью движения круглошлифовальные.
- Повторите шаги 1.3.2-1.3.4 в два раза больше, так что образцы шлифуются в общей сложности три раза. Как правило, три последовательных циклов измельчения уменьшит образцы в порошок с мукой консистенции.
- Если мука консистенция не достигнута, повторите шаги 1.3.2-1.3.4, пока образцы не измельчить в порошок равномерно малым размером частиц (эффективность экстракции обратно пропорциональна размеру частиц).
- Передача порошка в стеклянных флаконах или 1,5 мл микропробирок. Начать обработку вниз по течению сразу после измельчения (рекомендуется), или хранить образцы при -80 ° С до образцов готовы к добыче.
- Если образцы должны быть сохранены до тогоанализ, разделить выборку на 500 мг аликвоты (или 500 мкл аликвоты для жидких образцов) и разделить между несколькими трубками для хранения. Избегайте подвергая образцы для повторных циклов замораживания / оттаивания, так как они могут изменить состав пробы и отрицательно повлиять на будущие измерения образца.
2. Органическая кислота Стандартная подготовка
- Собрать подлинные стандарты для SCCAs интересов. Они будут использоваться для создания внешних и внутренних стандартных растворов для использования при определении концентрации SCCA. Для получения образцов кофе включают лимонную, яблочную, уксусную, молочную кислоту и в качестве кислот, представляющие интерес и адипиновой кислоты в качестве внутреннего стандарта.
- Убедитесь в том, что внутренний стандарт выбран не найден в природе в образце, а также о том, что стандарт не коэлировать с другими пиками в профиле образца.
- Выполнить стандартные кривые для каждого SCCA интерес, и определить линейный диапазон отклика для каждого SCCA (смотри раздел 4 для запуска инст). волнения Убедитесь в том, чтобы запустить стандартные кривые для каждого SCCA измеряется в образце.
Примечание: Стандартные кривые могут быть запущены в любой буфер или фон из исследуемого образца. Во втором случае ( "стандарт") Кроме того, значения площади пика каждой стандартной точки кривой будет определяться путем вычитания фона в сторону образца. - Предварительно этикетка все трубы и изделия из стекла, необходимые с кислым названием SCCA, концентрации и даты анализа.
- Готовят растворы для каждого стандарта при известной концентрации (10 мг / мл) с использованием мерную колбу для обеспечения точности во время стандартного препарата.
- Растворить твердые стандарты SCCA (лимонная кислота и яблочная кислота) в сверхчистой воде (18,2 МОм) для достижения требуемой концентрации для исходного раствора.
- Создание 10 мг / мл исходного раствора добавлением 100 мг стандартного в 10 мл мерную колбу. Наполните мерную колбу на 10 мл линии сверхчистой водой до dissolve кислоту.
- Создание более низкую концентрацию кислоты стандарта или слегка нагреть колб водить труднодоступных раствориться стандарты SCCA, как адипиновой кислоты, в раствор.
- Развести стандарты кислоты жидкой фазы (уксусная кислота и молочная кислота) в сверхчистой воде, чтобы достичь желаемой концентрации.
- Предварительно заполнить мерную колбу с 5 мл сверхчистой воды. Добавьте достаточное количество кислоты, чтобы получить раствор 10 мг / мл (рассчитанное с использованием плотности кислотных предоставленной производителем), в колбу, а затем добавить достаточное количество воды, чтобы довести до конечного объема раствора до 10 мл.
- Растворить твердые стандарты SCCA (лимонная кислота и яблочная кислота) в сверхчистой воде (18,2 МОм) для достижения требуемой концентрации для исходного раствора.
- Передача каждого исходного раствора в чистую стеклянную пробирку 15 мл, с политетрафторэтилена (PTFE) подкладке крышку, и печать с пластиковой пленкой парафина. Маточные растворы могут храниться в закрытых пробирках при температуре 4 ° С в течение 1 недели.
- Убедитесь в том, что стандарты SCCA не осаждается из раствора до его использования, если исходные растворы были в холодильнике после того, как ДГОвания. Drive осаждается обратно в раствор через слабом нагревании.
- Приготовьте раствор для экстракции SCCA. Включите внутренний стандарт в концентрации, достаточной для обнаружения в образцах (0,05 мг / мл). Подготовьте достаточное количество раствора для извлечения всех образцов.
- Приготовьте 50 мл экстракционного раствора SCCA путем разбавления внутреннего стандартного раствора до 0,05 мг / мл в сверхчистой воде. Добавьте 250 мкл внутреннего стандартного раствора (10 мг / мл) до 49,75 мл воды.
- Если экстракт необходимо разбавить, регулировать внутреннюю стандартную концентрацию в растворе для экстракции таким образом, чтобы конечная концентрация будет падать в пределах квантификации (давая обнаруживаемый, но не перенасыщен, пик, 5.2.2 ниже) из система CE после разбавления (0,05 мг / мл).
- Готовят свежий раствор для экстракции для каждой серии извлечений (т.е. для каждой экспериментальной серии).
- Подготовка стандартных образцов кривой(Ряд соответствующих разведений) для SCCAs интереса, используя минимум по меньшей мере, 5 баллов. Стандартные концентрации кривой, используемые должны быть в линейном диапазоне отклика для данного SCCA и охватывают концентрации SCCA, ожидаемые в образцах.
- Включите выбранный внутренний стандарт в стандартной кривой решений, чтобы количественно оценить внутреннего стандарта в образцах. Внутренний стандарт будет использоваться для оказания помощи в пиковой идентификации и расчета эффективности экстракции (раздел 6).
- Развести каждый SCCA до концентраций, определенных выше (0,01, 0,02, 0,04, 0,06, 0,08 мг / мл, см выше, 2.4.2) в новых микропробирок (по одному для каждой концентрации / стандартной точки кривой) с использованием сверхчистой воды. Подготовить 1 мл раствора для каждой стандартной точки кривой концентрации. Убедитесь в том, что каждая точка концентрации содержит все четыре стандарта кислоты и внутренний стандарт при правильной концентрации.
- Подготовьте новые стандартные точки кривой для каждого наборапроб, которые должны выполняться на системе капиллярного электрофореза. Удерживайте стандартные образцы кривой SCCA при 4 ° С до проведения анализа, который будет происходить после экстракции SCCAs из тканей-мишеней (раздел 3).
3. кислотную экстракцию Органические
- Предварительно этикеток пробирки с образцами, подготовка по меньшей мере, одну трубку для каждого образца, чтобы быть извлечены.
- Удалить образцы должны быть извлечены из хранилища и поместить их на лед во время взвешивания материала для экстракции.
- Взвесить 100 мг образца для экстракции SCCA.
- После взвешивания каждого образца, переноса ткани на чистую 1,5 мл микроцентрифужных трубки. Отмерьте количество образца как можно ближе к целевой массы, как это возможно, чтобы уменьшить изменчивость.
- Следите массы каждого образца, измеренной, как количество обнаруженных SCCAs будут нормализованы с использованием массы образца (см 6.5.2, ниже).
- После взвешивания всех образцов, прибавляют 1 мл раствора для экстракции (в Wateг + внутренний стандарт смесь со стадии 2.4) к каждой из пробирок. Держите соотношение экстракционного раствора к массе ткани одинаковы во всех извлечений (в данном случае 1 мл на 100 ± 5 мг ткани). Хорошо перемешайте вихря на 10 сек.
- Разрешить образцы сидеть при комнатной температуре в течение 1 ч. В течение этого часа, смешать каждую пробирку через каждые 15 минут, как в шаге 3.4.
- Через 1 ч экстракции, смешать образцов в последний раз и передавать образцы пробирки в микроцентрифуге. Центрифуга образцов при температуре 4 ° С, 10000 мкг в течение 10 мин для осаждения твердого материала (клеточные стенки, твердые частицы, и т.д.).
- При обработке жидких проб, добавьте соответствующую концентрацию внутреннего стандарта, кратко и центрифугу перемешать. После центрифугирования, обрабатывать жидкие образцы идентично экстракта из твердых образцов.
- Проверьте рН образцов, чтобы подтвердить, что они совместимы с диапазоном рН бегущего буфера в устройство обнаружения (этап 4.6) или буферную систему, будучи EMPloyed. По мере того как объемы пробы, как правило, достаточно мал, рН можно контролировать с помощью рН бумаги.
- Подготовка к фильтрации образцов с помощью шприца монтажа дисковых фильтров (3.8).
ПРИМЕЧАНИЕ: Предотвращение потери образца, гарантируя, что каждый фильтр правильно подключен к шприцу перед передачей супернатанта. Подготовьте один шприц, снабженный фильтром диска для каждого анализируемого образца (в том числе стандартных образцов кривой). - После центрифугирования проб и подготовки шприцевые фильтры, передавать супернатант из каждого образца в 3 мл шприц, снабженный шприцевой фильтр 0,2 мкм. С помощью нового фильтра и шприца для каждого образца. Фильтр всех образцов, в том числе стандартных образцов кривой и управления буфером, перед запуском в системе CE.
- Фильтр образца непосредственно в чистую центрифужную пробирку. После фильтрования, закройте пробирку, содержащую фильтрат и выбросьте устройство шприца / фильтра.
- Сразу же место отфильтрованные образцыв систему CE для обнаружения СЦСИ; или образцы хранят при температуре 4 ° С в течение ночи. Если образцы должны храниться в течение ночи, герметизации труб с пластиковым парафиновой пленки, чтобы предотвратить газообмен и испарение образца.
- Если образцы должны храниться дольше, чем на следующий день после фильтрации, флэш-замораживания экстракты в жидком азоте или замерзает при -20 ° С. После оттаивания, тем не менее, убедитесь, что каждый образец исследуют на образования осадка и фильтра, при необходимости (как на шаге 3.6).
4. Настройка обнаружения SCCA Выполнить
- Обратитесь к руководству пользователя CE для programming- и контроля программного обеспечения конкретных деталей.
- Приготовьте капиллярный электрофорез (СЕ) образца флаконов для обнаружения SCCA. Обеспечить Флаконы надлежащим образом маркированные, чистые и без дефектов.
- Вымойте и высушите колпачки флаконов CE перед использованием.
- Вымойте колпачки, погружая их в сверхчистой воде и позволяя им замочить на ночь. После замачивания колпачки, отбросить замочитьИНГ раствор и промойте колпачков в два раза больше сверхчистой водой.
- Передача ополаскивают колпачки на чистую сушильную поверхность выровненной с безворсовой тканью и дайте им высохнуть на воздухе. Обеспечить крышки полностью высохли перед использованием, чтобы избежать сбоев давления.
- Передача 1 мл образца в каждый флакон CE, соблюдая осторожность, чтобы избежать случайного разбрызгивания образца в горлышко флакона. После передачи данных установите крышку CE на каждом флаконе.
- Если разбавление необходимо, разбавьте образцы семян кофе 1:10 или 1: 100 непосредственно во флаконе CE с помощью сверхчистой воды. Для получения разведений более 1: 100, создание промежуточного разведения во избежание ошибок пипетирования.
- Подготовьте один флакон для каждой стандартной точки кривой путем переноса стандартной кривой, растворов (1,0 мл) с шагом 2,5 до флаконах CE. Закрывают каждую трубку после переноса.
- Готовят 0,1 М раствора гидроксида натрия (NaOH) путем добавления 0,04 г NaOH в химический стакан, содержащий 90 мл сверхчистой воды и позволяя гранулах то раствориться. Переносят 0,1 М раствора NaOH к мл мерную колбу 100 и довести общий объем до 100 мл.
- Добавить 1 мл 0,1 М раствора NaOH в чистую пробирку CE и крышкой.
- Подготовка буфера CE ампул для каждой партии образцов, которые будут работать на системе CE. Разделительные комплекты доступны или пользовательские буферы могут быть использованы 13.
- Подготовьте 1 флакон с 1 мл исходного буферного раствора и колпачок.
- Подготовьте три ампулы по 1 мл, каждая из которых работает буферного раствора и колпачок. Замените беговые буфер перед каждой серией образцов и стандартных точек кривой, или после 35 образцов, в зависимости от того что наступит раньше.
- Заполните три дополнительных ампул с 1 мл сверхчистой воды и колпачок каждый флакон.
- Подготовьте 1 пустой "отходы" флакон с крышкой.
- После подготовки чаш, описанных в пункте 4.8, загрузите флаконы, содержащие буферы и воду, а также флаконы отходов (из шагов 4.8.2-5) в буферный лоток капиллярный электрофорез SYSТЭМ, в соответствии с инструкциями изготовителя 15. Тщательно отметьте положение каждого флакона для автоматического пробоотборника программирования.
- Загрузите флаконах, содержащих стандартные точки кривой и ампулы, содержащие образцы, которые будут проанализированы в поднос образца на входе, как описано в инструкции изготовителя. Обратите внимание на положение каждого флакона для автоматического пробоотборника программирования (см шаги 4.11.1 ниже).
- Подготовка кондиционирования и примеры методов разделения (программы для них представлены в таблицах 1 и 2, соответственно), и записать файл последовательности образца в соответствии с инструкциями по эксплуатации прибора. Используйте метод разделения , подробно описанную в таблице 2: ополосните колонку инициатора (20 фунтов на квадратный дюйм) в течение 0,2 мин; ополоснуть ускорителя (20 фунтов на квадратный дюйм) в течение 0,5 мин, вводят образцы (0,5 PSI) на колонку для 0,09 мин, отдельные образцы при 20 кВ в течение 12 мин, промывают NaOH (20 фунтов на квадратный дюйм) в течение 0,5 мин, и, наконец, промыть водой ( 20 фунтов на квадратный дюйм) в течение 0,5 мин.
- Usiнг программного обеспечения управления CE, написать последовательность проб работает (т.е. рабочий список, список файлов подробно порядок , в котором будут проанализированы образцы, и метод , который будет использоваться для разделения каждого образца) с использованием "последовательности" электронных таблиц интерфейс. Каждая строка в таблице будет соответствовать пример запуска и производить один файл данных.
- Убедитесь, что при записи файла последовательности, образцы идентифицируют с помощью правильного положения в лотке для отбора проб. Убедитесь в том, что каждый файл данных имеет уникальное имя, чтобы предотвратить программное обеспечение от перезаписи предыдущих файлов. Программа CE работает капиллярная кондиционирования как отдельная последовательность до начала последовательности выполнения, содержащего метод разделения образца.
- Начните последовательности выборок запуска с стандартной кривой решений, а затем образцы SCCA, а в конце второго запуска стандартной кривой решений. Это позволит рассчитать степень любой потери сигнала, произошедшей в ходе анализа образца.

Таблица 1: Conditioning программа метод , используемый для получения капилляр для короткой цепи разделения карбоновой кислоты с помощью капиллярного электрофореза а.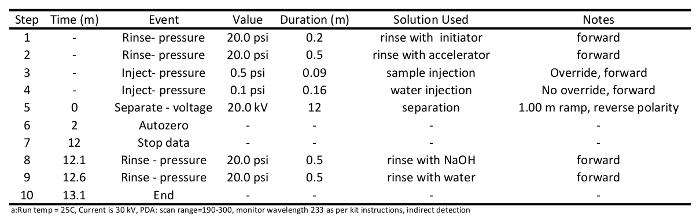
Таблица 2: Метод разделения программа , используемая для анализа с короткой цепью карбоновых кислот с помощью капиллярного электрофореза.5. Обнаружение SCCA Run Выполнение и сбор данных
- Инициировать капиллярные работает кондиционирования. Ожидать состояние капилляра два или три раза, прежде чем колонка готова к разделению образца. Кондиционирование колонки должна быть выполнена , как описано в Таблице 1. Вкратце, полоскание колонку с 0,1 М NaOH (20 фунтов на квадратный дюйм) в течение 1 мин, промыть водой (20 фунтов на квадратный дюйм) в течение1 мин, ополоснуть инициатора (20 фунтов на квадратный дюйм) в течение 0,5 мин, ополаскивали ускорителем (20 фунтов на квадратный дюйм) в течение 0,5 мин, отдельный ускорителем при 30 кВ в течение 10 мин, полоскать колонку с 0,1 М NaOH (20 фунтов на квадратный дюйм) в течение 0,5 мин, и, наконец, промыть колонку с водой (20 фунтов на квадратный дюйм) в течение 0,5 мин.
- Выдержать капилляр до начала каждого прогона последовательности выборок. Обеспечение надлежащего кондиционирования путем поддержания напряжения разделения является постоянным в течение пробега и наблюдения плоской базовой линии на трассе фотодиод массива.
- После кондиционирования, инициировать разделение образца, открыв меню "контроль" в программном обеспечении и выбора (то есть, нажав на) "запустить последовательность." Монитор фотодиод массив (PDA) след, чтобы обеспечить надлежащее разделение.
- Обратите внимание на первый след и убедитесь, что она имеет плоскую базовую линию и чисто решен (исходное разрешение), пики отдельных кислот. Перегружена образцы будут показывать длинные хвосты, пик или пик хвостохранилищ, и нужно будет разбавлять (рисунок 1).

Рисунок 1:. Сравнение КПК следы выделения перегруженный образец В аналита с увеличением концентрации, индивидуальный пик геометрия может начать становиться асимметричным. В (а) 0,05 мг / мл, уксусная кислота представляет собой четко определенную, симметричны пик. Поскольку концентрация уксусной кислотой возрастает до (б) 0,07 мг / мл и (в) 0,10 мг / мл, пиковую хвост формы (стрелки). Этот пик хвостохранилище является хорошим показателем того, что образец перегружен. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.- По завершении прогона последовательности, открыть файлы с данными по одному в программном обеспечении анализа CE и интегрировать пики.
- Интеграция выборочных пиков.
- Откройте первый файли установить автоматические шаги интегрирования для исключения первой 3 мин бега (где напряжение, и , следовательно , направление потока в колонке, инвертируется , как описано в таблице 1). В этом же меню, установить критерии выбора пика до минимальной ширины пика 50 единиц и площади пика 100 единиц (или заводские настройки по умолчанию), чтобы обеспечить умеренно высокий уровень селективности, разделения пиков кислот от фонового шума в след.
- Вручную проверить пиковые границы и исходные условия для каждого КПК следа для обеспечения правильного пика интеграции. Неверная интегральные пики (то есть, слегка асимметричный SSCA пик , который был интегрирован в виде двух отдельных пиков с помощью автоматизированного программного обеспечения) необходимо будет реинтегрируются вручную.
- Интеграция выборочных пиков.
- После интегрирования, просмотреть отчет о процентов площади, а затем выделить и скопировать отчет процента площади и вставить его в отдельную таблицу. Повторите эти действия для каждого образца для построения полного запуска пика ТЕЗИСОВ ДОКЛАДАт с каждой строкой , представляющей собой один пик (т.е.., каждый пик должен содержать одно соединение , если разделение работает хорошо).
Анализ 6. Данные
- Подготовка данных для анализа, используя таблицу, построенную в (5.4). Начинают анализ помечая Кислотные стандарты для каждого из стандартных точек кривой, в том числе внутреннего стандарта.
- Вычислить индекс сохранени дл каждого пика путем деления времени удерживания для каждого пика в образце по времени удерживания внутреннего стандарта в этом образце. Сортировка данных, установленные в результате индекс удерживания для идентификации пиков, представляющих интерес в каждом образце.
- После определения пика для каждой кислоты интерес, построить стандартные кривые для каждой кислоты с использованием внешних точек стандартной кривой.
- Генерирование стандарт (концентрация) кривой для каждого стандарта SCCA путем определения площади пика для каждой концентрации стандартов SCCA, и зависимости концентрации от XaXis против площади пика на оси у. Постройте линейной регрессии для каждой стандартной кривой SCCA и определим уравнение наклона (у = х + Ь).
- Убедитесь , что значения R 2 линейных регрессий 0,90 или выше , так как количественными, наиболее точно выполняются в линейном диапазоне по стандартной кривой.
- Вычислить концентрацию кислоты для данного SCCA в образце с использованием площади пика и уравнение углового коэффициента для линии линейной регрессии стандартной кривой (рассчитанной в разделе 6.3.2, выше). Если коротко, то разделить наблюдаемую площадь пика для данной кислоты наклон линии регрессии для стандартной кривой, Acid-х.
- Исправьте исходные значения концентрации, вычисленные на шаге 6.4 для потери образца во время обработки с использованием внутреннего стандарта (шаг 6.5).
- Расчет поправочного коэффициента для каждого образца с использованием внутреннего стандарта.
- Разделите фактическую концентрацию внутреннего стандарта (т.е. KNOколичество Wn добавлено в начале эксперимента) по найденному значению внутреннего стандарта в образце (то есть, количество рассчитывали по уравнению крутизна стандартной кривой для внутреннего стандарта). Умножьте исходные значения концентрации каждого SCCA в образце этого поправочного коэффициента.
- Разделить внутренний стандарт скорректированная концентрация СЦСИ по массе образца, используемого для извлечения для корректировки любого изменения массы образца. Этот расчет дает количество анализируемого вещества в массе образца (мг СЦСИ на мг молотый кофе в данном примере), которые затем могут быть преобразованы в соответствующие единицы для данного исследования (мг / мг, мг / г, г / г, и т.д. ).
- После расчета концентрации SCCA (нормируется либо массы [для твердых или жидких образцов] или [объема для жидких образцов]), использовать эти значения для статистического анализа в соответствии с требованиями опытно-конструкторских и вопросов, представляющих интерес.
- Usiнг программного обеспечения управления CE, написать последовательность проб работает (т.е. рабочий список, список файлов подробно порядок , в котором будут проанализированы образцы, и метод , который будет использоваться для разделения каждого образца) с использованием "последовательности" электронных таблиц интерфейс. Каждая строка в таблице будет соответствовать пример запуска и производить один файл данных.
Результаты
Этот протокол был успешно использован для измерения эффектов обработки семян на содержание SCCA зеленых семян кофе. В этом эксперименте шесть обработки были: насыщенный микробной суспензии из Leuconostoc pseudomesenteroides штамма GCP674 в ростовой среде (1), водная суспензия GCP674 ми...
Обсуждение
Как и с любой аналитической техникой, есть несколько важных факторов, которые могут существенно повлиять на качество и надежность данных, полученных. Во-первых, важно, чтобы обрабатывать образцы эффективно, с минимальным количеством циклов замораживания / оттаивания. Повторное замора?...
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
The authors would like to acknowledge the financial support of this project by The J.M. Smucker company.
Материалы
| Name | Company | Catalog Number | Comments |
| Ceramic Moarter and Pestle | Coorstek | 60310 | |
| Beckman Coulter P/ACE MDQ CE system | Beckman Coulter | Various | |
| Glass sample vials | Fisher Inc. | 033917D | |
| 1.5 ml microcentrifuge tubes | Fisher Inc. | 02-681-5 | |
| LC/MS grade water | Fisher Inc. | W6-1 | Milli-Q water (18.2 MΩ.cm) is also acceptable |
| 15 ml glass tube/ Teflon lined cap | Fisher Inc. | 14-93331A | |
| Parafilm M | Fisher Inc. | 13-374-12 | |
| CElixirOA detection Kit pH 5.4 | MicroSolv | 06100-5.4 | |
| BD Safety-Lok syringes | Fisher Inc. | 14-829-32 | |
| 17 mm Target Syringe filter, PTFE | Fisher Inc. | 3377154 | |
| 32 Karat, V. 8.0 control software | Beckman Coulter | 285512 | |
| capillary electrophoresis (CE) sample vials | Beckman Coulter | 144980 | |
| caps for CE vials | Beckman Coulter | 144648 | |
| Liquid Nitrogen | N/A | N/A | Liquid nitrogen is available from most facilities services |
Ссылки
- Araújo, W. L., Nunes-Nesi, A., Nikoloski, Z., Sweetlove, L. J., Fernie, A. R. Metabolic Control and Regulation of the Tricarboxylic Acid Cycle in Photosynthetic and Heterotrophic Plant Tissues: TCA Control and Regulation in Plant Tissues. Plant Cell Environ. 35 (1), 1-21 (2012).
- Finkemeier, I., Konig, A. C., et al. Transcriptomic Analysis of the Role of Carboxylic Acids in Metabolite Signaling in Arabidopsis Leaves. Plant Physiol. 162 (1), 239-253 (2013).
- Doyle, M. P., Buchanan, R. . Food Microbiology: Fundamentals and Frontiers. , (2013).
- Tůma, P., Samcová, E., Štulìk, K. Determination of the Spectrum of Low Molecular Mass Organic Acids in Urine by Capillary Electrophoresis with Contactless Conductivity and Ultraviolet Photometric Detection-An Efficient Tool for Monitoring of Inborn Metabolic Disorders. Anal Chim Acta. 685 (1), 84-90 (2011).
- López-Bucio, J., Nieto-Jacobo, M. F., Ramı́rez-Rodrı́guez, V., Herrera-Estrella, L. Organic Acid Metabolism in Plants: From Adaptive Physiology to Transgenic Varieties for Cultivation in Extreme Soils. Plant Sci. 160 (1), 1-13 (2000).
- Cebolla-Cornejo, J., Valcárcel, M., Herrero-Martìnez, J. M., Rosellò, S., Nuez, F. High Efficiency Joint CZE Determination of Sugars and Acids in Vegetables and Fruits: CE and CEC. Electrophoresis. 33 (15), 2416-2423 (2012).
- Rosello, S., Galiana-Balaguer, L., Herrero-Martinez, J. M., Maquieira, A., Nuez, F. Simultaneous Quantification of the Main Organic Acids and Carbohydrates Involved in Tomato Flavour Using Capillary Zone Electrophoresis. J Sci Food Agr. 82 (10), 1101-1106 (2002).
- Wasielewska, M., Banel, A., Zygmunt, B. Capillary Electrophoresis in Determination of Low Molecular Mass Organic Acids. Int J Environ Sci Dev. 5 (4), 417-425 (2014).
- Galli, V., Garcìa, A., Saavedra, L., Barbas, C. Capillary Electrophoresis for Short-Chain Organic Acids and Inorganic Anions in Different Samples. Electrophoresis. 24 (1213), 1951-1981 (2003).
- Klampfl, C. W. Determination of Organic Acids by CE and CEC Methods. Electrophoresis. 28 (19), 3362-3378 (2007).
- Kenney, B. F. Determination of Organic Acids in Food Samples by Capillary Electrophoresis. J Chromatogr A. 546, 423-430 (1991).
- Galli, V., Barbas, C. Capillary Electrophoresis for the Analysis of Short-Chain Organic Acids in Coffee. J Chromatogr A. 1032 (1-2), 299-304 (2004).
- Schmitt-Kopplin, P. Capillary Electrophoresis: Methods and Protocols. Methods in Molecular Biology. , 384 (2008).
- Nollet, L. . Chromatographic analysis of the environment 3rd ed. , (2006).
- . . ElixerOA Organic Acids/Anions Operating and Instruction Manual, MicroSolv Technology Corperation. , (2001).
- Dahlen, J., Hagberg, J., Karlsson, S. Analysis of low molecular weight organic acids in water with capillary zone electrophoresis employing indirect photometric detection. Fresenius J. Anal. Chem. 366 (5), 488-493 (2000).
- Ibanez, A. B., Bauer, S. Analytical method for the determination of organic acids in dilute acid pretreated biomass hydrolysate by liquid chromatography-time-of-flight mass spectroscopy. Biotech. For Biofuels. 7 (145), (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены