Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Die Erzeugung von Fluorescent Protein Fusions in
In diesem Artikel
Zusammenfassung
PCR-vermittelte Gen - Modifikation kann verwendet werden , fluoreszierendes Protein - Fusionen in Candida - Spezies zu erzeugen, die Visualisierung und Quantifizierung von Hefezellen und Proteinen erleichtert. Hier präsentieren wir eine Strategie für ein fluoreszierendes Protein - Fusion (ENO1-FP) in Candida parapsilosis zu konstruieren.
Zusammenfassung
Candida - Spezies, weit verbreitete Kolonisatoren der Darm- und Urogenitaltrakts, sind die Ursache für die Mehrzahl der invasiven Pilzinfektionen beim Menschen. So werden molekulare und genetische Werkzeuge benötigt, um die Untersuchung ihrer Pathogenese-Mechanismen zu erleichtern. PCR-vermittelte Genveränderung ist eine einfache und schnelle Ansatz Epitop-markierte Proteine zu erzeugen, deren Nachweis zu erleichtern. Insbesondere sind fluoreszierendes Protein (FP) Fusionen leistungsfähige Werkzeuge, die Visualisierung und Quantifizierung von beiden Hefezellen und Proteine, die durch Fluoreszenzmikroskopie und Immunoblotting ermöglichen, respectively. Plasmide enthalten FP - codierenden Sequenzen, zusammen mit Nahrungsmarkergene, die die Transformation von Candida - Arten zu erleichtern, wurden zum Zwecke der FP Konstruktion und Expression in Candida erzeugt wird . Hier präsentieren wir eine Strategie für eine FP - Fusion in einer Candida - Spezies zu konstruieren. Plasmide, die die Nourseothricin resista enthältnce Transformationsmarker - Gen (NAT1) zusammen mit Sequenzen für entweder grün, gelb oder Kirsche FPs (GFP, YFP, mCherry) zusammen mit Primer verwendet , die Gen-spezifische Sequenzen in einer Polymerase - Kettenreaktion (PCR) eine FP - Kassette zu erzeugen , . Diese genspezifischen Kassette hat die Fähigkeit, in das 3'-Ende des entsprechenden Genlocus durch homologe Rekombination zu integrieren. Erfolgreich in-frame-Fusion der FP-Sequenz in das Gen-Locus von Interesse genetisch überprüft, gefolgt von einer Analyse der Fusionsprotein-Expression mittels Mikroskopie und / oder Immundetektionsverfahren. Darüber hinaus ist für den Fall von stark exprimierten Proteine können erfolgreiche Fusionen für primär durch Fluoreszenz-Bildgebungstechniken gescreent werden.
Einleitung
Candida - Spezies sind symbiotischer Pilze , die die Darm- und Urogenitaltrakts aller Menschen besiedeln. Unter den Bedingungen der Immunschwäche, wie das mit Frühgeburt auftreten oder immunsuppressive Wirkung von Behandlungen für Krebs, kann Candida - Spezies opportunistischen Erregern werden. Von den Candida - Spezies, ist Candida albicans die häufigste Pilz Kolonisator und bewirkt , dass die Mehrheit der invasiven Pilzinfektionen. Andere Candida - Spezies wie C. glabrata, C. parapsilosis, C. tropicalis und C. kruseii auch schwere Infektionen bei immunsupprimierten Patienten verursachen, mit einigen ausstellenden intrinsische Resistenz gegen häufig Anti-Pilz - Antibiotika wie Fluconazol und Amphotericin B. Daher verwendet, Infektionen mit einigen dieser Arten werden immer häufiger, insbesondere bei Patienten beobachtet prophylaktisch mit Anti-Pilz-Mittel behandelt werden. Auch bei angemessene und rechtzeitige einNTI-Pilz - Behandlung, invasive Candida - Infektionen weiterhin mit einer signifikanten Morbidität und Mortalität 1 verbunden zu werden. Wegen der Bedeutung von Candida - Spezies in die menschliche Gesundheit besteht ein Bedarf an leicht verfügbaren molekularen Werkzeugen, die die Studie und Aufklärung ihrer Pathogenese - Mechanismen ermöglichen.
Ein wichtiges Instrument, das Forscher ermöglicht die Visualisierung und mikrobiellen Zellen und die Proteine zu quantifizieren, die sie zum Ausdruck bringen ist FP-Fusion-Technologie. Polymerase - Kettenreaktion (PCR) -vermittelte Modifikation Gen, wie in diesem Dokument beschrieben ist , ermöglicht die Konstruktion von Fusionen zwischen FP - Sequenzen und ein Candida Protein von Interesse an seiner genomischen Locus codierende Sequenz. Stabile Integration des Konstrukts erleichtert Analyse der Proteinexpression sowie Proteinlokalisierung Dynamik. Plasmide enthalten FP - Sequenzen, die für die Expression in Candida albicans optimiert und das kann in der PCR-vermittelten g verwendet werdenene Modifikationsstrategie wurden zuvor konstruiert 2, 3, 4, 5. Plasmide enthalten FP transformation "Kassetten": eine Sequenz FP auf einen Ernährungsmarker - Gen verknüpft, die die Transformation von C. albicans und C. parapsilosis 2, 3, 4, 5, 6, 7 erleichtert. Derzeit verfügbare Plasmide enthalten eine Vielzahl von selektierbaren Markergenen Nahrungs (URA3, HIS1, ARG4) für die Transformation von auxotrophen Stämmen sowie eine dominant Arzneimittelresistenzmarker (NAT1), die Auxotrophien fehlt Transformation von klinischen Stämmen ermöglicht. Darüber hinaus enthalten die Plasmide Optionen für bis zu vier verschiedenen FP-Sequenzen (grün [GFP], yellow [YFP], cyan [CFP] und Kirsche [mCherry]) und entweder eine ADH1 Terminierungssequenz für den Bau von Carboxy-terminus Protein - Fusionen oder einer Promotorsequenz für den Bau von Amino-Terminus Protein - Fusionen. Primer werden mit Homologie zu der Plasmid-DNA rund um die FP-Kassette entwickelt. Außerdem enthalten die Primer auch 5'-Verlängerungssequenzen eine Homologie zu dem Hefe - Gen von Interesse trägt markiert werden, der Integration der Kassette in den genomischen Locus durch homologe Rekombination (Figur 1) erleichtert. Genspezifischen FP Kassetten werden durch PCR erzeugt und dann umgewandelt in Candida - Zellen kompetent gemacht für die Aufnahme von DNA durch Behandlung mit Lithiumacetat.

Abbildung 1: Diagramm der wie FP - Sequenz - Fusionen in Candida - Spezies erzeugt werden. (A) Plasmid DNA includes eine FP - Sequenz und eine Sequenz , die Nourseothricin Widerstand (NAT1). Relativen Positionen Vorwärts (FWD) und rückwärts (REV) Primer gezeigt sind, mit schwarzen Abschnitte der Primer die Region der Homologie zu dem Plasmid-Sequenz anzeigt, und die purpurrote Bereiche bezeichnet die genspezifischen Region Homologie oder Primerverlängerung. (B) FP - Kassetten werden in Candida umgewandelt und zu integrieren in der ENO1 genomischen Locus durch homologe Rekombination (gestrichelte Linien). (C) Resultierende FP Fusionssequenz am 3' - Ende von ENO1. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Hier stellen wir ein Beispiel für Protein - Fusion (ENO1-FP) Konstruktionen in Candida - Spezies. Wir verwenden Tagging Plasmide , die die NAT1 Transformation Markergen zusammen mit Sequenzen , die für GFP, YFP enthält, odermCherry (Abbildung 2). Diese Plasmide werden zusammen mit den Primern in PCR verwendet , um genspezifische Kassetten erzeugen , die Fusion von FPs an das 3'-Ende ENO1 erleichtern, was zu einer Expression von ENO1 fusioniert an FPs an seinem Carboxy-Terminus.
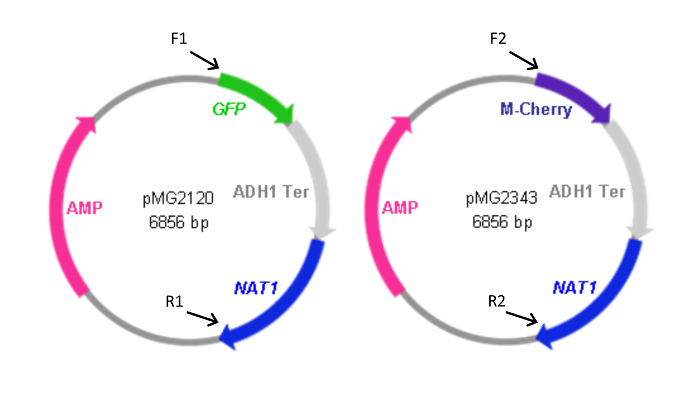
Abbildung 2: Karten von FP - Kassette enthaltenden Plasmide. Vorwärts (F) und rückwärts (R) Primer verwendet, um die Kassetten aus den Plasmiden zu erzeugen, zusammen mit der relativen Lage ihrer Homologie zu den Plasmiden angegeben. Primersequenzen sind in Tabelle 1 aufgeführt. F1 und R1 wurden auch zur Erzeugung der pYFP- NAT1 Kassette verwendet. Das Plasmid , das das YFP- NAT1 Kassette (pMG2263) enthält , ist identisch mit pMG2120 mit Ausnahme von YFP anstelle des GFP - Sequenz. Kassettengrößen: GFP-NAT1, 3,7 kbp; mCherry- NAT1, 3,2 kbp; YFP- NAT1, 3.7 kbp. Diese Zahl wurde von Gerami-Nejad modifiziert, et al. 4 Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Protokoll
1. Isolieren Sie Template Plasmide aus E. coli
- Wachsen E. coli das Templat - Plasmid bei über Nacht in 10 ml LB-Medium (LB) + 200 mg / L Ampicillin (AMP) 37 ° C enthält , unter Schütteln.
- Ernten Sie die Zellen durch bei 6.000 × g für 2 min zentrifugiert.
- Dekantieren Flüssigkeit, Isolierung und Reinigung von DNA aus E. Zellen durch ein Standardverfahren coli wie zuvor beschrieben in Ausubel et al. 8.
- Resuspendieren DNA in Tris-EDTA (TE; 10 mM Tris, pH 8,0, 1 mM EDTA, pH 8,0) bei einer Arbeitskonzentration von 50-100 ng / ml.
2. Entwurf Grundierungen
| Grundierung | Primer - Sequenz |
| F1 | 5 ' GAGAATTGAAGAAGAGTTGGGAGACAATGCTATCTATGCTGGTAAGGACTTCCACAATGCTCAAACTTTG GGTGGTTCTAAAGGTGAAGAATTATT 3 ' |
| R1 | 5 'GAGCGTTTGCACCAACAGGCCATCATTTGTGACGAGAGAAGACCTGACGTCATTAGATTGGCACCTTTGC GTAAAACGACGGCCAGTGAATTC 3 ' |
| F2 | 5 'GAGAATTGAAGAAGAGTTGGGAGACAATGCTATCTATGCTGGTAAGGACTTCCACAATGCTCAAACTTTG GGTGGTGTTTCAAAAGGTGAAGAAGATAAT 3 ' |
| R2 | 5 'GAGCGTTTGCACCAACAGGCCATCATTTGTGACGAGAGAAGACCTGACGTCATTAGATTGGCACCTTTGC ACTGGATGGCGGCGTTAGTATC 3 ' |
Tabelle 1: Primersequenzen in dieser Studie verwendet. Fett Kursiv Text zeigt Homologie zu dem ENO1 genomischen Locus, normale Schrift Regionen sind homologe DNA - Plasmid.
- Konstruktions Primer homolog zu Sequenzen , die Kassette zu Plasmid angrenzenden und amplifiziert werden , wie an das 3'-Ende des Zielgens von Interesse (zB ENO1) Rekombination in das Gen der genomischen Locus (Abbildung 2 und Tabelle 1) zu erleichtern , .
- Sicherzustellen, dass der Vorwärtsprimer Sequenzen, die die letzten 70 Basenpaaren (bp) des Gens von Interesse entsprechen, 5'-3 ', minus das Stoppcodon, die codierende Rahmen zu halten, plus die ersten etwa 30 bp des Plasmids Sequenz sein amplifiziert. Als Hinweis ist die GGTGGTGGTT in jedem Primer ein Poly-Glycin-Linker ohne FP Homologie. Bemerkenswert ist, in Abwesenheit eines Linkers kann es direkte Fusion von funktionellen Domänen sein, die theoretisch auf falsch gefaltete Proteine, geringe Ausbeute bei der Proteinproduktion oder beeinträchtigte Bioaktivität führen kann.
- Stellen Sie sicher, dass die Reverse-Primer-Sequenzen 70 bp direkt stromabwärts von Gen sind, 3'- 5 'einschließlich, keine Gen-Sequenz sowie die letzte approximately 30 bp des Ernährungs oder Arzneimittelresistenzmarker in dem Plasmid verwendet.
- Mit F1 und R1 GFP- NAT1 und YFP- NAT1 Kassetten mit pMG2120 und pMG2263 jeweils und F2 und R2 zu erzeugen mCherry- NAT1 mit pMG2343 zu erzeugen.
3. Generieren FP Cassetten durch PCR (Tag 1)
- Bereiten Sie Reagenzien für die PCR. Machen Sie einen Master-Mix (500 & mgr; l Endvolumen), indem die folgenden Mengen und Konzentrationen in ein 1,5-ml-Röhrchen: 50 & mgr; l PCR-Puffer (500 mM Kaliumchlorid, 100 mM Tris pH 8,0 in Wasser), 20 & mgr; l Desoxynukleotide (dNTPs; Stammischung von Nukleotiden bei jeweils 10 mM), 40 & mgr; l 25 mM Magnesiumchlorid, 20 ul Plasmid gereinigt (aus ~ 50-100 ng / ul Stammlösung), 10 & mgr; l jeder Vorwärts- und Rückwärts-Primer (von 10 mM Stammlösungen), 30 & mgr; l Taq Polymerase (generic, 5.000 Einheiten / ml) und 320 & mgr; l Wasser.
- Aliquot 50 ul Master-Mix in jeder von 10 PCR-Kompatible 0,5-ml-Röhrchen.
- Platzieren Sie PCR-Röhrchen in Thermocycler und führen Sie die folgenden Schritte aus: 1 Zyklus von 5 min bei 94 ° C dsDNA zu denaturieren; 40 Zyklen sequentiell von 45 sec bei 94 ° C, 30 sec bei 55 ° C Primer zu ermöglichen, um das Plasmid-Matrizen-DNA zu tempern, und 4 min bei 68 ° C für die Verlängerung der DNA-Produkte; und 1 endgültige Verlängerungszyklus von 15 min bei 72 ° C.
HINWEIS: Der PCR-Mastermix und Zyklusparameter müssen verwendet bezogen auf die Taq-Polymerase modifiziert werden. - Pool Alle Produkte der 10 PCR-Reaktionen in einem 1,5-ml-Röhrchen.
- Gegenstand 5 ul gepoolten PCR-Produkt einer Agarose-Gelelektrophorese Amplicongröße zu verifizieren und eine Schätzung der Produktkonzentration zu erhalten, basierend auf einem Vergleich mit einer DNA-Leiter. Im Allgemeinen verwenden ~ 250 ug Kassette DNA in jeder nachfolgenden Transformationsmischung.
- Ausfällen DNA durch Zugabe von 50 & mgr; l 3 M Natriumacetat von 750 & mgr; l 95% Ethanol zu den Produkten gefolgt und Inkubation mindestens 30 minbei -20 ° C
- Ernte der PCR-Produkte durch das Röhrchen bei 16.000 xg für 10 min zentrifugiert. Entfernen Sie vorsichtig und über Nacht den Überstand und trocknen Sie das Pellet verwerfen. Resuspendieren der getrockneten DNA-Kassette Pellet in 40 ul TE pH 8,0 und bei Raumtemperatur lagern bis zur Verwendung.
4. Transformations Candida - Zellen mit FP - DNA - Kassetten
- Am Tag 1 Hefestamm zu erholen von einer 15% Glycerin (-80 ° C) Lager durch Ausstreichen ein paar geschabt Kristalle auf Hefe-Pepton Dextrose mit Adenin (YPAD) Agar gefroren umgewandelt werden und bei 30 ° C inkubiert. Nach der Wiederherstellung des Koloniewachstums, eine einzige Kolonie in 2 ml Flüssigkeit YPAD Medium in einem Glaskulturröhrchen mit einem atmungsfähigen Kappe impfen und über Nacht bei 30 ° C unter Rühren inkubiert.
- Am Tag 2 verdünnt 300 & mgr; l über Nacht Hefekultur in 50 ml frisch YPAD (bis zu einer endgültigen OD 600 von ~ 0,2) in einem 125 ml Erlenmeyerkolben mit einem atmungsfähigen Kappe. Schütteln bei 30 ° Cfür ~ 3 h (auf eine endgültige OD 600 ~ 0,6-0,8).
- Gießen Die Übernachtkultur in ein 50 ml konisches Röhrchen und die Zellen pelletieren, indem sie in einer Tischzentrifuge bei 1 500 x g für 5 min dreht.
- Abgießen und ordnungsgemäß den Überstand verwerfen. Zellpellet in 5 ml Wasser. Wiederpelletieren Sie die Zellen durch Zentrifugieren erneut 5 min bei 1500 xg in einer Tischzentrifuge.
- Abgießen und ordnungsgemäß den Überstand verwerfen. Resuspendieren der Zellen in 500 & mgr; l TELiAc (TE Lithiumacetat: 10 mM Tris, pH 8,0, 1 mM EDTA, pH 8,0, 0,1 M Lithiumacetat), während in ein 1,5-ml-Röhrchen übertragen. Zentrifugieren Sie die Röhrchen für 2 min bei 3000 × g in einer Mikro.
- Die Zellen in 250 ul TELiAc. Das Gesamtvolumen einschließlich sollte das Pellet ~ 300 & mgr; l sein.
- Zu einer sauberen (unterschiedliche Mikrozentrifugenröhrchen als in 4.2.4), werden 5 ul Träger - DNA (10 mg / ml) und 150 & mgr; l hergestellt , Candida - Zellen (aus 4.2.4). Dies ist die negative Kontrolle für transformation.
- Auf eine zweite saubere Mikrozentrifugenröhrchen, werden 5 & mgr; l denaturierter Träger-DNA (dh bei 90 ° C für 10 min gekocht wurde, kühlt auf 4 ° C), alle 40 & mgr; l des hergestellten PCR-Produktes (von 3.3.1) und 150 ul vorbereitet Candida - Zellen (von 4.2.4).
- Inkubieren der beiden Transformationsmischungen für 30 min bei Raumtemperatur.
- Zu jedem Röhrchen Transformationsmischung, fügen 700 ul PLATE-Mix (10 mM Tris, pH 8,0, 1 mM EDTA, pH 8,0, 0,1 M Lithiumacetat in 50% Polyethylenglycol 3350). Drehen Sie die Rohre zu mischen und Inkubation über Nacht bei RT.
- Am Tag 3, brüten die Transformation bei 42 ° C mischt für 1 Stunde (Hitzeschock).
- die Transformation Zentrifuge mischt für 30 sec bei 16.000 xg in einer Mikrozentrifuge. Entfernen und ordnungsgemäß den Überstand verwerfen. Resuspendieren jeder der Zellpellets in 150 & mgr; l Wasser durch vorsichtiges Auf-und Abpipettieren, um Zellen nicht zu beschädigen.
- Für Transformationen utdurch Pipettieren der Lösungen auf den geeigneten selektiven Medien Agar (zB ohne Uridin) und verteilen Sie die Mischung gleichmäßig mit sterilen Glasperlen ilizing auxotrophen Markergene (zB URA3), die jeweils gesamte Mischung plattieren.
- Für Transformationen des Nourseothricin - Resistenz - Markergen (NAT1) verwendet wird , wie hier beschrieben, mischt Platte Transformation zuerst auf nicht-selektiven YPAD Agar und Inkubation bei 30 ° C für 6-12 h. Dieser Schritt hilft bei der Zellgewinnung, Post Hitzeschock, vor Stress Nourseothricin angewendet wird.
- Nach der teilweisen Erholung des Wachstums, die Candida - Zellen auf YPAD Replika - Platte , die 400 ug / ml Nourseothricin. Für Transformationen verwendet Nahrungsmarkergene (zB URA3), dieser Zwischenbeschichtungsschritt ist nicht erforderlich , und die Zellen können direkt auf selektive Medien ausplattiert Hefe (zB YPAD ohne Uridin) , wie in 4.4.2 beschrieben.
HINWEIS: Wenn die Umwandlung erfolgreich ist, colOnies sollte innerhalb von ein bis drei Tagen (zur Auswahl potentiell bis zu fünf Tagen nach Auswuchs auf Nourseothricin enthaltenden Agar) erscheinen. Keine Kolonien sollten mit Transformation haltige Mischungen Träger-DNA allein (Negativkontrolle) verteilt auf Platten erscheinen.
- Für auxotroph und Nourseothricin Marker Auswahl, Streifen mutmaßliche Trans als einzelne Kolonien auf frische selektive Medien-Agar-Platten und bei 30 ° C inkubieren, um Hefezellen propagieren, die für eine erfolgreiche Aufbau von FP-Fusionen gescreent werden können.
- Screen - Trans für die korrekte Integration der Tagging - Kassette (siehe Repräsentative Ergebnisse für ein detailliertes Beispiel). Wenn das Gen von Interesse in ausreichenden Mengen exprimiert wird, ganze Kolonie Fluoreszenz so auftreten, dass es möglich ist, den potenziellen Kandidaten Integranten unter Verwendung eines Plattenabbildungssystem mit Fluoreszenzdetektion Fähigkeit zu erkennen.
- Überprüfen Sie mutmaßliche Integranten durch PCR-Primer homolog zu Sequenzen unter Verwendung von outside der Integrationsbereich Fusion an das Zielgen zu bestätigen.
- Darüber hinaus betrachten Western Blot-Analyse der Expression und Größe des Fusionsproteins, sowie durch Fluoreszenzmikroskopie von Einzelzellen für eine visuelle Bestätigung der Proteinlokalisierung, falls bekannt zu bestimmen.
Ergebnisse
Als Beispiel haben wir dem oben beschriebenen Protokoll GFP und mCherry Fusionen zu konstruieren , in einem C. parapsilosis Laborstamm zu ENO1. Jeder mutmaßliche Trans wurde ursprünglich für das Wachstum erneut ausgestrichen. In diesem Beispiel wird , da das resultierende Fusionsprotein stark exprimiert (Enolase) und die FPs sind hell, wir in der Lage waren Trans durch Fluoreszenzmikroskopie zur Durchführung von diagnostischen PCR vor dem Bildschirm (Abbildung 3)
Diskussion
Konstruktion von Epitop - markierten Sequenzen in Candida Spezies die PCR-vermittelte Gen - Modifikationsstrategie oben beschrieben verwendet , kann als ein dreistufiges Verfahren zusammengefaßt werden. Zunächst wird eine Kassette durch PCR hergestellt, die die Sequenz homolog zur Integration und Regionen gewünschten codiert sowohl auf den Ort des Einfügens in das Hefegenom. Zweitens werden die Hefezellen transformiert werden, mit der Kassette chemisch kompetente mit Lithiumacetat und co-inkubiert hergestel...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Wir danken N. Dean für die ursprüngliche mCherry FP-Sequenz bietet, M. Gerami-Nejad für den Bau von Plasmiden, B. Larson für die technische Unterstützung und T. Heisel für hilfreiche Ratschläge bei der Entwicklung dieses Projektes. JB wurde vom European Research Council Erweiterte Auszeichnung 340.087 (RAPLODAPT) unterstützt. Mikroskopie und Imaging-Systeme wurden von der University of Minnesota Pediatrics Foundation und der University of Minnesota Imaging Center zur Verfügung gestellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 100W mercury lamp | CHIU Technical Corporation | M-100T | |
| 95% Ethanol | Any | NA | |
| Adenine | Any | NA | |
| Ampicillin | Any | NA | |
| Carrier DNA | Ambion | AM9680 | Sheared Salmon Sperm DNA 10 mg/ml |
| CCD Camera | Photometrics | CoolSNAP HQ | |
| Conical Tube | Corning | 430828 | 50ml |
| Culture Tube Rotator | New Brunswick | 2013923 | TC-8, or Any Culture Tube Rotator |
| Deoxynucleotides (dNTP) PCR Grade | Any | NA | |
| Eppendorf Tubes | Eppendorf | 022363719, 022363212 | 0.5ml, 1.5ml |
| Erlenmeyer Flask | Fisher Scientific | 7250089 | 125ml |
| Ethylenediaminetetraacetic Acid (EDTA) | Any | NA | |
| Freezer (-80 °C ) | Thermo Electron Corporation | ULT-1386-9-V | Revco Ultima II |
| GFP, YFP and Texas Red Filter Sets | Chroma Technology Corporation | 49002, 86004v2, 49008 | |
| Glass culture tubes | Fisher Scientific | 1496126 | 75mm |
| HRP goat anti-mouse antibody | Santa Cruz Biotechnology | SC-2005 | |
| HRP goat anti-rabbit antibody | Santa Cruz Biotechnology | SC-2301 | |
| Incubator (30 °C ) | Any | NA | |
| Lithium Acetate | Any | NA | |
| Lysogeny Broth (LB) Media | Any | NA | |
| Magnesium Chloride | Any | NA | |
| Microcentrifuge | Eppendorf | 5415 D | |
| Microscope | Nikon | E600 | Nikon Eclipse E600 |
| Microscope Image Analysis Software | Universal Imaging Corporation | 6.3r7 | MetaMorph Software Series 6.3r7 |
| Mouse anti-GFP antibody | Roche | 11814460001 | |
| Nourseothricin | Fisher Scientific | 50997939 | |
| PCR Thermocycler | Applied Biosystems | 9700 | GeneAmp PCR System |
| PCR tubes | BioExpress, GeneMate | T-3035-1 | 0.2ml |
| Polyethylene Glycol 3350 | Any | NA | |
| Potassium Chloride | Any | NA | |
| Rabbit anti-mCherry antibody | BioVision | 5993-100 | |
| Refrigerator (4°C) | Any | NA | |
| Sodium Acetate | Any | NA | |
| Stereomicroscope | Nikon | SMZ1500 | |
| Table Top Centrifuge | Labnet | Z 400 | Hermle Z 400 |
| Taq DNA Polymerase | Any | NA | |
| Tris(hydroxymethyl)aminomethane (Tris) | Any | NA | |
| Vortex Mixer | Scientific Industries | SI-0236 | Vortex Genie 2 |
| Yeast Extract Peptone Dextrose (YPD) Media | Any | NA |
Referenzen
- Bendel, C. M. Colonization and epithelial adhesion in the pathogenesis of neonatal candidiasis. Semin. Perinatol. 27 (5), 357-364 (2003).
- Gerami-Nejad, M., Berman, J., Gale, C. A. Cassettes for PCR-mediated construction of green, yellow, and cyan fluorescent protein fusions in Candida albicans. Yeast. 18 (9), 859-864 (2001).
- Gerami-Nejad, M., Dulmage, K., Berman, J. Additional cassettes for epitope and fluorescent fusion proteins in Candida albicans. Yeast. 26 (7), 399-406 (2009).
- Gerami-Nejad, M., Forche, A., McClellan, M., Berman, J. Analysis of protein function in clinical C. albicans isolates. Yeast. 29 (8), 303-309 (2012).
- Gerami-Nejad, M., Hausauer, D., McClellan, M., Berman, J., Gale, C. Cassettes for the PCR-mediated construction of regulatable alleles in Candida albicans. Yeast. 21 (5), 429-436 (2004).
- Gonia, S., Larson, B., Gale, C. A. PCR-mediated gene modification strategy for construction of fluorescent protein fusions in Candida parapsilosis. Yeast. 33 (2), 63-69 (2016).
- Milne, S. W., Cheetham, J., Lloyd, D., Aves, S., Bates, S. Cassettes for PCR- mediated gene tagging in Candida albicans utilizing nourseothricin resistance. Yeast. 28 (12), 833-841 (2011).
- Ausubel, F. M., et al. . Current Protocols in Molecular Biology. , (1995).
- Wilson, R. B., Davis, D., Mitchell, A. P. Rapid hypothesis testing with Candida albicans through gene disruption with short homology regions. J. Bacteriol. 181 (6), 1868-1874 (1999).
- Pulver, R., et al. Rsr1 focuses Cdc42 activity at hyphal tips and promotes maintenance of hyphal development in Candida albicans. Eukaryotic Cell. 12 (4), 482-495 (2013).
- Falgier, C., et al. Candida species differ in their interactions with immature human gastrointestinal epithelial cells. Pediatr. Res. 69 (5), 384-389 (2011).
- Nosek, J., et al. Genetic manipulation of the pathogenic yeast Candida parapsilosis. Curr. Genet. 42 (1), 27-35 (2002).
- Zemanova, J., Nosek, J., Tomaska, L. High-efficiency transformation of the pathogenic yeast Candida parapsilosis. Curr. Genet. 45 (3), 183-186 (2004).
- Benjamin, D. K., et al. Neonatal candidiasis among extremely low birth weight infants: risk factors, mortality rates, and neurodevelopmental outcomes at 18 to 22 months. Pediatrics. 117 (1), 84-92 (2006).
- Kullberg, B. J., Arendrup, M. C. Invasive Candidiasis. N Engl J Med. 373 (15), 1445-1456 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten