È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Iniezione idrodinamica pelvi renale per Non virali espressione delle proteine nel rene
In questo articolo
Riepilogo
Questo protocollo descrive un metodo per iniettare DNA plasmidico in rene del mouse tramite la pelvi renale per produrre l'espressione del transgene in particolare nel rene.
Abstract
Iniezione idrodinamica crea un ambiente locale, ad alta pressione di transfect vari tessuti con il DNA del plasmide ed altre sostanze. Iniezione della vena della coda idrodinamica, ad esempio, è un metodo ben stabilito che il fegato può essere transfected. Questo manoscritto descrive un'applicazione di principi idrodinamici per iniezione del rene del mouse direttamente con il DNA del plasmide per l'espressione genica del rene-specifica. Topi sono anestetizzati e rene è esposto da un'incisione del fianco seguita da una rapida iniezione di una soluzione contenente DNA plasmidico direttamente nella pelvi renale. L'ago è mantenuto sul posto per dieci secondi e il sito di incisione viene suturato. Il giorno seguente, immagini animali dal vivo, Western blot, o immunohistochemistry può essere usato per analisi di espressione genica o altri dosaggi adatti per il transgene di scelta vengono utilizzati per il rilevamento della proteina di interesse. Metodi pubblicati per prolungare l'espressione genica comprendono trattamento di integrazione e ciclofosfamide transgene transposon-mediata per inibire la risposta immunitaria per il transgene.
Introduzione
La tecnica di iniezione della vena della coda idrodinamica è diventato un modo comunemente usato per raggiungere elevati livelli di espressione genica nei mouse del fegato1,2. I reni sono anche trasfettati con questa tecnica ad un livello più basso, circa 100 volte meno3. L'iniezione idrodinamica pelvi renale descritto qui fornisce un modo semplice per controllare la specificità di espressione organo attraverso mezzi fisici utilizzando gli stessi principi idrodinamici che sono stati stabiliti in precedenza nel fegato4,5 , muscolo6e altri organi7,8. Questo metodo transfects cellule in animali vivi in vivo mediante pressione e velocità per forzare il fluido contenente DNA nelle cellule, allo stesso tempo inducendo danni all'organo che è rapidamente risolto9. Usando le tecniche chirurgiche consolidate per visualizzare il rene attraverso un' incisione di fianco10 insieme con una singola iniezione con una siringa di insulina, abbiamo trovato successo transfezione di vari tipi di cellule renali, principalmente interstiziale fibroblasti, tubuli e raccolta del condotto11. Dissezione di questi topi ha dimostrato che altri organi non transfected a livelli abbastanza in alto per visualizzare di luciferasi11di tecniche di imaging. Poiché la tecnica è non-virale, uso del DNA del plasmide per la transfezione permette facile e veloce preparazione dei reagenti necessari per l'iniezione.
Abbiamo usato iniezioni localizzate di idrodinamiche per esprimere l'antiossidante glutatione S-transferasi A4, il recettore del fattore di crescita 1 insulino-simile e l'eritropoietina dell'ormone nel rene, tutte dotate di effetti biologici previsti11, 12 , 13. valutazione dettagliata della via di somministrazione, volume di iniezione, dosaggio di DNA e la scelta del promotore è stata effettuata11. Inoltre, entrambi i piggyBac trasposone sistema trattamento e/o ciclofosfamide per sopprimere la reazione immunitaria per il transgene hanno dimostrato di migliorare i risultati a lungo termine espressione di gene11. Altri ricercatori hanno utilizzato un approccio della vena renale nel ratto con successo, raggiungere la transfezione alta efficienza per periodi di tempo superiori a un mese14. Tuttavia, correzione genetica dei fenotipi che imita la malattia umana vengono solitamente eseguiti in topi prima come un proof-of-concept poiché modelli genetici più mammiferi sono modelli murini. Abbiamo confrontato ad iniezione della vena renale alla pelvi renale iniezione e trovato che iniezione nella pelvi renale era superiore alla vena renale per l'espressione genica (circa dieci volte superiore) e sopravvivenza11. La pelvi renale è un percorso ideale di entrata nel rene, perché è abbastanza flessibile da tollerare fluttuazioni della produzione di urina e spesso è in grado di mantenere la sua integrità strutturale anche quando dilatato durante idronefrosi. Inoltre, iniezione nella pelvi renale consentito l'accesso al rene senza perforare la capsula del rene, permettendo il visibilmente trattenuto dal rene meglio di intraparenchymal iniezione del fluido iniettato. Altri organi del mouse non si dispone di un percorso di ingresso diverso da quello del sistema vascolare, ma lo spazio urinario del rene è un sito di iniezione ideale. Inoltre, iniezione nella vena renale ha provocato perdite di sangue nella cavità addominale. Il volume totale del rene dei reni di selvaggio-tipo di mouse è stato stimato dalla risonanza magnetica per essere circa 0,2 cm3, quindi il volume di un singolo rene è approssimativamente uguale alla quantità di liquido iniettato dal bacino renale idrodinamico iniezione (100 µ l)15. Qui, abbiamo messo a disposizione tutte le sfumature dettagliate del protocollo iniezione idrodinamica pelvi renale per raggiungere transfezione riproducibile del rene.
Protocollo
Tutti i metodi descritti qui sono stati approvati dalle commissioni di utilizzo (IACUCs) del Baylor College of Medicine e Vanderbilt University Medical Center e istituzionali Animal Care.
1. preparare la soluzione di DNA per l'iniezione
- Selezionare il plasmid(s) per esprimere la transgene(s) attentamente per massimizzare le caratteristiche desiderabili per migliorare l'efficienza di trasfezione e l'espressione del transgene.
Nota: Iniezione idrodinamica pelvi renale di plasmidi per esprimere il marcatore fluorescente TdTomato, l'eritropoietina (Epo) di ormone e luciferasi firefly sono stati descritti in precedenza11. Se non esiste un'analisi ben sviluppato per l'efficienza di trasfezione per il transgene, eseguire dal vivo animale formazione immagine della luciferasi introducendo 10 µ g di plasmide luciferasi-esprimendo come la luciferasi di lucciola avanzata al DNA diluito per iniezione.- Scegliere il plasmide più piccolo che è pratico per l'applicazione.
Nota: Piccoli plasmidi transfect generalmente meglio di plasmidi grandi cellule. Ad esempio, il gene di resistenza zeomycin e R6K origine di replicazione sono piccole, in modo utilizzando questi elementi nel backbone plasmide farà diminuire la dimensione del plasmide. - Esprimono il transgene da un promotore dei mammiferi.
Nota: Il tipo di cellula del rene trasfettato, lunghezza dell'espressione genica e la forza dell'espressione genica tutto risente la scelta del promotore. Vedere Woodard et al. per un confronto del citomegalovirus (CMV; costitutiva virale), alfa di fattore 1 di allungamento (EF-1 α; costitutiva endogeno), gamma-glutamil transferasi (γGT; tubulo-specifiche) e podocina (NPHS2; Podocita specifici)11. - Impiegare un sistema di integrazione non virali come trasposoni se più elevati livelli di espressione genica a lungo termine sono desiderabili11,16. Per gli studi con le prime letture meno di post-iniezione di 5 giorni, integrazione del transgene è inutile.
- Scegliere il plasmide più piccolo che è pratico per l'applicazione.
- Preparare il DNA del plasmide per iniezione utilizzando un metodo commerciale come un kit maxiprep privo di endotossina. Evitare accuratamente l'introduzione di endotossine via labware.
Nota: Presenza di endotossine nella soluzione di DNA di suscitare una risposta immunitaria grave nell'animale oggetto, compromettere l'esperimento e possibilmente uccidendo l'animale.- Dopo l'ultimo passaggio di lavaggio di isolamento del DNA è completo, assicurarsi che nessun etanolo è lasciato da odore e ispezione visiva. Utilizzare gel-caricamento suggerimenti per rimuovere gocce visibile. Asciugare le provette contenenti il pellet di DNA upside-down sui tessuti di tergicristallo di delicato compito di laboratorio a temperatura ambiente o in un forno di 37-60 ° C con un monitoraggio costante. Risospendere il pellet immediatamente dopo residua etanolo evaporato per evitare che cuocia del pellet.
Nota: Residuo etanolo interferisce con la lettura di spettrofotometro della concentrazione del DNA e introduzione al rene non è auspicabile. - Risospendere il pellet di DNA nello stesso buffer come verrà utilizzato per l'iniezione (consegna idrodinamico buffer; 100-300 µ l) per limitare la variazione nella composizione chimica della soluzione tampone del DNA fra i gruppi.
Nota: Non risospendere il pellet di DNA in una soluzione di tampone di eluizione che viene fornito con il kit. L'agente chelante EDTA si trovano comunemente nelle preparazioni di buffer "TE" potrebbe influire sulla funzione cardiovascolare e renale. A seconda del formato della pallina, eluire in 100-300 µ l di tampone di consegna idrodinamico per raggiungere un'elevata concentrazione. La concentrazione finale del DNA completamente diluita sarà tra 100 ng / µ l (dose 10 µ g/mouse) e 500 ng / µ l (dose 50 µ g/mouse) così la concentrazione di DNA stock dovrebbe superare questo livello. - Completamente e risospendere il pellet di DNA nel buffer. Lasciare il pellet nel buffer di idrodinamica consegna nel tubo originale a temperatura ambiente per almeno un'ora o una notte a 4 ° C prima di trasferire in una provetta sterile microfuge per garantire che il DNA è completamente sciolto.
- Leggere la concentrazione di DNA del plasmide su uno spettrofotometro o un altro metodo stabilito.
Nota: Letture devono essere redatta in duplice copia con ulteriori ripetizioni se necessario. Se il rapporto di 260/280 è inferiore a 1,8, la preparazione è contaminata con RNA o un'altra sostanza così scartare e preparare il DNA di nuovo. - Archivio plasmide DNA risospeso in tampone di iniezione a-20 ° C all'interno di una casella in un manuale di sbrinare il congelatore per evitare la degradazione del DNA.
Nota: Memorizzate in questo modo, la preparazione di DNA durerà per molti anni. Verificare l'integrità del DNA tramite l'elettroforesi del gel del digest e agarosio restrizione. DNA che viene spalmato lungo la corsia ha degradato e non può essere utilizzato mentre il DNA che produce nitide bande di dimensioni corrette può essere usato per l'iniezione.
- Dopo l'ultimo passaggio di lavaggio di isolamento del DNA è completo, assicurarsi che nessun etanolo è lasciato da odore e ispezione visiva. Utilizzare gel-caricamento suggerimenti per rimuovere gocce visibile. Asciugare le provette contenenti il pellet di DNA upside-down sui tessuti di tergicristallo di delicato compito di laboratorio a temperatura ambiente o in un forno di 37-60 ° C con un monitoraggio costante. Risospendere il pellet immediatamente dopo residua etanolo evaporato per evitare che cuocia del pellet.
- Preparare la soluzione di DNA plasmidico diluito per iniezione nella pelvi renale.
Nota: Si consideri controllo gruppi attentamente. Per molti studi, ingenuo e buffer solo iniettato controlli sono inclusi perché l'iniezione stessa provoca danni e può interessare il risultato sperimentale11.- Sbrinare il DNA privo di endotossina eluito nel buffer di idrodinamica consegna a temperatura ambiente in panchina.
- Calcolare la quantità di DNA necessaria per le iniezioni e preparare il DNA diluito per ogni gruppo. Amministrare il 10-50 µ g di plasmide DNA ha portato ad un volume totale di 100 µ l con buffer di consegna idrodinamico per topo.
Nota: Per un esempio, i calcoli per iniettare 3 topi con 10 µ g/mouse di un plasmide DNA che ha una concentrazione di 0,5 µ g / µ l sono come segue.- Preparare soluzione abbastanza DNA di avere circa il 20% extra per caricare le siringhe e dead space nell'ago. Per 3 topi, preparare un mix a 3.5 x. Calcolare la massa del DNA in µ g che dovrebbe essere nella soluzione. Qui sarebbe stato 10 µ g x 3.5 = 35 µ g.
- Calcolare il volume totale della soluzione desiderata per via parenterale 100 µ l per topo. In questo caso, sarebbe 100 µ l x 3.5 = 350 µ l di volume totale.
- Calcolare il volume d'archivio del DNA del plasmide per aggiungere alla soluzione. In questo caso, sarebbe 35 µ g / 0,5 µ g / µ l = 70 µ l di DNA plasmidico stock.
- Calcolare il volume del buffer da aggiungere alla soluzione di DNA diluita sottraendo il volume delle scorte DNA aggiunto (passo 1.3.2.3) dal volume totale del DNA diluito che è desiderato (passo 1.3.2.2). In questo caso, sarebbe 350 µ l - 70 µ l = 280 µ l di tampone di consegna idrodinamico.
- Preparare soluzioni in tubi sterili microfuge utilizzando puntali filtro disponibile in commercio con tecnica sterile sul banco di laboratorio.
Nota: Soluzioni di DNA possono essere preparati e conservati a temperatura ambiente per iniezioni impostata per quel giorno. Non iniettare topi con una soluzione fredda come questo abbasserà la loro temperatura corporea, ma il riscaldamento è inutile.
2. eseguire l'intervento di iniezione idrodinamica pelvi renale
- Selezionare il mouse con attenzione per la chirurgia.
Nota: Differenze di ceppo-specifici non sono ancora state osservate ma potrebbero essere possibile. La maggior parte delle iniezioni sono state sul C57BL/6 o sfondi FVB. Pelvi renale iniezioni funzionano meglio in topi che sono vecchi di 6-12 settimane. In topi maggiori di 16 settimane, fino ad un tasso di fallimento del 50% di luciferasi imaging è possibile per motivi non chiari. Lo stesso tasso di guasto relativo all'età è stato osservato per le iniezioni di vena di coda idrodinamica al fegato quindi questo potrebbe essere una limitazione generale relative al principio di iniezione idrodinamica. Lungo le stesse linee, altri hanno mostrato che iniezione della vena della coda idrodinamica in fegato fibrotico del ratto non è efficace come fegato sano, quindi potrebbe essere possibile che nelle impostazioni di fibrosi renale l'iniezione idrodinamica del bacino renale non sarà altrettanto efficace, ma Questo non è stato testato direttamente17. - Preparare i topi e siringhe di DNA per la chirurgia.
- Anestetizzare i topi con ketamina e xilazina.
- Mettere sull'apparecchiatura protettiva personale corretto richiesto dall'impianto animale come grembiule monouso laboratorio, mascherina chirurgica e guanti in nitrile.
- Lavorando con i topi di 2-4 in una sola volta, pesare ogni mouse in un becher da 500 mL in plastica su una scala che è una precisa di 0,1 g. calcolare la corretta quantità di xilazina di ketamina e 2 mg/mL di 24 mg/mL diluito in fisiologica 0,9% per amministrare a ogni mouse tramite l'iniezione intraperitoneale (Vedi video di riferimento per ulteriori informazioni su iniezione intraperitoneale) 18. utilizzare la formula (50 µ l + ((5 µL) x (peso (g))), o in alternativa calcolare secondo una formula dopo consultazione con il veterinario locale team e IACUC.
- Iniettare il mouse tramite l'iniezione intraperitoneale di tecniche standard. Posizionare il mouse in un secchio di carta fino a quando il mouse è immobile.
Nota: Topi sono pronti per la chirurgia quando non più rispondere alla prova di punta-pizzico. Dare topi che continuano a rispondere alle punta-pizzico di prova 20-30 min dopo l'iniezione iniziale 20-60 µ l più anestetico, a seconda della forza della risposta. - Posto il mouse su una piastra di calore acqua-diffuso coperto con un pad blu e posto veterinario unguento in entrambi gli occhi per evitare disidratazione corneale.
- Il lato sinistro della parte posteriore del mouse da spalla a fianco alla spina dorsale e groppa la barba con un rasoio progettato per governare dell'animale domestico. Rimuovere i detriti e i capelli sciolti.
- Preparare una siringa separata contenente 100 µ l di DNA diluito per ogni mouse anestetizzati, assicurandosi che non ci sono senza bolle d'aria.
- Utilizzare una siringa da insulina 0,5 mL U-100 sterile 29 x ½" con un ago fisso senza una sicurezza.
Nota: Il tipo di siringa è di importanza critica. Questo indicatore consente un veloce iniezione. L'ago fisso impedisce la soluzione di fuoriuscire. Presenza di una sicurezza impedirà l'accesso al bacino renale. Le siringhe specificate nella tabella materiali scivolano più uniformemente durante l'iniezione rispetto ad altri marchi testati. - Caricare la siringa a ~ 120 µ l e tirare lo stantuffo verso il basso per creare uno spazio nella parte superiore. Toccare con una penna fino a quando tutte aria bolle ascesa verso l'alto. Tenendo l'ago alto, attentamente premere lo stantuffo per rimuovere tutta l'aria fino a quando una goccia forma sulla punta dell'ago. Non dovrebbero esserci eventuali bolle visibili presenti, come questi possono causare un'embolia che ucciderà l'animale.
- Terminare premendo lo stantuffo fino a quando c'è 100 µ l nella siringa svuotando la soluzione in eccesso di DNA nel tubo microfuge originale. Attentamente etichetta se necessario e posizionare le siringhe caricate su un telino sterile per mantenere la sterilità se l'impianto in cui viene eseguito lavoro non consente il reincappucciamento degli aghi.
- Utilizzare una siringa da insulina 0,5 mL U-100 sterile 29 x ½" con un ago fisso senza una sicurezza.
- Anestetizzare i topi con ketamina e xilazina.
- Eseguire un intervento chirurgico di iniezione.
- Preparare il sito per la chirurgia. Posizionare un telino sterile sopra il termoforo e strumentario chirurgico sterile vuota sul telo sterile senza toccarli. Prendere il mouse e posizionarlo nel campo visivo. Regolare l'illuminazione per illuminare l'area.
- Togliere i pacchetti di tre 3,15% clorexidina gluconato e 70% alcool isopropilico pelle tamponi antisettici e posto vicino all'animale.
- Cambiare in guanti chirurgici sterili. Lavorando in un inizio di movimento circolare al sito di incisione, tampone l'animale con un nuovo tampone di clorexidina/alcol tre volte.
- Individuare il sito di incisione come mostrato in Figura 1A. Pizzicare la pelle con una pinzetta, usare le forbici per fare un taglio alla pelle strato di circa 1 cm dalla spina dorsale e sotto la gabbia toracica. Una volta che il sito di taglio è di circa 1 cm di lunghezza, fare un sito di taglio simile qui di seguito, nello strato del muscolo.
Nota: Effettuare l'incisione la giusta lunghezza per consentire il rene per venire a malapena attraverso l'incisione e quindi essere conservato in luogo dell'incisione stessa. Troppo piccola un'incisione ed il rene non possono essere esposti; troppo grande e rene continuamente scivola indietro nella cavità addominale. - Individuare il rene.
Nota: Potrebbe essere visibile tra il tessuto adiposo bianco. La milza si trova anche sul lato sinistro dell'animale. Il colore di questi organi possa essere visivamente distinguibile, come la milza è un marrone scuro, mentre il rene è un rosso-arancio scuro. Non è auspicabile per manipolare la milza come può essere facilmente rotto. - Senza toccare il rene, delicatamente esporlo dalla cavità addominale esercitando una pressione costante sull'addome con le dita (Figura 2). Utilizzare una pinzetta chiusa per spingere delicatamente indesiderati organi indietro nell'addome se necessario. Non utilizzare pinze aperte poiché ciò potrebbe danneggiare il rene o altri organi.
- Una volta che il rene è fuori l'addome, dolcemente separati e dall'ambiente circostante grasso quanto basta per visualizzare la pelvi renale, un piccolo punto bianco (Figura 1B). Spingere il grasso in eccesso da un lato, o rimuovere, se necessario. Essere sicuri di non rimuovere la ghiandola surrenale, situata vicino al polo superiore del rene, o la capsula del rene.
- Utilizzando chiuso forcipe a spingere verso il basso sul lato destro del rene, così che la pelvi renale rimane in vista, afferrare la siringa di insulina caricata con la mano destra e tenerlo parallelo al piano di lavoro con l'ago puntato verso la pelvi renale (Figura 2E). Inserire cautamente l'ago nella pelvi renale del rene immobilizzato, come mostrato in Figura 1B.
- Iniettare la soluzione rapidamente entro tre s. Circa un terzo del rene può cancellare e cambiare colore bianco.
Nota: È comune osservare accumulo di liquido nella capsula iniezione seguente del rene così come la formazione di un ematoma. Alcuni danni sono necessario per raggiungere un livello sufficiente di transfezione del DNA per il rilevamento. - Tenere l'ago in posizione per circa 10 s per impedire il riflusso della soluzione. Poi togliere l'ago lentamente ed attentamente. Restituire l'organo alla cavità addominale delicatamente che si estende il sito di incisione e utilizzando chiuso forcipe.
- Lo strato del muscolo dell'animale di sutura con suture assorbibili 5-0, 2-4 nodi indipendenti di immissione.
- Lo strato della pelle dell'animale di sutura con punti di sutura non assorbibile in nylon 5-0 o 6-0, 2-4 nodi indipendenti di immissione.
Nota: Strumenti chirurgici possono essere riutilizzati dopo l'immissione in un bagno di perle sterile e raffreddati.
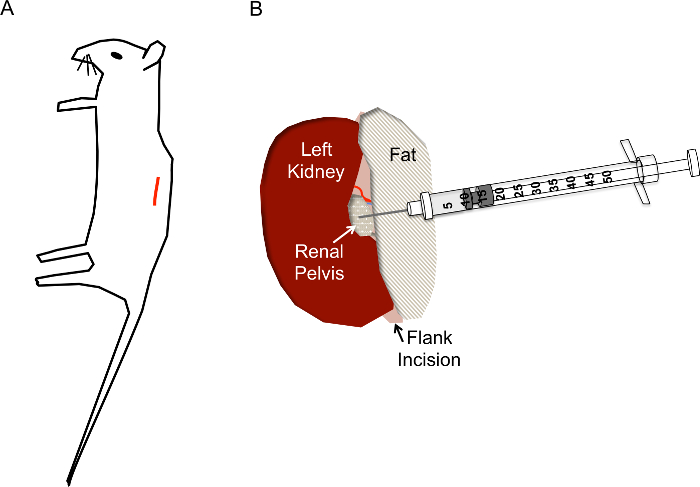
Figura 1. Posizionamento sito e ferri di incisione corretta per iniezioni idrodinamico pelvi renale. A) l'incisione (linea rossa) deve essere situato a circa 1 cm dalla spina dorsale e circa 1 cm sotto la gabbia toracica del mouse. B) dopo il rene viene esposto tramite l'incisione del fianco, pelvi renale dovrebbero trovarsi come a metà un puntino chiaro/bianco giallastro del rene. L'iniezione non deve disturbare la vena renale, arteria renale o dell'uretere. L'ago della siringa dell'insulina viene inserito direttamente nella pelvi renale come mostrato ad una profondità di circa 0,5 cm e rapidamente depresso in s. 2-3 Clicca qui per visualizzare una versione più grande di questa figura.
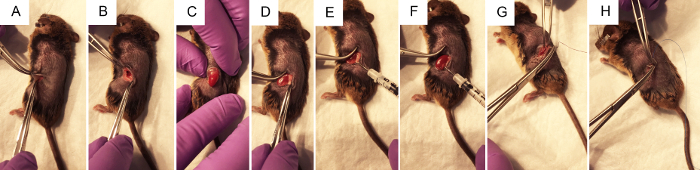
Figura 2. La procedura chirurgica per eseguire l'iniezione idrodinamica pelvi renale di DNA plasmidico. A) forcipe pizzicare la pelle per consentire al chirurgo di fare un'incisione del fianco di ~ 1 cm con un bisturi, in primo luogo attraverso lo strato della pelle, poi attraverso lo strato del muscolo. B) usando due paia di pinze chiuse per aprire la ferita chirurgica, il rene viene visualizzato all'interno dell'addome, se possibile. C) con una leggera pressione sull'addome, senza toccare alcun organi direttamente, il rene viene esposto tramite l'incisione del fianco. D) grasso viene sezionato delicatamente dal rene, disturbare appena possibile ottenere accesso alla pelvi renale. E) premendo sul lato destro del rene di sinistra per meglio visualizzare la pelvi renale, la siringa si tiene il pollice per il depressore e l'ago è attentamente ma saldamente posizionato nella pelvi renale. F) segue il < 3 iniezione di s, di compensazione può essere osservati nelle aree del rene che ha ricevuto la maggior parte dell'iniezione. G) sterile vicryl viola suture assorbibili sono usate per fare 2-4 nodi indipendenti nello strato del muscolo. H) suture non assorbibili in nylon blu sterili sono usate per fare 2-4 nodi indipendenti nello strato. Clicca qui per visualizzare una versione più grande di questa figura.
- Recupero da chirurgia e monitoraggio post-operatorio.
- Fornire topi con analgesici secondo i requisiti dell'ente IACUC per controllo di dolore. Ad esempio, somministrare buprenorfina per via sottocutanea ogni 8-12 h per 48 h postoperatorio se danno renale in relazione con NSAID è da evitarsi per lo studio.
- Tenere i topi a fuoco pad e frequentato dallo sperimentatore fino a quando è completamente mobile con decubito sternale. Quando completamente recuperato, i topi per tornare una gabbia pulita contenente una piccola quantità di biancheria da letto da loro gabbia a casa per ridurre lo stress. Fare non casa topi sottoposti ad intervento chirurgico con topi ingenuo.
Nota: La condizione dei topi migliorerà rapidamente, sembra avere un comportamento normale in 24-48h. - Dare fluidi salini e analgesia aumentata ai topi che appaiono stressati per migliorare la propria condizione. Se i topi non recuperare in fretta, misurare il peso del mouse ed eutanasia topi che hanno perso più del 20% del loro peso corporeo iniziale. Eutanasia topi apparendo uremica o altrimenti moribondo. Possibili problemi di salute sono dettagliati nella tabella 1.
Nota: Topi a volte rimuovere loro suture esterne o le suture allentarsi prima della chiusura della ferita. Povero suturazione dello strato muscolare con uno strato di cute intatta può causare un ernia al sito di incisione, indicato dal rigonfiamento. In tali casi, posizionare il mouse nell'ambito dell'anestesia (isoflurano è più veloce di chetamina/xilazina) e riparare il sito chirurgico con suture nuove appena possibile. Se le suture non assorbibili pelle rimangono dopo 10-14 giorni, è necessario rimuoverli. Occasionalmente topi possono rimuovere le suture dei loro compagni di gabbia o combattere. Rimuovere topi aggressore alla propria gabbia con arricchimento per impedire loro di danneggiare gli altri topi, non appena tale comportamento viene identificato. - Quando vengono raggiunti salute o endpoint sperimentale, eutanasia i topi per inalazione di anidride carbonica o isoflurano sovradosaggio seguita da un metodo secondario dell'eutanasia come dislocazione cervicale secondo la procedura operativa Standard per l'eutanasia in posto presso l'Istituto
| Causa | Inizio | Numero di topi colpiti | Sintomi | Azione immediata | Soluzione a lungo termine | ||
| Endotossine DNA contenuto | 6-40 h post-iniezione. | Suscettibile di incidere ogni mouse data la preparazione di DNA contaminata. | Problemi respiratori, segni di dolore severo, insufficienza d'organo, morte. | I topi affetti di eutanasia. Prova ogni componente iniettato per le endotossine con Limulus metodo lisato. | Utilizzare kit maxiprep privo di endotossina e labware solo sterile e nuove o trattati con NaOH. Utilizzare un buffer acquistato in commercio, endotossina-testato per diluire il DNA. | ||
| Sovradosaggio di anestesia | Durante la chirurgia, prima o dopo l'iniezione di DNA. | Possono interessare solo i topi più giovani, più piccoli o più magri. | Cessare la respirazione durante il rilievo di riscaldamento, minzione. | Diminuire l'anestesia per topi restanti. | Doppio controllo protocollo per precisione di dosaggio e preparazione. Escludere "runts." Se è stata utilizzata la dose appropriata, consultare il veterinario. | ||
| Bolla d'aria nella siringa o ago utilizzato per l'iniezione | Immediatamente dopo l'iniezione di pelvi renale. | A meno che non tutte le siringhe sono stati caricati con noncuranza, questo riguarda solo un mouse. | Senza fiato. | Verifica rimanente siringhe per segni di bolle d'aria. | Preparare con cura, siringhe, toccando la siringa per rimuovere le bolle nella parte inferiore. Migliorare le condizioni di illuminazione per visualizzare meglio le bolle. | ||
| Apertura del sito chirurgico | 12-72 h post-iniezione | Uno o più topi. A volte l'intera gabbia. | Ferita aperta, solitamente nessun altro disagio | Ripetere la sutura per riparare la ferita attentamente sotto anestesia isoflurane con tecnica sterile. Potrebbe essere necessario irrigare con soluzione fisiologica o rimuovere i bordi della ferita con le forbici. | Se tutti i topi hanno suture molto breve o mancante, potrebbe trattarsi di un mouse loro, eliminando così topi possono essere separati. Migliorare la tecnica di suturazione. Utilizzare nodi indipendenti. | ||
| Ernia al sito chirurgico | 48 + h dopo l'iniezione | Uno o più topi. | Tumulo è visibile nel sito chirurgico. | Nell'ambito dell'anestesia di isoflurane con tecnica sterile, tagliare la pelle guarita per rivelare ernia dello strato muscolare. Sostituire gli organi nel peritoneo, riparare strato muscolare con suture assorbibili e chiudere il sito. | Questo indica povero suturazione dello strato muscolare. Migliorare la tecnica di suturazione. Utilizzare nodi indipendenti. | ||
| Insufficienza renale | 48 + h dopo l'iniezione | Uno o più topi. | Perdita di peso di > 20%, eventualmente, di diventare uremica, curvo postura | Fornire la soluzione fisiologica e aumentare o prolungare l'analgesia. Se non si osserva alcun miglioramento, sacrificare i topi colpiti. | Modificare lo stato di malattia dell'animale per renderlo meno grave. Alterare il transgene per essere meno forte o inducibile. Iniettare topi ad un determinato timepoint precedenti in progressione di malattia. | ||
| Ascesso o infezione | Giorni a settimane dopo chirurgia | Uno o più topi. | Abcess palpabile o segni di sepsi | I topi affetti di eutanasia. Richiesta l'autopsia per confermare il sospetto di infezione. | Questo problema può verificarsi quando le condizioni chirurgiche e le iniezioni non sono sufficientemente sterili. La procedura illustrata è per il mouse con un sistema immunitario normale, ma ulteriori precauzioni devono essere prese nella cornice di animali immunocompromessi, come quelli trattati con ciclofosfamide. | ||
Tabella 1. Tabella dei potenziali problemi di salute riscontrati durante il protocollo di iniezione della pelvi renale. Anche se i problemi di salute elencati non sono comuni, ci sono una serie di errori investigatore-correlati che possono verificarsi nel corso della procedura. Questa tabella può essere di aiuto nella prevenzione e nella diagnosi dei problemi di salute, nonché per attuazione di potenziali rimedi per evitare tali problemi in futuro. Con la pratica, gli investigatori dovrebbero aspettare problemi di salute poco frequenti e la mortalità dovuto la procedura.
3. valutare gli effetti di efficienza e transgene di iniezione
- Utilizzare un'analisi ben sviluppato per il transgene desiderata per valutare l'efficienza di trasfezione. Utilizzare controlli positivi e negativi con attenzione per assicurarsi che il test è specifico.
Nota: A seconda della scelta del promotore, topi avrà probabilmente la più forte espressione del transgene il giorno 1; sempre entro la prima settimana dopo l'iniezione. - Eseguire dal vivo animale formazione immagine della luciferasi introducendo 10 µ g di plasmide luciferasi-esprimendo come la luciferasi di lucciola avanzata al DNA diluito per iniezione.
- Pulire tutte le superfici esposte ai topi. Posizionare la gabbia prima di topi nella camera e tenuta chiusa. Garantire non c'è abbastanza isoflurano per l'esperimento controllando il gage; in caso contrario, aggiungere isoflurano, fino a quando il livello raggiunge la linea "max". Avviare il flusso di isoflurane ruotando il quadrante di isoflurano a 3.5 e l'ossigeno a 2.
- Iniettare ogni mouse tramite l'iniezione intraperitoneale con 100 µ l di luciferina scongelati 30 mg/mL. Registrare il tempo.
- Aprire il software per controllare la macchina imaging cliccando sull'icona arancione e giallo del mouse. Sotto "Select/Add User ID," scegliere la sigla corretta dal menu a discesa accanto a "ID utente". Fare clic su "OK". La barra dei menu, scegliere "Acquisizione" e selezionare "Salvataggio automatico di..." dal menu a discesa. Selezionare la cartella o creare una nuova cartella per salvare i dati.
- Vai alla casella di acquisizione immagine in basso a destra. Verificare che le impostazioni automatiche sono come segue: Binning, medio; F/Stop, 1 per 8 luminescenti, per fotografare; Filtro di emissione, aperto; Modalità di imaging, controlla solo accanto a luminescenti, fotografia, Overlay e allineamento. Fare clic su "initialize" per inizializzare il sistema e attendere l'inizializzazione alla fine, poi cambiare il "campo visivo" a "E" all'immagine cinque topi.
- Girare la valvola per l'anestesia della tubazione tale che la Musetti anteriori all'interno della macchina sono amministrando isoflurano. Sistemare gli animali all'interno della macchina imaging nell'ordine desiderato sui loro stomaci con le spalle di fronte alla telecamera sopra per visualizzare il rene. Se più di una gabbia è essere imaged, posizionare la gabbia successiva nella camera di isoflurane.
- 5-10 minuti dopo l'iniezione di luciferina, premere "Acquire" per prendere l'immagine.
- La "tavolozza" sul lato destro, fare clic su "Immagine regola." Sotto "Scala dei colori," diminuire la barra "Min" fino a quando l'espressione è evidente in tutti i topi previsti, visualizzati come viola sopra ogni rene del mouse. Se qualsiasi topi non mostrano espressione, effettua i topi con 100 µ l di luciferina e attendere per almeno 3 minuti prima di riacquisizione.
- Se l'immagine ha saturato pixel, diminuire il tempo di esposizione e riacquisire per ottenere un'immagine quantitativa, come la presenza di pixel saturi si tradurrà in sottovalutando l'efficienza di trasfezione. Il tempo di esposizione possibile più basso è di 0,5 s.
- Se l'immagine mostra solo espressione debole il primo tempo di esposizione, aumentare il tempo di esposizione fino a 2 min e riacquisire. Ogni volta che l'immagine viene ripresa, i dati sono salvata automaticamente nella cartella selezionata quindi tutte le immagini sono disponibili per ulteriori analisi più tardi.
- Ripetere i passaggi da imaging per successive gabbie dei topi.
- Rimuovere i topi dalla macchina imaging. Spegnere il gas. Pulire la camera, Musetti anteriori e Stadio di formazione immagine. Chiudere il programma di computer.
Nota: Il software vi chiederà di "Salvare il set di dati." Questo si riferisce alle manipolazioni apportate al dataset, non i dati stessi.- Fare clic su "Yes" per salvare le modifiche alla scala e le regioni di interesse (ROI). Fare clic su "No" per ripristinare le impostazioni originali per le immagini.
- Per l'analisi dei dati, aprire il software. Della "tavolozza", fare clic su "Strumenti ROI". Fare clic sull'icona cerchio e fare clic su "1" nel menu a discesa per inserire un nuovo ROI nella finestra immagine come indicato da un ovale rosso con quattro quadrati intorno ad esso. Regolare la dimensione del ROI posizionando il cursore del mouse sopra un quadrato rosso e trascinando per racchiudere l'area viola sovrapponendo il rene iniettato.
- Con il cursore sopra un quadrato rosso sul ROI, pulsante destro del mouse, quindi selezionare "Duplicare ROI" per creare un nuovo ROI nella finestra immagine e spostare il mouse successivo. Ripetere la procedura fino a quando tutti i topi nell'immagine hanno un ROI sopra il rene iniettato.
- Nel menu direttamente sopra l'immagine, modificare "Unità" da "Conteggi" a "Radiance (fotoni)." Per esportare i dati ROI, la "tavolozza", scegliere "Strumenti di ROI", quindi fare clic sull'icona matita/righello per creare un foglio di calcolo delle misurazioni. Utilizzare le misure di "Medio Radiance" in ulteriore analisi nel programma di analisi e statistiche di dati di scelta.
- Eseguire la colorazione di sezioni come descritto11.
Nota: L'iniezione non transfect il rene intero ugualmente così diverse sezioni catturerà transfezione diverse efficienze11. Co-iniezione di perle come il lattice fluorescente microsfere possono contribuire ad identificare le regioni dovrà essere transgene-positivi (Figura 3D)11. Ottimizzazione del protocollo colorazione è estremamente importante. - Eseguire il Western blot per identificare il gene di interesse nel rene trasfettata.
Nota: Raccolta di organi per gli estratti della proteina deve essere fatto sul ghiaccio. Ancora una volta, non utilizzare una piccola fetta dell'organo in quanto questa zona non sono stata trasfettata bene. Transfezione è distribuita in modo non uniforme in tutto l'organo così combinare diverse aree e li. L'iniezione idrodinamica pelvi renale di un plasmide producendo l'eritropoietina dell'ormone ha provocato un modesto aumento dell'ematocrito, così è previsto che il transgene secernuto prodotti dovrebbero essere trovati in circolazione11. - Per a lungo termine ad alto livello espressione dei transgeni, combinare un sistema vettoriale l'integrazione con agenti immunosoppressori come la ciclofosfamide. La risposta immunitaria verso il transgene si verifica sopra il primo diverse settimane dopo l'iniezione ed è robusto11.
Risultati
La tecnica di iniezione e chirurgia sono semplici da eseguire una volta masterizzato, che non richiede grandi attrezzature o materiali costosi. Se nuovo in chirurgia renale incisione a fianco, una giornata di formazione su diversi topi prevista per l'eutanasia dovrebbe essere consentita in cui i topi non sono recuperata dopo chirurgia perché il primo tentativo di questo tipo di chirurgia può richiedere molto più tempo rispetto al normale. In alternativa, gli investigatori hanno familia...
Discussione
In questo protocollo è descritto un metodo affidabile per la realizzazione di espressione genica riproducibile in particolare nel rene. Nelle mani di un chirurgo esperto moderatamente abbiamo trovato la percentuale dei topi transfettati con questa tecnica per essere nella gamma di 50-100%, a seconda dell'età del mouse e la sensibilità di lettura del transgene. Il livello di espressione di gene della luciferasi era sopra priorità bassa per parecchi mesi in topi che ricevono piggyBac trasposoni e completamente...
Divulgazioni
Gli autori non hanno nulla di divulgare e non dichiarare alcun conflitto di interessi.
Riconoscimenti
Il Career Development Award dal Department of Veterans Affairs [BX002797] supportati L.E.W. e il National Institutes of Health [R01-DK095867] e American Heart Association [15GRNT25700209] supportati J.C. Il National Institutes of Health [DK093660], Department of Veterans Affairs [BX002190] e centro del Vanderbilt per la malattia renale supportati M.H.W. Questo materiale è il risultato di lavoro sostenuto con risorse e utilizzo di servizi VA Tennessee Valley Healthcare System.
Materiali
| Name | Company | Catalog Number | Comments |
| AnaSed Xylazine | Patterson Veterinary | 07-808-1947 | Anesthetic - Not controlled substance |
| BD Insulin Syringe 0.5 mL 29G 1/2 Inch | Cardinal Health | 309306 | Required syringes |
| Buprenex | Pharmacist/Veterinarian | Analgesia - Controlled Substance | |
| Dynarex Disposable Towel Drape | Thermo Fisher Scientific | 19-310-671 | Place over heat pad |
| EndoFree Plasmid Maxi Kit | Qiagen | 12362 | Use only endotoxin-free plasmid DNA |
| Endosafe Gel-Clot LAL Rapid Positive Control | Charles River | PC200 | Positive control for endotoxin test |
| Endosafe Gel-Clot LAL Rapid Single Test Vial | Charles River | R13500 | Endotoxin test |
| Extra Fine Micro Dissecting Scissors | Roboz Surgical Instrument | RS-5882 | Surgical tool |
| Fisherbrand Instant Sealing Sterilization Pouch - 9" | Thermo Fisher Scientific | 01-812-51 | For autoclaving surgical tools |
| Gaymar Heat Pump | Paragon Medical | TP-700 | Water-circulating heat pump |
| Germinator 500 | Roboz Surgical Instrument | DS-401 | To reuse surgical tools during surgery |
| Graefe Forceps | Roboz Surgical Instrument | RS-5136 | Surgical tool |
| Graefe Tissue Forceps | Roboz Surgical Instrument | RS-5153 | Surgical tool |
| Halsey Needle Holder, 5" Length | Roboz Surgical Instrument | RS-7841 | Surgical tool |
| Heat pads - 15" x 21" - need at least 3 | Paragon Medical | TP22G | For use with Gaymar Heat Pump |
| IsoFlo (Isoflurane, USP) | Abbott Animal Health | 5260-04-05 | For imaging and euthanasia |
| Isotec Isoflurane Delivery System Vaporizor | Smiths Medical | VCT3K2 | For imaging and euthanasia |
| Ketamine | Pharmacist/Veterinarian | Anesthetic - Controlled Substance | |
| Kimwipes | Kimberly-Clark Professional | 34120 | Laboratory tissues |
| Living Image software | Caliper Life Sciences | For live animal imaging | |
| Luciferin | Perkin Elmer | 122796 | For live animal imaging |
| Nanodrop 2000 | Thermo Scientific | ND-2000-US-CAN | Spectrophotometer for DNA measurement |
| Prevantics Swabs | Thermo Fisher Scientific | 23-100-110 | For skin surgery prep |
| Prolene 5-0 sutures Taper 30" | Thermo Fisher Scientific | NC0256891 | Non-absorbable sutures for skin |
| Puralube Brand Opthalmic Ointment | Patterson Veterinary | 07-888-2572 | To keep eyes moist during surgery |
| Trans IT - QR Hydrodynamic Delivery Solution | Mirus Bio | MIR-5240 | Hydrodynamic delivery buffer for diluting DNA |
| Vicryl 5-0 Sutures J303H | Thermo Fisher Scientific | NC9816710 | Absorbable sutures for muscle layer |
| Wahl Mini Arco Clipper | Med-Vet International | 8787-1550 | Shaver for skin prep |
| Xenogen IVIS 200 | Caliper Life Sciences | For live animal imaging |
Riferimenti
- Liu, F., Song, Y., Liu, D. Hydrodynamics-based transfection in animals by systemic administration of plasmid DNA. Gene Ther. 6 (7), 1258-1266 (1999).
- Zhang, G., Budker, V., Wolff, J. A. High levels of foreign gene expression in hepatocytes after tail vein injections of naked plasmid DNA. Human Gene Therapy. 10, 1735-1737 (1999).
- Fumoto, S., Nishimura, K., Nishida, K., Kawakami, S. Three-Dimensional Imaging of the Intracellular Fate of Plasmid DNA and Transgene Expression: ZsGreen1 and Tissue Clearing Method CUBIC Are an Optimal Combination for Multicolor Deep Imaging in Murine Tissues. PLoS One. 11 (1), e0148233 (2016).
- Yoshino, H., Hashizume, K., Kobayashi, E. Naked plasmid DNA transfer to the porcine liver using rapid injection with large volume. Gene Ther. 13 (24), 1696-1702 (2006).
- Kamimura, K., Suda, T., Xu, W., Zhang, G., Liu, D. Image-guided, lobe-specific hydrodynamic gene delivery to swine liver. Mol Ther. 17 (3), 491-499 (2009).
- Kamimura, K., Zhang, G., Liu, D. Image-guided,intravascular hydrodynamic gene delivery to skeletal muscle in pigs. Mol Ther. 18 (1), 93-100 (2010).
- Suda, T., Liu, D. Hydrodynamic gene delivery: its principles and applications. Mol.Ther. 15 (12), 2063-2069 (2007).
- Alino, S. F., et al. Naked DNA delivery to whole pig cardiac tissue by coronary sinus retrograde injection employing non-invasive catheterization. J Gene Med. 12 (11), 920-926 (2010).
- Suda, T., Gao, X., Stolz, D. B., Liu, D. Structural impact of hydrodynamic injection on mouse liver. Gene Ther. 14 (2), 129-137 (2007).
- Skrypnyk, N. I., Harris, R. C., de Caestecker, M. P. Ischemia-reperfusion model of acute kidney injury and post injury fibrosis in mice. J Vis Exp. (78), (2013).
- Woodard, L. E., et al. Kidney-specific transposon-mediated gene transfer in vivo. Sci Rep. 7, 44904 (2017).
- Liang, A., et al. Loss of glutathione S-transferase A4 accelerates obstruction-induced tubule damage and renal fibrosis. Journal of Pathology. 228 (4), 448-458 (2012).
- Liang, M., et al. Protective role of insulin-like growth factor-1 receptor in endothelial cells against unilateral ureteral obstruction-induced renal fibrosis. Am J Pathol. 185 (5), 1234-1250 (2015).
- Corridon, P. R., et al. A method to facilitate and monitor expression of exogenous genes in the rat kidney using plasmid and viral vectors. Am J Physiol Renal Physiol. 304 (9), F1217-F1229 (2013).
- Wallace, D. P., et al. Tracking kidney volume in mice with polycystic kidney disease by magnetic resonance imaging. Kidney Int. 73 (6), 778-781 (2008).
- Woodard, L. E., Wilson, M. H. piggyBac-ing models and new therapeutic strategies. Trends Biotechnol. 33 (9), 525-533 (2015).
- Yeikilis, R., et al. Hydrodynamics based transfection in normal and fibrotic rats. World J Gastroenterol. 12 (38), 6149-6155 (2006).
- Thalhofer, C. J., et al. In vivo imaging of transgenic Leishmania parasites in a live host. J Vis Exp. (41), (2010).
- Wooddell, C. I., et al. Muscle damage after delivery of naked plasmid DNA into skeletal muscles is batch dependent. Hum Gene Ther. 22 (2), 225-235 (2011).
- Crespo, A., et al. Hydrodynamic liver gene transfer mechanism involves transient sinusoidal blood stasis and massive hepatocyte endocytic vesicles. Gene Ther. 12 (11), 927-935 (2005).
- Rocca, C. J., Ur, S. N., Harrison, F., Cherqui, S. rAAV9 combined with renal vein injection is optimal for kidney-targeted gene delivery: conclusion of a comparative study. Gene Ther. 21 (6), 618-628 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon