É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Medição de edema cerebral pós-acidente vascular cerebral, zona de infarto e quebra da barreira hematoencefálica em um único conjunto de amostras cerebrais de roedores
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo descreve uma nova técnica de medição dos três parâmetros mais importantes de lesão cerebral isquêmica no mesmo conjunto de amostras cerebrais de roedores. Usar apenas uma amostra cerebral é altamente vantajoso em termos de custos éticos e econômicos.
Resumo
Uma das causas mais comuns de morbidade e mortalidade em todo o mundo é o AVC isquêmico. Historicamente, um modelo animal usado para estimular o AVC isquêmico envolve o oclusão da artéria cerebral média (MCAO). A zona infarto, o edema cerebral e a quebra da barreira hematoencefálica (BBB) são medidos como parâmetros que refletem a extensão da lesão cerebral após o MCAO. Uma limitação significativa para este método é que essas medidas são normalmente obtidas em diferentes amostras cerebrais de ratos, levando a encargos éticos e financeiros devido ao grande número de ratos que precisam ser eutanizados para um tamanho amostral adequado. Aqui apresentamos um método para avaliar com precisão a lesão cerebral após mcao medindo zona de infarto, edema cerebral e permeabilidade BBB no mesmo conjunto de cérebros de ratos. Esta nova técnica fornece uma maneira mais eficiente de avaliar a fisiopatologia do AVC.
Introdução
Uma das causas mais comuns de morbidade e mortalidade em todo o mundo é o AVC. Globalmente, o AVC isquêmico representa 68% de todos os casos de AVC, enquanto nos Estados Unidos o AVC isquêmico é responsável por 87% dos casos de acidente vascular cerebral1,2. Estima-se que o ônus econômico do AVC atinja US$ 34 bilhões nos Estados Unidos2 e € 45 bilhões na União Europeia3. Modelos animais de AVC são necessários para estudar sua fisiopatologia, desenvolver novos métodos de avaliação e propor novas opções terapêuticas4.
O AVC isquêmico ocorre com a oclusão de uma artéria cerebral grave, geralmente a artéria cerebral média ou um de seus ramos5. Assim, os modelos de AVC isquêmico envolveram historicamente a oclusão da artéria cerebral média (MCAO)6,7,8,9,10,11,12. Seguindo MCAO, a lesão neurológica é mais comumente avaliada pela medição da zona de infarto (IZ) usando um método de coloração de cloreto de tripheniltetrazolium (TTC) de 2,3,5, usando o método de coloração13, edema cerebral (BE) usando secagem ou cálculo dos volumes hemisféricos14,15,16e permeabilidade da barreira cerebral sanguínea (BBB) por uma técnica de espectrometria usando a coloração azul evans17,18,19.
O método tradicional de MCAO usa conjuntos separados de cérebros para cada uma das três medidas cerebrais. Para um grande tamanho amostral, isso resulta em um número significativo de animais eutanizados, com considerações éticas e financeiras adicionais. Um método alternativo para aliviar esses custos envolveria medições de todos os três parâmetros em um único conjunto de cérebros de roedores pós-MCAO.
Tentativas anteriores foram feitas para medir combinações de parâmetros na mesma amostra cerebral. Métodos simultâneos de coloração imunofluorescente20, bem como outras análises moleculares e bioquímicas21 foram descritos após a coloração de TTC na mesma amostra cerebral. Calculamos anteriormente os volumes do hemisfério cerebral para avaliar o edema cerebral e realizamos a coloração do TTC para calcular a zona de infarto no mesmo conjunto cerebral15.
No presente protocolo, apresentamos uma técnica modificada de MCAO que mede a lesão cerebral isquêmica através da determinação da permeabilidade de IZ, BE e BBB no mesmo conjunto de cérebros de roedores. O IZ é medido pela coloração TTC, o BE é determinado pelo cálculo do volume hemisférico, e a permeabilidade do BBB é obtida pelos métodos de espectrometria19. Neste protocolo, utilizou-se um modelo MCAO modificado, baseado na inserção direta e fixação do cateter monofilamento na artéria carótida interna (ICA) e posterior bloqueio do fluxo sanguíneo para a artéria cerebral média (MCA)22. Este método modificado mostra uma taxa reduzida de mortalidade e morbidade em comparação com o método tradicional de MCAO16,22.
Esta nova abordagem fornece um modelo financeiro e ético para medir lesões neurológicas após mcao. Essa avaliação dos principais parâmetros da lesão cerebral isquêmica ajudará a investigar de forma abrangente sua fisiopatologia.
Protocolo
Os seguintes procedimentos foram conduzidos de acordo com as recomendações da Declaração de Helsinque e Tóquio e as Diretrizes para o Uso de Animais Experimentais da Comunidade Europeia. Os experimentos também foram aprovados pelo Comitê de Cuidados Com Animais da Universidade Ben-Gurion do Negev.
1. Preparando ratos para o procedimento experimental
- Selecione ratos adultos machos Sprague-Dawley sem patologia atolizada, cada um pesando entre 300 e 350 g.
- Mantenha todos os ratos à temperatura ambiente a 22 °C, com 12 horas de ciclos claros e escuros antes do experimento.
- Certifique-se de que alimentos e água estão disponíveis ad libitum.
- Realizar todos os procedimentos entre 6:00.m e 14:00.m.
2. Preparando ratos para cirurgia
- Anestesiar os ratos por 30 minutos com isoflurane (4% para indução e 2% para manutenção) e 24% de oxigênio (1,5 L/min).
- Teste o nível de anestesia nos ratos, garantindo que eles não tenham um reflexo de retirada do pedal.
- Insira o cateter de calibre 24 na veia da cauda.
NOTA: O aquecimento da cauda para vasodilatação não é realizado.- Coloque os ratos sobre a mesa em uma posição supina. Use fita médica para fixar todos os quatro membros dos ratos.
- Coloque a sonda para medir a temperatura no reto do rato antes da cirurgia.
- Durante o procedimento, mantenha uma placa de aquecimento para suportar uma temperatura corporal do núcleo de 37 °C.
- Adicione pomada em ambos os olhos do rato para proteção.
- Raspe a área cirúrgica e desinfete com três aplicações de 10% de povidone-iodo seguido de 70% de álcool isopropílico.
3. Oclusão da artéria cerebral do lado direito
NOTA: A MCAO é realizada por uma técnica modificada, conforme descrito anteriormente16,22,23, com o uso de instrumentos descritos por McGarry et al.24 e Uluç et al.25.
- Dissecar a pele e a fáscia superficial na linha média ventral do pescoço com pinças cirúrgicas e tesouras com lâminas curvas.
- Identificar o triângulo muscular, composto pelo ICA, artéria carótida externa (ECA) e artéria carótida comum (CCA).
- Separe cuidadosamente o CCA direito e o ICA do nervo vago com microforceps para cirurgia vascular.
- Exponha a CCA direita e o ICA. Bloqueie o fluxo sanguíneo proveniente da CCA para o ICA usando micro-clipes ou torniquetes especiais para cirurgia vascular. Faça uma incisão (aproximadamente 1 mm) no ICA usando microscisores para cirurgia vascular.
- Insira um cateter monofilamento (4-0 nylon) diretamente através do ICA, cerca de 18,5-19 mm do ponto de bifurcação da CCA direita no círculo de Willis até atingir uma leve resistência, para ocluir a MCA26.
- Ligate em torno do ICA acima da bifurcação da CCA.
- Para o grupo de controle operado por farsa, realize uma inserção de linha de nylon em vez das etapas 3.5 e 3.616,22.
- Administre 5 mL de cloreto de sódio de 0,9% por injeção intraperitoneal.
- Feche a ferida por sutura e leve o rato para uma área de recuperação.
NOTA: Alguns minutos após o fim da anestesia, o rato acordará e se moverá independentemente ao redor da gaiola. - Às 23 horas após mcao, injete 2% de Evans azul em soro fisiológico (4 mL/kg)23,26 na veia traseira para ambos os grupos operados através de uma cânula27.
NOTA: Isto é usado como um rastreador de permeabilidade cérebro-sangue. Deixe circular por 60 minutos.
4. Determinação da zona de infarto
- Medida IZ às 24h após MCAO como descrito anteriormente9,15,18,19,26.
NOTA: Ratos que perderam mais de 20% de seu peso ou desenvolveram convulsões ou hemiplegia são excluídos do experimento. - Eutanize o rato substituindo a mistura de gás inspirada por 20% de oxigênio e 80% de dióxido de carbono até que o rato deixe de respirar espontaneamente.
- Abra o peito com uma incisão lateral de 5-6 cm através da parede abdominal sob a caixa torácica usando tesouras e fórceps cirúrgicos.
- Realize uma incisão diafragmática ao longo de toda a extensão da caixa torácica com tesoura e fórceps cirúrgicos.
- Deslocando cuidadosamente os pulmões, cortando a caixa torácica até a clavícula nos lados direito e esquerdo28.
- Perfuse com 200 mL de soro fisiológico normal através do ventrículo esquerdo do coração.
- Puna ou incise o átrio direito do coração com uma tesoura.
- Realizar decapitação usando uma guilhotina e coletar tecido cerebral.
- Usando uma tesoura de íris, cortada do foie magnum até a borda distal da superfície posterior do crânio em ambos os lados.
- Separe as lâmpadas olfativas, conexões nervosas ao longo da superfície ventral e superfície dorsal do crânio do cérebro.
- Remova o cérebro da cabeça.
- Produza 6 fatias cerebrais criando seções horizontais de 2 mm de espessura com uma lâmina de barbear de 0,009", sem revestimento, de borda única.
- Incubar por 30 min a 37 °C em 0,05% TTC.
- Coloque o tecido cerebral nos slides do microscópio e realize a varredura óptica dessas 6 fatias cerebrais com uma resolução de 1600x1600 dpi (ver Suplemento 1, por exemplo).
- Adicione um filtro azul com um editor de fotos (por exemplo, Adobe Photoshop CS2) usando a função Channel Mixer(Image > Adjustments > Channel Mixer) e salve a imagem como um formato de arquivo JPEG.
NOTA: Após a aplicação do filtro azul, a imagem aparecerá em escala de cinza. - Abra a imagem salva em ImageJ 1.37v29,30.
NOTA: Este programa de computador usa uma função limiar para isolar e calcular os pixels que são preto ou branco (ver Figura 1). - Para cada uma das 6 fatias cerebrais da imagem, selecione e salve cada hemisfério (ipsilateral direito ferido e contralateral inin ferido) como um arquivo de imagem separado usando a ferramenta "seleção de polígonos" do menu principal.
- Defina o limite para determinar o IZ usando uma função de limiar automático do menu principal do software ImageJ selecionando Image > Adjust > Threshold, e meça o número de pixels em cada hemisfério de um único conjunto cerebral.
NOTA: Macros podem ser usadas para esta etapa no software ImageJ (ver Suplemento 2 para o código). O corte é um parâmetro crítico para determinar quais pixels converter em branco e que se converter em preto dependendo do tom de cinza (ver Suplemento 3 e Suplemento 4 como exemplos). ImageJ então compara pixels brancos e pretos para determinar IZ. Com base no protocolo de coloração e configurações do scanner, usamos um valor de corte constante de 0,220. - Realizar a medição da correção do IZ para inchaço tecidual utilizando as Razões dos Hemisférios Cerebrais Ipsilaterais e Contralateral (RICH) método13,23 (ver exemplo no Suplemento 5).
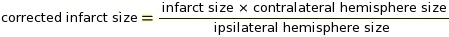
NOTA: O tamanho do infarto é avaliado como uma porcentagem do hemisfério contralateral.
5. Determinação do edema cerebral31
NOTA: Use ImageJ 1.37v para medição de BE32,33.
- Meça BE 24 h após MCAO. Para cálculo do BE, utilize os dados do volume do hemisfério esquerdo e direito (em unidades).
- Realize a digitalização óptica com uma resolução de 1600x1600 dpi (ver Suplemento 1, por exemplo).
- Selecione hemisférios cerebrais e defina o corte para determinar BE com ImageJ 1.37v, conforme descrito acima nas seções 4.17-4.19.
- Expresse a área BE como uma porcentagem das áreas padrão do hemisfério contralateral não afetado, calculada pelo método RICH utilizando a equação seguinte (ver exemplo no Suplemento 5)23,34.

NOTA: A extensão do BE é avaliada como uma porcentagem do hemisfério contralateral.
6. Determinação do rompimento do BBB
- Medir o rompimento do BBB 24 h após MCAO.
- Divida os hemisférios direito e esquerdo em seis fatias e coloque cada uma em um tubo de microcentrífuga.
- Homogeneize cada fatia do tecido cerebral em ácido tricloroacético, com base no cálculo de 1 g de tecido cerebral em 4 mL de ácido tricloroacético de 50%.
- Centrifugar a 10.000 x g por 20 min.
- Líquido supernacido diluído 1:3 com 96% de etanol.
- Realize a espectrofotometria de luminescência utilizando o software de espectrofotometria, instalando a placa e realizando uma leitura amostral usando os seguintes parâmetros: Comprimento de onda de intensidade de fluorescência de 620 nm (largura de banda 10 nm) e um comprimento de onda de emissão de 680 nm (largura de banda 10 nm)23,35 ; Mod top; Número Carne 25; Manual 100; Tremendo 1 segundo, 1 mm.
NOTA: Use um comprimento de onda de excitação de 620 nm (largura de banda 10 nm) e um comprimento de onda de emissão de 680 nm (largura de banda 10 nm). 23,35
Resultados
Medição da zona de infarto
Um teste t de amostra independente indicou que 19 ratos submetidos a MCAO permanente demonstraram um aumento significativo no volume de infarto cerebral em comparação com os 16 ratos operados por vergonha (MCAO=7,49% ± 3,57 vs. Sham = 0,31% ± 1,9, t(28,49) = 7,56, p < 0,01 (ver Figura 2A).). Os dados são expressos como uma porcentagem média do hemisfério contralateral ± SD.
Discussão
O objetivo principal do presente protocolo foi demonstrar medições consistentes de três parâmetros principais de lesão isquêmica: permeabilidade IZ, BE e BBB. Estudos anteriores neste campo demonstraram a possibilidade de realizar um ou dois desses parâmetros juntos na mesma amostra. Além da redução de custos que este método de três partes oferece, ele também fornece um modelo bioético mais desejável que limita o número de animais que devem ser operados e, posteriormente, eutanizados. Como em todas as té...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos a Maryna Kuscheriava, Maksym Kryvonosov, Daryna Yakumenko e Evgenia Goncharyk do Departamento de Fisiologia, Faculdade de Biologia, Ecologia e Medicina, Oles Honchar, Dnipro University, Dnipro, Ucrânia por seu apoio e contribuições úteis às nossas discussões. Os dados obtidos fazem parte da tese de doutorado de Ruslan Kuts.
Materiais
| Name | Company | Catalog Number | Comments |
| 2 mL Syringe | Braun | 4606027V | |
| 2% chlorhexidine in 70% alcohol solution | Sigma-Aldrich | 500 cc | Provides general antisepsis of the skin in the operatory field |
| 27 G Needle with Syringe | Braun | 305620 | |
| 3-0 Silk sutures | Henry Schein | 1007842 | |
| 4-0 Nylon suture | 4-00 | ||
| Brain & Tissue Matrices | Sigma-Aldrich | 15013 | |
| Cannula Venflon 22 G | KD-FIX | 183603985447 | |
| Centrifuge Sigma 2-16P | Sigma-Aldrich | Sigma 2-16P | |
| Compact Analytical Balances | Sigma-Aldrich | HR-AZ/HR-A | |
| Digital weighing scale | Sigma-Aldrich | Rs 4,000 | |
| Dissecting scissors | Sigma-Aldrich | Z265969 | |
| Eppendorf pipette | Sigma-Aldrich | Z683884 | |
| Eppendorf tube | Sigma-Aldrich | EP0030119460 | |
| Fluorescence detector | Tecan, Männedorf Switzerland | Model: Infinite 200 PRO multimode reader | Optional. |
| Fluorescence detector | Molecular Devices LLC | VWR cat. # 10822 512 SpectraMax Paradigm Multi Mode Microplate Reader Base Instrument | Optional. |
| Gauze sponges | Fisher | 22-362-178 | |
| Heater with thermometer | Heatingpad-1 | Model: HEATINGPAD-1/2 | |
| Hemostatic microclips | Sigma-Aldrich | ||
| Horizon-XL | Mennen Medical Ltd | ||
| Infusion cuff | ABN | IC-500 | |
| Micro forceps | Sigma-Aldrich | ||
| Micro scissors | Sigma-Aldrich | ||
| Multiset | Teva Medical | 998702 | |
| Olympus BX 40 microscope | Olympus | ||
| Operating forceps | Sigma-Aldrich | ||
| Operating scissors | Sigma-Aldrich | ||
| Optical scanner | Canon | Cano Scan 4200F | Resolution 3200 x 6400 dpi |
| Petri dishes | Sigma-Aldrich | P5606 | |
| Purina Chow | Purina | 5001 | Rodent laboratory chow given to rats, mice and hamster is a life-cycle nutrition that has been used in biomedical research for over 5 decades. Provided to rats ad libitum in this experiment. |
| Rat cages | Techniplast | 2000P | Conventional housing for rodents. Cages were used for housing rats throughout the experiment |
| Scalpel blades #11 | Sigma-Aldrich | S2771 | |
| Software | |||
| Adobe Photoshop CS2 for Windows | Adobe | ||
| ImageJ 1.37v | NIH | The source code is freely available. The author, Wayne Rasband (wayne@codon.nih.gov), is at the Research Services Branch, National Institute of Mental Health, Bethesda, Maryland, USA | |
| SPSS Statistics 22 | IBM | ||
| Office 365 ProPlus | Microsoft | - | Microsoft Office Excel |
| Windows 10 | Microsoft | ||
| Reagents | |||
| 2,3,5-Triphenyltetrazolium chloride | Sigma-Aldrich | 298-96-4 | |
| 50% trichloroacetic acid | Sigma-Aldrich | 76-03-9 | |
| Ethanol 96 % | Romical | Flammable liquid | |
| Evans blue 2% | Sigma-Aldrich | 314-13-6 | |
| Isoflurane, USP 100% | Piramamal Critical Care, Inc | NDC 66794-017 |
Referências
- Krishnamurthi, R. V., et al. Global and regional burden of first-ever ischaemic and haemorrhagic stroke during 1990-2010: findings from the Global Burden of Disease Study 2010. Lancet Global Health. 1, 259-281 (2013).
- Benjamin, E. J., et al. Heart Disease and Stroke Statistics-2017 Update: A Report From the American Heart Association. Circulation. 135, 146 (2017).
- Wilkins, E., et al. . European cardiovascular disease statistics 2017. , (2017).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Design, Development and Therapy. 9, 3445-3454 (2015).
- Lloyd-Jones, D., et al. Heart disease and stroke statistics--2009 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation. 119, 480-486 (2009).
- Shigeno, T., McCulloch, J., Graham, D. I., Mendelow, A. D., Teasdale, G. M. Pure cortical ischemia versus striatal ischemia. Circulatory, metabolic, and neuropathologic consequences. Surgical Neurology. 24, 47-51 (1985).
- Albanese, V., Tommasino, C., Spadaro, A., Tomasello, F. A transbasisphenoidal approach for selective occlusion of the middle cerebral artery in rats. Experientia. 36, 1302-1304 (1980).
- Hudgins, W. R., Garcia, J. H. Transorbital approach to the middle cerebral artery of the squirrel monkey: a technique for experimental cerebral infarction applicable to ultrastructural studies. Stroke. 1, 107-111 (1970).
- Waltz, A. G., Sundt, T. M., Owen, C. A. Effect of middle cerebral artery occlusion on cortical blood flow in animals. Neurology. 16, 1185-1190 (1966).
- Tamura, A., Graham, D. I., McCulloch, J., Teasdale, G. M. Focal cerebral ischaemia in the rat: 1. Description of technique and early neuropathological consequences following middle cerebral artery occlusion. Journal of Cerebral Blood Flow & Metabolism. 1, 53-60 (1981).
- Aspey, B. S., Cohen, S., Patel, Y., Terruli, M., Harrison, M. J. Middle cerebral artery occlusion in the rat: consistent protocol for a model of stroke. Neuropathology and Applied Neurobiology. 24, 487-497 (1998).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20, 84-91 (1989).
- O'Brien, M. D., Jordan, M. M., Waltz, A. G. Ischemic cerebral edema and the blood-brain barrier. Distributions of pertechnetate, albumin, sodium, and antipyrine in brains of cats after occlusion of the middle cerebral artery. Archives of Neurology. 30, 461-465 (1974).
- Chen, C. H., Toung, T. J., Sapirstein, A., Bhardwaj, A. Effect of duration of osmotherapy on blood-brain barrier disruption and regional cerebral edema after experimental stroke. Journal of Cerebral Blood Flow & Metabolism. 26, 951-958 (2006).
- Boyko, M., et al. Establishment of Novel Technical Methods for Evaluating Brain Edema and Lesion Volume in Stroked Rats: a Standardization of Measurement Procedures. Brain Research. , (2019).
- Boyko, M., et al. An experimental model of focal ischemia using an internal carotid artery approach. Journal of Neuroscience Methods. 193, 246-253 (2010).
- Sifat, A. E., Vaidya, B., Abbruscato, T. J. Blood-Brain Barrier Protection as a Therapeutic Strategy for Acute Ischemic Stroke. AAPS Journal. 19, 957-972 (2017).
- Jiang, X., et al. Blood-brain barrier dysfunction and recovery after ischemic stroke. Progress in Neurobiology. 163-164, 144-171 (2018).
- Belayev, L., Busto, R., Zhao, W., Ginsberg, M. D. Quantitative evaluation of blood-brain barrier permeability following middle cerebral artery occlusion in rats. Brain Research. 739, 88-96 (1996).
- Li, L., Yu, Q., Liang, W. Use of 2,3,5-triphenyltetrazolium chloride-stained brain tissues for immunofluorescence analyses after focal cerebral ischemia in rats. Pathology - Research and Practice. 214, 174-179 (2018).
- Kramer, M., et al. TTC staining of damaged brain areas after MCA occlusion in the rat does not constrict quantitative gene and protein analyses. Journal of Neuroscience Methods. 187, 84-89 (2010).
- Kuts, R., et al. A middle cerebral artery occlusion technique for inducing post-stroke depression in rats. Journal of Visualized Experiments. , e58875 (2019).
- Kuts, R., et al. A Novel Method for Assessing Cerebral Edema, Infarcted Zone and Blood-Brain Barrier Breakdown in a Single Post-stroke Rodent Brain. Frontiers in Neuroscience. 13, 1105 (2019).
- McGarry, B. L., Jokivarsi, K. T., Knight, M. J., Grohn, O. H. J., Kauppinen, R. A. A Magnetic Resonance Imaging Protocol for Stroke Onset Time Estimation in Permanent Cerebral Ischemia. Journal of Visualized Experiments. , e55277 (2017).
- Uluc, K., Miranpuri, A., Kujoth, G. C., Akture, E., Baskaya, M. K. Focal cerebral ischemia model by endovascular suture occlusion of the middle cerebral artery in the rat. Journal of Visualized Experiments. , e1978 (2011).
- Boyko, M., et al. The effect of blood glutamate scavengers oxaloacetate and pyruvate on neurological outcome in a rat model of subarachnoid hemorrhage. Neurotherapeutics. 9, 649-657 (2012).
- Kuts, R., et al. A Middle Cerebral Artery Occlusion Technique for Inducing Post-stroke Depression in Rats. Journal of Visualized Experiments. , e58875 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. , e3564 (2012).
- Poinsatte, K., et al. Quantification of neurovascular protection following repetitive hypoxic preconditioning and transient middle cerebral artery occlusion in mice. Journal of Visualized Experiments. , e52675 (2015).
- . ImageJ, U. S. National Institutes of Health Available from: https://imagej.nih.gov/ij (2018)
- Boyko, M., et al. Pyruvate's blood glutamate scavenging activity contributes to the spectrum of its neuroprotective mechanisms in a rat model of stroke. European Journal of Neuroscience. 34, 1432-1441 (2011).
- Collins, T. J. ImageJ for microscopy. Biotechniques. 43, 25-30 (2007).
- . ImageJ, U. S. National Institutes of Health Available from: https://imagej.nih.gov/ij (1997)
- Kaplan, B., et al. Temporal thresholds for neocortical infarction in rats subjected to reversible focal cerebral ischemia. Stroke. 22, 1032-1039 (1991).
- Kumai, Y., et al. Postischemic gene transfer of soluble Flt-1 protects against brain ischemia with marked attenuation of blood-brain barrier permeability. Journal of Cerebral Blood Flow & Metabolism. 27, 1152-1160 (2007).
- Schuleri, K. H., et al. Characterization of peri-infarct zone heterogeneity by contrast-enhanced multidetector computed tomography: a comparison with magnetic resonance imaging. Journal of the American College of Cardiology. 53, 1699-1707 (2009).
- Singh, A., Kukreti, R., Saso, L., Kukreti, S. Oxidative Stress: A Key Modulator in Neurodegenerative Diseases. Molecules. 24, (2019).
- Di Napoli, M. Caplan's Stroke: A Clinical Approach. Journal of the American Medical Association. 302, 2600-2601 (2009).
- Deb, P., Sharma, S., Hassan, K. M. Pathophysiologic mechanisms of acute ischemic stroke: An overview with emphasis on therapeutic significance beyond thrombolysis. Pathophysiology. 17, 197-218 (2010).
- Simard, J. M., Kent, T. A., Chen, M., Tarasov, K. V., Gerzanich, V. Brain oedema in focal ischaemia: molecular pathophysiology and theoretical implications. Lancet Neurology. 6, 258-268 (2007).
- Klatzo, I. Pathophysiological aspects of brain edema. Acta Neuropathology. 72, 236-239 (1987).
- Yang, Y., Rosenberg, G. A. Blood-brain barrier breakdown in acute and chronic cerebrovascular disease. Stroke. 42, 3323-3328 (2011).
- Lin, T. N., He, Y. Y., Wu, G., Khan, M., Hsu, C. Y. Effect of brain edema on infarct volume in a focal cerebral ischemia model in rats. Stroke. 24, 117-121 (1993).
- Liu, C., et al. Increased blood-brain barrier permeability in contralateral hemisphere predicts worse outcome in acute ischemic stroke after reperfusion therapy. Journal of NeuroInterventional Surgery. 10, 937-941 (2018).
- Boyko, M., et al. Establishment of novel technical methods for evaluating brain edema and lesion volume in stroked rats: A standardization of measurement procedures. Brain Research. 1718, 12-21 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados