Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Implantación De Stents Coronarios De Tamaño Humano En La Aorta Abdominal De Rata Usando Un Acceso Trans-Femoral
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe la implantación de stents coronarios humanos en la aorta abdominal de ratas con un apoE-/- fondo usando un acceso transporte-femoral. En comparación con otros modelos animales, los modelos murinos tienen las ventajas de un alto rendimiento, reproducibilidad, facilidad de manejo y alojamiento, y una amplia disponibilidad de marcadores moleculares.
Resumen
La intervención coronaria percutánea (ICP), combinada con el despliegue de un stent coronario, representa el patrón oro en el tratamiento intervencionista de la enfermedad arterial coronaria. La reestenosis en stent (ISR) está determinada por una proliferación excesiva de tejido neointimal dentro del stent y limita el éxito a largo plazo de los stents. Una variedad de modelos animales se han utilizado para aclarar los procesos fisiopatológicos subyacentes a la reestenosis en stent (ISR), siendo los modelos porcinos coronarios y de la arteria ilíaca del conejo los más frecuentemente utilizados. Los modelos murinos proporcionan las ventajas de un alto rendimiento, facilidad de manejo y alojamiento, reproducibilidad y una amplia disponibilidad de marcadores moleculares. El modelo de ratón deficiente en apolipoproteína E (apoE-/-) ha sido ampliamente utilizado para estudiar enfermedades cardiovasculares. Sin embargo, los stents deben ser miniaturizados para ser implantados en ratones, lo que implica cambios importantes de sus propiedades mecánicas y (potencialmente) biológicas. El uso de apoE-/- las ratas pueden superar estas deficiencias como apoE-/- las ratas permiten la evaluación de stents coronarios de tamaño humano mientras que al mismo tiempo proporcionan un fenotipo atherogenic. Esto los convierte en un modelo excelente y confiable para investigar la ISR después de la implantación del stent. Aquí, describimos, detalladamente, la implantación de stents coronarios humanos disponibles en el comercio en la aorta abdominal de ratas con un apoE-/- fondo usando un acceso transporte-femoral.
Introducción
La intervención coronaria percutánea (ICP), combinada con el despliegue de un stent coronario, representa el patrón oro en el tratamiento intervencionista de la enfermedad arterial coronaria1. El éxito a largo plazo de los stents, sin embargo, puede verse limitado por la aparición de reestenosis en stent (ISR) que está determinada por una proliferación excesiva de tejido neointimal dentro del stent2,3. La ISR puede requerir una reintervención con revascularización coronaria o re-ICP. Se han sugerido una variedad de modelos animales para el estudio de la ISR, cada uno de ellos con ventajas y deficiencias. Los principales inconvenientes de los modelos de arterias ilíacas coronarias y conejos más comúnmente utilizados, aunque desarrollando lesiones marcadamente similares a las de los humanos después de la implantación del stent4,5,son los grandes costos de animales y alojamiento que traen consigo dificultades logísticas, especialmente en estudios a largo plazo, así como limitaciones en el manejo y el equipo. Además, la disponibilidad de anticuerpos contra las proteínas celulares de cerdos y conejos es limitada. Por otro lado, los modelos murinos proporcionan las principales ventajas de un alto rendimiento y reproducibilidad, así como facilidad de manejo, alojamiento y, por lo tanto, rentabilidad. Además, un mayor número de anticuerpos están disponibles. Sin embargo, mientras que los ratones con deficiencia de Apolipoproteína E (apoE-/-)han sido ampliamente utilizados para el estudio de la aterosclerosis6,7,8,no son adecuados para el estudio de la ISR, ya que los stents tienen que ser miniaturizados para ser implantados en ratones, lo que potencialmente cambia las propiedades mecánicas de los stents. Por otra parte, la pared aórtica de los ratones mide entre 50 μm en ratones jóvenes y 85 μm en ratones viejos9,y los stents tienen que ser desplegados utilizando niveles de presión tan bajos como 2 atm, lo que podría conducir a la malaposición del stent10. Las ratas, sin embargo, permiten la implantación de stents coronarios humanos disponibles en el mercado, y demuestran un curso de curación vascular similar a los animales más grandes después de la implantación del stent aórtico, reportado por primera vez por Langeveld et al.11. Esta técnica requirió originalmente un acceso transporte-abdominal, que hizo necesario una constricción física de la aorta para alcanzar una interrupción temporal del flujo de sangre. Para evitar la lesión potencialmente asociada a los vasos y las reacciones inflamatorias, la técnica se perfeccionó posteriormente mediante la introducción de un acceso trans ilíaco, lo que además resultó en una mayor tasa de supervivencia de los animales12.
Debido a que las ratas de tipo salvaje no desarrollan lesiones ateroscleróticas13,las ratas apoE-/- se han generado ratas utilizando técnicas de nucleasa como la Ncleasa Efectora Activadora de Transcripción (TALEN)14,las repeticiones palindrómicas cortas agrupadas regularmente interespaciadas (CRISPR/Cas9)15,y zinc finger (ZF)16. ApoE-/- las ratas han estado disponibles comercialmente desde 2011. Proporcionando un fondo atherogenic, las ratas del apoE-/- permiten una evaluación más realista de stents coronarios de tamaño humano, especialmente con respecto a ISR.
Adjunto, describimos el método vía la ruta de acceso transfemoral y usando un stent droga-que eluting del fino-puntal del fino-cromo disponible en el comercio (DES), sin embargo, puede también ser aplicado para el estudio de otros tipos stents, tales como stents del metal desnudo (BMS) o stents biodegradables.
Protocolo
Los experimentos se realizaron de conformidad con la ley alemana de bienestar animal (TSchG) y la Directiva 2010/63/UE relativa a la protección de los animales utilizados con fines científicos. La aprobación oficial para este estudio fue otorgada por el Comité Gubernamental de Cuidado y Uso de Animales (Protocolo No.: AZ 87-51.04.2010.A065; Landesamt für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen, Recklinghausen, Alemania). El protocolo de estudio cumplió con la Guía para el Cuidado y Uso de Animales de Laboratorio. El tratamiento del dolor postoperatorio se basa en las recomendaciones de la Sociedad Alemana para la Ciencia de Animales de Laboratorio (GV-SOLAS), así como en la Iniciativa de Terapia Veterinaria del Dolor.
1. Técnicas básicas y procedimientos comunes
- Use apoE homocigótico-/- Ratas Sprague-Dawley. Identificar el genotipo de cada animal mediante métodos estándar17.
- Mantener a los animales en condiciones idénticas (21 °C ± 2 °C, 60% ± 5% de humedad y un ciclo de luz/oscuridad de 12 h) y garantizar el libre acceso al agua y a los alimentos.
- Lleve a cabo todos los procedimientos en condiciones limpias pero no esteriles.
- Una vez que la rata es anestesiada, realice todos los procedimientos bajo un microscopio quirúrgico a un aumento de 16x.
- Use hisopos de algodón para la hemostasia de compresión. Los hisopos de gasa (5 cm x 5 cm) empapados con solución de ringer lactato son útiles para mantener la ingle húmeda.
- Siga las regulaciones de eliminación de residuos para eliminar los materiales usados.
2. Preparaciones antes de la cirugía
- Prepare los medicamentos veterinarios antes de comenzar la operación. Mantenga todas las soluciones a temperatura ambiente, a menos que se indique lo contrario.
- Treinta minutos antes del procedimiento, administre 0.03-0.05 mg/kg de buprenorfina por vía subcutánea.
- Anestesiar a la rata con una inyección intraperitoneal de 100 mg/kg de peso corporal (BW) (S)-ketamina y 8 mg/kg de BW xilazina.
- Evalúe el peso de la rata usando una báscula de pesaje.
- Coloque la rata en una almohadilla térmica y fije las extremidades superiores e inferiores con cinta adhesiva médica. Coloque a la rata con su miembro trasero izquierdo completamente extendido y lo más en línea con su columna vertebral como sea posible para crear una línea recta entre la arteria femoral y la aorta. Esto facilitará el avance del stent montado en un balón a través de la bifurcación aórtica.
- Mantener la anestesia con inhalación de isoflurano al 1,5% vol. en oxígeno al 97,5% a un caudal de 2 L/min.
NOTA: Permita que la rata respire espontáneamente, sin intubación. - Aplique ungüento para los ojos para prevenir el daño ocular durante la inconsciencia.
- Afeitar el pelaje de la ingle y el área inferior del abdomen de la rata y esterilizar la piel correspondiente con una solución de povidona-yodo.
- Antes de comenzar la cirugía, verifique la profundidad adecuada de la anestesia pellizcando la punta de la cola y el tejido interdigital.
3. Cirugía
- Haga una incisión medial de ~ 0.5 \ u20121 cm en la ingle izquierda para abrir la piel y la fascia subyacente.
- Diseccione y sondee embotado embotado en las profundidades hasta que la arteria femoral izquierda que pulsa pueda ser identificada.
- Usando fórceps muy finos, prepare la arteria femoral eliminando suavemente el tejido conectivo circundante. Tenga cuidado de no dañar ni el nervio femoral ni la vena femoral, que es medial a la arteria.
- Preparar aproximadamente 1 cm de la arteria femoral. Coloque cuidadosamente la punta de las fórceps debajo del recipiente para levantarlo suavemente.
- Hilo piezas de 4-0 sutura de seda bajo las partes distales y proximales de la arteria y forman eslingas. Sujete los extremos de cada una de las dos eslingas de hilo entre las ramas de una abrazadera quirúrgica. Use las abrazaderas quirúrgicas para controlar la arteria. Estire y levante suavemente las eslingas para interrumpir temporalmente el flujo sanguíneo.
NOTA: Trabaje rápido para evitar un torniquete prolongado que pueda llevar al daño tisular. - Usando micro tijeras afiladas, realice una arteriotomía en el medio de la arteria femoral.
- Introduzca un cable guía a través de la arteriotomía. Al llegar a la eslinga del hilo proximal, suelte la tensión del hilo moviendo la abrazadera quirúrgica y avance el alambre guía más hacia la aorta abdominal.
NOTA: Corte el alambre guía con un cortador de alambre para facilitar la manipulación. - Coloque el extremo proximal del alambre guía entre el diafragma y las arterias renales.
NOTA: Avanzar demasiado el alambre guía conlleva el riesgo de lesión aórtica o cardíaca. Recomendamos abrir el abdomen para asegurar la colocación adecuada del alambre guía y del stent al menos para los primeros animales. - Introduzca un stent coronario engarzado y montado en un balón que mida 2,25 mm x 8 mm (máx. 2,5 mm x 8 mm) sobre el alambre guía en la arteria femoral y avance hacia la aorta abdominal.
- Coloque el stent justo encima de la bifurcación aórtica pero debajo de las arterias renales. Despliegue el stent inflando el catéter del globo a 12 atm por 15 s usando un sistema de la jeringuilla del inflación.
- Desinflar el catéter con balón y mantener la presión negativa de acuerdo con las recomendaciones del fabricante para el stent en uso.
- Retire lentamente el catéter desinflado mientras deja el stent en su lugar.
- Justo antes de sacar el catéter, cree tensión en el lazo del hilo por encima de la incisión con la abrazadera quirúrgica para interrumpir el flujo sanguíneo nuevamente. Luego retire el catéter con balón y ligar directamente el vaso proximally.
- Ate los lazos próximos y distales del hilo de rosca para ligar la arteria femoral y para confirmar hemostasis adecuado de la arteriotomía. Las arterias colaterales asegurarán la perfusión adicional al miembro.
- Cierre el músculo que borda la arteria, así como la incisión de la piel mediante el uso de 10-0 suturas no reabsorbibles.
4. Cuidado de animales después de la implantación de stent
- Inmediatamente después de la operación, permita que la rata se recupere durante 60 minutos en una jaula de unidad de cuidados intensivos especial con aire calentado (30 \ u201235 ° C) y un suministro de oxígeno.
- Observe a los animales cuidadosamente hasta que se recuperen por completo. Después, mueva las ratas a una jaula normal. Proporcionar acceso ad libitum al agua y los alimentos.
- Administrar analgesia postoperatoria cada 6-12 horas con 0,03-0,05 mg/kg de buprenorfina (s.c., en 500μl de NaCl) durante un total de 72 horas bajo evaluación clínica.
- Mezcle el alimento con clopidogrel (15 mg/kg) para evitar la trombosis del stent implantado.
- Para mejorar las condiciones hipercolesterolémicas y la formación de placa, comience la alimentación con dieta occidental a las 6 semanas después del nacimiento y continúe hasta la eutanasia. Si se desea, una cohorte de animales alimentados con ratas normales puede servir como control.
5. Recolección y procesamiento de tejidos
- Antes de comenzar la explantación de tejido en el punto de tiempo designado, eutanasiar al animal de acuerdo con las directrices de IACUC. Cosechar la aorta con stent para el análisis histológico al final del período de observación.
- Abra el abdomen mediante una incisión en la línea media y retire el segmento con stent de la aorta, así como las partes adyacentes de la aorta sin stent, que miden 0,5 cm cada una.
- Coloque el tejido en una solución de formol tamponado al 4% durante 24 h para la fijación.
- Incrustar el tejido arterial con stent en plástico y realizar tinción histológica e inmunohistoquímica de acuerdo con los protocolos estándar18,19.
6. Análisis histomorfométrico
- Realizar análisis histomorfométricos de secciones secuenciales de la parte proximal, media y distal de la aorta con stent por medio de un microscopio conectado a una computadora con un software de análisis de imágenes apropiado.
- Traza los contornos de la lámina elástica externa (EEL, entre adventitia y media), la lámina elástica interna (IEL, entre media y neointima), y la luz con una tableta de dibujo gráfico. A partir de estos valores, calcule el área EEL, el área IEL y el área de lumen con el software.
- Calcule el porcentaje de reestenosis en stent (ISR) del área transversal:
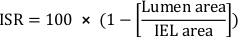
- Calcular el área neointimal total (Ai):
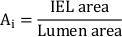
- Mida el grosor neointimal (NIT) sobre cada puntal de stent como la distancia entre el puntal y la luz. Mida el NIT entre los puntales del stent como la distancia entre el IEL y la luz.
Nota: Alternativamente, calcular NIT como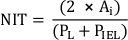
donde PL y PIEL son el lumen y el perímetro interno de la lámina elástica, respectivamente20. - Realizar análisis adicionales de acuerdo con los requerimientos del estudio.
Resultados
Este protocolo describe la implantación de stent en la aorta abdominal de ratas utilizando una vía de acceso transfemoral (Figura 1). El primer punto central de este modelo animal es que permite el despliegue de stents coronarios de tamaño humano. Un stent coronario engarzado y montado en el globo disponible en el comercio se puede colocar en la aorta abdominal de ratas. Así, además, se puede aplicar el mismo principio de despliegue de stent que en humanos. Otra ventaja del uso de ratas...
Discusión
Este protocolo describe la implantación de stents coronarios de tamaño humano en la aorta abdominal de las ratas del apoE-/-. Vale la pena destacar varios aspectos técnicos. En primer lugar, se debe evitar un desajuste entre el tamaño del stent y el tamaño de la aorta. La colocación de un stent demasiado pequeño puede llevar a la malaposición del stent, mientras que la implantación de un stent que es demasiado grande para la aorta puede causar estiramiento excesivo, desgarro y lesión del vaso. Por lo...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Nos gustaría dar las gracias a la Sra. Angela Freund por su inestimable asistencia técnica con la incrustación y la producción de diapositivas. También nos gustaría agradecer al Sr. Tadeusz Stopinski en el Instituto de Ciencia de Animales de Laboratorio y Cirugía Experimental por su perspicaz ayuda con el trabajo veterinario.
Materiales
| Name | Company | Catalog Number | Comments |
| Diet | |||
| SNIFF High Fat diet + Clopidogrel (15 mg/kg) | SNIFF Spezialdiäten GmbH, Soest | custom prepared | Western Diet |
| Drugs and Anesthetics | |||
| Buprenorphine | Essex Pharma | 997.00.00 | |
| ISOFLO (Isoflurane Vapor) vaporiser | Eickemeyer | 4802885 | |
| Isoflurane | Forene Abbott | B 506 | |
| Isotonic (0.9%) NaCl solution | DeltaSelect GmbH | PZN 00765145 | |
| Ringer's lactate solution | Baxter Deutschland GmbH | 3775380 | |
| (S)-ketamine | CEVA Germany | ||
| Xylazine | Medistar Germany | ||
| Consumable supplies | |||
| 10 mL syringes | BD Plastipak | 4606108V | |
| 2 mL syringes | BD Plastipak | 4606027V | |
| 6-0 prolene suture | ETHICON | N-2719K | |
| 4-0 silk suture | Seraflex | IC 158000 | |
| Bepanthen Eye and Nose Ointment | Bayer Vital GmbH | 6029009.00.00 | |
| Cotton Gauze swabs | Fuhrmann GmbH | 32014 | |
| Durapore silk tape | 3M | 1538-1 | |
| Poly-Alcohol Skin Desinfection Solution | Antiseptica GmbH | 72PAH200 | |
| Sterican needle 18 G | B. Braun | 304622 | |
| Sterican needle 27 3/4 G | B.Braun | 4657705 | |
| Tissue Paper | commercially available | ||
| Surgical instruments | |||
| Graefe forceps curved x1 | Fine Science Tools Inc. | 11151-10 | |
| Graefe forceps straight | Fine Science Tools Inc. | 11050-10 | |
| Needle holder Mathieu | Fine Science Tools Inc. | 12010-14 | |
| Scissors | Fine Science Tools Inc. | 14074-11 | |
| Semken forceps | Fine Science Tools Inc. | 11008-13 | |
| Small surgical scissors curved | Fine Science Tools Inc. | 14029-10 | |
| Small surgical scissors straight | Fine Science Tools Inc. | 14028-10 | |
| Standard pattern forceps | Fine Science Tools Inc. | 11000-12 | |
| Vannas spring scissors | Fine Science Tools Inc. | 15000-08 | |
| Equipment | |||
| Dissecting microscope | Leica MZ9 | ||
| Temperature controlled heating pad | Sygonix | 26857617 | |
| Equipment for stent implantation | |||
| Drug-eluting stent Xience 2,25mm x 8mm | Abbott Vascular USA | 1009544-18 | |
| Guide wire Fielder XT PTCA guide wire: 0.014" x 300cm | ASAHI INTECC CO., LTD Japan | AGP140302 | |
| Inflation syringe system | Abbott 20/30 Priority Pack | 1000186 | |
| Tissue processing and analysis | |||
| 30% H2O2 | Roth | 9681 | Histology |
| Ethanol | Roth | K928.1 | Histology |
| Giemsas Azur-Eosin-Methylenblau | Merck | 109204 | Histology |
| Graphic Drawing Tablet | WACOM Europe GmbH | CTL-6100WLK-S | |
| Roti Histofix, Formaldehyd 4% buffered | Roth | P087 | Histology |
| Technovit 9100 | Morphisto | 12225.K1000 | Histology |
Referencias
- Patel, M. R., et al. ACC/AATS/AHA/ASE/ASNC/SCAI/SCCT/STS 2017 Appropriate Use Criteria for Coronary Revascularization in Patients With Stable Ischemic Heart Disease: A Report of the American College of Cardiology Appropriate Use Criteria Task Force, American Association for Thoracic Surgery, American Heart Association, American Society of Echocardiography, American Society of Nuclear Cardiology, Society for Cardiovasular Angiography and Interventions, Society of Cardiovascular Computed Tomography, and Society of Thoracic Surgeons. Journal of the American College of Cardiology. 69 (17), 2212-2241 (2017).
- Virmani, R., Farb, A. Pathology of in-stent restenosis. Current Opinion in Lipidology. 10 (6), 499-506 (1999).
- Buccheri, D., Piraino, D., Andolina, G., Cortese, B. Understanding and managing in-stent restenosis: a review of clinical data, from pathogenesis to treatment. Journal of Thoracic Disease. 8 (10), 1150-1162 (2016).
- Perkins, L. E. Preclinical models of restenosis and their application in the evaluation of drug-eluting stent systems. Veterinary Pathology. 47 (1), 58-76 (2010).
- Kim, W. H., et al. Histopathologic analysis of in-stent neointimal regression in a porcine coronary model. Coronary Artery Disease. 11 (3), 273-277 (2000).
- Plump, A. S., et al. Severe hypercholesterolemia and atherosclerosis in apolipoprotein E-deficient mice created by homologous recombination in ES cells. Cell. 71 (2), 343-353 (1992).
- Breslow, J. L. Transgenic mouse models of lipoprotein metabolism and atherosclerosis. Proceedings of the National Academy of Sciences of the United States of America. 90 (18), 8314-8318 (1993).
- Knowles, J. W., Maeda, N. Genetic modifiers of atherosclerosis in mice. Arteriosclerosis, Thrombosis, and Vascular Biology. 20 (11), 2336-2345 (2000).
- Wheeler, J. B., Mukherjee, R., Stroud, R. E., Jones, J. A., Ikonomidis, J. S. Relation of murine thoracic aortic structural and cellular changes with aging to passive and active mechanical properties. Journal of the American Heart Association. 4 (3), 001744 (2015).
- Rodriguez-Menocal, L., et al. A novel mouse model of in-stent restenosis. Atherosclerosis. 209 (2), 359-366 (2010).
- Langeveld, B., et al. Rat abdominal aorta stenting: a new and reliable small animal model for in-stent restenosis. Journal of Vascular Research. 41 (5), 377-386 (2004).
- Oyamada, S., et al. Trans-iliac rat aorta stenting: a novel high throughput preclinical stent model for restenosis and thrombosis. Journal of Surgical Research. 166 (1), 9 (2011).
- Touchard, A. G., Schwartz, R. S. Preclinical restenosis models: challenges and successes. Toxicologic Pathology. 34 (1), 11-18 (2006).
- Wei, S., et al. Apolipoprotein E-deficient rats develop atherosclerotic plaques in partially ligated carotid arteries. Atherosclerosis. 243 (2), 589-592 (2015).
- Zhao, Y., et al. Hyperlipidemia induces typical atherosclerosis development in Ldlr and Apoe deficient rats. Atherosclerosis. 271, 26-35 (2018).
- Ekuni, D., et al. Occlusal disharmony accelerates the initiation of atherosclerosis in apoE knockout rats. Lipids in Health and Disease. 13 (144), 13 (2014).
- Bhattacharya, D., Van Meir, E. G. A simple genotyping method to detect small CRISPR-Cas9 induced indels by agarose gel electrophoresis. Scientific Reports. 9 (1), 39950 (2019).
- Malik, N., et al. Intravascular stents: a new technique for tissue processing for histology, immunohistochemistry, and transmission electron microscopy. Heart. 80 (5), 509-516 (1998).
- Kumar, A. H., McCauley, S. D., Hynes, B. G., O'Dea, J., Caplice, N. M. Improved protocol for processing stented porcine coronary arteries for immunostaining. Journal of Molecular Histology. 42 (2), 187-193 (2011).
- Jiang, Z., et al. A novel vein graft model: adaptation to differential flow environments. American Journal of Physiology - Heart and Circulatory Physiology. 286 (1), 18 (2004).
- Cornelissen, A., et al. Apolipoprotein E deficient rats generated via zinc-finger nucleases exhibit pronounced in-stent restenosis. Scientific Reports. 9 (1), 54541 (2019).
- Ritskes-Hoitinga, M. G. T., Jensen, T. L., Mikkelsen, L. F. . The Laboratory Mouse (Second Edition). , 567-599 (2012).
- Rune, I., et al. Long-term Western diet fed apolipoprotein E-deficient rats exhibit only modest early atherosclerotic characteristics. Scientific Reports. 8 (1), 23835 (2018).
- Daemen, J., et al. Early and late coronary stent thrombosis of sirolimus-eluting and paclitaxel-eluting stents in routine clinical practice: data from a large two-institutional cohort study. Lancet. 369 (9562), 667-678 (2007).
- Cornelissen, A., Vogt, F. J. The effects of stenting on coronary endothelium from a molecular biological view: Time for improvement. Journal of Cellular and Molecular Medicine. 23 (1), 39-46 (2019).
- Mori, H., et al. Pathological mechanisms of left main stent failure. International Journal of Cardiology. 263, 9-16 (2018).
- Wolinsky, H., Glagov, S. Comparison of abdominal and thoracic aortic medial structure in mammals. Deviation of man from the usual pattern. Circulation Research. 25 (6), 677-686 (1969).
- Lowe, H. C., James, B., Khachigian, L. M. A novel model of in-stent restenosis: rat aortic stenting. Heart. 91 (3), 393-395 (2005).
- Unthank, J. L., Nixon, J. C., Lash, J. M. Early adaptations in collateral and microvascular resistances after ligation of the rat femoral artery. Journal of Applied Physiology. 79 (1), 73-82 (1985).
- Nevzati, E., et al. Biodegradable Magnesium Stent Treatment of Saccular Aneurysms in a Rat Model - Introduction of the Surgical Technique. Journal of Visualized Experiments. (128), e56359 (2017).
- Aquarius, R., Smits, D., Gounis, M. J., Leenders, W. P. J., de Vries, J. Flow diverter implantation in a rat model of sidewall aneurysm: a feasibility study. Journal of NeuroInterventional Surgery. 10 (1), 88-92 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados