Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Bewertung von Proteininteraktionen in lebenden Zellen mit FRET-sensibilisierter Emission
In diesem Artikel
Zusammenfassung
Der Förster-Resonanz-Energietransfer (FRET) zwischen zwei Fluorophor-Molekülen kann zur Untersuchung von Proteininteraktionen in der lebenden Zelle verwendet werden. Hier wird ein Protokoll zur Verfügung gestellt, wie FRET in lebenden Zellen gemessen werden kann, indem die sensibilisierte Emission des Akzeptors und das Abschrecken des Donormoleküls mittels konfokaler Laser-Scanning-Mikroskopie detektiert werden.
Zusammenfassung
Der Förster-Resonanzenergietransfer (FRET) ist die strahlungslose Übertragung von Energie von einem angeregten Donor auf ein Akzeptormolekül und hängt vom Abstand und der Ausrichtung der Moleküle sowie dem Ausmaß der Überlappung zwischen den Donoremissions- und Akzeptorabsorptionsspektren ab. FRET ermöglicht es, die Interaktion von Proteinen in der lebenden Zelle im Laufe der Zeit und in verschiedenen subzellulären Kompartimenten zu untersuchen. In der Literatur wurden verschiedene intensitätsbasierte Algorithmen zur Messung von FRET mittels Mikroskopie beschrieben. Hier werden ein Protokoll und ein Algorithmus zur Quantifizierung der FRET-Effizienz bereitgestellt, die sowohl auf der Messung der sensibilisierten Emission des Akzeptors als auch der Abschreckung des Donormoleküls basieren. Die Quantifizierung der ratiometrischen FRET in der lebenden Zelle erfordert nicht nur die Bestimmung des Übersprechens (spektraler Spillover oder Bleed-Through) der fluoreszierenden Proteine, sondern auch die Detektionseffizienz des mikroskopischen Aufbaus. Das hier bereitgestellte Protokoll beschreibt, wie diese kritischen Parameter zu bewerten sind.
Einleitung
Die mikroskopische Analyse des Förster-Resonanz-Energietransfers (FRET) ermöglicht die Beurteilung der Wechselwirkungen zwischen Proteinen in lebenden Zellen. Es liefert räumliche und zeitliche Informationen, einschließlich Informationen darüber, wo in der Zelle und in welchem subzellulären Kompartiment die Interaktion stattfindet und ob sich diese Interaktion im Laufe der Zeit ändert.
Theodor Förster legte 1948 die theoretischen Grundlagen der FRET1. FRET ist eine strahlungslose Energieübertragung von einem angeregten Donor zu einem Akzeptormolekül und hängt vom Abstand der Moleküle und der relativen Orientierung ihrer Übergangsdipole sowie von der Überlappung zwischen den Donoremissions- und Akzeptorabsorptionsspektren ab. Die Energieübertragungsrate ist umgekehrt proportional zur sechsten Potenz des Donor-Akzeptor-Abstands. Somit kann FRET verwendet werden, um die molekulare Nähe im Bereich von 1-10 nm zu messen.
FRET konkurriert mit anderen De-Anregungsprozessen des Donormoleküls und führt zur sogenannten Donor-Quenching und sensibilisierten Emission des Akzeptors. Donor-Quenching ist eine Verringerung der Anzahl der emittierten Donorphotonen, während sensibilisierte Emission eine Erhöhung der emittierten Akzeptorphotonen ist. Viele mikroskopische FRET-Analysen verwenden Fluoreszenzintensitätsmessungen, einschließlich Akzeptor-Photobleiche 2, Donor-Photobleiche2 oder FRET-sensibilisiertes Photobleichen des Akzeptors3.
Hier werden ein Schritt-für-Schritt-Versuchsprotokoll und ein mathematischer Algorithmus zur Quantifizierung von FRET unter Verwendung von Donor Quenching und akzeptorsensibilisierter Emission4,5 vorgestellt, einer Methode, die oft als ratiometrische FRET bezeichnet wird. Es wurden viele Protokolle zur Annäherung an die sensibilisierte Emission veröffentlicht, nur wenige haben den absoluten FRET-Wirkungsgrad 6,7,8,9 quantifiziert. Die Quantifizierung der FRET-Effizienz in der lebenden Zelle erfordert die Bestimmung (i) des Übersprechens (spektraler Spillover oder Bleed-Through) der fluoreszierenden Proteine und (ii) der Detektionseffizienz des mikroskopischen Aufbaus. Während das Übersprechen durch die Bildgebung von Zellen beurteilt werden kann, die nur eines der Fluorophore exprimieren, ist die Beurteilung der relativen Detektionseffizienz der Donor- und Akzeptorfluoreszenz komplizierter. Es erfordert die Kenntnis mindestens des Verhältnisses der Anzahl der Donor- und Akzeptormoleküle, die zu den gemessenen Signalen führen. Die Anzahl der in lebenden Zellen exprimierten Fluorophore variiert jedoch von Zelle zu Zelle und ist unbekannt. Der sogenannte α-Faktor charakterisiert die relativen Signalstärken eines einzelnen angeregten Donor- und Akzeptormoleküls. Die Kenntnis des Faktors ist eine Voraussetzung für quantitative ratiometrische FRET-Messungen in Proben mit variablen Akzeptor-zu-Donor-Molekül-Verhältnissen, wie sie bei der Bildgebung lebender Zellen mit fluoreszierenden Proteinen auftreten. Die Verwendung eines 1-zu-1-Donor-Akzeptor-Fusionsproteins als Kalibriersonde ermöglicht die Bestimmung des α Faktors und dient gleichzeitig als Positivkontrolle. Diese genetisch gekoppelte Sonde wird von Zellen in unbekannten Gesamtmengen, aber in einer festen und bekannten relativen Menge von eins zu eins exprimiert. Das folgende Protokoll beschreibt, wie die 1-zu-1-Sonde aufgebaut und zur Quantifizierung der FRET-Effizienz verwendet wird. Eine Tabelle, die alle Formeln enthält, finden Sie in der Beilage und kann von den Lesern verwendet werden, um ihre eigenen Maße in die jeweiligen Spalten einzugeben, wie unten beschrieben.
Während das Protokoll das GFP-Cherry-Donor/Akzeptor-Paar verwendet, kann der vorgestellte Ansatz mit jedem anderen FRET-Paar durchgeführt werden. Die Zusatzdatei 1 enthält Details zu cyan-gelben Paaren.
Protokoll
1. Plasmid-Konstruktion
- Verwenden Sie zur Erzeugung der eGFP-mCherry1-Fusionssonde einen N1-Säugetierzellexpressionsvektor (siehe Materialtabelle) mit mCherry110, der unter Verwendung der Restriktionsstellen AgeI und BsrGI eingefügt wird.
- Verwenden Sie die folgenden Oligonukleotide, um eGFP11 ohne Stoppcodon als SalI-BamHI-Fragment zu amplifizieren: N-terminaler Primer 5'-AAT TAA CAG TCG ACG ATG GTG AGC AAG GGC GAG G 3' und C-terminaler Primer 5'-AAT ATA TGG ATC CCG CTT GTA CAG CTC GTC CAT GC 3'.
- Setzen Sie dieses SalI-BamHI-Fragment in die multiple Klonierungsstelle des N1-Vektors ein, um einen RNPPV-Linker (fünf Aminosäuren) zwischen dem grün und rot fluoreszierenden Protein einzuführen.
HINWEIS: Dieser Linker ergibt eine mittlere FRET-Effizienz für das GFP-Cherry-Donor-Akzeptor-Paar von etwa 0,25 -0,3 (Abbildung 1A). Die Wahl von steifen12 - undhelikalen 13-Linkern unterschiedlicher Länge zur maßstabsgetreuen gemessenen FRET-Effizienz wurde an anderer Stelle diskutiert, ist aber für unseren Zweck des Fusionsproteins nicht erforderlich. Der Einfachheit halber nennen wir die fluoreszierenden Proteine "GFP" und "Cherry".
2. Zellkultur und Transfektion
- Verwenden Sie eine beliebige Zelllinie, z. B. NRK-Zellen, für FRET-Experimente in Medien, z. B. Dulbeccos modifizierte Eagle-Medien (DMEM), ohne Phenolrot, um die Hintergrundfluoreszenz zu reduzieren. Aus dem gleichen Grund wird die Verwendung von phenolrotfreiem Trypsin empfohlen.
- Sobald die Zellen zu 80 % konfluent sind, trennen Sie die Zellen mit 1 ml 0,05 % Trypsin-EDTA, zählen Sie die Anzahl der in Suspension befindlichen Zellen mit einer Neubauer-Kammer und säen Sie etwa 10.000 Zellen pro Vertiefung eines Deckglases mit 8 Well-Kammern. Verwenden Sie alternativ aus einer konfluenten Zellkultur, die in einem T25-Kolben gezüchtet wurde, 1 Tropfen Zellsuspension aus einer 2-ml-Pipette oder 3 Tropfen aus einer 5-ml-Zellsuspension aus einer konfluenten Kultur, die in einem T-12,5-Zell-Kulturkolben gezüchtet wurde.
- Züchten Sie Zellen in 8-Well-Kammern (0,8 cm 2 / Well) mit #1,0 Deckglas für die Fluoreszenz-Lebendzellmikroskopie unter Standard-Zellkulturbedingungen (37°C und 5% CO2).
- 24 h nach der Beschichtung werden die Zellen mit einem geeigneten handelsüblichen Transfektionsmedium (siehe Materialtabelle) mit GFP, Kirsche, GFP/Kirsch-Mischung (1:1-Mischung, d. h. 0,8 μg und 0,8 μg GFP- und Kirschplasmid-DNA) und der GFP-Kirsch-Chimäre transfizieren.
- Verwenden Sie für die Transfektion 5 μl des Transfektionsreagenzes in 45 μl DMEM und 1,6 μg Plasmid-DNA. Rühren Sie um, indem Sie das Mikrozentrifugenröhrchen vorsichtig betätigen.
- Nach 15-minütiger Inkubation der Mischung bei Raumtemperatur 1-2 μl der Transfektionsreagenzmischung in jede Vertiefung des 8-Well-Objektträgers geben. Legen Sie das gekammerte Deckglas wieder in den Inkubator.
- Lassen Sie 20 Stunden nach der Transfektion verstreichen, bevor Lebendzell-Bildgebung durchgeführt wird, um eine ordnungsgemäße fluoreszierende Proteinexpression, Faltung und Reifung, insbesondere des roten Fluorophors, zu ermöglichen.
3. FRET-Bildgebung
- Abbildung transfizierter Zellen in einer befeuchteten und beheizten Klimakammer bei 37 °C. Um das Zellmedium bei einem physiologischen pH-Wert zu puffern, verwenden Sie CO 2 -Gas, das auf 5 % Durchfluss eingestellt ist, oder fügen Sie 20 mM HEPES hinzu, um das Zellmedium CO2 -unabhängig zu machen.
- Verwenden Sie ein konfokales Laser-Scanning-Mikroskop. Stellen Sie die Anregung und Emission wie folgt ein, um das Signal zu optimieren und das Übersprechen zu minimieren.
- Verwenden Sie die 488-nm-Linie des Argon-Ionenlasers, um GFP anzuregen, und den diodengepumpten 561-nm-Festkörperlaser (oder den 543-nm-Helium-Neon-Laser, abhängig von den verfügbaren Laserlinien), um Cherry anzuregen.
- Stellen Sie Folgendes in der Software eines kommerziellen konfokalen Mikroskops ein. Stellen Sie den dichroitischen Spiegel auf 488/561 ein, indem Sie über das Pulldown-Menü klicken. Sammeln Sie Fluoreszenz mit 488-nm-Laserlicht zur Anregung in Kanal 1 durch ein Emissionsband von 505 - 530 nm (oder 505 - 550 nm) und in Kanal 2 mit einem Langpassfilter >585 nm und verwenden Sie das 561-nm-Laserlicht zur Anregung in Kanal 3 mit einem Langpassfilter > 585 nm (Typ-in-Wellenlängen). Es können auch Bandpassfilter wie z.B. 590 - 650 nm oder ähnliches verwendet werden, die den Vorteil haben, Raman-Streuung auszuschließen.
- Stimulieren Sie mit den beiden Lasern nacheinander und stellen Sie den Bildgebungsmodus nach jeder Zeile auf Switch ein, so dass sich die Anregung des 512 x 512-Pixel-Bildes nach jeder Zeile abwechselt (und nicht nach jedem Bild, was die Fähigkeit zur Erkennung von FRET aufgrund der Diffusion der markierten Proteine aufheben würde, während die Bilder mit unterschiedlichen Anregungen aufgezeichnet werden; Klicken Sie auf die Schaltfläche).
- Richten Sie eine Mini-Zeitserie von drei Bildern per Tastenklick ein, um zu erkennen, ob ein signifikantes Photobleaching auftritt, und reduzieren Sie möglicherweise die Laserleistung. Optimal ist ein Photobleaching von weniger als 1%. Eine hohe Laserintensität kann auch zu einer Absorptionssättigung führen, die den scheinbaren FRET-Wirkungsgradverringert 14. Laserleistungen von bis zu 10-20 μW, gemessen an der Objektivlinse, sind sicher in der Anwendung.
- Erstens, Bildzellen, die das GFP-Cherry-Fusionskonstrukt exprimieren. Stellen Sie die Parameter ein, die die zeitintegrierte Laserintensität pro Pixel in einem konfokalen Bild definieren, d. h. die Pixelverweilzeit in Mikrosekunden, die akusto-optische Durchstimmungsfilter-Transmission (AOTF) in Prozent und den Zoom.
- Bildzellen mit einem 63-fachen Ölobjektiv und einem auf 3-fach eingestellten Zoom. Dies bietet eine ausreichende Vergrößerung und Auflösung, um Zellen in ihrer Gesamtheit abzubilden. Streben Sie eine Pixelgröße von 70-80 nm an.
- Stellen Sie die Pixelverweilzeit für den 488-nm- und 561-nm-Laser auf 2-4 μs und AOTF-Übertragung ein, so dass die Bilder ein gutes Signal-Rausch-Verhältnis ohne Ausbleichen und keine Pixel aufweisen, die eine Fluoreszenzintensitätssättigung aufweisen. Es ist vorteilhaft, die Laserleistung von 488 und 561 so einzustellen, dass die Signalpegel in Kanal 1 und Kanal 3 ähnlich sind.
- Stellen Sie die Verstärkung des Photomultipliers (Mittelungsmodus) auf 600-800 ein.
- Stellen Sie sich mit diesen Einstellungen 15-20 Zellen vor, die das GFP-Cherry-Fusionsprotein exprimieren. 15-20 Zellen liefern gute Statistiken, während die Gesamtzeit einer FRET-Messsitzung auf wenige Stunden begrenzt bleibt, um die Stabilität des mikroskopischen Aufbaus zu gewährleisten.
- Bild mit den gleichen Einstellungen: Zellen, die GFP, Cherry, GFP und Cherry exprimieren, und nicht transfizierte Zellen. Suchen Sie nach exprimierenden Zellen im grünen bzw. roten Kanal.
- Stellen Sie dann 15-20 Zellen dar, die Proteine von Interesse koexprimieren, die an GFP bzw. Cherry gekoppelt sind. Vermeiden Sie bei der Suche nach exprimierenden Zellen eine lange Exposition der Zellen, um die fluoreszierenden Proteine nicht zu bleichen. Cherry hat eine geringere Photostabilität als GFP, und das Bleichen von Cherry, dem Akzeptor, beeinträchtigt die FRET-Analyse.
ANMERKUNG: Die Absorptions- und Emissionsspektren von GFP und Cherry sind in der ergänzenden Abbildung 1 dargestellt. Nach einer Messung von 5-6 h ist es ratsam, die Bildgebung einiger Zellen, die die GFP-Cherry-Chimäre exprimieren, am Ende der Bildgebungssitzung zu wiederholen, um zu dokumentieren, dass der Aufbau stabil blieb und sich die nachgewiesenen FRET-Wirkungsgrade des GFP-Cherry-Fusionsproteins im Verlauf einer Bildgebungssitzung nicht signifikant veränderten.
4. Bildanalyse zur Erkennung absoluter FRET-Wirkungsgrade mittels Donor-Quenching und sensibilisierter Emission
HINWEIS: Hier finden Sie eine praktische Schritt-für-Schritt-Anleitung zur Bestimmung der FRET-Effizienz mithilfe der beigefügten Tabelle (Ergänzende Datei 2). Theorie und Herleitung der vorgestellten Gleichungen finden Sie ausführlich in den vorangegangenen Veröffentlichungen 4,15,16,17. Mit den beschriebenen Einstellungen werden die folgenden Fluoreszenzintensitäten erfasst.
- Messen Sie das Donorsignal I 1 in Kanal 1, dem Donorkanal, mit 488 nm Anregung und einer Emissionsbande von 505-530 nm.
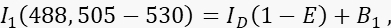
wobei ID das ungelöschte Donorsignal in Kanal 1 ist, das in Abwesenheit eines Akzeptors gemessen würde, die mittlere FRET-Effizienz und B 1 das durchschnittliche Hintergrundsignal in Kanal 1 ist. - Messen Sie das Akzeptorsignal I 3 in Kanal 3, dem Akzeptorkanal, mit 561 nm Anregung und Emission bei >585 nm.
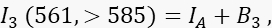
wobei IA das Akzeptorsignal und B 3 der Hintergrund in Kanal 3 ist. - Messen Sie das FRET-Signal in Kanal 2, dem Übertragungskanal, mit 488 nm Anregung und Emission bei >585 nm.
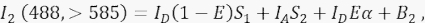
Dabei ist das Signal in Kanal 2 eine Summe aus vier verschiedenen Komponenten: (i) I D(1 - E)S1 ist der spektrale Überlauf vom gelöschten Donorsignal in den >585-Detektionskanal (mit dem Übersprechfaktor S1), (ii) IAS2 ist das Akzeptorsignal aus der direkten Anregung durch 488-nm-Licht (mit dem Übersprechfaktor S2), (iii) IDEα ist die sensibilisierte Emission des Akzeptors durch FRET aus dem angeregten Donormolekül (α wird in 4.8. - 4.10. näher beschrieben), und (iv) B2 ist das Hintergrundsignal. - Messen Sie die durchschnittlichen Hintergrundintensitäten in den Kanälen 1, 2, 3 in nicht transfizierten oder simulierten Zellen; Beides ist mit vernachlässigbarem Unterschied in Ordnung. Verwenden Sie für alle Zellmessungen das Freihandwerkzeug, um Interessenregionen abzugrenzen und perinukleäre Vesikel mit erhöhter Autofluoreszenz zu vermeiden. Es ist wichtig, eine signifikante Autofluoreszenz dieser perinukleären Vesikel zu vermeiden.
- Geben Sie die Messungen in die Spalten X, Y und Z der bereitgestellten Tabelle ein. Die durchschnittlichen Hintergrundintensitäten in den 3 Kanälen werden in A2, B2 und C2 der Excel-Tabelle (Ergänzungsdatei 2) eingegeben.
- Messen Sie die durchschnittlichen Intensitäten in den Kanälen 1, 2, 3 von Zellen, die nur GFP oder Cherry exprimieren, und geben Sie die Messungen in die Spalten C, D, E und N, O, P ein.
- Um E, den FRET-Wirkungsgrad, zu berechnen, bestimmen Sie die Übersprechfaktoren S 1 und S2. Der spektrale Übersprechfaktor S1 wird aus Zellen berechnet, die nur GFP exprimieren
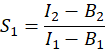
in Spalte I. Geben Sie den Mittelwert für S1 in die Zelle D2 der Excel-Tabelle ein. - Berechnen Sie den spektralen Übersprechfaktor S2 aus Zellen, die nur Cherry exprimieren
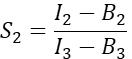
in Spalte T. Geben Sie den Mittelwert für S2 in die Zelle E2 der Excel-Tabelle ein. - Stellen Sie sicher, dass der α-Faktor das Signal einer beliebigen Anzahl von angeregten GFP-Molekülen in Kanal 1 mit dem Signal einer gleichen Anzahl von angeregten Cherry-Molekülen in Kanal 2 in Beziehung setzt und definiert ist durch
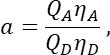

wobei Q A und QD die Fluoreszenzquantenausbeuten von Cherry und GFP sind; ηA und ηD die Detektionseffizienz der Akzeptor- und Donorfluoreszenz in den Kanälen 2 bzw. 1.
ANMERKUNG: Der α Faktor konnte aus zwei Proben bestimmt werden, die bekannte absolute Mengen an GFP und Cherry ausdrücken. Es ist jedoch unmöglich, die genaue Menge an GFP und Cherry zu kennen, die in einer Zelle exprimiert wird. Daher haben wir den Faktor berechnet, indem wir Zellen verwendet haben, die das GFP-Cherry-Fusionsprotein exprimieren. Während hier die absolute Menge noch unbekannt ist, ist bekannt, dass das Verhältnis von Donor- und Akzeptormolekülen eins ist. - Messen Sie die durchschnittlichen Intensitäten in den Kanälen 1, 2, 3 von Zellen, die das GFP-Cherry-Fusionsprotein exprimieren, und geben Sie die Messungen in die Spalten AE, AF, AG ein. Hintergrundintensitäten werden subtrahiert (in AH, AI, AJ).
- Berechnen Sie den α-Faktor (AJ-Säule) aus den Fluoreszenzintensitäten in Kanal 1, 2 und 3 des GFP-Cherry-Fusionsproteins wie folgt:
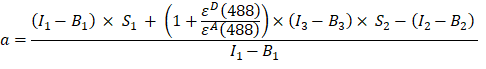
- Hintergrundkorrigierte Intensitäten, die in Kanal 1 (I 1 - B 1), 2 (I 2 - B 2) bzw. 3 (I 3 - B3) gemessen werden, werden mit der GFP-Cherry-Chimäre gemessen. Der spektrale Übersprechfaktor S1 wurde unter Verwendung von Zellen bestimmt, die nur GFP exprimieren (siehe 4.7.). εD und ε A sind die Extinktionskoeffizienten von GFP, dem Donor, und Cherry, dem Akzeptor, bei 488 nm und können aus der Literatur (ε GFP = 53.000 M-1 cm-1)18 und der Absorptionskurve von Kirsche (εKirsche ≈ 5560 M-1cm 1) bestimmt werden. Das Verhältnis
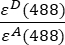 wurde in Zelle G2 der Excel-Tabelle eingegeben. Geben Sie den Mittelwert für den α Faktor in J2 ein.
wurde in Zelle G2 der Excel-Tabelle eingegeben. Geben Sie den Mittelwert für den α Faktor in J2 ein. - Verwenden Sie den ermittelten α Faktor für die Berechnung des FRET-Wirkungsgrads E wie folgt (Spalte AK):
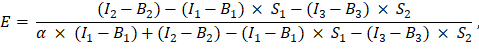
- Alternativ können Sie die FRET-Effizienz E für die Negativkontrollen bestimmen, d. h. die Koexpression von GFP und Cherry und die Expression von GFP allein, indem Sie die Messungen der Kanäle 1, 2 und 3 in der Excel-Tabelle in Spalte AD, AE und AF unter den GFP-Cherry-Fusionsproteinmessungen addieren. Bestimmen Sie die FRET-Effizienz zwischen den GFP- und Cherry-markierten Proteinen auf die gleiche Weise.
- Bestimmen Sie die Intensität des ungelöschten Donors, I D als (I 1 - B 1)/(1 - E), und die Akzeptorintensität als I A = I 3 - B3; Diese Werte sind proportional zu den Expressionsniveaus der markierten Proteine.
- Bestimmen Sie das korrigierte Akzeptor-zu-Donor-Intensitätsverhältnis (Q) des GFP-Cherry-Fusionsproteins wie folgt (Spalte AL):

- Berechnen Sie für andere co-transfizierte Zellen das Akzeptor-zu-Donor-Molekülverhältnis N A/ND wie folgt:
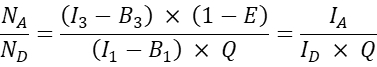
HINWEIS: Der Grund für die Bestimmung des N A / N-D-Verhältnisses und die Darstellung der mittleren zellulären FRET-Effizienz E im Vergleich zu NA /N D ist, dass ein Donormolekül Energie auf mehrere Akzeptoren übertragen kann, während ein Akzeptormolekül nur Energie von einem Donor zu einem bestimmten Zeitpunkt erhalten kann. Selbst wenn aufgrund der Stöchiometrie der Wechselwirkung nur ein Akzeptor mit einem Spender interagieren kann, wird erwartet, dass eine Erhöhung der Akzeptorkonzentration aufgrund des Gesetzes der Massenwirkung den Anteil der Spender im Komplex mit dem Akzeptor erhöht. Daher sollte bei einer festen (oder engen Reichweite) der Spenderexpression die FRET-Effizienz mit zunehmendem N A/ND steigen. Bei der Darstellung der FRET-Effizienz E versus N A/N D für die Co-Expression von GFP und Cherry, d.h. der negativen Sonde, sollte eine Erhöhung der N A/N D jedoch nicht zu einer Erhöhung der FRET-Effizienz führen (zumindest bei ausreichend niedrigen Akzeptorkonzentrationen, bei denen aufgrund der Nähe von Akzeptorfarbstoffen zu Donorfarbstoffen keine zufällige FRET auftritt).
Ergebnisse
Abbildung 1 zeigt die Bilder, die im Donorkanal, Kanal 1 (488, 505-530 nm), im Übertragungskanal Kanal 2 (488, >585 nm) bzw. im Akzeptorkanal, Kanal 3 (561, >585 nm), erhalten wurden. Repräsentative Bilder von Zellen, die nur GFP exprimieren, nur Kirsche exprimieren, GFP und Kirsche co-exprimieren und das GFP-Kirsch-Fusionsprotein exprimieren. Die mittleren zellulären FRET-Wirkungsgrade, die in NRK-Zellen berechnet wurden, die GFP-Cherry-Fusionsprotein exp...
Diskussion
Das vorgestellte Protokoll beschreibt die Verwendung der genetisch gekoppelten Eins-zu-Eins-Fluoreszenzprotein-Kalibrierungssonde zur Quantifizierung von FRET unter Verwendung des Nachweises der sensibilisierten Emission des Akzeptors und des Quenchings des Donormoleküls durch konfokale Mikroskopie. Diese Methode kann angewendet werden, um Proteininteraktionen im physiologischen Kontext der lebenden Zelle in verschiedenen subzellulären Kompartimenten zu bewerten. Die räumliche Auflösung kann weiter verbessert werden,...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Wir danken dem Neuroscience Imaging Service der Stanford University School of Medicine für die Bereitstellung von Ausrüstung und Raum für dieses Projekt. Diese Forschung wurde durch intramurale Mittel des Stanford Cancer Institute und der Abteilung für gynäkologische Onkologie Stanford sowie durch GINOP-2.3.2-15-2016-00026, GINOP-2.3.3-15-2016-00030, NN129371, ANN135107 des Nationalen Büros für Forschung, Entwicklung und Innovation, Ungarn, unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.5% Trypsin-EDTA without phenol red (10x) | Thermo Fisher Scientific | 15400054 | |
| Clontech mCherry N1 vector | Addgene | 3553 | |
| DMEM without phenol red | Thermo Fisher Scientific | 11054020 | |
| Fugene 6 | Promega | E2691 | |
| HEPES | Thermo Fisher Scientific | 15630080 | |
| LabTek 8-well chambers #1.0 | Thermo Fisher Scientific | 12565470 | |
| L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 |
Referenzen
- Förster, T. Zwischenmolekulare Energiewanderung und Fluoreszenz. Annal der Physik. 437, 55-75 (1948).
- Jovin, T. M., Arndt-Jovin, D. J. Luminescence digital imaging microscopy. Annual Review of Biophysics and Biophysical Chemistry. 18, 271-308 (1989).
- Mekler, V. M. A photochemical technique to enhance sensitivity of detection of fluorescence resonance energy transfer. Photochemistry and Photobiology. 59, 615-620 (1994).
- Vamosi, G., et al. Conformation of the c-Fos/c-Jun complex in vivo: A combined FRET, FCCS, and MD-modeling study. Biophysical Journal. 94 (7), 2859-2868 (2008).
- Renz, M., Daniels, B. R., Vamosi, G., Arias, I. M., Lippincott-Schwartz, J. Plasticity of the asialoglycoprotein receptor deciphered by ensemble FRET imaging and single-molecule counting PALM imaging. Proceedings of the National Academy of Science U. S. A. 109 (44), 2989-2997 (2012).
- van Rheenen, J., Langeslag, M., Jalink, K. Correcting confocal acquisition to optimize imaging of fluorescence resonance energy transfer by sensitized emission. Biophysical Journal. 86 (4), 2517-2529 (2004).
- Muller, S. M., Galliardt, H., Schneider, J., Barisas, B. G., Seidel, T. Quantification of Forster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Sciences. 4, 413 (2013).
- Gates, E. M., LaCroix, A. S., Rothenberg, K. E., Hoffman, B. D. Improving quality, reproducibility, and usability of FRET-based tension sensors. Cytometry Part A. 95 (2), 201-213 (2019).
- Menaesse, A., et al. Simplified instrument calibration for wide-field fluorescence resonance energy transfer (FRET) measured by the sensitized emission method. Cytometry Part A. , 24194 (2020).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nature Biotechnology. 22 (12), 1567-1572 (2004).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein (GFP). Gene. 173, 33-38 (1996).
- Nagy, P., et al. Novel calibration method for flow cytometric fluorescence resonance energy transfer measurements between visible fluorescent proteins. Cytometry Part A. 67 (2), 86-96 (2005).
- Arai, R., Ueda, H., Kitayama, A., Kamiya, N., Nagamune, T. Design of the linkers which effectively separate domains of a bifunctional fusion protein. Protein Engineering. 14 (8), 529-532 (2001).
- Szendi-Szatmari, T., Szabo, A., Szollosi, J., Nagy, P. Reducing the detrimental effects of saturation phenomena in FRET microscopy. Analytical Chemistry. 91 (9), 6378-6382 (2019).
- Tron, L., et al. Flow cytometric measurement of fluorescence resonance energy transfer on cell surfaces. Quantitative evaluation of the transfer efficiency on a cell-by-cell basis. Biophysical Journal. 45 (5), 939-946 (1984).
- Sebestyen, Z., et al. Long wavelength fluorophores and cell-by-cell correction for autofluorescence significantly improves the accuracy of flow cytometric energy transfer measurements on a dual-laser benchtop flow cytometer. Cytometry. 48 (3), 124-135 (2002).
- Szaloki, N., et al. High throughput FRET analysis of protein-protein interactions by slide-based imaging laser scanning cytometry. Cytometry Part A. 83 (9), 818-829 (2013).
- McRae, S. R., Brown, C. L., Bushell, G. R. Rapid purification of EGFP, EYFP, and ECFP with high yield and purity. Protein Expression and Purification. 41 (1), 121-127 (2005).
- Kremers, G. J., Goedhart, J., van Munster, E. B., Gadella, T. W. Cyan and yellow super fluorescent proteins with improved brightness, protein folding, and FRET Forster radius. Biochemistry. 45 (21), 6570-6580 (2006).
- Bajar, B. T., Wang, E. S., Zhang, S., Lin, M. Z., Chu, J. A Guide to Fluorescent Protein FRET Pairs. Sensors (Basel). 16 (9), (2016).
- Scott, B. L., Hoppe, A. D. Optimizing fluorescent protein trios for 3-Way FRET imaging of protein interactions in living cells. Science Reports. 5, 10270 (2015).
- Chen, Y. C., Spring, B. Q., Clegg, R. M. Fluorescence lifetime imaging comes of age how to do it and how to interpret it. Methods Molecular Biology. 875, 1-22 (2012).
- King, C., Sarabipour, S., Byrne, P., Leahy, D. J., Hristova, K. The FRET signatures of noninteracting proteins in membranes: Simulations and experiments. Biophysical Journal. 106 (6), 1309-1317 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten