Method Article
Herstellung und Kryo-FIB-Mikrobearbeitung von Saccharomyces cerevisiae für die Kryo-Elektronentomographie
In diesem Artikel
Zusammenfassung
Wir präsentieren ein Protokoll zur Lamellenpräparation von gefrorenen biologischen Proben mittels kryofokussiertem Ionenstrahl-Mikrobearbeitung für hochauflösende Strukturstudien von Makromolekülen in situ mit Kryo-Elektronentomographie. Das vorgestellte Protokoll enthält Richtlinien für die Herstellung von hochwertigen Lamellen mit hoher Reproduzierbarkeit zur strukturellen Charakterisierung von Makromolekülen innerhalb der Saccharomyces cerevisiae.
Zusammenfassung
Heute ist die Kryo-Elektronentomographie (Kryo-ET) die einzige Technik, die strukturnahe Daten über makromolekulare Komplexe in situliefern kann. Aufgrund der starken Wechselwirkung eines Elektrons mit der Materie beschränken sich hochauflösende Kryo-ET-Studien auf Proben mit einer Dicke von weniger als 200 nm, was die Anwendbarkeit von Kryo-ET nur auf die peripheren Regionen einer Zelle beschränkt. Ein komplexer Workflow, der die Vorbereitung dünner zellulärer Querschnitte durch kryofokussierte Ionenstrahlmikrobearbeitung (Kryo-FIBM) umfasst, wurde in den letzten zehn Jahren eingeführt, um die Erfassung von Kryo-ET-Daten aus dem Inneren größerer Zellen zu ermöglichen. Wir präsentieren ein Protokoll zur Herstellung von zellulären Lamellen aus einer Probe, die durch Tauchgefrieren unter Verwendung von Saccharomyces cerevisiae als prototypisches Beispiel einer eukaryotischen Zelle mit breiter Nutzung in der zellulären und molekularbiologischen Forschung verglast wurde. Wir beschreiben Protokolle zur Vitrifikation von S. cerevisiae in isolierte Flecken einiger Zellen oder eine kontinuierliche Monoschicht der Zellen auf einem TEM-Gitter und stellen für diese beiden Proben ein Protokoll zur Lamellenpräparation mittels Kryo-FIB zur Verfügung.
Einleitung
Jüngste Technologie- und Softwareentwicklungen haben die Elektronen-Kryomikroskopie (Kryo-EM) von verglasten biologischen Proben zu einer der Schlüsseltechniken in der strukturbiologischen Forschung in den letzten zehn Jahren gemacht1,2. Die Herstellung einer Probe für Kryo-EM besteht in der Regel aus dem Auftragen eines gereinigten Proteins oder eines Proteinkomplexes mit Nukleinsäure auf den Probenträger (TEM-Gitter), gefolgt von der Entfernung des größten Teils der Flüssigkeit mit einem Filterpapier und dem Einfrieren des Gitters mit der restdünnen Schicht einer Probe in flüssiges Ethan oder Propan3 . Die Probe wird somit in einer dünnen Schicht (typischerweise <80 nm) amorphen Puffers in einem vollständig hydratisierten Zustand, unter nahezu nativen Bedingungen und ohne chemische Fixierung oder Schwermetallkontrast fixiert. Die Abbildung der strukturell homogenen Probe im Transmissionselektronenmikroskop liefert dann Daten, die zur Bestimmung der dreidimensionalen Struktur des Makromoleküls bei nahezu atomarer Auflösung mit einem Einzelpartikelanalyseprotokoll2verwendet werden können. Eine solche in vitro Struktur entspricht der Darstellung des Makromoleküls unter den Bedingungen und der Behandlung, die während der Probenvorbereitung verwendet werden. Obwohl die unter den In-vitro-Bedingungen ermittelten Strukturen in der Regel dem voll funktionsfähigen Zustand des Makromoleküls entsprechen, würde die Fähigkeit, räumliche Beziehungen zwischen verschiedenen Makromolekülen innerhalb der Zelle abbilden, einen zusätzlichen funktionalen Kontext zu den Strukturdaten liefern.
Die Kryo-Elektronentomographie (Kryo-ET) wird verwendet, um 3D-Volumina pleomorpher Objekte oder makromolekularer Komplexe in situ4,5zurekonstruieren. Der Vorteil von Kryo-ET besteht darin, dass die dreidimensionale Information durch Die Abbildung einer einzelnen Entität erhalten wird. Die Auflösung, mit der einzelne makromolekulare Komplexe oder Organellen beobachtet werden, ist jedoch sehr begrenzt. Daher ist eine Mittelung der Makromoleküle (Sub-Tomogramm-Mittelung, STA) mit der gleichen Struktur aus einer größeren Anzahl von Tomogrammen notwendig, um 4-8 Å-Auflösungsmodelle aus den Kryo-ET-Daten6,7zu erreichen. Kürzlich wurde gezeigt, dass Kryo-ET und STA auch zur Bestimmung hochauflösender Strukturen makromolekularer Maschinen wie Ribosomen im Kontext der zellulären Umgebung eingesetzt werden können7. Der Einsatz der Transmissionselektronenmikroskopie ist jedoch durch die Probendicke begrenzt. Im Allgemeinen ist dies kein Problem für Einzelpartikel-Kryo-EM, wo die Optimierung der Vitrifikationsbedingungen schließlich zur Einbettung der Probe in eine dünne Eisschicht führen kann. Auf der anderen Seite sind die meisten Zellen für den 300 keV Elektronenstrahl tatsächlich nicht elektronentransparent. Der unelastische mittlere freie Weg in den verglasten biologischen Proben für die 300 keV-Elektronen beträgt etwa 395 nm8, was bedeutet, dass Kryo-ET-Studien für die meisten Zellen auf die zelluläre Peripherie beschränkt sind.
Es wurden verschiedene Techniken entwickelt, um die Probe auf eine ausreichende Dicke für Kryo-ET zu verdünnen. Die Kryo-Ultramikrotomie nutzt das mechanische Schneiden der Probe mit einem Diamantmesser bei der Temperatur des flüssigen Stickstoffs (-196 °C), um 60-80 nm dicke Abschnitte bereitzustellen, die für Kryo-ET9,10,11geeignet sind. Mehrere Schnitte können aus einer einzigen Zelle vorbereitet werden und die Datenanalyse kann schließlich 3D-Strukturinformationen für den größeren Teil der Zelle erzeugen. Das mechanische Slicing kann jedoch mehrere Artefakte wie gekrümmte Abschnitte, Spalten oder Probenkompression verursachen, die die resultierende Struktur beeinflussen und die Kryo-ET-Daten verzerren können10,11,12. Die kryofokussierte Ionenstrahlmikrobearbeitung (Kryo-FIBM) stellt einen alternativen Ansatz dar, bei dem ein dünner Zellschnitt durch allmähliche Ablation der Probe unter Verwendung eines fokussierten Strahls von Ga+ Ionen (FIB) in einem mehrstufigen Prozess hergestellt wird, was zu einem 80–300 nm dicken zellulären Querschnitt (Lamelle) führen kann13,14,15 . Im Gegensatz zur Kryo-Ultramikrotomie wird nur eine Lamelle aus einer einzigen Zelle hergestellt, die ~ 0,3-3% ihres Volumens ausmacht, und die Mikrobearbeitung mehrerer Zellen ist in der Regel notwendig, um einen Bereich von Interesse im gefrästen Querschnitt zu finden. Darüber hinaus ist der Durchsatz des gesamten Workflows heutzutage noch recht gering, oft beschränkt auf 6-8 hochwertige Lamellen aus einer 8-stündigen Kryo-FIBM-Sitzung. Zum anderen sind die Kryo-FIBM-Querschnitte frei von jeglichen Kompressionsartefakten und bieten einen geeigneten Eingang für hochauflösendes Kryo-ET. Darüber hinaus ist die Übertragung der Lamelle auf den Probenträger für Kryo-ET nicht notwendig, da die Probe während des gesamten Lamellenvorbereitungsprozesses auf dem TEM-Gitter zurückgehalten wird und dasselbe Gitter anschließend auf TEM übertragen werden kann. Wir gehen davon aus, dass der Durchsatz des Kryo-FIBM bald deutlich verbessert wird, vor allem durch die Verfügbarkeit von Software für das unbeaufsichtigte Lamellenfräsen16,17 und die Verwendung von FIBs, die nach dem Prinzip des Charge-Couple-Plasmas arbeiten, was eine schnellere Materialablation ermöglicht.
Saccharomyces cerevisiae (Hefe) sind eukaryotische Zellen mit Kugelform und Durchmesser von ~2-5 μm. Dank ihrer Größe, Zugänglichkeit, Genetik, Generationszeit und einfachen Manipulation wird die Hefe als eukaryotischer Modellorganismus in der zell- und molekularbiologischen Forschung umfassend untersucht, ähnlich wie Escherichia coli,die als prokaryotischer Modellorganismus in der Bakteriologie gut untersucht ist. Die Hefe kann leicht in Suspension kultiviert werden und in kurzer Zeit wird eine hohe Menge an Zellen erzeugt (Verdopplungszeit 1 – 2 Stunden). Noch wichtiger ist, dass Hefe eine komplexe interne Zellstruktur mit tierischen und pflanzlichen Zellen teilt, während sie ein kleines Genom behält, das aus einem geringen Gehalt an nicht-kodierender DNA besteht. Die strukturelle Charakterisierung des Hefeproteoms aus den hochauflösenden In-situ-Daten kann somit helfen, eine mechanistische Beschreibung für die umfangreiche Menge an funktionellen Daten in der Literatur zu liefern.
Hiermit stellen wir ein umfassendes Protokoll für die Erfassung von in situ Kryo-ET-Daten an der Hefeprobe zur Verfügung, das alle Schritte von der Probenkultivierung über die Kryo-FIBM-Lamellenvorbereitung bis hin zum Probentransfer zu TEM zur Kryo-ET-Datenerfassung abdeckt.
Protokoll
1. Kultivierung und Herstellung von Saccharomyces cerevisiae Zellen zur Vitrifikation
- Bereiten Sie flüssiges Wachstumsmedium für Saccharomyces cerevisiaevor.
- Autoklavieren Sie eine 500 ml Glasflasche zur Herstellung des Wachstumsmediums.
- Wiegen Sie 2,2 g Hefeextrakt (1,1%) und 4,4 g Pepton (2,2%) und mischen Sie 200 ml Wasser ein.
- Durch Autoklavieren 15 min bei 121 °C sterilisieren.
- Wiegen Sie 10 g Glukosepulver und mischen Sie 50 ml Wasser ein, um 20% ige Glukoselösung zu erhalten. Die Lösung durch einen 0,2 μm Filter leiten und bei 4 °C lagern.
- Bereiten Sie festes Medium für Saccharomyces cerevisiaevor.
- 4 g Agarpulver wiegen und mit 200 ml Wachstumsmedium mischen.
- Im Autoklaven 15 min bei 121 °C sterilisieren.
- Kühlen Sie das Medium auf 40-50 °C und fügen Sie 20 mL 20% sterile Glukose hinzu (im vorherigen Schritt zubereitet). Gießen Sie ~20 ml des gesamten Mediums in die Petrischale und lassen Sie es bei Umgebungstemperatur erstarren.
- Die Agarplatten zum Schutz vor Trocknung in Parafilm einwickeln und bei 4 °C lagern.
- Kultur Saccharomyces cerevisiae in Suspension
HINWEIS: Das Protokoll ist für die Vorbereitung einer Probe für Kryo-FIBM aus einer Suspension der Zelllinie Saccharomyces cerevisiae Stamm BY4741 [ATCC 4040002] oder ähnlichen Stämmen optimiert.- Autoklavieren Sie einen 50 mL Erlenmeyerkolben (oder ähnlichen).
- Arbeiten Sie in einer Motorhaube oder laminaren Flow-Box. 10 mL des Wachstumsmediums in einen sterilen 50 mL Erlenmeyerkolben pipetten.
- Ergänzen Sie das Medium mit 1 ml gefilterter 20% Glukose. Wählen Sie eine Hefekolonie aus einer Agarplatte mit einer sterilen Einweg-Impfschleife (1-10 μL).
- Den Erlenmeyerkolben in den Inkubator geben und bei 30 °C unter Rührung (150-200 U/min) züchtigen, bis die exponentielle Phase erreicht ist (ca. 7 h).
HINWEIS: Wir haben beobachtet, dass die exponentielle Phase nach ~ 15 h erreicht wird, wenn Kolonien aus Agarplatten gepflückt werden, die 4 Wochen lang bei Umgebungstemperatur kultiviert wurden. Siehe auch Hinweis unten.
- Kultur Saccharomyces cerevisiae auf einer Agarplatte aus Glycerinvorrat.
- Verwenden Sie eine neue Agarplatte aus dem 4 °C Lager.
- Nehmen Sie die S. cerevisiae-Brühe aus der -80 °C Tiefkühltruhe und legen Sie sie in einen Gefrierständer, um ein vollständiges Auftauen der Brühe zu vermeiden.
- Abkratzen und eine kleine Kultur mit einer sterilen Impfschleife (1-10 μL) auf 50 μL Wachstumsmedium übertragen. Richtig mischen.
- Übertragen Sie das gesamte Volumen der gemischten S. cerevisiae-Kultur und dispergieren Sie es mit einem sterilen Spreizstab über die Oberfläche der Agarplatte.
- Bei 30 °C ca. 48 Stunden inkubieren, bis sich Kolonien mit einem Durchmesser von 1,5-2 mm bilden.
HINWEIS: Es ist ratsam, die Kolonien vor dem Experiment frisch zu kulturieren. Kolonien, die älter als 1 Woche sind, benötigen eine längere Zeit für die Kultivierung in flüssigen Medien, um die exponentielle Wachstumsphase zu erreichen.
- Kultur Saccharomyces cerevisiae auf einem Agarteller.
- Verwenden Sie vorbereitete Agarplatten mit gewachsenen S. cerevisiae-Kolonien.
- 10 ml steriles Wachstumsmedium und 1 ml gefilterte 20% Glukose werden in einen 50 ml Erlenmeyerkolben pipetten.
- Wählen Sie eine Kolonie der S. cerevisiae-Kultur mit einer sterilen Impfschleife und mischen Sie sie mit einem Wachstumsmedium in einem Kolben.
- 50 Minuten bei 30 °C unter Rührung (150-200 U/min) inkubieren.
- Verdünnen Sie die Suspensionskultur zehnmal mit dem Wachstumsmedium und dispergieren Sie 50 μL Suspension auf einer Agarplatte mit einem sterilen Spreizstab.
- Bei 30 °C ca. 48 Stunden inkubieren, bis 1,5-2 mm Kolonien beobachtet werden.
- Wickeln Sie die Ränder der Petrischale mit Parafilm ein, um ein Austrocknen zu verhindern. Bei Raumtemperatur lagern und maximal 4 Wochen verwenden.
- Bereiten Sie Saccharomyces cerevisiae für das Einfrieren in Zellclustern vor.
- Bereiten Sie die S. cerevisiae-Zellkultur gemäß dem Protokoll im Abschnitt Kultivierung von Saccharomyces cerevisiae in Suspension (Abschnitt 1.3) vor und inkubieren Sie ~7 h bei 30 °C unter Rührung (150-200 U/min).
- Messen Sie den OD der S. cerevisiae Zellsuspensionskultur bei 600 nm mit einem UV/Vis-Spektralphotometer.
- Konzentrieren Sie die Zellsuspension auf OD600 = 1.
- Bereiten Sie S. cerevisiae für das Einfrieren in einer Zellmonoschicht vor.
- S. cerevisiae Zellkultur gemäß dem Protokoll im Abschnitt Kultivierung von Saccharomyces cerevisiae Suspension Zellkultur vorbereiten und ~7 h bei 30 °C unter Rühren (150-200 U/min) inkubieren.
- Messen Sie den OD der S. cerevisiae Zellsuspensionskultur bei 600 nm mit einem UV/Vis-Spektralphotometer.
- Die Zellen im Medium in das Zentrifugenröhrchen überführen und 2 Minuten lang vorsichtig mit relativer Zentrifugalkraft (900 x g) drehen.
- Entsorgen Sie das Medium aus dem Zellpellet durch Pipettieren.
- Fügen Sie dem Zellpellet frisches Medium hinzu. Berechnen Sie das Volumen des Mediums, um eine Zellsuspension von OD600 zu erhalten, die 30 bis 60 entspricht.
- Glycerin (50% Stammlösung) wird der Zellsuspension kurz vor der Vitrifikation zu einer Endkonzentration von 5% hinzugefügt.
HINWEIS: Glycerin wirkt als Schutzmittel, das die Qualität des Eises in den Regionen zwischen den Zellen verbessert. Glycerin wird den Zellen erst kurz vor der Vitrifikation zugesetzt, um seine Aufnahme in die Zelle zu minimieren.
2. Vitrifikation der Saccharomyces cerevisiae Probe
- Glühentladungs-TEM-Gitter mit der Carbonfolienseite nach oben für 30-45 s (Druck: 6-9 Pa, Strom: 7 mA).
- Stellen Sie den Verglasungsroboter auf folgende Parameter ein: Temperatur: 18 °C, Luftfeuchtigkeit: 100%, Blot-Zeit: 6 s, Wartezeit: 5 s, Löschzyklus: 1x und Blot-Kraft: 5.
HINWEIS: Die Blotkraft ist ein instrumentenspezifischer Wert und die optimalen Blotkraftwerte können sich bei verschiedenen Maschinen unterscheiden. Der optimale Wert für einen bestimmten Kolben muss experimentell bestätigt werden. - Bereiten Sie flüssiges Ethan für die Vitrifikation vor.
- Montieren Sie das nicht saugfähige Oberflächenpad an dem Blotting-Pad, das der Probe zugewandt ist. Verwenden Sie das Filterpapier für das andere Löschpad.
- Wählen Sie das glühend entladene Gitter mit der Pinzette und montieren Sie die Pinzette am Tauchgefrierinstrument.
- Tragen Sie 3,5 μL S. cerevisiae Suspension auf die Kohlenstoffseite des Gitters in der Kolbenklimakammer auf. Mischen Sie vor jeder Anwendung im Raster richtig.
- Tauchen Sie das Gitter in das flüssige Ethan ein.
- Übertragen Sie das Gitter von flüssigem Ethan auf LN2. Lagern Sie Gitter mit verglasten Zellen unter LN2-Bedingungen oder montieren Sie sie in die TEM-Gitterkartusche, um sie in das FIB-SEM-Mikroskop zu laden.
3. Montage von TEM-Gittern in die Gitterpatrone
HINWEIS: Der hier beschriebene Workflow verwendet die in der Gitterpatrone montierten TEM-Gitter, um die Probenhandhabung und den Transfer zwischen REM- und TEM-Mikroskopen zu erleichtern. Die Patronenbaugruppe besteht aus einem C-Ring, einem TEM-Gitter und einem C-Clip-Ring. Andere Optionen sind verfügbar, wenn Sie mit Instrumenten anderer Mikroskophersteller arbeiten. Der Gitterpatronen-Montagearbeitsplatz ist mit LN2gefüllt. Die LN2 Ebene deckt die Gitterbox mit den TEM-Gittern ab, aber die Montage der TEM-Gitter in die Kartusche erfolgt in LN2-Dämpfen. Es wird dringend empfohlen, während des Vitrifizierungsverfahrens eine schützende Gesichtsmaske oder einen Schutzschild zu tragen, um zu verhindern, dass die Probe durch Kontamination einatmet. Arbeiten Sie nicht mit den Werkzeugen, die eine Eiskontamination angesammelt haben.
- Stellen Sie die Montagearbeitsstation für die Gitterpatrone zusammen und bereiten Sie trockene Werkzeuge für das Clipping vor.
- Kühlen Sie den Montagearbeitsplatz mit LN2ab. Kühlen Sie die Clipping-Werkzeuge auf die Temperatur LN2.
- Legen Sie eine Gitterbox mit einer verglasten Probe in den Montagearbeitsplatz.
- Legen Sie ein TEM-Gitter mit der Probe mit Zellen nach unten zum C-Ring und befestigen Sie es mit einem C-Clip.
- Setzen Sie die abgeschnittenen Patronen in die Gitterbox ein und schließen Sie sie ordnungsgemäß.
- Lagern Sie die Kartuschen im LN2 Dewar oder laden Sie sie in das FIB-SEM-Mikroskop.
4. Laden und Manipulieren der Probe in das FIB-REM-Mikroskop
HINWEIS: Die Anleitung wurde für die Verwendung des Zweistrahlmikroskops Versa 3D geschrieben, das mit dem Kryo-FIB/REM-Präparationssystem PP3010 ausgestattet ist. Alternative Lösungen können unterschiedliche spezifische Parameter erfordern; Das allgemeine Konzept des Workflows sollte jedoch weiterhin gültig sein.
- Kühlen Sie das Mikroskop auf die Temperatur des flüssigen Stickstoffs ab.
- Pumpen Sie die Mikroskopkammer und die Präparationskammer (falls vorhanden) vor Beginn der Abkühlung (< 4 x 10-4 Pa) in ein Hochvakuum, um ein Kontaminationswachstum zu verhindern.
- Stellen Sie den Stickstoffgasstrom für die Präparationskammer, den Mikroskoptisch und den Mikroskop-Antikontaminator auf 5 l/min ein. Warten Sie, bis alle Komponenten eine Temperatur von < -180 °C erreicht haben.
HINWEIS: Das in dieser Studie verwendete FIB-SEM-Mikroskop verwendet gekühltes Stickstoffgas, um seine Stufe und seinen Antikontaminator abzukühlen. Andere Systeme können eine andere Methode zur Stufenkühlung verwenden. Der Kammerdruck erreicht ~3 x 10-5 Pa, sobald bühne und Antikontaminator bei -190 °C auf dem hier verwendeten Gerät sind. Die Wachstumsrate der Kohlenwasserstoff-Kontaminierungsschicht auf der Oberfläche der Lamelle mit dem in dieser Studie verwendeten Versuchsaufbau beträgt ~ 15 nm / Stunde.
- Laden Sie die Gitterkartusche mit der Probe in das Mikroskop.
- Montage und Kühlung der Ladestation auf die Temperatur LN2.
- Legen Sie das Shuttle (Probenhalter), die Gitterbox mit der Probe, den Gitterboxöffner und die Pinzette in die gekühlte Ladestation.
- Die Gitterkartusche vorsichtig mit der Probe nach oben in das Shuttle überführen.
- Drehen Sie das Shuttle im Inneren der Ladestation in die Ladeposition.
- In das Mikroskop laden.
- Optional beschichten Sie die Probe mit Metallschutzschichten.
HINWEIS: Ein starker Ladeeffekt kann beobachtet werden, wenn gefrorenes hydratisiertes biologisches Material SEM abbildet wird. Darüber hinaus führt die Bildgebung biologischer Proben mit FIB (auch bei niedrigen Strömen) zu schnellen Probenschäden. Daher kann eine zusätzliche Beschichtung der Probe im FIB-REM-Mikroskop durchgeführt werden, um die Probenoberfläche zu schützen.- Lagern Sie die Schutzschicht mit metallorganischem Platin durch das Gasinjektionssystem (GIS) ab.
- Stellen Sie die Probe auf die euzentrische Höhe (Koinzidenzpunkt für die Bildgebung mit Elektronen und Ionen).
- Neigen Sie die Bühne zurück auf 45° (Probe um 90° relativ zum Elektronenstrahl geneigt).
- Bewegen Sie die Bühne in der z-Achse4 mm unter die euzentrische Höhe.
- Stellen Sie die GIS-Nadel auf 26–30 °C ein.
- Abscheiden ~300-1000 nm der metallorganischen Platinschicht in das Gitter mit der biologischen Probe (entspricht 30–120 s der GIS-Ablagerung).
HINWEIS: Wir wenden GIS normalerweise für 30 s für Proben mit kleinen zellulären Clustern und 45 s für Proben mit einer Monoschicht der Zellen an.
- Sputterschichten Sie die Probenoberfläche mit einer leitfähigen Metallschicht.
- Lagern Sie ~10 nm der Metallschicht (Ir, Au, Pt) mit einer biologischen Probe in das Gitter ab.
- Lagern Sie die Schutzschicht mit metallorganischem Platin durch das Gasinjektionssystem (GIS) ab.
- Mikroskopparameter für die Lamellenvorbereitung einstellen
- Verwenden Sie für FIB die folgenden Parameter: Hochspannung = 30 kV, Strom = 10 pA (Bildgebung), 10 pA–3 nA (FIB-Fräsen)
- Verwenden Sie für REM die folgenden Parameter: Hochspannung = 2–5 kV, Spotgröße = 4,5, Strom = 8–27 pA.
- Stellen Sie die Scandrehung für beide Strahlen auf 180° ein.
- Stufenneigung einstellen: Fräswinkel 6-11° (entspricht Einer Bühnenneigung von 13°–18° für das Probenshuttle mit Vorneigung von 45° und FIB/REM-Mikroskop mit 52° Winkel zwischen REM und FIB-Säule).
5. Herstellung der Saccharomyces cerevisiae Lamelle
- Überprüfen Sie die Gitterqualität und wählen Sie einen geeigneten Cluster von Saccharomyces cerevisiaeaus.
- Überprüfen Sie, ob das TEM-Gitter von beiden Seiten ohne zusätzliches Wasser um den Zellcluster oder auf der Rückseite des Gitters ordnungsgemäß abgelöscht ist.
HINWEIS: Um die Rückseite des Gitters zu überprüfen, drehen Sie die Bühne auf -10° und bilden Sie das Raster mit FIB ab. - Wählen Sie die optimalen Zellcluster für die Lamellenvorbereitung gemäß den folgenden Empfehlungen aus.
- Positionieren Sie die Zellcluster in der Rasterzentrale. Die Fräsfläche sollte sich nicht außerhalb des Quadrats erstrecken, wobei die Abmessungen 1100 x 1100 μm in der Mitte des Gitters positioniert sind (550 μm in jede Richtung vom Gitterzentrum).
- Positionieren Sie die Zellcluster im zentralen Teil des Rasterquadrats ohne Überlappung zum Rasterbalken.
- Positionieren Sie die Zellcluster im Gitterquadrat mit kompakter löchriger Carbonfolie ohne Risse.
- Stellen Sie sicher, dass der Cluster nicht von Eiskontamination umgeben ist.
- Überprüfen Sie, ob das TEM-Gitter von beiden Seiten ohne zusätzliches Wasser um den Zellcluster oder auf der Rückseite des Gitters ordnungsgemäß abgelöscht ist.
- Wählen Sie die optimale Fräsposition in der Monoschicht Saccharomyces cerevisiae.
- Stellen Sie sicher, dass die Gitterbalken, die die Zellmonoschicht auf dem ausgewählten Rasterquadrat umgeben, sichtbar sind.
- Wählen Sie die optimale Position in der zellulären Monoschicht gemäß den folgenden Empfehlungen. Die ausgewählten Bereiche für das Fräsen sollten die folgenden Kriterien erfüllen:
- Haben Sie die Region von Interesse im Rasterzentrum. Die Fräsfläche sollte sich nicht außerhalb des Quadrats der Abmessungen 1100 x 1100 μm erstrecken, das im Rasterzentrum positioniert ist (550 μm in jede Richtung vom Zentrum des Gitters).
- Haben Sie den interessierenden Bereich im zentralen Teil des Rasterquadrates ohne Überlappung mit dem Rasterbalken.
- Umgeben Sie die Zellmonoschicht nicht mit Eiskontamination.
- S. cerevisiae Lamelle mit Kryo-FIB vorbereiten.
HINWEIS: Das Fräsmuster wird generiert und relativ zum interessierenden Bereich zentriert. Cryo-FIBM wird sequenziell mit mehreren Frässchritten bei verschiedenen FIB-Einstellungen durchgeführt. Die Lamelle mit einer Dicke von etwa 2 μm wird zunächst mit hohem Strom (0,3–3 nA) gefräst. Die Lamelle wird dann nach und nach auf 500 nm ausgedünnt. Der Feinfrässchritt bei niedrigen Strömen (10-30 pA) wird verwendet, um die Lamelle auf ~100-200 nm Dicke zu finalisieren.- Legen Sie einen Interessenbereich (ROI) auf die euzentrische Höhe fest und speichern Sie diese Position.
HINWEIS: Der Koinzidenzpunkt muss für jede Position separat ermittelt und gespeichert werden. Die euzentrische Höhe wird eingestellt, indem die Bühne auf 0° geneigt und der ROI zentriert wird, indem die Bühne in x- und y-Richtung bewegt wird. Die Bühne wird dann auf 25° geneigt und der ROI wird durch Ändern der Position der Stufe z-Achse zurück in die Mitte des gescannten Bereichs gebracht. Abschließend wird die Bühne zum Fräsen auf 13°–18° zurückgeneigt. - Definieren Sie ein rechteckiges Fräsmuster über dem ROI mit einer Scanrichtung von oben nach unten.
- Definieren Sie ein rechteckiges Fräsmuster unterhalb des ROI mit einer Scanrichtung von unten nach oben.
- Definieren Sie das inaktive rechteckige Fräsmuster, das den interessierenden Bereich abdeckt, um eine grobe Schätzung der Lamellendicke zu erhalten. Dieses Muster wird während der Lamellenvorbereitung nicht gefräst.
- Markieren Sie alle Muster und legen Sie die Lamellenbreite(x-Dimension) fest. Die Breite des Fräsmusters sollte 2/3 der Clusterbreite nicht überschreiten. Dies entspricht in den meisten Fällen 8–15 μm.
- Parameter für grobe Frässchritte einstellen
- FIB-Strom: 0,3–3,0 nA ; endgültige Lamellendicke: 1,5–2 μm; Breite der FIBM-Fläche: 8-12 um; Bühnenneigung: 13-17°; Dauer: 8 Minuten; aktive Fräsmuster: oben und unten.
- FIB-Strom: 0,3–1,0 nA; endgültige Lamellendicke: 1 μm; Breite der FIBM-Fläche: 7,5-11,5 μm; Bühnenneigung: 13-17°; Dauer: 8 Minuten; aktive Fräsmuster: oben und unten.
- FIB-Strom: 100–300 pA; dicke der endgültigen Lamellen: 0,5 μm ; Breite der FIBM-Fläche: 7,5-11,5 μm; Bühnenneigung: 13-17°; Dauer: 8 Minuten; aktive Fräsmuster: oben und unten.
- FIB-Strom: 30–100 pA; endgültige Lamellendicke: 0,3 μm ; Breite der FIBM-Fläche: 7,5-11,5 μm; Bühnenneigung: 13-17°; Dauer: 8 Minuten; aktive Fräsmuster: oben und unten.
- Parameter für den Feinfrässchritt einstellen:
- FIB-Strom: 10–30 pA; endgültige Lamellendicke: <0,2 um; Breite der FIBM-Fläche: 7-11 μm; Bühnenneigung: 13-17° (+1°); Dauer: 12 Minuten; aktive Fräsmuster: oben.
HINWEIS: Die groben Frässchritte (5.3.6) werden für jede Lamelle nacheinander durchgeführt. Im Gegensatz dazu folgt der Feinmahlschritt (5.3.7) nicht direkt auf das Grobfräsen, sondern Feinfrässchritte werden am Ende der Sitzung für alle Lamellen sequentiell durchgeführt, um die Kohlenwasserstoffkontamination auf der Lamellenoberfläche zu minimieren. Eine zusätzliche Stufenneigung von +1° wird während des Feinfrässchritts verwendet, um die Gleichmäßigkeit der Lamellendicke über ihre Länge zu erhöhen.
- FIB-Strom: 10–30 pA; endgültige Lamellendicke: <0,2 um; Breite der FIBM-Fläche: 7-11 μm; Bühnenneigung: 13-17° (+1°); Dauer: 12 Minuten; aktive Fräsmuster: oben.
- Legen Sie einen Interessenbereich (ROI) auf die euzentrische Höhe fest und speichern Sie diese Position.
6. Übertragung von Saccharomyces cerevisiae Lamellen auf Kryo-TEM
- Bereiten Sie einen richtig getrockneten Dewar vor und füllen Sie ihn mit LN2.
- Entladen Sie die Proben mit Lamellen aus dem FIB/REM-Mikroskop unter Kryobedingungen, geben Sie sie in eine Gitterbox und lagern Sie sie in einem LN2-Speicher Dewar zur Langzeitlagerung. Alternativ laden Sie die Gitter direkt in Kryo-TEM.
- Die korrekte Ausrichtung der Lamelle relativ zur Kryo-TEM-Stufenneigungsachse ist wichtig (siehe begleitendes Video bei 8:10 für weitere Details). Stellen Sie sicher, dass die Fräsrichtung der vorbereiteten Lamellen senkrecht zur Kryo-TEM-Stufenneigungsachse steht.
- Neigen Sie die Kryo-TEM-Stufe vor, um die Lamellenneigung relativ zur Gitterebene zu kompensieren, und sammeln Sie die Neigungsreihe mit dosissymmetrischem Schema19.
HINWEIS: Die Größe der Vorneigung (typischerweise 6–8°) wird durch den Winkel zwischen der TEM-Gitterebene und der FIB-Richtung während der Mikrobearbeitung bestimmt. Die Position der Lamellenfrontkante im Bild in Kryo-TEM kann verwendet werden, um das Vorzeichen des Vorneigungswinkels zu bestimmen. Dazu muss der Sinn der Mikroskop-Bühnenrotation bekannt sein. In unserem Versuchsaufbau entspricht die Position der Vorderkante der Lamelle auf der rechten Seite des im Nanosonden-SA-Modus aufgenommenen Bildes der negativen Vorneigung.
Ergebnisse
Die Kultur Saccharomyces cerevisiae wurde mitten in der exponentiellen Wachstumsphase geerntet. Wir bereiteten zwei Arten von Proben vor, bei denen die Zellen entweder als kleine Cluster mehrerer Zellen über die Oberfläche des TEM-Gitters verteilt wurden (Abbildung 1A, C) oder eine kontinuierliche Monoschicht über einzelnen Gitterquadrate des TEM-Gitters bildeten ( Abbildung1B, D). Der unterscheidungsbescheidender Faktor für die Vorbereitung der Probe mit entweder verschiedenen Zellinseln oder der zellulären Monoschicht ist die Konzentration der Zellkultur, die auf das TEM-Gitter aufgetragen wird. Die geerntete Zellkultur wurde auf OD600 = 1,0 für den ersten Fall bzw. auf OD600 = 30 bis 60 für den letzteren Fall konzentriert. Die Probe zur Herstellung der zellulären Monoschicht wurde vor der Vitrifikation mit 5% v/v Glycerin ergänzt. Das Glycerin ist entscheidend für die Vitrifikation der Pufferlösung, die den Raum zwischen den Zellen ausfüllt (Abbildung 2), da die Reflexionen des kristallinen Puffers für die ordnungsgemäße Positionsverfolgung und Fokussierung während der Kryo-ET-Datenerfassung nachteilig sein können.
Zusätzlich wurde die Hefe-Suspensionskultur gegen das nicht saugfähige Material wie das PTFE-Blotting-Pad oder das kundenspezifische 3D-gedruckte Pad aus FlexFill 98A-Material abgesaugt. Das Löschpapier wurde in Bezug auf die Probenanwendung nur auf der Rückseite des Rasters positioniert (Back-Blotting). Für das Tauchgefrieren der Suspensionskultur wird die Back-Blotting-Strategie empfohlen, da das Beittblendung mit dem Filterpapier von beiden Seiten zu einer Haftung der Zellen auf dem Löschpapier führt (Abbildung 1E).
Das hier beschriebene Protokoll verwendet TEM-Gitter, die in der Gitterpatrone abgeschnitten sind, was eine stabile Unterstützung für das Gitter bildet und die Probenhandhabung der Probe nach der Vitrifizierung erleichtert. Dies erzwingt die Notwendigkeit, dass andere Probenhalter und Shuttles im FIB/SEM- und TEM-Mikroskop eine solche Gitterkartusche aufnehmen können.
Nach dem Transfer der Probe in das FIB/REM-Mikroskop wurde die Probe zunächst mit einer 0,3–1,0 μm Schicht Methylcyclopentadienylplatin mit dem mikroskopischen Gasinjektionssystem (GIS) beschichtet. Eine zusätzliche Schicht des anorganischen Iridiums wurde auf die Probenoberfläche gesputtert, um die GIS-Schicht zu härten und die Oberfläche leitfähig zu machen. Die Lamellen wurden in mehreren Schritten gefräst (Abbildung 3), wobei (I) der Frässtrom, (II) die Lamellenbreite und (III) der Abstand der Fräsfläche über und unter den Proben schrittweise verringert wurden. Der letzte Frässchritt ("Polieren") wurde bei niedrigem Strom (10-30 pA) nur von der Oberseite der Lamelle und mit einer zusätzlichen Neigung der Probe um weitere 1° zum Ga+-Balken durchgeführt. Die Verwendung des beschriebenen Protokolls hat im Durchschnitt dazu geführt, dass innerhalb einer 6-8-stündigen Sitzung 8-10 Lamellen auf zwei TEM-Gittern hergestellt wurden.
Die TEM-Gitter mit den Lamellen wurden anschließend in ein Transmissionselektronenmikroskop überführt. Die Lamellen wurden zuerst gescreent und nur diejenigen ausgewählt, die minimale Vorhänge (Artefakte, die durch ungleichmäßiges Fräsen über die Lamellenoberfläche stammen), einen niedrigen Oberflächenkontaminationsgrad und einen guten Zellkontrast (normalerweise beobachtet bei Lamellen mit < 200 nm Dicke) für die Erfassung der Kryo-ET-Daten zeigten. Darüber hinaus wurden Lamellen, die Risse über die gesamte Länge enthielten, aus der Datenerfassung verworfen. Im Allgemeinen waren etwa 50% der auf TEM übertragenen Lamellen für die Datenerfassung geeignet. Die Tilt-Serie wurde auf dem Post-GIF-K2-Direktelektronendetektor mit dem energieselektrierten Spalt auf 20 eV gesammelt. Die Datenerfassung erfolgte in der SerialEM-Software18 und die Neigungsreihen wurden nach einem dosissymmetrischen Schema19 mit dem Neigungsbereich von ±60° und dem Inkrement von 3° erfasst. Die Daten wurden bei der Vergrößerung erfasst, die der Pixelgröße von 3,47 A/px entspricht. Die Gesamtdosis von 65 e/Å2 wurde gleichmäßig auf die einzelnen Teilrahmen verteilt. Die Neigungsbilder wurden als Satz von drei Frames gesammelt, die anschließend bei der Datenerfassung mit dem MotionCor220-Programm auf die Bewegungs- und Strahlungsschäden korrigiert wurden. Parameter der Kontrastübertragungsfunktion wurden mit Ctffind421geschätzt. Die Neigungsserien wurden in eTomo18 verarbeitet. Die Patch-Tracking-Routine wurde verwendet, um die Bilder auszurichten. Das Tomogramm wurde mit einem gewichteten Rückprojektionsalgorithmus nach 2x Binning der Bilder rekonstruiert und anschließend mit SIRT-ähnlichem Filter (auf 8 Iterationen eingestellt) in IMOD18gefiltert. Die Tomogrammsegmentierung wurde manuell in der Amira Software22durchgeführt. Die rekonstruierten Tomogramme liefern eine hochauflösende Darstellung des Hefezellinneren und ermöglichen es uns, Organellen wie Vakuolen oder Mitochondrien mit hohem Detaillierungsgrad zu beobachten oder makromolekulare Komplexe wie Mikrotubuli oder Kernporenkomplexe in situ und unter nahezu nativen Bedingungen zu untersuchen (Abbildung 4).

Abbildung 1: FIB- und REM-Bilder von vitrifiziertem S. cerevisiae
FIB (A) und SEM (C) Bilder der kleinen Hefecluster, die auf dem TEM-Gitter verglast sind. FIB (B) und SEM (D) Bilder der Hefe, die eine kontinuierliche Monoschicht auf der Gitteroberfläche bildet. Die Probe wurde vor der Bildgebung mit GIS und Irridium-Layer beschichtet. Die Maßstabsbalken in Paneelen A-B entsprechen 10 μm. Die Hefeprobe wird gegen nicht saugfähiges Material wie PTFE oder FlexFill 98A (grün) und mit dem Löschpapier von der Rückseite des Gitters (weiß, E)positioniert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
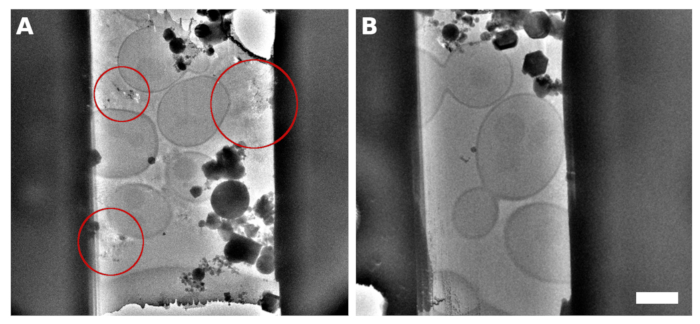
Abbildung 2: S. cerevisiae Lamellen
Ein TEM-Bild einer Lamelle, die aus der Probe mit kontinuierlicher Monolayer-Hefe über der Gitteroberfläche mikrobearbeitet wurde. Die zwischen den Zellen beobachteten Reflexionen enthielten falsch verglastes Medium/Puffer (A, mit roten Kreisen hervorgehoben). Ein TEM-Bild der auf der Hefe erzeugten Lamelle wird in eine kontinuierliche Monoschicht mit Der Zugabe von 5% Glycerin in das Medium/Puffer (B) verglast. Der Maßstabsbalken entspricht 2 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
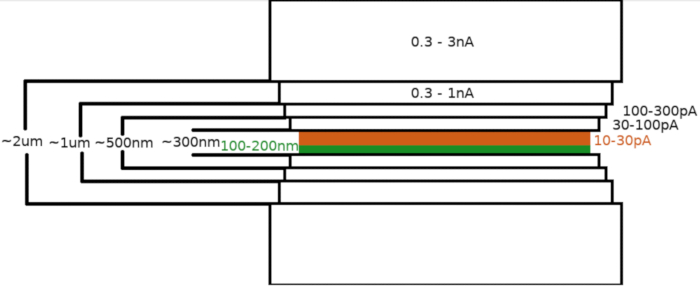
Abbildung 3: Kryo-FIBM-Workflow
Schematische Darstellung des Lamellenfräsprozesses. Die ersten groben Frässchritte werden bei hohen FIB-Strömen von beiden Seiten der vorläufigen Lamellenposition durchgeführt (grün hervorgehoben), während der letzte Polierschritt nur von der Oberseite und bei niedrigem FIB-Strom durchgeführt wird (orange hervorgehoben, siehe begleitendes Video bei 6:33). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
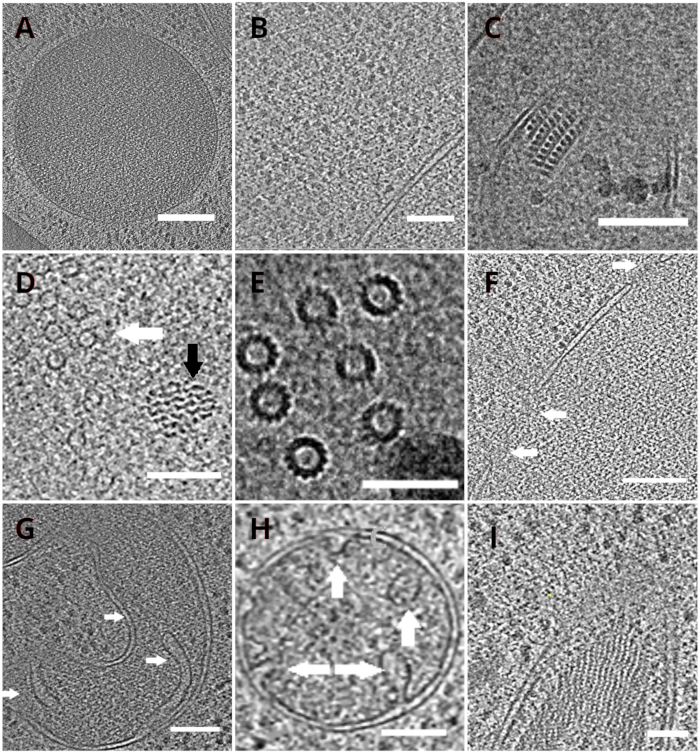
Abbildung 4: Hefeorganellen und makromolekulare Komplexe, dargestellt durch Kryo-ET
Scheiben der rekonstruierten Tomogramme, die eine Vakuole (A, Maßstabsbalken: 200 nm), Ribosomen (B, Maßstabsbalken: 200 nm), einen parakristallinen Kern von Peroxisom (C, Maßstabsbalken: 100 nm), Mikrotubuli (weißer Pfeil) in der Nähe einer nicht identifizierten Faserstruktur (schwarzer Pfeil, D, Maßstabsbalken: 100 nm), Details mehrerer Mikrotubuli (E, Maßstabsbalken: 50 nm), eine Kernmembran mit poren gekennzeichneten Poren (F, Maßstabsbalken 200nm), Mitochondrium(G,H,Maßstabsbalken: 100 nm, die Pfeile zeigen einzelne Kristalle an), ein Bündel nicht identifizierter filamentöser Strukturen(I,Maßstabsbalken: 100 nm). Die Tafeln B, C, D, E, G enthalten einen Abschnitt von Tomogrammen, die aus kleinen Zellclustern hergestellt wurden, während die Abschnitte von Tomogrammen, die auf Lamellen aus einer Monoschicht der Zellen gesammelt wurden, in den Tafeln A, F, H, Idargestellt sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Vorbereitung der Zellproben für Kryo-ET ist ein komplexer Workflow, der den Einsatz mehrerer High-End-Instrumente erfordert. Die Probenqualität kann bei jedem Vorbereitungsschritt beeinträchtigt werden, der den Durchsatz des gesamten Protokolls beeinflusst. Darüber hinaus stellt die Notwendigkeit des Probentransfers zwischen einzelnen Instrumenten ein zusätzliches Risiko der Probenkontamination oder Devitrifikation dar. Daher ist die Optimierung einzelner Schritte im Probenvorbereitungs-Workflow von hoher Bedeutung, um den Durchsatz und die Reproduzierbarkeit des Lamellenvorbereitungs-Workflows zu erhöhen. Das hier vorgestellte Protokoll beschreibt die optimierte Herstellung von Saccharomyces cerevisiae zur strukturellen Charakterisierung makromolekularer Komplexe in situ mittels Kryo-ET.
Das Protokoll beschreibt die Herstellung von zwei Arten von Hefeproben, die sich hauptsächlich in der Konzentration der Zellen auf dem TEM-Gitter unterscheiden. Beide Hefeproben ergaben hochwertige Lamellen für Kryo-ET und die Auswahl des Probentyps kann entsprechend den Zielen der jeweiligen Studie erfolgen. Die Hefe bildet isolierte Cluster von wenigen Zellen, die im ersten Fall zufällig über die Gitteroberfläche verstreut sind, während für den zweiten Probentyp eine kontinuierliche Monoschicht von Zellen auf der TEM-Gitteroberfläche vorhanden ist. Ersteres eignet sich dank des geringen Volumens des zu fräsenden Materials für die schnelle Lamellenvorbereitung. Die endgültige Lamelle ist ziemlich kurz und enthält daher nur 2-4 zelluläre Querschnitte. Die für die Probenvorbereitung geeigneten Bereiche sind zufällig über die Gitteroberfläche einschließlich der Gitterquadrate verteilt, was die Automatisierung des Lamellenvorbereitungsworkflows teilweise einschränken kann. Letztere Art der Probe erfordert die Verwendung größerer Ströme während der anfänglichen Mahlphase, um die Gesamtmahlzeit beizubehalten. Darüber hinaus ist diese Art von Probe anfälliger für Artefakte, die durch ungleichmäßiges Fräsen (Vorhang) entstehen. Daher wird GIS 50% länger auf die Probenoberfläche gesputtert als bei der Probe mit kleinen Zellclustern, um eine dickere Schutzschicht zu bilden. Als nächstes wird die Probe mit einer zusätzlichen Iridiumschicht (alternativ Platin oder Gold) gesputtert, um die GIS-Schicht auszuhärten, steifer zu machen und die Leitfähigkeit der Probenoberfläche zu erhöhen. FIBM von zusätzlichen Bereichen auf jeder Seite der Lamelle (~ 2-5 μm von der Lamellenkante) während des ersten Schritts des groben Lamellenfräsens wurde als vorteilhaft befunden, um die Anzahl der gebrochenen Lamellen höchstwahrscheinlich aufgrund der verringerten Spannung im endgültigen Querschnitt zu verringern23. Die endgültige Lamelle ist lang und enthält ~ 10 zelluläre Querschnitte, was die Anzahl der für Kryo-ET geeigneten Regionen erhöht. Die unsachgemäße Vitrifikation des Mediums oder Puffers zwischen den Zellen kann leicht durch die Zugabe des Kryoschutzmittels zur Pufferlösung (5% Glycerin, das in dieser Studie verwendet wurde) abgeschwächt werden. Da die meisten Quadrate für die Lamellenvorbereitung geeignet sind, eignet sich die Probe mit Zellen, die in einer kontinuierlichen Monoschicht organisiert sind, gut für die unbeaufsichtigte Lamellenvorbereitung.
Ein weiterer wichtiger Aspekt bei der Lamellenvorbereitung ist die Übertragung auf das Transmissionselektronenmikroskop und die korrekte Positionierung der Lamelle auf die Neigungsachse des Mikroskopetablierungs. Optimalerweise steht die Lamellenhauptachse senkrecht zur Neigungsachse des Mikroskops, was eine Verfolgung und Fokussierung auf Höhe des abgebildeten Bereichs ermöglicht und verhindert, dass die Lamellenkanten das Sichtfeld bei hohen Neigungswinkeln abschirmen. Bei der Erfassung der Kryo-ET-Daten nach dem dosissymmetrischen Schema18 sollte die Probe zunächst im Mikroskop gedreht werden, um die Neigung der Lamelle in Bezug auf die Gitterebene zu kompensieren.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Diese Arbeit wurde unterstützt Instruct-Ultra (Grant 731005), iNEXT-Discovery (Grant 871037), finanziert durch das Horizon 2020-Programm der Europäischen Kommission, und die CIISB-Forschungsinfrastruktur, ein Instruct-ERIC-Zentrum (LM2018127). Wir danken für die Unterstützung von Thermo Fisher Scientific Brno.
Materialien
| Name | Company | Catalog Number | Comments |
| Agar | Himedia | MB053 | |
| Glucose | PENTA | 12020-31000 | |
| Glycerol | Merck | G5516-1L | |
| ethane | Messer | 1007 | |
| LN2 | Lineq | LN2-1L | |
| Peptone | Merck | P5905-1KG | |
| Saccharomyces cerevisiae | ATCC | 201388 | strain BY4741 |
| Tweezers | Dumont | T539 | |
| Yeast extract | Duchefa Biochemie | Y1333.1000 | |
| Disposable | |||
| Blotting papers | Ted Pella | 47000-10 | |
| C-clip | ThermoScientific | 9432 909 97551 | |
| C-clip ring | ThermoScientific | 9432 909 97561 | |
| Spreading sticks | Merck | Z376779-1PAK | |
| Sterile inoculation loops | BRAND | BR452201-1000EA | |
| Sterile plastic Petri dishes | Sigma | SIAL0166 | |
| TEM grids | Quantifoil | 4420G-XA | |
| Equipment | |||
| Autoclave | Systec | 101291545 | |
| balances | BEL | M124A | |
| Cryo-FIB/SEM microscope | ThermoScientific | 1006123 | |
| Cryo-TEM microscope | ThermoScientific | 9432 057 03301 | |
| Laminar flow box | Telstar | AH5 | |
| Plasma cleaner | Gatan | 955.82001 | |
| Shaking incubator | New Brunswick | M1282-0002 | |
| UV/VIS spectrophotometer | WPA | S800 | |
| Vitrification robot | ThermoScientific | 9432 053 50621 |
Referenzen
- McMullan, G., Faruqi, A., Clare, D., Henderson, R. Comparison of optimal performance at 300keV of three direct electron detectors for use in low dose electron microscopy. Ultramicroscopy. 147, 156-163 (2014).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, (2018).
- Dubochet, J., McDowall, A. W. Vitrification of pure water for electron microscopy. Journal of Microscopy. 124, 3-4 (1981).
- Villa, E., Schaffer, M., Plitzko, J. M., Baumeister, W. Opening windows into the cell: focused-ion-beam milling for cryo-electron tomography. Current Opinion in Structural Biology. 23, 771-777 (2013).
- Mahamid, J., et al. Visualizing the molecular sociology at the HeLa cell nuclear periphery. Science. 351 (6276), 969-972 (2016).
- Schur, F. K. Toward high-resolution in situ structural biology with cryo-electron tomography and subtomogram averaging. Current Opinion in Structural Biology. 58, 1-9 (2019).
- O'Reilly, F. J., et al. In-cell architecture of an actively transcribing-translating expressome. Science. 369, 554-557 (2020).
- Rice, W. J., et al. Routine determination of ice thickness for cryo-EM grids. Journal of Structural Biology. 204, 38-44 (2018).
- Al-Amoudi, A., Norlen, L. P. O., Dubochet, J. Cryo-electron microscopy of vitreous sections of native biological cells and tissues. Journal of Structural Biology. 148, 131-135 (2004).
- Al-Amoudi, A., Studer, D., Dubochet, J. Cutting artefacts and cutting process in vitreous sections for cryo-electron microscopy. Journal of Structural Biology. 150, 109-121 (2005).
- Pierson, J., et al. Improving the technique of vitreous cryo-sectioning for cryo-electron tomography: electrostatic charging for section attachment and implementation of an anti-contamination glove box. Journal of Structural Biology. 169, 219-225 (2010).
- Dubochet, J., et al. How to "read" a vitreous section. Methods in Cell Biology. 79, 385-406 (2007).
- Rigort, A., et al. Focused ion beam micromachining of eukaryotic cells for cryoelectron tomography. Proceedings of the National Academy of Sciences. 109, 4449-4454 (2012).
- Schaffer, M., et al. Cryo-focused Ion Beam Sample Preparation for Imaging Vitreous Cells by Cryo-electron Tomography. Bio-protocol. 5, (2015).
- Wagner, F. R., et al. Preparing samples from whole cells using focused-ion-beam milling for cryo-electron tomography. Nature Protocols. 15 (6), 2041-2070 (2020).
- Buckley, G., et al. Automated cryo-lamella preparation for high-throughput in-situ structural Biology. Journal of Structural Biology. 210 (2), 107488 (2020).
- Zachs, T., et al. Fully automated, sequential focused ion beam milling for cryo-eletron tomography. eLife. e52286, (2020).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. Journal of Structural Biology. 152, 36-51 (2005).
- Hagen, W. J., Wan, W., Briggs, J. A. Implementation of a cryo-electron tomography tilt-scheme optimized for high resolution subtomogram averaging. Journal of Structural Biology. 197, 191-198 (2017).
- Zheng, S. Q., et al. MotionCor2: anisotropic correction of beam-induced motion for improved cryo-electron microscopy. Nature Methods. 14, 331-332 (2017).
- Rohou, A., Grigorieff, N. CTFFIND4: Fast and accurate defocus estimation from electron micrographs. Journal of Structural Biology. 192, 216-221 (2015).
- Stalling, D., Westerhoff, M., Hege, H. -. C. Amira: A highly interactive system for visual data analysis. The Visualization Handbook. , 749-767 (2005).
- Wolff, G., et al. Mind the gap: Micro-expansion joints drastically decrease the bending of FIB-milled cryo-lamellae. Journal of Structural Biology. 208, 107389 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten