Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Обобщенный метод определения состава свободных растворимых фенольных кислот и антиоксидантной способности зерновых и бобовых культур
В этой статье
Резюме
Фенольные кислоты являются важными фитохимическими веществами, которые присутствуют в цельных зернах. Они обладают биологически активными свойствами, такими как антиоксидантные защитные функции. Эта работа была направлена на представление информации об обобщенном методе идентификации ВЭЖХ, оценке общего фенольного содержания и определении антиоксидантной способности фенольных кислот в зерновых и бобовых культурах.
Аннотация
Фенольные кислоты представляют собой класс органических соединений, которые несут как фенольную группу, так и карбоновую группу. Они содержатся в зернах и концентрируются в отрубях злаков или семенной оболочке бобовых. Они обладают антиоксидантными свойствами, которые вызвали большой исследовательский интерес в последние годы, об их потенциальных антиоксидантных защитных функциях здоровья. В данной работе представлен обобщенный метод экстракции свободных растворимых фенольных кислот из цельного зерна и анализа их антиоксидантной способности. Было использовано пять образцов цельного зерна, включающих два зерновых (пшеница и желтая кукуруза) и три бобовых (коровий горох, фасоль почек и соя). Зерна перемалывали в муку, а их свободные растворимые фенольные кислоты извлекали с использованием водного метанола. Затем соединения были идентифицированы с помощью жидкого хроматографа высокого давления (ВЭЖХ). Метод Фолина-Чокалтеу был использован для определения их общего фенольного содержания, в то время как их антиоксидантные способности были определены с использованием анализа радикальной поглотительной способности DPPH, эквивалентной антиоксидантной способности Тролокса (TEAC) и абсорбционной способности кислородных радикалов (ORAC). Выявленные фенольные кислоты включали ванильную, кофейную, п-кумаровую и феруловую кислоты. Ванильная кислота была идентифицирована только в коровьем горохе, в то время как кофейная кислота была идентифицирована только в почечных бобах. p-кумаровая кислота была идентифицирована в желтой кукурузе, коровьем горохе и сое, в то время как феруловая кислота была идентифицирована во всех образцах. Феруловая кислота была преобладающей фенольной кислотой. Общая концентрация фенольных кислот в образцах снижалась в следующем порядке: соевый > коровий горох > желтая кукуруза = фасоль > пшеницы. Общая антиоксидантная способность (сумма значений анализов DPPH, TEAC и ORAC) снизилась следующим образом: соевые > почечные бобы > желтая кукуруза = коровий горох > пшеница. Это исследование пришло к выводу, что анализ ВЭЖХ, а также анализы DPPH, TEAC и ORAC предоставляют полезную информацию о составе фенольных кислот и антиоксидантных свойствах цельных зерен.
Введение
Фенольные кислоты являются одними из наиболее важных фитохимических веществ, изучаемых в растениях, из-за жизненно важной роли, которую они играют в защите растений от травоядных и грибковых инфекций, а также в поддержании структурной поддержки и целостности в тканях растений 1,2. Их много в отрубях злаков и семенной оболочке бобовых3. Структурно они делятся на две группы: гидроксибензойные кислоты (рис. 1) и гидроксикоричные кислоты (рис. 2). Общие гидроксибензойные кислоты в зерновых и бобовых включают галловую, п-гидроксибензойную, 2,4-дигидроксибензойную, протокатеховую, ванильную и сиринговую кислоты, в то время как общие гидроксикоричные кислоты включают кофейную, п-кумаровую, феруловую и синаповую кислоты3. Фенольные кислоты также обладают антиоксидантными свойствами, поскольку они способны поглощать свободные радикалы, которые вызывают окислительную прогорклость в жирах, а также инициировать и распространять индуцированный радикалами окислительный стресс в физиологических системах 4,5. Из-за этой жизненно важной физиологической роли в качестве антиоксидантов они являются предметом недавних исследований. Это связано с тем, что при употреблении в качестве компонентов растительной пищи они могут оказывать антиоксидантную защиту.
Зерновые и зерновые продукты являются основными источниками углеводной пищи для людей и животных во всем мире6. Зерновые включают пшеницу, рис, кукурузу (кукурузу), ячмень, тритикале, просо и сорго. Среди них кукуруза является наиболее используемой, с предполагаемым глобальным использованием 1 135,7 млн. тонн в 2019/2020 году, за которой следует пшеница с предполагаемым глобальным использованием 757,5 млн. тонн за тот же период7. Зерновые продукты являются отличными источниками энергии для потребителей, поскольку они являются богатыми источниками углеводов. Они также содержат некоторые белки, жиры, клетчатку, витамины и минералы6. В дополнение к своей питательной ценности, зерновые являются хорошими источниками фитохимических антиоксидантов, особенно фенольных кислот, которые обладают потенциалом для защиты физиологической системы от радикально-индуцированного окислительного повреждения3. Бобовые также являются хорошими источниками питательных веществ и, как правило, содержат больше белка, чем зерновые. Они также содержат витамины и минералы и используются при приготовлении различных продуктовпитания 8. Кроме того, бобовые являются хорошими источниками различных фитохимических антиоксидантов, включая фенольные кислоты, флавоноиды, антоцианы и проантоцианидины 9,10. Разные сорта злаков и бобовых могут иметь разный состав фенольной кислоты. Поэтому необходимо изучить состав фенольных кислот зерновых и бобовых культур и их сортов, чтобы узнать их потенциальную пользу для здоровья в отношении фенольных антиоксидантов.
Сообщалось о ряде анализов для измерения количества фенольных кислот в зерновых и бобовых культурах и определения их антиоксидантной активности. Наиболее распространенными методами анализа цельнозерновых фенольных кислот являются спектрофотометрия и жидкостная хроматография11. Целью данной работы была демонстрация обобщенного жидкого хроматографического метода высокого давления для определения состава свободнорастворимой фенольной кислоты и спектрофотометрических методов определения общего фенольного содержания и антиоксидантной способности некоторых цельнозерновых злаков и бобовых культур.
протокол
1. Тип образцов
- Для этого исследования используйте пять образцов цельного зерна, включающих два злака (например, твердая пшеница и желтая кукуруза) и три бобовых (например, бобы черноглазого коровьего гороха, соевые бобы и красные почки).
- В муку перемолоть 50 г каждого зерна в трипликатах, используя кофемолку, и пропустить их через сито 500 мкм.
- Хранить при температуре -20 °C.
2. Пробоподготовка
-
Определение содержания сухого вещества и выражение сухой весовой основы
ПРИМЕЧАНИЕ: Определение содержания сухого вещества в каждом порошкообразном образце в соответствии с методом AOAC (2000)12.- Включите печь с принудительной конвекцией и установите температуру на 130 °C.
- Сухой адсорбент (силикагель) в духовке в течение 30 мин до 1 ч и переложите высушенный силикагель в осушитель.
- Точно взвесьте 2 г каждого образца в чистую, предварительно высушенную и взвешенную алюминиевую банку.
- Высушите взвешенные образцы при 130 °C в течение 1 ч в печи принудительной конвекции.
- Перенесите высушенный образец в осушитель и дайте остыть до температуры окружающей среды.
- Взвесьте высушенный, охлажденный образец и запишите его вес.
- Рассчитайте содержание сухого вещества в каждом образце следующим образом:
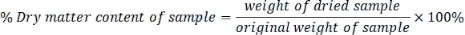
- Выразите каждый параметр, измеренный на основе сухого веса, используя следующую формулу:

-
Экстракция фенольной кислоты
ПРИМЕЧАНИЕ: Экстрагируйте растворимые свободные фенольные соединения в образцах зерна с использованием модификации метода Y. Qiu et al.5 , который позволяет фенольную экстракцию из миллиграммовых количеств цельного зерна.- Точно взвесьте 100 мг образца цельнозерновой муки непосредственно в микроцентрифужную трубку янтарного цвета емкостью 2 мл. Темный цвет трубки помогает предотвратить воздействие на смесь света.
- Добавьте 1 мл 80% водного метанола класса ВЭЖХ в каждую из пробирок, содержащих образцы.
- Вихрь ненадолго смешает раствор метанола и образцы.
- Обрабатывайте образцы ультразвуком в течение 60 мин для извлечения свободных растворимых фенольных соединений. Наденьте крышку на образцы на время обработки ультразвуком для дополнительной защиты от света.
- После обработки ультразвуком центрифугируют смесь при 20 000 × г в течение 5 мин для осаждения твердых остатков, оставляя супернатант сверху. Свободные фенольные соединения будут присутствовать в супернатанте после центрифугирования.
- Перенесите супернатант в чистую микроцентрифужную трубку.
ПРИМЕЧАНИЕ: Супернатант необходимо отфильтровать перед введением в прибор ВЭЖХ. Чтобы отфильтровать супернатант, снимите поршень шприца объемом 3 мл и прикрепите шприцевой фильтр. Фильтр должен иметь размер пор не более 0,22 мкм. - Пипетка примерно 0,4 мл надосадочного вещества попадает в верхнюю часть шприца. Повторно вставьте плунжер и протолкните жидкость через фильтр во флакон ВЭЖХ, содержащий флакон для флакона.
- После того, как прибор настроен для запуска метода, описанного в рукописи для анализа ВЭЖХ, загрузите флаконы в карусель, чтобы они соответствовали списку образцов.
- Получение ВЭЖХ-хроматограмм при 320 нм и 280 нм, показывающих различные пики, представляющие различные фенольные соединения.
- Используя соответствующие стандартные кривые, количественно оцените гидроксикоричные кислоты при 320 нм, поскольку они имеют максимальное поглощение на этой длине волны. По тому же принципу количественно оценивают гидроксибензойные кислоты при 280 нм.
- Храните оставшиеся экстракты при -20 °C для других анализов.
3. Фенольный состав
- Используйте жидкий хроматограф высокого давления (Таблица материалов) для идентификации и количественной оценки извлеченных фенольных соединений в образцах, основанный на методе J. Xiang, F.B. Apea-Bah, V. U. Ndolo, M.C. Katundu и T. Beta 4.
- Подготовьте стандарты фенольной кислоты (ванильная кислота, кофейная кислота, п-кумаровая кислота, феруловая кислота и синаповая кислота) для идентификации и количественной оценки составляющих фенольных соединений в экстрактах.
- Для этого взвесьте 1 мг каждого стандарта и растворите в 1 мл 50% водного метанола для получения 1000 мкг/мл каждого стандарта.
- Смешайте равные объемы всех пяти стандартов в янтарной центрифужной трубке объемом 2 мл для получения коктейля стандартов, каждый из которых имеет концентрацию 200 мкг/мл.
- Приготовьте серийные разведения стандартного коктейля, взяв объем в новую пробирку и разбавляя равным объемом водный растворитель метанола.
- Повторите последовательные разведения до концентрации 3,125 мкг/мл.
- Кроме того, отдельно разбавляют каждый стандарт 40 раз растворителем для получения концентрации 25 мкг/мл каждого стандарта.
- Установите температуру колонки на 35 °C, а температуру печи для образцов на 15 °C.
- Для приготовления подвижной фазы А (0,1% водной муравьиной кислоты) переложите 1 мл муравьиной кислоты в объемную колбу емкостью 1 л и добавьте воду класса ВЭЖХ до отметки 1 л. Хорошо встряхните, чтобы перемешать.
- Для получения подвижной фазы В (0,1% муравьиной кислоты в метаноле) переложите 1 мл муравьиной кислоты в объемную колбу емкостью 1 л и добавьте метанол класса ВЭЖХ до отметки 1 л. Хорошо встряхните, чтобы перемешать.
- При необходимости отрегулируйте громкость до отметки 1 л.
- Фильтруйте обе подвижные фазы через гидрофильную фильтровальную бумагу толщиной 0,45 мкм.
- Для анализа вводят 10 мкл каждого экстракта или стандарта (стандарты 25 мкг/мл и стандартные коктейли) в колонку обратной фазы.
- Элют с подвижными фазами по программе линейного градиента в течение 25 мин пробега следующим образом: 0-3,81 мин, 9%-14% В; 3,81-4,85 мин, 14%-15% В; 4,85-5,89 мин, 15%-15% В, 5,89-8,32 мин, 15%-17% В; 8,32-9,71 мин, 17%-19% В; 9,71-10,40 мин, 19%-19% В; 10,40-12,48 мин, 19%-26% В; 12,48-13,17 мин, 16%-28% В; 13,17-14,21 мин, 28%-35% В; 14,21-15,95 мин, 35%-40% В; 15,95-16,64 мин, 40%-48% В; 16,64-18,37 мин, 48%-53% В; 18,37-22,53 мин, 53%-70% В; 22,53-22,88 мин, 70%-90% В; 22.88-25.00 мин, 90% B.
- Сравните время удержания хроматографических пиков, полученных для аутентичных эталонов концентраций 25 мкг/мл, при 280 нм и 320 нм, с таковыми экстрактов, чтобы идентифицировать составляющие фенольные соединения в образцах.
- Построение калибровочных кривых для стандартных коктейлей фенольной кислоты с концентрацией эталонов на горизонтальной оси и площадью пика на вертикальной оси
- Используйте калибровочные кривые для оценки концентраций идентифицированных фенольных соединений путем сравнения пиковых областей на участке с концентрациями идентифицированных соединений при 280 нм и 320 нм, как упоминалось в предыдущем разделе.
4. Общее содержание фенолов
ПРИМЕЧАНИЕ: Определить общее фенольное содержание экстрактов с помощью метода Фолина-Чокалтеу, описанного F.B. Apea-Bah et al.13.
- Подготовка стандартов феруловой кислоты и галловой кислоты в диапазоне концентраций от 0,025 до 0,150 мг/мл для построения калибровочных кривых для сравнения для оценки общего содержания фенолов.
- Для этого точно взвесьте по 1 мг феруловой кислоты и галловой кислоты в емкости центрифужных трубок емкостью 2 мл.
- Добавляют 1 мл 50% водного метанола к каждому стандарту и вихрь растворяют, образуя 1 мг/мл запаса каждого стандарта.
- Приготовьте серию разведений из каждого исходного раствора в общей сложности 500 мкл.
- Пипетка 18,2 мкл каждого экстракта или стандарта в отдельную скважину на 96-луночной микропластине.
- Добавьте 36,4 мкл 10% (v/v) водного реагента Folin-Ciocalteu к каждому экстракту или стандарту.
- Затем добавляют 145,4 мкл 700 мМ карбоната натрия к каждой реакционной смеси.
- Инкубируют реакционные смеси в темноте при комнатной температуре (20-25 °С) в течение 2 ч.
- Считывание поглощения на микропластинчатом считывателе при 750 нм.
- Построение калибровочных кривых изменения абсорбции по отношению к концентрации эталонов фенольной кислоты и использование их для оценки общего содержания фенольных кислот.
- Экспрессируйте результаты в виде эквивалентов миллиграммов феруловой кислоты на грамм измельченного образца (мг FAE/г) и эквивалентов миллиграмм галловой кислоты на грамм измельченного образца (мг GAE/г) на основе сухого веса.
5. Антиоксидантные анализы
ПРИМЕЧАНИЕ: Определить антиоксидантную способность зерновых экстрактов с помощью следующих трех анализов: 2,2-дифенил-1-пикрилгидразил (DPPH) способность к радикальному удалению; 2,2'-азино-бис(3-этилбензотиазолин-6-сульфоновая кислота (ABTS) способность поглощать радикалы, которая также называется эквивалентной антиоксидантной способностью Тролокса (TEAC); и способностью поглощения радикалов кислорода (ORAC).
- Подготовка стандартов Trolox для стандартных кривых
- Используйте Trolox, водорастворимый аналог витамина Е, в качестве стандарта для оценки антиоксидантной способности экстрактов цельного зерна in vitro .
- Точно взвесьте 1 мг Тролокса в пробирку объемом 15 мл. Растворить в 4 мл 50% водного метанола. Вихрь растворяют для приготовления запасного раствора 1 мМ (1000 мкМ).
- Подготовьте шесть концентраций Тролокса, то есть 50, 100, 200, 400, 600 и 800 мкМ, чтобы построить стандартные кривые для оценки способности dpph к радикальному удалению и эквивалентной антиоксидантной способности Тролокса (TEAC). Аналогичным образом, приготовьте концентрации тролокса 6,25, 12,5, 25 и 50 мкМ для оценки способности поглощения радикалов кислорода (ORAC). Составьте общий объем каждой концентрации до 500 мкл, как показано в таблице 1.
- Разбавление экстрактов образцов
- Разбавьте экстракты образцов метанолом перед анализом. Здесь экстракты желтой кукурузы и коровьего гороха были разбавлены два раза, пшеница и фасоль были разбавлены пять раз, а экстракт сои был разбавлен метанолом в 10 раз.
- Анализ эквивалентной антиоксидантной способности тролокса (TEAC)
- Измерьте эквивалентную антиоксидантную способность Тролокса (TEAC) образцов, используя метод, описанный ранее F.B. Apea-Bah et al.14.
- Взвесьте 8,23 мг ABTS в чистую янтарную центрифужную трубку емкостью 2 мл.
- Затем взвесьте 1,62 мг персульфата калия в другую чистую янтарную центрифугу емкостью 2 мл.
- Добавьте 1 мл дистиллированной воды к каждому из них и вихрь, чтобы растворить их.
ПРИМЕЧАНИЕ: В результате получается 16 мМ раствора ABTS с 6 мМ водного раствора персульфата калия. - Приготовьте исходный раствор АБТС путем смешивания растворов АБТС и персульфата калия в равных объемах. Раствор сразу же изменится на темный цвет.
- Инкубировать смесь реагентов в темноте в течение 12-16 ч.
- Разбавить раствор ABTS 30 раз 200 мМ фосфатного буферного физиологического раствора (PBS), чтобы сформировать рабочий раствор ABTS. Для этого добавьте 58 мл 200 мМ PBS к 2 мл запасного раствора ABTS. Рабочий раствор будет содержать 0,27 мМ АБТС и 0,1 мМ персульфата калия.
- Для анализа поместите 10 мкл каждого разбавленного экстракта или тролокса в 96-луночную микропластину.
- Добавляют в каждую лунку 190 мкл рабочего раствора АБТС и инкубируют реакционные смеси в течение 60 мин.
- Измерьте поглощение реакционных смесей при 750 нм в считывателе микропластин.
- Используйте стандарты Trolox в концентрации от 100 до 800 мкмоль/л для построения калибровочной кривой.
- Оцените способность поглощения радикалов ABTS по калибровочной кривой.
- Экспрессируйте результаты в виде эквивалентов микромоли Тролокса на грамм (мкмоль TE/г) образца на основе сухого веса.
- Анализ DPPH
ПРИМЕЧАНИЕ: Определите способность образцов к радикальному удалению DPPH с помощью метода, описанного ранее F.B. Apea-Bah et al.13. Антиоксидантный анализ DPPH требует радикально-генерирующего соединения DPPH (2,2-дифенил-1-пикрилгидразил).- Точно взвесьте 1,2 мг DPPH в пустую центрифужную трубку емкостью 50 мл. Растворите DPPH в 30 мл метанола для получения метанольного раствора 60 мкмоль/л.
ПРИМЕЧАНИЕ: Анализ DPPH проверяет способность экстрактов образцов поглощать свободные радикалы, производимые DPPH. - Для анализа добавьте 5 мкл экстрактов образца или раствора Тролокса в микропластинчатые колодцы.
- Затем добавляют 195 мкл метанольного раствора DPPH 60 мкмоль/л и инкубируют в течение 60 мин.
- Измерьте поглощение реакционной смеси при 515 нм.
- Используйте стандарты Trolox (50-800 мкмоль/л) для построения калибровочной кривой с изменением поглощения на вертикальной оси и концентрациями Тролокса на горизонтальной оси.
- Оцените емкость очистки DPPH по калибровочной кривой.
- Экспрессируйте результаты в виде эквивалентов микромоли Тролокса на грамм (мкмоль TE/г) образца на основе сухого веса.
- Точно взвесьте 1,2 мг DPPH в пустую центрифужную трубку емкостью 50 мл. Растворите DPPH в 30 мл метанола для получения метанольного раствора 60 мкмоль/л.
- Способность поглощать кислородные радикалы
- Определение абсорбционной способности кислородных радикалов (ORAC) образцов на основе метода F.B. Apea-Bah et al.13.
- Для начала подготовьте стандарты Trolox концентраций 6,25, 12,5, 25 и 50 мкМ из стандартного раствора Trolox 1000 мкМ в буфере 75 мМ фосфата калия (K2HPO4/KH2PO4).
- Для этого взвесили 1 мг порошка Тролокса и растворили в 4 мл буферного раствора под ультразвуком для приготовления 1000 мкМ запасного раствора.
- Затем берут 50 мкл исходного раствора в центрифужную трубку емкостью 2 мл и разбавляют 950 мкл буферного раствора для получения 1000 мкл раствора тролокса 50 мкМ.
- Пипетку 500 мкл раствора 50 мкМ в новую трубку и разбавляют равным объемом буфера для получения 25 мкМ раствора Тролокса.
- Повторите последовательное разбавление 25 мкМ для получения 12,5 мкМ, а затем аналогичным образом повторите разбавление 12,5 мкМ для получения 6,25 мкМ.
- Подготовьте соответствующие разведения экстрактов образцов.
- Разбавьте экстракты желтой кукурузы и коровьего гороха 20 раз, экстракты пшеницы и фасоли 50 раз, а экстракт сои 100 раз буферным раствором.
- Перенесите 200 мкл каждого образца или стандарта Trolox в скважины черной 96-луночной микропластины для автоматического пипетирования.
- Затем заполните три резервуара с реагентами, поставляемыми с оборудованием ORAC, следующим: (1) буферным раствором; (2) 0,816 нМ флуоресцеина в буфере; и (3) 153 мМ 2,2'-азобиса(2-амидинопропана) дигидрохлорида (AAPH) в буфере.
- Поместите их в сосуды для автоматической пипетки.
- Настройте машину ORAC и автоматическую систему дозирования для анализа на основе стандартной рабочей процедуры.
- Для анализа настройте автоматизированную систему дозирования для передачи 25 мкл каждого разбавленного экстракта или стандартного в скважины прозрачной донной черной 96-луночной микропластины.
- Затем автоматически добавляют 150 мкл 0,816 нМ флуоресцеина в буфер.
- Инкубируйте реакционную смесь при 37 °C в течение 15 мин в машине ORAC.
- После этого автоматически добавляют 25 мкл AAPH к каждой реакционной смеси.
- Инкубируйте их при 37 °C в течение 50 мин в машине ORAC.
- Настройте машину ORAC для измерения флуоресцентного распада в течение инкубационного периода при длинах волн возбуждения и излучения 485 нм и 520 нм соответственно.
- После измерений постройте стандартную кривую Тролокса с Тролоксом (6,25-50 мкМ) на горизонтальной оси и флуоресцентным распадом на вертикальной оси.
- Оцените способность поглощения кислородных радикалов экстрактов из стандартной кривой Тролокса.
- Экспрессируйте результаты в виде образца мкмоль TE/г на основе сухой массы.
- Статистический анализ
- Представить все результаты как средство ± стандартное отклонение не менее трех.
- Выполните дисперсионный анализ (ANOVA) для определения влияния типа зерна на переменные отклика.
- Там, где существуют значительные различия при p < 0,05, используйте наименее значимую разницу (ЛСД) для сравнения средних.
- Выполните корреляционный анализ Пирсона, чтобы оценить взаимосвязь между содержанием феноликов и антиоксидантными способностями.
Результаты
В таблице 2 показаны фенольные кислоты, которые были идентифицированы в зерновых и бобовых культурах. На основе имеющихся аутентичных стандартов в образцах были идентифицированы четыре фенольные кислоты: ванильная, кофейная, п-кумаровая и феруловая кислоты. Ванильная ки...
Обсуждение
Цельные зерна были отобраны в качестве репрезентативных зерновых и бобовых, которые находят широкое применение в пищевых продуктах во всем мире. Хотя между сортами каждого зерна могут существовать различия, основное внимание в этом исследовании было уделено демонстрации обобщенного ...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Авторы с признательностью отмечают техническую поддержку г-жи Элисон Сер и г-жи Ханны Одуро-Обенг, а также поддержку в редактировании видеофильмов г-жой Дженис Фахардо и г-ном Мигелем дель Росарио.
Материалы
| Name | Company | Catalog Number | Comments |
| 15 mL Falcon conical centrifuge tubes | Fisher Scientific | 05-527-90 | |
| 2 mL Amber glass ID Surestop vial | Thermo Scientific | C5000-2W | |
| 2 mL Amber microcentrifuge tubes | VWR | 20170-084 | |
| 2,2′-Azobis(2-amidinopropane) dihydrochloride (AAPH) | Sigma-Aldrich | 440914-100G | |
| 2,2'-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid (ABTS) (C18H18N4O6S4) ≥98%, | Sigma Aldrich | A1888-2G | |
| 2,2-Diphenyl-1pikrylhydrazyl (DPPH) (C18H12N5O6) | Sigma Aldrich | D913-2 | |
| 6-Hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid (Trolox) (C14H18O4), ≥98% | Fluka Chemika | 56510 | |
| 9 mm Autosampler Vial Screw Thread Caps | Thermo Scientific | 60180-670 | |
| 96 well flat bottom plates | Fisher Scientific | 12565501 | |
| Agilent BioTek ELx800 microplate reader | Fisher Scientific | BT-ELX800NB | |
| Agilent BioTek Precision 2000 96/384 Automated Microplate Pipetting System | Fisher Scientific | N/A | |
| Agilent BioTek FLx800 Microplate Fluorescence Reader | Fisher Scientific | N/A | |
| Analytical balance SI-114 | Denver Instrument | SI-114.1 | |
| Autosampler, Waters 717 Plus | Waters | WAT078900 | |
| BD 3 mL syringe Luer-Lok Tip | BD | 309657 | |
| Bransonic ultrasonic cleaner, Branson 5510 | Millipore Sigma | Z245143 | |
| Corning LSE Vortex Mixer | Corning | 6775 | |
| Durapore Filter (0.45 µm PVDF Membrane) | Merck Millipore Ltd | HVLP04700 | |
| Durapore Membrane Filters (0.45 µm HV) | Merck Millipore Ltd | HVHP04700 | |
| Eppendorf Research plus, 0.5-10 µL | Eppendorf | 3123000020 | |
| Eppendorf Research plus, 0.5-5 mL | Eppendorf | 3123000071 | |
| Eppendorf Research plus, 100-1000 µL | Eppendorf | 3123000063 | |
| Eppendorf Research plus, 10-100 µL | Eppendorf | 3123000047 | |
| Ethyl acetate, HPLC grade | Fisher Chemical | E195-4 | |
| Ferulic acid standard | Sigma Aldrich | 128708-5G | |
| Fluorescein | Fisher Scientific | AC119245000 | |
| Folin & Ciocalteu phenol reagent | Sigma Aldrich | F9252 | |
| Formic acid, 99% | Acros Organics, Janssen Pharmaceuticalaan 3a | 27048-0010 | |
| Gallic acid standard | Sigma | G7384 | |
| High performance liquid chromatograph (HPLC), Waters 2695 | Waters | 960402 | |
| Methanol, HPLC grade | Fisher Chemical | A452-4 | |
| Micro pipet tips, 0.5-10 µL | Fisherbrand | 21-197-2F | |
| Microcentrifuge Sorvall Legend Micro 21 centrifuge | Thermo Scientific | 75002435 | |
| Multichannel micropipette, Proline Plus, 30-300 µL | Sartorius | 728240 | |
| Photodiode array detector, Waters 2996 | Waters | 720000350EN | |
| Pipet tips, 1000 µL | VWR | 83007-382 | |
| Pipet tips, 1-5 mL | VWR | 82018-840 | |
| Potassium persulfate (K2S2O8), ≥99.0% | Sigma Aldrich | 216224-100G | |
| Potassium phosphate dibasic anhydrous (K2HPO4) | Fisher Scientific | P288-500 | |
| Potassium phosphate monobasic (KH2PO4) | Fisher Scientific | P285-500 | |
| PYREX 250 mL Short Neck Boiling Flask, Round Bottom | Corning | 4321-250 | |
| Reversed phase C18 Analytical Column (100 x 3 mm) Accucore aQ | Thermo Scientific | 17326-103030 | |
| Roto evaporator, IKA RV 10 | IKA | 0010005185 | |
| Sodium carbonate (NaCO3) anhydrous | Fisher Chemical | S263-1 | |
| Sodium chloride (NaCl) | Mallinckrodt AR® | 7581 | |
| Sodium phosphate dibasic anhydrous (Na2HPO4) | Fisher Scientific | BP332-500 | |
| Sodium phosphate monobasic anhydrous (NaH2PO4) | Fisher bioreagents | BP329-500 | |
| Standardization pipet tips 0-200µL | Fisherbrand | 02-681-134 | |
| Syringe Driven Filter unit (0.22 µm) | Millex®-GV | SLGVR04NL | |
| Target micro-serts vial insert (400 µL) | Thermo Scientific | C4011-631 | |
| Ultrapure water (Direct Q-3 UV system with pump) | Millipore | ZRQSVP030 |
Ссылки
- Huitu, O., et al. Silicon, endophytes and secondary metabolites as grass defenses against mammalian herbivores. Frontiers in Plant Science. 5, 478 (2014).
- Joshi, J. R., Burdman, S., Lipsky, A., Yariv, S., Yedidia, I. Plant phenolic acids affect the virulence of Pectobacterium aroidearum and P. carotovorum ssp. brasiliense via quorum sensing regulation. Molecular Plant Pathology. 17 (4), 487-500 (2016).
- Dykes, L., Rooney, L. W. Phenolic compounds in cereal grains and their health benefits. Cereal Foods World. 52 (3), 105-111 (2007).
- Xiang, J., Apea-Bah, F. B., Ndolo, V. U., Katundu, M. C., Beta, T. Profile of phenolic compounds and antioxidant activity of finger millet varieties. Food Chemistry. 275, 361-368 (2019).
- Qiu, Y., Liu, Q., Beta, T. Antioxidant properties of commercial wild rice and analysis of soluble and insoluble phenolic acids. Food Chemistry. 121 (1), 140-147 (2010).
- Beverly, R. L., Motarjemi, Y. . Encyclopedia of Food Safety. 3, 309-314 (2014).
- FAO. Food Outlook - Biannual report on global food markets. Food and Agriculture Organization. , (2020).
- Erbersdobler, H. F., Barth, C. A., Jahreis, G. Legumes in human nutrition. Nutrient content and protein quality of pulses. Ernahrungs Umschau. 64 (9), 134-139 (2017).
- Dueñas, M., Hernández, T., Estrella, I. Assessment of in vitro antioxidant capacity of the seed coat and the cotyledon of legumes in relation to their phenolic contents. Food Chemistry. 98 (1), 95-103 (2006).
- Khang, D. T., Dung, T. N., Elzaawely, A. A., Xuan, T. D. Phenolic profiles and antioxidant activity of germinated legumes. Foods. 5 (2), 27 (2016).
- Hefni, M. E., Amann, L. S., Witthöft, C. M. A HPLC-UV method for the quantification of phenolic acids in cereals. Food Analytical Methods. 12 (12), 2802-2812 (2019).
- AOAC. . Official Methods of Analysis. 17th edn. , (2000).
- Apea-Bah, F. B., Head, D., Scales, R., Bazylo, R., Beta, T. Hydrothermal extraction, a promising method for concentrating phenolic antioxidants from red osier dogwood (Cornus stolonifer) leaves and stems. Heliyon. 6 (10), 05158 (2020).
- Apea-Bah, F. B., Minnaar, A., Bester, M. J., Duodu, K. G. Sorghum-cowpea composite porridge as a functional food, Part II: Antioxidant properties as affected by simulated in vitro gastrointestinal digestion. Food Chemistry. 197, 307-315 (2016).
- Robbins, R. J., Bean, S. R. Development of a quantitative high-performance liquid chromatography-photodiode array detection measurement system for phenolic acids. Journal of Chromatography A. 1038 (1-2), 97-105 (2004).
- Singleton, V. L., Rossi, J. A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. American Journal of Enology and Viticulture. 16, 144-158 (1965).
- Prior, R. L., Wu, X., Schaich, K. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements. Journal of Agricultural and Food Chemistry. 53 (10), 4290-4302 (2005).
- Ainsworth, E. A., Gillespie, K. M. Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin-Ciocalteu reagent. Nature Protocols. 2 (4), 875-877 (2007).
- Waterhouse, A. L. Determination of total phenolics. Current Protocols in Food Analytical Chemistry. 1, 1-8 (2002).
- Huang, D., Ou, B., Prior, R. L. The chemistry behind antioxidant capacity assays. Journal of Agricultural and Food Chemistry. 53 (6), 1841-1856 (2005).
- Esterbauer, H., Wäg, G., Puhl, H. Lipid peroxidation and its role in atherosclerosis. British Medical Bulletin. 49 (3), 566-576 (1993).
- Esterbauer, H., Gebicki, J., Puhl, H., Jürgens, G. The role of lipid peroxidation and antioxidants in oxidative modification of LDL. Free Radical Biology and Medicine. 13 (4), 341-390 (1992).
- Apea-Bah, F. B., Serem, J. C., Bester, M. J., Duodu, K. G. Phenolic composition and antioxidant properties of Koose, a deep-fat fried cowpea cake. Food Chemistry. 237, 247-256 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены