Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Производство аденоассоциированных вирусных векторов в клеточных стеках для доклинических исследований на крупных животных моделях
В этой статье
Резюме
Здесь мы предоставляем подробную процедуру крупномасштабного производства векторов AAV исследовательского класса с использованием адгезивных клеток HEK 293, выращенных в клеточных стеках, и аффинной хроматографической очистки. Этот протокол последовательно дает >1 x 1013 векторных геномов / мл, обеспечивая векторные количества, подходящие для исследований на крупных животных.
Аннотация
Векторы аденоассоциированного вируса (AAV) являются одними из наиболее клинически продвинутых векторов генной терапии, причем три генные терапии AAV одобрены для людей. Клиническое продвижение новых приложений для AAV включает переход от моделей мелких животных, таких как мыши, к более крупным животным моделям, включая собак, овец и нечеловеческих приматов. Одним из ограничений введения AAV более крупным животным является потребность в больших количествах вируса с высоким титром. В то время как культура суспензионных клеток является масштабируемым методом для производства векторов AAV, немногие исследовательские лаборатории имеют оборудование (например, биореакторы) или знают, как производить AAV таким образом. Кроме того, титры AAV часто значительно ниже при производстве в клетках суспензии HEK 293 по сравнению с адгезивными клетками HEK293. Здесь описан способ получения больших количеств высокотитерных AAV с использованием клеточных стеков. Также описан подробный протокол титрования AAV, а также методы проверки чистоты векторов. Наконец, представлены репрезентативные результаты экспрессии трансгенов, опосредованной AAV, в модели овец. Этот оптимизированный протокол для крупномасштабного производства векторов AAV в адгезивных клетках позволит лабораториям молекулярной биологии продвигать тестирование своих новых методов AAV-терапии на более крупных животных моделях.
Введение
Генная терапия с использованием векторов аденоассоциированного вируса (AAV) добилась огромных успехов за последние три десятилетия1,2. Продемонстрированные улучшения в различных генетических заболеваниях, включая врожденную слепоту, гемофилию и заболевания опорно-двигательного аппарата и центральной нервной системы, вывели генную терапию AAV на передний план клинических исследований3,4. В 2012 году Европейское агентство по лекарственным средствам (EMA) одобрило Glybera, вектор AAV1, экспрессирующий липопротеинлипазу (LPL) для лечения дефицита LPL, что делает его первым маркетинговым разрешением на лечение генной терапией в Европе или Соединенных Штатах5. С тех пор две дополнительные генные терапии AAV, Luxturna6 и Zolgensma7,получили одобрение FDA, и ожидается, что рынок будет быстро расширяться в течение следующих 5 лет с 10-20 генными терапиями, ожидаемыми к 2025году 8. Имеющиеся клинические данные свидетельствуют о том, что генная терапия AAV является безопасным, хорошо переносимым и эффективным методом, что делает ее одним из наиболее перспективных вирусных векторов, с более чем 244 клиническими испытаниями с участием AAV, зарегистрированных с ClinicalTrials.gov. Растущий интерес к клиническим применениям, связанным с векторами AAV, требует надежных и масштабируемых методов производства для облегчения оценки AAV-терапии на крупных животных моделях, поскольку это критический шаг в трансляционном конвейере9.
Для производства векторов AAV двумя основными требованиями являются геном AAV и капсид. Геном дикого типа (wt)-AAV представляет собой одноцепочечную ДНК длиной примерно 4,7 кб10. Геном wt-AAV содержит перевернутые концевые повторы (ITR), обнаруженные на обоих концах генома, которые важны для упаковки, и гены rep и cap 11. Гены rep и cap, необходимые для репликации генома, сборки вирусного капсида и инкапсуляции генома в вирусный капсид, удаляются из вирусного генома и предоставляются в транс для AAV векторной продукции12. Удаление этих генов из вирусного генома обеспечивает место для терапевтических трансгенов и всех необходимых регуляторных элементов, включая промотор и полиА-сигнал. РМЭ остаются в векторном геноме для обеспечения надлежащей репликации генома и вирусной инкапсуляции13,14. Чтобы улучшить кинетику экспрессии трансгенов, векторные геномы AAV могут быть спроектированы так, чтобы быть самокомплементарными, что смягчает необходимость преобразования из одноцепочечного в двухцепочечное преобразование ДНК во время репликации генома AAV, но снижает способность кодирования до ~ 2,4 кб15.
Помимо проектирования генома AAV, выбор серотипа капсида определяет тканевый и клеточный тропизм вектора AAV in vivo2. В дополнение к тканевому тропизму, было показано, что различные серотипы AAV демонстрируют различную кинетику экспрессии генов16. Например, Zincarelli et al.17 классифицировали различные серотипы AAV на серотипы с низкой экспрессией (AAV2, 3, 4, 5), серотипы умеренной экспрессии (AAV1, 6, 8) и серотипы с высокой экспрессией (AAV7 и 9). Они также классифицировали серотипы AAV на экспрессию с медленным началом (AAV2, 3, 4, 5) или экспрессию с быстрым началом (AAV1, 6, 7, 8 и 9). Эти расходящиеся тропизмы и кинетика экспрессии генов обусловлены аминокислотными вариациями в белках капсида, образованиях капсидного белка и взаимодействиях с рецепторами/корецепторами клеток-хозяев18. Некоторые капсиды AAV имеют дополнительные полезные характеристики, такие как способность пересекать гематоэнцефалический барьер после внутрисосудистого введения (AAV9) или находиться в долгоживущих мышечных клетках для длительной экспрессии трансгенов (AAV6, 6.2FF, 8 и 9)19,20.
Целью данной статьи является подробное описание экономически эффективного метода получения высокочистых, высокотитерных, исследовательских векторов AAV для использования в доклинических моделях крупных животных. Производство AAV с использованием этого протокола достигается с помощью двойной плазмидной трансфекции в адгезивные клетки эмбриональной почки человека (HEK)293, выращенные в клеточных стеках. Кроме того, в исследовании описан протокол очистки аффинной хроматографии гепарина сульфата, который может быть использован для серотипов AAV, содержащих гепаринсвязывающие домены, включая AAV2, 3, 6, 6.2FF, 13 и DJ21,22.
Для производства векторов AAV доступен ряд упаковочных систем. Среди них использование двухплазмидных котрансфекционных систем, в которых гены Rep и Cap и гены ad-хелпера (E1A, E1B55K, E2A, E4orf6 и VA РНК) содержатся в одной плазмиде (pHelper), имеет некоторые практические преимущества перед распространенным трехплазмидным (тройным) методом трансфекции, включая снижение затрат на производство плазмид23,24 . Плазмида генома AAV, содержащая кассету экспрессии трансгена (pTransgene), должна быть окружена ITR и не должна превышать ~4,7 кб в длину. Векторный титр и чистота могут быть затронуты трансгеном из-за потенциальных цитотоксических эффектов во время трансфекции. Оценка чистоты векторов описана в настоящем документе. Векторы, полученные с использованием этого метода, которые дают 1 x 1013 vg / mL для каждого, были оценены на моделях мышей, хомяков и овец.
Таблица 1: Состав требуемых растворов. Необходимая информация, включая проценты и объемы, компонентов, необходимых для различных решений по всему протоколу. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
протокол
1. Двойная плазмидная трансфекция клеток HEK293 в клеточных стеках
- Разморозить криоканец клеток HEK293 в бисерной ванне при температуре 37 °C.
ПРИМЕЧАНИЕ: Предварительно нагрейте полный DMEM до 37 ° C, пока ячейки оттаивают, чтобы гарантировать, что холодная температура не ударяет ячейки при покрытии. Убедитесь, что ячейки имеют низкое число прохода, в идеале менее 20, чтобы обеспечить оптимальный рост и эффективность трансфекции. Убедитесь, что клетки сертифицированы как не содержащие микоплазмы. - Переложите содержимое крио-флакона по каплям в коническую трубку объемом 15 мл, содержащую 10 мл предварительно нагретого полного DMEM, и центрифугируйте клетки при 500 х г в течение 5 мин.
- Аспирировать среду, а затем повторно суспендировать клетки HEK293 в 20 мл предварительно нагретого полного DMEM. Засейте клетки в пластину размером 15 см и инкубируйте при 37 °C, с 5% CO2.
- Разделите клетки с одной пластины размером 15 см на три для посева в камере культивирования клеток.
- Как только клетки сольются на 80%, аспирируйте среду и аккуратно промойте пластину 3 мл PBS, чтобы не нарушить монослой. Затем аспирировать PBS и добавить 3 мл трипсина.
- Инкубировать в течение 2 мин при 37 °C до тех пор, пока клетки не поднимутся с пластины, а затем нейтрализовать трипсин, добавив в пластину 7 мл полного DMEM.
- Соберите все среды и ячейки в трубку объемом 15 мл и гранулируйте клетки путем центрифугирования при 500 х г в течение 5 мин.
- Аспирировать супернатант из 15 мл трубки и повторно суспендировать клеточную гранулу в 3 мл полного DMEM. Добавьте 1 мл к каждой 15-сантиметровой пластине, содержащей 20 мл полного DMEM; аккуратно раскачивают пластины, чтобы равномерно распределить клетки, и инкубируют при 37 °C, с 5% CO2.
- Как только клетки сольются на 80%, повторите шаги 1.4.1 и 1.4.2. Соберите супернатант в конические трубки объемом 50 мл и осторожно переверните трубку, чтобы убедиться, что клетки однородны.
- Определяют плотность клеток, смешивая 10 мкл образцов клеток с 10 мкл трипанового синего цвета и добавляя смесь на слайд подсчета клеток для анализа в счетчике клеток.
- Смешайте 1 л предварительно подогретого полного DMEM с необходимой клеточной суспензией для засева клеточной культуральной камеры (площадь поверхности 6360см2)с 1 х 104 клетками /см2. Перелейте клеточную смесь в камеру клеточной культуры и осторожно вращайте, чтобы равномерно распределить клетки по каждому монослою(рисунок 1)и инкубировать при 37 °C, с 5% CO2.
- В дополнение к камере для культивирования клеток, пластина 15 см с 1 х 104 клетками /см2 в качестве эталона для слияния.
- После ~ 65-часовой инкубации проверьте опорную пластину на слияние - в идеале ~ 80%-90% слива.
ПРИМЕЧАНИЕ: Предварительно нагрейте полный DMEM для добавления в камеру клеточной культуры при 37 °C.
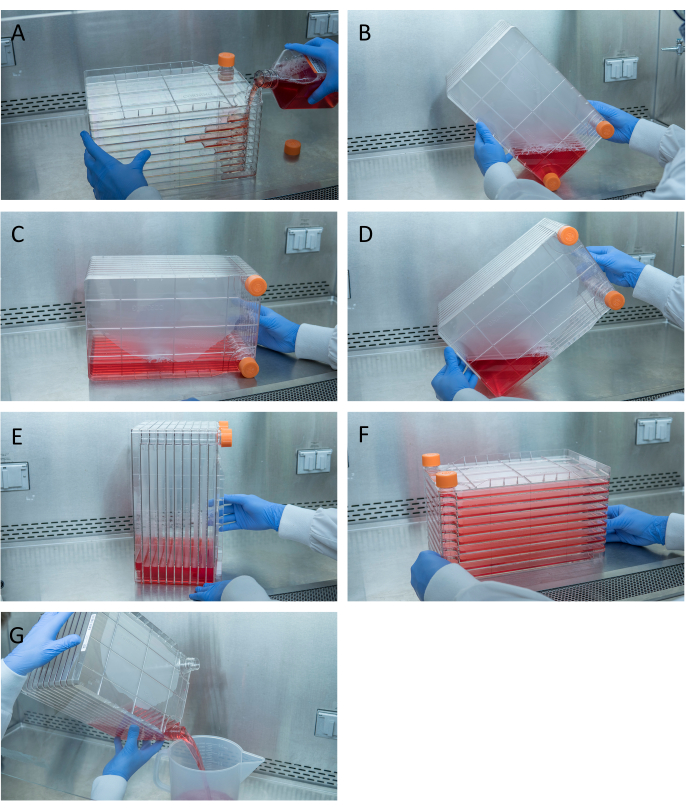
Рисунок 1:Маневрирование клеточного стека для посева и трансфекции клеток. Для посева стека клеток начните с удаления одного из вентиляционных колпачков и заливки 1 л предварительно нагретого полного DMEM с необходимым количеством ячеек HEK293(A). Равномерно распределите ячейки и среды, затянув оба вентиляционных колпачка, и поднесите все среды к углу стека ячеек с помощью одного из вентиляционных колпачков и поместите его в этот угол(B),поместите стек ячеек на его сторону(C),а затем поверните стек ячеек на 90 °(D)так, чтобы вентиляционные порты были вверх(E). Осторожно опустите стек ячеек в нормальное горизонтальное положение и убедитесь, что все камеры стека ячеек полностью покрыты средой(F). При трансфекции открутите оба вентиляционных колпачка и медленно вылейте старую среду в контейнер для отходов стерильных отходов, чтобы ровный поток не нарушал монослой ячеек(G). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Готовят смесь полиэтиленимин (PEI)/ДНК при соотношении концентраций 3:1 (мас./мас.).
- Готовят смесь ДНК в конической пробирке объемом 50 мл, добавляя 475 мкг pTrangene и 1425 мкг pHelper к 40 мл восстановленной сывороточной среды для создания соотношения pHelper:pTrangene 3:1.
ПРИМЕЧАНИЕ: Калькулятор смеси PEI/ДНК можно найти в таблице 2. - Добавьте 5,7 мл PEI (1 г/л) в восстановленную сывороточную среду и смесь ДНК по каплям. Затем кратковременно вихрь и насиживайте в течение 10 мин при комнатной температуре.
ПРИМЕЧАНИЕ: Поскольку PEI / ДНК инкубируется при комнатной температуре, она становится слегка мутной.
- Готовят смесь ДНК в конической пробирке объемом 50 мл, добавляя 475 мкг pTrangene и 1425 мкг pHelper к 40 мл восстановленной сывороточной среды для создания соотношения pHelper:pTrangene 3:1.
- После 8 мин инкубации PEI/ДНК удалите среду из камеры клеточной культуры.
ПРИМЕЧАНИЕ: Убедитесь, что обе оранжевые колпачки ослаблены, чтобы поддерживать плавный поток среды, чтобы избежать смещения ячеек. - Добавьте PEI/ДНК к 1 л предварительно разогретого полного DMEM и медленно влейте смесь в порт камеры клеточной культуры. Распределите жидкость равномерно по всем рядам(рисунок 1)и инкубируйте в течение 72 ч при 37 °C, с 5% CO2.
2 Сбор AAV и химический лизис трансфектированных клеток HEK293
- Энергично встряхните камеру клеточной культуры, чтобы выбить клетки до тех пор, пока среда не станет мутной от вытесненных клеток, и перелейте в четыре трубки центрифуги по 500 мл.
- Центрифугируйте пробирки при 18 000 х г в течение 30 мин при 4 °C, чтобы гранулировать ячейки. Перелейте осветленное супернатант в бутылку полиэтилентерефталатного сополиэфистра (ПЭТГ) объемом 1 л.
ПРИМЕЧАНИЕ: Если у вас нет доступа к высокоскоростной центрифуге, центрифуга при 12 000 х г в течение 40 мин. Гранулированные ячейки могут не быть твердыми на этой скорости и будут скользить как выливающийся супернатант. - Повторно суспендируют гранулы клеток в центрифужных трубках объемом 500 мл с буфером лизиса 50 мл и инкубируют в течение 60 мин при 37 °C.
- Центрифугируйте пробирки при 18 000 х г в течение 30 мин, а затем переложите супернатант в ту же бутылку PETG объемом 1 л. Выбросьте гранулированный клеточный мусор.
ПРИМЕЧАНИЕ: Немедленно очистите осветленный супернатант и храните при температуре 4 °C в течение 72 ч. Для длительного хранения храните при температуре -80 °C. Не хранить при температуре -20 °C.
3 AAV Векторная очистка с использованием гепариновой аффинной хроматографии
- Удалите сырой лизат с -80 °C и оставьте при 4 °C на ночь, чтобы оттаять. После размораживания используйте фильтр 0,22 мкМ для фильтрации сырого лизата.
- Чтобы пассивировать центробежный концентратор, добавьте 4 мл фильтрующего буфера предварительной обработки в центробежный концентратор для каждой используемой колонны сефарозы гепарина. Пассивируют центробежную концентратор при комнатной температуре в течение 2-8 ч. Установите пассивацию непосредственно перед этапами очищения.
- Настройте трубку и насос(рисунок 2).
- Поместите трубку в перистальтический насос и запустите 20 мл 1 М NaOH. Затем запустите 50 мл молекулярной воды, а затем запустите 50 мл базального DMEM.
- Прикрепите 5 мл гепарина сефарозного столба к трубке и запустите 25 мл базального DMEM для удаления консерванта.
- Пропустите 0,2 мкМ отфильтрованного сырого лизата через колонну со скоростью потока 1-2 капли/с.

Рисунок 2:Установка перистальтического насоса для очистки AAV. Запустите трубку из сырого лизата, через перистальтический насос и в колонку гепариновой матрицы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
ПРИМЕЧАНИЕ: Убедитесь, что вы не вводите пузырьки и не позволяете колонке высохнуть, так как это поставит под угрозу колонну и предотвратит элюирование AAV. Отбросьте столбец, если он высохнет, и используйте новый столбец для остатка сырого лизата.
- Загрузите весь сырой лизат на гепариновую колонну и используйте следующие растворы для промывки колонны.
- Мойте, используя 50 мл 1x сбалансированных солевых растворов Хэнка (HBSS) без Mg2+ и Ca2+.
- Промыть 15 мл 0,5 % N-лауроилсаркозина в HBSS без Mg2+ и Ca2+.
- Мойте, используя 50 мл HBSS без Mg2+ и Ca2+.
- Мойте, используя 50 мл HBSS с Mg2+ и Ca2+
- Мойте, используя 50 мл 200 мМ NaCl/HBSS с Mg2+ и Ca2+.
- Elute 5 x 5 мл (всего 25 мл) с 300 мМ NaCl/HBSS с Mg2+ и Ca2+ и маркировка элюций как E1-E5 (каждое элюирование составляет 5 мл).
- Концентрация вируса с помощью центробежного концентратора
- Раскрутите центробежный концентратор, содержащий буфер предварительной обработки, при 900 х г в течение 2 мин. Отбросьте сквозной поток.
- Промыть центробежный концентраторный фильтр 4 мл HBSS с Mg2+ и Ca2+ и центрифугой при 1000 х г в течение 2 мин; отбросьте сквозной поток.
- Добавьте элюирование E2 к центробежному концентратору. Открутите при 1000 х г в течение 5 мин и отбросьте сквозной поток.
- Закончите добавление E2, а затем добавьте E3 к центробежному концентратору и вращайте при 1000 х г в течение 5 мин, пока концентрированный вирус не составит приблизительно 1 мл.
ПРИМЕЧАНИЕ: Избегайте центрифугирования вектора таким образом, чтобы объем был ниже уровня фильтра. Не концентрируйте E1, E4 или E5 в центробежном концентраторе, так как они содержат очень мало или вообще не содержат векторов и содержат загрязняющие вещества. - Удалите концентрированный вирус из центробежного концентратора с помощью фильтрованного наконечника p200 и поместите его в стерильную центрифужную трубку объемом 1,5 мл.
- Промойте центробежный концентратор 200 мкл HBSS с Mg2+ и Ca2+, чтобы выбить оставшийся AAV из фильтра. Пипетка вверх и вниз энергично несколько раз (в течение ~ 30 с), чтобы вытеснить любой вирус, прилипший к мембране, и поместить в 1,5 мл центрифужную трубку с остальной частью вируса. Хорошо перемешайте трубку.
- Aliquot 5 мкл для экстракции ДНК и хранения очищенного вектора при -80 °C.
- Вымойте колонну, используя 25 мл 2 M NaCl. Далее используйте 25 мл 0,1% Triton X-100, предварительно нагретого до 37 °C, для промывки колонны. Далее промыть колонну, используя 50 мл стерильного dH2O,а затем промыть, используя 25 мл 20% этанола.
- Убедитесь, что колонная мембрана полностью насыщена 20% этанолом, так как это решение для хранения. Запечатайте колонну с помощью заглушек и храните при температуре 4 °C.
- Храните трубку в 1 М NaOH.
ПРИМЕЧАНИЕ: При правильной очистке гепариновые сефарозные колонны можно повторно использовать до пяти раз.
4 AAV геномная экстракция ДНК
- Готовят реакционную смесь, указанную в таблице 3, в ПЦР-пробирке для лечения ДНКазой.
| Компонент | Том |
| Очищенный вектор AAV | 5 мкл |
| 10x ДНКазный буфер | 2 мкл |
| ДНКаза | 1 мкл |
| ддН2О | 12 мкл |
| Заключительный том | 20 мкл |
Таблица 3: Формула мастер-микса для обработки ДНКазы. Рекомендуемые компоненты и объемы, необходимые для лечения ДНКазой вирусных векторов AAV во время экстракции ДНК.
- Вихрь трубки ПЦР для смешивания и импульса трубки ПЦР для раскрутки содержимого.
- Используя термоциклер, инкубируйте при 37 °C в течение 20 мин, а затем 75 °C в течение 15 мин для нагрева инактивации ДНКазы.
- Добавьте 5 мкл протеиназы К.
- Используя термоциклер, инкубируют при 50 °C в течение 60 мин, а затем при 95 °C в течение 30 мин для нагрева инактивации протеиназы K.
- Используйте набор для очистки ДНК для удаления потенциальных загрязняющих веществ.
ПРИМЕЧАНИЕ: Этот шаг был выполнен с использованием коммерчески доступного набора для очистки крови итканей (Таблица материалов).- Добавьте 200 мкл AL-буфера (набор для очистки крови и тканей, Таблица материалов)в ПЦР-трубку, содержащую вектор, обработанный ДНКазой/Протеиназой К.
- Вихрьте трубку ПЦР и инкубируйте при 56 °C в течение 10 мин в термоциклере.
- Пипетка жидкости из ПЦР-трубки в стерильный отжимной столб, сидящий в коллекторной трубке.
- Добавьте в колонку 200 мкл 100% этанола и тщательно перемешайте путем вихря.
- Центрифуга при 6 000 х г в течение 1 мин и отбрасывайте поток.
- Добавьте 500 мкл буфера AW1 (комплект для очистки крови и тканей, таблица материалов) в спиновуюколонку.
- Центрифуга при 6 000 х г в течение 1 мин и отбрасывайте поток.
- Добавьте 500 мкл буфера AW2 (набор для очистки крови и тканей, Таблица материалов) в спиновуюколонку.
- Центрифуга при 15 000 х г в течение 3 мин и отбрасывает поток насквозь.
- Поместите спиновую колонну в стерильную центрифужную трубку объемом 1,5 мл и добавьте 200 мкл буфера AE (набор для очистки крови и тканей, таблица материалов)непосредственно к мембране спиновой колонны.
- Инкубировать при комнатной температуре в течение 1 мин.
- Центрифуга при 6000 х гв течение 1 мин для элюирования ДНК.
- Храните ДНК при -20 °C.
5 Титрование геномов векторов AAV с использованием количественной полимеразной цепной реакции и зонда вируса обезьян 40 (SV40)
ПРИМЕЧАНИЕ: Выполните всю работу qPCR в вытяжке ПЦР, используя фильтрованные наконечники пипетки, чтобы избежать внешнего загрязнения ДНК. Если геном AAV не кодирует последовательность SV40 polyA, используйте зонд против ITR, описанного в другом месте25. Убедитесь, что плазмидная ДНК, выбранная в качестве стандарта, содержит последовательность SV40 polyA.
- Стандартная подготовка запасов
- Разбавляют исходный стандарт плазмиды ДНК (птрансгенную плазмиду, содержащую последовательность SV40 polyA) до конечной концентрации 10 мкг/мкл и хранят при -20 °C в 6 мкл аликвот.
- Определите номер копии, присутствующей в стандарте плазмидной ДНК, используя следующий онлайн-калькулятор26.
ПРИМЕЧАНИЕ: Используйте плазмидную ДНК, используемую для стандарта, производимого коммерческим поставщиком, чтобы обеспечить качество и правильную концентрацию. Подготовить большое количество стандарта (например, 10 мл) для проведения промежуточных исследований при переходе на вновь подготовленный стандарт.
- Приготовьте следующую смесь реагентов, указанную в таблице 4, как для образцов, так и для стандарта в центрифужной трубке объемом 1,5 мл.
ПРИМЕЧАНИЕ: Подготовьте достаточный избыток мастер-микса. Последовательности грунтовки/зонда см. в таблице 5.
| Компонент | Том |
| Универсальный мастер-микс qPCR (2X) | 10 мкл |
| Молекулярная вода | 4.5 мкл |
| 40x SV40 полиA грунтовка/зонд | 0.5 мкл |
| Заключительный том | 15 мкл |
Таблица 4: Мастер-микс qPCR для титрования AAV. Рекомендуемые компоненты и объемы, необходимые для qPCR ДНК, извлеченной из вирусных векторов AAV.
| Компонент | Последовательность |
| Грунтовка вперед | 5'-AGCAATAGCATCAAATTTCACAA-3' |
| Обратная грунтовка | 5'-ЧАГАКАТГАТААТАКАТАКАТТГАТТАГТАГТТ-3' |
| Зонд | /56-FAM/AGCATTTTT/Zen/TTCACTGCATTCTAGTTGTGGTTTGTC/3IABkFQ |
Таблица 5: Праймерные последовательности по отношению к последовательности ДНК SV40 polyA. Последовательности праймеров и зондов, используемых для титрования qPCR, которые связываются с конкретными областями вирусных векторов AAV, содержащими последовательность SV40 polyA.
- Пипетка мастер микс вверх и вниз для микширования.
- Установите разбавляющую пластину.
- Используйте прозрачную 96-луночную пластину для подготовки стандартных и пробных разбавлений, добавьте 45 мкл молекулярной воды в каждую скважину в каждой другой колонке, начиная с колонки 1 (колонки 1, 3, 5, 7, 9 и 11).
- Добавить 5 мкл стандарта в колодец А1 и пипетку перемешать.
- Используйте новый фильтрованный наконечник пипетки для создания разбавления 1/10 от скважины A1 до B1.
- Продолжайте серию 10-кратных разведений вниз по колонке до достижения G1.
- Не добавляйте к H1, так как это будет действовать как отрицательный контроль.
- Нанесите первый образец (S1), добавив его в скважину A3, образуя разбавление 1/10. Пипетку этой смеси и переложить 5 мкл в лунку В3. Отбросьте наконечник пипетки после этой передачи.
- С новым наконечником пипетки смешайте раствор в скважине B3 и получите 1/100 разбавления. Переложите 5 мкЛоф этой смеси в скважину С3 и выбросьте наконечник после переноса.
- С новым наконечником пипетки, пипеткой вверх и вниз раствор в скважине C3, чтобы сделать разбавление 1/1000. Отбросьте наконечник.
- Продолжайте разбавлять образцы, не добавляя образцы в колонки 2, 4, 6, 8, 10 или 12.
- После того, как все образцы будут разбавлены, смешайте содержимое в колодцах колонны 1, а затем переложите 20 мкл в колонку 2.
- Повторите это для столбцов 3, 5, 7, 9 и 11, чтобы создать реплики каждого стандарта и разбавления образца. См. рисунок 3 для компоновки пластин.
ПРИМЕЧАНИЕ: При следующей установке пластин на рисунке 3образцы, разбавленные рядами G и H, будут иметь только 1/10 и 1/100 разбавления.
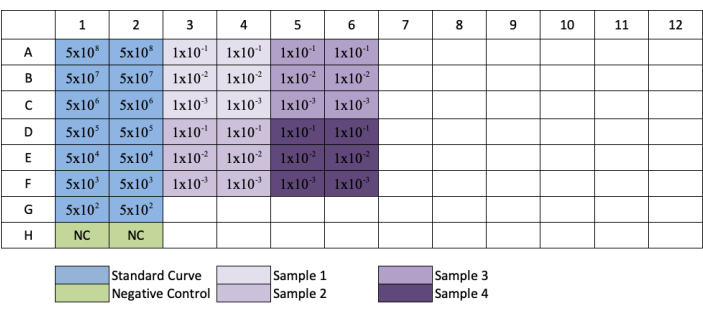
Рисунок 3:Компоновка пластин для титрования qPCR AAV. Синим цветом обозначено размещение серийного разбавления стандарта; зеленый цвет указывает на размещение отрицательного контроля; фиолетовый указывает на размещение разбавления образцов. Каждый стандартный, отрицательный или образец добавляется в реплику. Был добавлен пример концентрации стандарта, показывающий ряды разрежения стандарта, и размещение разбавления проб было добавлено в их соответствующие скважины. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Титрование с помощью qPCR на основе обнаружения полиА SV40
- Добавьте 15 мкл мастер-микса qPCR в каждую лунку 96-луночной пластины qPCR с белым полуоблетом.
- Перенесите 5 мкл каждого образца с прозрачной 96-луночной пластины на белую полуокнистую 96-луночную пластину qPCR.
- Используйте многоканальную пипетку, чтобы обеспечить адекватное смешивание основного микса и образца qPCR.
- Запечатайте пластину уплотнительной пленкой и центрифугируйте пластину qPCR при 1500 х г в течение 30 с.
- Запустите реакцию qPCR на пластинчатом инструменте амплификации и детектирования ПЦР в режиме реального времени, используя условия, предложенные в таблице 6.
| Секция | Циклов | Время | Температура | Описание |
| Предварительная инкубация | в 1 раз | 5 мин | 95 °С | Денатурация ДНК. |
| Усиление | в 38 раз | 15 с | 95 °С | Амплификация ДНК. Настройки могут быть изменены при использовании альтернативных грунтовок с различными температурами отжига. |
| 60 с | 60 °С | |||
| Охлаждение | в 1 раз | 60 с | 40 °С | Охлаждение пластин. Окончание пробега. |
Таблица 6: Протокол термоциклера для титрования qPCR на основе гидролизного зонда. Рекомендуемый термоциклерный протокол для использования зондового qPCR-титрования ДНК экстрагированных очищенных векторов AAV.
ПРИМЕЧАНИЕ: Таблицу титрования qPCR AAV см. в таблице 7.
- Анализ данных для определения числа копий генома AAV.
- Заполните ячейки данных электронной таблицы(таблица 7А)значениями концентрации, полученными в результате выполнения qPCR как для стандартных, так и для образцов разбавлений.
- Используйте значения концентрации из таблицы 7А для получения стандартной кривой(таблица 7В).
ПРИМЕЧАНИЕ: Стандартная кривая будет показана как натуральный логарифм (y = a ln(x) + b) вместе с эффективностью R2. Стандартная кривая должна иметь КПД, близкий к 100 %, иR2, близкий к 1,0 (≥0,99). - Заполните эффективность уклона, заполнив этот онлайн калькулятор27.
ПРИМЕЧАНИЕ: КПД в пределах 90%-110% является приемлемым. Если эффективность qPCR находится за пределами этого диапазона, повторно запустите qPCR. - Используйте значения концентрации из таблицы 7А для усреднения разбавлений каждого образца и определения стандартного отклонения каждого образца(таблица 7С).
ПРИМЕЧАНИЕ: Исключить разбавления из проб, которые более чем на одно стандартное отклонение от среднего значения разбавления пробы. - Используя среднюю концентрацию каждого разбавления, умножаем на коэффициент разбавления, а затем делим на пять, чтобы получить векторные геномы (vg)/мкл каждого образца(таблица 7C).
- Рассчитать vg/мл каждого образца, умножив среднее значение концентраций каждого образца на 80 000(таблица 7C).
- Усредните vg/ml каждого разбавления для получения конечного vg/mL каждого образца(таблица 7C).
ПРИМЕЧАНИЕ: Пользователь должен разделить среднюю концентрацию каждого разбавления на коэффициент пять для учета 5 мкл, загруженных в каждую скважину для пробега qPCR для получения концентрации в vg/μL. Коэффициент 80 000 учитывает переход от среднего значения концентрации каждой пробы к vg/mL. Во-первых, среднее значение концентрации каждого образца должно быть умножено на 2, чтобы учесть одноцепочечные геномы, поскольку набор праймер-зонд количественно определяет только одноцепочечную ДНК с положительным смыслом (ssDNA), а геном AAV существует в приблизительном соотношении 1:1 между ssDNA с положительным и отрицательным смыслом25,28. Среднее значение концентрации каждого образца должно быть умножено x40 для учета разбавления образца с 5 мкл очищенного вектора (раздел 4.1) до 200 мкл экстрагированной ДНК (раздел 4.6.12). Наконец, среднее значение концентрации каждого образца должно быть умножено на 1000 для преобразования из vg/μL в vg/mL.
6 Оценка качества и чистоты векторов
- Контроль качества - Вестерн Блот
- Приготовьте 12% гель SDS PAGE.
- Выполняют электрофорез полиакриламидного геля.
ПРИМЕЧАНИЕ: Нагрузка 6 x 1010 vg образцов на скважину. - Перенос белков на мембрану поливинилидендифторида (PVDF).
- Блокировка PVDF мембраны
- Снимите мембрану с передаточного аппарата и промойте в 0,1% PBST, чтобы удалить рыхлый акриламид.
- Поместите мембрану в блокирующий раствор на срок не менее 1 ч при комнатной температуре или на ночь при 4 °С.
ПРИМЕЧАНИЕ: Блокирующий буфер может быть дополнительно дополнен 2% козьей сывороткой.
- Инкубация с первичными антителами
- Декантируйте блокирующий буфер и добавляйте первичное антитело, анти-AAV мышиное моноклональное антитело в разведении 1:200.
- Инкубировать в течение ночи при 4 °C.
- Декантировать первичное антитело и промывать пять раз 0,1% ПБСТ в течение 5 мин при комнатной температуре с перемешиванием.
- Инкубация с вторичными антителами
- Декантируют промывной раствор и добавляют HRP-конъюгированное вторичное антитело, разбавленное при 1:7500 в блокирующем буфере, и инкубируют в течение 1 ч при комнатной температуре с перемешиванием.
- Декантировать вторичное антитело и промыть пять раз 0,1% ПБСТ в течение 5 мин при комнатной температуре с перемешиванием.
- Выполните окончательную промывку PBS при комнатной температуре с перемешиванием.
- Обнаружение белков с помощью усиленного хемилюминесцентного (ECL) субстрата.
- Изображение геля для визуализации вирусных белков (субъединицы VP1, VP2 и VP3)(рисунок 4).

Рисунок 4:Вестерн-блот, показывающий белки капсида AAV. Переулок А; Лестница MW, полоса B; AAV6.2FF-hIgG01, полоса C; AAV6.2FF-hIgG02, полоса D; AAV6.2FF-hIgG03 и полоса E; AAV6.2FF-hIgG04. 6 x 1010 vg каждого AAV6.2FF-hIgG был загружен в соответствующие полосы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Контроль чистоты - SDS PAGE и Coomassie Stain
- Подготовьте гель SDS-PAGE и образцы, как описано на этапах 6.1.1 и 6.1.2.
- Зафиксируйте гель в фиксирующем растворе на 1 ч или на ночь с легким перемешиванием. Замените фиксирующий раствор один раз в течение первого часа.
- Окрашивайте гель в окрашивающий раствор в течение 2-4 ч с мягким перемешиванием.
- Очистите гель раствором. Восполняйте очищающий раствор несколько раз до полного очищения фона геля (4-24 ч).
- Храните очищенный гель в растворе для хранения.
- Визуализируйте гель для визуализации всех белков, окрашенных окрашивающим раствором Coomassie.
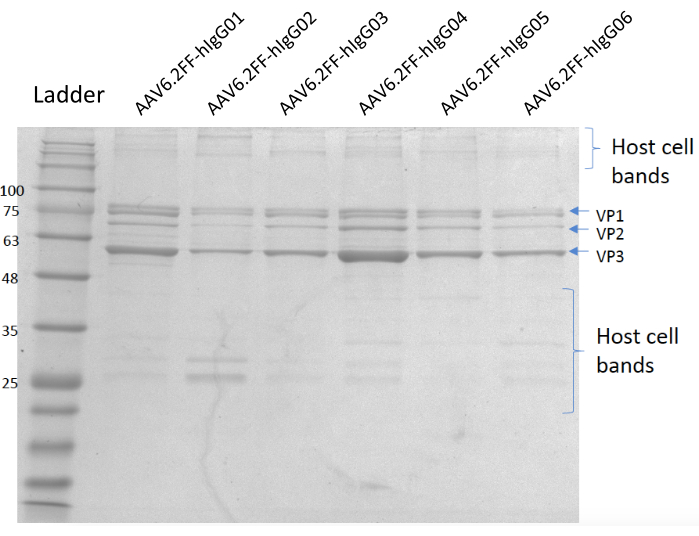
Рисунок 5:Гель, окрашенный Кумасси. Переулок А; Лестница MW, полоса B; AAV6.2FF-hIgG01, полоса C; AAV6.2FF-hIgG02, полоса D; AAV6.2FF-hIgG03, полоса E; AAV6.2FF-hIgG04, полоса F; AAV6.2FF-hIgG05 и полоса G; AAV6.2FF-hIgG06. 6 x 1010 vg каждого AAV6.2FF-hIgG был загружен в соответствующие полосы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Альтернативный анализ контроля чистоты - HEK293 обнаружение белка клетки-хозяина ELISA
- Выполните обнаружение белка клетки-хозяина HEK293 с помощью ИФА в соответствии с инструкциями производителя.
ПРИМЕЧАНИЕ: Используйте разбавления 5 х 10-2 и 1 х 10-3 для очищенных образцов rAAV. После того, как TMB добавлен в колодец, высиживайте вдали от света. Линейная регрессия не может быть использована для анализа результатов. - Выполните двухточечный анализ, кубический сплайн или четырехпараметрический метод логистической подгонки для интерполяции концентраций неизвестных и умножения на коэффициент разрежения для определения исходной концентрации образца.
- Выполните обнаружение белка клетки-хозяина HEK293 с помощью ИФА в соответствии с инструкциями производителя.
Результаты
Перевод с моделей мелких грызунов на более крупные модели животных и возможное клиническое применение представляет собой значительную проблему из-за большого количества AAV, необходимого для передачи более крупных животных и достижения терапевтических эффектов. Чтобы сравнить эффект...
Обсуждение
Производство рекомбинантных векторов AAV (rAAV), описанных в этой статье, использует общие материалы, реагенты и оборудование, найденные в большинстве исследовательских лабораторий и объектов молекулярной биологии. Эта статья позволяет читателю производить высококачественные rAAV in vitro<...
Раскрытие информации
Сара К. Вуттон является изобретателем по патенту США US10806802B2 для капсида AAV6.2FF.
Благодарности
Амира Д. Ргей, Бренна А. Й. Стивенс, Сильвия. Томас и Джейкоб Г. Э. Йейтс были получателями стипендий для студентов ветеринарного колледжа Онтарио, а также стипендий для выпускников Онтарио. Амира Д. Ргей была удостоена премии Mitacs Accelerate Studentship. Эта работа финансировалась грантом Проекта Канадских институтов исследований в области здравоохранения (CIHR) (#66009) и грантом совместных исследовательских проектов в области здравоохранения (NSERC partnered) (#433339) для SKW.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | Millipore Sigma | S2GPU05RE | |
| 0.25% Trypsin | Fisher Scientific | SM2001C | |
| 1-Butanol | Thermo Fisher Scientific | A399-4 | CAUTION. Use under a laminar flow hood. Wear gloves |
| 10 chamber cellstack | Corning | 3271 | |
| 1L PETG bottle | Thermo Fisher Scientific | 2019-1000 | |
| 30% Acrylamide/Bis Solution | Bio-Rad | 1610158 | |
| 96-well skirted plate | FroggaBio | FS-96 | |
| Adhesive plate seals | Thermo Fisher Scientific | 08-408-240 | |
| Ammonium persulfate (APS) | Bio-Rad | 161-0700 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Blood and Tissue Clean up Kit | Qiagen | 69506 | Use for DNA clean up in section 4.6 of protocol |
| Bromophenol blue | Fisher Scientific | B392-5 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Cell Culture Dishes | Greiner bio-one | 7000232 | 15 cm plates |
| Culture Conical Tube | Thermo Fisher Scientific | 339650 | 15 mL conical tube |
| Culture Conical Tube | Fisher Scientific | 14955240 | 50 mL conical tube |
| Dulbecco's Modified Eagle Medium (DMEM) with 1000 mg/L D-glucose, L-glutamine | Cytiva Life Sciences | SH30022.01 | |
| ECL Western Blotting Substrate | Thermo Fisher Scientific | 32209 | |
| Ethanol | Greenfield | P016EA95 | Dilute ethyl alcohol(95% vol) to 20% for section 3.7.4 and 70% for section 6.1.1.1 |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | SH30396.03 | |
| Glacial acetic acid | Fisher Scientific | A38-500 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Glycerol | Fisher Scientific | BP229-1 | |
| Glycine | Fisher Scientific | BP381-500 | |
| HBSS with Mg2+ and Ca2+ | Thermo Fisher Scientific | SH302268.02 | |
| HBSS without Mg2+ and Ca2+ | Thermo Fisher Scientific | SH30588.02 | |
| HEK293 cells | American Tissue Culture Collection | CRL-1573 | Upon receipt, thaw the cells and culture as described in manufacturer’s protocol. Once cells have been minimally passaged and are growing well, freeze a subfraction for future in aliquots and store in liquid nitrogen. Always use cells below passage number 30. Once cultured cells have been passaged more than 30 times, it is recommended to restart a culture from the stored aliquots |
| HEK293 host cell protein ELISA kit | Cygnus Technologies | F650S | Follow manufacturer’s instructions |
| Heparin sulfate column | Cytiva Life Sciences | 17040703 | |
| Kimwipe | Thermo Fisher Scientific | KC34120 | |
| L-glutamine (200 mM) | Thermo Fisher Scientific | SH30034.02 | |
| Large Volume Centrifuge Tube Support Cushion | Corning | CLS431124 | Support cushion must be used with large volume centrifuge tubes uless the centrifuge rotor has the approriate V-bottom cushions |
| Large Volume Centrifuge Tubes | Corning | CLS431123-6EA | 500 mL centrifuge tubes |
| MgCl2 | Thermo Fisher Scientific | 7791-18-6 | |
| Microcentrifuge tube | Fisher Scientific | 05-408-129 | 1.5 mL microcentrifuge tube, sterilize prior to use |
| Molecular Grade Water | Cytiva Life Sciences | SH30538.03 | |
| N-Lauroylsarcosine sodium salt | Sigma Aldrich | L5125 | CAUTION. Wear gloves |
| NaCl | Thermo Fisher Scientific | BP35810 | |
| Optimem, reduced serum medium | Thermo Fisher Scientific | 31985070 | |
| Pasteur pipets | Fisher Scientific | 13-678-20D | Sterilize prior to use |
| PBS (10x) | Thermo Fisher Scientific | 70011044 | Dilute to 1x for use on cells |
| Penicillin-Streptomycin Solution | Cytiva Life Sciences | SV30010 | |
| pHelper plasmid | De novo design or obtained from plasmid repository | NA | |
| Pipet basin | Thermo Fisher Scientific | 13-681-502 | Purchase sterile pipet basins |
| Polyethylene glycol tert-octylphenyl ether (Triton X-100) | Thermo Fisher Scientific | 9002-93-1 | CAUTION. Wear gloves |
| Polyethylenimine (PEI) | Polyscience | 24765-1 | Follow manufacturer’s instructions to produce a 1L solution. 0.22μm filter and store at 4°C |
| Polypropylene semi-skirted PCR Plate | FroggaBio | WS-96 | |
| Polysorbate 20 (Tween 20) | Thermo Fisher Scientific | BP337-100 | CAUTION. Wear gloves |
| polyvinylidene difluoride (PVDF) membrane | Cytiva Life Sciences | 10600023 | Use forceps to manipulate. Wear gloves. |
| Primary antibody | Progen | 65158 | |
| Protein Ladder | FroggaBio | PM008-0500 | |
| Proteinase K | Thermo Fisher Scientific | AM2546 | |
| pTrangene plasmid | De novo design or obtained from plasmid repository | NA | Must contain SV40 polyA in genome to be compatible with AAV titration in section 5.0 |
| Pump tubing | Cole-Parmer | RK-96440-14 | Optimize length of tubing and containment of virus in fractions E1-E5 |
| RQ1 Dnase 10 Reaction Buffer | Promega | M6101 | Use at 10x concentration in protocol from section 4.0 |
| RQ1 Rnase-free Dnase | Promega | M6101 | |
| Sample dilutent | Cygnus Technologies | I700 | Must be purchased separately for use with HEK293 host cell protein ELISA kit |
| Secondary antibody, HRP | Thermo Fisher Scientific | G-21040 | |
| Skim milk powder | Oxoid | LP0033B | |
| Sodium dodecyl sulfate (SDS) | Thermo Fisher Scientific | 28312 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Sodium hydroxide (NaOH) | Thermo Fisher Scientific | SS266-4 | |
| SV40 polyA primer probe | IDT | Use sequence in Table X for quote from IDT for synthesis | |
| Tetramethylethylenediamine (TEMED) | Thermo Fisher Scientific | 15524010 | CAUTION. Use under a laminar flow hood. Wear gloves |
| Tris Base | Fisher Scientific | BP152-5 | |
| Trypan blue | Bio-Rad | 1450021 | |
| Ultra-Filter | Millipore Sigma | UFC810024 | Ultra-4 Centrifugal 10K device must be used, as it has a 10000 molecular weight cutoff |
| Universal Nuclease for cell lysis | Thermo Fisher Scientific | 88702 | |
| Universal qPCR master mix | NEB | M3003L | |
| Whatman Paper | Millipore Sigma | WHA1001325 | |
| β-mercaptoethanol | Fisher Scientific | 21985023 | CAUTION. Use under a laminar flow hood. Wear gloves |
| CAUTION: Refer to the Materials Table for guidelines on the use of dangerous chemicals. |
Ссылки
- Hastie, E., Samulski, R. J. Adeno-associated virus at 50: A golden anniversary of discovery, research, and gene therapy success-a personal perspective. Human Gene Therapy. 26 (5), 257-265 (2015).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nature Reviews Drug Discovery. 18 (5), 358-378 (2019).
- Nathwani, A. C., et al. Long-term safety and efficacy of factor IX gene therapy in hemophilia B. The New England Journal of Medicine. 371 (21), 1994-2004 (2014).
- Kuzmin, D. A., et al. The clinical landscape for AAV gene therapies. Nature Reviews Drug Discovery. 20 (3), 173-174 (2021).
- Ylä-Herttuala, S. Endgame: glybera finally recommended for approval as the first gene therapy drug in the European union. Molecular Therapy: The Journal of the American Society of Gene Therapy. 20 (10), 1831-1832 (2012).
- FDA approves novel gene therapy to treat patients with a rare form of inherited vision loss. FDA News Release. FDA Available from: https://www.fda.gov/news-events/press-announcements/fda-approves-novel-gene-therapy-treat-patients-rare-form-inherited-vision-loss (2020)
- FDA approves innovative gene therapy to treat pediatric patients with spinal muscular atrophy, a rare disease and leading genetic cause of infant mortality. FDA News Release. FDA Available from: https://www.fda.gov/news-events/press-announcements/fda-approves-innovative-gene-therapy-treat-pediatric-patients-spinal-muscular-atrophy-rare-disease (2020)
- Statement from FDA Commissioner Scott Gottlieb, MD and Peter Marks, MD Ph.D., Director of the Center for Biologics Evaluation and Research on new policies to advance development of safe and effective cell and gene therapies. FDA Available from: https://www.fda.gov/news-events/press-announcements/statement-fda-commissioner-scott-gottlieb-md-and-peter-marks-md-phd-director-center-biologics (2020)
- Asokan, A., Schaffer, D. V., Samulski, R. J. The AAV vector toolkit: poised at the clinical crossroads. Molecular Therapy: The Journal of the American Society of Gene Therapy. 20 (4), 699-708 (2012).
- Rose, J. A., Hoggan, M. D., Shatkin, A. J. Nucleic acid from an adeno-associated virus: chemical and physical studies. Proceedings of the National Academy of Sciences of the United States of America. 56 (1), 86-92 (1966).
- Lusby, E., Fife, K. H., Berns, K. I. Nucleotide sequence of the inverted terminal repetition in adeno-associated virus DNA. Journal of Virology. 34 (2), 402-409 (1980).
- Masat, E., Pavani, G., Mingozzi, F. Humoral immunity to AAV vectors in gene therapy: challenges and potential solutions. Discovery Medicine. 15 (85), 379-389 (2013).
- Ling, C. Enhanced Transgene Expression from Recombinant Single-Stranded D-Sequence-Substituted Adeno-Associated Virus Vectors in Human Cell Lines In Vitro and in Murine Hepatocytes In Vivo. Journal of Virology. 89 (2), 952-961 (2014).
- Cathomen, T., Stracker, T. H., Gilbert, L. B., Weitzman, M. D. A genetic screen identifies a cellular regulator of adeno-associated virus. Proceedings of the National Academy of Sciences of the United States of America. 98 (26), 14991-14996 (2001).
- McCarty, D. M. Self-complementary AAV vectors; advances and applications. Molecular Therapy. 16 (10), 1648-1656 (2008).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of transduction efficiency, tropism and axonal transport of aav serotypes 1, 2, 5, 6, 8 and 9 in the mouse brain. PLOS One. 8 (9), 76310 (2013).
- Zincarelli, C., Soltys, S., Rengo, G., Rabinowitz, J. E. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Molecular Therapy. 16 (6), 1073-1080 (2008).
- Pillay, S., et al. Adeno-associated virus (AAV) serotypes have distinctive interactions with domains of the cellular AAV receptor. Journal of Virology. 91 (18), (2017).
- Merkel, S. F. Trafficking of adeno-associated virus vectors across a model of the blood-brain barrier; a comparative study of transcytosis and transduction using primary human brain endothelial cells. Journal of Neurochemistry. 140 (2), 216-230 (2017).
- van Lieshout, L. P., et al. A novel triple-mutant AAV6 capsid induces rapid and potent transgene expression in the muscle and respiratory tract of mice. Molecular Therapy. Methods & Clinical Development. 9, 323-329 (2018).
- Wu, Z., Asokan, A., Grieger, J. C., Govindasamy, L., Agbandje-McKenna, M., Samulski, R. J. single amino acid changes can influence titer, heparin binding, and tissue tropism in different adeno-associated virus serotypes. Journal of Virology. 80 (22), 11393-11397 (2006).
- Liu, J., Moon, Y. -. A. Simple purification of adeno-associated virus-DJ for liver-specific gene expression. Yonsei Medical Journal. 57 (3), 790-794 (2016).
- Grimm, D., Kern, A., Rittner, K., Kleinschmidt, J. A. Novel tools for production and purification of recombinant adeno-associated virus vectors. Human Gene Therapy. 9 (18), 2745-2760 (1998).
- Kimura, T., et al. Production of adeno-associated virus vectors for in vitro and in vivo applications. Scientific Reports. 9 (1), 13601 (2019).
- Aurnhammer, C., et al. Universal real-time PCR for the detection and quantification of adeno-associated virus serotype 2-derived inverted terminal repeat sequences. Human Gene Therapy Methods. 23 (1), 18-28 (2012).
- . Paramyxoviridae: The viruses and their replication. Fields Virology Available from: https://www.scholars.northwestern.edu/en/publications/paramyxoviridae-the-viruses-and-their-replication (1996)
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7297-7301 (1995).
- Kaludov, N., Brown, K. E., Walters, R. W., Zabner, J., Chiorini, J. A. Adeno-associated virus serotype 4 (AAV4) and AAV5 Both require sialic acid binding for hemagglutination and efficient transduction but differ in sialic acid linkage specificity. Journal of Virology. 75 (15), 6884-6893 (2001).
- Burnham, B., et al. Analytical ultracentrifugation as an approach to characterize recombinant adeno-associated viral vectors. Human Gene Therapy Methods. 26 (6), 228-242 (2015).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Frontiers in Microbiology. 10, 1570 (2019).
- Backovic, A., et al. Capsid protein expression and adeno-associated virus like particles assembly in Saccharomyces cerevisiae. Microbial Cell Factories. 11, 124 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены