A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הדמיה וסקולרית עמוקה בעין עם אולטרסאונד משופר בזרימה
In This Article
Summary
אנו מציגים טכניקת אולטרסאונד לא פולשנית ליצירת אנגיוגרפיות תלת מימדיות בעין ללא שימוש בחומרי ניגודיות.
Abstract
הרשתית בתוך העין היא אחת הרקמות התובעניות ביותר בגוף ולכן דורשת שיעורים גבוהים של אספקת חמצן מאספקת דם עשירה. הלמינה הנימית של הכורואיד קוים את פני השטח החיצוניים של הרשתית והוא המקור השולט של חמצן ברוב הרשתיות החוליות. עם זאת, מיטת כלי דם זו מאתגרת לתמונה עם טכניקות אופטיות מסורתיות בשל מיקומה מאחורי הרשתית סופגת האור. כאן אנו מתארים טכניקת אולטרסאונד בתדר גבוה עם שיפור זרימה עוקב למיטות כלי דם עמוקות תמונה (0.5-3 ס"מ) של העין עם רזולוציה מרחבית גבוהה. שיטה לא פולשנית זו פועלת היטב במינים עם תאי דם אדומים מגורענים (מודלים שאינם יונקים ובעלי חיים עובריים). זה מאפשר דור של אנגיוגרפיות תלת מימדיות לא פולשניות ללא שימוש בחומרי ניגודיות, והוא אינו תלוי בזוויות זרימת הדם עם רגישות גבוהה יותר מאשר טכניקות הדמיית אולטרסאונד מבוססות דופלר.
Introduction
חילוף החומרים הגבוה ברשתית החוליות מטיל טרייד-אוף מהותי בין שני צרכים מנוגדים; קצבי זרימת דם גבוהים ונתיב אור נטול כלי דם. כדי למנוע הפרעה חזותית של זלוף תאי דם אדומים, הרשתית של כל בעלי החוליות מקבלת חמצן וחומרים מזינים באמצעות גיליון של נימים מאחורי קולטני האור, choriocapillaris1,2,3. עם זאת, מקור יחיד זה של חומרים מזינים וחמצן מטיל מגבלה דיפוזיה לעובי של הרשתית 4,5, כל כך הרבה מינים פעילים חזותית יש מגוון רחב של רשתות כלי דם משוכללים כדי לספק אספקת דם נוספת זה איבר פעיל מטבולית6. מיטות כלי דם אלה כוללות כלי דם המזיפים את שכבות הרשתית הפנימית ביונקים וכמה דגים4,7,8,9,10, כלי דם בצד הפנימי (הפונה לאור) של הרשתית הנמצאים בדגים רבים, זוחלים וציפורים4,11,12,13, וסידורי כלי דם נגד של כורואיד הדגים, רט הכורואידית mirabile, המאפשרת ייצור של לחצים חלקיים חמצן סופר אטמוספרי14,15,16,16,17,18,19,20. למרות זאת, נתיבים לא-כרוידליים נוספים אלה לאספקת חומרים מזינים ברשתית ממלאים תפקיד חיוני בתדלוק הדרישות המטבוליות של ראייה מעולה4, האנטומיה התלת-ממדית של מבני כלי דם אלה מובנת היטב, ומגבילה את הבנתנו את האבולוציה המורפולוגית של העין החוליתנית.
באופן מסורתי, אספקת הדם ברשתית נחקרה באמצעות טכניקות אופטיות, כגון פונדוס עיניים. קטגוריה זו של טכניקות מספקת מידע לא הרסני בעל תפוקה גבוהה על אנטומיה של כלי דם שאינם כרוידיאליים ברזולוציה גבוהה21 ולכן משמשת בקלות לאבחון קליני של חריגות במבנה כלי הרשתית22. עם זאת, אפיתל הפיגמנט הרשתית סופג את האור המועבר ומגביל את עומק הראייה בטכניקות אופטיות אלה, ומספק מידע מופחת על מבנה ותפקוד choroidal ללא שימוש בחומר ניגודיות21. מגבלות עומק דומות מנוסות בטומוגרפיה של קוהרנטיות אופטית (OCT). טכניקה זו יכולה ליצור אנגיוגרפיות fundus ברזולוציה גבוהה באמצעות גלי אור על חשבון טכני של חדירת עומק23, בעוד הדמיית עומק משופרת OCT יכול לדמיין את הכורואיד על חשבון איכות הדמיה ברשתית24. הדמיית תהודה מגנטית מתגברת על המגבלות האופטיות של עיניים ו- OCT ויכולה למפות שכבות כלי דם ברשתית, אם כי ברזולוציה נמוכה25. היסטולוגיה וטומוגרפיה מיקרו-מחשבתית (μCT) שומרות על הרזולוציה הגבוהה של הטכניקות האופטיות ומספקות מידע על מורפולוגיה של כלי דם שלם-עין4, אך שתי הטכניקות דורשות דגימת עיניים ולכן אינן אפשריות במרפאה או במינים נדירים או בסכנת הכחדה. כדי להתגבר על חלק מהמגבלות של טכניקות הדמיית רשתית מבוססות אלה, המחקר כאן מציג פרוטוקול אולטרסאונד על בעלי חיים מרדימים, שבו תנועת הדם ממופה בסיליקו על סדרה של סריקות אולטרסאונד דו מימדיות מרווחות באותה מידה המשתרעות על פני עין שלמה על ידי יישום טכניקה דומה כפי שתואר בעבר להדמיה עוברית ולב וכלי דם26,27, 28 ובאנגיוגרפיה OCT29. גישה זו מאפשרת יצירת אנגיוגרפיות עיניים עמוקות תלת-ממדיות לא פולשניות ללא שימוש בחומר ניגודיות ופותחת אפיקים חדשים למיפוי התפלגות זרימת הדם בעין על פני מינים שונים.
Protocol
הפרוטוקול שלהלן בוצע באישור הפיקוח הדני לניסויים בבעלי חיים בתוך משרד המזון, החקלאות והדיג הדני, מינהל הווטרינריה והמזון הדני (היתר מספר 2016-15-0201-00835).
1. אמצעי הרדמה ואולטרסאונד
- להרדים את חיית המחקר.
הערה: סוג ומינון של הרדמה מתאימה תלויים מאוד במינים. באופן כללי, הרדמה מבוססת טבילה כגון MS-222 (אתיל 3-aminobenzoate מתנסולפוניק חומצה), בנזוקאין (אתיל 4-aminobenzoate), ו propofol (2,6-diisopropyl פנול) שימושיים דגים ודו-חיים אשר סופג בקלות את ההרדמה על זימים או עור (למשל, 0.05 מ"ג· L-1 בנזוקאין פורל קשת בענן). מגוון של תרכובות מומסות שניתן לנהל דרך הווריד, תוך שרירית, תוך שרירית, תוך-אפריטוני זמין עבור מי שפיר, כמו גם הרדמה על בסיס גז. אלפקסלון מנוהל תוך שרירית שימושי בזוחלים (למשל, 30 מ"ג-ק"ג-1 בלטאות), ואיזופלוראן המנוהל כגז שימושי בציפורים (למשל, 2% באוויר ליונים). עיין בספרות שפורסמה30,31,32 לקבלת סקירה מלאה של הרדמה זמינה בין מינים. - בדוק רפלקסים בבעלי החיים כדי לאשר רמה אופטימלית של הרדמה. ודא כי החיה היא ללא תנועה לחלוטין במהלך ההליך כמו הליך אולטרסאונד משופרת זרימה רגישה רעש תנועה.
- הרדמה עמוקה מדי יכולה לשנות את דפוסי זרימת הדם, אז לנהל טיטרציה מינון בשלב ההפעלה של ניסוי.
- הגדל את מינון ההרדמה בשלבים ולבחון את זרימת הדם בעין בסיוע מצב בהירות פשוט (B-mode) אולטרסאונד.
הערה: רמה אופטימלית של הרדמה מתקבלת כאשר החיה היא ללא תנועה (למעט נשימה) עם זרימת דם עינית גלויה.
- אם סוג /מינון של הרדמה אינו מתירני לתנועות נשימה, אז להבטיח אוורור נאות של החיה, למשל, באמצעות משאבת אוויר כדי לחמצן את המים עבור מינים מימיים או מכונת הנשמה עבור מינים נושמי אוויר.
- מקם את החיה בתנוחה המאפשרת גישה ישירה מלמעלה לעין.
הערה: בהתאם למינים, זה יכול להיות במצב סופי או לרוחב. זה יכול להיות שימושי כדי לבנות התקן החזקה פשוט באמצעות חתיכה קטנה של מתכת לא תגובתית (למשל, נירוסטה) וגומיות רופפות (ראה איור 1). - מניחים מדיום אולטרסאונד מתאים על העין של החיה. אם העפעפיים קנה המידה (אולטרסאונד אטום) לכסות את העין, ואז להזיז אותם בעדינות עם צמר גפן ספוגית.
הערה: עבור מינים ימיים, אמצעי האולטרסאונד הטוב ביותר הוא מי טנק נקיים שבהם החיה בדרך כלל חיה. עבור מינים יבשתיים, כמות נדיבה של ג'ל אולטרסאונד מבטיח תנועות חופשיות והדמיה של מתמר אולטרסאונד (כלומר, בדיקה מערך ליניארי) על פני השטח כולו של העין. משחה וטרינרית על העין הנגדית נדרשת עבור מינים יבשתיים.
2. רכישת תמונה אולטרסאונד עינית 2D ו 3D
- מקם את המדיאלי מתמר אולטרסאונד לעין בכיוון הגב / הגחון או rostral / caudal בהתאם לכיוון התמונה הרצוי.
- במצב B, עם עומק שדה מרבי, דמיינו את החלק המדיאלי והעמוק ביותר של העין וודאו שכל מבני העניין גלויים בשדה התמונה.
הערה: במינים מסוימים, העדשה הגבישית תופסת חלק גדול יחסית של הומור זגוגית, אשר עשוי לספוג את אולטרסאונד, במיוחד בתדרים גבוהים יותר. - תרגם באיטיות את המתמר לכל צד בעת בדיקת התמונות בזמן אמת. ודא שכל מבני העניין גלויים בשדה התמונה; אם לא, עבור למתמר עם תדירות נמוכה יותר ועומק שדה גדול יותר.
הערה: התדרים המרכזיים הבאים מאפשרים את עומק השדה המרבי הבא: 21 מגה-הרץ: 3 ס"מ, 40 מגה-הרץ: 1.5 ס"מ, 50 מגה-הרץ: 1 ס"מ (ראו טבלה 1). עם זאת, עומק מרבי זה של ערכי שדה יכול להיות נמוך משמעותית אם העין מכילה מסוידים או מבנים אטומים אולטרסאונד אחרים. - התאם עומק תמונה, היסט עומק (מרחק מראש התמונה למבנה העניין), רוחב התמונה, כמו גם מספר ומיקום של אזורי מוקד כדי לכסות את אזור העניין הרצוי בכל שלושת הממדים המרחביים (לדוגמה, עומק תמונה של 1 ס"מ, היסט עומק 2 מ"מ, רוחב תמונה של 1 ס"מ, אזור מוקד אחד).
הערה: למרות שמות ספציפיים של לחצנים המתאימים פרמטרים אלה עשוי להשתנות בין מערכות אולטרסאונד, רוב המערכות יהיו לחצנים עם שמות לוגיים עבור התאמות אלה. הגדרות פרמטר תמונה אלה משפיעות בדרך כלל על הטווח של רזולוציות זמניות אפשריות של רכישת אולטרסאונד. - הגדר קצב פריימים בטווח של 50-120 מסגרות·s-1.
הערה: הרזולוציה הזמנית (כלומר, מרווח הזמן בין סריקות B רצופות) חייבת להיות מספקת כדי להציג שונות גדולה בעוצמת הפיקסלים בכלי הדם המדומיים, כלומר, הרזולוציה הזמנית אינה יכולה להיות גבוהה מדי. מצד שני, כדי להשלים הקלטה תלת-ממדית מלאה של העין בזמן סביר, הרזולוציה הזמנית לא יכולה להיות נמוכה מדי. רזולוציה זמנית הנעה בין 50-120 מסגרות-1 מתאימה בדרך כלל להליך המשופר בזרימה ברוב המינים. על כמה מערכות אולטרסאונד, רזולוציה זמנית רצויה זו ניתן להשיג על ידי מעבר בין "הדמיה כללית" (רזולוציה מרחבית גבוהה / נמוכה זמנית) ו "קרדיולוגיה" (רזולוציה מרחבית נמוכה / רזולוציה זמנית גבוהה) מצבים. - התאם רווח דו-ממדי לרמה (~ 5 dB), כך שמבנים אנטומיים נראים רק ברכישת מצב B רק כדי להגדיל את יחס האות לרעש בשחזור המשופר בזרימה הבאה.
- כדי להשיג תמונה דו-ממדית משופרת בזרימה במיקום פרוסה יחיד, תרגם את המתמר למיקום זה והמשיך בשלב 3.1.
- כדי לרכוש הקלטה תלת-ממדית של אזור מעניין שלם, למשל, הרשתית, תרגם את המתמר לקיצוניות אחת של אזור העניין.
- כדי לקבוע את המיקום המדויק של הקצה הקיצוני של אזור העניין, הגדל את הרווח הדו-ממדי בקצרה.
- לאחר השלמת מיקום המתמר הנכון, הפחת את הרווח הדו-ממדי לפני ההקלטה כדי להבטיח יחס אות לרעש מרבי בשחזור המשופר בזרימה לאחר מכן.
- עבור כל שלב (פרוסה) בהקלטה התלת-ממדית, רכשו ≥100 מסגרות (באופן מיטבי ≥1000 פריימים).
- באמצעות מיקרו-מניפולטור או מנוע מתמר מובנה, תרגם את המתמר על פני כל אזור העניין בשלבים של, למשל, 25 מיקרומטר או 50 מיקרומטר (זכור לציין את גודל הצעד) ולחזור על רכישת המסגרות ≥100 עבור כל שלב.
- המתת חסד של חיית המחקר על פי הנחיות הטיפול בבעלי חיים של המוסד.
3. שחזור תמונה משופר בזרימה
- יצא את ההקלטות להדמיה דיגיטלית ולתקשורת בפורמט קובץ של רפואה (DICOM) (מעט-אנדיאן).
- כדי להפיק תמונה אחת משופרת בזרימה המבוססת על ≥100 מסגרות (T) הקלטה של סינים, חשב את סטיית התקן ברמת הפיקסלים (STD(x,y)) באמצעות הנוסחה:
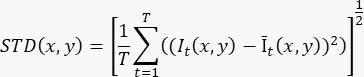
כאשר It(x,y) הוא עוצמת הפיקסל בקואורדינטת הפיקסלים (x,y) בזמן t, ו- Īt(x,y) הוא הערך הממוצע האריתמטי של I לאורך זמן. - חזור על שלב 3.2 עבור כל פרוסה בהקלטה התלת-ממדית.
- כדי להפוך את תהליך חישוב STD ושחזור התמונה לאוטומטי עבור פרוסות מרובות בהקלטה תלת-ממדית, בצע פעולה זו במצב אצווה באמצעות, לדוגמה, ImageJ וקובץ המאקרו המשלים (קובץ משלים 1).
- שלבו את כל הפרוסות המשוחזרות למחסנית תמונה אחת (הפקודה 'תמונות לערימה ' ב-ImageJ).
- ציין עובי פרוסה מגודל השלב המשמש במהלך הרכישה (הפקודה מאפיינים ב- ImageJ).
- שמור את מחסנית התמונות כקובץ TIF תלת-ממדי.
הערה: הקלטות תלת מימדיות משוקלל זרימה של כלי דם עיניים יכולות לשמש לאחר מכן ליצירת עיבודי נפח ולבניית מודלים אנטומיים דיגיטליים ופיזיים של מבני כלי דם של העין. אפשרויות עיבוד תמונה אלה חורגות מהטווח של פרוטוקול זה; עיין במאמרים שפורסמו בעבר לקבלת פרטים נוספים33,34,35.
תוצאות
טכניקת האולטרסאונד המשופרת בזרימה כדי לדמות מיטות וסקולריות של העין יכולה להיות מיושמת במגוון מינים וכיום נעשה בה שימוש ב-46 מינים שונים של בעלי חוליות (איור 1, טבלה 1). נוכחותם של תאי דם אדומים מגורענים בחולייתנים שאינם בוגרים-יונקים מספקת ניגודיות חיובית של דם זור...
Discussion
הדמיה וסקולרית באמצעות אולטרסאונד משופר בזרימה מספקת שיטה חדשה להדמיה לא פולשנית של כלי הדם של העין המציעה מספר יתרונות על פני הטכניקות הנוכחיות אך יש לה מגבלות מהותיות. היתרון העיקרי של אולטרסאונד משופר זרימה הוא היכולת ליצור אנגיוגרפיות עינית עם עומק של שדה העולה על אפיתל הפיגמנט הרשת?...
Disclosures
המחברים מצהירים כי לא קיימים אינטרסים משלימים.
Acknowledgements
עבודה זו קיבלה מימון מקרן קרלסברג (CF17-0778; CF18-0658), קרן לונדבק (R324-2019-1470; R346-2020-1210), קרנות Velux (00022458), קרן A.P. Møller לקידום מדעי הרפואה, תוכנית המחקר והחדשנות Horizon 2020 של האיחוד האירופי במסגרת הסכם המענקים מארי סקודובסקה-קירי (מס ' 754513) וקרן המחקר של אוניברסיטת ארהוס.
Materials
| Name | Company | Catalog Number | Comments |
| MS-222 | Sigma | E10521-50G | |
| Benzocaine | Sigma | E-1501 | |
| Propofol | B Braun | 12260470_0320 | |
| Alfaxalon | Jurox | NA | |
| Isoflurane | Zoetis | 50019100 | |
| Ultrasound scanner | VisualSonics | Vevo 2100 |
References
- Yu, C. Q., Schwab, I. R., Dubielzig, R. R. Feeding the vertebrate retina from the Cambrian to the Tertiary. Journal of Zoology. 278 (4), 259-269 (2009).
- Yu, D. Y., Cringle, S. J. Oxygen distribution and consumption within the retina in vascularised and avascular retinas and in animal models of retinal disease. Progress in Retinal and Eye Research. 20 (2), 175-208 (2001).
- Country, M. W. Retinal metabolism: A comparative look at energetics in the retina. Brain Research. 1672, 50-57 (2017).
- Damsgaard, C., et al. Retinal oxygen supply shaped the functional evolution of the vertebrate eye. Elife. , 8 (2019).
- Buttery, R. G., Hinrichsen, C. F. L., Weller, W. L., Haight, J. R. How thick should a retina be? A comparative study of mammalian species with and without intraretinal vasculature. Vision Research. 31 (2), 169-187 (1991).
- Ames, A., Li, Y., Heher, E., Kimble, C. Energy metabolism of rabbit retina as related to function: high cost of Na+ transport. The Journal of Neuroscience. 12 (3), 840-853 (1992).
- Chase, J. The Evolution of retinal vascularization in mammals: A comparison of vascular and avascular retinae. Ophthalmology. 89 (12), 1518-1525 (1982).
- Johnson, G. L. Ophthalmoscopic studies on the eyes of mammals. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 254 (794), 207-220 (1968).
- Johnson, G. L. I. Contributions to the comparative anatomy of the mammalian eye, chiefly based on ophthalmoscopic examination. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 194 (194-206), 1-82 (1901).
- Rodriguez-Ramos Fernandez, J., Dubielzig, R. R. Ocular comparative anatomy of the family Rodentia. Veterinary Ophthalmology. 16, 94-99 (2013).
- Copeland, D. E. Functional vascularization of the teleost eye. Current Topics in Eye Research. 3, 219-280 (1980).
- Meyer, D. B., Crescitelli, F. . The Visual System in Vertebrates. Handbook of Sensory Physiology. 7, (1977).
- Potier, S., Mitkus, M., Kelber, A. Visual adaptations of diurnal and nocturnal raptors. Seminars in Cell & Developmental Biology. 106, 116-126 (2020).
- Wittenberg, J. B., Wittenberg, B. A. Active secretion of oxygen into the eye of fish. Nature. 194, 106-107 (1962).
- Damsgaard, C. Physiology and evolution of oxygen secreting mechanism in the fisheye. Comparative Biochemistry and Physiology. 252, 110840 (2021).
- Damsgaard, C., et al. A novel acidification mechanism for greatly enhanced oxygen supply to the fish retina. Elife. 9, (2020).
- Wittenberg, J. B., Haedrich, R. L. The choroid rete mirabile of the fish eye. II. Distribution and relation to the pseudobranch and to the swimbladder rete mirabile. Biological Bulletin. 146 (1), 137-156 (1974).
- Wittenberg, J. B., Wittenberg, B. A. The choroid rete mirabile of the fish eye. I. Oxygen secretion and structure: comparison with the swimbladder rete mirabile. Biological Bulletin. 146 (1), 116-136 (1974).
- Berenbrink, M. Historical reconstructions of evolving physiological complexity: O2 secretion in the eye and swimbladder of fishes. Journal of Experimental Biology. 210, 1641-1652 (2007).
- Berenbrink, M., Koldkjaer, P., Kepp, O., Cossins, A. R. Evolution of oxygen secretion in fishes and the emergence of a complex physiological system. Science. 307 (5716), 1752-1757 (2005).
- Keane, P. A., Sadda, S. R. Retinal imaging in the twenty-first century: State of the art and future directions. Ophthalmology. 121 (12), 2489-2500 (2014).
- Yung, M., Klufas, M. A., Sarraf, D. Clinical applications of fundus autofluorescence in retinal disease. International Journal of Retina and Vitreous. 2 (1), 12 (2016).
- Ang, M., et al. Optical coherence tomography angiography: a review of current and future clinical applications. Graefe's Archive for Clinical and Experimental Ophthalmology. 256 (2), 237-245 (2018).
- Spaide, R. F., Koizumi, H., Pozonni, M. C. Enhanced depth imaging spectral-domain optical coherence tomography. American Journal of Ophthalmology. 146 (4), 496-500 (2008).
- Shen, Q., et al. Magnetic resonance imaging of tissue and vascular layers in the cat retina. Journal of Magnetic Resonance Imaging. 23 (4), 465-472 (2006).
- Tan, G. X., Jamil, M., Tee, N. G., Zhong, L., Yap, C. H. 3D reconstruction of chick embryo vascular geometries using non-invasive high-frequency ultrasound for computational fluid dynamics studies. Annals of Biomedical Engineering. 43 (11), 2780-2793 (2015).
- Ho, S., Tan, G. X. Y., Foo, T. J., Phan-Thien, N., Yap, C. H. Organ dynamics and fluid dynamics of the HH25 chick embryonic cardiac ventricle as revealed by a novel 4D high-frequency ultrasound imaging technique and computational flow simulations. Annals of Biomedical Engineering. 45 (10), 2309-2323 (2017).
- Dittrich, A., Thygesen, M. M., Lauridsen, H. 2D and 3D echocardiography in the Axolotl (Ambystoma Mexicanum). Journal of Visualized Experiments: JoVE. (141), e57089 (2018).
- Jia, Y., et al. Split-spectrum amplitude-decorrelation angiography with optical coherence tomography. Optics Express. 20 (4), 4710-4725 (2012).
- Clarke, K. W., Trim, C. M., Trim, C. M. . Veterinary Anaesthesia E-Book. , (2013).
- Flecknell, P. . Laboratory Animal Anaesthesia. , (2015).
- West, G., Heard, D., Caulkett, N. . Zoo Animal and Wildlife Immobilization and Anesthesia. , (2014).
- Lauridsen, H., Hansen, K., Nørgård, M. &. #. 2. 1. 6. ;., Wang, T., Pedersen, M. From tissue to silicon to plastic: three-dimensional printing in comparative anatomy and physiology. Royal Society Open Science. 3 (3), 150643 (2016).
- Lauridsen, H., et al. Inside out: Modern imaging techniques to reveal animal anatomy. PLoS One. 6 (3), 17879 (2011).
- Ruthensteiner, B., Heß, M. Embedding 3D models of biological specimens in PDF publications. Microscopy Research and Technique. 71 (11), 778-786 (2008).
- Damsgaard, C., Lauridsen, H. Deep vascular imaging in the eye with flow-enhanced ultrasound. bioRxiv. , 447055 (2021).
- Mueller, R. L., Ryan Gregory, T., Gregory, S. M., Hsieh, A., Boore, J. L. Genome size, cell size, and the evolution of enucleated erythrocytes in attenuate salamanders. Zoology. 111 (3), 218-230 (2008).
- Greis, C. Quantitative evaluation of microvascular blood flow by contrast-enhanced ultrasound (CEUS). Clinical Hemorheology and Microcirculation. 49, 137-149 (2011).
- Urs, R., Ketterling, J. A., Tezel, G., Silverman, R. H. Contrast-enhanced plane-wave ultrasound imaging of the rat eye. Experimental Eye Research. 193, 107986 (2020).
- Walls, G. L. . The vertebrate eye and its adaptive radiation. , (1942).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved