Method Article
Caratterizzazione delle giunzioni neuromuscolari nei topi mediante microscopia combinata confocale e super-risoluzione
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive un metodo per l'analisi morfometrica delle giunzioni neuromuscolari mediante microscopia combinata confocale e STED che viene utilizzata per quantificare i cambiamenti patologici in modelli murini di SMA e CMS correlati a ColQ.
Abstract
Le giunzioni neuromuscolari (NMJ) sono sinapsi altamente specializzate tra i motoneuroni inferiori e le fibre muscolari scheletriche che svolgono un ruolo essenziale nella trasmissione delle molecole dal sistema nervoso ai muscoli volontari, portando alla contrazione. Sono colpiti in molte malattie umane, tra cui disturbi neuromuscolari ereditari come la distrofia muscolare di Duchenne (DMD), sindromi miasteniche congenite (CMS), atrofia muscolare spinale (SMA) e sclerosi laterale amiotrofica (SLA). Pertanto, il monitoraggio della morfologia delle giunzioni neuromuscolari e delle loro alterazioni in modelli murini di malattia rappresenta un valido strumento per gli studi patologici e la valutazione preclinica degli approcci terapeutici. Qui vengono descritti i metodi per l'etichettatura e l'analisi della morfologia tridimensionale (3D) delle parti pre e postsinaptiche delle placche terminali del motore da fibre muscolari prese in giro murine. Le procedure per preparare i campioni e misurare il volume, l'area, la tortuosità e la morfologia/occupazione terminale degli assoni mediante imaging confocale e la distanza tra le pieghe giunzionali postsinaptiche e la larghezza della banda del recettore dell'acetilcolina (AChR) mediante microscopia STED (super-resolution stimulated emission depletion) sono dettagliate. Le alterazioni di questi parametri NMJ sono illustrate in topi mutanti affetti da SMA e CMS.
Introduzione
La giunzione neuromuscolare (NMJ) è una struttura complessa composta da un terminale assone motorio, una cellula di Schwann perisinaptica e una porzione di miofibra scheletrica coinvolta nella trasmissione di informazioni chimiche e nell'accoppiamento dell'attività del motoneurone inferiore alla contrazione muscolare. Nei mammiferi, la morfologia della giunzione neuromuscolare cambia durante lo sviluppo, adottando una tipica forma simile al pretzel dopo la maturazione, con differenze di forma e complessità tra le specie, e mostra un certo grado di plasticità in risposta a processi fisiologici come l'esercizio fisico o l'invecchiamento 1,2,3,4 . La piastra terminale motoria postsinaptica forma invaginazioni di membrana chiamate pieghe giunzionali, dove la parte superiore contenente i recettori dell'acetilcolina (AChR) è in stretto contatto con il ramo dell'assone terminale presinaptico5.
I cambiamenti morfologici e funzionali nelle giunzioni neuromuscolari contribuiscono alla fisiopatologia di diverse malattie neurodegenerative come l'atrofia muscolare spinale (SMA) e la sclerosi laterale amiotrofica (SLA), miopatie come la distrofia muscolare di Duchenne (DMD), sindromi miasteniche congenite (CMS), miastenia grave (MG) e miopatie centronucleari (CNM) e sarcopenia associata all'invecchiamento 3,6,7,8,9, 10,11,12. In queste malattie si osservano alterazioni strutturali della NMJ come frammentazione della placca terminale, riduzione delle dimensioni della piega giunzionale postsinaptica e/o denervazione. La patologia delle NMJ può essere un evento primario o precoce durante la progressione della malattia o apparire più recentemente come un evento secondario che contribuisce alle manifestazioni cliniche. In ogni caso, il monitoraggio della morfologia delle NMJ in modelli animali di queste malattie rappresenta un parametro prezioso per studiare i cambiamenti patologici e valutare l'efficacia di potenziali trattamenti.
La morfologia delle giunzioni neuromuscolari viene solitamente analizzata mediante tecniche che utilizzano la microscopia confocale 2,13,14,15 o la microscopia elettronica 5,16, con le loro limitazioni intrinseche come la risoluzione o le difficoltà tecniche, rispettivamente. Più recentemente, la microscopia a super-risoluzione è stata utilizzata anche per visualizzare particolari regioni del NMJ, come le zone attive presinaptiche o la distribuzione AChR sulla membrana postsinaptica16,17,18, come approccio alternativo o complementare all'analisi ultrastrutturale mediante microscopia elettronica.
Questo protocollo mira a fornire un metodo dettagliato e riproducibile per valutare i parametri morfologici NMJ combinando la microscopia a fluorescenza confocale e STED (Stimulated emission depletion). Importanti caratteristiche delle placche terminali presinaptiche e postsinaptiche, come volume, area, tortuosità relativa, larghezza della banda AChR e distribuzione terminale degli assoni nelle fibre muscolari innervate di gastrocnemio di topo e tibiale anteriore sono state quantificate nel contesto di condizioni normali e patologiche. In particolare, i difetti NMJ sono stati esemplificati nel modello murino Smn 2B/- di atrofia muscolare spinale, una malattia neuromuscolare con degenerazione del motoneurone causata da mutazioni nel gene SMN1 11,19, e in una subunità della coda simile al collagene di topi asimmetrici knockout acetilcolinesterasi (ColQ Dex2/Dex2 o ColQ-KO), come modello della sindrome miastenica congenita 20, 21,22.
Protocollo
La cura e la manipolazione dei topi sono state eseguite secondo la legislazione nazionale ed europea sulla sperimentazione animale e approvate dal comitato etico istituzionale. Nello studio sono stati utilizzati topi maschi e femmine di Smn2B/- (sfondo C57Bl/6J) e ColQ Dex2/Dex2 (sfondo B6D2F1/J) rispettivamente a 3 e 6 settimane di età.
1. Eutanasia dei topi e dissezione dei muscoli: tibiale anteriore e gastrocnemio
- Procedere all'anestesia del topo mediante iniezione intraperitoneale di una soluzione mista di ketamina (87,5 mg/kg)/xilazina (12,5 mg/kg) (0,1 ml/20 g di peso corporeo) prima dell'eutanasia per lussazione cervicale.
NOTA: Poiché SMA e ColQ-CMS colpiscono gli individui indipendentemente dal loro sesso, nel presente protocollo sono stati utilizzati topi maschi e femmine. - Rimuovere i peli degli arti posteriori utilizzando un piccolo rasoio elettrico e risciacquare le gambe con etanolo al 70%.
NOTA: La procedura di dissezione sarà diversa per ogni muscolo. Per la dissezione del tibiale anteriore (TA), seguire i passaggi 1.2.1-1.2.3, e per il gastrocnemio (GA) (parti mediale e laterale), seguire i passaggi 1.2.4-1.2.6. Maneggiare delicatamente i muscoli per evitare danni ai tessuti e schiacciarli o allungarli durante la dissezione.- Posizionare il mouse in posizione supina.
- Fare un'incisione cutanea di 5 mm con forbici affilate-smussate lungo la parte antero-esterna dell'arto posteriore distale, parallela alla tibia, per esporre il muscolo. Utilizzare forbici extra-sottili per rimuovere la fascia.
- Tagliare prima il tendine distale (vicino alla zampa) e poi il tendine prossimale (vicino al ginocchio) usando forbici extrasottili e una pinza sottile curva. Maneggiare il muscolo con cura per evitare danni alle miofibre e ai nervi.
NOTA: Il tendine prossimale deve essere sezionato il più vicino possibile all'osso per raccogliere l'intero muscolo. - Posizionare il mouse in posizione prona, utilizzare forbici affilate-smussate per fare un'incisione cutanea dalla parte superiore del compartimento posteriore distale dell'arto posteriore fino alla zampa e rimuovere la pelle.
- Afferrare il tendine di Achille con una pinza seghettata media, tagliarlo con una forbice extra-sottile e separare delicatamente l'AG dal tessuto circostante fino al suo inserimento prossimale.
- Sul lato prossimale, inserire la pinza seghettata media nella tasca formata tra il bicipite femorale (BF) e il GA. Separare i due muscoli per tagliare il tendine GA il più vicino possibile all'inserimento osseo con una forbice extra-sottile.
- Per la fissazione dei tessuti, posizionare ciascun muscolo in una provetta da microcentrifuga da 2 mL contenente 1 mL di soluzione di paraformaldeide (PFA) al 4% p/v diluita in tampone fosfato salino (PBS senza Ca 2+Mg 2+) e conservare a 4 °C per18-24 ore.
ATTENZIONE: Paraformaldeide e formaldeide sono tossiche e devono essere maneggiate in una cappa chimica con adeguati dispositivi di protezione. - Il giorno successivo, lavare i muscoli fissi 3 volte per 5 minuti con PBS in piastre a 12 pozzetti agitando delicatamente a temperatura ambiente (RT) all'interno di una cappa aspirante chimica.
NOTA: il protocollo può essere interrotto in questo passaggio e continuato entro un mese. In questo caso, aggiungere PBS integrato con azoturo di sodio allo 0,01% per conservare i campioni a 4 °C. - Prendere in giro ogni muscolo in piccoli fasci di fibre larghi circa 1 mm usando due pinze seghettate sottili.
NOTA: È fondamentale manipolare i muscoli molto delicatamente con la pinza, senza forza eccessiva, per prevenire danni ai tessuti durante la presa in giro.- Dissociare il muscolo TA in 3 o 4 fasci a seconda delle sue dimensioni.
- Per GA, separare le parti mediale e laterale del muscolo e quindi dissociare ciascuna parte in 4-5 fasci a seconda delle loro dimensioni.
2. Immunocolorazione
- Procedere con la permeabilizzazione delle fibre muscolari: trasferire i fasci muscolari in piastre a 24 pozzetti contenenti l'1% (v/v) di Triton X-100 in PBS e tenerli sotto delicata agitazione (50 rpm) per 1 ora a RT o 5 h a 4 °C.
NOTA: Dividere i fasci muscolari tra due piastre per procedere con immunocolorazioni separate e ridurre al minimo il rischio di confusione anticorpale. Non dividerli in più di due pozzetti (1 pozzetto/piastra); altrimenti, il numero (N) di NMJ che sono rappresentativi del loro stato generale nel muscolo analizzato potrebbe essere insufficiente. - Lavare i campioni 3 volte per 5 minuti con PBS a RT e incubarli con una soluzione bloccante composta da albumina sierica bovina (BSA) al 4% in PBS/Triton X-100 all'1% per 4 ore a 4 °C, agitando delicatamente (50 rpm).
NOTA: Non utilizzare una pompa di aspirazione durante le fasi di lavaggio, ma aspirare la soluzione manualmente con una pipetta da 200 μL e punte di piccole dimensioni (il riferimento è indicato nella tabella dei materiali). - Incubare i campioni per una notte (O/N) a 4 °C sotto delicata agitazione (50 rpm) con la soluzione bloccante indicata al punto 2.2 contenente anticorpi monoclonali primari contro il neurofilamento M (NF-M, 2H3, diluizione 1/200) o la glicoproteina 2 della vescicola sinaptica (SV2, diluizione 1/200) per marcare rispettivamente i terminali degli assoni presinaptici o le zone attive.
- Il giorno successivo, lavare i fasci muscolari 3 volte per 5 minuti in PBS sotto agitazione (50 giri / min).
- Per l'imaging confocale: Incubare i fasci muscolari con anticorpi secondari anti-topo coniugati con un fluoroforo a emissione rossa (F594) (diluizione 1/500) e α-bungarotoxin coniugato con un fluoroforo a emissione verde (α-BTX-F488) (diluizione 1/1000) in PBS per 2 ore a RT sotto agitazione (50 rpm).
- Per l'imaging STED: Incubare i fasci muscolari con anticorpi secondari anti-topo coniugati con un fluoroforo a emissione verde (F488) (diluizione 1/500) e α-bungarotoxina coniugata con un fluoroforo ad emissione di rosso lontano caratterizzato da un'elevata fotostabilità (α-BTX-F633) (diluizione 1/1000) in PBS per 2 ore a RT sotto agitazione (50 rpm).
NOTA: Non esporre i campioni alla luce durante l'incubazione per evitare il fotosbiancamento.
- Lavare i fasci muscolari etichettati 3 volte per 5 minuti con PBS sotto agitazione (50 giri / min) e posizionarli su un vetrino con un mezzo di montaggio.
NOTA: Posizionare un massimo di 4-5 fasci muscolari per vetrino per consentire la sigillatura. - Aggiungi una copertina in vetro di grado #1.5 (o #1.5H) (spessore 0,17 mm) sulla parte superiore e posiziona magneti cilindrici su entrambi i lati della diapositiva per applicare pressione e appiattire i muscoli.
- Tenere i vetrini al riparo dalla luce O/N a 4°C. Sigillare i vetrini in modo permanente con lo smalto.
3. Acquisizione di immagini
- Acquisizioni al microscopio confocale
NOTA: Le immagini sono state raccolte con un microscopio confocale a scansione laser invertita utilizzando un obiettivo ad immersione in olio di magnitudine 63x (HCX Plan Apo CS, apertura numerica 1,4 (NA)).- Per l'analisi in cieco, lasciare che una persona non coinvolta nell'analisi codifichi ogni diapositiva con un determinato numero. Rimanere in cieco ai gruppi sperimentali fino a quando la quantificazione dei parametri NMJ è completa per tutti i campioni.
- Avviare il software del microscopio in modalità di configurazione > machine.xlhw (Figura 1 supplementare).
- Posizionare il vetrino sullo stadio del microscopio e trovare il piano di osservazione all'interno del campione guardando sotto l'illuminazione a fluorescenza a largo campo DAPI con il set di filtri DAPI.
- Fare clic su Apri progetto > Nuovi progetti e creare una cartella per memorizzare le acquisizioni di immagini (Figura supplementare 1).
Nota : creare un nuovo progetto per ogni NMJ per limitare le dimensioni della cartella ed evitare problemi di memoria del computer. - Per gestire i parametri di acquisizione, fare clic sulla finestra della scheda Acquisizione e impostare il foro stenopeico confocale su 1.0 Airy unit e potenza laser per ottimizzare i livelli di guadagno e offset per la fluorescenza verde/F488 (α-BTX) utilizzando un laser a 488 nm sulla piastra terminale che deve essere ripreso (modalità Live ON).
- Successivamente, ottimizzare l'acquisizione della fluorescenza rosso/F594 (NF-M o SV2) utilizzando un laser adattato all'osservazione F594. In questo studio è stato utilizzato un laser a 552 nm (modalità Live ON). Impostare lo spettro di emissione del colorante con i seguenti intervalli per ciascun laser: laser 405 (DAPI) da 414 a 483 nm, laser 488 (F488-α-BTX) da 506-531 nm e laser 552 (NF-M/SV2) da 622-650 nm.
- Raccogli pile di immagini di giunzioni neuromuscolari in ciascun gruppo sperimentale con le stesse impostazioni: dimensione dell'immagine 1024 x 1024 pixel (73,7 x 73,7 μm) a frequenza di campionamento di 400 Hz, X ON bidirezionale, fattore di zoom 2,5, dimensione Z-step 0,5 μm in modalità Z-Wide.
NOTA: per ogni NMJ, il numero di sezioni è impostato per acquisire l'intera giunzione. Le impostazioni di acquisizione descritte sopra soddisfano il teorema del campionamento di Nyquist-Shanon. Tuttavia, l'utente può fare clic sul pulsante Ottimizza formato , presente su tutti i recenti software operativi confocali, per garantire che la dimensione dei pixel e lo Z-step soddisfino la frequenza di campionamento Nyquist ideale. Questa azione eviterà immagini sovracampionate o sottocampionate, che causeranno una perdita di precisione nelle misurazioni del volume. - Salvare il file originale (.lif) o le immagini Z-stack (.tif) in una cartella con un nome che includa il nome in codice della diapositiva, il tipo di colorazione e il numero di placca finale.
NOTA: Raccogliere sequenzialmente (non simultaneamente) le scansioni utilizzando i laser a 488 nm e 552 nm (F488 e F594) per evitare la diafonia della fluorescenza F488 nel canale F594 e viceversa (bleed-through). NB: il percorso del fascio può essere configurato con il Dye Assistant nel software del microscopio. - Passare alla diapositiva codificata successiva e ripetere i passaggi 3.1.3-3.1.8 per ogni NMJ.
- Alla fine della sessione, fare clic su Apri in 3D Viewer e scegliere un rappresentante NMJ di un gruppo sperimentale per visualizzare l'etichettatura 3D.
NOTA: questa modalità di visualizzazione consente di verificare che i parametri di acquisizione siano corretti. - Chiudere il software del microscopio, pulire gli obiettivi con i tessuti per lenti e quindi spegnere il sistema.
- Acquisizioni mediante microscopia STED
NOTA: Le immagini sono state raccolte con un microscopio confocale a scansione laser invertita dotato di Gated STED a 775 nm utilizzando un obiettivo ad immersione in olio 100x (HC PL APO CS2 1.4 NA).- Per l'analisi in cieco, lasciare che una persona non coinvolta nell'analisi codifichi ogni diapositiva con un determinato numero. Rimanere in cieco ai gruppi sperimentali fino a quando la quantificazione dei parametri NMJ è completa per tutti i campioni.
- Avviare il software del microscopio in modalità di configurazione > machine.xlhw e STED ON (Figura 2 supplementare).
- Fare clic su Apri progetto > Nuovi progetti per creare una cartella in cui archiviare le acquisizioni di immagini.
Nota : generare una nuova cartella per ogni diapositiva per limitare le dimensioni della cartella ed evitare problemi di memoria del computer. - Posizionare il vetrino sul palco del microscopio e visualizzarlo sotto l'illuminazione a fluorescenza ad ampio campo utilizzando il laser a 488 nm per trovare il piano di osservazione all'interno del campione.
- Cerca un NMJ marcato con colorazioni di neurofilamento M (NF-M) o SV2 utilizzando il laser a 488 nm con una rilevazione spettrale da 506-531 nm.
- Quando un NMJ è stato identificato, fare clic su Attiva STED e iniziare ad acquisire immagini in una regione che contiene diverse pieghe giunzionali (Figura supplementare 3) utilizzando il laser a 635 nm con un rilevamento spettrale da 640-750 nm.
NOTA: prestare attenzione alla tabella di ricerca della saturazione durante l'acquisizione dell'immagine e fare clic sul pulsante LUT rapida per evitare la sovraesposizione (valori di grigio >255; per 8 bit). - Raccogli le immagini di ciascun gruppo sperimentale con le stesse impostazioni: dimensione dell'immagine 2048 x 2048 pixel (38,75 x 38,75 μm) a una frequenza di campionamento di 400 Hz.
NOTA: la potenza del laser di esaurimento (STED) è impostata su 65%. - Salvare le immagini con un nome file che include il codice della diapositiva.
NOTA: È possibile fare clic su Formato XY ottimizzato: Imposta formato per ottenere la migliore impostazione di acquisizione con l'imaging STED. - Passare alla diapositiva codificata successiva e ripetere i passaggi 3.2.3-3.2.8. Ripetere questa procedura per tutte le diapositive.
- Al termine della sessione di microscopia STED, trasferire i file di immagine su un altro computer e salvare i file originali (. lif) in un'unità esterna o in un server.
- Spegnere il software del microscopio, pulire gli obiettivi con i tessuti delle lenti e quindi spegnere il sistema.
4. Analisi delle immagini - microscopia confocale
NOTA: tutte le immagini sono state elaborate con computer che utilizzano il sistema operativo Microsoft Windows 10 professional.
- Avviare ImageJ e una macro personalizzata per calcolare il volume della piastra terminale NMJ postsinaptica, l'area MIP (Maximum Intensity Projection) e la tortuosità relativa.
- Elabora stack di immagini NMJ utilizzando il freeware NIH ImageJ23, il plugin iGeodesic e la macro personalizzata per ottenere misurazioni dei parametri NMJ. Avviare il software ImageJ.
NOTA: l'ultima versione di ImageJ è disponibile gratuitamente e può essere scaricata24. Per aprire formati di file proprietari, il plugin Bio-Formats Package25 deve essere scaricato26 . Questo passaggio non è necessario nel caso in cui l'operatore utilizzi Fiji perché il plugin è già installato nel software. Il plugin iGeodesic27 per calcolare la tortuosità è disponibile anche online28; verificare la disponibilità di questo plugin nella versione ImageJ/Fiji che verrà utilizzata. Le Macro personalizzate sono disponibili anche online29. - Trascinare e rilasciare il file Macro_NMJ_VOL_Marinelloetal.ijm (custom made, Supplementary Coding File 1) nella finestra di ImageJ; La macro verrà aperta in una seconda finestra. In questa nuova finestra, fare clic su Macro > Esegui macro.
Nota : la macro può elaborare sia file proprietari e TIFF. I file devono soddisfare i seguenti criteri: per i formati di file proprietari, salvare solo una giunzione (cioè la pila di immagini) per file, ordinata in una cartella; per le immagini TIFF, i file devono essere salvati in una cartella contenente sottocartelle, ciascuna denominata JunctionX (X corrisponde a un numero NMJ) con le pile di immagini di una determinata giunzione (RGB TIFF) (Figura supplementare 4). - Selezionare la cartella nativa contenente le sottocartelle Junction che devono essere analizzate e cliccare su Select.
- Nel nuovo menu a comparsa chiamato Cartella di salvataggio, selezionare la cartella di archiviazione e fare clic su Seleziona.
- Nel nuovo menu a comparsa chiamato Tipo immagine, selezionare il formato delle acquisizioni Z-stack.
- Selezionare il canale RGB corrispondente alla colorazione di interesse e indicare la dimensione dei pixel XY e Z-step (z). La macro eseguirà automaticamente l'analisi.
NOTA: nel caso in cui siano selezionati formati di file proprietari, la macro legge direttamente la dimensione dei pixel e il passo Z (z). Tuttavia, l'utente deve ancora indicare il canale di interesse (C1, C2 o C3). La macro fornirà un foglio dati (.csv) per ogni parametro di giunzione (volume della piastra terminale, area MIP e tortuosità) nella cartella di salvataggio. La macro genera anche tre file . TIF , che corrispondono al perimetro di Drawing_MaxprojX.tif di colorazione α-BTX, DrawingJunctionX.tif e MIP MaxprojX.tif. Questi file TIFF vengono generati per verificare la qualità delle acquisizioni e per garantire che l'elaborazione delle immagini sia stata eseguita correttamente.
Volume NMJ postsinaptico (V): La macro separerà le immagini da un singolo NMJ e manterrà il canale α-bungarotoxin F488 corrispondente alla piastra terminale postsinaptica. Lo stack viene segmentato utilizzando la soglia Otsu30 sulla fetta intermedia dello stack. L'immagine binaria risultante è dilatata di 1 pixel e la funzione Analizza particelle viene utilizzata per misurare l'area della piastra finale di ciascun oggetto rilevato. Per ottenere il volume NMJ postsinaptico, la macro somma tutte le aree misurate della piastra terminale della pila e la moltiplica per il valore Z-step (z) in μm.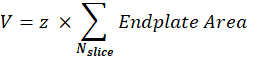
Area della piastra terminale di proiezione di intensità massima (MIP): dopo la soglia della pila, si ottiene la proiezione di intensità massima (MIP) utilizzando la funzione ImageJ del progetto Z . La funzione Analizza particelle viene quindi utilizzata per quantificare l'area della piastra terminale MIP.
Tortuosità NMJ MIP (T): La tortuosità NMJ, che riflette il grado di complessità della piastra terminale del motore postsinaptico comprese pieghe e perforazioni31, è calcolata in base a ciascun MIP utilizzando la seguente formula, dove d Obj(AB) è la distanza tra A e B lungo il perimetro dell'oggetto, e dEuc(AB) è la distanza euclidea tra A e B (linea retta).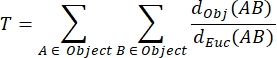
- Impostare il valore di tortuosità più alto nel gruppo wild-type di ciascuna condizione sperimentale al 100% e normalizzare tutti gli altri valori della condizione sperimentale a questo valore per ottenere la tortuosità NMJ relativa.
- Elabora stack di immagini NMJ utilizzando il freeware NIH ImageJ23, il plugin iGeodesic e la macro personalizzata per ottenere misurazioni dei parametri NMJ. Avviare il software ImageJ.
- Avvia ImageJ e macro personalizzata per quantificare l'accumulo di neurofilamenti presinaptici e la colorazione della glicoproteina 2 della vescicola sinaptica.
NOTA: L'accumulo di neurofilamenti (qui, NF-M) e/o l'alterata distribuzione delle vescicole sinaptiche (qui, SV2) sono marcatori di trasporto assonale anormale e/o traffico vescicolare alterato e sono stati precedentemente osservati in NMJ di vari modelli murini SMA32,33,34.- Trascinare e rilasciare il file Macro_NMJ_ACCU_Marinelloetal.ijm (file di codifica supplementare personalizzato 2) nella finestra di ImageJ; La macro si aprirà in una seconda finestra. In questa nuova finestra, fare clic su Macro > Esegui macro.
Nota : la macro può elaborare sia formati di file proprietari e file TIFF. I file devono soddisfare i criteri indicati nella NOTA seguente al punto 4.1.2. - Selezionare la cartella nativa contenente le sottocartelle Junction che devono essere analizzate e cliccare su Select.
- Nel nuovo menu a comparsa chiamato Cartella di salvataggio, selezionare la cartella di archiviazione e fare clic su Seleziona.
- Nel nuovo menu a comparsa chiamato Tipo immagine, selezionare il formato delle acquisizioni Z-stack.
- Nel pop-up Informazioni sulla colorazione , indicare l'etichetta e il colore presinaptico e postsinaptico e fare clic su OK. Ad esempio, Etichetta presinaptica: SV2 o NF, Colore presinaptico: R, Etichetta postsinaptica: BTX, Colore postsinaptico: G.
NOTA: per i formati di file proprietari, devono essere indicate le etichette e i canali corrispondenti (C1, C2 o C3). - Nel pop-up Dimensione pixel, indicare XY dimensione pixel 0,072 μm e Z passo 0,5 μm (z) e fare clic su OK. La macro eseguirà automaticamente l'analisi.
NOTA: Questo parametro corrisponde alle dimensioni dell'immagine 1024 x 1024 pixel (73,7 x 73,7 μm) selezionate prima delle acquisizioni al microscopio confocale ed è correlato alle impostazioni dell'obiettivo e dello zoom. Se sono selezionati i formati di file proprietari, la macro legge direttamente la dimensione dei pixel e Z-step (z). La macro memorizzerà, nella cartella di salvataggio, un foglio dati (.csv) di volumi presinaptici e postsinaptici, un'immagine TIFF multipagina del rilevamento corrente per ogni etichettatura (pre- e postsinaptica). Come indicato sopra, questi file TIFF vengono generati per verificare la qualità delle acquisizioni e per garantire che l'elaborazione delle immagini sia stata eseguita correttamente.
La macro calcola il volume della colorazione M del neurofilamento assonale (volume NF) dal canale NF-M-F594 che colocalizza con la marcatura α-bungarotoxin-F488 e il volume della colorazione della glicoproteina 2 della vescicola sinaptica NMJ (volume SV2) dal canale SV2-F594 che colocalizza con la marcatura α-BTX-F488. L'accumulo di NF-M viene quantificato calcolando il rapporto tra il volume NF e il volume della placca terminale postsinaptica (α-BTX) e l'occupazione del terminale assone NMJ per il rapporto tra i volumi SV2 e α-BTX, come mostrato di seguito.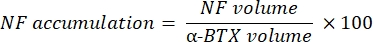
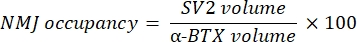
- Trascinare e rilasciare il file Macro_NMJ_ACCU_Marinelloetal.ijm (file di codifica supplementare personalizzato 2) nella finestra di ImageJ; La macro si aprirà in una seconda finestra. In questa nuova finestra, fare clic su Macro > Esegui macro.
5. Analisi delle immagini - microscopia STED
NOTA: l'elaborazione delle immagini è stata eseguita con il software offline del produttore del microscopio STED.
- Avviare il software del microscopio.
- Aprire il progetto facendo clic sul pulsante Apri progetto . Selezionare il file di progetto (.lif) e aprirlo. Le immagini vengono visualizzate sullo schermo insieme ai loro nomi.
- Nella finestra Processo : fare clic su Riduzione rumore > Mediana. Nella parte inferiore della finestra centrale, impostate Raggio su 5,00 e Iterazione su 1,00 e deselezionate Filtro 3D.
- Quindi seleziona la scheda Apri progetti in alto a sinistra della finestra e scegli un'immagine.
- Fare clic su Applica per convalidare i parametri. Viene creata una nuova immagine chiamata "nameofimage_median001".
NOTA: è possibile fare clic su Anteprima prima di Applica per monitorare l'effetto del filtro mediano, che migliorerà il contrasto dell'immagine e uniformerà i profili di linea utilizzati per la quantificazione. - Applicare il filtro a tutte le immagini come indicato nei passaggi 5.4-5.5.
- Nelle schede Apri progetti, fare clic sull'icona dell'unità floppy per salvare tutti i progetti, incluse le immagini filtrate appena create.
NOTA: il passaggio successivo verrà eseguito utilizzando l'immagine filtrata denominata "nameofimage_median001". - Calcola la distanza tra le strisce AChR
NOTA: I cambiamenti nella morfologia delle pieghe postgiunzionali sono spesso osservati nei disturbi neuromuscolari come segno di patologia NMJ (immaturità o degenerazione). La distanza (d) tra le strisce AChR, rilevate mediante colorazione con α-bungarotoxin, viene calcolata generando profili di intensità e quantificando la distanza tra ciascun picco di intensità massima disegnando un profilo di linea (figura supplementare 5).- Utilizzando il software del microscopio, selezionare il menu Quantifica nella parte superiore della finestra centrale.
- Fai clic sulla scheda Strumenti in alto a sinistra. Seleziona Intensità nel pannello in alto a sinistra e fai clic sull'icona Profilo linea . Impostare Oversampling su 1 e selezionare Ordina canali.
- Fare clic sulle schede Apri progetti e selezionare l'immagine filtrata da analizzare.
NOTA: è possibile ingrandire l'immagine scorrendo con il mouse del computer. La gamma dinamica dell'immagine può essere modificata utilizzando la barra sul lato sinistro accanto all'immagine visualizzata, che facilita la visualizzazione delle strisce. - Quindi, fai clic sull'icona Disegna linea nel menu in alto della finestra di destra e traccia una linea che attraversa perpendicolarmente diverse strisce / pieghe giunzionali.
NOTA: il profilo di intensità viene visualizzato nella finestra centrale. - Fare clic sulla parte superiore del primo picco e spostare il puntatore del mouse tenendo premuto il pulsante sinistro del mouse fino al raggiungimento del picco massimo successivo.
NOTA: Le informazioni sono mostrate nel profilo di intensità, mentre la distanza tra i due picchi viene visualizzata sotto il grafico con denominazione "dx". - Fai clic con il pulsante destro del mouse mentre sei nell'immagine della finestra di destra e seleziona Salva ROI. Apri i ROI (Regioni di interesse) salvati facendo clic su Carica ROI.
- Fai clic sull'icona della freccia in alto a sinistra della finestra di destra, fai clic sul ROI ed eliminalo facendo clic sull'icona del cestino.
- Ripetere questa operazione tutte le volte che è necessario da diversi profili di intensità per ottenere il numero previsto di distanze di banda AChR che rappresenteranno il valore globale nel muscolo analizzato.
NOTA: Il valore N ottimale può essere calcolato in anticipo in base alla differenza stimata tra gruppi, rischio α, potenza e test a una o due code. Nell'attuale progetto sperimentale, è stato applicato un test di Mann-Whitney a una coda (rischio α = 10%; potenza = 80%) e il valore N è stato stimato in almeno cinque distanze di banda AChR per NMJ al fine di confrontare i due gruppi di animali.
- Larghezza della striscia AChR
NOTA: La larghezza della striscia (w) corrisponde alla semimassima (FWHM) del profilo di intensità, che è la distanza tra i punti in cui il valore di fluorescenza del segnale α-BTX è la metà della sua intensità massima (Figura 5 supplementare).- Utilizzando il software del microscopio, selezionare il menu Quantifica nella finestra centrale.
- Fare clic sulla scheda Strumenti in alto a sinistra. Seleziona Intensità nel pannello in alto a sinistra e fai clic sull'icona Determina FWHM . Spuntare Ordina canali.
NOTA: per ottimizzare il rilevamento dei picchi da parte del software, Imposta soglia e larghezza sono stati impostati rispettivamente su 50 e 3. Adatta questi valori per ogni esperimento e chiedi consiglio a uno scienziato esperto di imaging. - Fare clic sulle schede Apri progetti e selezionare l'immagine filtrata da analizzare.
NOTA: è possibile ingrandire l'immagine visualizzata nella finestra di destra scorrendo con il mouse del computer. Come indicato sopra (NOTA dopo il passaggio 5.8.3), la gamma dinamica dell'immagine può essere modificata per una visualizzazione ottimale delle strisce. - Quindi, fai clic sull'icona Disegna rettangolo nel menu in alto della finestra di destra. Selezionare una striscia orizzontale o verticale e disegnare un rettangolo perpendicolarmente alla striscia. Nella finestra centrale viene visualizzato un profilo.
- Fate clic su Verticale o Orizzontale del menu Proiezione media situato nel pannello di sinistra, a seconda che l'orientamento della striscia sia verticale o orizzontale.
- Fare clic su Statistiche nella finestra centrale e leggere il valore FWHM.
- Fare clic con il pulsante destro del mouse sull'immagine visualizzata nella finestra di destra e selezionare Salva ROI.
NOTA: Aprire i ROI salvati facendo clic su Carica ROI. - Fai clic sull'icona della freccia in alto a sinistra della finestra di destra, fai clic sul ROI ed eliminalo facendo clic sull'icona del cestino.
- Ripetere questa operazione tutte le volte che è necessario da diversi ROI rettangolo fino ad ottenere il numero previsto di larghezze di banda AChR, che sarà rappresentativo del valore globale nel muscolo analizzato.
6. Disegno sperimentale e prove statistiche
- Eseguire analisi statistiche utilizzando software specifici.
NOTA: I dati sono stati raccolti da N ≥ 3 repliche biologiche e almeno 20 NMJ per genotipo per l'imaging al microscopio confocale, e N ≥ 5 repliche biologiche e N = 5 NMJ per genotipo per l'imaging STED, in ciascun gruppo sperimentale. La significatività è stata valutata mediante test di Mann-Whitney spaiato (non parametrico) e i valori p sono indicati nelle legende delle figure corrispondenti.
Risultati
Al fine di facilitare l'analisi morfologica delle giunzioni neuromuscolari a livello pre- e postsinaptico in modo riproducibile, è stato sviluppato un flusso di lavoro dal prelievo muscolare all'imaging e alla quantificazione utilizzando il software del microscopio e le macro personalizzate ImageJ (Figura 1). Per esemplificare l'utilità di questo protocollo, è stata valutata la morfologia delle NMJ in due modelli murini di malattie genetiche, topi Smn2B / - e ColQ Dex2 / Dex2 affetti da atrofia muscolare spinale (SMA) e una forma di sindrome miastenica congenita (CMS), rispettivamente, e i dati sono stati confrontati con compagni di controllo di pari età.
La struttura NMJ è stata valutata dai muscoli tibiale anteriore e gastrocnemio di topi Smn2B/- (sfondo C57Bl/6) e ColQ Dex2/Dex2 (sfondo B6D2F1/J) di 3 e 6 settimane, rispettivamente, quando i segni della malattia sono già presenti in questi animali. A 3 settimane di età, i topi Smn2B/- mostrano segni di ritardo nello sviluppo e nella denervazione del muscolo scheletrico, come atrofia NMJ e perdita35,36. I topi CMS hanno una patologia primaria nelle NMJ e manifestano una riduzione del peso corporeo dalla prima settimana di vita e una marcata debolezza muscolare20 (dati non mostrati). Come mostrato nella Figura 2A, la piastra terminale del motore postsinaptico marcata con α-bungarotoxina fluorescente è apparsa più piccola e/o frammentata nei mutanti delle due linee di topo mediante microscopia confocale. La quantificazione degli Z-stack NMJ utilizzando queste macro personalizzate di ImageJ ha rivelato marcate diminuzioni del volume della piastra terminale, della proiezione della massima intensità (MIP) e della tortuosità relativa nei topi SMA e CMS rispetto ai controlli, come segni di difetti di maturazione NMJ32 (Figura 2B-D). Il volume della placca terminale postsinaptica e la MIP sono diminuiti negli animali malati (variazione di piega di 2,7 e 2,0 per il volume e 2,5 e 2,0 per la MIP, rispettivamente nei topi Smn2B/- e ColQ Dex2/Dex2). La tortuosità relativa era anche inferiore nei muscoli carenti di SMN e ColQ rispetto alla WT (16,97% ± 1,33% nella SMA contro il 48,84% ± il 5,90% dei topi WT e il 13,29% ± 2,79% nei topi di controllo CMS rispetto al 30,20% ± 4,44% dei topi di controllo). Inoltre, la quantificazione della distribuzione dei rami terminali degli assoni presinaptici utilizzando la macro personalizzata ImageJ ha rivelato un pattern alterato nella distribuzione del neurofilamento M nei due modelli animali, con un aumento dell'immunomarcatura (84,65% ± 0,32% contro 16,57% ± 2,03% e 23,64% ± 2,78% rispetto al 18,77% ± 1,73% nei topi Smn2B/- e ColQ Dex2/Dex2 rispetto ai controlli, rispettivamente) (Figura 3A-D ). Con la colorazione SV2, è stata osservata anche una riduzione del 43% del rapporto di occupazione, cioè la percentuale di regioni contenenti AChR con zone attive adiacenti ai terminali nervosi, (topi Smn2B / - (49,36% ± 3,76% in SMA contro 85,69% ± 2,34% topi WT) (Figura 3E, F). Questo parametro NMJ è stato calcolato anche in GA di mutanti ColQ Dex2/Dex2, ma non è stata trovata alcuna differenza statisticamente significativa rispetto ai compagni di cucciolata di controllo (dati non mostrati).
Abbiamo ulteriormente analizzato le caratteristiche della membrana postsinaptica quantificando la distanza tra le pieghe giunzionali e la larghezza delle strisce AChR, che si trovano sulla cresta di queste pieghe, nel muscolo carente di ColQ utilizzando la microscopia STED (super-resolution stimulated emission depletion). Come mostrato nella Figura 4, l'aspetto di queste strutture può essere chiaramente visualizzato mediante marcatura fluorescente α-bungarotoxin e analisi del profilo di intensità. Abbiamo valutato questi parametri NMJ e abbiamo trovato un aumento della distanza di piega giunzionale (d) e della larghezza (w) delle strisce AChR nel muscolo gastrocnemio dei mutanti (358,3 nm ± 11,97 nm e 320,8 nm ± 10,90 nm per la distanza e 216,9 nm ± 10,51 nm e 186,3 nm ± 7,015 nm per la larghezza, in ColQ Dex2 / Dex2 rispetto ai topi wild-type, rispettivamente, p < 0,05) (Figura 4C,D).
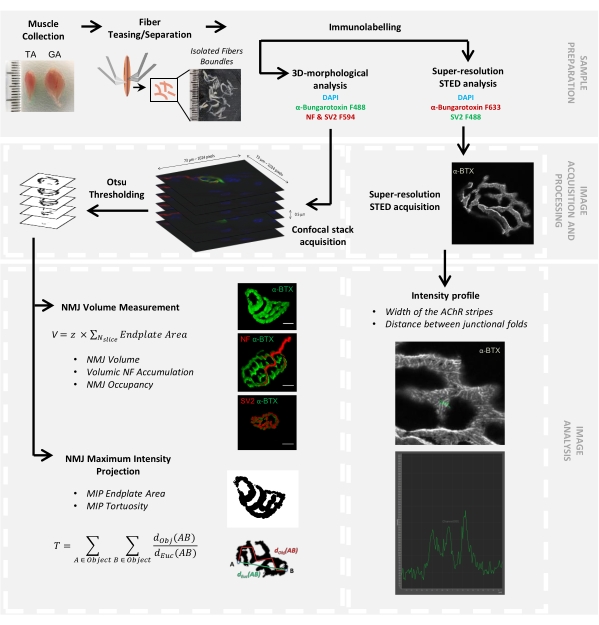
Figura 1: Diagramma di flusso del protocollo video per la caratterizzazione 3D multiscala NMJ mediante microscopia confocale e STED. I muscoli tibiale anteriore (TA) e gastrocnemio (GA) sono stati raccolti dai topi e le fibre muscolari sono state prese in giro prima della marcatura con α-bungarotoxin-F488 o α-bungarotoxin-F633, DAPI, anticorpi primari diretti contro il neurofilamento M (NF-M) e la glicoproteina della vescicola sinaptica 2 (SV2) e anticorpi secondari coniugati con fluoroforo (F488 o F594). Le pile di immagini sono state acquisite mediante microscopia confocale ed elaborate per misurare il volume NMJ postsinaptico, l'accumulo presinaptico di NF-M, l'occupazione terminale degli assoni NMJ, l'area della piastra terminale della proiezione della massima intensità postsinaptica (MIP) e la tortuosità (d Obj (AB) è la distanza tra A e B lungo il perimetro dell'oggetto (linea rossa), mentre dEuc (AB) è la distanza euclidea tra A e B (linea verde)). Per l'analisi al microscopio STED, la larghezza delle strisce del recettore dell'acetilcolina (AChR) e la distanza tra le pieghe giunzionali sono state quantificate dai profili di intensità della colorazione α-BTX-F633. Fare clic qui per visualizzare una versione ingrandita di questa figura.
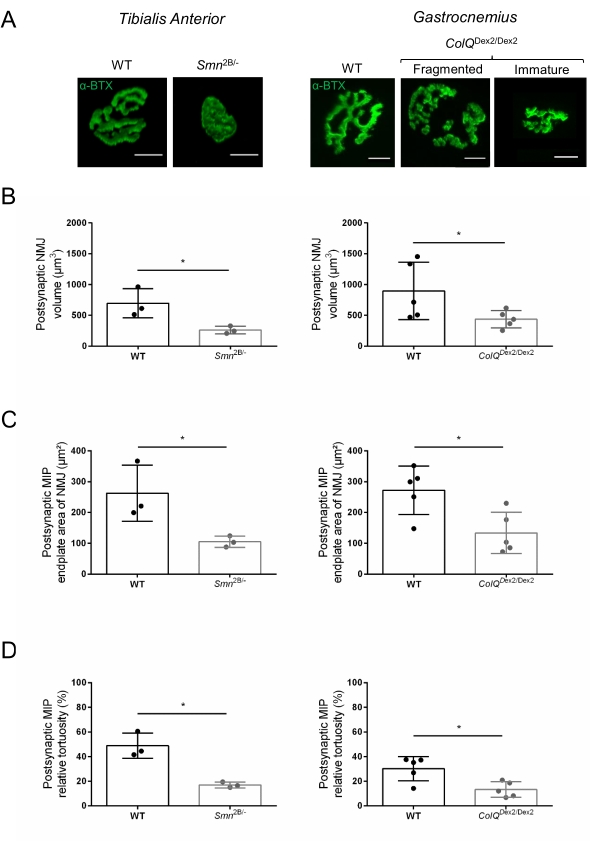
Figura 2: Caratterizzazione multiparametrica della NMJ postsinaptica in modelli murini di atrofia muscolare spinale (SMA) e sindrome miastenica congenita (CMS) correlata a ColQ. (A) Immagini rappresentative di endplate motorie postsinaptiche da muscoli TA e GA marcate con α-bungarotoxin-F488 (α-BTX). (B) Quantificazione del volume della placca terminale postsinaptica NMJ, (C) area di proiezione di intensità massima (MIP) e (D) tortuosità relativa in TA di topi wild-type (WT) e Smn2B/- di 3 settimane (grafici a sinistra, N = 3 animali per genotipo, n = 37 e n = 56 NMJ, rispettivamente) e 6 WT e ColQ Dex2/Dex2 di 6 settimane di età topi (grafici a destra, N = 5 topi per genotipo, n = 89 e n = 97 NMJ, rispettivamente). I dati sono espressi come media per topo (punto) ± SEM. Le differenze tra i gruppi sono state analizzate mediante test di Mann-Whitney (* p < 0,05). La barra della scala è di 10 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
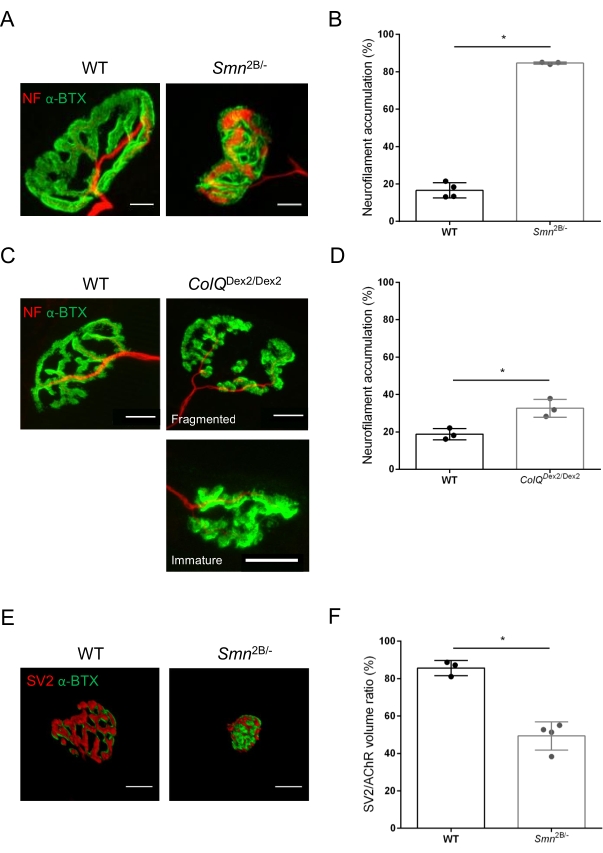
Figura 3: Analisi morfometrica della distribuzione terminale degli assoni presinaptici nei muscoli di topi WT e mutanti. Modello di innervazione NMJ nei muscoli tibiale anteriore (TA) e gastrocnemio (GA) di topi CMS wild-type, SMA e ColQ-correlati. (A, B) Giunzioni neuromuscolari rappresentative da TA di topi WT e Smn2B/- a 21 giorni di età marcati con anticorpi contro il neurofilamento M (NF-M, rosso) e α-bungarotoxin-F488 (α-BTX, verde) (A), e risultati dell'analisi quantitativa dell'accumulo di neurofilamenti (B); (C, D) Giunzioni neuromuscolari rappresentative da GA di topi WT e ColQ Dex2/Dex2 di 6 settimane marcati con anticorpi contro il neurofilamento M (NF-M, rosso) e α-bungarotoxin-F488 (α-BTX, verde), che mostrano placche terminali postsinaptiche frammentate e immature (C) e risultati di accumulo di neurofilamenti nei due gruppi di animali (D). N = 4 (n = 34 NMJs) (B) e N = 3 (n = 54 NMJs) (D) WT animali e N=3 (n = 36 NMJs) Smn2B/- e N = 3 (n = 55 NMJs) ColQDex2/Dex2 topi sono stati analizzati negli esperimenti (B, D). (E, F) Immagini rappresentative dell'occupazione terminale degli assoni nelle NMJ da TA di topi WT e Smn2B/- di 3 settimane marcati con anticorpi contro la glicoproteina 2 della vescicola sinaptica (SV2, rosso) e la α-bungarotoxin-F488 (α-BTX, verde) (E) e risultati dell'occupazione NMJ (rapporto volume SV2/AChR) (F). Sono stati analizzati muscoli di N = 3 (n = 50 NMJ) wild-type e N = 4 (n = 62 NMJ) topi Smn2B / -. I dati sono espressi come valore medio per topo (punto) ± SEM. Le differenze tra i gruppi sono state analizzate mediante test di Mann-Whitney (* p < 0,05). Le barre della scala sono 20 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
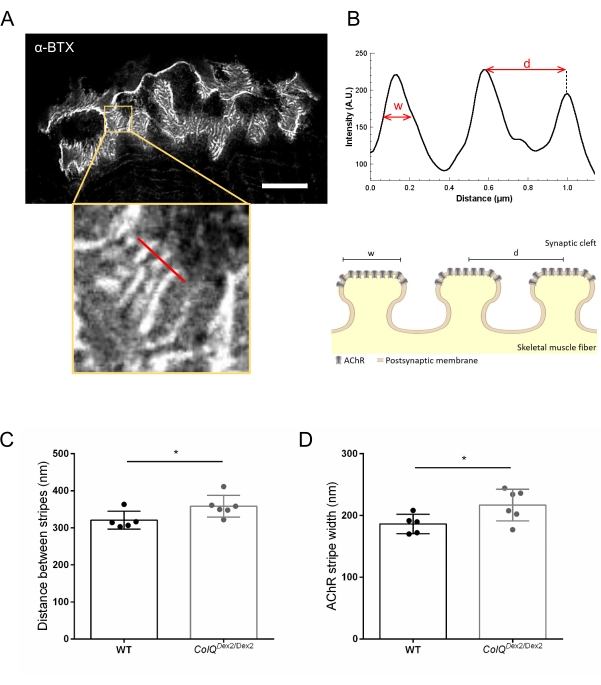
Figura 4: Imaging STED delle endplate postsinaptiche NMJ. (A) Immagine STED rappresentativa di un NMJ marcato con α-bungarotoxin-F633 (α-BTX) da gastrocnemio di un topo wild-type di 6 settimane che mostra strisce AChR postgiunzioni (la barra della scala è 5 μm). (B) Maggiore ingrandimento di una regione con strisce AChR (pannello inferiore) utilizzata per generare il profilo di intensità. La larghezza (w) delle strisce AChR e la distanza tra due strisce adiacenti (d) di questa regione sono state quantificate e presentate nel grafico a barre. Rappresentazione schematica della piastra terminale postsinaptica per illustrare la larghezza della banda AChR (w) e la distanza (d). Questi parametri, (C) AChR distanza di banda e (D) larghezza, sono stati misurati nei topi ColQ Dex2 / Dex2 e compagni di cucciolata di controllo a 6 settimane di età. NMJ di 5 WT (totale n = 29 NMJ) e 6 ColQ Dex2/Dex2 (totale n = 43 NMJ) animali sono stati analizzati alla cieca. I dati sono espressi come media per topo (punto) ± SEM. Le differenze statistiche tra i gruppi sono state analizzate utilizzando il test di Mann-Whitney (* p < 0,05). Fare clic qui per visualizzare una versione ingrandita di questa figura.
Figura supplementare 1: Lancio del software LAS X e dei parametri per le acquisizioni confocali. Le varie fasi per acquisire immagini confocali sono descritte nelle sezioni da 3.1.2 a 3.1.7 del protocollo. Per ogni acquisizione di stack NMJ, viene aperto un progetto (passo 3.1.4) e vengono selezionati i parametri di dimensione dell'immagine, velocità di acquisizione, assi X, Y e Z (passo 3.1.7), con ogni scansione sequenziale indicata (Seq.1, laser 405 per DAPI; Seq.2, laser 488 per α-BTX-F488; e Seq.3, laser 552 per anticorpi secondari coniugati F594). Clicca qui per scaricare questo file.
Figura supplementare 2: Lancio del software LAS X e dei parametri per le acquisizioni STED. I passaggi per acquisire le immagini STED sono descritti nelle sezioni da 3.2.2 a 3.2.8 del protocollo. Il microscopio viene avviato in modalità di configurazione STED ON (passo 3.2.2) e viene aperto un progetto (passo 3.2.3). I parametri per l'acquisizione delle immagini (passo 3.2.7) (dimensione dell'immagine, velocità di acquisizione, fattore di zoom, asse X), con ogni scansione sequenziale sono indicati (Seq.1 per α-BTX-F633; Seq.2 per anticorpi secondari coniugati F488). Clicca qui per scaricare questo file.
Figura 3: Immagini di pieghe giunzionali colorate con α-BTX ottenute mediante microscopia STED. Esempi di immagini di una piastra terminale postsinaptica etichettata con α-BTX-F633 da un mouse wild-type di 6 settimane che sono stati acquisiti con una messa a fuoco corretta (a sinistra) o errata (a destra). Clicca qui per scaricare questo file.
Figura 4 supplementare: popup di Windows per descrivere i dati di input e output ottenuti dalle macro ImageJ personalizzate. Esempi di dati di input (file .tif e .lif) di immagini NMJ sono mostrati nella colonna di sinistra. I dati di output delle macro (colonna di destra) vengono salvati in cartelle (Save_Volume, Save_Accu) che contengono immagini della giunzione (.tif) e schede tecniche contenenti i risultati (file .csv). Clicca qui per scaricare questo file.
Figura 5 supplementare: Analisi della distanza e della larghezza dello stripe AChR da un'acquisizione STED utilizzando il software LAS X. I passaggi per analizzare le immagini STED NMJ sono descritti nella sezione 5 del protocollo. A) Immagine di una regione marcata della placca terminale postsinaptica contenente strisce AChR. La regione di interesse per l'analisi delle strisce viene selezionata disegnando una linea perpendicolare (linea verde, per la distanza della striscia) o un rettangolo perpendicolare (rettangolo viola, per la larghezza della striscia). (B, C) Vengono mostrati i profili di intensità delle regioni selezionate e le misurazioni per calcolare la distanza tra le strisce AChR (B) e la larghezza della banda AChR (C). Clicca qui per scaricare questo file.
File di codifica supplementare 1: Macro_NMJ_VOL_Marinelloetal. Macro personalizzata ImageJ per estrarre le misure dei parametri NMJ (volume NMJ, area endplate MIP e tortuosità NMJ). Clicca qui per scaricare questo file.
File di codifica supplementare 2: Macro_NMJ_ACCU_Marinelloetal. ImageJ macro personalizzata per estrarre l'accumulo NF-M e la colorazione SV2. Clicca qui per scaricare questo file.
Discussione
Il protocollo video descritto fornisce un metodo dettagliato per quantificare la struttura 3D delle giunzioni neuromuscolari combinando microscopia confocale e STED che può essere utilizzata per caratterizzare i cambiamenti patologici a livello pre- e postsinaptico. L'alta risoluzione della microscopia STED consente la visualizzazione e l'analisi morfometrica di nanostrutture che non sono identificabili dall'imaging confocale convenzionale. Questa procedura ci ha permesso di misurare le alterazioni strutturali delle NMJ in due muscoli appendicolari, tibiale anteriore e gastrocnemio, di topi CMS correlati a SMA e ColQ.
Per ottenere risultati affidabili con questa tecnica, è fondamentale sezionare e stuzzicare correttamente i muscoli, prestando particolare attenzione alla fascia che circonda il muscolo e alla forza applicata per separare i fasci muscolari; in caso contrario, il modello di innervazione potrebbe essere interrotto impedendo una corretta valutazione presinaptica NMJ. Sebbene vengano fornite informazioni dettagliate per analizzare NMJ da TA e GA, in linea di principio, questo protocollo potrebbe essere adattato ad altri muscoli, compresi i muscoli piatti, come il diaframma o l'addome trasverso37, che non richiedono la fase di presa in giro. Anche la fissazione dei tessuti è fondamentale per garantire una colorazione di buona qualità; pertanto, si consiglia di utilizzare PFA di alta qualità ad un volume appropriato (15-20 volte quello del muscolo). Inoltre, il tempo di esposizione al fissativo è un passo importante perché artefatti, come il restringimento e l'aggregazione, possono apparire a causa della sovrafissazione e influenzare le caratteristiche NMJ. Date le dimensioni dei campioni e la velocità di penetrazione della soluzione di paraformaldeide nei tessuti38, si raccomanda un tempo di fissazione di 18-24 h per questo tipo di muscolo. Nel caso in cui la fase di colorazione sia pianificata più di una settimana dopo la raccolta dei tessuti, si suggerisce di mantenere i muscoli fissati con PFA in PBS integrati con azoturo di sodio a 4 ° C per prevenire la proliferazione batterica.
Questo protocollo presenta un approccio che utilizza α-BTX-F488 per l'imaging confocale e α-BTX-F633 per l'imaging STED. Questi fluorofori sono stati scelti per adattarsi al progetto sperimentale descritto, ma possono essere modificati in base alle attrezzature e ai materiali disponibili. Ad esempio, l'etichettatura α-BTX F488 può essere selezionata quando si utilizza un laser STED CW 592 nm per l'acquisizione e la quantificazione delle immagini. Tuttavia, sembra che la configurazione applicata nel presente studio (eccitazione pulsata dipendente STED, esaurimento di 775 nm) mostri prestazioni più elevate e una migliore risoluzione rispetto ad altri approcci, come STED39 ad onda continua, rendendolo più adatto per l'applicazione corrente. È inoltre importante selezionare attentamente le impostazioni di potenza del laser, in particolare per STED (sia eccitazione che esaurimento), poiché le caratteristiche di un profilo di intensità non possono essere misurate in caso di saturazione, e quindi qualsiasi segnale saturo in un'immagine NMJ potrebbe compromettere l'intera analisi.
Questo flusso di lavoro dettagliato, che include l'acquisizione e l'analisi delle immagini utilizzando il software del microscopio e le macro ImageJ, è stato sviluppato per facilitare l'analisi morfometrica NMJ autonoma mediante microscopia confocale e STED da un singolo muscolo. I flussi di lavoro precedentemente descritti per l'analisi confocale NMJ, come NMJ-morph2 o NMJ-Analyser14, hanno aperto la strada alla progettazione di metodi semiautomatici che facilitano l'analisi morfologica di NMJ e studi comparativi. NMJ-morph (e la sua versione aggiornata aNMJ-morph15) è una piattaforma gratuita basata su ImageJ che utilizza la proiezione di intensità massima per misurare 21 caratteristiche morfologiche, e NMJ-Analyser utilizza uno script sviluppato in Python che genera 29 parametri rilevanti dall'intera struttura NMJ 3D. La soglia manuale è l'unico passaggio durante l'elaborazione delle immagini in questi due metodi che richiedono l'analisi dell'utente. Questo protocollo integrato descrive in dettaglio i passaggi per la preparazione dei tessuti, le acquisizioni di immagini confocali 3D e l'elaborazione basata su ImageJ di NMJ da interi muscoli scheletrici e fornisce una panoramica semplificata di cinque importanti parametri delle piastre terminali postsinaptiche (volume, area di proiezione massima e tortuosità) e presinaptiche (occupazione terminale degli assoni e accumulo di neurofilamenti). Un ulteriore parametro di rilevanza biologica, il modello di organizzazione AChR delle pieghe giunzionali postsinaptiche, è stato incorporato per l'analisi morfometrica a livello nanometrico mediante microscopia STED a super-risoluzione (risoluzione 20-30 nm)40. È interessante notare che la preparazione dei tessuti per l'imaging STED è più semplice di altri metodi utilizzati per gli studi ultrastrutturali NMJ, come la microscopia elettronica a trasmissione convenzionale (TEM)9, che è una procedura piuttosto complessa e dispendiosa in termini di tempo che richiede un manipolatore esperto per ottenere sezioni ultrasottili della regione muscolare appropriata. Inoltre, i dati quantitativi da più pieghe giunzionali possono essere ottenuti automaticamente usando il software associato a STED.
Questo protocollo è stato applicato per illustrare difetti NMJ precedentemente noti nei muscoli carenti di SMN e ColQ 20,36,41,42. Cambiamenti comuni sono stati trovati nei due modelli murini mediante microscopia confocale, come la diminuzione del volume della placca terminale postsinaptica, l'area MIP e la tortuosità relativa e l'aumento dell'accumulo di neurofilamenti, mentre alcuni risultati più specifici (diminuzione dell'occupazione NMJ), sono stati osservati solo nei topi SMA, come indicatore del traffico di vescicole alterato36. Infine, un aumento della distanza e della larghezza della banda AChR è stato rilevato in ColQ-KO mediante analisi STED, che sono segni di difetti ultrastrutturali nelle pieghe giunzionali postsinaptiche, come precedentemente osservato da TEM20. È importante sottolineare che questo protocollo può aiutare in una caratterizzazione morfologica più approfondita delle giunzioni neuromuscolari durante lo sviluppo, il mantenimento e in varie condizioni patologiche.
Divulgazioni
Gli autori non dichiarano conflitti di interesse relativi a questo lavoro.
Riconoscimenti
Ringraziamo la "Imaging and Cytometry Core Facility" di Genethon, così come il servizio di istologia, che sono supportati in parte dai fondi per le attrezzature della Regione Ile-de-France, del Conseil General de l'Essonne, della Genopole Recherche di Evry, dell'Università di Evry Val d'Essonne e dell'INSERM, Francia. Siamo anche grati al Dr. Rashmi Kothary per aver fornito la linea di mouse Smn 2B / 2B (Università di Ottawa, Canada) e al Dr. Eric Krejci per la linea di mouse ColQDex2 / + (non pubblicato, Università di Parigi, Francia). Ringraziamo Guillaume Corre per il suo sostegno nell'analisi statistica. Gli anticorpi monoclonali 2H3 (sviluppati da Jessel, T.M. e Dodd, J.) e SV2 (sviluppati da Buckley, K.M.) sono stati ottenuti dalla Developmental Studies Hybridoma Bank (DSHB), creata dal NICHD del NIH e mantenuta presso l'Università dell'Iowa, Dipartimento di Biologia, Iowa City, IA 52242. Questo lavoro è stato sostenuto dall'Association Française contre les Myopathies (AFM-Telethon), dall'INSERM e dall'Università di Evry Val d'Essonne.
Materiali
| Name | Company | Catalog Number | Comments |
| Buffers and Reagents | |||
| Alexa Fluor 488 goat anti-mouse IgG (F488) | Life Technologies, Thermofisher | A-11001 | |
| Alexa Fluor 488 α-bungarotoxin (F488-a-BTX) | Life Technologies, Thermofisher | B13422 | |
| Alexa Fluor 594 goat anti-mouse IgG (F594) | Life Technologies, Thermofisher | A-11032 | |
| ATTO-633 α-bungarotoxin (F633-a-BTX) | Alomone Labs | B-100-FR | |
| Bovine serum albumin (BSA) | Sigma | A2153 | |
| DAPI Fluoromount-G | Southern Biotech | 00-4959-52 | |
| DPBS | Gibco, Invitrogen | 14190-169 | |
| Ethanol Absolute | VWR | 20821.296 | |
| Immersion Oil, n = 1.518 | THORLABS | MOIL-10LF | Low autofluorescence |
| Neurofilament (NF-M) antibody | DSHB | AB_531793 | |
| Paraformaldehyde (PFA) | MERCK | 1.04005 | |
| Synaptic vesicle glycoprotein 2 (SV2) antibody | DSHB | AB_2315387 | |
| Triton X-100 | Sigma | T8787 | |
| Materials | |||
| Alnico Button cylindrical magnets | Farnell France | E822 | diameter of 19.1 mm with maximal pull of 1.9 Kg |
| 63x 1.4 NA magnitude oil immersion HCX Plan Apo CS objective | Leica Microsystems | ||
| 100x 1.4 NA HC PL APPO CS2 Objective | Zeiss | ||
| Curved thin forceps-Moria iris forceps | Fine Science Tools | 11370-31 | |
| Extra thin scissors - Vannas-Tübingen Spring Scissors | Fine Science Tools | 15-003-08 | |
| Fine serrated forceps | Euronexia | P-95-AA | |
| Gel loading tip round 1-200 µL | COSTAR | 4853 | |
| Leica laser-scanning confocal microscope TCS SP8 | Leica Microsystems | ||
| Leica Laser-scanning confocal microscope TCS SP8 Gated STED 775 nm | Leica Microsystems | ||
| Lens Cleaning Tissue | Whatman (GE Healthcare) | 2105-841 | |
| Medium serrated forceps | Euronexia | P-95-AB | |
| Microscope cover glasses 24x50 nm No 1.5H 170±5 µm | Marienfield | 107222 | High precision |
| Nunclon delta surface (12-well plates) | Thermo Scientific | 150628 | |
| Nunclon delta surface (24-well plates) | Thermo Scientific | 142475 | |
| Safeshield scalpel | Feather | 02.001.40.023 | |
| Sharp-blunt scissors - fine Scissors - Martensitic Stainless Steel | Fine Science Tools | 14094-11 | |
| Superfrost plus slides | Thermo Scientific | J1800AMNZ | |
| Software | |||
| GraphPad | Prism, San Diego (US) | Release N°6.07 | Statistical software |
| ImageJ software | National Institutes of Health | Release N° 1.53f | |
| Leica Application Suite X software | Leica Microsystems | Release N°3.7.2.2283 | Free microscope software available at https://www.leica-microsystems.com/products/microscope-software/p/leica-las-x-ls/downloads/ |
Riferimenti
- Slater, C. R. Postnatal maturation of nerve-muscle junctions in hindlimb muscles of the mouse. Developmental Biology. 94 (1), 11-22 (1982).
- Jones, R. A., et al. NMJ-morph reveals principal components of synaptic morphology influencing structure-function relationships at the neuromuscular junction. Open Biology. 6 (12), (2016).
- Willadt, S., Nash, M., Slater, C. Age-related changes in the structure and function of mammalian neuromuscular junctions. Annals of the New York Academy of Sciences. 1412, 41-53 (2018).
- Boehm, I., et al. Comparative anatomy of the mammalian neuromuscular junction. Journal of Anatomy. 237 (5), 827-836 (2020).
- Nishimune, H., Shigemoto, K. Practical anatomy of the neuromuscular junction in health and disease. Neurologic Clinics. 36 (2), 231-240 (2018).
- Moloney, E. B., de Winter, F., Verhaagen, J. ALS as a distal axonopathy: molecular mechanisms affecting neuromuscular junction stability in the presymptomatic stages of the disease. Frontiers in Neuroscience. 8, (2014).
- Lovering, R. M., Iyer, S. R., Edwards, B., Davies, K. E. Alterations of neuromuscular junctions in Duchenne muscular dystrophy. Neuroscience Letters. 737, 135304 (2020).
- Koneczny, I., Herbst, R. Myasthenia Gravis: Pathogenic effects of autoantibodies on neuromuscular architecture. Cells. 8 (7), 671 (2019).
- Dowling, J. J., et al. Myotubular myopathy and the neuromuscular junction: a novel therapeutic approach from mouse models. Disease Models & Mechanisms. 5 (6), 852-859 (2012).
- Gibbs, E. M., et al. Neuromuscular junction abnormalities in DNM2-related centronuclear myopathy. Journal of Molecular Medicine. 91 (6), 727-737 (2013).
- Swoboda, K. J., et al. Natural history of denervation in SMA: Relation to age, SMN2 copy number, and function. Annals of Neurology. 57 (5), 704-712 (2005).
- Rodríguez Cruz, P. M., Palace, J., Beeson, D. The neuromuscular junction and wide heterogeneity of congenital myasthenic syndromes. International Journal of Molecular Sciences. 19 (6), 1677 (2018).
- Tse, N., et al. The neuromuscular junction: Measuring synapse size, fragmentation and changes in synaptic protein density using confocal fluorescence microscopy. Journal of Visualized Experiments: JoVE. (94), e52220 (2014).
- Mejia Maza, A., et al. NMJ-Analyser identifies subtle early changes in mouse models of neuromuscular disease. Scientific Reports. 11 (1), 12251 (2021).
- Minty, G., et al. aNMJ-morph: a simple macro for rapid analysis of neuromuscular junction morphology. Royal Society Open Science. 7 (4), 200128 (2020).
- Modla, S., Mendonca, J., Czymmek, K. J., Akins, R. E. Identification of neuromuscular junctions by correlative confocal and transmission electron microscopy. Journal of Neuroscience Methods. 191 (2), 158-165 (2010).
- Kittel, R. J., et al. Bruchpilot promotes active zone assembly, Ca2+ channel clustering, and vesicle release. Science. 312 (5776), 1051-1054 (2006).
- York, A. L., Zheng, J. Q. Super-resolution microscopy reveals a nanoscale organization of acetylcholine receptors for trans-synaptic alignment at neuromuscular synapses. eNeuro. 4 (4), (2017).
- Bowerman, M., Murray, L. M., Beauvais, A., Pinheiro, B., Kothary, R. A critical smn threshold in mice dictates onset of an intermediate spinal muscular atrophy phenotype associated with a distinct neuromuscular junction pathology. Neuromuscular Disorders. 22 (3), 263-276 (2012).
- Feng, G., Krejci, E., Molgo, J., Cunningham, J. M., Massoulié, J., Sanes, J. R. Genetic analysis of collagen Q: Roles in acetylcholinesterase and butyrylcholinesterase assembly and in synaptic structure and function. Journal of Cell Biology. 144 (6), 1349-1360 (1999).
- Sigoillot, S. M., et al. Neuromuscular junction immaturity and muscle atrophy are hallmarks of the ColQ-deficient mouse, a model of congenital myasthenic syndrome with acetylcholinesterase deficiency. The FASEB Journal. 30 (6), 2382-2399 (2016).
- Vanhaesebrouck, A. E., Beeson, D. The congenital myasthenic syndromes: expanding genetic and phenotypic spectrums and refining treatment strategies. Current Opinion in Neurology. 32 (5), 696-703 (2019).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Linkert, M., et al. Metadata matters: access to image data in the real world. Journal of Cell Biology. 189 (5), 777-782 (2010).
- Legland, D., Beaugrand, J. Automated clustering of lignocellulosic fibres based on morphometric features and using clustering of variables. Industrial Crops and Products. 45, 253-261 (2013).
- . GitHUb Available from: https://github.com/Genethon/ImCy (2021)
- Otsu, N. A Threshold selection method from gray-level histograms. IEEE Transactions on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Sanes, J. R., Lichtman, J. W. Induction, assembly, maturation and maintenance of a postsynaptic apparatus. Nature Reviews Neuroscience. 2 (11), 791-805 (2001).
- Kong, L., et al. Impaired synaptic vesicle release and immaturity of neuromuscular junctions in spinal muscular atrophy mice. The Journal of Neuroscience. 29 (3), 842-851 (2009).
- Cifuentes-Diaz, C., et al. Neurofilament accumulation at the motor endplate and lack of axonal sprouting in a spinal muscular atrophy mouse model. Human Molecular Genetics. 11 (12), 1439-1447 (2002).
- Murray, L. M., Comley, L. H., Thomson, D., Parkinson, N., Talbot, K., Gillingwater, T. H. Selective vulnerability of motor neurons and dissociation of pre- and post-synaptic pathology at the neuromuscular junction in mouse models of spinal muscular atrophy. Human Molecular Genetics. 17 (7), 949-962 (2008).
- Boyer, J. G., et al. Myogenic program dysregulation is contributory to disease pathogenesis in spinal muscular atrophy. Human Molecular Genetics. 23 (16), 4249-4259 (2014).
- Ling, K. K. Y., Gibbs, R. M., Feng, Z., Ko, C. -. P. Severe neuromuscular denervation of clinically relevant muscles in a mouse model of spinal muscular atrophy. Human Molecular Genetics. 21 (1), 185-195 (2012).
- Murray, L., Gillingwater, T. H., Kothary, R. Dissection of the transversus abdominis muscle for whole-mount neuromuscular junction analysis. Journal of Visualized Experiments: JoVE. (83), e51162 (2014).
- Baker, J. R. . Principles of biological microtechnique; a study of fixation and dyeing. , (1958).
- Vicidomini, G., et al. STED Nanoscopy with time-gated detection: Theoretical and experimental aspects. PLoS ONE. 8 (1), 054421 (2013).
- Badawi, Y., Nishimune, H. Super-resolution microscopy for analyzing neuromuscular junctions and synapses. Neuroscience Letters. 715, 134644 (2020).
- Thomson, S. R., et al. Morphological characteristics of motor neurons do not determine their relative susceptibility to degeneration in a mouse model of severe spinal muscular atrophy. PLoS ONE. 7 (12), 052605 (2012).
- McMacken, G. M., et al. Salbutamol modifies the neuromuscular junction in a mouse model of ColQ myasthenic syndrome. Human Molecular Genetics. 28 (14), 2339-2351 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon