É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um método passo-a-passo para detectar anticorpos neutralizantes contra a AAV usando um ensaio baseado em células coloridas
Neste Artigo
Resumo
Um protocolo de laboratório abrangente e um fluxo de trabalho de análise são descritos para um ensaio rápido, econômico e simples baseado em células coloridas para detectar elementos neutralizantes contra o AAV6.
Resumo
Os vírus associados à adeno recombinante (rAAV) provaram ser um vetor seguro e bem sucedido para a transferência de material genético para tratar várias condições de saúde tanto no laboratório quanto na clínica. No entanto, anticorpos neutralizantes pré-existentes (NAbs) contra capsídeos AAV representam um desafio contínuo para a administração bem sucedida de terapias genéticas em grandes modelos experimentais animais e populações humanas. A triagem preliminar para a imunidade do hospedeiro contra a AAV é necessária para garantir a eficácia das terapias genéticas baseadas em AAV como ferramenta de pesquisa e como um agente terapêutico clinicamente viável. Este protocolo descreve um ensaio in vitro colorimétrico para detectar fatores neutralizantes contra o sorotipo AAV 6 (AAV6). O ensaio utiliza a reação entre um gene repórter de fosfatase alcalina (AP) e seu substrato NBT/BCIP, que gera uma mancha roxa quantificável insolúvel após a combinação.
Neste protocolo, as amostras de soro são combinadas com um AAV expressando AP e incubadas para permitir que possíveis atividades de neutralização ocorram. A mistura de soro do vírus é posteriormente adicionada às células para permitir a transdução viral de quaisquer AAVs que não tenham sido neutralizados. O substrato NBT/BCIP é adicionado e sofre uma reação cromogênica, correspondendo à transdução viral e atividade neutralizante. A proporção de área colorida é quantitatada usando uma ferramenta de software livre para gerar titulações neutralizadoras. Este ensaio mostra uma forte correlação positiva entre coloração e concentração viral. A avaliação de amostras de soro de ovelhas antes e depois da administração de um AAV6 recombinante levou a um aumento dramático na atividade neutralizante (aumento de 125 a >10.000 vezes). O ensaio apresentou sensibilidade adequada para detectar atividade neutralizante em diluições de soro >1:32.000. Este ensaio fornece um método simples, rápido e econômico para detectar NAbs contra AAVs.
Introdução
Os vírus associados ao Adeno (AAV) são cada vez mais utilizados como vetores para a entrega de terapias genéticas para tratamentos experimentais para várias condições de saúde que impactam os sistemas nervosos cardiovascular, pulmonar, circulatório, ocular e central1,2,3,4,5. A popularidade dos vetores AAV como uma plataforma líder de terapia genética decorre de seu perfil positivo de segurança, expressão transgênica de longo prazo e tropismos específicos de tecido amplo1,6. Resultados bem-sucedidos em estudos em animais abriram caminho para mais de cinquenta ensaios clínicos de terapia genética AAV que atingiram com sucesso seus pontos finais de eficácia7, bem como a liberação do primeiro medicamento comercialmente disponível de terapia genética AAV aprovado pela Food and Drug Administration8 dos EUA. Após os sucessos iniciais, a AAV continuou a ganhar tração nos setores de pesquisa básica e clínica como vetor de escolha e atualmente é a única terapia genética in vivo aprovada para uso clínico nos EUA e europa9. No entanto, a presença de anticorpos neutralizantes pré-existentes (NAbs) contra capsídeos vetoriais de AAV continua a ser um empecilho tanto para a pesquisa pré-clínica quanto para a eficácia dos ensaios clínicos. Os NAbs estão presentes em populações humanas e animais ingênuas e inibem a transdução genética após a administração in vivo de um vetor AAV1. A soropositividade AAV é um critério de exclusão para a maioria dos ensaios de terapia genética e, portanto, a triagem preliminar para imunidade hospedeira é crucial tanto no laboratório quanto na clínica. Estabelecer um ensaio que possa detectar a presença de NAbs contra AAV é um passo essencial no pipeline de qualquer projeto de pesquisa baseado em terapia genética AAV. Este relatório se concentra no AAV6, que tem sido de interesse dos pesquisadores devido à sua transdução eficiente e seletiva no músculo estriado (músculo cardíaco e esquelético)1,10,11,12. A terapia genética é considerada uma estratégia promissora para atingir o coração porque é difícil atingir especificamente o coração sem procedimentos invasivos de coração aberto.
A atividade neutralizante é geralmente determinada usando um ensaio de inibição de transdução in vitro ou in vivo. In vivo Os ensaios da NAb geralmente envolvem a administração de soro de um sujeito de teste (por exemplo, humano ou animal grande) em camundongos, seguido por um AAV com um gene repórter, seguido de testes para a expressão do gene repórter ou antígeno correspondente. Ensaios in vitro determinam os títulos de NAb incubando soro ou plasma de um animal humano ou grande em diluições seriais com um AAV recombinante (rAAV) que expressa um gene repórter. As células estão infectadas com a mistura soro/vírus, e até que ponto a expressão genética do repórter é inibida é avaliada em comparação com os controles. Ensaios in vitro são amplamente utilizados para a triagem de NAb devido ao seu custo relativamente menor, rapidez nos testes e maior capacidade de padronização e validação13,14 em comparação com ensaios in vivo. Ensaios in vivo são frequentemente relatados como ter maior sensibilidade15,16, mas a mesma alegação foi feita em relação aos ensaios in vitro14,17.
Até o momento, ensaios in vitro NAb têm usado principalmente luminescência (luciferase) como o gene repórter para detectar a neutralização. Embora um método baseado em luz tenha mérito em muitos contextos, um ensaio de NAb colorimétrico/cromogênico pode ser vantajoso em algumas circunstâncias. Os ensaios colorimétricos para avaliar a neutralização têm sido empregados com sucesso para outros vírus, como influenza e adenovírus18,19. Sua atratividade decorre de sua simplicidade, menor custo e exigência apenas de aparelhos e ferramentas de laboratório cotidianos20. Ensaios nab que usam um gene repórter baseado em luminescência requerem kits de substrato caros, um luminômetro e software correspondente para análise21. Este ensaio colorimétrico tem a vantagem de exigir apenas um microscópio leve e um substrato muito barato. O relato da sensibilidade dos ensaios colorimétricos versus luminescentes tem gerado resultados conflitantes. Um estudo sugeriu ensaios ELISA baseados em luminescência que mostram maior sensibilidade e reprodutibilidade comparável aos ensaios colorimétricos22, enquanto outro encontrou ensaios ELISA baseados em colorimetria para conferir maior sensibilidade23. Aqui, um protocolo detalhado para um ensaio in vitro NAb contra a AAV que utiliza a reação cromogênica entre um AAV codificando um gene repórter de fosfatase alcalina (AP) e um tetrazolium nitro azul /5-bromo-4-cloro-3-indol fosfato (NBT/BCIP) substrato é fornecido. Este protocolo passo-a-passo foi desenvolvido com base em um relatório anterior que utilizou um gene de repórter hPLAP (phosphatase alcalina da placenta humana) (AAV6-hPLAP) para detectar atividade neutralizante contra AAV24. Este ensaio é econômico, demorado, fácil de configurar e requer habilidades técnicas mínimas, equipamentos de laboratório e reagentes. Além disso, a simplicidade deste ensaio lhe dá o potencial de ser otimizado para aplicações amplas em diferentes tipos de células, tecidos ou sorotipos virais.
Protocolo
Todos os aspectos do cuidado e experimentação animal foram conduzidos seguindo as diretrizes do Instituto Florey de Neurociência e Saúde Mental e o Código Australiano para o Cuidado e Uso de Animais para Fins Científicos após a Referência25. Foram utilizadas no estudo ovelhas Merino de 1,5 a 3 anos. Uma visão geral esquemática do protocolo de ensaio é fornecida na Figura 1.
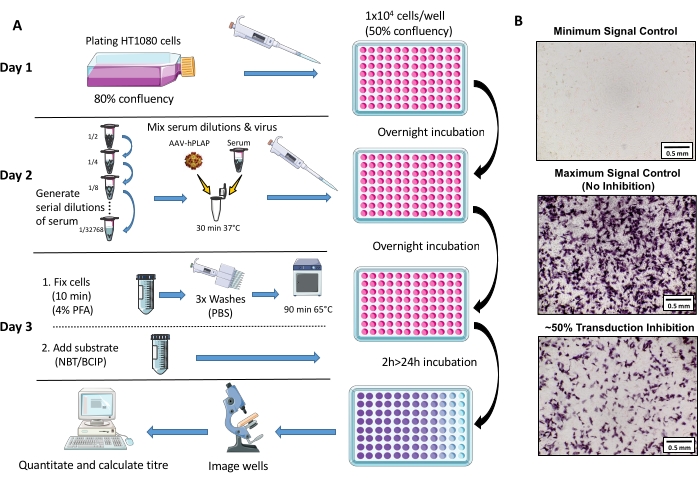
Figura 1: Diagrama esquemático do protocolo de ensaio NAb. (A) Representação visual do ensaio NAb ilustrando as etapas primárias envolvidas no protocolo de três dias. Resumidamente, as células são cultivadas e banhadas durante a noite. No dia seguinte, diluições seriais de soro são preparadas, incubadas com AAV e incubadas com as células durante a noite. No dia seguinte, as células são fixas, lavadas, incubadas, combinadas com o substrato, e incubadas novamente, seguidas de imagem e quantitação. (B) Imagens representativas de um controle mínimo de sinal (inibição completa de AAV), um controle máximo de sinal (sem inibição) e uma amostra de soro de ovino com ~50% de inibição do sinal. Barra de escala = 0,5 mm. Clique aqui para ver uma versão maior desta figura.
1. Preparação inicial
- Para avaliação em ovinos: coletar sangue em tubos ativadores de coágulos separadores de soro de 8 mL (ver Tabela de Materiais), deixar a amostra de sangue à temperatura ambiente (RT) por 20-30 min e, posteriormente, girar a 2.100 x g por 15 minutos. O supernatante claro que se forma no topo dos tubos é o soro. Aliquot a fase aquosa clara em tubos de microcentrifuus e armazene a -80 °C.
NOTA: O soro a -80 °C permanece estável por ~5 anos. O sangue foi coletado da veia carótida usando uma agulha de 16 G (ponta cortada) e seringa de animais conscientes. - Inativar o soro bovino fetal (FBS) colocando-o em um banho de água a 56 °C por 30 min e redemoinho intermitentemente. Para precisão, coloque um termômetro em uma segunda garrafa contendo um volume equivalente de água e adicione-o ao banho de calor ao mesmo tempo que a garrafa FBS. Comece o tempo quando o termômetro atingir 56 °C.
- Empregue técnica asséptica adequada e prática de cultura celular para todas as etapas subsequentes realizadas na cultura celular 26,27. Pulverizar 70% de etanol em todos os objetos e no capô antes de usar e limpar com 1% de hipoclorito de sódio após a conclusão.
- Faça o DMEM (Modified Eagle Medium, meio de águia modificada) da Dulbecco, combinando alta glicose (4,5 g/L) DMEM (89%) com FBS inativados pelo calor (10%) e Estreptomicina penicilina (1%). Combine e filtre usando um sistema de filtragem de vácuo estéril (tamanho de poros de 0,22 μm, membrana polietroésulfone) (ver Tabela de Materiais). Armazene dMEM completo embrulhado em papel alumínio a 4 °C.
- Estabeleça células HT1080 (ver Tabela de Materiais) e passagem em um frasco quadrado de 75 cm2 , conforme descrito em Reference28. Crie vários estoques congelados de células. Não use células após 20 passagens, pois a aprovação adicional pode influenciar os resultados do ensaio.
2. Dia 1 - Chapeamento de células
- Passagem HT1080 células quando atingem ~80% de confluência.
- DMEM completo pré-quente (preparado na etapa 1.4), 0,05% trypsin-EDTA e 1x salina tamponada com fosfato (PBS) a 37 °C em banho-maria. Remova o meio de crescimento das células passagens usando um sistema de aspiração.
NOTA: Toda aspiração neste protocolo utiliza um sistema de vácuo com um tubo ligado a uma pipeta sorológica estéril de 5 mL. - Lave as células em 10 mL de células pré-aquecidas (37 °C) 1x PBS e trippsinize células por 3-4 min em 4 mL de 0,05% de trypsin-EDTA para desprender as células do frasco.
- Inativar a trippsina adicionando 6 mL de DMEM completo pré-aquecido e pipeta as células em um tubo de 50 mL. Calcule o número e a concentração de células viáveis usando um hemótmetro e o método de exclusão azul trypan29.
- Diluir as células a uma concentração de 1 x 105 células/mL em DMEM completo pré-aquecido. Semente 100 μL de células/bem em placas claras de fundo plano de 96 bem (1 x 104 células por poço). Incubar a placa a 37 °C, 5% de dióxido de carbono (CO2) durante a noite por 16-22 h.
3. Dia 2 - Infectando as células
- Remova a placa/s da incubadora e use um microscópio leve para confirmar que as células estão uniformemente dispersas dentro dos poços e que a confluência é ~50%. Se as células não estiverem dentro de uma faixa de confluência de 45%-55%, repita o protocolo 'Dia 1' e ajuste a concentração celular inicial de acordo.
- Gerar diluições seriais das amostras de soro de interesse em tubos de microcentrifuuuge de 1,5 mL usando DMEM completo pré-aquecido como diluente. A Tabela 1 demonstra a geração de uma cascata de diluição para amostras triplicadas.
- Para realizar o ensaio em triplicado, prepare um genoma vetorial de 7,5 x 106 (vg)/μL de solução de trabalho do AAV6-hPLAP (ver Tabela de Materiais) diluindo uma solução de estoque de vírus em 1x PBS.
- Adicione 66 μL da solução de funcionamento do vírus 7,5 x 106 vg/μL a cada tubo contendo 264 μL de diluição de soro/mídia (330 μL de volume/diluição total, consulte a Tabela 1).
NOTA: Este é um ensaio robusto que não requer condições perfeitas de cultura. No entanto, para quantificar com precisão e garantir que cada execução de ensaio seja confiável, é necessário incluir o seguinte: (1) um vírus e controle somente de mídia, (2) um controle somente de mídia e (3) uma amostra de controle positivo NAb em todas as placas sob as mesmas condições experimentais. O volume descrito (330 μL) é responsável por amostras triplicadas +10% da mistura de soro e vírus. A realização de réplicas é altamente recomendada para a determinação precisa da atividade neutralizante.
- Misture as diluições do vírus/soro por pipeta e coloque os tubos contendo as misturas vírus/soro em uma incubadora a 37 °C, 5% de CO2 por 30 minutos para permitir que a neutralização potencial ocorra.
- Pipeta 100 μL da mistura vírus/soro para cada poço na placa de 96 poços contendo 1 x 104 células/poço para cada diluição.
NOTA: Isso gerará uma concentração viral final de 15k vírus/multiplicidade celular de infecção (MOI) em cada poço. A Tabela 2 fornece um exemplo de layout de placa de amostra de 96 poços para avaliar amostras para uma diluição de 1/512. - Enrole a placa de 96 poços contendo células, soro e AAV-hPLAP em papel alumínio e coloque em uma incubadora a 37 °C, 5% de CO2 durante a noite por 16-24 h para permitir a entrada de AAV nas células.
| Selo cascata de diluição | Diluição | 3 x amostra (240 μL) + 10% de volume tampão (24 μL) | Proporção de soro:mídia |
| Diluição 1 (D1) | 1/2 | 264 μL soro 264 μL mídia | 50:50 |
| Diluição 2 (D2) | 1/4 | 264 μL D1 + 264 μL de mídia | 25:75 |
| Diluição 3 (D3) | 1/8 | 264 μL D2 +264μL de mídia | 12.5:87.5 |
| Diluição 4 (D4) | 1/16 | 264 μL D3 +264 μL de mídia | 6.25:93.75 |
| Diluição 5 (D5) | 1/32 | 264 μL D4 +264 μL de mídia | 3.13:96.87 |
| Diluição 6 (D6) | 1/64 | 264 μL D5 +264 μL de mídia | 1.56:98.44 |
| Diluição 7 (D7) | 1/128 | 264 μL D5 +264 μL de mídia | 0.78:99.22 |
| Diluição 8 (D8) | 1/256 | 264 μL D5 +264 μL de mídia | 0.39:99.61 |
| Diluição 9 (D9) | 1/512 | 264 μL D7 + 264 μL de mídia | 0.2:99.8 |
| Diluição 10 (D10) | 1/2048 | 132 μL D8 + 396 μL de mídia | 0.05:99.95 |
| Diluição 11 (D11) | 1/8192 | 132 μL D9 + 396 μL de mídia | 0.01:99.99 |
| Diluição 12 (D12) | 1/32768 | 132 μL D10 + 396 μL de mídia | 0.003:99.997 |
Tabela 1: Volumes de soro e diluente necessários para gerar diluições seriais de soro em triplicado.
| Amostra de soro #1 | Amostra de soro #2 | Amostra de soro #3 | Mono AB (mAB), controles e amostras extras | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| Um | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 50 ng MAb | 50 ng MAb | 50 ng MAb |
| B | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 5 ng MAb | 5 ng MAb | 5 ng MAb |
| C | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 0,5 ng MAb | 0,5 ng MAb | 0,5 ng MAb |
| D | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | MO (-C) | MO (-C) | MO (-C) |
| E | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | VO (+C) | VO (+C) | VO (+C) |
| F | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | Amostra #1 1/512 | Amostra #1 1/512 | Amostra #1 1/512 |
| G | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | Amostra #2 1/512 | Amostra #2 1/512 | Amostra #2 1/512 |
| H | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | Amostra #3 1/512 | Amostra #3 1/512 | Amostra #3 1/512 |
Tabela 2: Exemplo de layout de placa de 96 poços para avaliar amostras de soro ingênuo em diluições que variam de 1/2 a 1/512. Diluições mais altas são incorporadas ao ensaio se avaliar uma amostra conhecida como positiva para NAbs AAV (amostras pós-administração) ou se um título maior for necessário. MO (-C): Controle somente de mídia. VO (+C): Controle somente de vírus e mídia. mAb: Anticorpo monoclonal contra AAV (Controle positivo NAb).
4. Dia 3 - Fixação e adição de substrato às células
- Pré-aqueça uma alíquota de 1x PBS a 37 °C (~25 mL/96-well). Resfriar alíquotas separadas de PBS (~25 mL/96-well plate) e H2O destilado duplo (DDW, ~25 mL/96-well plate) a 4 °C. Dissolva uma pelota de BCIP/NBT (ver Tabela de Materiais) em 10 mL de DDW em um tubo de centrífuga cônica de 50 mL por vórtice (10 mL é suficiente para placas de 2 x 96).
- Aspire a mídia dos poços da placa de 96 poços usando uma pipeta sorológica ou similar anexada a um sistema de aspiração baseado em sucção ou vácuo de capô de fumaça. Coloque suavemente a ponta da pipeta sorológica no poço e remova a mídia tomando cuidado para não perturbar as células aderidas.
- Adicione 50 μL de RT 4% PFA a cada poço usando uma pipeta. Enrole a placa em papel alumínio e deixe-a em RT por 10 minutos para fixar as células.
ATENÇÃO: Paraformaldeído (PFA) é um provável cancerígeno e é tóxico de contato com a pele ou visual ou inalação. Manuseie em um capô de fumaça com equipamento de proteção individual adequado, bem como uma máscara facial. Faça novo 4% pfa diluído em PBS (~7 mL necessário por placa de 96 poços).
- Adicione 50 μL de RT 4% PFA a cada poço usando uma pipeta. Enrole a placa em papel alumínio e deixe-a em RT por 10 minutos para fixar as células.
- Lave e aspire as células com 200 μL de RT 1x PBS. Repita este passo duas vezes.
NOTA: Uma pipeta multicanal é uma opção eficiente para as etapas de pipetação. - Pipeta 200 μL de PBS pré-aquecido em cada poço, enrole a placa em papel alumínio e incubar a 65 °C por 90 min para desnaturar atividade fosfatase alcalina endógena30.
- Aspirar poços e lavar células com 200 μL de PBS frio (4 °C). Aspirar novamente, lavar em 200 μl de DDW frio, e aspirar novamente.
- Pipeta 50 μL do BCIP/NBT dissolvido (preparado na etapa 4.1) em cada poço.
- Enrole a placa em papel alumínio e incubar na RT por 2-24 h.
NOTA: Seja consistente com o tempo de incubação entre as corridas; a flexibilidade de tempo permite que os usuários fotografem poços no dia 3 ou no dia seguinte. - Usando uma câmera de microscópio leve, tire fotos de cada poço usando uma lente objetiva 4x, garantindo que a mesma exposição, equilíbrio branco e configurações de luz sejam usadas consistentemente para todos os ensaios realizados.
- Posicione cada um bem de forma idêntica e certifique-se de que as bordas do poço não são visíveis nas fotos. Salve fotos em formato TIF ou similar.
NOTA: As configurações específicas variam entre microscópios, mas a quantitação será mais eficaz se a iluminação de fundo for alta e consistente em todos os poços (Figura 1B).
- Posicione cada um bem de forma idêntica e certifique-se de que as bordas do poço não são visíveis nas fotos. Salve fotos em formato TIF ou similar.
5. Quantitação para determinar a atividade neutralizante usando ImageJ
- Baixe e instale o software livremente disponível "ImageJ" (ver Tabela de Materiais).
- Abra a imagem a ser analisada no ImageJ selecionando Arquivo > Aberto (Figura 2).
- Se usar imagens coloridas, converta-se em escala de cinza selecionando > tipo de imagem > de 8 bits.
- Clique em Imagem > Ajuste > Limiar. Ajuste o limiar até que todas as áreas coloridas estejam coloridas em vermelho, mas o fundo não. Ao adicionar NBT/BCIP, o produto colorido será depositado na área ao redor das células expressas hPLAP.
NOTA: Recomenda-se usar a mesma configuração de limiar para todas as imagens capturadas na mesma placa. - Clique em Analisar > definir medidas e marque a Área, Limite ao Limite, Fração de Área e Exibir caixas de seleção e clique em Ok.
- Para determinar a leitura do sinal (porcentagem de coloração) de um determinado poço, clique em Analisar > Medida. A coluna '% Área' da janela pop-up exibe a leitura do sinal.
- Realize a quantitação para todas as réplicas da amostra. Exclua quaisquer poços contaminados, poços que mostrem distribuição celular desigual, ou poços variando em densidade celular ou iluminação.
NOTA: Consulte a Figura Suplementar 1 para exemplos de poços que devem ser considerados para exclusão. Normalmente, 3-4 poços podem exigir exclusão de uma placa de 96 poços. A Figura 2 fornece uma representação visual do processo de quantitação usando ImageJ.
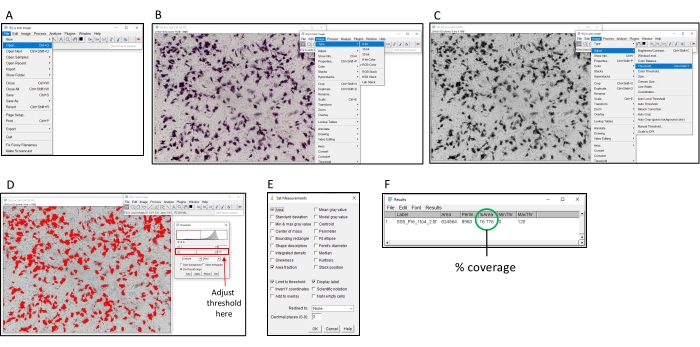
Figura 2: Etapas para determinar a coloração percentual usando o software ImageJ. (A) Abra a imagem a ser analisada com o software ImageJ. (B) Converta a imagem em escala de cinza de 8 bits. (C) Abra a janela do limiar. (D) Ajuste o limiar máximo para que todas as áreas coloridas sejam cobertas, mas a área de fundo não é (este limiar deve ser consistente em uma placa inteira). (E) Selecione o dropbox 'Analisar', clique em 'Definir medidas' e marque 'Área', 'Fração de área', 'Limite de limite' e 'Etiqueta de exibição' e clique em 'OK'. (F) Clique em 'Medir' para medir a área coberta. A área % indica a proporção da imagem colorida. Isso pode então ser usado com as amostras de controle para determinar o título TI50 . Clique aqui para ver uma versão maior desta figura.
6. Determinação do título de inibição da transdução (TI50)
- Determine a leitura média das réplicas (usando as etapas descritas na etapa 5) para o seguinte: (1) Controle somente de mídia (leitura de sinal de linha de base). (2) Vírus + controle somente de mídia (leitura máxima de sinal). (3) Vírus + amostras de soro de interesse.
- Calcule a porcentagem de inibição usando a seguinte fórmula:
100 - [(Leitura de sinal de amostra de teste (virus + amostra de soro de interesse) - leitura de sinal de linha de base (controle somente de mídia)) / (leitura máxima de sinal (somente mídia e vírus) - leitura de sinal de linha de base) x 100] = % inibição de transdução13. - Calcule a inibição de transdução de todas as réplicas de cada diluição para todas as amostras utilizando a fórmula em 6.2. Determine a inibição média da transdução entre as réplicas técnicas para cada diluição para todas as amostras e controles.
- Calcule o título de inibição de transdução de 50% (titulador TI50 ) de uma amostra de interesse determinando a menor diluição da amostra que produz 50% ou maior inibição de transdução da atividade hPLAP. por exemplo, se uma diluição de 1/8 de uma amostra tiver maior que 50% de inibição de transdução com base no cálculo realizado em 6,2 (e uma diluição de 1/4 não), informe o titulador TI50 como 1/8.
7. Determinação de partículas AAV neutralizadas
- Calcule o número de partículas AAV neutralizadas por μL de soro para uma determinada amostra, empregando a seguinte fórmula:
((CONTAGEM de células MOI x/bem) / (volume de soro / fator de diluição de titulação TI50 )) / 2 = partículas neutralizadas de AAV / μL de soro9.
NOTA: A divisão por 2 representa o TI50 medindo 50% das partículas neutralizadas. Para uma amostra que dá um tito50 de 1/4 (25% de soro, 75% diluente) no qual o ensaio utilizou 80 μL de soro não diluído e um MOI de 15k banhado em 1 x 104 células, seria utilizado o seguinte cálculo: (((15000 x 10000) / (80/4)) / 2 = 3,75x106 partículas neutralizadas / μL de soro.
Resultados
Ensaio de transdução para estabelecer a dose viral ideal para cobertura de placas
Células HT1080, uma linha celular fibrossarcoma bem estabelecida, foram selecionadas para este ensaio. Uma concentração de 1 x 104 células HT1080/bem fornecida ~50% de confluência celular em cada poço de uma placa de 96 poços. Para determinar a concentração viral ideal para o ensaio, um rAAV codificando um gene de repórter hPLAP (alcalina alcalina da placenta humana) (AAV6-hPLAP)3...
Discussão
Este relatório descreve um ensaio colorimétrico que avalia a extensão da neutralização da AAV em uma determinada amostra de soro, avaliando uma reação cromogênica correspondente ao grau de transdução viral in vitro. O desenvolvimento do protocolo foi baseado na reação cromogênica conhecida entre a enzima fosfatista e nbt/BCIP, que tem sido amplamente utilizada como ferramenta de coloração para a detecção de alvos proteicos em aplicações como a imunohistoquímica e como ferramenta repórter par...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este estudo foi financiado por um Projeto do Conselho Nacional de Saúde e Pesquisa Médica para a JRM e CJT (ID 1163732) e, em parte, pelo Programa de Apoio à Infraestrutura Operacional do Governo Vitoriano. A SB é apoiada por uma bolsa conjunta de doutorado do Baker Heart and Diabetes Institute-La Trobe University. A KLW é apoiada pela The Shine On Foundation e uma Future Leader Fellowship da National Heart Foundation of Australia (ID 102539). A JRM é apoiada por uma Bolsa Sênior de Pesquisa do Conselho Nacional de Saúde e Pesquisa Médica (ID 1078985).
Materiais
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin/EDTA | Gibco | 25300-054 | |
| 50 mL conical centrifuge tube | Falcon | 14-432-22 | Or equivalent |
| 75 cm2 square flasks | Falcon | 353136 | Or equivalent |
| 96 well flat bottomed plate | Falcon | 353072 | |
| AAV6-CMV-hPLAP Vector | Muscle Research & Therapeutics Lab (University of Melbourne, Australia) AAV6-CMV-hPLAP can be provided upon request. | ||
| Aluminium foil | |||
| Anti-AAV6 (intact particle) mouse monoclonal antibody, (ADK6) | PROGEN | 610159 | Positive control monoclonal antibody |
| BCIP/NBT | SIGMAFAST | B5655 | |
| Cell and tissue culture safety cabinet | |||
| Electronic Pipette | 5 & 10 mL stripette inserts | ||
| Fetal Bovine Serum | Gibco | 10099-141 | |
| Haemocytometer | |||
| High glucose Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 11965118 | |
| HT1080 cells | ATCC | ||
| ImageJ Software | Freely available: https://imagej.nih.gov/ij/download.html | ||
| Incubator | 37 °C, 5% CO2 | ||
| Light microscope with camera | Capable of taking photos with a 4x objective lens | ||
| Oven | For a 65 °C incubation | ||
| Paraformaldehyde | MERCK | 30525-89-4 | |
| Penicillin Streptomycin | Gibco | 15140-122 | |
| Phosphate buffered saline | |||
| Pipettes and tips | 20 μL, 200 μL & 1 mL single pipettes and tips & 200 μL multichannel pipette | ||
| Stericup quick release filter | Millipore | S2GPU10RE | Used for combining media reagents |
| Trypan blue solution | Sigma-Aldrich | T8154 | |
| VACUETTE TUBE 8 ml CAT Serum Separator Clot Activator | Greiner BIO-ONE | 455071 | Used for serum collection & processing from sheep |
| Water bath |
Referências
- Bass-Stringer, S., et al. Adeno-associated virus gene therapy: Translational progress and future prospects in the treatment of heart failure. Heart, Lung and Circulation. 27 (11), 1285-1300 (2018).
- Casey, G. A., Papp, K. M., MacDonald, I. M. Ocular gene therapy with adeno-associated virus vectors: current outlook for patients and researchers. Journal of Ophthalmic and Vision Research. 15 (3), 396-399 (2020).
- Lykken, E. A., Shyng, C., Edwards, R. J., Rozenberg, A., Gray, S. J. Recent progress and considerations for AAV gene therapies targeting the central nervous system. Journal of Neurodevelopmental Disorders. 10 (1), 16 (2018).
- Guggino, W. B., Cebotaru, L. Adeno-Associated Virus (AAV) gene therapy for cystic fibrosis: Current barriers and recent developments. Expert Opinion on Biological Therapy. 17 (10), 1265-1273 (2017).
- Perrin, G. Q., Herzog, R. W., Markusic, D. M. Update on clinical gene therapy for hemophilia. Blood. 133 (5), 407-414 (2019).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nature Reviews Drug Discovery. 18 (5), 358-378 (2019).
- Kuzmin, D. A., et al. The clinical landscape for AAV gene therapies. Nature Reviews Drug Discovery. 20 (3), 173-174 (2021).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: A randomised, controlled, open-label, phase 3 trial. Lancet. 390 (10097), 849-860 (2017).
- Weber, T. Anti-AAV Antibodies in AAV gene therapy: Current challenges and possible solutions. Frontiers in Immunology. 12, 658399 (2021).
- Weeks, K. L., et al. Phosphoinositide 3-kinase p110alpha is a master regulator of exercise-induced cardioprotection and PI3K gene therapy rescues cardiac dysfunction. Circulation: Heart Failure. 5 (4), 523-534 (2012).
- Gregorevic, P., et al. Systemic delivery of genes to striated muscles using adeno-associated viral vectors. Nature Medicine. 10 (8), 828-834 (2004).
- Bernardo, B. C., et al. Gene delivery of medium chain acyl-coenzyme A dehydrogenase induces physiological cardiac hypertrophy and protects against pathological remodelling. Clinical Science (London). 132 (3), 381-397 (2018).
- Meliani, A., et al. Determination of anti-adeno-associated virus vector neutralizing antibody titer with an in vitro reporter system. Human Gene Therapy Methods. 26 (2), 45-53 (2015).
- Falese, L., et al. Strategy to detect pre-existing immunity to AAV gene therapy. Gene Therapy. 24 (12), 768-778 (2017).
- Wang, D., et al. Adeno-Associated virus neutralizing antibodies in large animals and their impact on brain intraparenchymal gene transfer. Molecular Therapy - Methods & Clinical Development. 11, 65-72 (2018).
- Wang, M., et al. Prediction of adeno-associated virus neutralizing antibody activity for clinical application. Gene Therapy. 22 (12), 984-992 (2015).
- Kruzik, A., et al. Detection of biologically relevant low-titer neutralizing antibodies against adeno-associated virus require sensitive in vitro assays. Human Gene Therapy Methods. 30 (2), 35-43 (2019).
- Lehtoranta, L., Villberg, A., Santanen, R., Ziegler, T. A novel, colorimetric neutralization assay for measuring antibodies to influenza viruses. Journal of Virological Methods. 159 (2), 271-276 (2009).
- Johnston, P. B., Grayston, J. T., Loosli, C. G. Adenovirus neutralizing antibody determination by colorimetric assay. Proceedings of the Society for Experimental Biology and Medicine. 94 (2), 338-343 (1957).
- Xiaoli Zhu, T. G. . Nano-Inspired Biosensors for Protein Assay with Clinical Applications. , 237-264 (2019).
- Jungmann, A., Muller, O., Rapti, K. Cell-based measurement of neutralizing antibodies against adeno-associated virus (AAV). Methods in Molecular Biology. 1521, 109-126 (2017).
- Samineni, S., et al. Optimization, comparison, and application of colorimetric vs. chemiluminescence based indirect sandwich ELISA for measurement of human IL-23. Journal of Immunoassay and Immunochemistry. 27 (2), 183-193 (2006).
- Siddiqui, J., Remick, D. G. Improved sensitivity of colorimetric compared to chemiluminescence ELISAs for cytokine assays. Journal of Immunoassay and Immunochemistry. 24 (3), 273-283 (2003).
- Arnett, A. L., Garikipati, D., Wang, Z., Tapscott, S., Chamberlain, J. S. Immune responses to rAAV6: The Influence of canine parvovirus vaccination and neonatal administration of viral vector. Frontiers in Microbiology. 2, 220 (2011).
- Australian code for the care and use of animals for scientific purposes. National Health and Medical Research Council Available from: https://www.nhmrc.gov.au/about-us/publications/australian-code-care-and-use-animals-scientific-purposes (2013)
- Coecke, S., et al. Guidance on good cell culture practice. A report of the second ECVAM task force on good cell culture practice. Alternatives to Laboratory Animals. 33 (3), 261-287 (2005).
- Journal of Visualized Experiments. General Laboratory Techniques. Journal of Visualized Experiments Database. , (2018).
- AAV-HT1080 Cells. Stratagene Available from: https://www.chem-agilent.com/pdf/strata/240109.pdf (2003)
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111 (3), 1-3 (2015).
- Bieber, S., et al. Extracorporeal delivery of rAAV with metabolic exchange and oxygenation. Scientific Reports. 3, 1538 (2013).
- Winbanks, C. E., Beyer, C., Qian, H., Gregorevic, P. Transduction of skeletal muscles with common reporter genes can promote muscle fiber degeneration and inflammation. PLoS One. 7 (12), 51627 (2012).
- Thomas, C. J., et al. Evidence that the MEK/ERK but not the PI3K/Akt pathway is required for protection from myocardial ischemia-reperfusion injury by 3',4'-dihydroxyflavonol. European Journal of Pharmacology. 758, 53-59 (2015).
- Barger, A., et al. Use of alkaline phosphatase staining to differentiate canine osteosarcoma from other vimentin-positive tumors. Veterinary Pathology. 42 (2), 161-165 (2005).
- Gregorevic, P., et al. Evaluation of vascular delivery methodologies to enhance rAAV6-mediated gene transfer to canine striated musculature. Molecular Therapy. 17 (8), 1427-1433 (2009).
- Sharma, A., Ghosh, A., Hansen, E. T., Newman, J. M., Mohan, R. R. Transduction efficiency of AAV 2/6, 2/8 and 2/9 vectors for delivering genes in human corneal fibroblasts. Brain Research Bulletin. 81 (2-3), 273-278 (2010).
- Smejkal, G. B., Kaul, C. A. Stability of nitroblue tetrazolium-based alkaline phosphatase substrates. Journal of Histochemistry & Cytochemistry. 49 (9), 1189-1190 (2001).
- Falese, L., et al. Strategy to detect pre-existing immunity to AAV gene therapy. Gene Therapy. 24 (12), 768-778 (2017).
- Orlowski, A., et al. Successful transduction with AAV Vectors after selective depletion of anti-aav antibodies by immunoadsorption. Molecular Therapy - Methods & Clinical Development. 16, 192-203 (2020).
- Goossens, K., et al. Differential microRNA expression analysis in blastocysts by whole mount in situ hybridization and reverse transcription quantitative polymerase chain reaction on laser capture microdissection samples. Analytical Biochemistry. 423 (1), 93-101 (2012).
- Entrican, G., Wattegedera, S. R., Griffiths, D. J. Exploiting ovine immunology to improve the relevance of biomedical models. Molecular Immunology. 66 (1), 68-77 (2015).
- Walters, E. M., Prather, R. S. Advancing swine models for human health and diseases. Molecular Medicine. 110 (3), 212-215 (2013).
- Rapti, K., et al. Neutralizing antibodies against AAV serotypes 1, 2, 6, and 9 in sera of commonly used animal models. Molecular Therapy. 20 (1), 73-83 (2012).
- Tellez, J., et al. Characterization of naturally-occurring humoral immunity to AAV in sheep. PLoS One. 8 (9), 75142 (2013).
- Gupta, S., et al. Recommendations for the validation of cell-based assays used for the detection of neutralizing antibody immune responses elicited against biological therapeutics. Journal of Pharmaceutical and Biomedical Analysis. 55 (5), 878-888 (2011).
- Gupta, S., et al. Recommendations for the design, optimization, and qualification of cell-based assays used for the detection of neutralizing antibody responses elicited to biological therapeutics. Journal of Immunological Methods. 321 (1-2), 1-18 (2007).
- Shankar, G., et al. Recommendations for the validation of immunoassays used for detection of host antibodies against biotechnology products. Journal of Pharmaceutical and Biomedical Analysis. 48 (5), 1267-1281 (2008).
- U.S. Department of Health and Human Services Food and Drug Administration. Center for Drug Evaluation and Research (CDER). Immunogenicity Testing of Therapeutic Protein Products — Developing and Validating Assays for Anti-Drug Antibody Detection. U.S. Department of Health and Human Services Food and Drug Administration. , (2019).
- Baatartsogt, N., et al. A sensitive and reproducible cell-based assay via secNanoLuc to detect neutralizing antibody against adeno-associated virus vector capsid. Molecular Therapy - Methods & Clinical Development. 22, 162-171 (2021).
- Watano, R., Ohmori, T., Hishikawa, S., Sakata, A., Mizukami, H. Utility of micro mini pigs for evaluating liver-mediated gene expression in the presence of neutralizing antibody against vector capsid. Gene Therapy. 27 (9), 427-434 (2020).
- Majowicz, A., et al. Therapeutic hFIX activity achieved after single AAV5-hFIX treatment in Hemophilia B patients and NHPs with pre-existing anti-AAV5 NABs. Molecular Therapy - Methods & Clinical Development. 14, 27-36 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados