È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Trapianto intra-peritoneale per la generazione di leucemia mieloide acuta nei topi
In questo articolo
Riepilogo
Qui, l'iniezione intra-peritoneale delle cellule leucemiche viene utilizzata per stabilire e propagare la leucemia mieloide acuta (LMA) nei topi. Questo nuovo metodo è efficace nel trapianto seriale di cellule LMA e può servire come alternativa per coloro che possono sperimentare difficoltà e incongruenze con l'iniezione endovenosa nei topi.
Abstract
C'è un bisogno insoddisfatto di nuove terapie per trattare la leucemia mieloide acuta (LMA) e la ricaduta associata che coinvolge le cellule staminali persistenti della leucemia (LSC). Un modello sperimentale di roditore AML per testare terapie basate sul trapianto di successo di queste cellule tramite iniezioni retro-orbitali nei topi riceventi è irto di sfide. Lo scopo di questo studio era quello di sviluppare un metodo semplice, affidabile e coerente per generare un robusto modello murino di LMA utilizzando una via intra-peritoneale. Nel presente protocollo, le cellule del midollo osseo sono state trasdotte con un retrovirus che esprime oncoproteina di fusione umana MLL-AF9. È stata testata l'efficienza delle popolazioni di lignaggio negativo (Lin-) e Lin-Sca-1+c-Kit+ (LSK) come LSC donatrici nello sviluppo della LMA primaria ed è stata adottata l'iniezione intraperitoneale come nuovo metodo per generare LMA. Il confronto tra iniezioni intra-peritoneali e retro-orbitali è stato fatto in trapianti seriali per confrontare e contrastare i due metodi. Entrambe le cellule Lin e LSK trasdotte con il virus umano MLL-AF9 si sono innestate bene nel midollo osseo e nella milza dei riceventi, portando a una LMA conclamata. L'iniezione intra-peritoneale di cellule donatrici ha stabilito la LMA nei riceventi dopo il trapianto seriale e l'infiltrazione delle cellule AML è stata rilevata nel sangue, nel midollo osseo, nella milza e nel fegato dei riceventi mediante citometria a flusso, qPCR e analisi istologiche. Pertanto, l'iniezione intraperitoneale è un metodo efficiente di induzione della LMA utilizzando il trapianto seriale di cellule leucemiche del donatore.
Introduzione
La leucemia mieloide acuta (LMA) è un tipo di tumore ematologico di diversa eziologia con prognosi infausta1. La generazione di modelli animali AML pone le basi per la comprensione delle sue complesse variazioni e patobiologia nel tentativo di scoprire nuove terapie2. La leucemogenesi nei topi comporta il trapianto di cellule donatrici che esprimono oncoproteine di fusione, comprese le fusioni che coinvolgono il gene della leucemia a linea mista (MLL) per indurre potentemente la LMA, per imitare la malattia nell'uomo3. Varie origini cellulari di cellule donatrici sono state riportate nel trapianto di AML4 associata al gene MLL, con pochissime conoscenze sulle cellule responsabili dell'origine della malattia.
Sono state sviluppate molteplici vie per il trapianto nei topi; piuttosto che un'iniezione intra-femorale, che introduce direttamente cellule donatrici mutanti nel midollo osseo5, un'iniezione endovenosa che utilizza il plesso del seno venoso, la vena caudale e la vena giugulare è stata ampiamente utilizzata per generare modelli murini di LMA 6,7,8,9. Nel caso dell'iniezione retroorbitale (r.o.), vari svantaggi intrinseci, come la limitazione del volume, l'elevata richiesta tecnica, le poche possibilità di ripetuti tentativi o errori e potenziali lesioni oculari, sono stati importanti ostacoli con alternative limitate o non praticabili7. L'iniezione della vena caudale può avere problemi simili oltre alle lesioni locali; Per facilitare la procedura, i topi spesso devono essere riscaldati per dilatare le vene della coda10. È anche difficile individuare la vena caudale senza una fonte di luce aggiuntiva, in particolare nel ceppo C57BL / 6 dei topi. Per l'iniezione della vena giugulare, il personale di ricerca richiede una formazione sufficiente per localizzare la vena e limitare le possibili complicanze. Inoltre, sia le iniezioni di seno venoso che di vena giugulare devono essere eseguite in anestesia, il che aggiunge un altro livello di complessità. Pertanto, si è tentati di esplorare nuove vie per il trapianto per facilitare la creazione di modelli murini AML.
L'iniezione intraperitoneale (i.p.) è comunemente usata per somministrare farmaci, coloranti e anestetici 11,12,13,14,15; È stato anche usato per introdurre cellule ematopoietiche per l'ematopoiesi ectopica16 e per trapiantare cellule staminali mesenchimali derivate dal midollo osseo in vari modelli murini 17,18,19,20,21. Tuttavia, è stato usato raramente per stabilire neoplasie ematopoietiche nei topi, in particolare per studiare la progressione della malattia AML.
Il presente studio descrive la fattibilità dell'iniezione di i.p. nella generazione di modelli murini AML, oltre a confrontare l'efficienza del trapianto di popolazioni di lignaggio negativo (Lin-) e Lin-Sca-1 + c-Kit + (LSK) come cellule donatrici. Questi risultati forniscono un modo semplice ed efficiente per generare modelli sperimentali di LMA e leucemie mieloidi correlate. Tale metodo ha il potenziale per migliorare la nostra comprensione dei meccanismi della malattia e fornire un modello relativamente facile per testare terapie sperimentali.
Protocollo
Tutti gli esperimenti sono stati preapprovati dall'Institutional Animal Care and Use Committee presso la Pennsylvania State University.
1. Preparazione di tamponi e reagenti
- Preparare piastre di agar LB con ampicillina integrata (AP) (piastre sterili da 10 cm). Per fare questo, sciogliere 10 g di brodo LB con agar in 400 ml di acqua distillata, mescolare e portare il volume fino a 500 ml. Sterilizzare la soluzione in autoclave, quindi lasciare raffreddare la soluzione, aggiungere 0,5 ml di ampicillina (stock: 150 mg / ml) nella soluzione e agitare per mescolare. Aggiungere immediatamente 18 mL di soluzione in una piastra sterile da 10 cm vicino a una lampada ad alcool, lasciare solidificare a temperatura ambiente e conservare le piastre capovolte a 4 °C fino a un ulteriore utilizzo.
- Preparare i mezzi LB sciogliendo 10 g di LB senza agar in 500 mL di acqua distillata. Sterilizzare la soluzione mediante autoclave, lasciare raffreddare la soluzione, aggiungere 0,5 ml di ampicillina (stock: 150 mg/ml) nella soluzione e agitare per mescolare.
- Preparare il tampone di flusso aggiungendo 5 ml di penicillina/streptomicina e 10 ml di siero bovino fetale inattivato dal calore (hiFBS) in 485 ml di 1x soluzione salina tamponata fosfato di Dulbecco (DPBS).
NOTA: Per inattivare l'FBS mediante riscaldamento, posizionare le bottiglie FBS scongelate a bagnomaria a 56 °C. Assicurarsi che le bottiglie non si ribaltino o non vengano altrimenti sommerse nel bagnomaria. La temperatura è fondamentale per il completo degrado; per garantire ciò, attendere che la temperatura si stabilizzi a 56 °C dopo aver messo le bottiglie a bagnomaria. Ruotare delicatamente le bottiglie ogni 10 minuti tre volte. Non lasciare che il siero incubi per più di 30 minuti. - Preparare i mezzi di manutenzione aggiungendo 50 ml di hiFBS, 5 mL di L-glutammina e 5 ml di penicillina/streptomicina in 440 ml di terreno di aquila modificato (DMEM) di Dulbecco. Preparare i mezzi di trasfezione aggiungendo 50 ml di hiFBS e 5 ml di L-glutammina in 445 ml di supporti DMEM.
- Preparare il tampone di lisi dei globuli rossi (RBC) aggiungendo 4,145 g di NH4Cl, 0,504 g di NaHCO3 e 16,81 mg di acido etilendiamminotetraacetico (EDTA) in 500 ml di acqua distillata. Preparare il mezzo di Dulbecco modificato (IMDM) di Iscove aggiungendo 75 ml di hiFBS, 5 g di albumina sierica bovina (BSA), 0,5 ml di 10 mg/ml di insulina, 2,5 ml di olotransferrina da 4 mg/ml, 3,5 μL di β-mercaptoetanolo, 5 ml di L-glutammina e 0,5 ml di ciprofloxacina in 416,5 mL di media IMDM.
- Preparare 10 ml di 2x mezzi IMDM, in cui la concentrazione di citochine è il doppio della quantità in 1x IMDM media, aggiungendo 10 μL di 50 ng/μL mr-SCF, 20 μL di 25 ng/μL mr-Flt3L, 20 μL di 10 ng/μL mr-IL-6, 20 μL di 10 ng/μL mr-IL-3, 10 μL di 10 mg/mL di insulina, e 50 μL di olotransferrina da 4 mg/mL in 9,87 mL di mezzi IMDM incompleti.
NOTA: assicurarsi che il buffer di flusso, il tampone di lisi dei globuli rossi, i mezzi di manutenzione, i mezzi di trasfezione e i supporti IMDM incompleti siano sterilizzati con filtro prima dell'uso.
2. Trasformazione plasmidica
- Scongelare 20 μL di cellule competenti α-Select su ghiaccio. Aggiungere 1 μL (~2 ng) di MSCV-MLL-AF9-EF1α-luc2-P2A-EGFP-LC3 plasmide22 alle cellule competenti scongelate e mescolare delicatamente picchiettando il tubo. Incubare la reazione sul ghiaccio per 30 minuti.
- Shock termico della miscela mediante incubazione per 40 s in un blocco riscaldante a 42 °C. Trasferire immediatamente il tubo sul ghiaccio per 2 minuti.
- Aggiungere 1 mL di fluido LB (senza ampicillina) al tubo e agitare a 37 °C e 200 giri/min per 1 ora.
- Centrifugare il tubo a temperatura ambiente a 500 x g per 4 minuti ed eliminare 0,9 mL di surnatante. Risospendere il precipitato nei restanti 0,1 mL di fluido LB.
- Distribuire le cellule competenti trasformate su piastre di agar AP LB preriscaldate (37 °C). Incubare la piastra capovolta a 37 °C per 12-16 ore.
- Scegli una singola colonia e spendi le cellule trasformate in 10 ml di materiale AP LB durante la notte a 37 °C e 200 giri/min.
- Aggiungere 5 mL di cellule competenti trasformate esaurite a 500 mL di materiale AP LB in un matraccio e incubare il matraccio per una notte a 37 °C e 200 giri/min.
- Estrarre il plasmide utilizzando un kit di estrazione plasmidica secondo le istruzioni del produttore e risospendere in 0,5 ml di acqua ultrapura autoclavata. Quantificare il plasmide utilizzando uno spettrofotometro.
3. Trasfezione di cellule ecotrope di Phoenix (pECO)
- Coltura 2 x 106 pECO celle/piastra in mezzi di manutenzione in piastre da 10 cm in un incubatore umidificato al 5% di CO2 a 37 °C. Assicurarsi che le cellule pECO siano mantenute in fase di crescita esponenziale e si dividano attivamente prima del passaggio.
- Quando le cellule diventano confluenti all'80%, lavare le piastre con 5 ml di DPBS due volte, aggiungere 1 ml di tripsina alla piastra e incubare in un incubatore umidificato al 5% di CO 2 a 37 °C per2 minuti. Raccogliere le cellule con 5 mL di terreno di mantenimento in una provetta sterile da 15 mL e centrifugare a 4 °C e 400 x g per 3 minuti. Risospendere il pellet cellulare in 5 ml di mezzi di mantenimento.
- Mescolare 10 μL di sospensione cellulare e 10 μL di blu tripano e caricare 10 μL su un emocitometro per contare le cellule.
Totale celle/mL = (Totale celle contate x Fattore di diluizione x 104 celle/ml)/Numero di quadrati contati)
Seminare 2 x 10 6 cellule/piatto in piatti da6 cm utilizzando 5 ml di terreno di mantenimento per la trasfezione e la coltura delle cellule in un incubatore umidificato al 5% di CO2 a 37 °C. - Sostituire i mezzi di mantenimento con 5 ml di terreno di trasfezione quando le cellule diventano confluenti al 50%-60% dopo 18 ore di coltura.
- Mantenere il reagente di trasfezione a temperatura ambiente per almeno 30 minuti prima della trasfezione.
- Aggiungere 5,5 μg di MSCV-MLL-AF9-EF1α-luc2-P2A-EGFP-LC3 plasmide22 a 0,5 mL di media DMEM semplice in un tubo sterile da 1,5 ml. Mescolare delicatamente picchiettando il tubo e lasciarlo riposare per 10 minuti.
- Aggiungere 14,6 μL (3 volte la quantità di plasmide; v / p) di reagente di trasfezione al tubo e picchiettare delicatamente il tubo ogni 10 minuti tre volte.
- Aggiungere uniformemente la miscela a goccia su tutte le aree dei piatti con le cellule pECO in mezzi di trasfezione. Spostare delicatamente i piatti avanti e indietro 10 volte e lateralmente 10 volte. Incubare le stoviglie in un incubatore umidificato al 5% di CO2 a 37 °C per 48 ore.
- Misurare l'efficienza di trasfezione mediante microscopia a fioritura e citometria a flusso per la proteina fluorescente verde (GFP) come descritto in22. Le cellule vengono prima controllate su FSC-A/FSC-H e FSC-A e SSC-A per acquisire singoletti. La popolazione GFP+ è controllata sul grafico FL1 confrontandolo con cellule non trasfettate.
- Raccogliere e filtrare i surnatanti attraverso un filtro a siringa da 0,45 μm in un tubo sterile da 50 ml. Utilizzare immediatamente i surnatanti per la trasduzione o congelarli in azoto liquido e conservarli a -80 °C fino a nuovo utilizzo.
NOTA: le cellule pECO devono essere opportunamente miscelate e seminate in piatti in modo uniforme. Lasciare che le cellule si diffondano spostando i piatti avanti e indietro 10 volte e lateralmente 10 volte durante la semina. Il numero di cellule da seminare può variare a seconda delle variazioni nel conteggio. Per trovare il numero ottimale di cellule di semina che può raggiungere il 50% -60% di confluenza dopo 18 ore di coltura, è utile seminare cellule con diluizioni seriali.
4. Trasduzione lentivirale
- Eutanasia di topi femmina CD45.1 di 8-10 settimane C57BL6/J (da due a tre topi donatori per topo ricevente) in una camera di CO2 .
- Sterilizzare tutto il corpo dei topi con etanolo al 70%. Posizionare i topi su un tampone chirurgico sterile su una tavola di polistirolo e fissare le gambe attraverso i cuscinetti delle zampe del mouse.
- Tagliare la pelle sopra la cavità addominale sulla linea mediana e allargare lo spazio sottocutaneo verso le zampe posteriori con forbici sterili affilate.
- Estendere l'incisione dalla linea mediana addominale fino alle caviglie. Allargare lo spazio sottocutaneo sotto le zampe posteriori con le lame di forbici sterili affilate.
- Tagliare il tendine di Achille con forbici sterili affilate. Tenere il tendine usando una pinza con i denti e tagliare l'altra estremità attaccata al femore per rimuovere il muscolo gastrocnemio.
- Tagliare il tendine del quadricipite attaccato al ginocchio con forbici sterili affilate. Tenere il tendine usando una pinza con i denti e tagliare le teste muscolari attaccate al femore per rimuovere il muscolo gastrocnemio.
- Tagliare gli altri muscoli che circondano il femore all'estremità attaccati alla tibia con forbici sterili affilate.
- Tagliare la caviglia con forbici sterili affilate, assicurandosi che la tibia rimanga intatta. Tenere l'estremità distale del femore usando una pinza con i denti e tagliare l'articolazione dell'anca con forbici sterili affilate, assicurandosi che la testa del femore rimanga intatta.
- Trasferire le tibie e i femori in un tampone di flusso in un tubo sterile da 15 ml.
- Separare la tibia e il femore rompendo il ginocchio a mano. Rimuovere la rotula, la cartilagine e i condili femorali per esporre il plateau tibiale e il femore distale a mano. Rimuovere i muscoli con una garza sterile e quindi immergere le ossa nel tampone di flusso.
- Tagliare il collo del femore e lavare le cellule del midollo osseo con tampone di flusso da entrambe le estremità del femore usando una siringa da 10 ml con un ago da 23 G.
- Tagliare il malleolo tibiale e lavare le cellule del midollo osseo con tampone di flusso da entrambe le estremità della tibia usando una siringa da 10 ml con un ago da 23 G.
- Disperdere le cellule pipettando su e giù usando una siringa da 10 mL con un ago da 18 G. Centrifugare la sospensione monocellulare a 4 °C e 400 x g per 3 minuti.
- Scartare il surnatante e risospendere le cellule in 5 ml di tampone di lisi dei globuli rossi per lisare i globuli rossi per 3 minuti.
- Aggiungere 5 mL di tampone di flusso per arrestare la lisi e centrifugare la sospensione cellulare a 4 °C e 400 x g per 3 minuti.
- Posizionare un filtro cellulare da 70 μm su un tubo sterile da 50 ml. Sospendere il pellet con 5 ml di tampone di flusso, mescolare e passare attraverso il filtro cellulare per raccogliere le cellule.
- Regolare la concentrazione della cella con tampone di flusso a 1 x 108/mL in tubi di polipropilene a fondo tondo.
- Selezionare le cellule di Lin- utilizzando un kit di isolamento delle cellule ematopoietiche del topo secondo le istruzioni del produttore.
- Tenere da parte tre provette da 1 x 104 cellule in 100 μL di tampone per un controllo non colorato e due controlli singoli colorati con anticorpi per CD117 (c-Kit) antitopo coniugato con APC e Ly-6A/E antitopo coniugato PE-Cy7 (Sca-1). Utilizzare 1 μL di anticorpo (da 0,2 mg/mL di stock) per ciascuno dei singoli controlli colorati con anticorpi.
- Colorare il resto delle cellule in una provetta con entrambi gli anticorpi (4 μL di ciascuno da 0,2 mg/mL di stock) in 400 μL. Incubare i tubi sul ghiaccio al buio per 0,5-1 ora.
- Dopo la colorazione, lavare le celle aggiungendo 1 mL di tampone di flusso e centrifugare a 4 °C e 400 x g per 3 minuti.
- Risospendere le cellule per il controllo non colorato e i controlli singoli colorati con anticorpi in 100 μL di tampone di flusso. Risospendere le cellule colorate con doppio anticorpo in 1 mL di tampone di flusso per la selezione.
- Ordinare le cellule staminali ematopoietiche (HSC) come una popolazione LSK utilizzando un selezionatore cellulare come descritto in23,24.
- Durante la colorazione, rivestire un piatto sterile da 6 cm con retronectina come segue: Preparare 100 μg/mL di scorte di retronectina in PBS e aggiungere 0,9 mL di PBS e 0,1 mL di retronectina a un piatto da 6 cm. Rivestire il piatto in un cappuccio sterile a temperatura ambiente per 2 ore. Quindi, rimuovere la retronectina e bloccare il piatto con 0,5 ml di BSA filtrato al 2% (in PBS) per 30 minuti. Lavare il piatto con 5 ml di PBS due volte e il piatto è pronto per la trasduzione.
- Centrifugare le HSC selezionate o le cellule di Lin- non selezionate a 4 °C e 400 x g per 3 minuti e risospendere in 3 mL di 2x (di citochine) mezzi IMDM e 3 mL di surnatante virale (generato dal punto 3.10) in un piatto rivestito di retronectina. Incubare il piatto in un incubatore umidificato al 5% di CO2 a 37 °C per 6 o 24 ore.
NOTA: Nel presente studio, le cellule di Lin- sono state ordinate o non ordinate a seconda del disegno sperimentale.
5. Trapianto seriale (Figura 1)
NOTA: I topi riceventi primari erano topi maschi C57BL6/J di 8-10 settimane (CD45.2). Sono stati forniti acqua ad libitum contenente antibiotici per prevenire infezioni digestive opportunistiche, da 3 giorni prima del trapianto a 7 giorni dopo il trapianto. I topi riceventi primari sono stati irradiati sub-letalmente (4,75 Gy) 3 ore prima del trapianto25. L'isoflurano non è stato applicato ai topi con iniezione intraperitoneale.
- Dopo la trasduzione per 6 o 24 ore, raccogliere le cellule mediante centrifugazione a temperatura ambiente e 400 x g per 3 minuti. Utilizzare la tripsina per raccogliere le cellule attaccate al fondo del piatto, se necessario. Scartare il surnatante e risospendere le cellule nel PBS preriscaldato. Determinare il volume di PBS in base al numero di destinatari (cioè 0,1 mL/topo e 0,5 ml/topo per i riceventi con iniezioni retro-orbitali e intra-peritoneali, rispettivamente).
- Collocare i topi riceventi irradiati sub-letalmente in una camera di isoflurano (la portata di ossigeno è impostata su 1,0 L/min e il vaporizzatore di isoflurano è impostato su 5%). Applicare unguento bagnato sugli occhi per prevenire la secchezza durante l'anestesia. I topi sono pronti per ulteriori procedure quando il battito cardiaco scende a 60 battiti al minuto.
- Iniettare cellule in topi riceventi primari retroorbitalmente (0,1 mL/topo)7 o intraperitonealmente (0,5 mL/topo)26 con un ago da 27 G1/2. Osservare i topi continuamente fino a quando non acquisiscono sufficiente coscienza per mantenere la recumbentenza sternale. Monitorare quotidianamente i topi per il loro benessere dopo il trapianto.
- Dopo 1 mese, raccogliere il sangue settimanalmente mediante sanguinamento retroorbitale per monitorare la leucocitosi valutando l'emocromo completo (CBC) su un havet come descritto di seguito.
- Posizionare il mouse lateralmente dopo l'anestesia con isoflurano (la portata di ossigeno è impostata su 1,0 L/min e il vaporizzatore di isoflurance è impostato su 5%). I topi sono pronti per ulteriori procedure quando il battito cardiaco scende a 60 battiti al minuto.
- Proptose l'occhio con il pollice e l'indice. Penetrare nel plesso del seno venoso con tubo capillare hemacrit asterile attraverso il canto interno.
- Raccogliere 20-25 μL di sangue in un tubo di raccolta del sangue EDTA e chiudere le palpebre per fermare l'emorragia. Applicare una goccia di soluzione oftalmica di gentamicina solfato sull'occhio.
- Alla fine, quando i globuli bianchi (WBC) raggiungono 4 x 10 4 cellule / μL, eutanasia del topo in una camera CO2 e isolare le cellule del midollo osseo lavando i femori e le tibie con tampone di flusso, seguito dalla lisi dei globuli rossi come menzionato nella fase4.
- Alla fine, raccogliere gli splenociti come indicato di seguito.
- Eutanasia del topo in una camera CO2 . Posizionare i topi su un tampone chirurgico sterile su una tavola di polistirolo e fissare le gambe attraverso i cuscinetti delle zampe del mouse. Sterilizzare tutto il corpo dei topi con etanolo al 70%.
- Tagliare la pelle e il muscolo sulla linea mediana per esporre la cavità addominale con forbici sterili affilate. Isolare la milza con forbici sterili affilate e metterla in un tampone di flusso in un tubo sterile da 15 ml.
- Mescolare la milza attraverso un colino sterile da 70 μm in un piatto da 6 cm con 3 ml di tampone di flusso. Trasferire le cellule dal piatto in una provetta sterile da 15 ml e centrifugare la sospensione monocellulare a 4 °C e 400 x g per 3 minuti.
- Scartare il surnatante e risospendere le cellule in 5 ml di tampone di lisi dei globuli rossi per lisare i globuli rossi per 3 minuti. Aggiungere 5 mL di tampone di flusso per arrestare la lisi e centrifugare la sospensione cellulare a 4 °C e 400 x g per 3 minuti.
- Posizionare un filtro cellulare da 70 μm su un tubo sterile da 50 ml. Sospendere il pellet con 5 ml di tampone di flusso, mescolare e passare attraverso il filtro cellulare per raccogliere le cellule.
- Identificare le cellule AML primarie (1°) colorando gli splenociti e le cellule del midollo osseo con l'anticorpo CD45.1 coniugato con FITC e rilevando su un citometro a flusso. Le cellule vengono prima controllate su FSC-A/FSC-H e FSC-A e SSC-A per acquisire singoletti. La popolazione CD45.1+ è controllata sul grafico FL1 confrontandolo con cellule non colorate.
- Per il trapianto secondario (2°), risospendere le cellule spleniche LMA CD45.1 da riceventi di 1° r.o. in PBS (0,1 mL/topo) e iniettarle retroorbitalmente in topi maschi CD45.2 C57BL6/J. Parallelamente, risospendere le cellule spleniche AML da 1° i.p. riceventi in PBS (0,5 mL/topo) e iniettarle intraperitonealmente in topi maschi di 8-12 settimane di proteina di fluorescenza rossa (RFP) che esprimono Ai14TdTomato 27.
- Per il trapianto terziario (3°), risospendere le cellule LMA isolate dal midollo osseo o dalla cavità peritoneale di 2° i.p. riceventi e iniettarle intraperitonealmente rispettivamente in topi Ai14TdTomato (RFP+) o CD45.2. Risospendere le cellule AML isolate dalla cavità peritoneale dei riceventi di 2° r.o. e trapiantarle mediante iniezione di r.o. in topi Ai14TdTomato (RFP+).
NOTA: Per il 2° trapianto, abbiamo identificato la progressione della malattia in 2° riceventi monitorando il CBC nel sangue periferico. Per confermare ulteriormente l'istituzione della LMA, abbiamo raccolto sangue periferico intero mediante puntura cardiaca, midollo osseo, milza e fegato. Inoltre, abbiamo eseguito il lavaggio i.p. per raccogliere le cellule i.p. Le sospensioni monocellulari sono state acquisite dal midollo osseo, dalla milza e dal lavaggio i.p. come descritto sopra. Le cellule di questi siti sono state analizzate su un citometro a flusso dopo la lisi dei globuli rossi. Le cellule AML sono state riconosciute come cellule RFP negative (RFP-). Per il 3° trapianto, abbiamo campionato sangue, midollo osseo, milza, fegato e cellule i.p. all'endpoint; Le cellule RFP o CD45.1+ sono state identificate come cellule AML ed esaminate mediante citometria a flusso. Non è stata somministrata acqua di irradiazione o antibiotica a topi riceventi 2° e 3°.
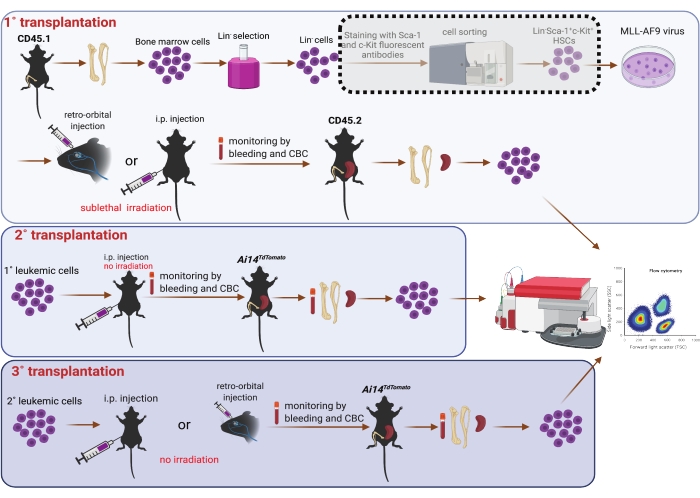
Figura 1: Schema della trasduzione virale di MLL-AF9 nelle HSC del midollo osseo e trapianto seriale (1°, 2° e 3°). L'ordinamento della popolazione doppia positiva di Sca-1 e c-Kit utilizzando un ordinatore di celle mostrato nella casella dell'ombra tratteggiata è considerato facoltativo, se le risorse lo consentono. La figura è stata creata utilizzando BioRender (https://biorender.com/). Fare clic qui per visualizzare una versione ingrandita di questa figura.
6. Lavaggio intraperitoneale
- Iniettare 5 mL di IMDM media incompleto nella cavità peritoneale due volte per raccogliere le cellule in un tubo sterile da 15 ml. Centrifugare la sospensione cellulare a temperatura ambiente e 400 x g per 3 min. Trapianto di cellule LMA (4 x 105 cellule/topo) dalla cavità peritoneale di 2° riceventi tramite iniezione i.p. in topi riceventi 3° CD45.2 (n = 3).
7. Analisi istologica 28
- Isolare la milza, i fegati e i femori dai topi dopo l'eutanasia. Fissarli in 5 ml di formalina tamponata al 10% (v/v). Campionare la milza e il fegato da controparti sane per i confronti.
- Incorporare i tessuti fissi in paraffina e tagliarli in sezioni. Colorare le sezioni con coloranti di ematossilina ed eosina (H & E).
- Ottenere le immagini al microscopio con ingrandimento 20x installato con un software compatibile per l'analisi istologica.
8. Esecuzione della PCR semi-quantitativa (qPCR)
- Preparare gli RNA nel reagente RNA secondo le istruzioni del produttore.
- Utilizzare 0,5-1,0 μg di RNA per sintetizzare il cDNA utilizzando un kit di trascrizione inversa del cDNA secondo le istruzioni del produttore.
- Utilizzare cDNA per eseguire qPCR utilizzando un kit qPCR ed eseguire i campioni in un sistema qPCR. Utilizzare le seguenti sonde TaqMan pre-convalidate: KMT2A (MLL; Ref Seq: NM_001197104(2), IDT)29 e 18S RNA ribosomiale (Hs99999901_s1).
- Caricare gli ampliconi KMT2A e 18S su un gel di agarosio al 2% per visualizzare l'espressione. Acquisire immagini in un imager installato con il programma software compatibile.
9. Trattamento dei dati
- Analizza i risultati utilizzando un software di analisi statistica e presenta i risultati come media ± SEM. Genera figure utilizzando uno strumento illustratore commerciale.
Risultati
Confronto dell'efficienza del trapianto di cellule LMA murine utilizzando vie di trapianto r.o. e i.p.
In precedenza, l'istituzione di 1° AML è stata riportata in topi riceventi trapiantati retroorbitalmente con cellule LSK trasdotte MLL-AF9 e la trapiantabilità di 1° cellule AML è stata dimostrata mediante trapianto seriale30. Il presente studio è il primo a valutare la possibilità di utilizzare le cellule Lin- del midollo osseo per eseguire il trapianto. La ...
Discussione
Questi studi sopra descritti forniscono prove a sostegno del fatto che il trapianto di cellule Lin- è paragonabile alle cellule LSK nella generazione di LMA murina 1°. Inoltre, i dati attuali mostrano anche che l'iniezione i.p. è un metodo efficiente e conveniente per stabilire la LMA murina rispetto all'iniezione endovenosa (o r.o.).
Oltre alle cellule LSK, altre popolazioni come il progenitore granulocitario-monocitario (GMP), il progenitore linfoide comune (CLP) e il progenito...
Divulgazioni
Gli autori non dichiarano alcun conflitto di interessi.
Riconoscimenti
Gli autori ringraziano la Flow Cytometry Core Facility dell'Huck Institute e la Histopathology Core Facility dell'Animal Diagnostic Laboratory, Dipartimento di Scienze Veterinarie e Biomediche, The Pennsylvania State University, per aver fornito un supporto tecnico tempestivo. Questo lavoro è stato sostenuto da sovvenzioni dell'American Institute for Cancer Research (KSP), Penn State College of Agricultural Sciences, Penn State Cancer Institute, USDA-NIFA project 4771, numero di adesione 00000005 a K.S.P. e R.F.P.
Materiali
| Name | Company | Catalog Number | Comments |
| a-Select competent cells | Bioline | BIO-85027 | |
| Ammonium chloride (NH4Cl) | Sigma Aldrich | Cat# A-9434 | |
| Ampicillin | Sigma Aldrich | Cat# A0797 | |
| Bovine Serum Albumin (BSA), Fraction V—Low-Endotoxin Grade | Gemini bio-products | Cat# 700-102P | |
| Ciprofloxacin HCl | GoldBio.com | Cat# C-861-100 | |
| DMEM, high glucose, no glutamine | Gibco | Cat# 11960-044 | |
| Dulbecco’s Phosphate-Buffered Saline (PBS) | Corning | Cat# 21-031-CV | |
| EDTA, Disodium Salt (EDTA-2Na), Dihydrate, Molecular Biology Grade | Calbiochem | Cat# 324503 | |
| Fetal Bovine Serum - Premium Select | Atlanta Biologicals | Cat# S11550 | |
| Holo-transferrin, bovine | Sigma Aldrich | Cat# T1283 | |
| Insulin solution human | Sigma | Cat# I-9278 | |
| Iscove's Modified Dulbecco's Medium (IMDM) | Gibco | Cat# 12440-053 | |
| L-glutamine 200 mM (100×) solution | HyClone, Gelifesciences | Cat# SH30034.01 | |
| LB broth, Lennox | NEOGEN | Cat #: 7290A | |
| LB Broth with agar (Miller) | Sigma Aldrich | Cat# L-3147 | |
| Mouse anti-mouse CD45.1 (FITC) | Miltenyi Biotec | Cat# 130-124-211 | |
| Mouse Interleukin-3 (IL-3) | Gemini bio-products | Cat# 300-324P | |
| Mouse Interleukin-6 (IL-6) | Gemini bio-products | Cat# 300-327P | |
| Mouse Stem Cell Factor (SCF) | Gemini bio-products | Cat# 300-348P | |
| Penicillin-Streptomycin Solution, 100x | Corning | Cat# 30-002-CI | |
| Phenix-Eco (pECO) cells | ATCC | CRL-3214 | |
| Potassium Bicarbonate (KHCO3), Granular | JT. Baker | Cat# 2940-01 | |
| Rat anti-mouse CD117 (c-kit) (APC) | BioLegend | Cat # 105812 | |
| Rat anti-mouse Ly-6A/E (Sca-1) (PE-Cy7) | BD Pharmingen | Cat# 558162 | |
| Recombinant Murine Flt3-Ligand | Pepro Tech, INC. | Cat# 250-31L | |
| RetroNectin Recombinant Human Fibronectin Fragment | TaKaRa | Cat# T100A | |
| TransIT-293 Reagent | MirusBio | Cat# MIR 2705 | |
| TRI Reagent | Sigma Aldrich | Cat# T9424 | |
| Trypan Blue Solution, 0.4% | Gibco | Cat # 15250061 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | Cat# 25200-056 | |
| β-Mercaptoethanol (BME) | Sigma Aldrich | Cat# M3148 | |
| Commercial Assays | |||
| EasySep Mouse Hematopoietic Progenitor Cell Isolation Kit | StemCell technologies | Cat# 19856A | |
| High-Capacity cDNA Reverse Transcription Kit | Thermo Fisher | Cat# 4368813 | |
| PerfeCTa qPCR SuperMix | Quanta Bio | Cat# 95051-500 | |
| Plasmid Maxi Kit (25) | Qiagen | Cat#:12163 | |
| Animals | |||
| Ai14TdTomato mice | Jackson Laboratory | Strain # 007914 | |
| CD45.1 C57BL6/J mice | Jackson Laboratory | Strain # 002014 | |
| CD45.2 C57BL6/J mice | Jackson Laboratory | Strain # 000664 | |
| Instruments and Softwares | |||
| Adobe illustrator | Version 25.2.3 | ||
| BD accuri C6 flow cytometer | BD Biosciences | ||
| FlowJo 10.8.0 | BD | ||
| GeneSys software program | Version 1.5.7.0 | ||
| GraphPad Prism version 6 | GraphPad | ||
| Hemavet 950FS | Drew Scientific | ||
| 7300 Real time PCR system | Applied Biosystems | ||
| Syngene G:BOX Chemi XR5 Chemiluminescence Fluorescence Imaging | G:Box Chemi |
Riferimenti
- Dohner, H., Weisdorf, D. J., Bloomfield, C. D. Acute myeloid leukemia. The New England Journal of Medicine. 373 (12), 1136-1152 (2015).
- Fortier, J. M., Graubert, T. A. Murine models of human acute myeloid leukemia. Cancer Treatment and Research. 145, 183-196 (2010).
- Ernst, P., et al. Definitive hematopoiesis requires the mixed-lineage leukemia gene. Developmental Cell. 6 (3), 437-443 (2004).
- Fisher, J. N., Kalleda, N., Stavropoulou, V., Schwaller, J. The Impact of the cellular origin in acute myeloid leukemia: learning from mouse models. Hemasphere. 3 (1), 152 (2019).
- Zhan, Y., Zhao, Y. Hematopoietic stem cell transplant in mice by intra-femoral injection. Methods in Molecular Biology. 430, 161-169 (2008).
- Price, J. E., Barth, R. F., Johnson, C. W., Staubus, A. E. Injection of cells and monoclonal antibodies into mice: comparison of tail vein and retroorbital routes. Proceedings of the Society for Experimental Biology. 177 (2), 347-353 (1984).
- Yardeni, T., Eckhaus, M., Morris, H. D., Huizing, M., Hoogstraten-Miller, S. Retro-orbital injections in mice. Lab Animal. 40 (5), 155-160 (2011).
- Suckow, M. A., Danneman, P., Brayton, C. . The Laboratory Mouse. , (2001).
- Barr, J. E., Holmes, D. B., Ryan, L. J., Sharpless, S. K. Techniques for the chronic cannulation of the jugular vein in mice. Pharmacology, Biochemistry, and Behavior. 11 (1), 115-118 (1979).
- Kang, Y. Analysis of cancer stem cell metastasis in xenograft animal models. Methods in Molecular Biology. 568, 7-19 (2009).
- Nungestee, W., Wolf, A., Jourdonais, L. Effect of gastric mucin on virulence of bacteria in intraperitoneal injections in the mouse. Proceedings of the Society for Experimental Biology and Medicine. 30 (2), 120-121 (1932).
- Gargiulo, S., et al. Mice anesthesia, analgesia, and part I: anesthetic considerations in preclinical research. ILAR journal. 53 (1), 55-69 (2012).
- Leong, S. -. K., Ling, E. -. A. Labelling neurons with fluorescent dyes administered via intravenous, subcutaneous or intraperitoneal route. Journal of Neuroscience Methods. 32 (1), 15-23 (1990).
- Ma, P., et al. Intraperitoneal injection of magnetic Fe3O4-nanoparticle induces hepatic and renal tissue injury via oxidative stress in mice. International Journal of Nanomedicine. 7, 4809-4918 (2012).
- Schwarze, S. R., Ho, A., Vocero-Akbani, A., Dowdy, S. F. In vivo protein transduction: delivery of a biologically active protein into the mouse. Science. 285 (5433), 1569-1572 (1999).
- Muench, M. O., Chen, J. C., Beyer, A. I., Fomin, M. E. Cellular therapies supplement: the peritoneum as an ectopic site of hematopoiesis following in utero transplantation. Transfusion. 51, 106-117 (2011).
- Zhao, W., et al. Intravenous injection of mesenchymal stem cells is effective in treating liver fibrosis. World Journal of Gastroenterology. 18 (10), 1048 (2012).
- Yousefi, F., Ebtekar, M., Soleimani, M., Soudi, S., Hashemi, S. M. Comparison of in vivo immunomodulatory effects of intravenous and intraperitoneal administration of adipose-tissue mesenchymal stem cells in experimental autoimmune encephalomyelitis (EAE). International Immunopharmacol. 17 (3), 608-616 (2013).
- Cheng, K., et al. Transplantation of bone marrow-derived MSCs improves cisplatinum-induced renal injury through paracrine mechanisms. Experimental and Molecular Pathology. 94 (3), 466-473 (2013).
- Castelo-Branco, M., et al. Intraperitoneal but not intravenous cryopreserved mesenchymal stromal cells home to the inflamed colon and ameliorate experimental colitis. PLoS One. 7 (3), 33360 (2012).
- Bazhanov, N., et al. Intraperitoneally infused human mesenchymal stem cells form aggregates with mouse immune cells and attach to peritoneal organs. Stem Cell Research & Therapy. 7, 27 (2016).
- Liu, Q., Chen, L., Atkinson, J. M., Claxton, D. F., Wang, H. G. Atg5-dependent autophagy contributes to the development of acute myeloid leukemia in an MLL-AF9-driven mouse model. Cell Death & Disease. 7 (9), 2361 (2016).
- Wognum, A. W., Eaves, A. C., Thomas, T. E. Identification and isolation of hematopoietic stem cells. Archives of Medical Research. 34 (6), 461-475 (2003).
- Randall, T. D., Weissman, I. L. Characterization of a population of cells in the bone marrow that phenotypically mimics hematopoietic stem cells: resting stem cells or mystery population. Stem Cells. 16 (1), 38-48 (1998).
- Gott, K. M., et al. A comparison of Cs-137 gamma rays and 320-kV X-rays in a mouse bone marrow transplantation model. Dose Response. 18 (2), 1559325820916572 (2020).
- Miner, N. A., Koehler, J., Greenaway, L. Intraperitoneal injection of mice. Applied Microbiology. 17 (2), 250-251 (1969).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Manual hematoxylin and eosin staining of mouse tissue sections. Cold Spring Harbor Protocols. 2014 (6), 655-658 (2014).
- Ronan, J. L., Wu, W., Crabtree, G. R. From neural development to cognition: unexpected roles for chromatin. Nature Review Genetics. 14 (5), 347-359 (2013).
- Qian, F., et al. Interleukin-4 treatment reduces leukemia burden in acute myeloid leukemia. FASEB Journal. 36 (5), 22328 (2022).
- Krivtsov, A. V., et al. Transformation from committed progenitor to leukaemia stem cell initiated by MLL-AF9. Nature. 442 (7104), 818-822 (2006).
- Chen, W., et al. Malignant transformation initiated by Mll-AF9: gene dosage and critical target cells. Cancer Cell. 13 (5), 432-440 (2008).
- Somervaille, T. C. P., Cleary, M. L. Identification and characterization of leukemia stem cells in murine MLL-AF9 acute myeloid leukemia. Cancer Cell. 10 (4), 257-268 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon