需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
有限的床上用品和筑巢作为小鼠早期生活逆境的模型
摘要
该协议描述了一种动物模型,用于研究由贫困环境和产后早期不可预测的孕产妇护理引起的早期生活逆境如何影响大脑发育和未来精神障碍的风险。
摘要
早期生活逆境 (ELA),例如虐待、忽视、缺乏资源和不可预测的家庭环境,是患抑郁症等神经精神疾病的已知风险因素。ELA 的动物模型已被用于研究慢性压力对大脑发育的影响,并且通常依赖于操纵孕产妇护理的质量和/或数量,因为这是哺乳动物(包括人类)早期生活经历的主要来源。在这里,提供了在小鼠中使用有限床上用品和嵌套 (LBN) 模型的详细方案。该模型模拟了资源匮乏的环境,通过限制给母鼠的筑巢材料的数量,为她的幼崽建造巢穴,并通过笼子中的网状平台将小鼠与床上用品分开,从而在关键的发育窗口(出生后第 2-9 天)引发碎片化和不可预测的母体护理模式。提供了代表性数据来说明 LBN 模型导致的母体行为变化,以及幼崽体重减轻和基础皮质酮水平的长期变化。成年后,在 LBN 环境中饲养的后代已被证明表现出异常的压力反应、认知缺陷和快感缺乏样行为。因此,该模型是定义 ELA 如何改变压力敏感大脑回路的成熟并导致长期行为变化的重要工具,从而赋予对精神障碍的脆弱性。
引言
出生后早期是一个关键的发育窗口,在此期间,环境影响可以改变发展轨迹。例如,早期逆境 (ELA) 可以改变大脑发育,从而引发认知和情绪功能的长期变化。ELA 的例子包括儿童或青少年时期发生的身体或情感虐待、忽视、资源不足以及不可预测的家庭环境1。众所周知,ELA 是患抑郁症、物质使用障碍、创伤后应激障碍 (PTSD) 和焦虑症等疾病的危险因素 2,3,4,5。鉴于美国的儿童贫困水平最近增加了一倍多,从 2021 年的 5.2% 增加到 2022 年的 12.4%6,这一点很重要,虽然贫困本身不一定是 ELA,但它确实增加了各种类型 ELA7 的可能性。
长期以来,动物模型对于了解早期生活压力对大脑发育和成人结果的影响至关重要。近年来用于剖析这种现象的两种主要动物模型是母体分离 (MS) 和由有限的垫料和筑巢材料 (LBN) 引起的贫困环境。MS 是作为父母剥夺8 (parent deprivation) 的模型而开发的。在其中,啮齿动物水坝每天从幼崽身上带走,通常持续几个小时,直到断奶8 点。已发现 MS 范式会导致成年期的抑郁和焦虑样行为9,以及对慢性压力的异常反应10,11。另一方面,首先在 Baram 实验室12 中开发的 LBN 模型并没有将母犬与幼崽分开,而是改变了幼崽的饲养环境,模仿了资源匮乏的环境12,13。在该模型中减少筑巢材料的数量并防止直接接触垫料会导致水坝的产妇护理中断3.由于认知和情感大脑回路的正常发展需要强大且可预测的孕产妇护理14,因此 LBN 的碎片化孕产妇护理会导致一系列结果,包括下丘脑-垂体-肾上腺 (HPA) 轴过度活跃、多个大脑区域的兴奋性抑制平衡改变、促肾上腺皮质激素释放激素 (CRH) 水平升高以及后代的抑郁样行为13, 15,16,17,18,19。
ELA 导致神经精神疾病风险增加的确切机制尚不完全清楚。它被认为与 HPA 轴回路的改变有关19,20,最近的证据表明这可能是由小胶质细胞突触修剪的变化引起的19。LBN 模型已被证明是了解围产期环境对大脑发育和长期行为结果影响的重要工具。虽然该模型最初是为大鼠开发的,但它也已针对小鼠进行了调整,以利用现有的转基因工具12,13。值得注意的是,该模型在两个物种中非常相似,并引发了高度收敛的结果,例如 HPA 轴的改变、认知缺陷和抑郁样行为,从而突出了其跨物种的效用和转化潜力。本文将详细介绍如何在小鼠中使用有限垫料和筑巢模型,收集和分析母体行为和后代结果,以验证模型的疗效和预期结果。
研究方案
所有涉及动物的程序均按照美国国立卫生研究院实验动物护理和使用指南进行,并经佐治亚州立大学机构动物护理和使用委员会批准(批准号 A24011)。这些小鼠是在佐治亚州立大学的动物设施中饲养的。实验是在围产期 (出生后第 2-10 天 [P] 2-10) 对 C57BL/6J 菌株进行的,包括雄性和雌性。用于本研究的试剂和设备列在 材料表中。
1. 材质设置
- 根据笼子的尺寸剪下网状隔板,在较长的边上留下 3 厘米的多余部分。
注意: 材料表中提供的网格由制造商切割。 - 折叠边缘,包括多余的部分,以创建一个精确适合笼子边缘的平台,并且离地面高度为 ~2.5 厘米。这将允许尿液和粪便通过网状隔板,而动物无法取回玉米棒子垫料。最后,确保所有锋利的边缘都向下折叠,以防止对动物造成任何伤害。
注意:网状隔板可重复使用,应在两次使用之间用热水和肥皂彻底清洁,然后喷洒 70% 乙醇。 - 将相机安装在三脚架上并准备录制系统。
注意:建议使用视频管理软件。这些记录会产生 .mp4 个文件,这些文件会自动合并为 1 小时的片段。 - 将设置调整为连续录制。
注意:其他推荐设置为 1920 x 1080 分辨率和 30 帧/秒。 - 如果视频管理软件没有自动完成,请将生成的 .mp4 文件设置为分成 1 小时的片段。
- 如果分析熄灯时段,请使用红外照明。
注意: 为减少笼侧面的录制眩光,建议禁用摄像机的红外 (IR)。相反,在暗相录制期间,请在房间内使用 IR 泛光灯。
2. 有限垫料和嵌套 (LBN) 范式
- 将 1-4 只雌性与一只单舍雄性饲养员配对。
注意:实验雌性首次配对的推荐年龄为 P75。使用未产雌性是理想的,但在不可行的情况下,例如使用有价值的转基因小鼠品系,经产雌性可能会在之后继续繁殖大约四个月。建议(尽管不是必需的)每天检查阴道栓以确认交配日期(胚胎日 [E]0)。- 一旦水坝怀孕,就要把干扰降到最低。
注意:经产雌性通常可以重复使用,在生育能力下降之前最多生产五窝。如果大坝被重新用于实验,它们应该优先每次用于相同的条件,或者只从控制切换到 LBN,但绝不能反过来,以避免 LBN 对大坝的任何残留长期影响。
- 一旦水坝怀孕,就要把干扰降到最低。
- 在 E17 上(或者如果没有检查插头,每当雌性看起来明显怀孕时),将雌性分到它们自己的标准有机玻璃笼中,并给它们一个棉套(5 x 5 厘米)来筑巢。
注意:最好将分离的雌性转移到远离主菌落房间的安静的小房间,进行 12 小时的光照/黑暗循环,并且对控制和 LBN 设置人员的干扰最小。 - 记录出生日期(大约 E19)。
- 在 P2 处,对幼崽进行计数和性别鉴定。将窝产草随机分配到 LBN 或 Control 条件(如果它是母猪的第一窝)。与幼崽的这种互动应在灯亮起后 1 到 4 小时之间完成。
- 小心地将幼崽放入一个新的、干净的笼子中,按性别进行分类。男性肛门和生殖器之间的肛门生殖器距离大于女性,可以用作标识符。
- 将雄性和雌性分成几组进行计数。
- 淘汰超过 8 只幼崽的幼崽,丢弃少于 4 只的幼崽。最佳窝产仔数为 4-8 只幼崽,因为超出此范围的任何事情都会干扰研究期间孕产妇护理的分配。
注意:可能因窝产仔数而受到影响的变量是幼仔体重、摄食机会和母幼犬互动,这可能会使实验感到困惑。理想情况下,小鼠不会被交叉寄养,因为它们比大鼠更不可能存活。
- 设置 Control 和 LBN 条件,如图 1 所示。
- 控制:使用标准尺寸的鼠标鞋盒笼(19.4 cm x 13.0 cm x 38.1 cm)和 ~220 g 玉米棒垫料(取决于笼子尺寸,目标是 ~1 cm 高)和一个标准方形棉巢(5 x 5 cm)。
- 为了帮助老鼠适应这种不熟悉的环境,将旧笼子中的一个粪便颗粒放在新笼子的每个角落。此外,将前一个笼子中的少量(硬币大小)用过的棉套放在新套管上。
- LBN:将先前准备好的网状隔板放入装有 ~110 克玉米棒垫料的标准鞋盒笼中(目标是 ~0.5 厘米高)。网眼应防止小鼠与玉米芯垫料直接接触。
- 最后,加入半个棉质小窝方块 (2.5 x 5 cm)。重复上述所有步骤以帮助适应。
注意:建议将鞋盒笼保持在标准的、不通风的架子上,因为已经证明这种设置是安静的,并且不会引起在 LBN 笼21 中饲养的幼犬体温过低。然而,如果通风笼中的气流增加,情况可能并非如此;因此,如果研究人员使用通风笼,则应测量系统中的噪音水平和幼犬核心温度。
- 最后,加入半个棉质小窝方块 (2.5 x 5 cm)。重复上述所有步骤以帮助适应。
- 控制:使用标准尺寸的鼠标鞋盒笼(19.4 cm x 13.0 cm x 38.1 cm)和 ~220 g 玉米棒垫料(取决于笼子尺寸,目标是 ~1 cm 高)和一个标准方形棉巢(5 x 5 cm)。
- 将幼崽添加到指定的笼子中,并将它们放在巢箱的顶部。接下来,将母鼠放在面向幼崽的笼子里,因为这会帮助她更快地注意到它们的存在。确保至少包含 8 天足够的食物和水,以避免干扰笼子,直到 P10 实验结束。
- 将摄像头放在笼子前面的三脚架上,以便清楚地从侧面看到水坝和她的幼崽。(可选)在笼子周围放置镜子,以更好地捕捉所有角度。虽然每天只需要分析 1 小时的视频录制,但相机设置为在实验期间 24/7 连续录制,以便监测干扰。
注意:也可以亲自观察小鼠,并且可以手动评分母性行为,尽管最好进行视频记录,以防止由于实验者在房间内而造成任何干扰。如果使用通风架,可能还需要使用与此处描述不同的程序来安排用于孕产妇护理记录的摄像机。 - 在 P10 的早晨,将所有动物放回标准笼子条件(理想情况下与上述对照条件相同)并称量幼仔。
- 对所有幼崽一视同仁,并在 P21 断奶,分成 2-5 只同性同窝仔。
注意:尽可能将同性同窝伴侣安置在一起,但如有必要,将不同同窝的同性后代放在一起。建议避免将外壳控制和 LBN 后代一起避免(参见 Yang 等人关于球果组成对行为表型的影响22)。

图 1:笼式设置示例。 图像左侧的笼子显示了一个标准控制 (CTL) 笼子,其中包含大量垫料和一个完整的巢穴。右侧的笼子显示了一个有限的床上用品和筑巢 (LBN) 设置,其中有一半的床上用品、半个巢和一个用于将动物与床上用品隔开的网状隔板。 请单击此处查看此图的较大版本。
3. 产妇行为评分
- 尽管在此设置中收集了连续记录,但仅分析 P3 到 P6 的 1 小时。建议在灯光更换后不早于 1 小时分析录制的视频,以允许习惯并分析每天一致时间的视频。
注意:从 P3 到 P6 的时期通常包含由于 LBN 导致的孕产妇护理的最大差异;因此,现在只需要分析一下。建议的观察/记录时间允许在从活动周期过渡到非活动周期后捕获活动,反之亦然。然而,非活跃期是母体最有可能参与孕产妇护理的时候,并且之前已被证明包含产妇行为的最大群体差异3。
注意:捕获 P2 记录的时间比其他日子晚,因为小鼠需要至少 1 小时来适应笼子的变化。除非这是一个感兴趣的变量,否则请从分析中丢弃这一天。 - 对 表 1 中所示的所有行为进行评分。通常,在数据收集时间开始后的前 50 分钟内对行为进行评分。
注意:这可以通过手动或使用行为观察研究交互式软件(BORIS,一种开源软件)或类似类型的软件以电子方式完成。以下说明适用于手部评分,可适用于所选的任何软件。 - 在打印的表格中,使用缩写、比赛的开始时间和持续时间以及任何描述性注释记录观察到的行为。例如,如果母狗正在积极哺乳,然后离开巢穴,但幼崽仍然附着在她身上,请将其记为 AN,后跟 O。仍然附着的幼崽的描述(以及数量)应该在侧面留作注释,以备将来需要时使用。
注意:不会分析任何时长小于 3 秒的行为。此规则有助于筛选出由于外部干扰(如环境噪声)而导致的瞬时行为。当 AN 回合出现明显的中断(例如由于大的移动或拉伸)并迅速恢复时,就会出现例外。在这种情况下,记录的行为是 AN,后跟 N-AN,如 表 1 所示。 - 如果同时发生多个行为,请记录最活跃的行为。这方面的一个例子是,如果母鸡是低哺乳期的,但后来开始舔舐和梳理毛发,则注意到低哺乳期会停止,下一次行为应标记为 LG,并注明这发生在 LN 期间。
| 行为类型 | 缩写 | 描述 | ||||
| 舔/梳理 | LG公司 | 母犬正在舔/梳理她的幼崽。 | ||||
| 积极护理 | 一 | 母犬站着喂养她的幼崽,而她的背部是拱形的。 | ||||
| 新的主动护理 | 不 | 这种行为专门用于大坝中断护理但很快恢复的情况。这是 3s 规则的一个例外。 | ||||
| 低护理 | 在 | 母猫正在积极地喂养她的幼崽,但她的背部很低或几乎是平的。此行为通常在一段时间后遵循 AN。 | ||||
| 侧面护理 | 锡 | 母鼠在哺乳时侧卧(也称为被动护理)。 | ||||
| 离巢 | O | 母鸡不在巢上,她也没有吃/喝。这可以从她在笼子里走来走去或探索中观察到。 | ||||
| 饮食 | E | 母鸡不在巢穴里吃东西或喝水。 | ||||
| 自我梳理 | 新加坡 | 大坝正在梳理自己。 | ||||
| 携带幼崽 | C | 母马携带幼崽,通常是为了将它们重新安置回巢穴。 | ||||
| 筑巢 | 铌 | 大坝正在积极建造或搬迁巢穴。 | ||||
| 移动巢 | M | 大坝正在巢穴上移动。这表明母犬以不同于 LG 或任何类型的护理的方式与幼崽互动,例如嗅探、抚养或踩踏幼崽。 | ||||
表 1:产妇护理行为的描述。
4. 产妇行为数据分析
- 将评分结果编译到电子表格中。
- 如果视频是电子分析的,请删除发作时间短于 3 秒的行为,如步骤 3 中所述。
- 计算每天观察的平均回合长度、平均频率以及舔舐和梳理的总持续时间。
注意:可以对任何评分行为进行描述性统计,但舔舐和梳理通常会在 LBN 的碎片化方面呈现最明显的破坏(即更短、更频繁的比赛)。这些变量可以作为 P3-P6 的平均值进行分析,也可以作为每天的重复测量进行分析,以查找随时间推移的任何变化(如果对此感兴趣)。
5. 熵的计算
注意:孕产妇护理行为的熵或不可预测性是根据 Vegetabile 等人提出的方法计算的23。该方法基于母体护理行为充当马尔可夫链的假设,可用于估计行为序列的熵率。每个大坝的行为序列都使用经验过渡矩阵 ij> i,j = 1...从一种行为 (i) 移动到另一种行为 (j) 的条件概率 7,熵率由此计算得出,如前所述 3,23,如下所示: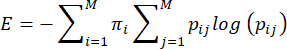
其中 Pij 是在观察到 DAM 执行行为 I 后接下来观察到行为 j 的条件概率,πi 是观察到行为 I 的频率,M (=7) 是不同行为的总数。读者可以参考 Vegetabile 等人 23 来讨论方程的理论基础;这里的重点是如何在 LBN 模型中应用该方法。
- 要计算此参数,请安排分析所需的格式。
- 通过将时间相加,将 AN、LN、SN 和 N-AN 合并为一个名为 N 的变量,因为它们都涉及护理。
注意:有关孕产妇护理行为的描述,请参阅 表 1 。 - 将与自身或小狗导向的行为(M 和 O)无关的行为添加到 O 中。
- 分别输入 LG、E、SG、C 和 NB,总共有 7 个行为。
- 通过将时间相加,将 AN、LN、SN 和 N-AN 合并为一个名为 N 的变量,因为它们都涉及护理。
- 创建包含以下顺序的列的电子表格:Mouse ID、Litter ID、Litter #、Treatment、Day、Time、Behavior 和 Status。
- 在小鼠 ID 中,添加 dam 的小鼠系/基因型。
- 在 Litter ID (窝圾 ID) 中,使用母犬的标识符,后跟 Litter Number(窝圾编号)。
- 在窝数 # 中,表示大坝的窝数。
- 根据放置动物的条件,确保处理是 LBN 或对照。
- 将日期表示为分析的相应产后日。
- 将行为开始和结束(相对于录制开始)的时间指示为视频中的时间戳。
- 从前面描述的 7 种行为(N、O、LG、E、SG、C 和 NB)中选择一种行为(表 1)。
- 标记两种类型的状态:START 和 STOP。因此,每个行为都会出现两次;第一种表示法表示开始,第二种表示法表示停止。
- 按照此格式,包括所有分析日期的信息。
- 在 R 环境中,导入已按上述方式格式化的数据集。
- 安装 https://github.com/bvegetabile/entropyRate 上提供的软件包。
注意:运行此代码会生成一个名为 LBN 的文件夹;无论条件如何,此文件夹都包含计算的熵。此外,受试者可以平均 P3-P6 每天的熵,并在条件之间进行比较。
结果
代表性结果表明,LBN 笼中贫困环境施加的 ELA 如何影响母体的孕产妇护理和后代的生理结果。在 P3-P6 的 LBN 中,产妇护理行为的每日熵较高 (F1,58 = 7.21,p = 0.0094; 图 2A),以及该时期每个大坝的平均熵 (t15 = 3.03, p = 0.0085;图 2B)。值得注意的是,当维持在同一处理组中时,来自同一母猪的不同凋落物的平均熵率没有显著...
讨论
本文提供了在小鼠中应用 LBN 模型的详细方案。该模型是理解早期生活中具有行为学和翻译相关性的慢性压力形式如何导致后代神经精神疾病发展的重要工具13。它还可用于从分子、神经内分泌或基于回路的角度研究母体行为和母体大脑中的任何变化24。对于这些类型的问题,奇偶校验可能是需要考虑的更重要的变量。我们观察到,母体行为熵分数在同一母猪内?...
披露声明
作者没有利益冲突。
致谢
这项工作得到了NIMH K99/R00独立之路奖 #MH120327、白厅基金会资助#2022-08-051和NARSAD青年研究员资助#31308的支持,这些资助来自大脑与行为研究基金会和约翰和波莉·斯帕克斯基金会。作者要感谢佐治亚州立大学动物资源部为我们的动物提供的特殊照顾,并感谢 Ryan Sleeth 在建立和维护我们的视频管理系统方面提供的出色技术支持。Bolton 博士还要感谢 Tallie Z. Baram 博士在博士后研究期间在正确实施 LBN 模型方面的出色培训。
材料
| Name | Company | Catalog Number | Comments |
| 2-inch 4 MP 4x Zoom IR Mini PT Dome Network Camera | Hikvision | DS-2DE2A404IW-DE3(S6) | |
| Amazon Basics Aluminum Light Photography Tripod Stand with Case - Pack of 2, 2.8 - 6.7 Feet, 3.66 Pounds, Black | Amazon | From Amazon | |
| Blue Iris | Blue Iris Security | Optional video management software | |
| CAMVATE 1/4"-20 Mini Ball Head with Ceiling Mount for CCTV & Video Wall Monitors Mount - 1991 | Camvate | From Amazon | |
| Corn cob bedding | The Andersons | 4B | |
| Cotton nestlet | Ancare | NES3600 | |
| Mesh divider | McNICHOLS | 4700313244 | Standard, Aluminum, Alloy 3003-H14, 3/16" No. .032 Standard (Raised), 70% Open Area |
| Tendelux DI20 IR Illuminator | Tendelux | From Amazon |
参考文献
- Warhaftig, G., Almeida, D., Turecki, G. Early life adversity across different cell- types in the brain. Neurosci Biobehav Rev. 148, 105113 (2023).
- Duffy, K. A., Mclaughlin, K. A., Green, P. A. Early life adversity and health-risk behaviors: Proposed psychological and neural mechanisms. Ann N Y AcadSci. 1428 (1), 151-169 (2018).
- Molet, J., et al. Fragmentation and high entropy of neonatal experience predict adolescent emotional outcome. Transl Psychiatry. 6 (1), e702 (2016).
- Garvin, M. M., Bolton, J. L. Sex-specific behavioral outcomes of early-life adversity and emerging microglia-dependent mechanisms. Front Behav Neurosci. 16, 1013865 (2022).
- Andersen, S. L. Neuroinflammation, early-life adversity, and brain development. Harv Rev Psychiatry. 30 (1), 24-39 (2022).
- Shrider, E. A., Creamer, J. . Poverty in the United States: 2022. , 60 (2023).
- Roos, L. L., Wall-Wieler, E., Lee, J. B. Poverty and early childhood outcomes. Pediatrics. 143 (6), e20183426 (2019).
- Ader, R., Tatum, R., Beels, C. C. Social factors affecting emotionality and resistance to disease in animals: I. Age of separation from the mother and susceptibility to gastric ulcers in the rat. J Comp Physiol Psychol. 53 (5), 446-454 (1960).
- Nishi, M. Effects of early-life stress on the brain and behaviors: Implications of early maternal separation in rodents. Int J Mol Sci. 21 (19), 7212 (2020).
- Trujillo, V., Durando, P. E., Suárez, M. M. Maternal separation in early life modifies anxious behavior and fos and glucocorticoid receptor expression in limbic neurons after chronic stress in rats: Effects of tianeptine. Stress. 19 (1), 91-103 (2016).
- Yu, S., et al. Early life stress enhances the susceptibility to depression and interferes with neuroplasticity in the hippocampus of adolescent mice via regulating miR-34c-5p/SYT1 axis. J Psychiatr Res. 170, 262-276 (2023).
- Walker, C. D., et al. Chronic early life stress induced by limited bedding and nesting (LBN) material in rodents: Critical considerations of methodology, outcomes and translational potential. Stress. 20 (5), 421-448 (2017).
- Rice, C. J., Sandman, C. A., Lenjavi, M. R., Baram, T. Z. A novel mouse model for acute and long-lasting consequences of early life stress. Endocrinology. 149 (10), 4892-4900 (2008).
- Glynn, L. M., Baram, T. Z. The influence of unpredictable, fragmented parental signals on the developing brain. Front Neuroendocrinol. 53, 100736 (2019).
- Karst, H., et al. Acceleration of GABA-switch after early life stress changes mouse prefrontal glutamatergic transmission. Neuropharmacology. 234, 109543 (2023).
- Demaestri, C., et al. Resource scarcity but not maternal separation provokes unpredictable maternal care sequences in mice and both upregulate CRH-associated gene expression in the amygdala. Neurobiol Stress. 20, 100484 (2022).
- Breton, J. M., et al. Early life adversity reduces affiliative behavior with a stressed cagemate and leads to sex-specific alterations in corticosterone responses in adult mice. Horm Behav. 158, 105464 (2023).
- Bath, K. G., Manzano-Nieves, G., Goodwill, H. Early life stress accelerates behavioral and neural maturation of the hippocampus in male mice. Horm Behav. 82, 64-71 (2016).
- Bolton, J. L., et al. Early stress-induced impaired microglial pruning of excitatory synapses on immature CRH-expressing neurons provokes aberrant adult stress responses. Cell Rep. 38 (13), 110600 (2022).
- Dahmen, B., et al. Effects of early-life adversity on hippocampal structures and associated HPA axis functions. Dev Neurosci. 40 (1), 13-22 (2018).
- Bolton, J. L., Short, A. K., Simeone, K. A., Daglian, J., Baram, T. Z. Programming of stress-sensitive neurons and circuits by early-life experiences. Front Behav Neurosci. 13, 30 (2019).
- Yang, M., Lewis, F., Foley, G., Crawley, J. N. In tribute to Bob Blanchard: Divergent behavioral phenotypes of 16p11.2 deletion mice reared in same-genotype versus mixed-genotype cages. Physiol Behav. 146, 16-27 (2015).
- Vegetabile, B. G., Stout-Oswald, S. A., Davis, E. P., Baram, T. Z., Stern, H. S. Estimating the entropy rate of finite Markov chains with application to behavior studies. J Educ Behav Stat. 44 (3), 282-308 (2019).
- Rincón-Cortés, M., Grace, A. A. Postpartum scarcity-adversity disrupts maternal behavior and induces a hypodopaminergic state in the rat dam and adult female offspring. Neuropsychopharmacology. 47 (2), 488-496 (2022).
- Gallo, M., et al. Limited bedding and nesting induces maternal behavior resembling both hypervigilance and abuse. Front behav neurosci. 13, 167 (2019).
- Manzano Nieves, G., Bravo, M., Baskoylu, S., Bath, K. G. Early life adversity decreases pre-adolescent fear expression by accelerating amygdala pv cell development. eLife. 9, e55263 (2020).
- Johnson, F. K., et al. Amygdala hyper-connectivity in a mouse model of unpredictable early life stress. Transl Psychiatry. 8 (1), 49 (2018).
- Demaestri, C., et al. Type of early life adversity confers differential, sex-dependent effects on early maturational milestones in mice. Horm Behav. 124, 104763 (2020).
- Reemst, K., et al. Molecular underpinnings of programming by early-life stress and the protective effects of early dietary ω6/ω3 ratio, basally and in response to LPS: Integrated mRNA-miRNAs approach. Brain Behav Immun. 117, 283-297 (2024).
- Reemst, K., et al. Early-life stress and dietary fatty acids impact the brain lipid/oxylipin profile into adulthood, basally and in response to LPS. Front Immunol. 13, 967437 (2022).
- Reemst, K., et al. Early-life stress lastingly impacts microglial transcriptome and function under basal and immune-challenged conditions. Transl Psychiatry. 12 (1), 507 (2022).
- Wang, T., et al. The nucleus accumbens CRH-CRHR1 system mediates early-life stress-induced sleep disturbance and dendritic atrophy in the adult mouse. Neurosci Bull. 39 (1), 41-56 (2023).
- Knop, J., Van, I. M. H., Bakermans-Kranenburg, M. J., Joëls, M., Van Der Veen, R. Maternal care of heterozygous dopamine receptor d4 knockout mice: Differential susceptibility to early-life rearing conditions. Genes Brain Behav. 19 (7), e12655 (2020).
- Bennett, S. N., Chang, A. B., Rogers, F. D., Jones, P., Peña, C. J. Thyroid hormones mediate the impact of early-life stress on ventral tegmental area gene expression and behavior. Horm Behav. 159, 105472 (2024).
- Parel, S. T., et al. Transcriptional signatures of early-life stress and antidepressant treatment efficacy. Proc Natl Acad Sci U S A. 120 (49), e2305776120 (2023).
- Julie-Anne, B., et al. Reactivation of early-life stress-sensitive neuronal ensembles contributes to lifelong stress hypersensitivity. J Neurosci. 43 (34), 5996 (2023).
- Bolton Jessica, L., et al. Maternal stress and effects of prenatal air pollution on offspring mental health outcomes in mice. Environ Health Perspect. 121 (9), 1075-1082 (2013).
- Block, C. L., et al. Prenatal environmental stressors impair postnatal microglia function and adult behavior in males. Cell Rep. 40 (5), 111161 (2022).
- Peña, C. J., et al. Early life stress alters transcriptomic patterning across reward circuitry in male and female mice. Nat Commun. 10 (1), 5098 (2019).
- Lapp, H. E., Salazar, M. G., Champagne, F. A. Automated maternal behavior during early life in rodents (amber) pipeline. Sci Rep. 13 (1), 18277 (2023).
- Madison, F. N., Palin, N., Whitaker, A., Glasper, E. R. Sex-specific effects of neonatal paternal deprivation on microglial cell density in adult California mouse (Peromyscus californicus) dentate gyrus. Brain, Behav. Immun. 106, 1-10 (2022).
- Walker, S. L., Sud, N., Beyene, R., Palin, N., Glasper, E. R. Paternal deprivation induces vigilance-avoidant behavior and accompanies sex-specific alterations in stress reactivity and central proinflammatory cytokine response in California mice (Peromyscus californicus). Psychopharmacology. 240 (11), 2317-2334 (2023).
- Molet, J., Maras, P. M., Avishai-Eliner, S., Baram, T. Z. Naturalistic rodent models of chronic early-life stress. Dev Psychobiol. 56 (8), 1675-1688 (2014).
- Tsuchimine, S., et al. Comparison of physiological and behavioral responses to chronic restraint stress between C57BL/6J and balb/c mice. Biochem Biophys Res Commun. 525 (1), 33-38 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。