Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Metal Bağlama Oligopeptidlerinin Yapısı ve Mekanizmalarının Belirlenmesinde Iyon Hareketliliği-Kütle Spektrometresi Teknikleri ve Metal Bağlayıcı Oligopeptidlerin Redoks Aktivitesi
Bu Makalede
Özet
Iyon hareketlilik-kütle spektrometresi ve moleküler modelleme teknikleri, tasarlanmış metal bağlayıcı peptidlerin ve bakır bağlayıcı peptid metanobakinin seçici metal şelat performansını karakterize edebilir. Metal şelat peptidler yeni sınıflar geliştirilmesi metal iyon dengesizliği ile ilişkili hastalıklar için terapötik yol yardımcı olacaktır.
Özet
Elektrosprey iyonizasyonu (ESI), kütlesini, genel yükünü, metal bağlayıcı etkileşimlerini ve konformasyonel şeklini muhafaza ederken bir sulu faz peptid veya peptit kompleksini gaz fazına aktarabilir. IYON hareket-kütle spektrometresi (IM-MS) ile kaplin ESI, bir peptitin kütle-şarj (m/z) ve çarpışma kesitinin (CCS) eşzamanlı olarak ölçülmesine olanak tanıyan ve stokiyometrisi, protonasyon durumu ile ilgili enstrümental bir teknik sağlar. ve konformasyonel şekil. Bir peptit kompleksinin genel yükü 1) peptidin asidik ve bazik bölgeleri ve 2) metal iyonun oksidasyon durumu ile kontrol edilir. Bu nedenle, bir kompleksin genel yük durumu peptidler metal iyon bağlama afinitesini etkileyen çözeltinin pH fonksiyonudur. ESI-IM-MS analizleri için, peptit ve metal iyonları çözeltileri sadece sulu çözeltilerden hazırlanır ve pH seyreltik sulu asetik asit veya amonyum hidroksit ile ayarlanır. Bu, pH bağımlılığı ve metal iyon seçiciliğinin belirli bir peptid için belirlenmesini sağlar. Ayrıca, bir peptid kompleksinin m/z ve CCS'si B3LYP/LanL2DZ moleküler modelleme ile metal iyon koordinasyonu ve kompleksin üçüncül yapısının bağlayıcı bölgelerini ayırt etmek için kullanılabilir. Sonuçlar, ESI-IM-MS'in bir dizi alternatif metanobakin peptidin seçici şelatif performansını nasıl karakterize ettiğini ve bakır bağlayıcı peptid metanobakin ile karşılaştırabileceğini göstermektedir.
Giriş
Bakır ve çinko iyonları canlı organizmalar için gereklidir ve oksidatif koruma, doku büyümesi, solunum, kolesterol, glikoz metabolizması ve genom okuma1dahil olmak üzere süreçler için çok önemlidir. Bu işlevleri etkinleştirmek için, Cys thiolate gibi gruplar, Onun imidazol, Onun2,3,(daha nadiren) metiyonin tiyoteter, ve Glu ve Asp karboksiat seçici aktif sitelere kofaktör olarak metaller dahil metalloenzimler. Bu koordinasyon gruplarının benzerliği, His ve Cys ligandlarının doğru işleyişi sağlamak için Cu(I/II) veya Zn(II) ile nasıl seçici olarak birleştirirler konusunda ilginç bir soru doğurmaktadır.
Seçici bağlama genellikle Zn(II) veya Cu(I/II) iyonkonsantrasyonlarınıkontrol eden peptidlerin elde edilmesi ve ticareti ile gerçekleştirilir 4. Cu(I/II) son derece reaktiftir ve enzimlere oksidatif hasara veya adventif bağlanmaya neden olur, bu nedenle serbest konsantrasyonu bakır şaperonlar ve bakır düzenleyici proteinler tarafından sıkı bir şekilde düzenlenir ve onu hücredeki çeşitli yerlere güvenli bir şekilde taşır ve sıkıca homeostaz isikontrol 5,6. Bakır metabolizması veya homeostaz bozulması doğrudan Menkes ve Wilson hastalığı7 yanı sıra kanserler7 ve nöral bozukluklar, prion8 ve Alzheimerhastalığı9 gibi karıştığı 9 .
Wilson hastalığı gözlerde artan bakır düzeyleri ile ilişkilidir, karaciğer ve beynin bölümleri, Cu redoks reaksiyonları reaktif oksijen türleri üretir nerede(I/II) reaktif oksijen türleri üretir, hepatolentiküler ve nörolojik dejenerasyona neden. Mevcut şelasyon tedavileri küçük tiyol amino asit penicillamine ve triethylenetetramine vardır. Alternatif olarak, metanotrofik bakır edinimi peptidler methanobactin (mb)10,11 cu (I)12için yüksek bağlayıcı yakınlık nedeniyle tedavi potansiyeli sergiler. Methylosinus trichosporium OB3b gelen metanobactin (mb-OB3b) Wilson hastalığının bir hayvan modeli nde incelendiğinde, bakır verimli karaciğer den çıkarıldı ve safra13ile atılır . In vitro deneyler mb-OB3b karaciğer sitosol bulunan bakır metallothionein bakır chelate olabileceğini doğruladı13. Lazer ablasyon endüktif plazma kütle spektrometresi görüntüleme teknikleri Wilson hastalığı karaciğer örneklerinde bakır mekansal dağılımı araştırılmış14,15,16 ve mb-OB3b gösterdi bakırı sadece 8 gün17kısa tedavi süreleri ile temizler.
Mb-OB3b ayrıca Ag(I), Au(III), Pb(II), Mn(II), Co(II), Fe(II), Ni(II) ve Zn(II)18,19gibi diğer metal iyonlarıyla da bağlanacaktır. Fizyolojik Cu(I) bağlama alanı için rekabet Ag(I) tarafından sergilenmektedir, çünkü cu(I) mb-OB3b kompleksinden yerinden edebilir, hem Ag(I) hem de Ni(II) aynı zamanda Cu(I)19tarafından yerinden edilemeyen Mb'ye geri dönüşü olmayan bir bağlanma gösterir. Son zamanlarda, 2His-2Cys bağlayıcı motifi ile alternatif metanobactin (amb) oligopeptidler bir dizi incelenmiştir20,21, ve onların Zn(II) ve Cu (I/II) karakterize bağlama özellikleri. Birincil amino asit dizileri benzerdir ve hepsi 2His-2Cys motifi, Pro ve asetillenmiş N-terminus içerir. 2His-2Cys motifi mb-OB3b'nin iki enethiol oxazolone bağlama yerinin yerini aldığı için esas olarak mb-OB3b'den farklıdırlar.
Elektrosprey iyonizasyoniyoniyonizasyon iyon hareketlilik-kütle spektrometresi (ESI-IM-MS) ile birleştiğinde peptidlerin metal bağlayıcı özelliklerini belirlemek için güçlü bir araçtekniği sağlar, çünkü kütle-yük(m/z) ve çarpışmayı ölçer. çözelti fazından kütle, yük ve konformasyonel şekillerini muhafaza ederken kesit (CCS). m/z ve CCS peptidler stokiyometri, protonasyon durumu ve konformasyonel şekil ile ilgilidir. Stokiyometri, türde bulunan her elementin kimliği ve sayısı açıkça belirlendiği için belirlenir. Peptit kompleksinin genel yükü asidik ve bazik alanların protonlanma durumu ve metal iyonun oksidasyon durumu ile ilgilidir. CCS, kompleksin üçüncül yapısıyla ilgili dönme ortalama boyutunu ölçtebildiği için peptit kompleksinin konformasyonel şekli hakkında bilgi verir. Kompleksin genel yük durumu da pH bir fonksiyonudur ve karboksil gibi deprotonated temel veya asidik siteler, His, Cys ve Tyr da metal iyon için potansiyel bağlayıcı siteleri olduğu için peptid metal iyon bağlayıcı afinite etkiler. Analizler için, peptit ve metal iyon seyreltik sulu asetik asit veya amonyum hidroksit tarafından ayarlanmış pH ile sulu çözeltiler halinde hazırlanır. Bu, peptid için pH bağımlılığının ve metal iyon seçiciliğinin belirlenmesini sağlar. Ayrıca, ESI-IM-MS tarafından belirlenen m/z ve CCS, kompleksin metal iyon koordinasyonu ve üçüncül yapısını keşfetmek için B3LYP/LanL2DZ moleküler modelleme ile kullanılabilir. Bu makalede gösterilen sonuçlar, ESI-IM-MS'in bir dizi bir set peptidin seçici şelat performansını nasıl karakterize ettiğini ve bunları bakır bağlayıcı peptid mb-OB3b ile nasıl karşılaştırabileceğini ortaya koymaktadır.
Protokol
1. Reaktiflerin hazırlanması
- Kültür Methylosinus trichosporium OB3b, Cu(I)-free mb-OB3b18,22,23,dondurma-kuru örnek ve kullanılabilir hale gelene kadar -80 °C'de saklayın.
- Amb peptidleri sentezleyin (>amb1için %98 saflık , amb2, amb4; >amb 7 için%70saflık), numuneleri dondurup kurutun ve kullanıma kadar -80 °C'de saklayın.
- Satın alma >98% saflık manganez(II) klorür, kobalt(II) klorür, nile(II) klorür, bakır(II) klorür, bakır(II) nitrat, gümüş(I) nitrat, çinko(II) klorür, demir(III) klorür ve kurşun(II) klorür.
- Amb türlerinin çarpışma kesitlerini ve HPLC sınıfı veya daha yüksek amonyum hidroksit, buzul asetik asit ve asetonititin çarpışma kesitlerini ölçmek için kalibran olarak kullanılan poli-DL-alanin polimerleri satın alın.
2. Stok çözeltisinin hazırlanması
-
Peptit stok çözeltisi
- Doğru tartmak, en az üç önemli rakamlar kullanarak, 10.0-20.0 mb-OB3b veya amb kütlesi 1.7 mL plastik şişe.
NOT: Tartılmış kütle, 1,00 mL deiyonize (DI) su eklendiğinde, peptitin çözünürlüğe bağlı olarak 12,5 mM veya 1,25 mM verim vermelidir. - Bir pipet kullanarak, tartılmış peptid numunesine 12,5 mM veya 1,25 mM çözeltisi vermek için 1,00 mL deiyonize su (>17,8 MΩ cm) ekleyin. Kapağı güvenli bir şekilde yerleştirin ve en az 20 ters çevirmeyle iyice karıştırın.
- Bir mikropipet kullanarak 50.0 μL aliquots peptit örnek ten ayrı etiketli 1.5 mL şişeler içine aliquots ve kullanıma kadar -80 °C'de saklayın.
- Doğru tartmak, en az üç önemli rakamlar kullanarak, 10.0-20.0 mb-OB3b veya amb kütlesi 1.7 mL plastik şişe.
-
Metal iyon stok çözümleri
- Doğru tartmak, en az üç önemli rakamlar kullanarak, 1.7 mL şişe metal klorür veya gümüş nitrat 10.0-30.0 mg kütlesi.
NOT: 1.00 mL DI su eklendiğinde tartılmış kütle 125 mM olmalıdır. - 125 mM çözeltiyi verim vermek için 1,7 mL şişedeki tartılmış metal numuneye 1,00 mL DI su ekleyin. Kapağı güvenli bir şekilde yerleştirin ve en az 20 ters çevirmeyle iyice karıştırın.
- Doğru tartmak, en az üç önemli rakamlar kullanarak, 1.7 mL şişe metal klorür veya gümüş nitrat 10.0-30.0 mg kütlesi.
- Amonyum hidroksit stok çözeltileri: DI suyu ile %99,5 asetik asit çözeltisinin 57 μL'sini 1,00 mL'lik son hacmine seyrelterek 1,0 M asetik asit çözeltisi hazırlayın. %21 amonyum hidroksit çözeltisinin 90 μL'sini DI suyuyla 1,00 mL'lik son hacmine seyrelterek 1,0 M amonyum hidroksit çözeltisi hazırlayın. 0,10 M ve 0,010 M asetik asit ve amonyum hidroksit çözeltisi hazırlamak için 1,0 M çözelti100 μL alarak her çözeltinin art arda iki seyreltme yapın.
- Poli-DL-alanin stok çözeltisi:1.0 0 mg PA tartılarak ve 1.0 mL DI suda eriterek 1.000 ppm vermek için poli-DL-alanin (PA) hazırlayın. Iyice karıştırın. Bir mikropipet kullanarak, 50,0 μL aliquots dağıtın ve her biri 1,7 mL şişe içine yerleştirin ve -80 °C'de saklayın.
3. Elektrosprey-iyon hareketlilik-kütle spektrometresi analizi
- ESI giriş tüplerini ve iğne kılcal damarını yaklaşık 500 μL 0,1 M buzul asetik asit, 0,1 M amonyum hidroksit ve son olarak DA suyu ile iyice temizleyin.
- 1.000 ppm PA stok çözeltisinin 50.0 μL aliquot'unu eritin ve 100 ppm PA vermek için 450 μL DI su ile seyreltin. Bu çözeltinin 100,0 μL'lik pipet'i ve 10 ppm PA çözeltisi vermek için 500 μL DI su ve 500 μL asetonitril ile 1,00 mL'ye seyreltin.
- Tartışma bölümünde açıklandığı gibi yerel ESI-IM-MS koşullarını kullanarak her biri 10 dk için 10 ppm PA çözeltisinin negatif ve pozitif iyon IM-MS spektrumlarını toplayın.
- 12,5 mM veya 1,25 mM amb stok çözeltisinin 50,0 μL'lik bir aliquot'u eritin ve 0,125 mM amb'lik son konsantrasyonu vermek için DI suyu yla art arda seyreltmeler yapın. Her seyreltme iyice karıştırın.
- Pipet 100.0 μL 125 mM metal iyon stok çözeltisi, 1.7 mL şişe yerleştirin ve 12.5 mM metal iyon vermek için DI su ile 1.00 mL seyreltmek. Son 0,125 mM metal iyon konsantrasyonu vermek için art arda iki seyreltme ile tekrarlayın. Her seyreltme iyice karıştırın.
- Pipet 200.0 μL 0.125 mM amb içine 1.7 mL şişe içine, 500 μL DI su ile seyreltin ve iyice çözeltikarıştırın.
- 1,0 M asetik asit çözeltisi 50 μL ekleyerek numunenin pH'ını 3,0'a ayarlayın.
- PH ayarlı numuneye 0,125 mM metal iyonun 200,0 μL'sini ekleyin. Numunenin 1,00 mL'lik son hacmini elde etmek için DI suyu ekleyin, iyice karıştırın ve numunenin RT'de 10 dakika boyunca dengelemesine izin verin.
- Künt bir burun şırıngası kullanarak numunenin 500 μL'sini alın ve negatif ve pozitif iyon ES-IM-MS spektrumlarını her biri 5 dakika için toplayın. Kalibre edilmiş mikro pH elektrotunu kullanarak son pH'ını kaydetmek için numunenin kalan 500 μL'sini kullanın.
- PH'ı 4.0, 5.0, 6.0, 7.0, 8.0, 9.0 veya 10.0 olarak ayarlamak için 3.6-3.9 adımlarını değiştirirken, 0,010 M, 0,10 M veya 1,0 M asetik asit veya amonyum hidroksit çözeltilerinin yeni hacimlerini ekleyerek tekrarlayın.
- Her biri 10 dakika boyunca 10 ppm PA çözeltisinin negatif ve pozitif iyon ESI-IM-MS spektrumlarını toplayın.
4. amb numunelerinin metal iyon titrasyonunun hazırlanması
- 3.1-3.5 adımlarında açıklanan adımları izleyin.
- Pipet 200.0 μL 0.125 mM amb içine 1.7 mL şişe içine, 500.0 μL DI su ile seyreltin ve iyice çözeltikarıştırın.
- 0,010 M amonyum hidroksit çözeltisinin 80 μL'sini ekleyerek numunenin pH =9,0'ı ayarlayın.
- Metal iyonunun 0,14 molar eşdeğeri vermek için 0,125 mM metal iyon çözeltisinin 28 μL'sini ekleyin, numunenin son hacmini 1,00 mL yapmak için DI su ekleyin, iyice karıştırın ve numunenin RT'de 10 dakika boyunca dengede olmasını bekleyin.
- Künt bir burun şırıngası kullanarak numunenin 500 μL'sini alın ve negatif ve pozitif iyon ESI-IM-MS spektrumlarını her biri 5 dakika için toplayın. Kalibre edilmiş mikro pH elektrotunu kullanarak son pH'ını kaydetmek için numunenin kalan 500 μL'sini kullanın.
- 0.28, 0.42, 0.56, 0.70, 0.84, 0.98, 1.12, 1.26 veya 1.40 molar eşdeğerleri vermek için 0.125 mM metal iyon çözeltisinin uygun hacmini eklemek için adım 4.3'ü değiştirirken 4.2-4.5 adımLarını tekrarlayın.
- Her biri 10 dakika boyunca 10 ppm PA çözeltisinin negatif ve pozitif iyon IM-MS spektrumlarını toplayın.
5. ESI-IM-MS pH titrasyon verilerinin analizi
- IM-MS spektrumlarından hangi yüklü ambs türlerinin teorik m/z izotop desenleriyle eşleştirilerek mevcut olduğunu belirleyin.
- MassLynx'i açın ve Kromatogram penceresini açmak için Kromatogram'a tıklayın.
- IM-MS veri dosyasını bulmak ve açmak için Dosya menüsüne gidin ve Açın.
- Kromatogramı sağ tıklayıp sürükleyerek ve serbest bırakarak IM-MS spektrumu ayıklayın. Spektrum penceresi IM-MS spektrumu gösteren açılacaktır.
- Spektrum penceresinde, Araçlar ve Izotop modelinetıklayın. Izotop modelleme penceresinde, amb türünün moleküler formülünü girin, Yüklü iyon kutusunu Göster'i işaretleyin ve şarj durumunu girin. Tamam'ıtıklatın.
- IM-MS spektrumundaki tüm türleri tanımlamak ve m/z izotop aralıklarını kaydetmek için tekrarlayın.
- Her amb türü için, herhangi bir rastlantısal m/z türünü ayırın ve varış zamanı dağılımlarını (ATD) onları tanımlamak için m/z izotop desenlerini kullanarak ayıklayın.
- MassLynx'te programı açmak için DriftScope'a tıklayın. DriftScope'ta IM-MS veri dosyasını bulup açmak için Dosya ve Aç'ı tıklatın.
- Fareyi ve sol tıklatmayı kullanarak amb türünün m/z izotop desenini yakınlaştırın.
- Izotop deseni seçmek için Seçim aracını ve sol fare düğmesini kullanın. Geçerli seçimi kabul et düğmesini tıklatın.
- Herhangi bir rastlantısal m/z türünü ayırmak için seçim aracını ve sol fare düğmesini kullanarak amb türünün izotop deseniyle hizalanmış ATD zamanını seçin. Geçerli seçimi kabul et düğmesini tıklatın.
- ATD'yi dışa aktarmak için Dosyaya gidin | MassLynx'e dışa aktarın,ardından Drift Süresini Koru'u seçin ve dosyayı uygun klasöre kaydedin.
- ATD'nin merkezotosini belirleyin ve türün popülasyonunun bir ölçüsü olarak ATD eğrisi altındaki alanı entegre edin.
- MassLynx'in Kromatogram penceresinde kaydedilen dışa aktarılan dosyayı açın. İşlem e tıklayın | Menüden tümleştirin. ApexTrack Peak Tümleştirme kutusunu işaretleyin ve Tamam'ıtıklatın.
- Sentroid ATD 'yi (tA)ve kromatogram penceresinde gösterildiği gibi entegre alanı kaydedin. Kaydedilen tüm amb ve PA IM-MS veri dosyaları için tekrarlayın.
- Göreceli bir yüzde ölçeğine normalleştirmek için her titrasyon noktasındaki pozitif veya negatif iyonların tüm çıkarılan amb türleri için entegre ATD'yi kullanın.
- Amb türlerinin kimliklerini ve bunların tümleşik ATD'lerini her pH'ındaki kimliklerini bir elektronik tabloya girin.
- Her pH için, tek tek amb'nin ATD'sini yüzde ölçeğine normalleştirmek için tümleşik ATD'lerin toplamını kullanın.
- Her amb türün pH'a karşı yüzde lik yoğunluklarını bir grafikte çizin ve her türün popülasyonunun pH'ın bir fonksiyonu olarak nasıl değiştiğini gösterin.
6. Çarpışma kesitleri
- Bir elektronik tablo kullanarak, PA negatif25,26 ve pozitif27 iyonları CCSs (Ω) o tampon gaz28 ölçülen ccss (Ωc)aşağıdaki Denklem 1 kullanarak düzeltilmiş CCS , nerede dönüştürün: z = iyon yükü; e c = elektron yükü (1.602×10-19 C); m N 2 = N2 gazının kütlesi (Da); ve miyon = iyon kütlesi. 29.000
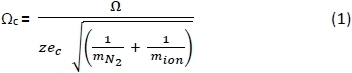
- Aşağıdaki Denklem 2'yi kullanarak PA kalibranlarının ve amb türlerinin ortalama varış sürelerini (tA)drift sürelerine (tD)dönüştürün: c = gelişmiş görev döngüsü gecikme katsayısı (1,41) ve m/z peptit iyonunun kütle-şarjıdır.

- Plan PA calibrants 'tD vs onların Ωc. Daha sonra, aşağıda gösterilen Denklem 3'ün en az karereyon uyumunu kullanarak, A' ve B değerlerini belirleyin: A' sıcaklık, basınç ve elektrik alanı parametreleri için düzeltmedir; ve B, IM aygıtının doğrusal olmayan etkisini telafi eder.

- Bu A' ve B değerlerini ve ambs ATD'den gelen merkezroid tD değerini kullanarak Denklem 3'ü kullanarak Ω c'lerini ve Denklem 1'ikullanarak Ωc'lerini belirlerler. Bu yöntemyaklaşık%2,26,27tahmini mutlak hataları ile peptit türleri için CCSs sağlar.
7. Hesaplama yöntemleri
- Becke 3-parametre hibrid fonksiyoneller oluşan teori B3LYP/ LanL2DZ düzeyini kullanın30 ve Dunning temelseti31 ve elektron çekirdek potansiyelleri32,33,34 bulmak için gözlemlenen m/z amb türlerinin tüm olası koordinasyon türleri için geometri için optimize edilmiş konfüçücüler35.
NOT: Hesaplamaların nasıl oluşturup gönderilen ayrıntılar için Ek Dosya'dakiGaussView kullanımına bakın. - Her bir konformosun öngörülen serbest enerjisini karşılaştırın ve Sigma programı36'dakiiyon ölçekli Lennard-Jones (LJ) yöntemini kullanarak teorik CCS'lerini hesaplayın.
- En düşük serbest enerji konforperlerinden, deneyde gözlenen conformrler için üçüncül yapıyı ve koordinasyon türünü belirlemek için IM-MS ölçülen CCS ile aynı fikirde olan LJ CCS'yi hangi konformasyoncuya sergiler belirleyin.
Sonuçlar
amb1 metal bağlama
Amb1'in 20 IM-MS çalışması(Şekil 1A)hem bakır hem de çinko iyonlarının pH'ya bağlı bir şekilde amb1'e bağlı olduğunu göstermiştir(Şekil 2). Ancak bakır ve çinko farklı koordinasyon bölgelerinde farklı reaksiyon mekanizmaları ile amb1'e bağlanır. Örneğin, Cu(II) amb1'e eklenmesi disülfit köprü oluş...
Tartışmalar
Kritik adımlar: ESI-IM-MS ile inceleme için çözüm fazı davranışlarının muhafaza edilmesi
Peptidlerin stokiyometrisini, şarj durumunu ve konformasyonel yapısını korumak için yerli ESI enstrümantal ayarları kullanılmalıdır. Yerel koşullar için, KONI gerilimleri, sıcaklıklar ve gaz akışları gibi ESI kaynağındaki koşulların optimize edilmesi gerekir. Ayrıca, kaynak, tuzak, iyon hareketliliği ve transfer dalgalarındaki (özellikle IM hücresine enjeksiyon gerilimini kontro...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu materyal, 1764436, NSF enstrüman desteği (MRI-0821247), Welch Vakfı (T-0014) ve Enerji Bakanlığı (TX-W-20090427-0004-50) ve L3 Communications'ın bilgi işlem kaynakları altında Ulusal Bilim Vakfı tarafından desteklenen çalışmalara dayanmaktadır. . Biz California Üniversitesi Bower grubu teşekkür ederiz - Santa Barbara Sigma programı ve Ayobami Ilesanmi video tekniği göstermek için paylaştığı için.
Malzemeler
| Name | Company | Catalog Number | Comments |
| acetonitrile HPLC-grade | Fisher Scientific (www.Fishersci.com) | A998SK-4 | |
| ammonium hydroxide (trace metal grade) | Fisher Scientific (www.Fishersci.com) | A512-P500 | |
| cobalt(II) chloride hexahydrate 99.99% | Sigma-Aldrich (www.sigmaaldrich.com) | 255599-5G | |
| copper(II) chloride 99.999% | Sigma-Aldrich (www.sigmaaldrich.com) | 203149-10G | |
| copper(II) nitrate hydrate 99.99% | Sigma-Aldrich (www.sigmaaldrich.com) | 229636-5G | |
| designed amb1,2,3,4,5,6,7 peptides | Neo BioLab (neobiolab.com) | designed peptides were synthized by order | |
| designed amb5B,C,D,E,F peptides | PepmicCo (www.pepmic.com) | designed peptides were synthized by order | |
| Driftscope 2.1 software program | Waters (www.waters.com) | software analysis program | |
| Freeze-dried, purified, Cu(I)-free mb-OB3b | cultured and isolated in the lab of Dr. DongWon Choi (Biology Department, Texas A&M-Commerce) | ||
| glacial acetic acid (Optima grade) | Fisher Scientific (www.Fishersci.com) | A465-250 | |
| Iron(III) Chloride Anhydrous 98%+ | Alfa Aesar (www.alfa.com) | 12357-09 | |
| lead(II) nitrate ACS grade | Avantor (www.avantormaterials.com) | 128545-50G | |
| manganese(II) chloride tetrahydrate 99.99% | Sigma-Aldrich (www.sigmaaldrich.com) | 203734-5G | |
| MassLynx 4.1 | Waters (www.waters.com) | software analysis program | |
| nickel chloride hexahydrate 99.99% | Sigma-Aldrich (www.sigmaaldrich.com) | 203866-5G | |
| poly-DL-alanine | Sigma-Aldrich (www.sigmaaldrich.com) | P9003-25MG | |
| silver nitrate 99.9%+ | Alfa Aesar (www.alfa.com) | 11414-06 | |
| Waters Synapt G1 HDMS | Waters (www.waters.com) | quadrupole - ion mobility- time-of-flight mass spectrometer | |
| zinc chloride anhydrous | Alfa Aesar (www.alfa.com) | A16281 |
Referanslar
- Dudev, T., Lim, C. Competition among Metal Ions for Protein Binding Sites: Determinants of Metal Ion Selectivity in Proteins. Chemical Reviews. 114 (1), 538-556 (2014).
- Sovago, I., Kallay, C., Varnagy, K. Peptides as complexing agents: Factors influencing the structure and thermodynamic stability of peptide complexes. Coordination Chemistry Reviews. 256 (19-20), 2225-2233 (2012).
- Sóvágó, I., Várnagy, K., Lihi, N., Grenács, &. #. 1. 9. 3. ;. Coordinating properties of peptides containing histidyl residues. Coordination Chemistry Reviews. 327, 43-54 (2016).
- Rubino, J. T., Franz, K. J. Coordination chemistry of copper proteins: How nature handles a toxic cargo for essential function. Journal of Inorganic Biochemistry. 107 (1), 129-143 (2012).
- Robinson, N. J., Winge, D. R. Copper Metallochaperones . Annual Review of Biochemistry. 79, 537-562 (2010).
- Scheiber, I. F., Mercer, J. F. B., Dringen, R. Metabolism and functions of copper in brain. Progress in Neurobiology. 116, 33-57 (2014).
- Tisato, F., Marzano, C., Porchia, M., Pellei, M., Santini, C. Copper in Diseases and Treatments, and Copper-Based Anticancer Strategies. Medicinal Research Reviews. 30 (4), 708-749 (2010).
- Millhauser, G. L. Copper and the prion protein: Methods, structures, function, and disease. Annual Review of Physical Chemistry. 58, 299-320 (2007).
- Arena, G., Pappalardo, G., Sovago, I., Rizzarelli, E. Copper(II) interaction with amyloid-beta: Affinity and speciation. Coordination Chemistry Reviews. 256 (1-2), 3-12 (2012).
- Kim, H. J., et al. Methanobactin, a copper-acquisition compound from methane-oxidizing bacteria. Science. 305 (5690), 1612-1615 (2004).
- Di Spirito, A. A., et al. Methanobactin and the link between copper and bacterial methane oxidation. Microbiology Molecular Biology Reviews. 80 (2), 387-409 (2016).
- Kenney, G. E., Rosenzweig, A. C. Chemistry and biology of the copper chelator methanobactin. ACS Chemical Biology. 7 (2), 260-268 (2012).
- Summer, K. H., et al. The biogenic methanobactin is an effective chelator for copper in a rat model for Wilson disease. Journal of Trace Elements in Medicine and Biology. 25 (1), 36-41 (2011).
- Hachmoeller, O., et al. Investigating the influence of standard staining procedures on the copper distribution and concentration in Wilson's disease liver samples by laser ablation-inductively coupled plasma-mass spectrometry. Journal of Trace Elements in Medicine and Biology. 44, 71-75 (2017).
- Hachmoeller, O., et al. Spatial investigation of the elemental distribution in Wilson's disease liver after D-penicillamine treatment by LA-ICP-MS. Journal of Trace Elements in Medicine and Biology. 44, 26-31 (2017).
- Hachmoeller, O., et al. Element bioimaging of liver needle biopsy specimens from patients with Wilson's disease by laser ablation-inductively coupled plasma-mass spectrometry. Journal of Trace Elements in Medicine and Biology. 35, 97-102 (2016).
- Mueller, J. C., Lichtmannegger, J., Zischka, H., Sperling, M., Karst, U. High spatial resolution LA-ICP-MS demonstrates massive liver copper depletion in Wilson disease rats upon Methanobactin treatment. Journal of Trace Elements in Medicine and Biology. 49, 119-127 (2018).
- Choi, D. W., et al. Spectral and thermodynamic properties of Ag(I), Au(III), Cd(II), Co(II), Fe(III), Hg(II), Mn(II), Ni(II), Pb(II), U(IV), and Zn(II) binding by methanobactin from Methylosinus trichosporium OB3b. Journal of Inorganic Biochemistry. 100, 2150-2161 (2006).
- McCabe, J. W., Vangala, R., Angel, L. A. Binding Selectivity of Methanobactin from Methylosinus trichosporium OB3b for Copper(I), Silver(I), Zinc(II), Nickel(II), Cobalt(II), Manganese(II), Lead(II), and Iron(II). Journal of the American Society of Mass Spectrometry. 28, 2588-2601 (2017).
- Sesham, R., et al. The pH dependent Cu(II) and Zn(II) binding behavior of an analog methanobactin peptide. European Journal of Mass Spectrometry. 19 (6), 463-473 (2013).
- Wagoner, S. M., et al. The multiple conformational charge states of zinc(II) coordination by 2His-2Cys oligopeptide investigated by ion mobility - mass spectrometry, density functional theory and theoretical collision cross sections. Journal of Mass Spectrom. 51 (12), 1120-1129 (2016).
- Bandow, N. L., et al. Isolation of methanobactin from the spent media of methane-oxidizing bacteria. Methods in Enzymology. 495, 259-269 (2011).
- Choi, D. W., et al. Spectral and thermodynamic properties of methanobactin from γ-proteobacterial methane oxidizing bacteria: a case for copper competition on a molecular level. Journal of Inorganic Biochemistry. 104 (12), 1240-1247 (2010).
- Pringle, S. D., et al. An investigation of the mobility separation of some peptide and protein ions using a new hybrid quadrupole/travelling wave IMS/oa-ToF instrument. International Journal of Mass Spectrometry. 261 (1), 1-12 (2007).
- Forsythe, J. G., et al. Collision cross section calibrants for negative ion mode traveling wave ion mobility-mass spectrometry. Analyst. 14 (20), 6853-6861 (2015).
- Allen, S. J., Giles, K., Gilbert, T., Bush, M. F. Ion mobility mass spectrometry of peptide, protein, and protein complex ions using a radio-frequency confining drift cell. Analyst. 141 (3), 884-891 (2016).
- Bush, M. F., Campuzano, I. D. G., Robinson, C. V. Ion Mobility Mass Spectrometry of Peptide Ions: Effects of Drift Gas and Calibration Strategies. Analytical Chemistry. 84 (16), 7124-7130 (2012).
- Salbo, R., et al. Traveling-wave ion mobility mass spectrometry of protein complexes: accurate calibrated collision cross-sections of human insulin oligomers. Rapid Communications in Mass Spectrometry. 26 (10), 1181-1193 (2012).
- Smith, D. P., et al. Deciphering drift time measurements from travelling wave ion mobility spectrometry-mass spectrometry studies. European Journal of Mass Spectrometry. 15 (2), 113-130 (2009).
- Becke, A. D. Density-functional thermochemistry. III. The role of exact exchange. Journal of Chemical Physics. 98 (7), 5648-5652 (1993).
- Dunning, T. H., Hay, P. J. Gaussian basis sets for molecular calculations. Modern Theoretical Chemistry. 3, 1-27 (1977).
- Hay, P. J., Wadt, W. R. Ab initio effective core potentials for molecular calculations. Potentials for potassium to gold including the outermost core orbitals. Journal of Chemical Physics. 82 (1), 299-310 (1985).
- Hay, P. J., Wadt, W. R. Ab initio effective core potentials for molecular calculations. Potentials for the transition metal atoms scandium to mercury. Journal of Chemical Physics. 82 (1), 270-283 (1985).
- Wadt, W. R., Hay, P. J. Ab initio effective core potentials for molecular calculations. Potentials for main group elements sodium to bismuth. Journal of Chemical Physics. 82 (1), 284-298 (1985).
- . Gaussian 09, Revision C.01. Gaussian, Inc. , (2012).
- Wyttenbach, T., von Helden, G., Batka, J. J., Carlat, D., Bowers, M. T. Effect of the long-range potential on ion mobility measurements. Journal of the American Society of Mass Spectrometry. 8 (3), 275-282 (1997).
- Choi, D., et al. Redox activity and multiple copper(I) coordination of 2His-2Cys oligopeptide. Journal of Mass Spectrometry. 50 (2), 316-325 (2015).
- Rigo, A., et al. Interaction of copper with cysteine: stability of cuprous complexes and catalytic role of cupric ions in anaerobic thiol oxidation. Journal of Inorganic Biochemistry. 98 (9), 1495-1501 (2004).
- Vytla, Y., Angel, L. A. Applying Ion Mobility-Mass Spectrometry Techniques for Explicitly Identifying the Products of Cu(II) Reactions of 2His-2Cys Motif Peptides. Analytical Chemistry. 88 (22), 10925-10932 (2016).
- Choi, D., Sesham, R., Kim, Y., Angel, L. A. Analysis of methanobactin from Methylosinus trichosporium OB3b via ion mobility mass spectrometry. European Journal of Mass Spectrometry. 18 (6), 509-520 (2012).
- Martell, A. E., Motekaitis, R. J. NIST Standard Reference Database 46. Institute of Standards and Technology. , (2001).
- Pesch, M. L., Christl, I., Hoffmann, M., Kraemer, S. M., Kretzschmar, R. Copper complexation of methanobactin isolated from Methylosinus trichosporium OB3b: pH-dependent speciation and modeling. Journal of Inorganic Biochemistry. 116, 55-62 (2012).
- Amin, E. A., Truhlar, D. G. Zn Coordination Chemistry: Development of Benchmark Suites for Geometries, Dipole Moments, and Bond Dissociation Energies and Their Use To Test and Validate Density Functionals and Molecular Orbital Theory. Journal of Chemical Theory and Computation. 4 (1), 75-85 (2008).
- Sorkin, A., Truhlar, D. G., Amin, E. A. Energies, Geometries, and Charge Distributions of Zn Molecules, Clusters, and Biocenters from Coupled Cluster, Density Functional, and Neglect of Diatomic Differential Overlap Models. Journal of Chemical Theory and Computation. 5 (5), 1254-1265 (2009).
- Lillo, V., Galan-Mascaros, J. R. Transition metal complexes with oligopeptides: single crystals and crystal structures. Dalton Transactions. 43 (26), 9821-9833 (2014).
- Choutko, A., van Gunsteren, W. F. Conformational Preferences of a beta-Octapeptide as Function of Solvent and Force-Field Parameters. Helvetica Chimica Acta. 96 (2), 189-200 (2013).
- Angel, L. A. Study of metal ion labeling of the conformational and charge states of lysozyme by ion mobility mass spectrometry. European Journal of Mass Spectrometry. 17 (3), 207-215 (2011).
- Kelso, C., Rojas, J. D., Furlan, R. L. A., Padilla, G., Beck, J. L. Characterisation of anthracyclines from a cosmomycin D-producing species of Streptomyces by collisionally-activated dissociation and ion mobility mass spectrometry. European Journal of Mass Spectrometry. 15 (2), 73-81 (2009).
- El Ghazouani, A., et al. Copper-binding properties and structures of methanobactins from Methylosinus trichosporium OB3b. Inorganic Chemistry. 50 (4), 1378-1391 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır