Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Ионная мобильность-массовая спектрометрия Методы для определения структуры и механизмов распознавания ионов металла и Redox деятельности металлических связывая олигопептиды
В этой статье
Резюме
Ионно-массовая спектрометрия и методы молекулярного моделирования могут характеризовать селективное металлическое хелативирование производительности разработанных металлосвязывающих пептидов и медно-связывающего пептида метанобактина. Разработка новых классов металлических хелатных пептидов поможет привести к терапии заболеваний, связанных с дисбалансом ионов металла.
Аннотация
Ионизация электроспрея (ESI) может передавать пептидный или пептидный комплекс в газофазный комплекс, сохраняя при этом его массу, общий заряд, металлосвязывающие взаимодействия и конформационную форму. Соединение ESI с ионной массой-спектрометрией (IM-MS) обеспечивает инструментальную технику, которая позволяет одновременно измерять массу пептида к заряду (м/з) и сечение столкновения (CCS), которые относятся к его стойхиометрии, состоянию протонации, и конформационная форма. Общий заряд пептидного комплекса контролируется протонацией 1) кислой пептидной и основных участков пептида и 2) состояния окисления металлического иона (ы). Таким образом, общее состояние заряда комплекса является функцией рН раствора, который влияет на пептиды металлических ионных связывающих сродства. Для анализа ESI-IM-MS решения пептида и ионов металла готовятся из растворов только для водных, при этом рН регулируется с разбавленной aqueous уксусной кислотой или гидроксидом аммония. Это позволяет определить зависимость от рН и селективность ионов металла для конкретного пептида. Кроме того, м/з и CCS пептидного комплекса могут быть использованы с помощью молекулярного моделирования B3LYP/LanL2D, чтобы различить связывающие участки координации иона металла и третичной структуры комплекса. Результаты показывают, как ESI-IM-MS может охарактеризовать селективное хелатирование работы набора альтернативных пептидов метанобактина и сравнить их с медно-связывающим пептидным метанобактином.
Введение
Ионы меди и цинка имеют важное значение для живых организмов и имеют решающее значение для процессов, включая окислительную защиту, рост тканей, дыхание, холестерин, метаболизм глюкозы и чтение генома1. Для обеспечения этих функций, такие группы, как тиолат Cys, имидазол его2,3, (более редко) тиоэтер метионина, и карбоксилат глю и Асп выборочно включать металлы в качестве кофакторов в активных местах металлургии. Сходство этих координационных групп поднимает интригующий вопрос о том, как Его и Кис лиганды выборочно включать либо Cu (I/II) или N (II) для обеспечения правильного функционирования.
Селективная привязка часто достигается путем приобретения и оборота пептидов, которые контролируют концентрации ионов Cu (I/II)4. Cu(I/II) является высокореактивной и вызывает окислительный ущерб или приключений связывания с ферментами, так что его свободная концентрация жестко регулируется медных сопровождающих и медно-регулирующих белков, которые транспортируют его безопасно в различные места в клетке и плотно контролировать свой гомеостаз5,6. Нарушение метаболизма меди или гомеостаза непосредственно связано с болезнью Менкеса и Уилсона7, а также рак7 и нервные расстройства, такие как прион8 и болезнь Альцгеймера9.
Болезнь Уилсона связана с повышением уровня меди в глазах, печени и участках мозга, где редокс-реакции Cu (I/II) производят реактивные виды кислорода, вызывая гепатомлентику и неврологическую дегенерацию. Существующие хелатотерапии являются небольшой тиол аминокислоты пеницилламин и триэтиленетрамин. Кроме того, метанотрофных медь приобретения пептиды метанобатактина (мб)10,11 экспонат терапевтический потенциал из-за их высокой связывающей сродство cu (I)12. Когда метанобактин (mb-OB3b) из трихоспория Methylosinus OB3b был изучен в животной модели болезни Вильсона, медь была эффективно удалена из печени и выводится через желчь13. Эксперименты in vitro подтвердили, что mb-OB3b может хеляции меди из медного металлотионеина, содержащегося в цитозоле печени13. Лазерная абляция индуктивно связаны плазменной массой спектрометрии визуализации методы исследовали пространственное распределение меди в болезни Вильсона образцы печени14,15,16 и показали, что mb-OB3b удаляет медь с короткими периодами лечения только 8 дней17.
MB-OB3b также будет связываться с другими ионами металла, включая Ag (I), Au(III), Pb (II), Mn (II), Co (II), Fe (II), Ni (II), и Зн(II)18,19. Конкуренция за физиологические Cu (I) связывания сайт выставлен ag (I), потому что он может вытеснить Cu (I) из комплекса MB-OB3b, как с Ag (I) и Ni (II) также показывает необратимые связывания мб, которые не могут быть смещены Cu (I)19. В последнее время серия альтернативных метаноактина (амб) олигопептиды с 2His-2Cys связывающий мотив были изучены20,21, и их N (II) и Cu (I/II) связывающие свойства характеризуется. Их первичные аминокислотные последовательности похожи, и все они содержат мотив 2His-2Cys, Pro и ацетилированный N-терминус. Они в основном отличаются от mb-OB3b, потому что мотив 2His-2Cys заменяет два энетиола оксазолон связывания сайтов mb-OB3b.
Ионизация электроспрея в сочетании с ионно-массовой спектрометрией (ESI-IM-MS) обеспечивает мощную инструментальную технику для определения металлосвязывающих свойств пептидов, поскольку она измеряет их массу к заряду(м/з)и столкновение поперечное сечение (CCS) при сохранении их массы, заряда и конформационной формы от фазы решения. М/з и CCS относятся к пептидам стоихиометрии, состоянию протонации и конформации. Stoichiometry определяется потому, что личность и количество каждого элемента, присутствуют в видов явно определены. Общий заряд пептидного комплекса связан с состоянием протонации кислых и основных участков и состоянием окисления металлического иона (ы). CCS дает информацию о конформиционной форме пептидного комплекса, поскольку она измеряет вращенный средний размер, который относится к третичной структуре комплекса. Общее состояние заряда комплекса также является функцией рН и влияет на металлическую ионную сродство пептида, потому что депротонированные основные или кислые участки, такие как карбоксил, его, Cys и Tyr, также являются потенциальными местами связывания металлического иона. Для анализа пептид и ион металла готовятся в водных растворах с рН, скорректированным разбавленной aqueous уксусной кислотой или гидроксидом аммония. Это позволяет определить зависимость от рН и селективность ионов металла для пептида. Кроме того, м/з и CCS, определенные ESI-IM-MS, могут быть использованы с помощью молекулярного моделирования B3LYP/LanL2D, чтобы обнаружить тип координации ионов металла и третичной структуры комплекса. Результаты, приведенные в этой статье, показывают, как ESI-IM-MS может охарактеризовать селективную хелатную производительность набора пептидов amb и сравнить их с медно-связывающим пептидом mb-OB3b.
протокол
1. Подготовка реагентов
- Культура Метилосинус трихоспорий OB3b, изолировать Cu (I) бесплатно mb-OB3b18,22,23, заморозить сухой образец и хранить при -80 градусов по Цельсию до использования.
- Синтезировать амб пептиды (ямт;98% чистоты для amb1, amb 2 , amb4;
- Покупка хлорида из 98% чистоты марганца (II), хлорида кобальта (II), хлорида никле (II), хлорида меди (II), медь (II) нитрата, серебра (I) нитрата, хлорида цинка (II), хлорида железа (III) хлорида и свинца (II) хлорида.
- Приобретите поли-DL-аланиновые полимеры, используемые в качестве калибрантов для измерения поперечных сечений видов amb и hPLC класса или более высокого гидроксида аммония, ледниковой уксусной кислоты и ацетонитрила.
2. Подготовка биржевого раствора
-
Пептидный стоковый раствор
- Взвесьте точно, используя по крайней мере три значительные цифры, масса 10,0-20,0 мг mb-OB3b или amb в 1,7 мл пластикового флакона.
ПРИМЕЧАНИЕ: Взвешенная масса должна дать либо 12,5 мМ, либо 1,25 мМ, в зависимости от растворимости пептида, когда добавляется 1,00 мл деионированной (DI) воды. - Используя трубу, добавьте 1,00 мл деионированной воды (17,8 МТ см) к взвешенному пептидному образцу, чтобы дать раствор 12,5 мМ или 1,25 мм. Поместите крышку надежно и тщательно перемешать с по крайней мере 20 инверсий.
- Использование микропипета распределять 50,0 qL aliquots из пептида образца в индивидуально помечены 1,5 мл флаконов и хранить их на -80 градусов по Цельсию до использования.
- Взвесьте точно, используя по крайней мере три значительные цифры, масса 10,0-20,0 мг mb-OB3b или amb в 1,7 мл пластикового флакона.
-
Металлические ионные фондовые решения
- Взвесьте точно, используя по крайней мере три значимые цифры, масса 10,0-30,0 мг хлорида металла или нитрата серебра в 1,7 мл флакона.
ПРИМЕЧАНИЕ: Взвешенная масса должна дать 125 мМ при добавлении 1,00 мл воды DI. - Добавьте 1,00 мл воды DI в взвешенный металлический образец в флакон 1,7 мл, чтобы дать раствор 125 мМ. Поместите крышку надежно и тщательно перемешать с по крайней мере 20 инверсий.
- Взвесьте точно, используя по крайней мере три значимые цифры, масса 10,0-30,0 мг хлорида металла или нитрата серебра в 1,7 мл флакона.
- Растворы гидроксида аммония:подготовьте раствор уксусной кислоты 1,0 м, разбавив 57 л уксусной кислоты раствором с водой DI до конечного объема 1,00 мл. Подготовьте раствор гидроксида аммония 1,0 М, разбавив 90 л гидроксида аммония с водой DI до конечного объема 1,00 мл. Сделайте два последовательных разбавления каждого раствора, принимая 100 л растворов 1,0 М для подготовки 0,10 М и 0,010 М растворов уксусной кислоты и гидроксида аммония.
- Поли-DL-аланина бульон решение: подготовить поли-DL-аланина (PA) весом 1,0 мг ПА и растворения в 1,0 мл воды DI дать 1000 промилле. Тщательно перемешайте. Используя микропипелет, распределите 50,0 аликотов, и поместите каждый в 1,7 мл флакон и хранить при -80 градусов по Цельсию.
3. Анализ электроспрей-ионной мобильности-массы спектрометрии
- Очистите ESI вход трубки и капиллярии иглы тщательно около 500 л 0,1 М ледниковой уксусной кислоты, 0,1 М гидроксид аммония, и, наконец, DI воды.
- Оттепель 50,0 л аликут 1000 промилле PA бульона раствора и разбавить его 450 л воды DI, чтобы дать 100 промилле PA. Pipet 100.0 л этого раствора и разбавить его до 1,00 мл с 500 л воды DI и 500 л ацетонитрила, чтобы дать 10 ppm PA раствор.
- Соберите отрицательные и положительные ионные спектры IM-MS 10 ppm PA решения в течение 10 минут каждый с помощью родной ESI-IM-MS условиях, описанных в разделе обсуждения.
- Оттепель 50,0 мл аликут 12,5 мм или 1,25 мм amb бульонного раствора и сделать последовательные разбавления с di воды, чтобы дать окончательную концентрацию 0,125 мм amb. Тщательно перемешайте каждое разбавление.
- Пипетка 100,0 л металлического ионного бульона 125 мм, поместите во флакон 1,7 мл и разбавьте до 1,00 мл с водой DI, чтобы дать 12,5 мм металлического иона. Повторите еще два последовательных разбавления, чтобы дать окончательную концентрацию иона 0,125 мМ. Тщательно перемешайте каждое разбавление.
- Пипет капот 200,0 л из 0,125 мм в флакон 1,7 мл, разбавьте 500 л воды DI и тщательно перемешайте раствор.
- Отрегулируйте рН образца до 3,0, добавив 50 кл. раствора уксусной кислоты.
- Добавьте 200,0 л металлического иона 0,125 мМ в скорректированный рН образец. Добавьте DI воду, чтобы получить окончательный объем 1,00 мл образца, тщательно перемешайте и дайте образцу уравновеситься в течение 10 минут на RT.
- Используя тупой нос шприц принять 500 зл и собирать отрицательные и положительные ионные ES-IM-MS спектра в течение 5 минут каждый. Используйте оставшиеся 500 л образца для записи его окончательного рН с помощью откалиброватого микро-рН электрода.
- Повторите шаги 3.6-3.9, при изменении шага 3.7 для регулировки рН до 4.0, 5.0, 6.0, 7.0, 8.0, 9.0, или 10.0 путем добавления новых томов растворов 0.010 M, 0.10 M, или 1.0 M уксусной кислоты или гидроксида аммония.
- Соберите отрицательные и положительные спектры ESI-IM-MS из 10 ppm PA решение для 10 минут каждый.
4. Подготовка металлического иона титрации образцов амба
- Следуйте шагам, описанным в шагах 3.1-3.5.
- Пипет капот 200,0 л из 0,125 мм в флакон 1,7 мл, разбавьте 500,0 л воды DI и тщательно перемешайте раствор.
- Отрегулируйте рН образца до рН 9,0, добавив 80 qL раствора гидроксида аммония 0,010 М.
- Добавьте 28 мл металлического ионного раствора 0,125 мМ, чтобы дать 0,14 молярных эквивалента металлического иона, добавьте воду DI, чтобы сделать окончательный объем образца 1,00 мл, тщательно перемешайте и дайте образцу уравновесить в течение 10 мин на РТ.
- Использование тупого носшшшного шприца возьмите 500 зл и соберите отрицательные и положительные ионные спектры ESI-IM-MS в течение 5 мин каждый. Используйте оставшиеся 500 л образца для записи его окончательного рН с помощью откалиброватого микро-рН электрода.
- Повторите шаги 4.2-4.5, при изменении шага 4.3, чтобы добавить соответствующий объем ионного раствора 0,125 мМ, чтобы дать либо 0,28, 0,42, 0,56, 0,70, 0,84, 0,98, 1,12, 1,26, или 1,40 молярового эквивалента.
- Соберите отрицательные и положительные ионные спектры IM-MS из 10 ppm PA решение для 10 минут каждый.
5. Анализ данных титрации ESI-IM-MS pH
- Из IM-MS спектра определить, какие заряженные виды амбприсутствуют присутствуют, сопоставляя их с их теоретическими м / z изотопных моделей.
- Откройте MassLynx и нажмите на Chromatogram, чтобы открыть окно Chromatogram.
- Перейдите в меню файла и откройте для поиска и открытия файла данных IM-MS.
- Извлеките спектр IM-MS путем right-clicking и волочить через chromatogram и выпускать. Окно спектра откроется, показывая спектр IM-MS.
- В окне спектра нажмите на модели Tools и Isotope. В окне изотопного моделирования введите молекулярную формулу вида amb, проверьте заряженную ионную коробку Show и введите состояние заряда. Нажмите OK.
- Повторите, чтобы идентифицировать все виды в спектре IM-MS и зафиксировать их диапазон изотопов м/з.
- Для каждого вида amb, отделить любые случайные м / z видов и извлечь их время прибытия распределения (ATD) с использованием их м / z изотопных моделей для их идентификации.
- В MassLynx нажмите на DriftScope, чтобы открыть программу. В DriftScope нажмите на файл и открыть, чтобы найти и открыть файл данных IM-MS.
- Используйте мышь и левый щелчок, чтобы увеличить на м / z изотопный узор видов amb.
- Используйте инструмент «Выбор» и кнопку левой мыши для выбора изотопов. Нажмите кнопку текущего выбора Accept.
- Чтобы отделить любые случайные виды м/з, используйте инструмент «Выбор» и кнопку левой мыши, чтобы выбрать время, выровненные по времени ATD, с изотопным узором видов amb. Нажмите кнопку текущего выбора Accept.
- Для экспорта ATD, перейдите в файл Экспорт в MassLynx,затем выберите Сохранить время дрейфа и сохранить файл в соответствующей папке.
- Определите центроид ATD и интегрируйте область под кривой ATD как измерение населенности вида.
- В окне Chromatogram MassLynx открывается сохраненный экспортированный файл. Нажмите на процесс Интеграция из меню. Проверьте apexTrack Пик Интеграция поле и нажмите OK.
- Запись центроида ATD (tA)и интегрированной области, как показано на окне Chromatogram. Повторите для всех сохраненных amb и PA IM-MS файлов данных.
- Используйте интегрированный ATD для всех извлеченных видов амба либо положительных или отрицательных ионов в каждой точке титрования, чтобы нормализовать относительную процентную шкалу.
- Введите идентичности видов amb и их интегрированной ATD на каждом рН в электронную таблицу.
- Для каждого рН используйте сумму интегрированных ATD, чтобы нормализовать ATD отдельного amb в процентной шкале.
- Участок процент интенсивности каждого вида amb против рН в графике, чтобы показать, как популяция каждого вида варьируется в зависимости от рН.
6. Поперечные сечения столкновения
- Используя электронную таблицу, преобразуйте CCS (я) ПА отрицательных25,26 и положительных27 ионов, измеренных в буферном газеОн 28, в исправленный CCS(c)с помощью уравнения 1 ниже, где: z ионный заряд; e c - электрон-заряд (1.602-10-19 C); м N 2 - масса газа N2 (Da); и мионная ионная масса. 29
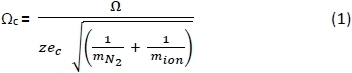
- Преобразуйте среднее время прибытия (tA) калибрантов и видов amb в время дрейфа (tD)используя уравнение 2 ниже, где: c - увеличенный коэффициент задержки цикла пошлины (1.41), и m/z масса-к-заряда иона пептида.

- Участок PA калибрантов 'тD против их Qc. Затем, используя регрессию наименьших квадратов в соответствии с уравнением 3, показанную ниже, определите значения A' и B, где: A' является коррекцией параметров температуры, давления и электрического поля; и B компенсирует нелинейный эффект устройства для вхасжей.

- Используя эти значения A' и B и значение centroid tD от ATD амбов, определяющих их значениеq c с помощью Equation 3 и их значение с помощью Equation 1. Этот метод обеспечивает CCS для пептидных видов с оценками абсолютные ошибки около 2%25,26,27.
7. Вычислительные методы
- Используйте b3LYP / LanL2D уровне теории, состоящий из Беке 3-параметр гибридных функций30 и Даннинг базы набор31 и электрон потенциалов ядра32,33,34, чтобы найти геометрические оптимизированные конформисты для всех возможных типов координации наблюдаемых видов м/з 35.
ПРИМЕЧАНИЕ: Для получения подробной информации о том, как построить и представить расчеты относятся к использованию GaussView в дополнительном файле. - Сравните предсказанную свободную энергию каждого из конформистов и вычислите их теоретические УХУ с помощью метода Ионного леннарда-Джонса (LJ) из программы Sigma36.
- Из самых низких свободных энергии конформисты определить, какой конформер экспонатов LJ CCS, который согласен с IM-MS измеряется CCS для определения третичной структуры и типа координации для конформаторов наблюдается в эксперименте.
Результаты
Металлический переплетамб1
IM-MS исследование20 из amb1 (Рисунок 1A) показали, что как медь и цинк ионов связаны с amb1 в рН-зависимым образом (Рисунок 2). Тем не менее, медь и цинк связаны с amb1 через различные ...
Обсуждение
Критические шаги: сохранение поведения на фазе решения для обследования через ESI-IM-MS
Родные инструментальные настройки ESI должны быть использованы, которые сохраняют пептид ытоихиометрии, состояние заряда и конформационную структуру. Для местных условий необходимо оптимиз?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Этот материал основан на работе, поддерживаемой Национальным научным фондом в соответствии с 1764436, поддержкой инструментов NSF (MRI-0821247), Фондом Уэлча (T-0014) и вычислительными ресурсами Министерства энергетики (TX-W-20090427-0004-50) и L3 Communications . Мы благодарим группу Бауэра Калифорнийского университета - Санта-Барбара за то, что они поделились программой Sigma и Айобами Илесанми за демонстрацию техники в видео.
Материалы
| Name | Company | Catalog Number | Comments |
| acetonitrile HPLC-grade | Fisher Scientific (www.Fishersci.com) | A998SK-4 | |
| ammonium hydroxide (trace metal grade) | Fisher Scientific (www.Fishersci.com) | A512-P500 | |
| cobalt(II) chloride hexahydrate 99.99% | Sigma-Aldrich (www.sigmaaldrich.com) | 255599-5G | |
| copper(II) chloride 99.999% | Sigma-Aldrich (www.sigmaaldrich.com) | 203149-10G | |
| copper(II) nitrate hydrate 99.99% | Sigma-Aldrich (www.sigmaaldrich.com) | 229636-5G | |
| designed amb1,2,3,4,5,6,7 peptides | Neo BioLab (neobiolab.com) | designed peptides were synthized by order | |
| designed amb5B,C,D,E,F peptides | PepmicCo (www.pepmic.com) | designed peptides were synthized by order | |
| Driftscope 2.1 software program | Waters (www.waters.com) | software analysis program | |
| Freeze-dried, purified, Cu(I)-free mb-OB3b | cultured and isolated in the lab of Dr. DongWon Choi (Biology Department, Texas A&M-Commerce) | ||
| glacial acetic acid (Optima grade) | Fisher Scientific (www.Fishersci.com) | A465-250 | |
| Iron(III) Chloride Anhydrous 98%+ | Alfa Aesar (www.alfa.com) | 12357-09 | |
| lead(II) nitrate ACS grade | Avantor (www.avantormaterials.com) | 128545-50G | |
| manganese(II) chloride tetrahydrate 99.99% | Sigma-Aldrich (www.sigmaaldrich.com) | 203734-5G | |
| MassLynx 4.1 | Waters (www.waters.com) | software analysis program | |
| nickel chloride hexahydrate 99.99% | Sigma-Aldrich (www.sigmaaldrich.com) | 203866-5G | |
| poly-DL-alanine | Sigma-Aldrich (www.sigmaaldrich.com) | P9003-25MG | |
| silver nitrate 99.9%+ | Alfa Aesar (www.alfa.com) | 11414-06 | |
| Waters Synapt G1 HDMS | Waters (www.waters.com) | quadrupole - ion mobility- time-of-flight mass spectrometer | |
| zinc chloride anhydrous | Alfa Aesar (www.alfa.com) | A16281 |
Ссылки
- Dudev, T., Lim, C. Competition among Metal Ions for Protein Binding Sites: Determinants of Metal Ion Selectivity in Proteins. Chemical Reviews. 114 (1), 538-556 (2014).
- Sovago, I., Kallay, C., Varnagy, K. Peptides as complexing agents: Factors influencing the structure and thermodynamic stability of peptide complexes. Coordination Chemistry Reviews. 256 (19-20), 2225-2233 (2012).
- Sóvágó, I., Várnagy, K., Lihi, N., Grenács, &. #. 1. 9. 3. ;. Coordinating properties of peptides containing histidyl residues. Coordination Chemistry Reviews. 327, 43-54 (2016).
- Rubino, J. T., Franz, K. J. Coordination chemistry of copper proteins: How nature handles a toxic cargo for essential function. Journal of Inorganic Biochemistry. 107 (1), 129-143 (2012).
- Robinson, N. J., Winge, D. R. Copper Metallochaperones . Annual Review of Biochemistry. 79, 537-562 (2010).
- Scheiber, I. F., Mercer, J. F. B., Dringen, R. Metabolism and functions of copper in brain. Progress in Neurobiology. 116, 33-57 (2014).
- Tisato, F., Marzano, C., Porchia, M., Pellei, M., Santini, C. Copper in Diseases and Treatments, and Copper-Based Anticancer Strategies. Medicinal Research Reviews. 30 (4), 708-749 (2010).
- Millhauser, G. L. Copper and the prion protein: Methods, structures, function, and disease. Annual Review of Physical Chemistry. 58, 299-320 (2007).
- Arena, G., Pappalardo, G., Sovago, I., Rizzarelli, E. Copper(II) interaction with amyloid-beta: Affinity and speciation. Coordination Chemistry Reviews. 256 (1-2), 3-12 (2012).
- Kim, H. J., et al. Methanobactin, a copper-acquisition compound from methane-oxidizing bacteria. Science. 305 (5690), 1612-1615 (2004).
- Di Spirito, A. A., et al. Methanobactin and the link between copper and bacterial methane oxidation. Microbiology Molecular Biology Reviews. 80 (2), 387-409 (2016).
- Kenney, G. E., Rosenzweig, A. C. Chemistry and biology of the copper chelator methanobactin. ACS Chemical Biology. 7 (2), 260-268 (2012).
- Summer, K. H., et al. The biogenic methanobactin is an effective chelator for copper in a rat model for Wilson disease. Journal of Trace Elements in Medicine and Biology. 25 (1), 36-41 (2011).
- Hachmoeller, O., et al. Investigating the influence of standard staining procedures on the copper distribution and concentration in Wilson's disease liver samples by laser ablation-inductively coupled plasma-mass spectrometry. Journal of Trace Elements in Medicine and Biology. 44, 71-75 (2017).
- Hachmoeller, O., et al. Spatial investigation of the elemental distribution in Wilson's disease liver after D-penicillamine treatment by LA-ICP-MS. Journal of Trace Elements in Medicine and Biology. 44, 26-31 (2017).
- Hachmoeller, O., et al. Element bioimaging of liver needle biopsy specimens from patients with Wilson's disease by laser ablation-inductively coupled plasma-mass spectrometry. Journal of Trace Elements in Medicine and Biology. 35, 97-102 (2016).
- Mueller, J. C., Lichtmannegger, J., Zischka, H., Sperling, M., Karst, U. High spatial resolution LA-ICP-MS demonstrates massive liver copper depletion in Wilson disease rats upon Methanobactin treatment. Journal of Trace Elements in Medicine and Biology. 49, 119-127 (2018).
- Choi, D. W., et al. Spectral and thermodynamic properties of Ag(I), Au(III), Cd(II), Co(II), Fe(III), Hg(II), Mn(II), Ni(II), Pb(II), U(IV), and Zn(II) binding by methanobactin from Methylosinus trichosporium OB3b. Journal of Inorganic Biochemistry. 100, 2150-2161 (2006).
- McCabe, J. W., Vangala, R., Angel, L. A. Binding Selectivity of Methanobactin from Methylosinus trichosporium OB3b for Copper(I), Silver(I), Zinc(II), Nickel(II), Cobalt(II), Manganese(II), Lead(II), and Iron(II). Journal of the American Society of Mass Spectrometry. 28, 2588-2601 (2017).
- Sesham, R., et al. The pH dependent Cu(II) and Zn(II) binding behavior of an analog methanobactin peptide. European Journal of Mass Spectrometry. 19 (6), 463-473 (2013).
- Wagoner, S. M., et al. The multiple conformational charge states of zinc(II) coordination by 2His-2Cys oligopeptide investigated by ion mobility - mass spectrometry, density functional theory and theoretical collision cross sections. Journal of Mass Spectrom. 51 (12), 1120-1129 (2016).
- Bandow, N. L., et al. Isolation of methanobactin from the spent media of methane-oxidizing bacteria. Methods in Enzymology. 495, 259-269 (2011).
- Choi, D. W., et al. Spectral and thermodynamic properties of methanobactin from γ-proteobacterial methane oxidizing bacteria: a case for copper competition on a molecular level. Journal of Inorganic Biochemistry. 104 (12), 1240-1247 (2010).
- Pringle, S. D., et al. An investigation of the mobility separation of some peptide and protein ions using a new hybrid quadrupole/travelling wave IMS/oa-ToF instrument. International Journal of Mass Spectrometry. 261 (1), 1-12 (2007).
- Forsythe, J. G., et al. Collision cross section calibrants for negative ion mode traveling wave ion mobility-mass spectrometry. Analyst. 14 (20), 6853-6861 (2015).
- Allen, S. J., Giles, K., Gilbert, T., Bush, M. F. Ion mobility mass spectrometry of peptide, protein, and protein complex ions using a radio-frequency confining drift cell. Analyst. 141 (3), 884-891 (2016).
- Bush, M. F., Campuzano, I. D. G., Robinson, C. V. Ion Mobility Mass Spectrometry of Peptide Ions: Effects of Drift Gas and Calibration Strategies. Analytical Chemistry. 84 (16), 7124-7130 (2012).
- Salbo, R., et al. Traveling-wave ion mobility mass spectrometry of protein complexes: accurate calibrated collision cross-sections of human insulin oligomers. Rapid Communications in Mass Spectrometry. 26 (10), 1181-1193 (2012).
- Smith, D. P., et al. Deciphering drift time measurements from travelling wave ion mobility spectrometry-mass spectrometry studies. European Journal of Mass Spectrometry. 15 (2), 113-130 (2009).
- Becke, A. D. Density-functional thermochemistry. III. The role of exact exchange. Journal of Chemical Physics. 98 (7), 5648-5652 (1993).
- Dunning, T. H., Hay, P. J. Gaussian basis sets for molecular calculations. Modern Theoretical Chemistry. 3, 1-27 (1977).
- Hay, P. J., Wadt, W. R. Ab initio effective core potentials for molecular calculations. Potentials for potassium to gold including the outermost core orbitals. Journal of Chemical Physics. 82 (1), 299-310 (1985).
- Hay, P. J., Wadt, W. R. Ab initio effective core potentials for molecular calculations. Potentials for the transition metal atoms scandium to mercury. Journal of Chemical Physics. 82 (1), 270-283 (1985).
- Wadt, W. R., Hay, P. J. Ab initio effective core potentials for molecular calculations. Potentials for main group elements sodium to bismuth. Journal of Chemical Physics. 82 (1), 284-298 (1985).
- . Gaussian 09, Revision C.01. Gaussian, Inc. , (2012).
- Wyttenbach, T., von Helden, G., Batka, J. J., Carlat, D., Bowers, M. T. Effect of the long-range potential on ion mobility measurements. Journal of the American Society of Mass Spectrometry. 8 (3), 275-282 (1997).
- Choi, D., et al. Redox activity and multiple copper(I) coordination of 2His-2Cys oligopeptide. Journal of Mass Spectrometry. 50 (2), 316-325 (2015).
- Rigo, A., et al. Interaction of copper with cysteine: stability of cuprous complexes and catalytic role of cupric ions in anaerobic thiol oxidation. Journal of Inorganic Biochemistry. 98 (9), 1495-1501 (2004).
- Vytla, Y., Angel, L. A. Applying Ion Mobility-Mass Spectrometry Techniques for Explicitly Identifying the Products of Cu(II) Reactions of 2His-2Cys Motif Peptides. Analytical Chemistry. 88 (22), 10925-10932 (2016).
- Choi, D., Sesham, R., Kim, Y., Angel, L. A. Analysis of methanobactin from Methylosinus trichosporium OB3b via ion mobility mass spectrometry. European Journal of Mass Spectrometry. 18 (6), 509-520 (2012).
- Martell, A. E., Motekaitis, R. J. NIST Standard Reference Database 46. Institute of Standards and Technology. , (2001).
- Pesch, M. L., Christl, I., Hoffmann, M., Kraemer, S. M., Kretzschmar, R. Copper complexation of methanobactin isolated from Methylosinus trichosporium OB3b: pH-dependent speciation and modeling. Journal of Inorganic Biochemistry. 116, 55-62 (2012).
- Amin, E. A., Truhlar, D. G. Zn Coordination Chemistry: Development of Benchmark Suites for Geometries, Dipole Moments, and Bond Dissociation Energies and Their Use To Test and Validate Density Functionals and Molecular Orbital Theory. Journal of Chemical Theory and Computation. 4 (1), 75-85 (2008).
- Sorkin, A., Truhlar, D. G., Amin, E. A. Energies, Geometries, and Charge Distributions of Zn Molecules, Clusters, and Biocenters from Coupled Cluster, Density Functional, and Neglect of Diatomic Differential Overlap Models. Journal of Chemical Theory and Computation. 5 (5), 1254-1265 (2009).
- Lillo, V., Galan-Mascaros, J. R. Transition metal complexes with oligopeptides: single crystals and crystal structures. Dalton Transactions. 43 (26), 9821-9833 (2014).
- Choutko, A., van Gunsteren, W. F. Conformational Preferences of a beta-Octapeptide as Function of Solvent and Force-Field Parameters. Helvetica Chimica Acta. 96 (2), 189-200 (2013).
- Angel, L. A. Study of metal ion labeling of the conformational and charge states of lysozyme by ion mobility mass spectrometry. European Journal of Mass Spectrometry. 17 (3), 207-215 (2011).
- Kelso, C., Rojas, J. D., Furlan, R. L. A., Padilla, G., Beck, J. L. Characterisation of anthracyclines from a cosmomycin D-producing species of Streptomyces by collisionally-activated dissociation and ion mobility mass spectrometry. European Journal of Mass Spectrometry. 15 (2), 73-81 (2009).
- El Ghazouani, A., et al. Copper-binding properties and structures of methanobactins from Methylosinus trichosporium OB3b. Inorganic Chemistry. 50 (4), 1378-1391 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены