A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تقنيات قياس الطيف الكتلي للتنقل من أيون لتحديد بنية وآليات التعرف على الأيون المعدني ونشاط الأكسدة من Oligopeptides التجليد المعدني
In This Article
Summary
يمكن أن يتسم قياس الطيف الكتلي للأيون وتقنيات النمذجة الجزيئية بالأداء الانتقائي للربط المعدني للببتيدات المصممة الملزمة بالمعادن والببتيد المربط بالنحاس ميثانوباكتين. تطوير فئات جديدة من الببتيدات المعدنية مخلب يساعد على أن يؤدي إلى العلاجات للأمراض المرتبطة بسوء التوازن الأيون المعادن.
Abstract
يمكن للأيونات الكهربائية (ESI) نقل الببتيد المائي المرحلة أو مجمع الببتيد إلى مرحلة الغاز مع الحفاظ على كتلته، والشحنة الإجمالية، والتفاعلات ملزمة للمعادن، والشكل المطابقة. يوفر اقتران ESI مع قياس الطيف الكتلي للتنقل أيون (IM-MS) تقنية مفيدة تسمح بالقياس المتزامن للبببببوب من الكتلة إلى الشحن (م/ض) والمقطع العرضي للتصادم (CCS) الذي يتعلق بالقياس إلى السطواط، حالة البروز، وشكل المطابقة. يتم التحكم في الشحنة الإجمالية لمجمع الببتيد من قبل protonation من 1) المواقع الحمضية والأساسية للبببتيد و 2) حالة الأكسدة من أيون (ق) المعادن. ولذلك، فإن حالة الشحن الكلي للمجمع هي وظيفة من درجة الحموضة من الحل الذي يؤثر على الببتيدات المعادن أيون تقارب ملزمة. بالنسبة لتحليلات ESI-IM-MS، يتم إعداد حلول الببتيد والأيونات المعدنية من حلول مائية فقط، مع ضبط درجة الحموضة مع حمض الخليك المائي المخفف أو هيدروكسيد الأمونيوم. وهذا يسمح للاعتماد على الحموضة وانتقائية الأيون المعدنية التي سيتم تحديدها لببتيد معين. وعلاوة على ذلك، يمكن استخدام م / ض وCCS من مجمع الببتيد مع B3LYP / LanL2DZ النمذجة الجزيئية لتمييز مواقع ملزمة لتنسيق أيون المعادن والهيكل الثالثي للمجمع. تظهر النتائج كيف يمكن لESI-IM-MS أن تميز الأداء الانتقائي لمجموعة من ببتيدات الميثانوباكتين البديلة ومقارنتها بالببتيد اتانوباكتين الملزم بالنحاس.
Introduction
أيونات النحاس والزنك ضرورية للكائنات الحية وحاسمة للعمليات بما في ذلك الحماية من الأكسدة، ونمو الأنسجة، والتنفس، والكوليسترول، والتمثيل الغذائي للجلوكوز، وقراءة الجينوم1. لتمكين هذه الوظائف، ومجموعات مثل ثيوليت من سايس، إيميدازول له2،3،(أكثر نادرا) ثيوثير من الميثيونين، وcarboxylate من غلو وAsp إدراج المعادن بشكل انتقائي كعوامل مساعدة في المواقع النشطة لل الإنزيمات المعدنية. ويثير التشابه بين مجموعات التنسيق هذه سؤالاً مثيراً للاهتمام فيما يتعلق بكيفية إدراج الأربطة له وشركة Cys بشكل انتقائي إما Cu(I/II) أو Zn(II) لضمان الأداء الصحيح.
وغالبا ما يتم تنفيذ الربط الانتقائي عن طريق اكتساب والاتجار الببتيدات، التي تسيطر على الزنك (II) أو Cu(I/II) تركيزات أيون4. Cu (I/II) هو رد فعل للغاية ويسبب الضرر التأكسدي أو الربط السبتي للإنزيمات، لذلك يتم تنظيم تركيزها الحر بإحكام من قبل مرافقي النحاس والبروتينات التي تنظم النحاس التي تنقلها بأمان إلى مواقع مختلفة في الخلية وبإحكام السيطرة على التوازن5،6. اضطراب التمثيل الغذائي للنحاس أو التوازن هو متورط مباشرة في مرض Menkes وويلسون7 وكذلك السرطانات7 والاضطرابات العصبية، مثل بريون8 ومرض الزهايمر9.
ويرتبط مرض ويلسون مع زيادة مستويات النحاس في العينين والكبد وأجزاء من الدماغ، حيث ردود فعل الأكسدة من Cu (I / II) تنتج أنواع الأكسجين التفاعلية، مما تسبب في انحطاط الكبد والعصبية. علاجات إزالة معدن ثقيل الموجودة هي الأحماض الأمينية الصغيرة ثيول بينيسيلامين وثلاثي إيثيلينتيترامين. بدلا من ذلك، والببتيدات methanotrophic النحاس اكتساب methanobactin (ميغابايت)10،11 تظهر الإمكانات العلاجية بسبب تقاربها ملزمة عالية لCu(I)12. عندما تمت دراسة ميثانوباكتين (mb-OB3b) من ميثيلوسينوس trichosporium OB3b في نموذج حيواني لمرض ويلسون، تمت إزالة النحاس بكفاءة من الكبد وتفرز من خلال الصفراء13. في التجارب المختبرية أكدت أن MB-OB3b يمكن أن مخلب النحاس من metallothionein النحاس الواردة في الكبد cytosol13. وقد بحثت تقنيات التصوير بالتحليل الطيفي الكتلي للاستئصال بالليزر في التوزيع المكاني للنحاس في عينات كبد مرض ويلسون14و15و16، وأظهرت أن mb-OB3b يزيل النحاس مع فترات معالجة قصيرة من 8 أيام فقط17.
كما سيتم ربط MB-OB3b مع أيونات معدنية أخرى، بما في ذلك Ag(I) وAu(III) وPb(II) وMn(II) و Co(II) وFe(II) وNi(II) وZn(II)18و19. يتم عرض المنافسة على موقع الربط Cu(I) الفسيولوجية من قبل Ag(I) لأنه يمكن أن تحل محل Cu(I) من مجمع mb-OB3b، مع كل من Ag(I) و Ni(II) كما تظهر ملزمة لا رجعة فيها لMb التي لا يمكن إزاحتها من قبل Cu(I)19. في الآونة الأخيرة، وقد درست سلسلة من الماثانوبكتين البديلة (أمب) oligopeptides مع عزر 2His-2Cysملزمة 20،21،والزنك (II) وCu (I / II) خصائص ملزمة تتميز. تسلسل الأحماض الأمينية الأولية متشابهة، وأنها تحتوي على كل عزر 2His-2Cys، برو وأسيتيلاتي N-terminus. وهي تختلف أساسا عن MB-OB3b لأن عزر 2His-2Cys يحل محل موقعين ربط oxazolone enethiol من MB-OB3b.
يوفر التأين الكهربائي المقترن بقياس الطيف الكتلي للأيون (ESI-IM-MS) تقنية مفيدة قوية لتحديد خصائص الببتيدات الملزمة بالمعادن لأنها تقيس من الكتلة إلى الشحن(م/ض)والاصطدام المقطع العرضي (CCS) مع الحفاظ على كتلتهم، تهمة، وشكل المطابقة من مرحلة الحل. وm /z وCCS تتعلق بالببتيدات stoichiometry، حالة البروتونيشن، وشكل المطابقة. يتم تحديد قياس التبشّر لأن هوية وعدد كل عنصر موجود في الأنواع يتم تحديده بوضوح. التهمة الإجمالية لمجمع الببتيد تتعلق بحالة البروز للمواقع الحمضية والأساسية وحالة الأكسدة لأيون (أيون) المعادن. يعطي CCS معلومات عن الشكل المطابقة لمجمع الببتيد لأنه يقيس الحجم المتوسط التناوب الذي يتعلق بالهيكل الثالث للمجمع. حالة الشحن العام للمجمع هو أيضا وظيفة من درجة الحموضة ويؤثر على تقارب ربط أيون المعادن الببتيد لأن المواقع الأساسية أو الحمضية deprotonated مثل carboxyl، له، Cys وTyr هي أيضا مواقع ملزمة المحتملة لأيون المعادن. للتحليلات، يتم إعداد الببتيد وأيون المعادن في حلول مائية مع الحموضة المعدلة عن طريق تخفيف حمض الخليك المائي أو هيدروكسيد الأمونيوم. وهذا يسمح للاعتماد على الحموضة وانتقائية الأيون المعدنية التي سيتم تحديدها للبببتيد. وعلاوة على ذلك، يمكن استخدام الـ m/z وCCS التى يحددها ESI-IM-MS مع النمذجة الجزيئية B3LYP/LanL2DZ لاكتشاف نوع تنسيق أيون المعادن والهيكل الثالثي للمجمع. النتائج المبينة في هذه المقالة تكشف كيف ESI-IM-MS يمكن أن تميز الأداء الانتقائي مخلب مجموعة من الببتيدات أمب ومقارنتها بالببتيد النحاس ملزمة MB-OB3b.
Protocol
1- إعداد الكواشف
- ثقافة ميثيلوسينوس trichosporium OB3b، عزل Cu(I)-خالية من MB-OB3b18،22،23،تجميد الجافة العينة وتخزينها في -80 درجة مئوية حتى استخدامها.
- توليف الببتيدات أمب (> 98٪ نقاء لamb1،أمب2،أمب4؛ > 70٪ نقاء لamb7)،تجميد الجافة العينات، وتخزينها في -80 درجة مئوية حتى استخدامها.
- شراء > 98٪ كلوريد المنغنيز (II)، كلوريد الكوبالت (II)، كلوريد النيكل (II)، كلوريد النحاس (II)، نترات النحاس (II)، نترات الفضة (I)، كلوريد الزنك (II)، كلوريد الحديد (III) وكلوريد الرصاص (II).
- شراء البوليمرات بولي-دل-ألانين المستخدمة ككاليبرانتس لقياس القطاعات العرضية للتصادم من الأنواع الأمب ودرجة HPLC أو أعلى هيدروكسيد الأمونيوم، وحمض الخليك الجليدي، وأسيتونيتريل.
2. إعداد حل المخزون
-
محلول أسهم الببتيد
- وزن بدقة، وذلك باستخدام ما لا يقل عن ثلاثة أرقام هامة، وكتلة من 10.0-20.0 ملغ من MB-OB3b أو amb في قارورة بلاستيكية 1.7 مل.
ملاحظة: يجب أن تنتج الكتلة وزنه إما 12.5 mM أو 1.25 mM، اعتمادا ً على ذوبان الببتيد، عند إضافة 1.00 مل من الماء منزوع الأيونات (DI). - باستخدام pipet، إضافة 1.00 مل من الماء منزوع الأيونات (> 17.8 MΩ سم) إلى عينة الببتيد وزنه لإنتاج إما 12.5 mM أو 1.25 مل الحل. ضع الغطاء بشكل آمن واخلطه جيداً مع ما لا يقل عن 20 انعكاسًا.
- باستخدام micropipet الاستغناء عن 50.0 ميكروL aliquots من عينة الببتيد إلى قارورة وصفت بشكل فردي 1.5 مل وتخزينها في -80 درجة مئوية حتى استخدامها.
- وزن بدقة، وذلك باستخدام ما لا يقل عن ثلاثة أرقام هامة، وكتلة من 10.0-20.0 ملغ من MB-OB3b أو amb في قارورة بلاستيكية 1.7 مل.
-
حلول مخزون أيون المعادن
- وزن دقيق، وذلك باستخدام ما لا يقل عن ثلاثة أرقام هامة، وكتلة 10.0-30.0 ملغ من كلوريد المعادن أو نترات الفضة في قارورة 1.7 مل.
ملاحظة: يجب أن ينتج الكتلة وزنه125 مل عند إضافة 1.00 مل من مياه DI. - إضافة 1.00 مل من المياه DI إلى عينة معدنية وزنه في قارورة 1.7 مل لإنتاج الحل 125 mM. ضع الغطاء بشكل آمن واخلطه جيداً مع ما لا يقل عن 20 انعكاسًا.
- وزن دقيق، وذلك باستخدام ما لا يقل عن ثلاثة أرقام هامة، وكتلة 10.0-30.0 ملغ من كلوريد المعادن أو نترات الفضة في قارورة 1.7 مل.
- حلول مخزون هيدروكسيد الأمونيوم:إعداد محلول حمض الخليك 1.0 M عن طريق تخفيف 57 ميكرولتر من محلول حمض الخليك 99.5٪ مع مياه DI إلى حجم نهائي قدره 1.00 مل. إعداد محلول هيدروكسيد الأمونيوم 1.0 M عن طريق تخفيف 90 ميكرولتر من محلول هيدروكسيد الأمونيوم 21٪ مع مياه DI إلى حجم نهائي قدره 1.00 مل. جعل اثنين من التخفيفات المتعاقبة من كل حل عن طريق اتخاذ 100 ميكرولتر من حلول 1.0 M لإعداد 0.10 M و 0.010 M حمض الخليك وهيدروكسيد الأمونيوم الحلول.
- بولي-دل-ألانين الأوراق المالية الحل: إعداد بولي دل ألانين (السلطة الفلسطينية) عن طريق وزنها 1.0 ملغ من السلطة الفلسطينية وتذوب في 1.0 مل من المياه DI لإعطاء 1000 جزء في المليون. يُخلط المزيج جيداً. باستخدام micropipet، الاستغناء عن 50.0 ميكروL aliquots، ووضع كل في قارورة 1.7 مل وتخزينها في -80 درجة مئوية.
3- تحليل قياس الطيف الكتلي للرذاذ الكهربائي - أيون
- تنظيف أنابيب مدخل ESI والإبرة الشعرية بدقة مع حوالي 500 ميكرولتر من 0.1 M حمض الخليك الجليدي، 0.1 M هيدروكسيد الأمونيوم، وأخيرا DI المياه.
- إذابة aliquot 50.0 ميكرولتر من 1000 جزء في المليون السلطة الفلسطينية الأوراق المالية الحل والتخفيف مع 450 درجة مئوية من المياه DI لإعطاء 100 جزء في المليون السلطة الفلسطينية. Pipet 100.0 μL من هذا الحل والتخفيف من ذلك إلى 1.00 مل مع 500 ميكرولتر من المياه DI و 500 ميكرولتر من acetonitrile لإعطاء 10 جزء في المليون السلطة الفلسطينية الحل.
- جمع الأطياف الأيونية الإيجابية IM-MS من حل السلطة الفلسطينية 10 جزء في المليون لمدة 10 دقائق كل باستخدام شروط ESI-IM-MS الأصلية كما هو موضح في قسم المناقشة.
- إذابة aliquot 50.0 ميكرولتر من 12.5 مليون متر أو 1.25 مليون متر مربع حل الأسهم أمب وجعل التخفيفات المتعاقبة مع مياه DI لإعطاء تركيز نهائي من 0.125 مليون متر. يُمزج كل تخفيف جيداً.
- Pipet 100.0 درجة مئوية من محلول الموردين المعادن 125 مل الأوراق المالية، ووضع في قارورة 1.7 مل والمخففة إلى 1.00 مل مع المياه DI لإعطاء 12.5 مليون متر من الأيون المعدني. كرر مع اثنين من تخفيف أكثر متتالية لإعطاء تركيز أيون المعادن 0.125 m النهائي. يُمزج كل تخفيف جيداً.
- Pipet 200.0 ميكرولتر من 0.125 مليون متر في قارورة 1.7 مل، مخفف ة مع 500 ميكرولتر من مياه DI، وخلط الحل جيدا.
- ضبط درجة الحموضة للعينة إلى 3.0 عن طريق إضافة 50 درجة مئوية من 1.0 M محلول حمض الخليك.
- أضف 200.0 لتر من أيون المعدن البالغ 0.125 مليون متر إلى العينة المعدلة حسب درجة الحموضة. إضافة المياه DI لإنتاج حجم نهائي من 1.00 مل من العينة، ومزيج جيدا، والسماح للعينة لequilibrate لمدة 10 دقيقة في RT.
- باستخدام حقنة الأنف الحادة تأخذ 500 ميكرولتر من العينة وجمع الأطياف السلبية والإيجابية ES-IM-MS لمدة 5 دقائق لكل منهما. استخدم 500 ميكرولتر المتبقية من العينة لتسجيل درجة الحموضة النهائية باستخدام قطب درجة الحموضة الجزئي المعاير.
- كرر الخطوات 3.6 إلى 3.9، مع تعديل الدرجة 3.7 لضبط درجة الحموضة إلى 4.0 أو 5.0 أو 6.0 أو 7.0 أو 8.0 أو 9.0 أو 10.0 عن طريق إضافة وحدات تخزين جديدة من 0.010 M أو 0.10 M أو 1.0 M حمض الخليك أو حلول هيدروكسيد الأمونيوم.
- جمع الأطياف أيون ESI-IM-MS السلبية والإيجابية من حل السلطة الفلسطينية 10 جزء في المليون لمدة 10 دقيقة لكل منهما.
4. إعداد معايرة الأيون المعدني ة من عينات أمب
- اتبع الخطوات الموضحة في الخطوات 3.1 إلى 3.5.
- Pipet 200.0 ميكرولتر من 0.125 مليون متر في قارورة 1.7 مل، تمييع مع 500.0 ميكرولتر من المياه DI وخلط الحل تماما.
- ضبط درجة الحموضة للعينة إلى درجة الحموضة = 9.0 عن طريق إضافة 80 ميكرولتر من محلول هيدروكسيد الأمونيوم 0.010 M.
- إضافة 28 درجة مئوية من محلول أيون معدني 0.125 m M لإعطاء 0.14 مكافئات الأضراس من أيون المعادن، إضافة DI المياه لجعل الحجم النهائي للعينة 1.00 مل، ومزيج جيدا، والسماح للعينة لequilibrate لمدة 10 دقيقة في RT.
- باستخدام حقنة الأنف الحادة تأخذ 500 ميكرولتر من العينة وجمع الأطياف السلبية والإيجابية ESI-IM-MS لمدة 5 دقائق لكل منهما. استخدم 500 ميكرولتر المتبقية من العينة لتسجيل درجة الحموضة النهائية باستخدام قطب درجة الحموضة الجزئي المعاير.
- كرر الخطوات 4.2-4.5، مع تعديل الدرجة 4.3 لإضافة وحدة تخزين مناسبة من حل أيون معدني 0.125 m لإعطاء إما 0.28 أو 0.42 أو 0.56 أو 0.70 أو 0.84 أو 0.98 أو 1.12 أو 1.26 أو 1.40 مكافئات مولار.
- جمع الأطياف الأيونية السلبية والإيجابية IM-MS من حل السلطة الفلسطينية 10 جزء في المليون لمدة 10 دقائق لكل منهما.
5. تحليل بيانات معايرة درجة الحموضة ESI-IM-MS
- من أطياف IM-MS تحديد الأنواع المشحونة من ambs موجودة عن طريق مطابقتها مع أنماط نظائرها م / ز النظرية.
- فتح MassLynx وانقر على كروماتوغرام لفتح نافذة كروماتوغرام.
- انتقل إلى القائمة ملف وفتح لتحديد موقع ملف بيانات IM-MS وفتحه.
- استخراج الطيف IM-MS عن طريق النقر بزر الماوس الأيمن والسحب عبر الكروماتوغرام والإفراج. سيتم فتح نافذة الطيف التي تظهر طيف IM-MS.
- في نافذة الطيف، انقر على نموذج الأدوات والنظائر. في نافذة نمذجة النظائر، أدخل الصيغة الجزيئية لأنواع أمب، وتحقق من مربع إظهار أيون مشحون، وأدخل حالة الشحن. انقر فوق موافق.
- كرر لتحديد جميع الأنواع في طيف IM-MS وتسجيل نطاق نظائرها m/z.
- لكل نوع من أنواع أمب، فصل أي نوع من أنواع m/z المتزامنة واستخراج توزيعات وقت وصولها (ATD) باستخدام أنماط نظائرها m/z للتعرف عليها.
- في MassLynx انقر على DriftScope لفتح البرنامج. في DriftScope انقر على ملف وفتح لتحديد موقع وفتح ملف البيانات IM-MS.
- استخدام الماوس واليسار انقر لتكبير نمط النظائر م / ض من الأنواع أمب.
- استخدم أداة التحديد وزر الماوس الأيسر لتحديد نمط النظائر. انقر فوق الزر قبول التحديد الحالي.
- لفصل أي نوع م / ز عرضية استخدام أداة التحديد وزر الماوس الأيسر لتحديد ATD الوقت محاذاة مع نمط النظائر من الأنواع أمب. انقر فوق الزر قبول التحديد الحالي.
- لتصدير ATD، انتقل إلى ملف | تصدير إلى MassLynx، ثم حدد الاحتفاظ الوقت الانجراف وحفظ الملف في المجلد المناسب.
- تحديد centroid من ATD ودمج المنطقة تحت منحنى ATD كمقياس لتجمعات الأنواع.
- في إطار كروماتوغرام من MassLynx فتح الملف الذي تم تصديره المحفوظة. انقر على عملية | دمج من القائمة. حدد المربع تكامل قمة ApexTrack وانقر فوق موافق.
- تسجيل ATD centroid (رA)والمنطقة المتكاملة كما هو موضح في إطار كروماطوغرام. كرر لكافة ملفات البيانات المحفوظة amb و PA IM-MS.
- استخدم الـ ATD المدمج لجميع أنواع أمب المستخرجة من الأيونات الإيجابية أو السالبة في كل نقطة معايرة للتطبيع إلى مقياس نسبة مئوية نسبية.
- أدخل هويات الأنواع أمب وATD المتكاملة في كل رقم الحموضة في جدول بيانات.
- لكل رقم الهيدروجيني، استخدم مجموع ATDs المدمجة لتطبيع ATD لـ amb الفردية إلى مقياس النسبة المئوية.
- رسم الكثافة المئوية لكل نوع من الأنواع أمب مقابل الحموضة في رسم بياني لإظهار كيف يختلف عدد سكان كل نوع كدالة للحموضة.
6. تصادم عبر المقاطع
- باستخدام جدول بيانات، قم بتحويل CCSs (Ω) من PAسالب25و26 و27 أيونات إيجابية مقاسة في الغاز العازل28 لتصحيح CCS (Ωc)باستخدام المعادلة 1 أدناه، حيث: z = أيون المسؤول؛ (هـ) ج = شحن الإلكترون (1.602 × 10-19 C)؛ (م) نون 2 = كتلة الغاز N2 (دا)؛ وm أيون = كتلة أيون. 29
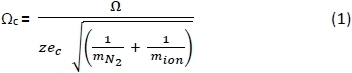
- تحويل متوسط أوقات الوصول (رA)من calibrants السلطة الفلسطينية والأنواع أمب إلى أوقات الانجراف (رD)باستخدام المعادلة 2 أدناه، حيث: ج = معامل تأخير دورة العمل المعززة (1.41)، وم / ض هو كتلة إلى تهمة من أيون الببتيد.

- رسم السلطة الفلسطينية كاليبرانتس 'رD مقابل بهم Ωج. ثم، باستخدام تناسب الانحدار أقل المربعات من المعادلة 3 الموضحة أدناه، حدد القيم A' و B، حيث: A' هو تصحيح لمعلمات درجة الحرارة والضغط والمجال الكهربائي; وB يعوض عن التأثير غير الخطي لجهاز IM.

- باستخدام هذه القيم A' و B وقيمة tD centroid من ATD من ambs تحديدC Ω الخاصة بهم باستخدام المعادلة 3 وΩ الخاصة بهم باستخدام المعادلة 1. توفر هذه الطريقة CCSs لأنواع الببتيد مع أخطاء مطلقة تقدر بحوالي 2٪25،26،27.
7- الأساليب الحسابية
- استخدام B3LYP / LanL2DZ مستوى النظرية، والتي تتألف من بيك 3-معلمة الهجين وظائف30 وأساس Dunning مجموعة31 والإمكانات الأساسية الإلكترون32،33،34 لتحديد موقع مطابقة الهندسة الأمثل لجميع أنواع التنسيق اتّساهاً من الأنواع الـm/z amb الملاحظة35.
ملاحظة: للحصول على تفاصيل حول كيفية إنشاء وإرسال الحسابات الرجوع إلى استخدام GaussView في ملف تكميلي. - قارن الطاقة الحرة المتوقعة لكل من المعاقين وحساب CCSs النظرية الخاصة بهم باستخدام طريقة لينارد جونز (LJ) على مقياس أيون من برنامج سيغما36.
- من أدنى المطابقة للطاقة الحرة تحديد الذي يعرض CONFormer CCS LJ الذي يتفق مع CCS IM-MS قياس لتحديد الهيكل الثالث ونوع التنسيق للمطابقة التي لوحظت في التجربة.
النتائج
ربط المعادن من amb1
وأظهرت دراسة IM-MS20 من amb1 (الشكل 1A) أن كل من أيونات النحاس والزنك ملزمة لamb1 بطريقة تعتمد على درجة الحموضة(الشكل 2). ومع ذلك، النحاس والزنك ملزمة إلى amb1 من خلال آليات رد فعل مختلفة في مواق?...
Discussion
الخطوات الحاسمة: الحفاظ على سلوكيات مرحلة الحل للفحص عن طريق ESI-IM-MS
يجب استخدام إعدادات ESI الآلية الأصلية التي تحافظ على قياس الببتيدات، وحالة الشحن، والهيكل التوافقي. بالنسبة للظروف المحلية، يجب تحسين الظروف في مصدر ESI مثل الفولتية المخروطية ودرجات الحرارة وتدفقات الغاز. أيضا،...
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
وتستند هذه المواد إلى العمل الذي تدعمه المؤسسة الوطنية للعلوم بموجب 1764436، ودعم أجهزة NSF (MRI-0821247)، ومؤسسة ويلش (T-0014)، وموارد الحوسبة من وزارة الطاقة (TX-W-20090427-0004-50) وL3 Communications . نشكر مجموعة باور من جامعة كاليفورنيا - سانتا باربرا لتقاسم برنامج سيغما وAyobami Ilesanmi لإظهار هذه التقنية في الفيديو.
Materials
| Name | Company | Catalog Number | Comments |
| acetonitrile HPLC-grade | Fisher Scientific (www.Fishersci.com) | A998SK-4 | |
| ammonium hydroxide (trace metal grade) | Fisher Scientific (www.Fishersci.com) | A512-P500 | |
| cobalt(II) chloride hexahydrate 99.99% | Sigma-Aldrich (www.sigmaaldrich.com) | 255599-5G | |
| copper(II) chloride 99.999% | Sigma-Aldrich (www.sigmaaldrich.com) | 203149-10G | |
| copper(II) nitrate hydrate 99.99% | Sigma-Aldrich (www.sigmaaldrich.com) | 229636-5G | |
| designed amb1,2,3,4,5,6,7 peptides | Neo BioLab (neobiolab.com) | designed peptides were synthized by order | |
| designed amb5B,C,D,E,F peptides | PepmicCo (www.pepmic.com) | designed peptides were synthized by order | |
| Driftscope 2.1 software program | Waters (www.waters.com) | software analysis program | |
| Freeze-dried, purified, Cu(I)-free mb-OB3b | cultured and isolated in the lab of Dr. DongWon Choi (Biology Department, Texas A&M-Commerce) | ||
| glacial acetic acid (Optima grade) | Fisher Scientific (www.Fishersci.com) | A465-250 | |
| Iron(III) Chloride Anhydrous 98%+ | Alfa Aesar (www.alfa.com) | 12357-09 | |
| lead(II) nitrate ACS grade | Avantor (www.avantormaterials.com) | 128545-50G | |
| manganese(II) chloride tetrahydrate 99.99% | Sigma-Aldrich (www.sigmaaldrich.com) | 203734-5G | |
| MassLynx 4.1 | Waters (www.waters.com) | software analysis program | |
| nickel chloride hexahydrate 99.99% | Sigma-Aldrich (www.sigmaaldrich.com) | 203866-5G | |
| poly-DL-alanine | Sigma-Aldrich (www.sigmaaldrich.com) | P9003-25MG | |
| silver nitrate 99.9%+ | Alfa Aesar (www.alfa.com) | 11414-06 | |
| Waters Synapt G1 HDMS | Waters (www.waters.com) | quadrupole - ion mobility- time-of-flight mass spectrometer | |
| zinc chloride anhydrous | Alfa Aesar (www.alfa.com) | A16281 |
References
- Dudev, T., Lim, C. Competition among Metal Ions for Protein Binding Sites: Determinants of Metal Ion Selectivity in Proteins. Chemical Reviews. 114 (1), 538-556 (2014).
- Sovago, I., Kallay, C., Varnagy, K. Peptides as complexing agents: Factors influencing the structure and thermodynamic stability of peptide complexes. Coordination Chemistry Reviews. 256 (19-20), 2225-2233 (2012).
- Sóvágó, I., Várnagy, K., Lihi, N., Grenács, &. #. 1. 9. 3. ;. Coordinating properties of peptides containing histidyl residues. Coordination Chemistry Reviews. 327, 43-54 (2016).
- Rubino, J. T., Franz, K. J. Coordination chemistry of copper proteins: How nature handles a toxic cargo for essential function. Journal of Inorganic Biochemistry. 107 (1), 129-143 (2012).
- Robinson, N. J., Winge, D. R. Copper Metallochaperones . Annual Review of Biochemistry. 79, 537-562 (2010).
- Scheiber, I. F., Mercer, J. F. B., Dringen, R. Metabolism and functions of copper in brain. Progress in Neurobiology. 116, 33-57 (2014).
- Tisato, F., Marzano, C., Porchia, M., Pellei, M., Santini, C. Copper in Diseases and Treatments, and Copper-Based Anticancer Strategies. Medicinal Research Reviews. 30 (4), 708-749 (2010).
- Millhauser, G. L. Copper and the prion protein: Methods, structures, function, and disease. Annual Review of Physical Chemistry. 58, 299-320 (2007).
- Arena, G., Pappalardo, G., Sovago, I., Rizzarelli, E. Copper(II) interaction with amyloid-beta: Affinity and speciation. Coordination Chemistry Reviews. 256 (1-2), 3-12 (2012).
- Kim, H. J., et al. Methanobactin, a copper-acquisition compound from methane-oxidizing bacteria. Science. 305 (5690), 1612-1615 (2004).
- Di Spirito, A. A., et al. Methanobactin and the link between copper and bacterial methane oxidation. Microbiology Molecular Biology Reviews. 80 (2), 387-409 (2016).
- Kenney, G. E., Rosenzweig, A. C. Chemistry and biology of the copper chelator methanobactin. ACS Chemical Biology. 7 (2), 260-268 (2012).
- Summer, K. H., et al. The biogenic methanobactin is an effective chelator for copper in a rat model for Wilson disease. Journal of Trace Elements in Medicine and Biology. 25 (1), 36-41 (2011).
- Hachmoeller, O., et al. Investigating the influence of standard staining procedures on the copper distribution and concentration in Wilson's disease liver samples by laser ablation-inductively coupled plasma-mass spectrometry. Journal of Trace Elements in Medicine and Biology. 44, 71-75 (2017).
- Hachmoeller, O., et al. Spatial investigation of the elemental distribution in Wilson's disease liver after D-penicillamine treatment by LA-ICP-MS. Journal of Trace Elements in Medicine and Biology. 44, 26-31 (2017).
- Hachmoeller, O., et al. Element bioimaging of liver needle biopsy specimens from patients with Wilson's disease by laser ablation-inductively coupled plasma-mass spectrometry. Journal of Trace Elements in Medicine and Biology. 35, 97-102 (2016).
- Mueller, J. C., Lichtmannegger, J., Zischka, H., Sperling, M., Karst, U. High spatial resolution LA-ICP-MS demonstrates massive liver copper depletion in Wilson disease rats upon Methanobactin treatment. Journal of Trace Elements in Medicine and Biology. 49, 119-127 (2018).
- Choi, D. W., et al. Spectral and thermodynamic properties of Ag(I), Au(III), Cd(II), Co(II), Fe(III), Hg(II), Mn(II), Ni(II), Pb(II), U(IV), and Zn(II) binding by methanobactin from Methylosinus trichosporium OB3b. Journal of Inorganic Biochemistry. 100, 2150-2161 (2006).
- McCabe, J. W., Vangala, R., Angel, L. A. Binding Selectivity of Methanobactin from Methylosinus trichosporium OB3b for Copper(I), Silver(I), Zinc(II), Nickel(II), Cobalt(II), Manganese(II), Lead(II), and Iron(II). Journal of the American Society of Mass Spectrometry. 28, 2588-2601 (2017).
- Sesham, R., et al. The pH dependent Cu(II) and Zn(II) binding behavior of an analog methanobactin peptide. European Journal of Mass Spectrometry. 19 (6), 463-473 (2013).
- Wagoner, S. M., et al. The multiple conformational charge states of zinc(II) coordination by 2His-2Cys oligopeptide investigated by ion mobility - mass spectrometry, density functional theory and theoretical collision cross sections. Journal of Mass Spectrom. 51 (12), 1120-1129 (2016).
- Bandow, N. L., et al. Isolation of methanobactin from the spent media of methane-oxidizing bacteria. Methods in Enzymology. 495, 259-269 (2011).
- Choi, D. W., et al. Spectral and thermodynamic properties of methanobactin from γ-proteobacterial methane oxidizing bacteria: a case for copper competition on a molecular level. Journal of Inorganic Biochemistry. 104 (12), 1240-1247 (2010).
- Pringle, S. D., et al. An investigation of the mobility separation of some peptide and protein ions using a new hybrid quadrupole/travelling wave IMS/oa-ToF instrument. International Journal of Mass Spectrometry. 261 (1), 1-12 (2007).
- Forsythe, J. G., et al. Collision cross section calibrants for negative ion mode traveling wave ion mobility-mass spectrometry. Analyst. 14 (20), 6853-6861 (2015).
- Allen, S. J., Giles, K., Gilbert, T., Bush, M. F. Ion mobility mass spectrometry of peptide, protein, and protein complex ions using a radio-frequency confining drift cell. Analyst. 141 (3), 884-891 (2016).
- Bush, M. F., Campuzano, I. D. G., Robinson, C. V. Ion Mobility Mass Spectrometry of Peptide Ions: Effects of Drift Gas and Calibration Strategies. Analytical Chemistry. 84 (16), 7124-7130 (2012).
- Salbo, R., et al. Traveling-wave ion mobility mass spectrometry of protein complexes: accurate calibrated collision cross-sections of human insulin oligomers. Rapid Communications in Mass Spectrometry. 26 (10), 1181-1193 (2012).
- Smith, D. P., et al. Deciphering drift time measurements from travelling wave ion mobility spectrometry-mass spectrometry studies. European Journal of Mass Spectrometry. 15 (2), 113-130 (2009).
- Becke, A. D. Density-functional thermochemistry. III. The role of exact exchange. Journal of Chemical Physics. 98 (7), 5648-5652 (1993).
- Dunning, T. H., Hay, P. J. Gaussian basis sets for molecular calculations. Modern Theoretical Chemistry. 3, 1-27 (1977).
- Hay, P. J., Wadt, W. R. Ab initio effective core potentials for molecular calculations. Potentials for potassium to gold including the outermost core orbitals. Journal of Chemical Physics. 82 (1), 299-310 (1985).
- Hay, P. J., Wadt, W. R. Ab initio effective core potentials for molecular calculations. Potentials for the transition metal atoms scandium to mercury. Journal of Chemical Physics. 82 (1), 270-283 (1985).
- Wadt, W. R., Hay, P. J. Ab initio effective core potentials for molecular calculations. Potentials for main group elements sodium to bismuth. Journal of Chemical Physics. 82 (1), 284-298 (1985).
- . Gaussian 09, Revision C.01. Gaussian, Inc. , (2012).
- Wyttenbach, T., von Helden, G., Batka, J. J., Carlat, D., Bowers, M. T. Effect of the long-range potential on ion mobility measurements. Journal of the American Society of Mass Spectrometry. 8 (3), 275-282 (1997).
- Choi, D., et al. Redox activity and multiple copper(I) coordination of 2His-2Cys oligopeptide. Journal of Mass Spectrometry. 50 (2), 316-325 (2015).
- Rigo, A., et al. Interaction of copper with cysteine: stability of cuprous complexes and catalytic role of cupric ions in anaerobic thiol oxidation. Journal of Inorganic Biochemistry. 98 (9), 1495-1501 (2004).
- Vytla, Y., Angel, L. A. Applying Ion Mobility-Mass Spectrometry Techniques for Explicitly Identifying the Products of Cu(II) Reactions of 2His-2Cys Motif Peptides. Analytical Chemistry. 88 (22), 10925-10932 (2016).
- Choi, D., Sesham, R., Kim, Y., Angel, L. A. Analysis of methanobactin from Methylosinus trichosporium OB3b via ion mobility mass spectrometry. European Journal of Mass Spectrometry. 18 (6), 509-520 (2012).
- Martell, A. E., Motekaitis, R. J. NIST Standard Reference Database 46. Institute of Standards and Technology. , (2001).
- Pesch, M. L., Christl, I., Hoffmann, M., Kraemer, S. M., Kretzschmar, R. Copper complexation of methanobactin isolated from Methylosinus trichosporium OB3b: pH-dependent speciation and modeling. Journal of Inorganic Biochemistry. 116, 55-62 (2012).
- Amin, E. A., Truhlar, D. G. Zn Coordination Chemistry: Development of Benchmark Suites for Geometries, Dipole Moments, and Bond Dissociation Energies and Their Use To Test and Validate Density Functionals and Molecular Orbital Theory. Journal of Chemical Theory and Computation. 4 (1), 75-85 (2008).
- Sorkin, A., Truhlar, D. G., Amin, E. A. Energies, Geometries, and Charge Distributions of Zn Molecules, Clusters, and Biocenters from Coupled Cluster, Density Functional, and Neglect of Diatomic Differential Overlap Models. Journal of Chemical Theory and Computation. 5 (5), 1254-1265 (2009).
- Lillo, V., Galan-Mascaros, J. R. Transition metal complexes with oligopeptides: single crystals and crystal structures. Dalton Transactions. 43 (26), 9821-9833 (2014).
- Choutko, A., van Gunsteren, W. F. Conformational Preferences of a beta-Octapeptide as Function of Solvent and Force-Field Parameters. Helvetica Chimica Acta. 96 (2), 189-200 (2013).
- Angel, L. A. Study of metal ion labeling of the conformational and charge states of lysozyme by ion mobility mass spectrometry. European Journal of Mass Spectrometry. 17 (3), 207-215 (2011).
- Kelso, C., Rojas, J. D., Furlan, R. L. A., Padilla, G., Beck, J. L. Characterisation of anthracyclines from a cosmomycin D-producing species of Streptomyces by collisionally-activated dissociation and ion mobility mass spectrometry. European Journal of Mass Spectrometry. 15 (2), 73-81 (2009).
- El Ghazouani, A., et al. Copper-binding properties and structures of methanobactins from Methylosinus trichosporium OB3b. Inorganic Chemistry. 50 (4), 1378-1391 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved