Method Article
Adenovirüs Üretimi İçin Verimli Bir Yöntem
Bu Makalede
Özet
Burada, pAdEasy sistemini kullanarak adenovirüs üretimi için bir protokol sunuyoruz. Teknoloji, pAdTrack ve pAdEasy-1 plazmidlerinin rekombinasyonunu, adenovirüs paketleme ve amplifikasyonunu, adenoviral parçacıkların hücre lysate ve kültür ortamından arındırılmasını, viral titrasyonunu ve adenovirüsün fonksiyonel testini içerir.
Özet
Adenoviral transdüksiyon, ilgi geninin çok çeşitli hücre tiplerine ve organlarına ekspresyonunun güçlü ve geçici bir indüksiyon avantajına sahiptir. Bununla birlikte, rekombinant adenoviral teknoloji zahmetli, zaman alıcı ve pahalıdır. Burada, transdüklenmiş hücrelerde güçlü bir yeşil floresan protein (GFP) ekspresyonunu indükleye edebilecek saflaştırılmış adenoviral parçacıklar elde etmek için pAdEasy sistemini kullanarak geliştirilmiş bir protokol sunuyoruz. Bu geliştirilmiş yöntemin avantajları, Bert Vogelstein tarafından geliştirilen orijinal yönteme kıyasla daha hızlı hazırlık ve üretim maliyetinin düşmesidir. Adenoviral teknolojinin ana adımları şunlardır: (1) pAdTrack-GFP'nin BJ5183 bakterilerinde pAdEasy-1 plazmid ile yeniden birleşmesi; (2) adenoviral parçacıkların ambalajı; (3) AD293 hücrelerinde adenovirüslerin amplifikasyonu; (4) adenoviral parçacıkların hücre lisatından ve kültür ortamından arındırılması; ve (5) adenovirüslerin viral titrasyonu ve fonksiyonel testi. Orijinal yöntemdeki iyileştirmeler (i) BJ5183 içeren pAdEasy-1'deki bakterilerin kimyasal dönüşümü ile yeniden birleştirilmesinden oluşur; (ii) rekombinant klonların "negatif" ve "pozitif" PCR ile seçilmesi; (iii) adenoviral paketleme için K2 transfeksiyon sistemini kullanan AD293 hücrelerinin transfeksiyonu; (iv) AD293 hücrelerinin hücre kültürü ortamında serbest bıraktıklarına ilişkin viral parçacıkların amonyum sülfat ile çökeltülerek; ve (v) virüsün tek adımlı sezyum klorür süreksiz gradyan ultrasantrifülasyonu ile saflaştırılması. Çeşitli kaynaklardan (insan, sığır, murine) farklı transdüklenmiş hücre türlerinde (hepatositler, endotel hücreleri gibi) ilgi geninin güçlü bir ifadesi elde edildi. Adenoviral aracılı gen transferi, modern gen tedavileri geliştirmek için ana araçlardan birini temsil eder.
Giriş
Adenovirüsler çekirdek kapağı ve çift iplikli lineer DNA genom 1 ,2,3içeren gelişmemiş virüslerdir. Adenovirüsler çok çeşitli hücre tiplerini enfekte edebilir ve enfeksiyon aktif konak hücre bölünmesine bağlı değildir. Enfeksiyondan sonra, adenovirüs genomik DNA'sını konak hücre çekirdeğine tanıtır, burada epikromomal kalır ve konağın genleriyle birlikte yazıya dökülır. Böylece, eklemeli mutajensis veya onkogenler düzenlemesi için minimum potansiyel risk elde edilir4,5,6. Adenoviral genom konak genom ile birlikte çoğaltılmaz ve böylece adenoviral genler bölünen bir hücre popülasyonunda seyreltilir. Adenoviral transdüksiyonun avantajları arasında şunlar vardır: (i) yüksek düzeyde transgene ekspresyasyonu; (ii) epizomal ekspresyon nedeniyle viral DNA'nın konak genomuna entegrasyonu ile ilgili risklerin azaltılması; (iii) çok çeşitli bölme ve bölmeyen hücre tiplerinin transdüksiyon. Biyomedikal araştırmalarda kullanılan adenovirüslerin çoğu çoğaltıcı olmayandır, E1 bölgesi 7,8,9'danyoksundur. Üretimleri için E1 dizisini (HEK293 gibi) sağlayan bir hücre hattı gereklidir. Ayrıca, viral genoma bir transjen yerleştirilmesine izin vermek için viral yaşam döngüsü (E3) için gerekli olmayan bir bölge silindi; diğer bölgeler (E2 ve E4) bazı adenovirüslerde daha da silindi, ancak bu durumlarda, adenoviral üretim veriminde azalma ve transjenin düşük ekspresyonu bildirildi7.
Burada, AdEasy Sistemini kullanarak adenovirüslerin inşası, paketlenmesi ve saflaştırılması için geliştirilmiş bir protokol sunuyoruz. Bu iyileştirmeler, aşağıdaki avantajlar nedeniyle Bert Vogelstein2,10tarafından geliştirilen orijinal yönteme kıyasla adenovirüsün daha hızlı ve ekonomik bir şekilde paketlenmesine izin verdi: (i) BJ5183 içeren pAdEasy-1'deki bakterilerin kimyasal dönüşümü ile yeniden birleştirilmesi; (ii) rekombinant klonların PCR tarafından seçilmesi; (iii) adenoviral paketleme için K2 transfeksiyon sistemini kullanan AD293 hücrelerinin transfeksiyonu; (iv) viral paketleme ve amplifikasyondan sonra kültür ortamından adenoviral parçacıkların çökeltilmesi; (v) tek adımlı sezyum klorür (CsCl) gradyan ultrasantrifüjleme kullanılarak adenoviral saflaştırma.
AdEasy sistemini kullanarak adenovirüs üretimi için protokol (Şekil 1) aşağıdaki adımları içerir:
(1) BJ5183 bakterilerinde pAdTrack-GFP'nin pAdEasy-1 ile yeniden birleşmesi
(2) Adenoviral parçacıkların paketlenmesi
(3) Adenovirüs amplifikasyonu
(4) Adenoviral parçacıkların hücre lisatından ve kültür ortamından arındırılması
(5) Adenovirüs titrasyonu.
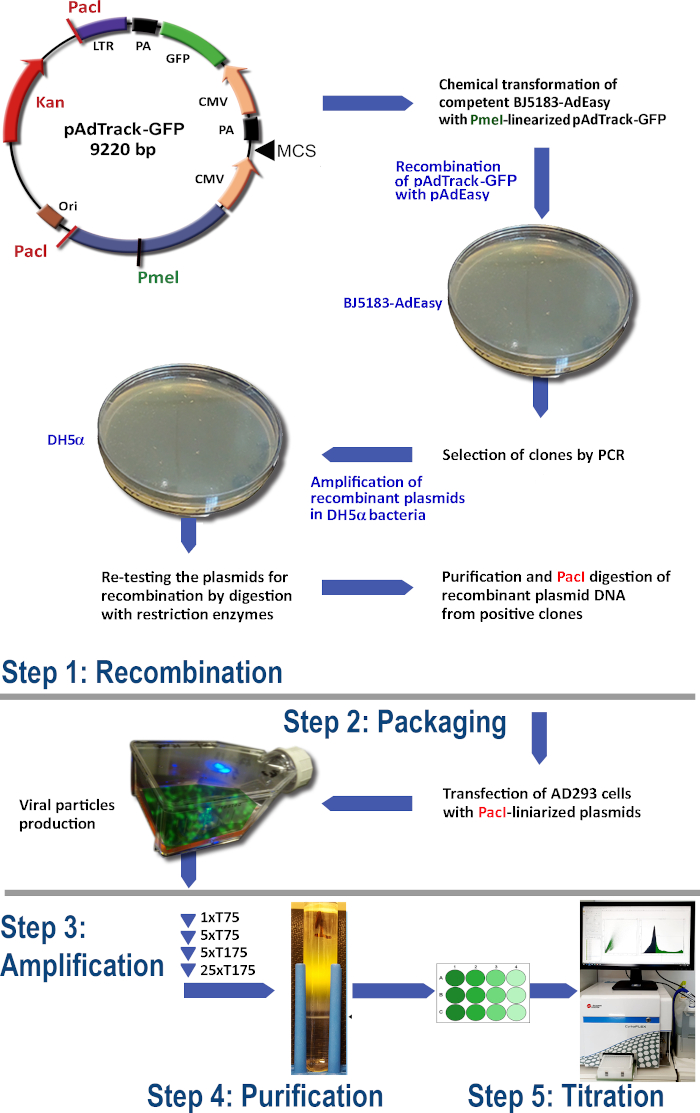
Şekil 1: Adenovirüs üretim teknolojisi. Adenoviral teknolojinin ana adımları şunlardır: (1) pAdTrack-GFP'nin BJ5183 bakterilerinde pAdEasy-1 plazmid ile yeniden birleşmesi. Seçilen rekombinlenmiş plazmidler DH5α bakterilerinde yükseltilir ve daha sonra saflaştırilir; (2) Adeno-E1 proteinleri üreten AD293 hücrelerindeki adenoviral parçacıkların paketlenmesi; (3) AD293 hücrelerinde adenovirüs amplifikasyonu; (4) Adenoviral parçacıkların hücre lisatından ve kültür ortamından bir CsCl yoğunluk gradyanı üzerinde ultra merkezirifülasyon ile saflaştırılması; (5) Adenovirüs titrasyonu ve fonksiyonel test. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bu protokolde, konak hücrelerde GFP ekspresyonunun neden olabileceği adenovirüs üretimi için teknolojiyi örneklendirdik. GFP zaten pAdTrack-CMV mekik vektörün (Addgene #16405) omurgasına ikinci bir CMV promotörü altında yerleştirilmiştir ve muhabir geni olarak kullanılır (Şekil 1). Bu nedenle, burada pAdTrack-CMV vektörü pAdTrack-GFP olarak belirledik ve GFP'nin ifadesini gösteri amaçlı değerlendirdik. GFP ifadesinin yanı sıra, sistem pAdTrack-CMV'nin birden fazla klonlama bölgesinde klonlanabilecek bir ilgi genini aşırı ifade etmek için kullanılabilir. pAdTrack-CMV'de klonlanmış bir gen veya minigene, cDNA11ile karşılaştırıldığında ifade indüksiyonu için genellikle daha verimlidir. Veriler, çeşitli kaynaklardan (insan, sığır, murine) transdüklenmiş hücrelerde (hepatositler, endotel hücreleri gibi) güçlü bir GFP ekspresyonu gösterdi. Adenoviral aracılı gen transferi, modern gen tedavileri geliştirmek için ana araçlardan birini temsil eder.
Protokol
Güvenlik Notu: Genel olarak, adenovirüsler biyogüvenlik seviyesi 2 organizmalar olarak sınıflandırılır ve bu nedenle, tüm manipülasyonlar eğitimli bir kişi tarafından, biyolojik tehlike koruyucu ekipman (eldivenler, biyolojik aerosoller için yüz maskesi, laboratuvar önlüğü vb.) giyerek sınıf II biyogüvenlik kabininde yapılmalıdır. Adenovirüs ile kontamine olan tüm katı malzemeler 30 dakika boyunca% 10 çamaşır suyu çözeltisi ile dezenfekte edilmeli ve 121 ° C ve 1 bar'da 30 dakika boyunca otomatik olarak kapatılmalıdır. Eklenen gene bağlı olarak, oluşturulan adenovirüs tehlikeli potansiyele sahip olabilir ve diğer biyogüvenlik seviyelerinde sınıflandırılabilir.
1. Deneysel hazırlık
- Adenoviral manipülasyonlar için ayrı bir hücre kültürü başlığı ve her adenovirüs tipi için ayrı bir inkübatör kullanın. Viral paketleme ve amplifikasyon için filtre kapaklı T şişeleri kullanın; havalandırmalı Petri plakalarında mümkün olduğunca transdüksiyon deneylerinden kaçının.
- Her kullanımdan sonra hücre kültürü başlığını boşaltın ve 15 dakika boyunca UV'ye maruz bırakın.
- Pipet yardımını, pipetleri ve diğer mutfak gereçlerini periyodik olarak otoklav edin. Mümkünse, ayrı bir hücre kültürü laboratuvarında/davlumbazında kültür, adenoviral ambalaj için hücreler (AD293 hücreleri) ve transdüksiyon deneylerinde kullanılacak hücreler. Aynı dönemde güçlendirilmiş farklı adenovirüs partileri PCR ile çapraz kontaminasyon açısından kontrol edilmelidir.
- Aşağıdaki çözümleri hazırlayın.
- SOB (Super Optimal Broth) ortamı hazırlayın: 20 g tripto, 5 g maya özü, 0,5 g NaCl (10 mM son konsantrasyon), 2,5 mL 1 M KCl (2,5 mM son konsantrasyon), amd H2O ila 1 L. 121 °C'de otoklavlamadan sonra, aşağıdaki steril çözeltileri ekleyin: 5 mL 1 M MgCl2 ve 5 mL 1 M MgSO4.
- SOC (Catabolite baskılı Süper Optimal et suyu) ortamını hazırlayın: 1 L steril SOB'da aşağıdaki steril çözeltileri ekleyin: 20 mL 1 M glikoz, 5 mL 1 M MgCl2 ve 5 mL 1 M MgSO4.
- Yağış çözeltisi hazırlayın: 60 mL H 2 O'da29,5g potasyum asetat çözün, 11,5 mL asetik asit ekleyin ve H2O ila 100 mL.
- Resüspensiyon tamponunu hazırlayın: 95 mL% 20 glikoz, 5 mL 1 M Tris-Cl pH 8, 4 mL 0.5 M EDTA pH 8 ve200mL'ye H 2 O ekleyin.
- Lizis çözeltisi hazırlayın: 4,8 mL 8,3 M NaOH, 10 mL% 20 SDS ve H2O ila 200 mL.
2. BJ5183 bakterilerinde pAdTrack-GFP viral vektörün pAdEasy-1 plazmid ile rekombinasyonu
- pAdTrack-GFP'nin doğrusallaştırılması ve doğrusallaştırılmış plazmidlerin saflaştırılması.
- Buz üzerinde aşağıdaki sindirim karışımını hazırlayın:
10 μg pAdTrack-GFP
5 μL 10x renksiz tampon
2 μL Pme I
H 2O'dan 50 μL'lik son hacme kadar. - Bir su banyosunda 3 saat boyunca 37 ° C'de kuluçkaya yatır.
- 65 °C'de 20 dakika inaktive edin.
- Pme I ile pAdTrack-GFP'nin sindiriminin verimliliğini kontrol edin: %0,8 agarose jel üzerinde 1 μg sindirilmemiş plazmid ile paralel olarak sindirilmiş plazmid 1 μg çalıştırın.
- Buz üzerinde aşağıdaki sindirim karışımını hazırlayın:
- DNA'nın izolasyonu ve saflaştırılması
NOT: 1-6. adımların duman kaputunda yapılması gerekir.- Sindirim karışımının üzerine eşit miktarda fenol/kloroform/izoamil alkol (25:24:1) ekleyin ve karışım homojen olana kadar tüpü ters çevirin.
- 16.200 x g'da3 dakika santrifüj ve ardından üst sulu fazı bir toplama tüpüne aktarın.
- Alt organik faz ve girdap üzerine eşit miktarda fenol/kloroform/izoamil alkol (25:24:1) ekleyin.
- 16.200 x g'da3 dakika santrifüj ve ardından üst fazı aynı toplama tüpüne aktarın.
- Toplama tüpünde ve girdapta hasat edilen sulu fazın üzerine eşit miktarda kloroform ekleyin.
- 16.200 x g'da3 dakika santrifüj ve ardından üst sulu fazı yeni bir toplama tüpüne aktarın.
- 1/10 hacimli 3 M sodyum asetat ve 2 cilt soğuk % 100 etanol ve girdap ekleyin.
- -70 °C'de 1 saat veya -20 °C'de gece boyunca kuluçkaya yatırın.
- Numuneyi buz üzerinde çözün ve 16.200 x g ve 4 °C'de 10 dakika santrifüj edin.
- Süpernatant çıkarın ve% 75 etanol 750 μL ekleyin.
- 16.200 x g ve 4 °C'de 3 dakika santrifüj ve süpernatantı çıkarın.
- Tüm süpernatant kaldırmak ve pelet kaput kurulamak için kısa bir süre tüp döndürün. DNA peletini uzun süre kurutmayın, çünkü çözünmesi zordur.
- Peletin 15 μL H2O'da çözün.
- Bir spektrofotometre (örneğin, Nanodrop) kullanarak DNA konsantrasyonunu ölçün.
- pAdTrack-GFP ile AdEasier-1 bakterilerinin dönüşümü
NOT: Bu adımda, pAdTrack-GFP'nin pAdEasy-1 plazmid ile yeniden birleşmesi gerçekleşir.- Üreticilerin talimatlarını izleyerek ticari bir dönüşüm kiti kullanarak AdEasier-1 (BJ5183 içeren pAdEasy-1, Addgene #16399) kimyasal yetkin bakterileri hazırlayın. 100 μL yetkin bakterinin aliquotlarını -80 °C'de tutun.
- Buz üzerinde yetkin AdEasier-1 bakterilerinin bir aliquot çözün ve 1 μg saflaştırılmış Pme I - sindirilmiş pAdTrack-GFP ekleyin. Tüpü sallayarak hafifçe karıştırın (karışımı pipetle etmeyin). Buzda 10 dakika kuluçkaya yaslanın.
- 900 μL SOC ortamı ekleyin ve 37 °C'de 1 saat boyunca sallanarak kuluçkaya yatırın.
- 600 x g'da5 dakika boyunca mikro yakıt.
- 900 μL'lik süpernatantı çıkarın, pelet ve süpernatantı karıştırın ve LB-agar plakalarındaki dönüştürülmüş bakterileri kanamycin ile tohumlayın.
- 37 °C'de ~16 saat kuluçkaya yatır (18 saati aşmayın).
- Pcr ile olası pozitif klonların seçimi
- Kürdanları ikiye bölün ve yarı kürdanları otoklavlayarak sterilize edin.
- Steril yarı kürdan kullanarak küçük ve yarı saydam kolonileri alın.
- Kısaca, yarım kürdanı 10 μL suda (pcr tüpünde) bakterilerle döndürün ve ardından yarım kürdanı kanamycinli 100 μL SOC ortamı içeren 1,5 mL Eppendorf tüpüne koyun. Klonları "negatif" ve "pozitif" PCR ile test ederken, 37 ° C'de 4-6 saat kuluçkaya yatırın.
- Bakteri örneğini elde etmek için 10 μL su içeren PCR tüplerini 95 °C'de 5 dakika boyunca bakterilerle kuluçkaya yatırın ve "negatif" ve "pozitif" PCR'ye paralel olarak çalıştırın.
- "Negatif" PCR - pAdTrack-GFP bütünlüğünü test etmek için: Buzdaki negatif PCR için aşağıdaki PCR karışımını hazırlayın.
Bakteri örneğinin 5 μL'si
0.1 μL Astar İleri (4631 F: 5'-CAGTAGTCGGTGCTCGTCCAG)
0.1 μL astar Ters (5616 R: 5'-TATGGGGGCTGTAATGTTGTCTC)
0,1 μL dNTP 10 mM
3 μL 5x Tampon
1,5 μL MgCl2 25mM
0.1 μL GoTaq Polimeraz
H2O ila 15 μL'lik son hacim
NOT: DNA şablonlarının pAdTrack-GFP vektörü olduğu pozitif kontrol dahil edilmelidir. - "Pozitif" PCR - ilgi geninin varlığını test etmek için. Eklenen gen için belirli astarlar kullanın ve karışımı önceki adımda olduğu gibi hazırlayın. GFP için kullanılan astarlar şunlardı:
F: 5'-CAAGGACGACGGCAACTACA
R: 5'-ATGGGGGTGTTCTGCTGGTA - "Negatif" ve "pozitif" PCR'ye paralel olarak çalıştırın. PCR Programı: 5 dk, 95 °C; Aşağıdaki adımların 40 döngüsü: 30 sn, 95 °C; 30 sn, 68 °C; 1 dk, 72 °C; son uzama: 10 dk, 72 °C.
NOT: İlgi genini amplifikasyon için tavlama sıcaklığını uyarlayın. - PCR ürünlerini% 1 agarose jel üzerinde değerlendirin ve klonların seçimini yapın.
- "Negatif PCR" için PCR ürünü vermeyen klonları ve "pozitif PCR"den sonra belirli BIR PCR ürününü daha fazla işlemeyi düşünün.
- Seçilen rekombinant klonların bakteri kültürlerini büyütün
- Kanamycin ile 4 mL SOC ortamında varsayılan pozitif klonların kültürlerini seyreltin (adım 2.4.3.) ve bir gecede 37 ° C'de sallanarak kuluçkaya bırakın.
- AdEasier-1 bakterilerinden plazmid DNA izolasyonu (Alkali liziz kullanarak miniprep)
- Mikrosantrifüj tüplerinde 1,5 mL bakteri kültürünü aktarın, 16.200 x g'da1 dakika santrifüj ve süpernatantı çıkarın.
- Aynı tüpte başka bir 1,5 mL bakteri kültürünü aktarın, santrifüjü tekrarlamayı tekrarlayın ve süpernatantı çıkarın.
- 200 μL resüspensiyon tamponu ekleyin (50 mM glikoz, 10 mM EDTA, 25 mM Tris-HCl pH 8).
- 200 μL lizis çözeltisi ekleyin (0,2 N NaOH, % 1 SDS), tüpü ters çevirerek hafifçe karıştırın.
- 200 μL çökeltme çözeltisi (60 mL 5 M potasyum asetat, 11,5 mL buzul asetik asit ekleyin, 100 mL'ye kadar H2O ekleyin) ve tüpü ters çevirerek hafifçe karıştırın.
- 16.200 x g'da3 dakika santrifüj.
- Süpernatantı yeni bir mikrosantrifüj tüpüne aktarın, 500 μL izopropanol ekleyin, karıştırın ve buzda 20 dakika kuluçkaya yatırın.
- 16.200 x g'da 15 dakika santrifüj ve 500 μL% 75 etanol ekleyin.
- 16.200 x g'da 10 dakika santrifüj ve süpernatantı çıkarın.
- 16.200 x g'da3 dakika santrifüj, süpernatantı çıkarın ve 15 μL H2O ekleyin.
- Yeniden birleştirilmiş plazmidlerin amplifikasyonu, izolasyonu ve yeniden test edilmesi
- AdEasier-1 hücrelerinden izole edilen DNA ile DH5α bakterilerinin dönüşümü.
- Üreticilerin talimatlarına uyarak ticari dönüşüm kitini kullanarak DH5α yetkin bakterileri hazırlayın.
- Buz üzerinde 100 μL DH5α yetkin bakterisini çözün, rekombinant DNA'yı ekleyin ve buzda 10 dakika kuluçkaya yatırın. Daha sonra bakterileri kanamycin ile LB-agar plakalarına tohumlayın.
- Gece boyunca 37 °C'de kuluçkaya yatır.
- Birkaç koloni toplar ve her birini kanamycin ile 2 mL LB ortamında, bir gecede 37 °C'de, sallanarak büyütür.
- DNA'yı izole edin (alkali lizis kullanarak Miniprep) ve elde edilen DNA'yı 25 μL H2O'da yeniden diriltir.
- Pozitif klonları enzymatic sindirim ile onaylayın.
- Buz üzerinde aşağıdaki karışımı hazırlayın:
5 μL rekombinant DNA
1.5 μL 10x renksiz Tampon
0,5 μL Hind III veya Pst I
H2O ila 15 μL'lik son hacim - 37 °C'de 30 dakika kuluçkaya yatır.
NOT: Kontrol olarak, pAdTrack-GFP ve pAdEasy-1 plazmidlerini de sindirin. - Her numuneye RNase A ile 3 μL Sx6 yükleme tamponu ekleyin (miniprep arabelleklerinde RNase A yoksa).
- Sindirilen DNA parçalarını %1 agarose jel elektroforezi üzerinde çalıştırın.
NOT: Pozitif bir klonun sindirim deseni, sindirilen pAdEasy plazmid parçalarının çoğunu içerir ve pAdTrack vektörü ile pAdEasy rekombinasyonunu ortaya çıkarır. İlgi geni klonlama için kullanılan kısıtlama enzimleri ile sindirim ile kanıtlanmalıdır.
- Buz üzerinde aşağıdaki karışımı hazırlayın:
- Adenovirüs ambalajı için plazmid DNA (transfeksiyon sınıfı) hazırlanması.
- Plazmid DNA'yı izole etmek için pozitif bir klondan 200 mL bakteri kültürü yetiştirin.
- Plazmid DNA'yı, üreticinin talimatlarını izleyerek plazmid DNA Midiprep (örneğin, Qiagen Plasmid Midi Kit) için ticari bir kit kullanarak izole edin.
- AdEasier-1 hücrelerinden izole edilen DNA ile DH5α bakterilerinin dönüşümü.
3. Adenoviral parçacıkların paketlenmesi
- 1. Gün. AD293 hücrelerinin tohumlarını
- AD293 hücrelerini PBS ile yıkayın ve 37 °C'de 2-5 dakika boyunca% 0.125 Trypsin ile kuluçkaya yatırın.
- Hücreleri serumla soğuk ortamda toplayın.
- 4 °C'de 400 x g'da 5 dakika santrifüj.
- Hücreleri serumla orta hızda yeniden depola ve hücreleri ~2 x 106/T25 şişe yoğunluğunda tohumla. Tercihen, filtreli bir şişe kullanın.
- 1. Gün. Pac I ile rekombinant DNA'yı sindirin
- Aşağıdaki karışımı hazırlayın:
6 μL rekombinant DNA (1 μg/μL)
2 μL Pac I
2,5 μL 10x renksiz Tampon
H2O ila 25 μL'lik son hacim - 37 °C'de 3 saat (veya geceleme) kuluçkaya yatırın ve ardından enzimi 65 °C'de 20 dakika boyunca inaktive edin.
- Etanol ile DNA çökeltme: 2,5 μL (1/10 v/v) 3 M sodyum asetat ve 2-3 hacim% 100 etanol ekleyin. -70 °C'de 30 dakika veya -20 °C'de bir gecede kuluçka.
- 4 °C'de 30 dakika boyunca 16.200 x g'da santrifüj ve peletin steril suya yeniden harcanır.
- Aşağıdaki karışımı hazırlayın:
- 2. Gün: AD293 hücrelerinin K2 reaktifi kullanılarak transfeksiyon
- Transfeksiyondan iki saat önce, hücrelerin üzerine 40 μL K2 Çarpanı ekleyin.
- A ve B çözümleri hazırlayın:
Çözüm A: Opti-MEM'in 260 μL'sinde 6 μg Pac l-lineerize DNA ekleyin.
Çözüm B: Opti-MEM'in 248,4 μL'sinde 21,6 μL K2 Reaktif ekleyin. - A çözeltisi B üzerine çözelti ekleyin ve pipetleme ile hafifçe karıştırın.
- Karışımı oda sıcaklığında 20 dakika kuluçkaya yatırın. Hücrelere damla yönünde A ve B karışımı ekleyin.
- 3-11. Gün: Floresan mikroskopi ile GFP ekspresyonını izleyin
NOT: Floresan mikroskopide hücreler yeşil görünmeli ve yavaş yavaş ayrılmalıdır. - 11. Gün: F1 adenoviral parçacıklarını hasat
- Müstakil hücreleri ve ortamı 50 mL'lik bir tüpte toplayın, yapışan hücreleri kazıyın ve aynı tüpe ekleyin.
- 400 x g'da 5 dakika santrifüj, süpernatantı yeni bir tüpte toplayın ve hücre peletini 0,5 mL PBS'de yeniden biriktirin.
- Hücre kesintisi
- Hücre süspansiyonu bir mikrosantrifüj tüpüne aktarın.
- Üç dondurma/çözme döngüsü gerçekleştirin (sıvı nitrojende dondurun veya maksimum 7 dakika boyunca 37 °C'de -80 °C /thaw'da dondurun).
- Kırık hücreleri üç kez 23 G şırınga iğneden geçirin.
- Hücre kalıntılarını 12 dakika boyunca 9.600 x g'da santrifüjleme ile çıkarın.
- Süpernatant toplanan ortam ile 50 mL tüpe aktarın.
4. Adenovirüs'ün amplifikasyonu
NOT: AD293 hücreleri gerekli izdihama ulaşmadıysa enfeksiyon için kullanılacak adenoviral stokların (virüs üreten hücrelerden elde edilen lisat) aliquotları -80 °C'de saklanabilir.
- F2 adenoviral parçacıklarını hazırlayın.
- AD293 hücrelerini bir T75 şişesinde (5 x 106 hücre/şişe) tohumla.
- F1 adenoviral parçacıklarını kullanarak ~%90 birleştirilmiş AD293 hücrelerini enfekte edin: T75 şişesinde yetişen hücrelerin üzerine hücre homojenatı ve T25 şişesinden ortamı ekleyin.
- Floresan mikroskopi ile GFP ekspresyonını izleyin.
- Transdüklenmiş AD293'ün ~%90'ı ayrıldığında virüs üreten hücreleri hasat etmek (~ transdüksiyondan sonraki5. gün). Hücre kültürünü 4 °C'de orta tutun.
- 1 mL PBS'deki hücreleri (F1'dekilerle benzer şekilde) bozun.
- F3 adenoviral parçacıklarını hazırlayın.
- T175 şişesinde tohumlanan ~%90 birleştirilmiş AD293 hücrelerini F2 adenoviral parçacıklarla ve F2 adenoviral parçacıklardan hücre kültürü ortamını enfekte edin.
- Hücreleri hasat (~5 gün sonra transdüksiyon).
- 2 mL PBS'deki hücreleri (F1'dekilerle benzer şekilde) bozun.
- F4 adenoviral parçacıklarını hazırlayın.
- F3 adenoviral parçacıklar ve hücre kültürü ortamı ile ~%90 birleştirilmiş AD293 hücreleri içeren 5 T175 şişesini enfekte edin.
- Hücreleri hasat (~5 gün sonra transdüksiyon).
- 3 mL PBS'de hücreleri (F1'dekilerle benzer şekilde) bozun.
- F5 adenoviral parçacıklarını hazırlayın.
- F4 adenoviral stok ve hücre kültürü ortamı ile ~%90 birleştirilmiş AD293 hücreleri içeren 25 T175 şişesini enfekte edin.
5. Adenovirüs'ün hücre lisatından ve kültür ortamından arındırılması
- Virüs üreten hücrelerin ve kültür ortamının toplanması.
- F5'in AD293 hücrelerini transdüksiyondan 5 gün sonra hasat edin.
- Ortamı, adenoviral parçacıkların çökelttiri için steril bir şişeye saklayın.
NOT: Adenovirüs saflaşına kadar ortamı buzdolabında tutun. - Hücreleri 400 x g'da, 5 dakika boyunca, 4 oC'de santrifüj edin.
- Son peletin 5 mL'si 10 mM Tris HCl, pH 8'i 2 mM MgCl2ile yeniden biriktirin.
- 1,5 mL tüplerde süspansiyon aliquot.
- Hücreleri bozun (F1 için olanlarla benzer şekilde): üç donma/çözülme döngüsü.
NOT: Ultrasantrifüjleme hemen yapılamıyorsa, numuneleri -80 °C'de tutun. - Hücre süspansiyonu üç kez 23G şırınga iğneden geçirin.
- Homojenatı 9 600 x g'da 12 dakika santrifüj edin.
- CsCl gradyan ultrasantrifüjleme ile süpernatantı adenovirüs saflaştırması için sakla.
- Kültür ortamında salınan adenovirüs yağışları.
- Oda sıcaklığında kaydedilmiş hücre kültürü ortamına sahip şişeyi getirin.
- Her 500 mL hücre kültürü ortamına 121 g amonyum sülfat ekleyin (çözeltinin doygunluğu% 40 - 42 arasında olmalıdır).
- Amonyum sülfat tamamen çözünene kadar dikkatlice karıştırın.
- Oda sıcaklığında en az 2,5 saat kuluçkaya yatırın.
- Santrifüj 1600 x g, 15 dakika, 22 oC ve pelet sakla.
- Peletin 4 mL'si 10mM Tris HCl pH 8'de 2mM MgCl2ile yeniden biriktirin; bu süspansiyon CsCl gradyan ultracentrifugation ile derhal arındırılmalıdır.
NOT: Arıtma adımı daha sonra gerçekleştirilemezse, yeniden 10mM Tris HCl, 2mM MgCl 2 ile pH 8'e karşı yeniden uyarılmış peleteri bir gecede dialyzeedin.
- Ultrasantrifüjleme ile adenovirüs saflaştırması.
- SW41Ti rotor için polipropilen tüplerde süreksiz bir CsCl gradyani hazırlayın. Tüpün altına 3 mL 765 mg/mL CsCl (yüksek yoğunluk: 1,4 g/L) ekleyin. İlk CsCl katmanının üzerine yavaşça 3 mL 288,5 mg/mL CsCl (düşük yoğunluk: 1,2 g/L) ekleyin.
- Hücrelerden salınan veya hücre kültürü ortamından (daha önce açıklandığı gibi) gradyanın üzerine çöken 3 - 4 mL adenoviral parçacık süspansiyonunun hafifçe yer paylaşımı.
- Tüpleri mineral yağ ile doldurun ve tüpleri soğuk SW41Ti kovalarına koyun.
- Tüpleri aşındırın. Doldurulmuş polipropilen tüplerin rotora simetrik olarak yüklendiğinden emin olun. Rotor'u ultracentrifuge'a koyun.
- 210.000 x g ve 4 °C'de santrifüj, 18 saat boyunca fren yok.
- Bantları almak için ultracentrifuge tüplerini arkasında siyah bir kağıt olan bir standa yerleştirin.
- Net üst fazı, hücre kalıntılarını ve üst bandı ağartma çözeltisi ile bir atık kabına atın.
- Tam adenovirüs (~700 μL - 1 mL) içeren en düşük bandı steril 1,5 mL tüpte hasat edin ve buzda tutun.
- Diyaliz tamponunda diyaliz kasetini önceden ıslatma (10 mM Tris-Cl tampon pH 8, 2 mM MgCl2).
- Saflaştırılmış adenovirüsü 2 mL şırınna kullanarak diyaliz kasetine enjekte edin.
- Dialyze bir gecede 10 mM Tris-Cl tampon pH 8, 2 mM MgCl2 'ye karşı (diyaliz tamponunu 3 - 4 kez değiştirin).
- Adenoviral stoğu 10 - 100 μL'lik aliquots diyaliz kasetinden hasat edin.
- Viral aliquotlara %4 son konsantrasyona sakkaroz ekleyin (kriyoproteksiyon için).
- Aliquots'u -80 °C'de saklayın.
6. Adenovirüs titrasyonu
- 1. Gün: Hücreleri kaplama
- AD293 hücrelerini, Şekil 2'de gösterildiği gibi, 1 mL tam büyüme ortamında kuyu başına2,5 × 10 5 hücre (12 kuyu kültür plakasında) yoğunluğunda tohumlayın. Doğru titer tayini için hücrelerin her kuyuya eşit şekilde yayıldığını sağlayın.
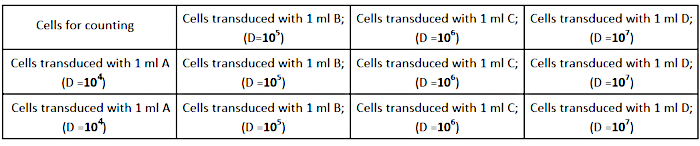
Şekil 2: Titrasyon plakası tasarımı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- 2. Gün: Hücrelerin transdüksiyon
- Hücreleri trypsin ile bir kuyudan ayırın ve sayın. Viral titreyi hesaplamak için kullanılacağından bu sayıya dikkat edin.
- Viral stokun seri seyreltmelerini (1/104;1/10 5; 1/106;1/10 7)1 mL tam büyüme ortamında aşağıdaki gibi gerçekleştirin:
- 1/103: virüs stoğunun seyreltilmesi - 1998 μL tam ortasına 2 μL viral stok ekleyin.
- 1/104: 120 μL ila 1080 μL tam orta (A) seyrelterek 1/103'ün 1:10 seyreltilmesini yapın.
- 1/105: 120 μL A ila 1080 μL tam orta (B) seyrelterek B'nin 1:10 seyreltilmesini yapın.
- 1/106: 120 μL B ila 1080 μL tam orta (C) seyrelterek 1:10 C seyreltme yapın.
- 1/107: 120 μL C'yi 1080 μL tam orta (D) seyrelterek 1:10 D seyreltme yapın.
NOT: Deneyi üç taraflı olarak gerçekleştirmek için her seyreltmeden (A, B, C, D) 3 tüp hazırlayın. - Hücre kültürü ortamını kuyulardan çıkarın ve Şekil 2'degösterildiği gibi virüsün hazırlanan seyreltmelerini ekleyin.
- 3. Gün: GFP ifadesini izleme
- Floresan mikroskobu kullanarak kuyularda yeşil hücrelerin varlığını kontrol edin.
- 4. Gün: GFP pozitif hücrelerin akış sitometri analizi
- On iki 1,5 mL tüp hazırlayın ve etiketle.
- Hücre kültürü ortamını (müstakil hücrelerle birlikte) 1,5 mL tüplerde toplayın ve buzda tutun.
- Her kuyuya 200 μL tripsin ekleyin.
- Co 2 inkübatöründe plakayı 37 °C'de 2 -3 dakika kuluçkaya yatırın.
- Hücreleri hücre kültürü ortamı ile aynı Eppendorf tüplerinde hasat edin. Tüpleri buzda tut.
- Hücreleri 400 x g'da, 5 dakika boyunca, 4 °C'de pelet.
- Üstnatant kaldırmak; Tüpleri buzda tut.
- Peleti 250 μL PBS + % 2 FBS'de yeniden diriltin; Tüpleri buzda tut.
- Hücre süspansiyonu akış sitometri tüplerine veya plakasına aktarın.
- Numuneleri, GFP ifade hücrelerinin floresanını kaydeden bir akış sitometresinde çalıştırın.
Titer hesaplaması: Aşağıdaki formül kullanılarak viral titerin hesaplanması için ana popülasyondan% 5 - 20 GFP pozitif hücreli örnekler dikkate alınmalıdır:
Titer (TU/mL) = D x F/100 x C/V
D = seyreltme faktörü
F = pozitif hücrelerin yüzdesi / 100
C = hücre sayısı / kuyu
V = viral inokülum hacmi
7. Hedef hücrelerin adenoviral transdüksiyonu ve indüklenen protein ekspresyonunun testine tabi ted
- 1. Gün: Hücrelerin tohumlama
- Kuyularda eşit olarak yayılmalarını sağlayan hedef hücreleri tohumla.
- 2. Gün: Hücrelerin transdüksiyon
- Hedef hücreleri bir kuyudan ayırın ve sayın.
- Hücreleri hücre başına istenen sayıda enfeksiyöz parçacıkla transdüze etmek için gereken uygun adenoviral süspansiyon hacmini hesaplayın.
- Hedef hücrelere ilgili miktarda viral süspansiyon ekleyin.
- 3. Gün: Viral süspansiyonun kaldırılması ve GFP ifadesinin kontrol edilmesi
- Adenoviral parçacıklar içeren hücre kültürü ortamını taze ortamla değiştirin.
- Floresan mikroskopta GFP ifadesini kontrol edin.
Sonuçlar
Daha hızlı ve verimli adenovirüs üretimi elde etmek için orijinal Vogelstein protokolünü değiştirdik ve geliştirdik. İlk olarak, daha kolay bir rekombinant seçimi elde etmek için metodolojiyi revize ettik. Rekombinasyondan sonra, BJ5183 bakteri klonları, pAdTrack-GFP'nin bütünlüğünü yeniden birleştirme eksikliğinin bir göstergesi olarak değerlendirmekiçin "negatif PCR" veya ilgi genini tanımlamak için "pozitif PCR" ile test edildi, bizim durumumuzda GFP'ye asimile edildi (Şekil 3B). Hem "negatif" hem de "pozitif" PCR'larda, pAdTrack-GFP'yi kontrol şablonu olarak kullandık, bu da pAdTrack bütünlüğü için 986 bp bant(Şekil 3A, şerit 1) ve GFP için 264 bp bant verdi (Şekil 3B, şerit 3). "Negatif PCR" için kullanılan astarlar, pAdTrack-GFP'deki PmeI sitesini içeren 986 bp'lik bir parçayı yükseltmek için tasarlanmıştır. Bu DNA parçası rekombinasyondan sonra büyük ölçüde genişler ve pozitif rekombinant klonlarda yükseltilmez. pAdTrack-GFP'nin bozulmadan kaldığı rekombinasyon için negatif klonlar Şekil 3A, şerit 3, 4 ve 6'da temsil edilir. Astarlar, rekombinasyon bölgesinin bitişiğindeki DNA dizilerinde tavlama. Potansiyel pozitif rekombinant klonlar(Şekil 3A, şerit 2 ve 5), Şekil 3B, şerit 1 ve 2'de gösterildiği gibi GFP'yi ifade etti. Bu klonlardan alınan plazmid DNA izole edildi ve daha yüksek miktarda DNA elde etmek için DH5α dönüşümü için kullanıldı. DH5α'da güçlendirilmiş bu önceden seçilmiş rekombinant plazmidler daha sonra enzimmatik sindirim ile test edildi. Şekil 3'teC-E, Hind III, PstI, BamHI kısıtlama enzimleri ile sindirilen bir rekombinant-pozitif klonun enzimatik sindiriminin sonuçları gösterilmiştir(Şekil 3C, D, E şerit 2). Rekombinant klonun HindIII ve PstI sindirim kalıpları pAdEasy-1 için elde edilenlere benzerdi, çünkü HindIII ve PstI pAdEasy-1 plazmidini sırasıyla 24 ve 25 kez kestiler ,(Şekil 3C ve D, şerit 3); HindIII bir kez kesti ve PstI pAdTrack-GFP vektörün dört katını kesti(Şekil 3C ve D, şerit 1). BamHI iki kez kesti pAdEasy-1 vektörü(Şekil 3C, şerit 3) ve bir kez pAdTrack-GFP (Şekil 3C, şerit 1).
PacI, rekombinant plazmidden 4,5 kb'lık bir parça kesti (Şekil 3F, şerit 2), pAdTrack-GFP'den 2863 bp'lik bir parça (Şekil 3F, şerit 1) ve pAdEasy-1 vektörünü doğrusallaştırdı (Şekil 3F, şerit 3). DNA merdiveni Şekil 3C-F, şerit 4'te temsil edilir. Rekombinant plazmid, AD293 transfection için daha fazla kullanım için Pac I ile sindirildi.
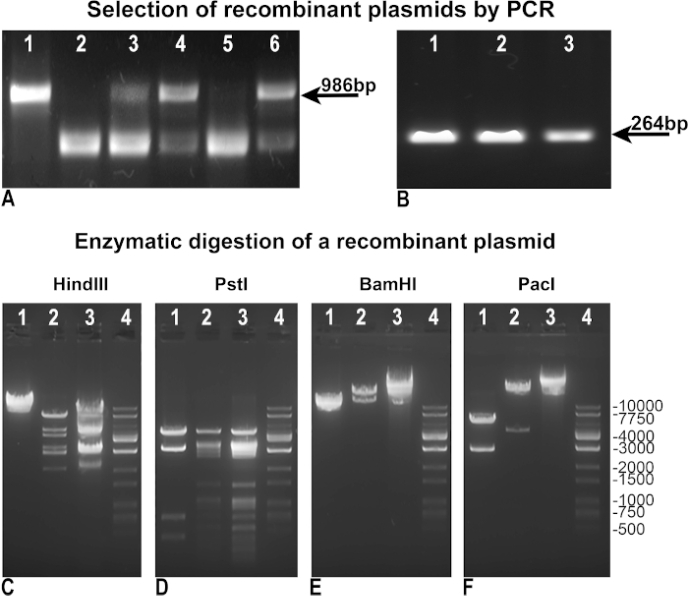
Şekil 3: pAdTrack-GFP'nin pAdEasy-1 plazmid ile yeniden birleşmesi. pAdTrack-GFP ve pAdEasy-1'in rekombinasyonundan sonra elde edilen plazmidler pAdTrack-GFP bütünlüğü (A) için "negatif" PCR ile test edildi. Rekombinant olmayan klonlar, pAdTrack-GFP plazmidinden (A, şerit 3, 4 ve 6) yükseltilen diziye karşılık gelen 986 bp bandın varlığı ile kanıtlandı. Rekombinasyon için potansiyel olarak pozitif olan klonlar (A, şerit 2 ve 5) de elde edildi. pAdTrack-GFP vektörü şablon olarak kullanıldığında, pAdTrack-GFP (A, şerit 1) için 986 bp'lik bir bant elde edildi. Potansiyel olarak pozitif rekombinant klonlar GFP ekspresyörü için "pozitif" PCR (B) ile test edildi; hem potansiyel olarak yeniden birleştirilmiş klonlar (B, şerit 1 ve 2) hem de pAdTrack-GFP plazmid için 264 bp'lik bir bant görünür. Potansiyel bir rekombinant klonun DNA'sı HindIII, PstI, BamHI ve PacI kısıtlama enzimi (C-F, şerit 2) ile test edildi. Kontrollerde pAdEasy-1 vektörü (C-F, şerit 3) ve pAdTrack-GFP plazmid (C-F, şerit 1) aynı enzimlerle sindirildi. DNA merdiveni C-F şerit 4'te temsil edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ad293 hücrelerinde adenoviral paketleme ve amplifikasyon yapıldı. Adenoviral parçacıklar (AdV-GFP), AD293 hücre lisatından ve enfekte hücreler tarafından salındıkları hücre kültürü ortamından arındırıldı. Hücre kültürü ortamında bulunan adenovirüsü konsantre etmek için, parçacıklar amonyum sülfat ile çöke çekildi ve daha sonra 2 mM MgCl 2 ile 10 mM Tris HCl pH8'de yeniden kullanıldı , hücre lizisi için kullanılan tampon. Daha sonra, hücre lisatından ve kültür ortamından gelen adenoviral parçacıklar CsCl süreksiz gradyan ultrasantrifüjasyonu ile saflaştırılmıştır. Ultrasantrifüjlemeden sonra, Şekil 4'tegösterildiği gibi güçlü bir saflaştırılmış AdV-GFP bandı elde edildi.

Şekil 4: Süreksiz bir CsCl gradyanı üzerinde ultracentrifugation ile adenoviral saflaştırma. Hücre homojenatı ve ortamdan çökelen adenovirüs, düşük ve yüksek yoğunluklu CsCl çözeltileri tarafından oluşturulan süreksiz bir gradyan üzerinde ultrasantrifüjene maruz kaldı. Her iki olguda da güçlü GFP-adenovirüs bantları kanıtlandı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bir mL (TU/mL) başına transdüksiyon ünitelerinde ifade edilen viral titreyi belirlemek için AD293 hücrelerine AdV-GFP'nin seri seyreltmeleri bulaştı. 48 saat sonra, enfekte hücreler GFP'yi viral süspansiyonun seyreltme faktörü ile ters bir korelasyonda ifade etti. Bu floresan mikroskopi ile gözlenmiş ve GFP pozitif hücrelerin yüzdesi akış sitometrisi ile belirlenmiştir (Şekil 5). Titreyi hesaplamak için, GFP pozitif hücrelerin% 5 - 20'sini indükleyen viral seyreltme göz önünde bulunduruldu (Şekil 5C). Genellikle, GFP-adenovirüs için~10 10 (TU/mL) viral titre elde ederiz.
Aşağıda, 300000 hücrenin (C) 1 mL adenoviral çözelti (V) ile% 6 GFP pozitif hücrelerin (F) elde edildiği 106 (D) seyreltme faktöründe transdük edildiği belirli bir adenoviral parti için adenoviral titer hesaplamasının bir örneğini sunuyoruz:
Titer (TU/mL) = D x F/100 x C/V = 106 x 6/100 x 300000/1 = 1,8 x 1010 TU/mL
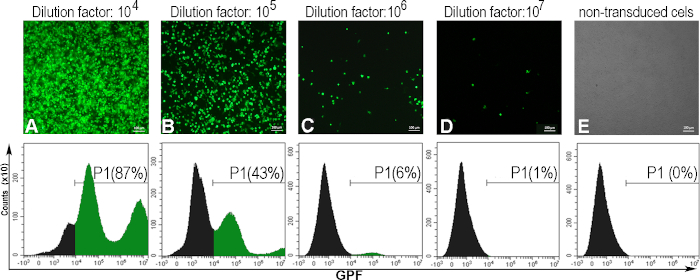
Şekil 5: Adenoviral titerin değerlendirilmesi. AD293 hücreleri çeşitli adenoviral seyreltmelerle enfekte oldu. Kırk sekiz saat sonra, hücreler floresan mikroskopi ile gözlendi ve farklı adenoviral seyreltmeler (A-D) tarafından indüklenen GFP pozitif hücrelerin yüzdesini belirlemek için akış sitometrisi ile analiz edildi. Akış sitometrisi için kapıyı kurmak için, transdüklenmiş olmayan hücreler de analiz edildi (E). Seyreltme faktörü için hesaplanan titer 106, hücrelerin% 6'sı GFP pozitif olduğunda 1.8 x 1010 TU / mL idi. Paneller için A-E, çubuklar: 100μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Hazırlanan adenovirüsün transdüksiyon potansiyelini test etmek için dört hücre hattı kullanıldı: insan endotel hücreleri (EA.hy926), sığır aort endotel hücreleri (BAEC), murine hepatositler (Hepa 1-6) ve murine mezenkimal stromal hücreler (MSC). Endotel hücreleri (EA.hy926 ve BAEC) 25 TU/hücre ile, hepatositler 5 TU/hücre ile, MSC ise 250 TU/hücre ile transdüklenmiştir.
1.8 x 10 10 TU/mL'lik adenoviral süspansiyon kullanılarak3 x 10 6 hücreye 25TU/hücre ile bulaştırmak için gereken adenoviral süspansiyon hacminin nasıl hesaplandığının bir örneği aşağıda verilmiştir.
1 hücre için ................. 25 TU
3 x 106 hücre .............. x TU  x=75 x 106 TU
x=75 x 106 TU
Viral stok içeriyorsa
1.8 x 1010 TU .................... 1 mL
75 x 106 TU .................... y mL  y= 4,2 x 10-3 mL = 4,2μL viral stok
y= 4,2 x 10-3 mL = 4,2μL viral stok
Transdüksiyondan 48 saat sonra hücreler floresan mikroskopi ile analiz edildi. Şekil 6'dagösterildiği gibi, insan veya sığır endotel hücreleri iyi verimlilikle transdüklenmiştir (~%50) 25 TU/hücre için(Şekil 6 EA.hy926 ve BAEC). Murine hepatositleri (Hepa 1-6) adenovirüs tarafından düşük miktarda adenovirüs parçacıklarında (5 TU/ hücre) verimli bir şekilde transdüklenmiştir, ancak daha yüksek oranda ölü hücre (PI-pozitif hücreler) kaydedildiği için adenovirüse karşı da hassastırlar (~%16) diğer hücre türlerine kıyasla. Mezenkimal stromal hücreler, spesifik adenoviral reseptörlerin (yayınlanmamış veriler) eksikliği nedeniyle en zor transdüse olan hücrelerdir (Şekil 6).
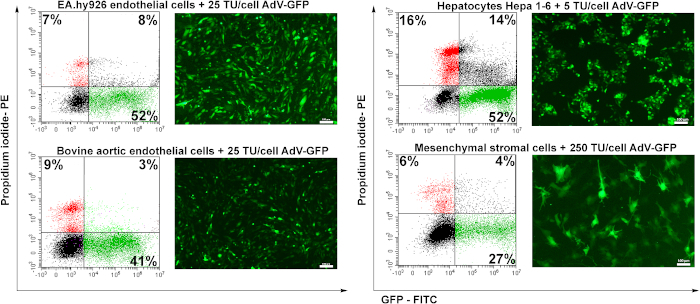
Şekil 6: Transdüklenmiş hücrelerde adenovirüs enfektivitesi ve GFP ekspresyonunun indüksiyonu. İnsan endotel hücreleri (EA.hy926), sığır aort endotel hücreleri (BAEC), murine hepatositler (Hepa 1-6) ve murine mezenkimal stromal hücreler (MSC) belirtilen miktarda adenovirüs ile transdüklenmiştir. Floresan mikroskopi ile GFP sapsandı ve GFP pozitif hücrelerin yüzdesi akış sitometrisi ile analiz edildi. Akış sitometrisi ile belirlenen PI pozitif hücreler viral transdüksiyon ile belirlenen hücre mortalitesini gösterir. EA.hy926 hücreleri, sığır aort endotel hücreleri ve Hepa 1-6 hücreleri, %41 -52 arasında değişen transdüksiyon verimi olan adenovirüs tarafından yüksek oranda transdüksiyon edildi. MSC için, daha yüksek miktarda virüs (250 TU/hücre) transdüklenmiş hücrelerin sadece% 27 GFP pozitif indükledi. Çubuklar: 100μm. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Rekombinant adenovirüsler gen iletimi ve ekspresyonu için çok yönlü bir araçtır12,13,14. Adenoviral transdüksiyon ile güçlü protein ekspresyonunu teşvik etmek için, ilgi geninin kodlama dizisi adenovirüsün genomuna yerleştirilir. Bert Vogelstein laboratuvarında geliştirilen AdEasy adenoviral sistemi, vahşi tip adenovirüs serotip 5 genomunun çoğunu içeren bir omurga plazmid (pAdEasy-1) ve gen klonlama için tasarlanmış bir mekik vektörü (pAdTrack) içerir2,10. Adenoviral genlerin silinmesi E1 (enfeksiyöz virüs parçacıklarının bir montajından sorumludur) ve E3 (konak bağışıklığından kaçınmada rol oynayan proteinleri kodlama) adenoviral genomda, 6.5-7.5 kb'lık bir ilgi geninin yerleştirilebileceği bir alan yarattı2,3. Bu boyut birçok gen için yeterlidir, özellikle daha kısa intronları olanlar için15,16,17. Ayrıca bir transgene18 , 19,20cDNA taşıyan adenovirüslerin üretimini bildiren araştırmacılar da vardır. Bununla birlikte, cDNA taşıyan adenovirüsler için bir gen veya mini gen taşıyan benzerlerine göre daha düşük transgene ekspresyonu elde ettik (veriler gösterilmedi).
Önceki yöntemlerin iyileştirilmesi ve uyarlaması2,10,14,18,21, adenoviral üretim teknolojisi daha kısa bir süre, daha düşük maliyet ve daha az çaba gerektirir. Tam uzunlukta adenoviral DNA, mekik vektörü ile pAdEasy-1 plazmid arasında homolog rekombinasyon eğilimli E. coli suşu, BJ5183 arasında rekombinasyon ile elde edilir. Protokol, AdEasier-1 hücrelerinin kimyasal dönüşümünü ima eder (pAdEasy-1 içeren BJ5183 bakterileri). Bu teknik, bazı laboratuvarlarda bulunmayan, çok basit, rekombinasyon verimini artıran ve yetkin hücreler elde etmek ve dönüşümü gerçekleştirmek için gereken süreyi azaltan bir elektroporatör gerektirmez. PCR tarafından gerçekleştirilen rekombinant klonların ön seçimi süreyi daha da kısaltır ve tüm prosedürü kolaylaştırır. Benzer bir prosedür Zhao ve iş arkadaşları tarafından kullanıldı22, ancak protokolde astarların dizilerini optimize ettik.
GFP-adenovirüs paketleme ve amplifikasyon için, kültür plakasına daha uygun olan AD293 hücreleri olmak üzere bir HEK293 türev hücre hattı kullanılmıştır. Adenoviral üretim için yaygın olarak kullanılan diğer hücre hatları şunlardır: 911, 293FT, pTG6559 (A549 türevi), PER. C6 (HER türevi), GH329 (HeLa türevi), N52. E6 ve HeLa-E123,24,25,26. Elimizde 911 hücre kullanıldığında adenoviral üretimde iyileşme sağlanamadı (veriler gösterilmedi). AD293 hücrelerinin K2 reaktifi kullanılarak rekombinant plazmid ile transfeksiyon, viral paketleme adımının verimliliğini oldukça artırdı. Adenovirüs üretiminden sonra, adenovirüslerin ~% 70'i hala hücrelerin içindedir ve üç donma ve çözülme döngüsü ile serbest bırakılır. Döngü sayısını artırmak uygun değildir, çünkü adenovirüsü yok eder.
Rutin adenoviral üretim süreci boyunca, hücre kültürü ortamında çok sayıda viral parçacık salınır. Enfekte AD293 hücrelerinin toplanması sırasında bu hücre kültürü ortamının atılması önemli bir viral kayba neden olacaktır. Schagen ve iş arkadaşları tarafından açıklanan protokolü, amonyum sülfat27ile çökerek adenoviral parçacıkları hücre kültürü ortamından arındırmak için optimize ettik. Bu yöntem, polietilen glikol28kullanan yöntemle karşılaştırıldığında hücre kültürü ortamından adenovirüs geri kazanımında daha yüksek bir verimliliğe sahiptir. Çökülen adenovirüs, tuz fazlalığını gidermek için ultrasantrifüjleme ile hemen arındırılmalı veya buzdolabında birkaç gün ancak diyalizden sonra tutulmalıdır. Çökeltmeyi diyaliz olmadan birkaç saatten fazla tutmak virüs için zararlıdır.
Adenoviral parçacıkların tek adımda gerçekleştirilen ultrasantrifüjleme ile saflaştırılması, adenoviral stoğun manipülasyonunu azaltır ve ardışık ultrasantrifüjasyon adımları14,29kullanan protokollere kıyasla prosedürü kolaylaştırır. Saflaştırılmış adenovirüs diyalizi, transdüksiyonu daha da etkileyebilecek sezyum klorürü çıkarmak için gereklidir. Protokolde, MgCl2 içeren ancak diyaliz için sakkaroz içermeyen Tris tamponu kullandık, çünkü donma için koruyucu olarak ihtiyaç duyulan büyük, haksız miktarda sakkaroz gerektiriyor. Böylece, daha sonra, doğrudan donma için hazırlanan adenoviral stoklara sakkaroz ekledik. Saflaştırılmış adenovirüslerin sık sık donmasını ve çözülmesini önlemek için, adenoviral stokların aliquot ve -80 ° C'de saklanması önerilir. Adenoviral titer, GFP muhabir geni ve transdüklenmiş hücrelerin belirli bir viral seyreltme yüzdesi göz önüne alınarak akış sitometrisi ile değerlendirildi. Bu yöntem klasik "plak tahlili" ile karşılaştırıldığında daha hızlıdır ve adenoviral parçacıkların enfeksiyon kapasitesini ortaya çıkaramayan kapsid proteinlerinin (ELISA veya akış sitometrisi gibi çeşitli yöntemlerle) değerlendirilmesi ile karşılaştırıldığında daha güvenilirdir. Bununla birlikte, ELISA tabanlı niceleme, Q-PCR veya plak tahlilleri, özellikle floresan izleyici içermeyen adenovirüslerin titrasyonu için yararlı olan alternatif yöntemlerdir.
pAdTrack adenovirüslerinin Coxsackievirus ve Adenovirus Reseptörleri (CAR) tarafından tanınan insan adenovirüsleri serotip 5'ten türetildiği göz önüne alındığında, GF'nin kapasitesini gösterdik.P-adenovirüs insan kökenli hücreleri (endotel hücreleri) transdüse etmek için, aynı zamanda diğer kökenlerden hücreler: sığır (endotel hücreleri) ve murine (mezenkimal stromal hücreler ve hepatositler). Veriler, GFP-adenovirüsün bir transjenin yüksek düzeyde ifadeye neden olabileceğini gösterdi.
Sonuç olarak, bu zahmetli teknolojiyi, adenoviral parçacıkları elde etmek için gereken zamanı, maliyetleri ve çabayı azaltmak için optimize ettik. Hazırlanan adenovirüs çeşitli hücre tiplerini enfekte edebilir ve ilgi geninin ekspresyonunun teşvikini teşvik edebilir. Bu protokol çeşitli deneylerde kullanılabilir, çünkü adenoviral aracılı gen transferi modern gen tedavileri geliştirmek için ana araçlardan birini temsil eder.
KıSALTMALAR: AdV-GFP, adenoviral parçacıklar; BAEC, sığır aort endotel hücreleri; CsCl, sezyum klorür; GFP, yeşil floresan protein; MSC, mezenkimal stromal hücreler; TU, dönüştürücü üniteler.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma, 2014-2020 Rekabetçilik Operasyonel Programı (POC-A.1-A.1.1.4-E-2015, Kimlik: P_37_668; diabeter kısaltması), Romanya Araştırma ve İnovasyon Bakanlığı'nın bir hibesi PCCDI- UEFISCDI, PN-III-P1-1.2-PCCDI-2017-0697 PNCD III içinde ve Romanya Akademisi tarafından. Yazarlar, cömert ve ilgili tavsiyeleri için Kyriakos Kypreos'a (Yunanistan Patras Üniversitesi), film çekimi, film kurgusu ve grafik tasarım için Ovidiu Croitoru'ya (Güzel Sanatlar Üniversitesi, Bükreş, Romanya) ve teknik yardım için Mihaela Bratu'ya teşekkür ediyorlar.
Malzemeler
| Name | Company | Catalog Number | Comments |
| AD293 cells | Agilent Technologies | 240085 | |
| AdEasier-1 cells | Addgene | 16399 | |
| Agarose I (for electrophoresis) | Thermo Scientific | 17850 | |
| Ammonium sulfate | Sigma | A4418 | |
| Ampicillin sodium salt | Sigma | A0166 | |
| BamH I | Thermo Scientific | FD0054 | |
| Cell culture plates 100 mm | Eppendorf | 30702115 | |
| Cesium chloride | Sigma | L4036 | |
| DH5alpha bacteria | Thermo Scientific | 18265017 | |
| DMEM (GlutaMAX, 4.5g/L D-Glucose) | Gibco | 3240-027 | |
| EA.hy926 cells | ATCC | CRL-2922 | |
| EDTA | Sigma | E5134 | |
| Ethanol (99.8%) | Roth | 5054.2 | |
| Fetal Bovine Serum | Sigma | F7524 | |
| Flasks T25, T75, T175 | Eppendorf | 30712129 | |
| Glucose | Sigma | G7021 | |
| Hepa 1-6 murine hepatocytes | ATCC | CRL-1830 | |
| Hind III | Thermo Scientific | FD0504 | |
| Kanamycin Sulfate | Thermo Scientific | 15160054 | |
| K2 Transfection System | Biontex | T060-5.0 | |
| LB medium | Formedium | LBx0102 | |
| LB-agar | Formedium | LBx0202 | |
| Mix & Go E. coli Transformation kit | Zymo Research | T3001 | |
| Midori Green Advanced DNA stain | Nippon Genetics Europe | MG-04 | |
| NaOH | Sigma | S8045 | |
| Opti-MEM | Thermo Scientific | 31985070 | |
| Pac I | Thermo Scientific | FD2204 | |
| pAdEasy-1 | Addgene | 16400 | |
| pAdTrack-CMV | Addgene | 16405 | |
| Phenol:chloroform:isoamyl alcohol (24:24:1) | Invitrogen | 15593-031 | |
| Polymerase GoTaq | Promega | M3005 | |
| Pme I (Mss I) | Thermo Scientific | FD1344 | |
| Potassium acetate | VWR Chemicals | 43065P | |
| Pst I | Thermo Scientific | FD0614 | |
| Qiagen Midi Prep kit | Qiagen | 12125 | |
| Cell Scraper | TPP | 99003 | |
| SDS | Thermo Scientific | 28365 | |
| Slide-A-Lyzer dialysis cassettes | Thermo Scientific | 66330 | |
| Sodium pyruvate | SIGMA | P5280-100G | |
| Syringe with 23G neeedle | B Braun | 464BR | |
| Tris HCl | Sigma | 1185-53-1 | |
| Trypan blue | Roth | CN76.1 | |
| Tubes 50ml | TPP | 91050 | |
| Ultra-Clear Tubes (14x89 mm) | Beckman Coulter | 344059 | |
| Centrifuge (refrigerated) | Sigma Sartorius | 3-19KS | |
| HeraeusFresco 17 Microcentrifuge | Thermo Scientific | 75002420 | |
| Ultracentrifuge with SW41Ti rotor | Beckman Coulter | Optima L-80 XP | |
| Culture Hood | Thermo Scientific | Class II | |
| Pipettes (0-2µl, 1-10µl, 2-20µl, 10-100µl, 20-200µl, 100-1000µl) | Thermo Scientific | ||
| Dry Block Heating Thermostat | Biosan | TDB-120 | |
| Thermocycle | SensoQuest | 012-103 | |
| Water Bath | Memmert | WNB 14 |
Referanslar
- Lee, C. S., et al. Adenovirus-Mediated Gene Delivery: Potential Applications for Gene and Cell-Based Therapies in the New Era of Personalized Medicine. Genes and Diseases. 4 (2), 43-63 (2017).
- He, T. C., et al. A simplified system for generating recombinant adenoviruses. Proceedings of the National Academy of Sciences of the United States of America. 95 (5), 2509-2514 (1998).
- Russell, W. C. Update on adenovirus and its vectors. The Journal of General Virology. 81, 2573-2604 (2000).
- Rauschhuber, C., Noske, N., Ehrhardt, A. New insights into stability of recombinant adenovirus vector genomes in mammalian cells. European Journal of Cell Biology. 91 (1), 2-9 (2012).
- Saha, B., Wong, C. M., Parks, R. J. The adenovirus genome contributes to the structural stability of the virion. Viruses. 6 (9), 3563-3583 (2014).
- Kreppel, F., Kochanek, S. Modification of adenovirus gene transfer vectors with synthetic polymers: a scientific review and technical guide. Molecular Therapy: the Journal of the American Society of Gene Therapy. 16 (1), 16-29 (2008).
- Dormond, E., Perrier, M., Kamen, A. From the first to the third generation adenoviral vector: what parameters are governing the production yield. Biotechnol Advances. 27 (2), 133-144 (2009).
- Parks, R. J., et al. A helper-dependent adenovirus vector system: removal of helper virus by Cre-mediated excision of the viral packaging signal. Proceedings of the National Academy of Sciences of the United States of America. 93 (24), 13565-13570 (1996).
- Jager, L., Ehrhardt, A. Emerging adenoviral vectors for stable correction of genetic disorders. Current Gene Therapy. 7 (4), 272-283 (2007).
- Luo, J., et al. A protocol for rapid generation of recombinant adenoviruses using the AdEasy system. Nature Protocols. 2 (5), 1236-1247 (2007).
- Dumitrescu, M., et al. Adenovirus-Mediated FasL Minigene Transfer Endows Transduced Cells with Killer Potential. International Journal of Molecular Sciences. 21 (17), (2020).
- Campos, S. K., Barry, M. A. Current advances and future challenges in Adenoviral vector biology and targeting. Current Gene Therapy. 7 (3), 189-204 (2007).
- Khare, R., Chen, C. Y., Weaver, E. A., Barry, M. A. Advances and future challenges in adenoviral vector pharmacology and targeting. Current Gene Therapy. 11 (4), 241-258 (2011).
- Jager, L., et al. A rapid protocol for construction and production of high-capacity adenoviral vectors. Nature Protocols. 4 (4), 547-564 (2009).
- Zvintzou, E., et al. Pleiotropic effects of apolipoprotein C3 on HDL functionality and adipose tissue metabolic activity. Journal of Lipid Research. 58 (9), 1869-1883 (2017).
- Karavia, E. A., et al. Apolipoprotein A-I modulates processes associated with diet-induced nonalcoholic fatty liver disease in mice. Molecular Medicine. 18, 901-912 (2012).
- Lampropoulou, A., Zannis, V. I., Kypreos, K. E. Pharmacodynamic and pharmacokinetic analysis of apoE4 [L261A, W264A, F265A, L268A, V269A], a recombinant apolipoprotein E variant with improved biological properties. Biochemical Pharmacology. 84 (11), 1451-1458 (2012).
- Zheng, S. Y., Li, D. C., Zhang, Z. D., Zhao, J., Ge, J. F. Adenovirus-mediated FasL gene transfer into human gastric carcinoma. World Journal of Gastroenterology. 11 (22), 3446-3450 (2005).
- Ambar, B. B., et al. Treatment of experimental glioma by administration of adenoviral vectors expressing Fas ligand. Human Gene Therapy. 10 (10), 1641-1648 (1999).
- Okuyama, T., et al. Efficient Fas-ligand gene expression in rodent liver after intravenous injection of a recombinant adenovirus by the use of a Cre-mediated switching system. Gene Therapy. 5 (8), 1047-1053 (1998).
- van Dijk, K. W., Kypreos, K. E., Fallaux, F. J., Hageman, J. Adenovirus-mediated gene transfer. Methods in Molecular Biology. 693, 321-343 (2011).
- Zhao, Y. D., Li, T., Huang, G. A simple negative selection method to identify adenovirus recombinants using colony PCR. Electronic Journal of Biotechnology, North America. 17 (1), 46-49 (2014).
- Kovesdi, I., Hedley, S. J. Adenoviral producer cells. Viruses. 2 (8), 1681-1703 (2010).
- Lin, X. Construction of new retroviral producer cells from adenoviral and retroviral vectors. Gene Therapy. 5 (9), 1251-1258 (1998).
- Fallaux, F. J., et al. Characterization of 911: a new helper cell line for the titration and propagation of early region 1-deleted adenoviral vectors. Human Gene Therapy. 7 (2), 215-222 (1996).
- Altaras, N. E., et al. Production and formulation of adenovirus vectors. Advances in Biochemical Engineering/ Biotechnology. 99, 193-260 (2005).
- Schagen, F. H., et al. Ammonium sulphate precipitation of recombinant adenovirus from culture medium: an easy method to increase the total virus yield. Gene Therapy. 7 (18), 1570-1574 (2000).
- Colombet, J., et al. Virioplankton 'pegylation': use of PEG (polyethylene glycol) to concentrate and purify viruses in pelagic ecosystems. Journal of Microbiological Methods. 71 (3), 212-219 (2007).
- Kypreos, K. E., van Dijk, K. W., van Der Zee, A., Havekes, L. M., Zannis, V. I. Domains of apolipoprotein E contributing to triglyceride and cholesterol homeostasis in vivo. Carboxyl-terminal region 203-299 promotes hepatic very low density lipoprotein-triglyceride secretion. Journal of Biological Chemistry. 276 (23), 19778-19786 (2001).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır